הלם זיהומי - Septic shock
הופניתם מהדף הלם זיהומי לדף הנוכחי.
"
עקרונות בכירורגיה
מאת ד"ר צבי קויפמן
| עקרונות בכירורגיה | ||
|---|---|---|
| ||
| שם המחבר | ד"ר צבי קויפמן | |
| שם הפרק | הלם | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – אלח דם
הלם זיהומי הוא מצב חרום רפואי, המצריך מאמץ רב מצד הרופאים המטפלים, כדי למנוע תחלואה נוספת ותמותה. אבחנה מוקדמת, ניטור חודרני מקיף, וטיפול אינטנסיבי לא שינו בצורה משמעותית את הפרוגנוזה של החולים, מאז תוארה התסמונת לראשונה ב-1951. שיעור התמותה נע בסדרות שונות בין 40 ל-90 אחוזים. בארצות הברית מוערך, כי בין 20,000 ל-60,000 חולים מתים מדי שנה מהלם זיהומי מפאת חיידקים גרם-שליליים בלבד. הטיפול הרפואי המודרני, הכולל טיפול אונקולוגי תוקפני, שימוש נרחב בכימותרפיה ואמצעים אחרים כמו מדכאי מערכת החיסון, מערכות ניטור ואבחון חודרניות למיניהן, רק מגדיל את הסבירות, ששכיחות תסמונת זו תעלה עם הזמן.
הלם זיהומי או אלח-דם הם מושגים חופפים. ההגדרה של אלח-דם היא מורכבת ורבגונית. היא מוגדרת כמצב פיזיולוגי הנגרם כתוצאה מנוכחותם של מיקרואורגניזמים או הרעלנים שלהם בזרם הדם וברקמות הגורמים לקריסת מנגנוני ההומאוסטזיס של הגוף. התגובה הפיזיולוגית של הגוף לנוכחות מיקרו-אורגניזם יכולה להתבטא במספר דרכים:
- SIRS (Systemic Inflammatory Response Syndrome) – תהליך פיזיולוגי המבטא את תגובת הגוף למצב דלקתי כלשהו. בחולים הלוקים ב-SIRS ניתן לראות קצב נשימה מוגבר - יותר מ-20 נשימות לדקה, חום גוף חריג - יותר מ-℃38 (מעלות צלזיוס) או פחות מ-℃36, קצב לב מוגבר - יותר מ-90 פעימות לדקה ולויקוציטוזיס - יותר מ-12,000 או פחות מ-4,000
- דלקת (Infection) - המתבטאת בנוכחות של חיידקים בגוף במקום שלא צריכים היו להיות או מסוג שונה מהצפוי
השילוב של דלקת עם SIRS מהווה את ההלם הזיהומי, או אלח- הדם.
מקור הזיהום
בבני אדם, מהווה מערכת העיכול מאגר גדול של חיידקים גרם-שליליים, וכנראה מהווה גם את המקור לרוב הזיהומים, לאחר ניתוחי בטן, באלח-דם מרתי, בזיהום עולה בדרכי השתן, וכדי. אולם, גם ללא מקור אנטומי ברור, תיתכן חדירת חיידקים אלה מהתכייבויות קטנות לאורך מערכת העיכול, בחולים עם כשל חיסוני בדרגות שונות.
בנוסף למקורות הזיהום האנטומיים הללו, מהווה הזיהום הסביבתי הנרכש בעיה שכיחה באוכלוסיית המאושפזים, במיוחד בחולים קשים. בחולים המאושפזים ביחידות לטיפול נמרץ לסוגיהן קיימת שכיחות גבוהה של זיהומים נוזוקומיים, עד למעלה מ-20 אחוזים(!), לעומת שכיחות ממוצעת של בין 5 ל-10 אחוזים במחלקות האשפוז הרגילות. שיעור מקרי אלח-דם מבין הזיהומים הנוזוקומיים הוא גבוה ונע בין 14 ל-29 אחוזים. בחולים במצב קשה מוזכרות הסיבות הבאות לשכיחות הגבוהה של זיהומים נוזוקומיים:
- חולים בטיפול נמרץ הם החולים הקשים ביותר בבית החולים
- החולים הם הקשישים והצעירים ביותר מבין המאושפזים
- ביחידות אלה קיים שימוש נרחב במערכות ניטור וטיפול חודרניות (מכונות הנשמה, צנתרים)
- צפיפות החולים היא הגבוהה מבין מחלקות האשפוז
- בדרך כלל מדובר בזמן אשפוז ארוך
- לחולים במצב קשה ניתן בדרך כלל יותר טיפול אנטיביוטי מלכל קבוצה אחרת
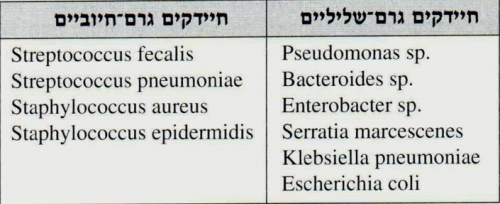
בקבוצת הזיהומים הנוזוקומיים בולט מקומם של אורגניזמים נוספים לחיידקים גרם-שליליים (טבלה 3.17).
פאתוגנים
אף על פי שהפאתוגן השכיח המבודד מחולים המפתחים אלח-דם היה ונותר מתוך קבוצת המתגים הגרם-שליליים, עולה והולכת חשיבותם (ושכיחותם) של הפאתוגנים הלא קלאסיים - חיידקים גרם-חיוביים, חיידקים אנארוביים ופטריות. יש להתחשב בקבוצה זו בעת קביעת הטיפול האנטיביוטי האמפירי, תוך התייחסות לחולה (מזרקי סמים, חולים עם מסתמים מלאכותיים וכדומה). לא תמיד ניתן לבדד מחולל מוגדר כגורם לתסמונת האלחית. זיהום מוקדי יכול אף הוא לגרום להלם זיהומי, מבלי שניתן יהיה לתרבת מיקרו-אורגניזמים, גם בתרביות דם חוזרות.
פתוגנזה
זיהום חודרני על-ידי חיידקים, פטריות, ריקטציה, נגיפים ושאר אורגניזמים, גורם לשחרור מספר רב של מתווכים בכוח בתסמונת ההלם הזיהומי. רוב תשומת הלב התמקד בעיקר באנדוטוקסין, אך גם למרכיבים אחרים של פאתוגנים אלה השפעה דומה.
מערכות החלבונים העיקריות העוברות שפעול בעת ההלם הזיהומי הן: (א) מערכת הקשירה; (ב) מערכת המשלים; (ג) מערכת הקינינים. כנראה, התמונה הפתופיזיולוגית נוצרת משפעול מערכות אלו, מיחסי הגומלין שביניהן, ומהשפעה ישירה של מתווכים נוספים על מערכות תאיות ואברי מטרה למיניהם. הפעלת גורם הגמן קשורה בהפעלת שאר מרכיבי מערכת הקרישה האינטרינזית, ובאותו זמן מאפשרת הפיכתו של פלסמינוגן לפלסמין (המהווה את הצעד הראשון במערכת פירוק הקריש). שפעול בו-זמני זה של מערכות הקרישה והפיברינוליזה גורם לקרישה תוך-כלית נרחבת (Disseminated Intravascular Coagulation - DIC), לניצול טסיות וגורמי קרישה, לאיסכמיה תאית משנית לפקקת, למיקרואנגיופאתיה ולתמס דם. פלסמין וגורם הגמן גורמים לשפעול קאליקראין תוך יצירת בראדיקינין האחראי להרחבת העורקיקים, ולעלייה בחדירות הוסקולרית הנצפית בשלבי ההלם. מערכת המשלים המופעלת גורמת ליצירת אנאפילוטוקסינים וחלבוני משלים פעילים. אלה כשלעצמם גורמים לאיגור נויטרופילים ושפעולם, לעידוד התהליך הדלקתי, להרס תאים אנדותליים ולשחרור מתווכים מתוך הליזוסומים. הונח, שלמונוקינים (תוצרי הפרשת מונוציטים) תפקיד מרכזי כמתווך בין הגורמים האקסטרינזיים, המשפיעים בעת הזיהום (כגון אנדוטוקסין) לבין המערכות התאיות המופעלות (טסיות דם, ניטרופילים, תאי אנדותל) בתגובת המאכסן לתהליך הזיהומי. קיימים חומרים נוספים, שהוצעו כמתווכים אפשריים בשרשרת הפתופיזיולוגית - קטכולאמינים, פרוסטגלנדינים לסוגיהם השונים, אנדורפינים ועוד.
לא ידוע המשקל היחסי של כל גורם בתהליך; ייתכן שהתסמונת הקלינית נגרמת בסופו של דבר על ידי שילוב משתנה של גורמים אלו. מכל מקום, מוסכם שמתווכים אלה מובילים למסלול משותף, המחמיר את מצבו של החולה, אם לא חלה בינתיים היערכות טיפולית מתאימה. כל המתווכים וההשפעות למיניהן גורמים בסופו של דבר לפגם בזילוח ולהפרעה בחילוף החומרים ברמה המיקרוצירקולטורית, המביאים למשוב חיובי ולהמשך התהליך הפתופיזיולוגי. מהמתווכים המשוערים של תסמונת ההלם הזיהומי נגזר אופן הטיפול. כפי שנראה להלן, מוצעים תרופות וחומרים המונעים או מעכבים הפעלה או תוצאה של פעולת מתווך מסוים. אך, כפי שנאמר לעיל, נראה שאין ההלם הזיהומי נגרם בסופו של דבר על-ידי חומר אחד בלבד, אלא הוא מהווה שילוב משתנה של גורמים וסקולריים, הורמונים, פרוטאזות וכוי. מכאן, שאין לחפש מרשם שגרתי מקובל לטיפול סגולי בהלם זיהומי, אלא את השילוב הנכון של תרופות (בנוסף לטיפול התומך), בהתאם לפתופיזיולוגיה המוצגת לפנינו (טבלה 4.17).
פגיעה במערכת הנשימה
אחד הסימנים הראשונים של אלח-דם הוא קצב נשימה מואץ ואוורור יתר ריאתי. תופעה זו קיימת גם ללא עדות לנזק ריאתי ונגרמת על- ידי גירוי של קולטנים במרכז הנשימה על-ידי רעלנים, חום, ועלייה בקצב חילוף החומרים. לאחר 24–72 שעות מתפתחת אי-ספיקת נשימה והיפוקסיה - תסמונת ARDS (על תסמונת זו ראו בפרק "חבלה").
פגיעה בלב
התהליך העיקרי במערכת כלי הדם הוא הרחבה כוללת של המערכת הוורידית והעורקית. התהליך מתווך על-ידי קינינים, פרוסטגלנדינים, תחמוצת הניטרט וגירוי קולטני ביתא על-ידי קטכולאמינים. בנוסף עולה חדירות כלי הדם על-ידי השפעה ישירה של הרעלנים והציטוקינים על האנדותל. נוזלים עוברים מכלי הדם למרווח הבין תאי ודם נאגר במערכת הספלנכנית. כל אלה תורמים להחזר ורידי ירוד ולירידה בלחץ הדם. בשלבים הראשוניים תגובת הגוף היא עלייה בקצב הלב, עלייה בנפח הפעימה (Stroke volume) ועלייה בלחץ הדופק (Pulse pressure), ולכן העור חם ואדום. בתגובה לעליית ב-TNF (Tumor Necrosis Factor) ובציטוקין 1-IL נוצר ביטוי עודף של מולקולות הצמדה (Adhesion molecules) על פני האנדותל, ואלה גורמות לנזק לתאי האנדותל ולהפרעה באספקת הדם לרקמות. ירידה ביכולת ההתכווצות של הלב עם עלייה בנפח הסוף-דיאסטולי (LVEDV) וירידה במקטע הפליטה של שני חדרי הלב בנוכחות נפח פעימה תקין הם ממצאים האופייניים בחולים הלוקים ב-SIRS ומהווים מדד פרוגנוסטי טוב. מנגנון הפגיעה ויכולת התכווצות שריר הלב בחולים עם תהליך זיהומי קשה אינו ברור דיו. דיכוי שריר הלב באופן ישיר על-ידי הטוקסין, הפרעה בהתכווצות המיוציטים הנגרמת על-ידי ה-TNF וירידה בזיקה של קולטני אלפא אדרנרגיים הם מנגנונים שתוארו. מצב זה המתואר כתמונה ההיפרדינמית של אלח-הדם מהווה פיצוי על הפגיעה בשריר הלב. התפתחות של אי-ספיקה לבבית מצביעה על פרוגנוזה רעה.
הפרעות במערכת העצבים המרכזית
הרעה במצב ההכרה, בלבול וחוסר התמצאות עד אובדן הכרה, אופייניים לאלח-דם. היפוקסיה עם ירידה באספקת דם למוח עלולים לפגוע במצב ההכרה. Septic associated encephalopathy היא מצב בו חמצון תאי המוח תקין אולם עלייה ברמת החומצות האמיניות, החומצות האורגניות ותוצרי הרעלנים גורמת לשיבוש הנירוטרנסמיטורים במוח ולהפרעה בהכרה. שינויים ניכרים בחום הגוף עלולים גם הם להיגרם מפגיעה במערכת העצבים המרכזית. הגורם לעליית החום הוא ציטוקין 1-IL המשוחרר מהמקרופגים המעורבים בתהליך הדלקתי. הסיבה לירידת החום מתחת לטווח התקין נובעת גם היא מגירוי מרכזי, ומאובדן חום דרך הריאות והעור, בשל הנשמת (dyspnea) והרחבת כלי הדם ההיקפיים. ירידת החום שכיחה יותר בזקנים ובתינוקות שהם בעלי מסה שרירית נמוכה ובחולים במחלות קשות המונעות ייצור חום עקב צמרמורות.
הפרעות בכליות ובדרכי השתן
ירידה בתפוקת השתן משקפת לרוב ירידה בנפח זרימת הדם לכליה. במצבים אלה, מכיל השתן רמות נמוכות של נתרן ורמות גבוהות של אשלגן והוא בעל אוסמולליות גבוהה. הפרפוזיה לכליה נפגעת בגלל חוסר נוזלים והקטנת הנפח היעיל של הדם בשל בריחת נוזלים למרווח הבין-תאי. עם החמרת ההלם הזיהומי מחמירה הפגיעה בכליות. הפגיעה בכליות מתוקנת לרוב על-ידי עירוי נוזלים, אך טיפול איטי ולא מספיק עלול להביא להופעה של אי-ספיקה כלייתית חדה, אף על פי שהחולה יציב המודינמית בשל התכווצות עורקי הכליה.
הפרעות במערכת העיכול
הפרעה בתנועתיות ואטוניה של הקיבה והמעי הדק, שכיחות בהלם זיהומי. גורמים לכך הבצקת בשורש המעי, דלקת הצפק, ואופיאטים לשיכוך כאבים. דמם ממערכת העיכול העליונה עקב כיבי דחק שכיח גם כן. נזק היפוקסי לכבד מתבטא בעלייה ברמות הטרנסאמינזות והבילירובין. בחולים קשים יכולה להופיע פגיעה קשה בכבד המובילה לעיתים למות החולה.
הפרעות במערכת ההמאטולוגית
עלייה במספר הלויקוציטים נגרמת משילוב של נדידה של ניטרופילים לזרם הדם בעקבות הגירוי של הקטכולאמינים, ויציאת צורות צעירות יותר מלשד העצם עקב גירוי הציטוקינים. נוכחות של צורות צעירות אלה לאורך זמן מהווה גורם פרוגנוסטי רע. אנמיה אינה מאפיינת הלם זיהומי.
תרומבוציטופניה קלה או בינונית יכולה ללוות מצבים של אלח-דם. הירידה במספר הטסיות נגרמת כתוצאה מהיצמדות הטסיות לתאי האנדותל הפגוע בכלי הדם הקטנים ומשקיעת צברי טסיות בנימיות הדם מסיבה לא ברורה. עלייה ב-PTT וב-PT, שכיחה באלח-דם. חולים הלוקים באלח-דם קשה יפתחו DIC במנגנון השפעול של גורם הגמן. שפעול גורם זה נגרם על-ידי חיידקים גרם-חיוביים ועל-ידי הליפופוליסכרדים ממקור חיידקים גרם-שליליים. מערכת הקרישה הפנימית מופעלת, ובנוסף תאי האנדותל ומאקרופגים מתחילים להפריש גורם רקמתי המפעיל את מערכת הקרישה החיצונית. לחולי אלח-דם יש נטיית יתר לקרישת דם. הפגיעה בדופן כלי הדם וחשיפת האנדותל, ירידה ברמות של פרוטאין C ואנטי תרומבין 3, עלייה בייצור של 2-TXA על פני האנדותל וייצור של מולקולות הגורמות להצמדת הטסיות לאנדותל חושפים את החולה למצב של קרישת יתר.
צריכה מטבולית
חולים הלוקים באלח-דם הם חולים קטבוליים מאוד. בחולים אלה התגובה המטבולית משתבשת, המעבר לניצול של חומצות שומן מוגבל למרות העלייה בתצרוכת המטבולית והעלייה בתצרוכת החמצן במנוחה. הציטוקינים ובמיוחד ב-IL-1, IL-6 ו–TNF מעודדים פירוק מוגבר של חלבוני שרירי השלד ומעבר של חומצות אמיניות משרירי השלד לכבד ליצירת סוכר. פירוק שרירי השלד גורם למאזן חנקן שלילי. הטיית תהליכי ייצור החלבון בכבד מאלבומין לחלבוני השלב החד מתווכת על-ידי ה-1-IL ו-TNF, ומסבירה את ירידת הרמות של האלבומין בנוסף לבריחתו למרווח הבין-תאי. חולים הלוקים באלח-דם נוטים גם לפתח היפונתרמיה, היפוקלמיה, היפוקלצמיה, היפופוספטמיה והיפומגנזמיה.
מונוקינים
פורסמו עבודות רבות הנוגעות לתפקידו של המקרופאג/מונוציט כתא עיקרי וחשוב בוויסות התגובה החיסונית, האנדוקרינית והמטבולית של הגוף לתהליכים דלקתיים וזיהומיים שונים. תוך כדי כך, נתגלה תפקיד אפשרי למונוקינים (תוצרי הפרשה של המקרופאגים) בפתופיזיולוגיה של הלם זיהומי.
השם "אינטרליקין-1" הוצע לראשונה ב-1979 ככינוי לתוצר הפרשה של מקרופאגים המפעיל תאי B ותאי T, שהיה ידוע עד אז כ"גורם מפעיל לימפוציטים" (Lymphocyte activating factor). התברר, כי לאינטרליקין-1 פעילות דומה לזו של חומרים שתוארו כבר קודם, כגון פירוגן אנדוגני, ה-Leukocyte endogenous mediator ונראה שמדובר בחומר זהה, או בקבוצת חומרים בעלי מבנה ופעילות דומים. נמצא, שתגובת הגוף (הסטראוטיפית) למגוון רחב של זיהומים ובאלח-דם, לתהליכים חיסוניים ודלקתיים - "תגובת השלב החד" (Acute phase response) מתווכת בעיקר על-ידי אינטרליקין-1. תגובה זו כוללת עליית חום גוף, עלייה מרשימה בייצור חלבוני השלב החד בכבד (הפטוגלובין, מרכיבי משלים, פיברינוגן וצרולופלסמין), לויקוציטוזיס עם סטייה שמאלה (שחרור נויטרופילים צעירים מלשד העצם) היפרגאמאגלובולינמיה, חסר דם, ירידה ברמות האבץ והברזל בנסיוב, כימוטקסיס, שחרור קולוגנאזה, דה-גראנולציה של ניטרופילים, ועוד. מבחינה חיסונית משרה אינטרליקין-1 יצירת אינטרליקין-2 (דרך שפעול לימפוציטים מסוג T), שהוא בעל תפקיד נכבד בוויסות התגובה החיסונית.
חילוף החומרים באלח-דם מאופיין על-ידי קטבוליזם ניכר של חלבון משריר משורטט, מאזן חנקן שלילי ביותר, וירידה בולטת במשקל. אלו חלים כתוצאה מהשפעה ישירה של אינטרליקין-1 על שרירי השלד, וגם כתוצאה מעלייה קיצונית בפרוסטגלנדין E2, המשרים עליית חום הגוף (צריכה קלורית מוגברת), עידוד חמצון חומצות-אמינו בשריר וקליטתן על-ידי הכבד, עיכוב קליטת חומצות אמינו מהדם לשריר ופרוטיאוליזיס מוגבר. מתוארות גם השפעות נוספות של המונוקינים על חילוף החומרים של רקמת השומן (עיכוב קטוגנאזה בכבד וירידה בניצול שומן לאנרגיה), הפחמימות (גליקוגנוליזה מואצת, ירידה בייצור של גליקוגן, עלייה בשימוש היקפי בגלוקוזה), ועל התגובה האנדוקרינית לאלח-דם (היפראינסולינמיה, דיכוי תפקוד אדרנוקורטיקלי) ועוד.
קאכטין (cachetin) היה השם שניתן לגורם מקרופאגי המעכב קליטת ליפידים לתוך רקמת שומן. בנוסף מקטין הקאכטין בצורה משמעותית את ייצור אנזימים מרכזיים ופעילותם בתהליך בניית השומן (בעיקר ליפופרוטאין-ליפאזה). חומר זה נקרא גם Tumor necrosis factor עקב פעילותו המרשימה נגד כמה סוגים של שאתות מוצקות.
הקשר של גורם זה להלם זיהומי נתגלה כאשר נמצא, כי אחד המשרים העיקריים ליצירתו הוא אנדוטוקסין. חיות שטופלו במנות קטנות של קאכטין פיתחו מצב דומה להלם זיהומי, עם חום, שלשול, חמצת מטבולית ופגיעה צירקולטורית. על רקע ממצאים אלה נמצא, כי אנטיסרום לקאכטין הגן על עכברים מפני ההשפעות הממיתות של אנדוטוקסין. בנוסף הודגם, כי הביטוי של גורם זה משתנה בחיות שהפכו עמידות לאנדוטוקסין. לא נמצא ייצור או הפרשת קאכטין על-ידי מאקרופאגים מעכברים עמידים לאנדוטוקסין שגורו על-ידי אנדוטוקסין. דקסמתאזון, שהוסף לתאים רגישים לפני מתן אנדוטוקסין, הפריע לייצור m-RNA לקאכטין (בעיקר ברמת שיעתוק הגן), אם ניתן לפחות שעתיים לפני השרייה על-ידי אנדוטוקסין. ייתכן, כי אחת הסיבות לכך, שנמצא כי קורטיקוסטרואידים אינם יעילים, כאשר הם ניתנים בשלבים המאוחרים של הלם זיהומי, היא שאז כבר מאוחר מכדי להפריע לתהליך שיעתוק הגן ותרגומו לקאכטין. ממצא מעניין נוסף הוא, שהקאכטין מסוגל להשרות ייצור אינטרליקין-1, ובדומה לחומר זה, גורם לעליית חום גוף (פירוגניות).
לא קשה להבחין בקשר האפשרי בין מונוקינים למנגנון התגובה האלחית. אינטרליקנים כנראה אחראים לביטויי התגובה של השלב החד הנצפים באלח-דם, והשינויים המטבוליים המובילים בהמשך לכישלון רב-מערכתי (Multiple system organ failure), כשייתכן שהקאכטין אחראי לפגיעה הצירקולטורית ולהתפתחות מצב ההלם.
המחקר בטיפול בהשפעותיהם השונות של מונוקינים הוא עדיין בתחילתו. קורטיקוסטרואידים מדכאים יצירת אינטרליקין-1 in vivo-in vitro, וגורמים לתגובת שלב חד מופחתת. תרופות מקבוצת נוגדי הדלקת הלא-סטרואידיים מסוגלות לעכב חלק מהשפעותיהם של האינטרליקינים ברמות השונות (המתווכות על-ידי הפרשת פרוסטגלנדין E2), כגון עלייה בחום הגוף וחילוף חומרים חלבוני מוגבר. לעומת זאת, אין לתרופות אלה השפעה על שחרור ניטרופילים מלשד העצם ושפעולם, על ייצור חלבוני השלב החד, על ריבוי פיברובלאסטים ועל שפעול לימפוציטים.
עם הגדרת תפקידם המדויק של המונוקינים באטיופתוגנזה של ההלם הזיהומי, צפוי מחקר רב במציאת מעכבים שונים לגורמים אלה ובאמצעים יעילים למניעת השפעותיהם השליליות.
ממצאים קליניים ואבחנה
התמונה הקלינית המוכרת של תת-לחץ-דם, אוליגוריה, חמצת לקטית וחום גבוה על רקע תרביות דם חיוביות בוודאי שאינה מעוררת ספק לגבי האבחנה של הלם זיהומי. אך המאמצים האבחנתיים חייבים להתמקד במטרה להגיע לאבחנה משוערת עוד לפני התפתחות התמונה הסוערת. שכן דחיית הטיפול לשלב כה מאוחר, ייתכן שתעלה בחייו של החולה.
היפרתרמיה, הסימן הקלאסי כביכול של זיהום הדם אינו מחויב המציאות, שכן (בזיהום עם חיידק גרם-שלילי) 13 אחוזים מהחולים הם היפותרמיים (חום גוף פחות מ-℃36.4) וב-5 אחוזים חום הגוף תקין. מתברר, כי הסימן המוקדם ביותר של אלח-דם הוא היפרוונטילציה, המופיעה לפני הליקוי ההמודינמי. אכן, כבר נאמר כי הופעה פתאומית של נשימת-יתר בחולים בקבוצת סיכון גבוה, מהווה הוריה לעריכת תרביות דם, וגם למדידת רמות גזים בדם עורקי. חמצת מטבולית מסיבה בלתי מוסברת אף היא יכולה להיות סימן מבשר.
התופעות הקליניות של זיהום בחיידק גרם-שלילי דומות לאלו של זיהום בחיידק גרם-חיובי, ואי אפשר להבדיל ביניהם על סמך התמונה הקלינית בלבד. אמנם בעבודה אחת צוין, כי קצב הלב ותפוקת הלב היו נמוכים יותר בחולים עם בקטרמיה גרם-שלילית, אך נראה כי לממצא זה אין ערך אבחנתי.
הסימנים והתסמינים הנוספים כוללים: שינויים במצב ההכרה (אנצפלופתיה), צמרמורות, תופעות בעור, תת-לחץ דם, תרומבוציטופניה, הפרעות קרישה ולויקופניה. בסופו של דבר יופיעו גם סימני כשל אברי מטרה - אי-ספיקת כליות חדה, תסמונת המצוקה הנשימתית של המבוגר, הפרעות בתפקודי כבד, דימום ממערכת העיכול, ועוד.
התמונה הקלינית של הלם זיהומי בקצות טווח הגילאים (יילודים, ילדים וקשישים) מעט שונה מהמתואר עד כאן, וחשוב להזכיר ולהכיר גם אותה. הלם זיהומי יכול להוות את ההסתמנות הראשונה של מחלה זיהומית בקשיש. הסימנים השכיחים של אלח-דם - צמרמורת, נשמת ולויקוציטוזיס יכולים לא להופיע בחולה הקשיש, כשטכיקרדיה היא הממצא היחיד המרמז לכיוון זיהום. בנוסף, בחולים מבוגרים שכיחה יותר תסמונת הבקטרמיה ללא עליית חום, עם שיעור תמותה גבוה של 50 אחוזים ומעלה הנלווה למצב זה. לעיתים הביטויים היחידים של אלח-דם הם שינויים קלים בהכרה, או בלבול בלתי מוסבר.
הסימנים והתסמינים של אלח-דם (ולאחריו הלם) ביילודים הם לרוב לא-ייחודיים, ויכולים לרמז לכיוון מחלה בדרכי הנשימה, בדרכי העיכול, או במערכת העצבים המרכזית. הופעתם של אי יציבות בחום הגוף, מצוקה נשימתית, קשיים באכילה, גריות-יתר, דום-נשימה, שריעות הכבד והטחול, צהבת, ארגמנת, פרכוסים והפרעות קרישה (כסימן בודד או בשילוב) צריכה לעורר חשד, כי ייתכן שהסיבה להחמרת מצבו של היילוד היא בקטרמיה מסכנת חיים.
בגיל הילדות, הסימנים המוקדמים של אלח-דם משותפים לאלה של זיהומים מערכתיים. חום הגוף הוא בדרך כלל גבוה, אך היפותרמיה יכולה לעורר חשד לאלח-דם (לא רק ביילוד) במיוחד בחולים עם דיכוי חיסוני. בתחילה הילד החולה מצמרר, נמצא בנשמת, תוך הרחבת כלי דם היקפיים. עם התקדמות המצב הזיהומי, מופיעים סימנים צירקולטוריים בולטים - תת-לחץ דם, עור לח וקר, כיחלון ו"עור משויש" בגפיים. הדופק נעשה מהיר וחוטני, ותפוקת השתן יורדת. סיבוכים אינם מאחרים לבוא, עם הפרעות קרישה, שינויים בעור ואי-ספיקת כליות ומערכת הנשימה.
האבחנה של הלם זיהומי תוכח סופית על-ידי שילוב תופעות הלם צירקולטורי עם תרביות דם חיוביות או הוכחת מקור זיהום ברור. בכל מקרה - אין להמתין עד להוכחה חד-משמעית של זיהום (במיוחד בחולים בקבוצת סיכון גבוה - אלה הלוקים באי יציבות המודינמית, או המדוכאים מבחינה חיסונית), ויש להתחיל מיד בטיפול אמפירי לפי הכללים המותווים להלן.
טיפול
ניטור ותמיכה המודינמית
חולים הלוקים באלח-דם קשה, מספקים מדדים קליניים כגון קצב הלב, לחץ ותפוקת שתן - מידע חשוב אך מוגבל ביחס למצב ההמודינמי ולאספקת החמצן לרקמות, ומכאן הצורך בניטור פולשני בחולים אלה, כגון הכנסת צנתר לעורק הריאה.
נוזלים: חולים באלח-דם זקוקים לנוזלים במתן דרך הווריד. מתן קריסטלואידים עד ללחץ מילוי של חדר שמאל (Wedge pressure) של 10–15 מילימטר כספית ותפוקת שתן של 1 סנטימטר מעוקב לקילוגרם שעה הם המטרה. כמות הנוזלים הנדרשת תלויה בגיל החולה ובמהלך המחלה. מתן עירוי דם לחולים עם אלח-דם הכרחי בחולים המדממים באופן פעיל, בחולים עם סימני אי-יציבות המודינמית או בחולים הלוקים במחלות לב עם המוגלובין נמוך. ככלל, בהיעדר אחת מההוריות המצוינות לעיל העלאת המוגלובין מעבר ל-10 גרם/דציליטר לא נמצאה כמשפרת את אספקת החמצן לרקמות.
תרופות ואזואקטיביות
לעיתים, יש להוסיף טיפול תרופתי על מנת לשפר את הפרפוזיה לרקמות. יש לשאוף לשמור על לחץ דם סיסטולי של 100 מילימטר כספית, ולחץ עורקי ממוצע של 70 מילימטר כספית. התרופות העיקריות בשימוש למטרה זו הם הדופאמין, דובוטמין, אדרנלין, נוראדרנלין ופנילאפרין. היעילות, הבטיחות והסכנות שבטיפול בתרופות אלה לא נבדקו במידה מספקת בעבודות פרוספקטיביות אקראיות. השימוש בתרופות אלה מעלה את הדרישות המטבוליות של הגוף ואף נמצא כמעלה את התמותה בקבוצת חולים שמצבם קשה. עקרונות הטיפול בתסמונת ההלם הזיהומי מוגדרים היטב וכוללים העמסת נוזלים, טיפול אנטיביוטי, סילוק מוקד הזיהום, ותמיכה המודינמית ונשימתית. מוצגות דרכי טיפול חדשות המתייחסות למתווכים המשוערים של התסמונת.
אנטיביוטיקה
סוג האנטיביוטיקה הנבחר בצורה ניסיונית לפני הביסוס המעבדתי, תלוי בפאתוגן המשוער. גם נכון למועד כתיבת מאמר זה, נגרם הלם זיהומי לרוב על- ידי חיידקים גרם-שליליים - לפיכך מקובל השילוב של תרופות ביתא לקטאם ואמינוגליקוזיד. ניתן להשיג שיפור אצל כ-80 אחוזים מהחולים כתוצאה משילוב אמיקאצין עם פיפרצילין או מוקסולקטאם. גנטאמיצין יכול להחליף את האמיקאצין, כתרופה חלופית ממשפחת האמינוגליקוזידים, ביחידות לטיפול נמרץ, שבהן עדיין לא גבוהה שכיחות העמידות של מתגים גרם-שליליים לתרופה זו.
קיימים צפלוספורינים מדור שלישי בעלי טווח פעילות רחב נגד חיידקים גרם-שליליים המאפשרים להשיג בקלות רמה בקטריוצידית בנסיוב. בחולים שאינם ניטרופניים או לוקים בזיהום של פסידומונאס, טיפול בלעדי בצפלוספורין מדור שלישי הוכח כיעיל באותה מידה כמו שילוב של ביתא לקטאם-אמינוגלוקוזיד. טיפול בתרופה יחידה כזאת עלול לעורר בעיות כמו התפתחות מהירה של עמידות כתוצאה מהשריית האנזים ביתא לקטאמאזה, וחוסר יעילות יחסית נגד אנטרוקוקים ופסידומונאס.
שילוב ניסיוני נוסף הוא של שתי תרופות ביתא לקטאמיות. בשילוב מוקסולקטאם עם פיפרצילין הושגו אותן תוצאות כמו בטיפול בביתא- לקטאם ואמינוגליקוזיד. יתרונות שילוב זה הם ביצירת סינרגיזם, כיסוי טווח רחב של חיידקים, והימנעות מהנפרוטוקסיות של הטיפול באמינוגליקוזיד.
אם קיים חשד סביר שמדובר בחולה שבו נגרם הזיהום על-ידי סטאפילוקוקים (נוטלי סמים, חולים עם צנתרים תוך-כליים, או חולים עם דיכוי מנגנון החיסון התאי), יש צורך לשלב את האנטיביוטיקום היעיל נגד קבוצה זו. בעיה קשה במיוחד מהווה זיהום של סטאפילוקוק זהוב העמיד בפני מתיצילין, ששכיחותו עולה והולכת כבעיה טיפולית בחולים מאושפזים. במקרים רבים חיידקים אלה גם עמידים בפני צפלוספורינים (עמידות צולבת) ואמינוגליקוזידים. תרופת הבחירה במקרה דנן היא ואנקומיצין, כאשר גם ריפאמפיצין, חומצה פוסידית, וקוטרימוקסאזול פעילים נגד חיידק זה. סטאפילוקוקוס אפידרמידיס מהווה אף הוא פאתוגן חשוב במצבים מסוימים, וגם במקרה דנן תיתכן עמידות בפני מתיצילין וצפלוספורינים אחדים. גם לגבי חיידק זה הודגמה רגישות לואנקומיצין ולריפאמפיצין. בכל מקרה, בזיהומים קשים של סטאפילוקוקים קיימת כנראה הוריה להשתמש בשילוב תרופות הפעילות נגד חיידקים אלה.
לסיכום: אף על פי שניתן להשיג כיסוי אנטיביוטי רחב נגד מגוון חיידקים בתרופה אחת, במיוחד בתרופה מתוך הפניצילינים והצפלוספורינים מדור מתקדם, עדיין נראה, כי רצוי לשלב שתי תרופות (לפחות). שילוב כזה מכסה חיידקים גרם-שליליים וחיוביים כאחד, יכול להיות סינרגיסטי, מונע התפתחות זנים עמידים, ויעיל במקרה של אלח-דם של יותר מחיידק אחד. נראה, כי אכן מוצדק במצב החרום של ההלם הזיהומי, לבחור בשתי תרופות כטיפול התחלתי, במיוחד כאשר לעיתים חולפים עוד 3 ימים עד הגדרת החיידק ורגישותו.
תמיכה מטבולית
לצורך חישוב הצריכה הקלורית בחולים, ניתן להשתמש בנוסחה של הריס-בנדיקט ולהוסיף לה עוד 20 אחוזים לחולה במצב דחק קל ו-50 אחוזים לחולה במצב דחק בינוני וסין 80 ל-150 אחוזים לחולה במצב דחק חמור. צריכת האנרגיה יכולה להגיע ל-50 קילו קלוריה לקילוגרם ליממה אף על פי שצריכת החלבון עלולה להגיע לכדי 2.5 גרם לקילוגרם ליממה, מתן של יותר מ-1.5 גרם חלבון ליממה לא הוכח כיעיל.
הזנה דרך המעי הוכחה כעדיפה ביחס להזנה תוך-ורידית. חולים שהוזנו דרך המעי החלימו מהר יותר והפרוגנוזה שלהם הייתה טובה יותר. הפרעה מטבולית חמורה יותר ועלייה בולטת יותר בציטוקינים בתגובה לאלח-דם נמצאה בחולים שהוזנו דרך הווריד. התכשירים המוכרים להזנה דרך הפה מכילים רבי סוכר, חלבונים, או חומצות אמיניות חופשיות וחומצות שומן ארוכות ובינוניות. ככלל, תכשירים אלו הם בעלי אוסמולליות נמוכה, זולים ונסבלים היטב על-ידי החולים. תכשירים מתקדמים יותר המכילים חומצות גרעין, גלוטמין, ארגינין וחומצות שומן מסוג אומגה 3 הראו שיפור בתפקוד מערכת החיסון, שיפור במצב התזונתי ושיעור בקטרמיה נמוך יותר ולכן השימוש בהם זכה לשם immunonutrition. הגלוטמין הוא חומר הדלק העיקרי למעי ובזמן דחק מונע איבוד אנטרוציטים. ארגינין היא חומצה אמינית המעלה את מספר הלימפוציטים מסוג T, וחומצות שומן מסוג אומגה 3 גורמות ליצור של פרוסטגלנדינים וליקוטריאנים החיוניים להתמודדות עם אלח-הדם. חומצות הגרעין משמשות ליצור RNA ונמצאו כמסייעות להתמודדות עם תהליכים דלקתיים וזיהומיים. לחולים הנמצאים במצב קשה ורמת הספיגה שלהם נמוכה יש לתת הזנה תוך-ורידית.
שמירה על חום הגוף
שינויים בחום הגוף משנים את עקומת הדיסוציאציה של החמצן. בטמפרטורות נמוכות החמצן נקשר חזק יותר ולכן אינו משתחרר ברקמות אלא בלחצי חמצן נמוכים מאוד. לכן חשוב מאוד לחמם חולים אלה על-ידי כיסוי החולה ומזרן חימום. העלייה בחום הגוף לרוב אינה דורשת טיפול. עלייה בחום עלולה לגרום לאי ספיקת לב של חולים בעלי תפקוד לב ירוד או חולים בהיפוקסיה, ולהחמיר את מחלתם. רצוי להוריד את חום הגוף של חולים שחום גופם עולה ל-℃41 ומעלה. קירור חיצוני על-ידי מאוורר או שמיכות קירור יעיל, אבל קשור בצמרמורות ובכיווץ כלי הדם ההיקפיים ולכן אינו רצוי. מתן תרופות מורידות חום, בשילוב עם תכשירים המונעים רעד יעיל מאוד.
נלוקסון
מחקר רב מתמקד סביב מערכת האנדורפינים במצבי ההלם השונים, כולל הלם זיהומי. נראה, כי בעת הלם זיהומי (כתוצאה מתת-לחץ דם, ממצב הדחק, או כתוצאה מהאנדוטוקסין) משתחרר מבלוטת יותרת המוח הפרואופיומלנקורטין, המתפרק בהמשך ל-ACTH ולביתא-אנדורפין. לביתא-אנדורפין זה נועד כנראה תפקיד חשוב בהיווצרות התת-לחץ דם. בדגמים ניסויים שונים הוכח, כי נלוקסון משפר את לחץ הדם ותפוקת הלב על-ידי הגברת עוצמת הכיווץ של המיוקארד, ואף מפחית בצורה משמעותית את התמותה בחיות שטופלו. בבני אדם לעומת זאת, אין עדיין תמימות דעים לגבי תפקיד הטיפול בנוגדי אנדורפינים בהלם זיהומי, כשמספר עבודות מסיקות שטיפול זה אינו יעיל וייתכן, כי הוא אף מזיק. מכל מקום, ברור כי מצויים חולים שבהם השיפור ההמודינמי, בעקבות מתן נלוקסון, הוא אכן משמעותי. ייתכן, שיעילות הטיפול בנלוקסון מתבטאת בעיקר לפני התחלת השלבים ה-"בלתי הפיכים" של ההלם הזיהומי.
אייקוזנואידים
לפרוסטגלנדינים, לתרומבקסאנים ולליקוטרינים, הנקראים כקבוצה אייקוזנואידים, מוקדשת תשומת לב כמתווכים אפשריים בשרשרת הפתופיזיולוגית של מנגנון ההלם. חומרים שונים מקבוצה זו (ליקוטרינים, תרומבקסאן A2) גורמים לחדירות ואסקולרית מוגברת, להיצרות הסימפונות ולתופעות קרדיוואסקולריות שונות, הכוללות ירידה בכוח כיווץ שריר הלב, ירידה ממושכת בלחץ הדם, וכיווץ כלי דם ריאתיים, כלייתיים וכליליים - כל אלה הם אירועים המופיעים במהלך ההלם הזיהומי.
מעכבים חוסמי תרומבוקסאן סינתטאזה שיפרו בחיות את לחץ הדם הריאתי, תפוקת הלב, מתח החמצן בדם עורקי ומספר מדדים ביוכימיים, ואף האריכו את ההיוותרות בחיים בדגמים ניסויים שונים. תרופות נוגדות דלקת לא-סטרואידיות (מסוג אספירין) הפועלות במנגנון של עיכוב ציקלואוקסיגנאזה שניתנו לעכברים בהלם זיהומי, הפחיתו את התחלואה והתמותה. הבעיה עם קבוצה זו של תרופות היא העיכוב הלא-סגולי של יצירת פרוסטגלנדינים בעלי השפעות מנוגדות. בכליה, לדוגמה, ייצור אנדוגני של פרוסטגלנדינים ואזודיליטטוריים שומר על הזילוח הכלייתי. ולכן, עם עיכוב יצירת פרוסטגלנדינים בעלי השפעות שליליות (כיווץ כלי דם, איגור טסיות וכוי) יורדת רמתם של פרוסטגלנדינים בעלי השפעה הפוכה, המגינים על המערכת הקרדיוואסקולרית במצב ההלם.
קיימות עבודות רבות המדגימות יעילות בולטת של תכשירים מעכבי אייקוזנואידים, הן בשיפור ההמודינמיקה הפגומה והן בשיעור ההיוותרות בחיים. מאידך, מספר העבודות בבני אדם הוא עדיין מועט. לחולים עם אלח-דם קליני ניתן דזוקסיבן, מעכב תרומבקסאן סינתטאזה, אשר הפחית את רמות תרומבקסאן B2 בצורה משמעותית. לעומת זאת, מעקף ריאתי, תנגודת היקפית ומדדים פתופיזיולוגיים נוספים לא השתפרו מבחינה משמעותית. ייתכן שלתרומבקסאן תפקיד בשלב מוקדם יותר של אלח-הדם. פיתוחם של מעכבים סגוליים יותר של מטבוליטים של חומצה ארכידונית יאפשר לימוד מדויק של תפקיד כל חומר בשרשרת הפתופיזיולוגית ויסייע לקבוע את הטיפול האפשרי היעיל.
טיפולים ניסיוניים
במחקרים שונים נוסו נוגדנים לאנדוטוקסין ממקור אנושי כנגד LPS של א. קולי ונמצאו יעילים בחלק מהעבודות. נוגדנים כנגד TNF ניתנו לפני השראת אלח-הדם או בתחילתו ונמצאו יעילים בחלק מהמחקרים.
בחלק מהמחקרים נמצא שאנטגוניסטים 1-7-IL הניתנים בתחילת ההלם הזיהומי מקטינים תמותה.
ה-GMCSF הוא חומר האחראי על קצב הייצור, תהליכי ההבשלה ותפקוד המקרופגים והגרנולוציטים. הוא מאריך את חיי הגרנולוציטים. דווח שמתן GMCSF לחולים הלוקים באלח-דם הגביר את יעילות תפקוד הגרנולוציטים והפחית את שיעורי התמותה.
כירורגיה בחולי אלח-דם
ניתוח חולים הלוקים באלח-דם הוא אתגר רפואי וניתוחי, הן בשל השפעות אלח-הדם על מערכות הגוף והשלכותיו על התגובה להרדמה ולניתוח והן משום שרבים מחולים אלה לוקים במחלות רקע קשות ונחשבים כבעלי סיכון ניתוחי גבוה. בניגוד לניתוחים מתוכננים שבהם כל מצב זיהומי מהווה סיבה לדחיית הניתוח, כאן הניתוח מבוצע דווקא בשל קיום הזיהום. זאת משום שניתוח הוא האמצעי היחיד העשוי לצמצם את ממדי תהליך הזיהום ואת השפעותיו השליליות של אלח-הדם על מערכות הגוף השונות. במצבים אלה יש לבצע ניתוח בתנאים לא מיטביים, כאשר הנטייה לנסות לשפר את מצב החולים על-ידי טיפול שמרני מוטעית. לניתוח עשויות להיות השפעות מיטיבות גם על הפרעות פתופיזיולוגיות הקשורות במחלות הרקע של החולה. סילוק המקור הזיהומי יאפשר החזרת הפיזיולוגיה לקדמותה ולכן יפחית את השיבושים במערכות. קביעת הזמן לניתוח חשובה. מחד גיסא, אין לדחות את הניתוח לשלב שבו ההשפעות המערכתיות של אלח-הדם תהיינה קשות מדי ובלתי הפיכות ומאידך גיסא אין למהר ולנתח לפני מיצוי הטיפול השמרני. הניטור במהלך הניתוח צריך לכלול רישום פעולת הלב, ומעקב רציף אחר תפוקת השתן, מאזן חומצה בסיס, רמות סוכר, תפקודי הכליה ותפקודי קרישה. על פי מחלות העבר ומצב החולה יש להחליט על החדרת צנתר מרכזי או סוון-גנץ לניטור תפקוד הלב השמאלי. יש להחדיר קו עורקי (Arterial line) ולעקוב אחר ערכי לחץ החמצן בדם.
בניתוח יש לבצע את ההליך הדרוש לסילוק המקור לאלח-הדם. רצוי לסיים את הניתוח של חולים הלוקים באלח-דם בזמן קצר ככל הניתן, להקטין איבוד נוזלים וחום, ולנסות להימנע מביצוע פעולות העלולות לגרום לסיבוכים שיאריכו את זמן הניתוח ויוסיפו לחומרת המחלה (פתיחת מעי). יש לנסות למנוע פיזור של הזיהום. חשוב ליטול דגימות דם לתרבית ולבדיקות רגישות מכל מקור זיהום אפשרי, כולל תרביות אנארוביות ואארוביות ותרביות רקמה.
יש להדגיש את חשיבות השטיפות המרובות של חללים מזוהמים על מנת להקטין את העומס החיידקי. בהתאם למקום הזיהום ואופיו יש לתכנן מראש כניסה חוזרת לניקוז ושטיפה של החלל המזוהם.
הלם זיהומי מהווה מצב חירום רפואי העולה והולך בשכיחותו, אשר למרות אבחנה נכונה, ניטור חודרני וטיפול מקיף, עדיין גורם לשיעור תמותה גבוה של חולים הלוקים בתסמונת. ידועים כמה מנגנונים פתופיזיולוגיים, התורמים להיווצרות מצב ההלם, אך נראה שטרם נתגלו כל המתווכים בעלי תפקיד אטיופתוגנטי בהשראת התסמונת. המחקר החדשני מתמקד היום במציאת חומרים אלה, ובניסוי מעכבים סגוליים. יש לקוות, שעם העמקת הידע על הלם זיהומי והמשך המחקר הקליני בבני אדם, יפחת וילכו שיעורי התחלואה והתמותה המשמעותיים של הלוקים בהלם זיהומי.
ראו גם
- לנושא הקודם: נזק ריאתי חד לאחר עירוי תוצרי דם
- לתוכן העניינים של הפרק
- לתוכן העניינים של הספר
- לפרק הקודם: חבלות
- לפרק הבא: ריפוי פצעים
המידע שבדף זה נכתב על ידי ד"ר צבי קויפמן - מומחה בכירורגיה, מנהל היחידה לבריאות השד מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק