הפארין קו-פקטור - Heparin cofacor - II
| מדריך בדיקות מעבדה | |
| הפארין קו-פקטור II | |
|---|---|
| Heparin cofacor II | |
| שמות אחרים | heparin cofactor A ,HCII, leuserpin 2 ו-dermatan sulfate cofactor |
| תחום | מנגנוני קואגולציה |
| טווח ערכים תקין | במבוגרים תחום הנורמה של HCII בפלזמה הוא 65-145%, או .0.5-1.4μmol/L ביילודים תחום הנורמה הוא 50% מזה של מבוגרים, אם כי בגיל 6 חודשים תחום הנורמה בתינוקות משתווה לזה של מבוגרים. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
אישוש של סיכון לפקקת ברמות שונות של HCII.
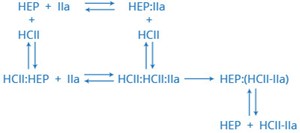
HCII הוא חלבון המקודד על ידי הגן SERPIND1 הממוקם בכרומוזום 22 באתר 22q11. הוא פקטור קרישה המעכב את פקטור IIa (תרומבין), ומשמש קו-פקטור של הגליקוזאמינוגליקנים הפארין ושל dermatan sulfate. התוצר המקודד על ידי גן זה, הוא מעכב של האנזים serine protease (serpin) ומעכב במהירות את תרומבין בנוכחות מולקולות רב-אניוניות כגון הפארין, chondroitin ,heparn sulfate או dermatan sulfate. גן זה מכיל 5 אקסונים ו-4 introns. ל-HCII יש הומולוגיה עם antithrombin III ועם חברים נוספים במשפחת העל של α-1-antitrypsin.
מוטציות בגן זה גורמות לחסר של HCII, מה שעלול להגביר את הייצור של תרומבין וכתוצאה מכך לקרישיות יתר. בשנת 1981 נוקה HCII והסתבר שמדובר בגליקופרוטאין פוליפפטידי בעל שרשרת בודדה המכיל 499 חומצות אמינו (480 חומצות של החלבון הבשל ו-19 חומצות של ה-signal peptide).
מצב מולד של חסר HCII דווח במצבים נדירים, וההורשה היא אוטוזומלית-דומיננטית. יחס ברור בין סיכון מוגבר של פקקת לבין חסר של HCII לא הודגם, שכן חסר של HCII מופיע הן באנשים בריאים כמו גם באלה הסובלים מאפיזודות של יצירת פקקת.
המשקל המולקולרי של HCII הוא 65 קילו-דלטון (Tollefsen וחב' ב-J Biol Chem משנת 1982). ריכוז CHII בפלזמה הוא 8.5-9.0 מיליגרם/דציליטר. HCII מסונתז בכבד (Tollefsen ו-Petska ב-Blood משנת 1985) ויש לו תקופת מחצית-חיים בפלזמה של 60 שעות. HCII מעכב תרומבין באופן ספציפי, בניגוד לאנטי-תרומבין המעכב תרומבין, פקטור Xa, ועוד סרין פרוטאזות. העיכוב של תרומבין על ידי HCII הוא בערך פי-10 אטי יותר מאשר העיכוב של תרומבין על ידי אנטי-תרומבין, והוא מתרחש דרך יצירת קומפלקסים אקווי-מולריים בין האתר הפעיל של HCII לבין האתר הפעיל של תרומבין (Tollefsen ב-Prog Mol Biol Transl Sci משנת 2010). פעילות האנטי-תרומבין של HCII מתגברת פי-1,000 לפחות, בנוכחות הפארין, הפארן סולפאט ודרמטן-סולפאט (Tollefsen וחב' ב-J biol Chem משנת 1983). התפקיד הפיזיולוגי של HCII אינו ברור, אך תפקידו עשוי להיות כמעכב של תרומבין בנוכחות דרמטן-סולפאט. חסר נרכש של HCII מדווח במטופלים עם מחלת כבד, או עם DIC (disseminated intravascular coagulation). היפוכו של דבר, רמות מוגברות של HCII נצפות במצבים של מפגעי כליות עם פרוטאינוריה, במהלך הריונות, או תוך נטילת גלולות למניעת היריון. מספר מוגבל של מחקרים הראה שהטרוזיגוטיות של HCII אינה גורם סיכון ליצירת פקקת, ללא גורמי סיכון מקבילים. מחקרים אחרים מדווחים על אפיזודות של פקקת ב-36% מאלה עם חסר HCII.
מידת הפיזור של גליקוזאמינוגליקנים על פני התא או במשתית החוץ-תאית (ECM) משפיעה על יעילות פעילותם של HCII ושל אנטי-תרומבין בעיכוב של תרומבין. פיברובלסטים בתרבית, כמו גם תאי שריר חלק וסקולרי, מסנתזים פרוטאוגליקנים המעודדים את עיכוב תרומבין על ידי HCII, אך סינתזה זו אינה מתרחשת בתאי אנדותל, מה שמצביע על כך ש-HCII עשוי לעכב תרומבין באזורים מחוץ לנהור (lumen) הווסקולרי (McGuire ו-Tollefsen ב-J Biol Chem משנת 1987, ו-Shirk וחב' ב-Arterioscler Thromb Vasc Biol משנת 1996). אף על פי שהתפקיד הפיזיולוגי המדויק של CHII אינו ברור לחלוטין, הנוכחות של קומפלקסים של -CHII תרומבין בפלזמה של אדם מצביעה על יכולת CHII לעכב פעילות תרומבין in vivo (Andersson וחב' ב-Thromb Res משנת 1996). HCII התגלה גם ב-intima של עורקי אדם נורמליים, והיכולת של dermatan sulfate בדופן העורק לסייע לפעילותו נחלשת ברבדים טרשתיים בעורק (Cooper וחב' ב-Clin Appl Thromb Hemost משנת 1996).
ניסויים נוספים הדגימו שנוכחות של β-mercaptoethanol אינה משפיעה על התנועה של HCII באלקטרופורזה בג'ל, מה שמוכיח שאין ב-HCII קשרים די-סולפידיים תוך-מולקולריים המחוזרים על ידי β-mercaptoethanol. מבנה מולקולה זה דומה למבנה של antithrombin III. נמצא גם כן שבניגוד לעיכוב של תרומבין, HCII מעכב חלש את פקטור הקרישה Xa. ל-HCII יש כנראה תפקיד בתגובה החיסונית, שכן הוא נכרך עם תהליך הדגרדציה של חלבונים בתיווך לויקוציטים, המביא לשחרור ציטוקינים בתגובה הדלקתית עם נויטרופילים ומונוציטים (Brummel-Ziedins וחב' ב-Hematology משנת 2018). ממצא אחר הוא ש-HCII הוא בעל יכולת מוגברת לעכב תרומבין בנשים הרות, מה שמגן עליהן מפני פקקות. במהלך הטרימסטר השלישי להיריון רמת HCII בפלזמה הייתה גבוהה ב-50% מרמתו הנורמלית בנשים לא הרות (Massouh וחב' ב-J Lab Clin Med משנת 1989, ו-Bellart וחב' ב-Blood Coagul Fibrinolysis משנת 1998), זאת אף על פי שהפלזמה של האישה ההרה ושל העובר מכילים רק כמויות קורט של dermatan sulfate (Andrew וחב' ב-J Clin Invest משנת 1992). לעומת זאת, הקומפלקסים של תרומבין-HCII מוגברים בשליש ה-3 של ההיריון פי-4 (Liu וחב' ב-Thromb Haemost משנת 1995). היפוכו של דבר, רמות CHII ירדו לרמה של 50% מהנורמה בהיריון בנשים עם pre-eclampsia חמורה, מה שמרמז לאפשרות שהירידה בפעילות של HCII יכולה להיות כרוכה עם תפקוד לקוי של השלייה. אכן, השלייה עשירה ב-dermatan sulfate ועשויה אף להיות מקור משמעותי של פרוטאוגליקן זה בצירקולציה, מה שמאפשר ל-HCII יכול להסתייע באופן מקומי על מנת לעכב קרישה בשלייה (Brennan וחב' ב-J Biol Chem משנת 1984). עם זאת, נראה ש-HCII אינו נדרש להיריון תקין בעכברים, שכן הכלאה של עכברים בהם שני ההורים חסרים CHII, יצרה שגרים דומים בגודלם ובשרידותם, בדומה לשגרים בהם ההורים היו הטרוזיגוטיים ל-HCII.
סוגיה חשובה המתעוררת היא האם ההגנה שמקנה HCII מפני קרישת-יתר תלויה בקטליזה של ריאקציית HCII-thrombin על ידי גליקוזאמינוגליקנים בדופן כלי הדם. HCII אנושי מנוקה מעכב תרומבין בשיעורי דרגה-שנייה של קבוע k = 6.3 x 10(4) M-1 min-1 בהיעדר גליקוזאמינוגליקן, ובקבוע של k=2.0x10(8) M-1 min-1 בנוכחות דרמטן סולפאט או הפארין. בהנחה ש-HCII בעכבר מעכב תרומבין בקינטיקה דומה, וריכוזו בפלזמה הוא 0.35μM, מחצית הזמן הנדרש לעיכוב של תרומבין בפלזמת עכבר הוא 30 שניות בהיעדר גליקוזאמינוגליקן. עם זאת, סביר שאנטי-תרומבין שולט בעיכוב של תרומבין, שכן ריכוזו בפלזמה שהוא בערך 2.0μM הגבוה משמעותית מזה של CHII, והוא אף מעכב תרומבין מהר יותר גם בהיעדר גליקוזאמינוגליקן. הקישור של HCII לגליקוזאמינוגליקן מתחת לשכבת האנדותל, עשויה להגדיל באופן דרמטי את העיכוב של תרומבין בנקודה בה יש נזק עורקי. באופן התומך בהשערה זו, הודגם ש-HCII מסומן רדיו-אקטיבית, נקלט לתוך דופן כלי הדם, ויוצר קומפלקס עם תרומבין, לאחר גרימת נזק באנדותל של אבי העורקים של ארנבת על ידי צנתר-בלון (Hatton וחב' ב-J Lab Clin Med משנת 1999). ניסויים עתידיים בהם עכברים חסרי HCII העוברים שיקום עם HCII רקומביננטי, בנוסף לניסויים עם עכברים וריאנטים בהם קיים פגם בקישור HCII לדרמטן סולפאט או להפארין, עשויים לספק ראייה ישירה לשפעול של HCII על ידי גליקוזאמינוגליקנים במודל של פקקות בעורק הקרוטידי בעכברים (Blinder וחב' ב-J Biol chem משנת 1989, ו-Whinna וחב' באותו כתב עת משנת 1991).
הוצע ש-HCII משתתף ברגולציה של הקרישה או כמשתתף בתהליכים כגון דלקת, טרשת עורקים, וריפוי פצעים (He וחב' ב-J Clin Invest משנת 2002). על מנת לחקור את התפקוד הפיזיולוגי של HCII, קטע של 2kb של הגן של HCII בעכבר, המקודד למחצית הקצה ה-N-טרמינלי, הושמט על ידי ריקומבינציה הומולוגית בתאי גזע עובריים. בחינה ביוכימית אישרה את היעדר העיכוב של תרומבין התלוי ב-dermatan sulfate בעכברי HCII–/–. בגיל שנה, עכברים נטולי-HCII היו במידה רבה דומים לעכברי wild-type מאותו השגר במשקלם ובהישרדותם, והם אף לא סבלו מפקקות ספונטניות או מאנומליות מורפולוגיות. לעומת זאת, בהשוואה עם עכברי wild-type, עכברים נטולי-HCII הדגימו פרק זמן קצר משמעותית שנדרש לחסימות העורק הקרוטידי לאחר פגיעה פוטו-כימיקלית באנדותל, אך אנומליה זו תוקנה על ידי עירוי של HCII מנוקה. ממצאים אלה מרמזים לכך ש-HCII מסוגל לעכב פקקת בצירקולציה העורקית.
העובדה ש-HCII נקשר ל-dermatan sulfate הנמצא גם ברקמות חוץ-וסקולריות, מרמזת לפעילויות שאינן קשורות להומוסטאזיס, כגון הגנה מפני פעילות תרומבין לאחר פגיעה ונזק רקמתי, זאת על ידי וויסות של הפעילויות המיטוגניות או הכימוטקטיות של תרומבין. בהתאמה עם הפעילות האחרונה, היא התצפית שפרוטאזות מופרשות מנויטרופילים יכולות לבקע את הקצה ה-N טרמינלי של HCII ליצירה של פפטיד כימוטקטי הכולל את שיירי חומצות אמינו 49–60, שעשוי לשחק תפקיד בתהליכים דלקתיים. לפיכך, נראה ש-HCII יכול לשמש באופן מינורי כאנטי-קואגולנט בצירקולציה, אך תפקידו העיקרי יכול לבוא לביטוי ברקמות חוץ-וסקולריות. מחקרים עדכניים ביססו קשר בין רמות HCII והיצרות מחודשת (restenosis) לאחר פרוצדורה אנגיופלסטית של החדרת תומכן, וסכנה של תהליך טרשתי בעורק הקרוטידי. אף על פי שחסר HCII אינו מהווה גורם סיכון משמעותי לפקקת, רמתו היחסית גבוהה בצירקולציה (1.2μM) ויכולתו להתקשר ולהיות משופעל על ידי גליקוזאמינוגליקנים, תורמת אף כי חלקית לפעילות מעכבת-תרומבין של anti-thrombin.
מנגנון השפעול על ידי HCII
בניגוד לכל ה-serpins האחרים עם ארגינין באתר הפעיל שלהם, ב-HCII השייר הפעיל הוא לאוצין. הספפציפיות של HCII לתרומבין מסתייעת על ידי לולאה של 80 חומצות אמינו בקצה ה-N-טרמינלי, המכילה שני repeats נסתרים דמויי-hirudin, הנחשפים על הקישור של גליקוזאמינוגליקנים. שני repeats אלה הם: GEGEEDDDY(SO4) ו-IFSEDDDY(SO4)IDI. ההשערה היא שהזנב ה-N-טרמינלי החומצי מגיב עם אתר הקישור הבסיסי של HCII הטבעי, ושזנב זה משתחרר מאינטראקציה אלקטרוסטטית זו עם אתר הקישור של הפארין על ידי תחרות עם גליקוזאמינוגליקנים על אותו אתר. השערה מעט שונה באשר לשפעול של HCII על ידי הפארין לצורך עיכוב תרומבין מתבססת על המבנה הגבישי של HCII והדמיון המכניסטי לפעילות anti-thrombin. השערה זו שונה מההשערה המקורית בכך שהיא אינה נסמכת על הַעְתָּקָה ישירה של הזנב החומצי של HCII על ידי ההתקשרות של הפארין, אלא על ניתוק זנב זה כתוצאה משינוי בקונפורמציה של HCII בעת הקישור של הפארין. המנגנון הוא לפיכך אלוסטרי באופן מלא.
הוראות לביצוע הבדיקה
אין ליטול דם בצנטר שעבר הפאריניזציה. הדם צריך להילקח במבחנות ציטראט המכילות 3.2% סודיום ציטראט. יש למלא את המבחנה (פקק תכלת) במלואה כדי שיישמר יחס נכון בין הדם לציטראט. יש להפוך המבחנה המלאה בדם לפחות 6 פעמים כדי לוודא ערבוב מוחלט בין נוגד הקרישה לדם. יש לסרכז את המבחנה למשך 10 דקות במהירות 1,500g ולאסוף 2/3 מנפח הפלזמה, תוך זהירות לא לזהם את הפלזמה עם התאים במשקע, ולהעביר את הפלזמה למבחנת פלסטיק. יש לסרכז שנית למשך 10 דקות כדי להיפטר מטסיות דם, ולהעביר את הפלזמה המטוהרת למבחנת פלסטיק, ולהקפיא את הפלזמה עד לבדיקה עצמה. אם הפלזמה לא מוקפאת ונשמרת בקירור, היא יציבה למשך 48 שעות (Lane ו-Boisclair ב-Blood Coagulation & Hemostasis משנת 1991).
מספר גישות משמשות למדידה של HCII:
- בדיקת ELISA בה מצפים פלטת microtiter עם נוגדן רב-שבטי כנגד HCII. מוסיפים לבארות המצופים פלזמה מהולה לתקופת הדגרה של 45 דקות, ולאחר שטיפות, ה-HCII הקשור לבארות מתגלה על ידי הוספה של נוגדן חד-שבטי כנגד HCII אליו קשור האנזים horseradish peroxidase. לאחר פרק זמן נוסף של הדגרה ושטיפות מוסיפים את המצע לפראוקסידאז שהוא לרוב p-nitro phenol, ומודדים את עוצמת הצבע הצהוב המתקבל בעזרת ELISA plate reader
- בדיקת דרמטן-סולפאט-HCII: מוסיפים כמות מדודה של dermatan sulfate לפלזמה הנמדדת, כאשר ה-dermatan sulfate נקשר באופן ספציפי ל-HCII ומגביר את פעילות העיכוב שלו כנגד תרומבין. מוסיפים למבחנה תרומבין בכמות מדודה, ומודדים את פעילות התרומבין השארי שנותר לאחר העיכוב עם HCII באמצעות מצע כרומוגני. על ידי השוואה כנגד סדרה של סטנדרטים וכמויות שונות של HCII שהוסף בתחילת הבדיקה, ניתן לחשב את ריכוז HCII בפלזמה. להלן פירוט הבדיקה האחרונה של עיכוב תרומבין על ידי HCII: הפעילות של HCII נקבעה על ידי מדידת כמות תרומבין המעוכב בפלזמה של עכבר בהוספה של דרמטן סולפאט. פלזמה (2 מיקרוליטר) עורבבה עם 50 מיקרוגרם/מ"ל של דרמטן סולפאט שהופק מעור חזיר, ועם 16 ננומולר של α-תרומבין ממקור אדם בבופר TS/PEG ב-pH7.4. תרומבין הוסף כדי לאתחל את הריאקציה. לאחר הדגרה של 60 שנ' בטמפרטורת החדר, מוסף המצע הכרומוגני (500 מיקרוליטר של 100 מיקרומולר tosyl-Gly-Pro-Arg-p-microanilide תכשיר הידוע כ-Chromozym TH של חברת Roche בבופר (TS/PEG והבליעה באורך גל 540 ננומטר נקבעה ברציפות 100 שנ'. שיעור השינוי בבליעה הוא פרופורציוני לתרומבין הפעיל שנותר בנוזל ההדגרה. הריכוז המולרי של HCII בפלזמה חושב מכמות התרומבין שעוכב, מתוך השערה של סטויכיומטריית עיכוב של 1:1
- שיטה נוספת למדידת פעילות HCII בפלזמה פורסמה על ידי Vinazzer וחב' ב-Thromb Res משנת 1987. עקרון השיטה מבוסס על אינאקטיבציה של antithrombin III בפלזמה על ידי הוספה של פרקציית IgG מנסיוב עז שחוסנה כנגד antithrombin III אנושי. אינאקטיבציה מלאה של antithrombin III בפלזמה מטופלת עם הפארין לה הוסף IgG האמור, ניתנת להדגמה על ידי חסר של Xa-effect. תרומבין עוכב רק באופן חלקי לאחר אינאקטיבציה של antithrombin III. המאפיינים של עיכוב זה מיוחסים לפעילות של HCII. בשיטת הבדיקה של Vinazzer וחב', שניתן ליישמה בשגרה הקלינית, נמצא שרמה נמוכה של CHII מופיעה בשחמת הכבד (צירוזיס) כמו גם ב-DIC, אך לא בחסר של antithrombin III. כן מצאו חוקרים אלה שב-15 תוך 269 מקרים של DVT נשנית, פעילות HCII הייתה מתחת ל-70% מהנורמה, כאשר ב-4 מהמקרים האחרונים פעילות CHII הייתה בין 44-54% מהנורמה. במחלה חסימתית עורקית, פעילות HCII נמצאה נמוכה מ-60% מהנורמה ב-18 מתוך 583 מטופלים
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק