הבדלים בין גרסאות בדף "חומצה D-לקטית - D-lactate"
(←ראו גם) |
|||
| שורה 70: | שורה 70: | ||
==ראו גם== | ==ראו גם== | ||
| − | *[[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | + | * [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] |
| + | * [[בדיקות ביוכימיות|בדיקות מעבדה - בדיקות ביוכימיות]] | ||
* [[בדיקת מחלות מעי|בדיקות מעבדה - מחלות מעי]] | * [[בדיקת מחלות מעי|בדיקות מעבדה - מחלות מעי]] | ||
| שורה 77: | שורה 78: | ||
| + | [[קטגוריה:בדיקות מעבדה - בדיקות ביוכימיות]] | ||
[[קטגוריה:בדיקות מעבדה - מחלות מעי]] | [[קטגוריה:בדיקות מעבדה - מחלות מעי]] | ||
| − | |||
[[קטגוריה: בדיקות מעבדה: כימיה בדם]] | [[קטגוריה: בדיקות מעבדה: כימיה בדם]] | ||
[[קטגוריה: בדיקות מעבדה: כימיה בשתן]] | [[קטגוריה: בדיקות מעבדה: כימיה בשתן]] | ||
גרסה מ־15:14, 28 במרץ 2017
| מדריך בדיקות מעבדה | |
| חומצה D-לקטית | |
|---|---|
| D-lactate | |
| מעבדה | כימיה בדם וכימיה בשתן |
| תחום | זיהוי חמצת מטבולית לא שגרתית |
| טווח ערכים תקין | בדם ובשתן-0.00-0.25 מילימול/ליטר (0.00-22.5 מיליגרם/ליטר). |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
יחד עם מדידת D-lactate בשתן משמשת מדידת חומצה זו לאבחון תרחיש של D-lactate acidosis, בעיקר באלה עם תסמונת המעי הקצר (short-bowel syndrome) או באלה שעברו ניתוח מסוג jejunoileal bypass.
שני האיזומרים של חומצה לקטית
כמקובל עם מולקולות ביולוגיות פעילות רבות, כמו חומצות אמינו או גלוקוזה, לקטאט קיים בטבע בשתי צורות סטראו-איזומריות, כתוצאה מנוכחות של אטום פחמן א-סימטרי. מולקולות כלקטאט המציגות סטראו-איזומריוּת הן פעילות אופטית, דהיינו ש-2 האיזומרים גורמים לרוטציה של אור מקוטב בכיוונים מנוגדים. שני האיזומרים של לקטאט הידועים כ- L-lactate ו-D-lactate , גורמות לרוטציה של האור עם כיוון השעון (+), ונגד כיוון השעון (-), בהתאמה.
שתי הצורות של לקטאט עוברות מטבוליזם ליצירת פירובאט על ידי פעולת האנזים LDH או lactate dehydrogenase. אלא שאנזים זה ספציפי לאיזומר שלו באופן ש-L-lactate זקוק לאנזים L-LDH, ואילו D-lactate זקוק לאנזים D-LDH. תאי יונקים מכילים רק L-LDH כך שבאדם הלקטאט הנוצר הוא באופן כמעט בלעדי L-lactate. לעומת זאת, זני חיידקים המסוגלים לגרום לתסיסה של פחמימות (כמו lactobacillus spp), מכילים את 2 האנזימים ולכן הם מסוגלים לייצר D-lactate ו-L-lactate. בעבר הייתה השערה שהכמות המאוד קטנה של D-lactate המצויה באופן נורמאלי בדם של בני-אדם בריאים (ריכוז של 5-20 מיקרומול/ליטר על פי Petteri וחב' ב-Clin Biochem משנת 2008, לעומת ריכוז של 1 מילימול/ליטר של L-lactate) נובעת באופן בלעדי ממקורות אקסוגניים כמו דיאטה (יוגורט, גבינה, שמנת חמוצה) או תוצרת של חיידקי הפלורה של המעי המפרקים פחמימות. אלא שכיום כבר ברור שלמרות החסר של D-LDH, גם D-lactate יכול להיווצר ולעבור מטבוליזם בתאי אדם, למרות שכל הפעילות הזו מתאימה לכמויות הזעירות של איזומר זה.
D-לקטאט
חומצה D-lactate מיוצרת על ידי חיידקים השוכנים במעי הגס כחלק מהפלורה הטבעית, כאשר פחמימות לא נספגו לחלוטין במעי הדק. כאשר כמות גדולה של D-lactate נספגת במעי ומגיעה לדם, באפיזודות של תסמונת המעי הקצר שמתרחשות בדרך כלל לאחר ארוחות עשירות בפחמימות, נוצרת חמצת מטבולית, שינויים בסטאטוס המנטאלי (מנמנום ועד תרדמת), בלבול, קושי להתרכז, איבוד זיכרון, ומגוון של תסמינים נוירולוגיים ובעיקר קשיי דיבור (dysarthria) ושגשון (ataxia). רוב הסובלים מהתסמונת מתלוננים על תחושת שיכרות, למרות שלא צרכו כלל אלכוהול.
למרות שתואר הקשר הזמני בין העלייה ברמת D-lactate בפלזמה לבין התופעות האנצפלופתיות הנלוות, לא פוענח עדיין המנגנון של יצירת התסמינים הנוירולוגיים. חמצת על רקע D-lactate מאובחנת באופן אופייני בקרב אלה עם תסמונת המעי הקצר, או לאחר ניתוח מסוג מעקף jejunoileal, מה שגורם להפרעה בספיגת פחמימות במעי הדק. בנוסף, גם ילדים בריאים שלוקים ב-gastroenteritis עלולים לפתח D-lactic acidosis (על פי Petersen ב-Nutr Clin Pract משנת 2005).
היצירה המטבולית של D-lactate בתאי אדם היא תוצאה של מסלול ה-methylglyoxal, שהוא מסלול מינורי של גליקוליזה המייצר כמויות ננומולריות של methylgloxal, תוצר טוקסי המותמר ל-D-lactate (על פי Ewaschuk וחב' ב-J Nutr משנת 2005, ו-Uribarri וחב' ב-Medicine משנת 1998). כמו כן ידוע שחומצה D-לקטית היא תוצר הקצה של האנזים Glyoxalase II (הידוע כ-hydroxyacyl-glutathione hydrolase, המסב את תוצר הביניים S-lactosyl-glutathione ליצירת גלוטתיון מחוזר (GSH) ו-D-lactate. בהיעדר של D-LDH תאי אדם יכולים לעבור מטבוליזם של D-lactate לפירובאט על ידי פעולת האנזים המיטוכונדריאלי D-2-hydroxyacid-dehydroganse.
חומצות אורגניות במערכת העיכול מקורן ישירות מן המזון, וכן על ידי יצירתן במעי. במצב פיזיולוגי תקין, רמת החומצות האורגניות אינה בעייתית למאזן "חומצה-בסיס" בגוף, שכן הכמות של החומצות הדיאטטיות אינה עולה על סף היכולת המטבולית של גופנו לפרק אותן. בנוסף, החומצות מופיעות במזון ביחד עם מלחי האשלגן שלהן, כמו לדוגמה במקרה של חומצת לימון, ופרוק מטאבולי של ציטראט-אשלגן מביא ליצירת ביקרבונאט בסיסי, הסותר את חומציות היתר של החומצות האורגניות שבמזון.
D-lactic acidosis
במצב תקין נוצרות במעי חומצות אורגניות בכמות מתונה, כתוצרי חילוף חומרים של חיידקי מעי שכיחים, וגופנו מסב אותם לתוצרי פירוק. החומצות העיקריות הנוצרות הן חומצה אצטית (60%), בוטירית (20%) ופרופיונית (20%), והן מופיעות בעיקר במעי העיוור בו מתבצע המגע העיקרי בין צמחיית המעי והמזון (Halperin ו-Kamel ב-Kidney Int משנת 1996). בכרכשת לעומת זאת, מפרקים חיידקים בעיקר סיבים בלתי-מסיסים, ומעט חד- ודו-סוכרים וכן מקטעי עמילן, שלא עוכלו במעלה המעי הדק. מקובל שהגליקוליזה האנאירובית בכרכשת מביאה ליצירת 2 מולקולות של חומצה אורגנית מכל מולקולת סוכר. אם 25 גרם גלוקוזה מגיעים לכרכשת, ייוצרו מדי יום כ-50 גרם חומצה לקטית, בהתאם לשכיחות החיידק השולט, ייקבע היחס בין האיזומרים L ו-D של חומצה לקטית. כמו כן, אם קיימת שהות מספקת של התוצר האחרון בכרכשת, יקבע סוג החיידקים וכמותם את קצב ההסבה של חומצה לקטית לחומצה אצטית בנוסף ל-CO2. כיוון שבדרך כלל כמות הסוכר המגיעה לכרכשת מוגבלת, יניב הפירוק על ידי חיידקים בעיקר חומצה אצטית. אך לעתים, כמו לאחר ניתוח ליצירת מעקף בין המעי הצם והכרוך, או לאחר כריתה נרחבת של המעי הדק, עלול להתרחש מצב מטאבולי משמעותי ובלתי שכיח של חמצת על רקע חומצה D-לקטית,. במידה פחותה יתרחש המגע בין חיידקי הכרכשת לבין הדו-סוכר לקטוזה, שלא יתפרק דיו במעלה המעי בגין חסר האנזים lactase, בתסמונת אי הסיבולת ללקטוזה.
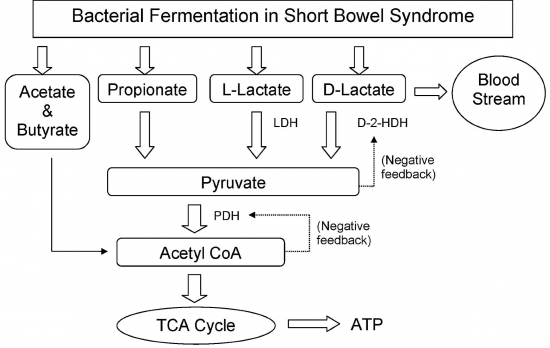
לא כל חיידקי המעי מייצרים חומצות אורגניות ולבטח לא כולם יגרמו להתהוות רמות מולאריות דומות של 2 האיזומרים של חומצה לקטית. קבוצת הלקטובצילים מביאה ליצירת לקטאט לאין שיעור יותר מחיידקי clostridium במעי, וכאשר ה-pH בנהור המעי יורד לתחום חומצי יותר, עולה ביתר פעילות החיידק Lactobacillus acidophilus (Stolberg וחב' ב-N Eng J Med משנת 1982). חיידק זה מכיל את האנזים DL-latate racemase המשחלף בין 2 האיזומרים L ו-D. בתנאים פיזיולוגיים תקינים, חומצה D-לקטית היא תוצר זניח במעי, אך כאשר כמות גדולה של גלוקוזה באה במגע עם זן הלקטובצילוס האמור, יביא פירוק אנארובי של הסוכר ליצירה מרוב של 2 האיזומרים של לקטאט. בנוסף, עלולים להצטבר חומרים רעילים אחרים דוגמת אלדהידים, כהלים, מרקאפטנים וכן אמינים. האחרונים יכולים לפעול כנירוטרנסמיטרים המסייעים לגרימת תרחישים נירולוגיים. למרות שהאדם חסר את האנזים D-lactate dehydrogenase, יש לו יכולת מוגבלת לפרק D-lactate בסיוע האנזים D-α-hydroxy acid dehydrogenase שפעילותו ניכרת בכבד ובקורטקס הכלייתי.
חומצה D-לקטית ו-anion gap
חומצה D-לקטית היא גם תוצר מטבולי של propylene glycol. מגוון של תרופות מומסות בפרופילן-גליקול כדי להפוך אותן מתאימות לעירי תוך-ורידי. כאשר תרופות אלו מוזלפות לווריד בקצב מהיר, יכול להצטבר פרופילן-גליקול, מה שעלול לגרום ל-osmolal gap. גם חמצת על רקע של anion gap יכולה להתפתח, והיא נוצרת על ידי תוצרים מטבוליים של פרופילן-גליקול, הכוללים מספר חומצות אורגניות חזקות, שאחת מהן היא חומצה D-לקטית. רוב המקרים מדווחים הם כתוצאה מעירוי של lorazepam ו-diazepam במינונים גבוהים.
חומצה D-לקטית יכולה להצטבר ולתרום ל- anion gap acidosis שלketoacidosis על רקע סוכרת. מחקר אחד הראה שהריכוזים של D-lactate לעתים קרובות עולים באותם חולים על meq/L2 ואף יכולים להגיע לתחום של meq/L8-10. החומצה ה-D-לקטית כנראה נובעת מ-methylglyoxal, מטבוליט של אצטון כמו גם של dihydroxyacetone phosphate. שני החומרים האחרונים יכולים להצטבר באלה עם diabetic ketoacidosis.
כאשר מתפתחת חמצת על רקע D-לקטאט, הגדלת ה-anion gap יכולה להיות קטנה יותר מהנפילה בריכוז ביקרבונאט בפלזמה (כלומר בלוקים בתסמונת ניתן למצוא הן anion gap גבוה וכן חמצת מטבולית היפר-כלורֶמית. ההתפתחות של חמצת היפרכלורמית, קשורה לסטראו-ספציפיות של הקוֹ-טרנספורטר של sodium-L-lactate בממברנה הלומינאלית של האבוביות הפרוקסימאליות. תרחיש זה גורם להפחתה ביעילות של הספיגה מחדש של D-lactate, כאשר ההפרשה של D-lactate לשתן עם אשלגן או נתרן תפחית את ה-anion gap ללא שינוי ברמות ביקרבונאט, וכן היא תגביר את ריכוזי הכלור. לכן, ההערכה של נבדק החשוד לחמצת D-לקטית יכולה להיעזר על ידי קביעה בשתן של ה-anion gap כמו גם של ה-osmolar gap: הפרשת נתרן ו/או אשלגן ביחד עם D-לקטאט בשתן, תיצור anion gap חיובי חזק, דהיינו הריכוזים בשתן של קטיונים כנתרן ואשלגן, יהיו גבוהים יותר מריכוזי האניונים בשתן.
תסמונת המעי הקצר ו-D-lactic acidosis
עד שנת 1979 שלטה ההשערה שכל המקרים של hyper-lactatemia ו-חמצת לקטית הם כתוצאה מהגברה האיזופורם הדומיננטי L-lactate. באותה שנה דווח על המקרה הראשון בו חמצת לקטית נבעה באופן בלעדי מהגברה של D-lactate ולא של L-lactate, ומדובר היה במטופל ש-3 שנים קודם לכן עבר ניתוח לכריתת חלק מהמעי הדק שלו. תסמונת המעי הקצר אינה סיבוך הכרחי לאחר ניתוח של כריתת למעלה מ-50% של המעי הדק. ניתוח רדיקלי זה עלול להתבצע במקרים של תסמונת קרוהן, סרטן המעי, אי-ספיקה של המעי, פגיעה טראומטית במעי, אן פגם מולד במעי כגון midgut volvulus המתגלה כבר בלידה. תסמונת המעי הקצר יכולה להתרחש באלה שעברו ניתוח מעקף jejunoileal במקרים של השמנה מוגזמת. חמצת על רקע של D-lactate, מוגדרת כרמת D-lactate בפלזמה שמעל 3 מילימול/ליטר, בשילוב עם חמצת מטבולית כאשר ה-pH של הדם נמוך מ-7.35, היא רק אחת ממספר ליקויים מטבוליים שיכולים להתרחש במטופלים עם תסמונת המעי הקצר.
תסמונת המעי הקצר עיקרה תת-ספיגה בעקבות כריתה נרחבת של 50% ומעלה מאורך המעי הדק (Ziegler ב-Clin Perinat משנת 1986). תסמונת זו נגרמת או על ידי מומים מלידה או נרכשים של מערכת העיכול, בעיקר כתוצאה מדלקת כרכשת מכייבת (necrotizing enterocolitis), ובשיעורים נמוכים יותר כתוצאה מחסימת מעי, מחלת הירשפרונג וכן גסטרוסכיזיס. אחד הסיבוכים הנדירים של תסמונת המעי הקצר שלא זכה לתשומת-לב, היא התהוות חמצת מטאבולית על רקע יצירת האיזומר "הלא טבעי" D, של חומצה לקטית. תוצר מטאבולי זה של חיידקי הכרכשת מקבוצת לקטובצילוס, המפרקים את המזון הפחממני העודף המגיע לכרכשת בעת המעבר להזנה פומית שבועות אחדים לאחר הניתוח (Gurevitch וחב' ב-Acta Pedatr משנת 1993). חומצה D-lactic המצטברת לרמות גבוהות בדם ובשתן, אינה ניתנת לגילוי בבירור מעבדתי שגרתי, שנועד למדוד רמת L-lactate. בהתאם צריכה להיות דרישה ספציפית למדידת D-lactate בדם או בשתן, אם כי הבדיקה בשתן מועדפת כיוון ש-D-lactate מופרשת במהירות בשתן.
לא ברור עדיין האם תסמיני האנצפלופתיה אמנם נובעים מעלייה ברמת D-lactate בדם, כיוון שקיים דמיון קליני בין תסמונת המעי הקצר לבין פגימות מלידה או נרכשות בחילוף החומרים של פירובאט, מודגש שהפרעה לתהליך האחרון המושרית על ידי D-lactate עלולה לשבש את תפקוד מערכת העצבים המרכזית (Cross ו-Callway בMayo Clin Proc משנת 1984). בעקבות תצפיות בבעלי חיים במצבי חמצת של D-לקטאט שגרמו לשינויים היסטו-פתולוגיים באפיתל המעי, בדומה לאלה שמוצאים בבני-אדם, הועלתה אפשרות שחמצת זו עלולה לסייע בספיגה מוגברת של רעלנים מהמעי (Dunlop ו-Hammond ב-An NY Acad Sci משנת 1965). חמצת כשלעצמה עלולה להגביר את הרגישות העצבית לרעלנים של חיידקים ואף דווח ש-D-lactate יכול להפריע לתפקוד מערכת העצבים המרכזית, אם על ידי מעולה דמוית נירוטרנסמיטר או על ידי הפרעה לצריכת חמצן במוח (Oh וחב' ב-Metabolism משנת 1985).
לעומת זאת, למרות שרמות מוגברות של D-לקטאט גרמו לתסמינים עצביים ברוב החולים (Perlmutter וחב' ב-J Pediatr משנת 1983), דווח על כאלה ללא כל תסמינים ראויים לציון (Thurn וחב' ב-Am J Med משנת 1985). בדומה, הזלפה תוך-ורידית של D-לקטאט במתנדבים בריאים, שהביאה את רמתו בדם לריכוז של 6 מילימול/ליטר, לא הביאה לתסמין נירולוגי כלשהו, כך שלא תמיד ניתן לייחס ל-D-לקטאט את המפגעים הנירולוגיים המתוארים.
מדידה של לקטט בפלזמה
שיטות שגרתיות למדידת רמת לקטט בפלזמה, מבוססות על פעילות של אנזימים הפועלים על לקטאט, לקטאט דהידרוגנאזה המופק מרקמות של בעלי חיים, ולקטאט אוקסידאזה המופק מחיידקים. החיישנים של לקטט המוחדרים באנליזרים של גזים בדם, מבוססים על פעילות לקטט אוקסידאזה המקובע על פני ממברנה. כאשר הלקטט בדגימה בא במגע עם האנזים לקטט אוקסידאזה, הוא מתחמצן ליצירת פירובאט ומי חמצן. ה-H2O2 שנוצר בריאקציה נמדד בשיטה אמפּרוֹמטרית על ידי מרכזית (Cross ו-Callaway הכלואה בתוך החיישן. חשוב לציין ש-2 האנזימים המשרתים מדידת לקטט ספציפיים רק ל-L-lactate, וכך הם מודדים רק את רמת L-lactate, ולא יראו כל זיקה ל-D-lactate גם אם האחרון יגיע בדם לריכוז של 10 מילימול/ליטר.
פותחו אמנם מספר שיטות למדידה ספציפית של D-lactate , שאמורות להיות יותר רגישות משיטות המדידה של L-lactate, שהרי במצבים תת-קליניים ריכוזי D-lactate נמוכים, ושיטות אלו מבוססים בדרך כלל על פעילות האנזים D-lactate dehydrogenase, והן אינן זמינות באופן רחב Ludvigsen) וחב' ב-Clin Chem משנת 1983). את הבדיקה מבצעים על ידי שינוי האנזים מ-L-LDH ל-D-LDH, כאשר כל יתר תנאי הריאקציה האנזימאטית זהים.
המחסור היחסי הנוכחי בערכות לבדיקת רמת D-lactate, עשוי להשתנות בקרוב עם הגברה בעניין המחקרי על המשמעות הקלינית של הגברה תת-קלינית ברמות D-lactate בפלזמה, דהיינו רמות D-lactate בתחום של 50 מיקרומול/ליטר עד 2 מילימול/ליטר (Herrera וחב' ב-Ann Clin Biochem משנת 2008).
הוראות לביצוע הבדיקה
יש ליטול דגימת שתן אקראית חד-פעמית או איסוף 24 שעות ללא חומרים משמרים, ולהקפיאו מיד. השתן צריך להישלח למעבדה קרובה קפוא, ולמעבדה רחוקה על קרח יבש. יציבות השתן: קפוא-שנה; מקורר-7 ימים; שתן בטמפרטורת החדר-3 ימים. יש לפסול שתן שהגיע למעבדה מופשר, או דגימת שתן מאוד המוליטית, ליפמית או איקטרית.
את דגימת הדם יש ליטול במבחנת סודיום פלואוריד-פוטסיום אוקסלאט (פקק אפור), ולאחר סרכוז יש להקפיא מיד את הנוזל העליון. יש לפסול דגימות מאוד המוליטיות, ליפמיות או איקטריות. שיטת הבדיקה המקובלת היא מדידה ספקטרופוטומטרית של D-lactate (על פי Brandt וחב' ב-Anal Biochem משנת 1980).
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק 