חומצת פוספטאז של הערמונית - Prostatic acid phosphatase
| מדריך בדיקות מעבדה | |
| חומצת פוספטאז של הערמונית | |
|---|---|
| Prostatic acid phosphatase | |
| שמות אחרים | PAP, PSAP, prostatic specific acid phosphatase |
| |
| מעבדה | ]]כימיה בדם]] |
| תחום | סמן מוקדם של סרטן הערמונית. |
| טווח ערכים תקין | קטן מ-2.1 ננוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
סיוע לנבא הישנות התהליך הסרטני כתוצאה מקרצינומה של הערמונית לאחר כריתה רדיקלית שלה לאחר אבחון קליני של סרטן ערמונית מקומי. מעקב אחר תגובה לתרפיית אבלציה עם אנדרוגן, המתבצעת בשילוב עם מדידת PSA.
כללי
מדובר באנזים המיוצר על ידי בלוטת הערמונית. רמתו בדם מוגברת באנשים עם סרטן הערמונית, כאשר רמות האנזים הגבוהות ביותר מתגלות באלה עם מחלה גרורתית של הערמונית. במחלות עצם כגון מחלת Paget או hyperparathyroidism, מחלות של תאי דם כגון sickle-cell disease, multiple myeloma או מחלות אגירה ליזוזומליות כגון מחלת Gaucher, מוצאים רמות מוגברות באופן מתון של PAP. מספר תרופות יכולות לגרום לעליות זמניות של האנזים, כמו גם בטיפולים של הערמונית כגון עיסוי, ביופסיה או בדיקה רקטלית. תפקידו הפיזיולוגי של PAP כנראה כרוך בתהליך ההֲמָסָה של נוזל הזרע (Boron ב-Med Physiol משנת 2003).
השימוש באנזים PAP להערכת הפרוגנוזה של סרטן הערמונית
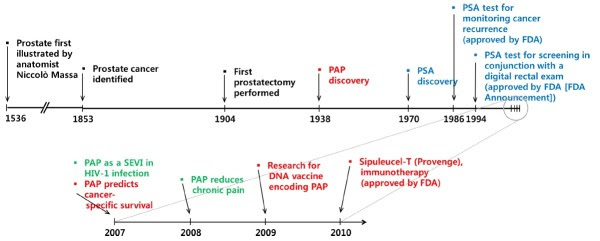
PAP שימש לנטר ולהעריך את ההתקדמות של סרטן הערמונית, עד ההכנסה של הסמן PSA. מחקר מאוחר יותר הציע שיש ל-PAP תפקיד בניבוי סרטן הערמונית בסיכון גבוה, מה שהביא לחידוש העניין באנזים זה כסמן ביולוגי (Taira וחב' ב-Oncology משנת 2007). PAP היה סמן הסרטן המועיל הראשון בהופעתו בשנות ה-40 וה-50 של המאה ה-20.
אימונוהיסטוכימיה
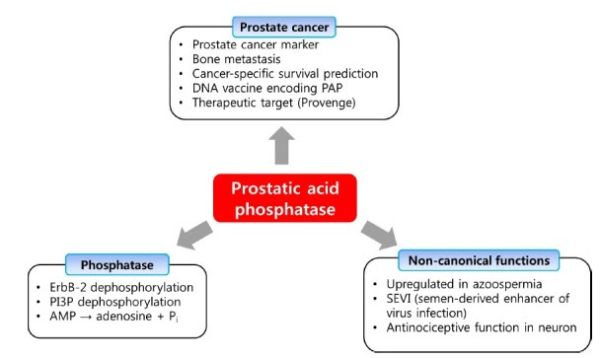
הצביעה האימונוהיסטוכימית של PAP מתבצעת לרוב עם בדיקת PSA על ידי פתולוגים, על מנת לסייע באבחון של קרצינומות מובדלות באופן לא מובהק. לדוגמה, אדנו-קרצינומה של הערמונית שאינה מובהקת, וקרצינומה של מערכת השתן כולל קרצינומה של שלפוחית השתן, עלולים להופיע באופן דומה בבחינה מיקרוסקופית, אך PAP ובדיקת PSA עשויים להבדיל ביניהם (Genega וחב' ב־Mod Pathol משנת 2000), כיוון שאדנו-קרצינומה של הערמונית נצבעת לרוב עם PSA ו/או PAP, בעוד שקרצינומה של מערכת השתן אינה נצבעת באופן דומה. בנוסף, PAP עשוי לשחק תפקיד חשוב בהעברה של HIV. חוקרים באוניברסיטת Ulm בגרמניה, מצאו ש-PAP יוצר סיבים העשויים מעמילואיד. הם מכנים סיבים אלה כ-semen-derived enhancer of virus infection (להלן SEVI), והראו שסיבים אלה יכולים לקשור ויריונים של HIV, ומסייעים לאחרונים להיקשר לתאי המטרה. הקשר בין PAP לבין HIV עלול להגביר את היכולת של הנגיף להדביק תאי אדם במספר סדרי גודל. PAP עשוי להיות מטרה במאמצים לדכא התפשטות של HIV (Münch וחב' ב-Cell משנת 2007).
דיכוי כאבים
מחקר באוניברסיטאות של צפון קרוליינה ושל הלסינקי, הציע ש-PAP עשוי להיות בעל השפעות אנטי-נוניספטיביות (כלומר השפעות הנגרמות על-ידי גירוי של קולטנים תחושתיים של כאב במערכת העצבים), בעל השפעות אנטי-היפראלגסיות (כלומר השפעות המפחיתות רגישות מוגברת לכאב), ובעל השפעות אנטי-אלודיניות (כלומר קולטני כאבים שנורים באופן ספונטני ללא שום טריגרים ידועים או קשיים בעיבוד אותות חוט השדרה שיכולים לגרום לכאבים עזים (אלודיניה) על ידי מגע קל לרוב ללא כאבים), דהיינו השפעות שנמשכות פרק זמן ארוך מזה של מורפין. מינון אחד של PAP נמשך עד שלושה ימים, בהשוואה להשפעה של 5 שעות בטיפול של מינון אחד של מורפין. במצבי עקה, תאי עצב משחררים ATP המפעיל תחושת כאב. ATP עובר פירוק ל-adenosine monophosphate (להלן AMP), PAP ממיר לאדנוזין, מולקולה המדכאת כאב (Zylka וחב' ב-Neuron משנת 2008).
תפקידים של PAP
סרטן הערמונית הוא אחד מסוגי הסרטן השכיחים ביותר, והוא השני ברשימת סוגי הסרטן הקטלניים בקרב גברים ברוב מדינות המערב, אם כי האטיולוגיה שלו לא זוהתה (Hsing ו-Chokkalingam ב-Front Biosci משנת 2006). אם סרטן זה מתגלה בשלב מוקדם - גדולים הסיכויים לריפוי מלא. Prostatic acid phosphatase או PAP הוא פוספו-מונואסטראז לא ספציפי המסונתז בתאי האפיתל של הערמונית, וריכוזו עולה ביחס ישר להתקדמות הממצא הסרטני. העניין ב-PAP התחדש בגלל השימושיות שלו בניבוי סרטן הערמונית משלב ביניים עד לסיכון גבוה, והצלחתו באימונו-תרפיה של סרטן זה. סמנים רבים של סרטן הערמונית זוהו ובהם PSA, prostate specific membrane antigen (להלן PSMA), PAP ו-prostate stem cell antigen (להלן PSCA), כאשר כל אלה מסייעים להגביר את הסיכוי לגילוי מוקדם של סרטן הערמונית (Truong וחב' ב-Hum Pathol משנת 1993, Gupta וחב' ב-Eur Urol משנת 2009, Hobisch וחב' ב-Cancer Res משנת 1998, Batta וחב' ב-Int J Cur Biomed Phar Res משנת 2012, Madu ו-Lu ב-J Cancer משנת 2010, ו-Bussemakers וחב' ב-Cancer Res משנת 1999).
פרט ל-PAP ו-PSA המהווים סמנים ביולוגיים מוכרים (Makarov וחב' ב-Ann Rev Med משנת 2009, ישנם עוד מועמדים אחדים כסמנים. בהם: α-Methylacyl coenzyme A racemase (AMACR) ,B7-H3 ,Caveolin-1 (Cav-1), כרומוגרנין, Endoglin (CD 105) ,Human kallikrein 2 ,Interleukin-6 ,Ki-67, סרקוזין, Transforming growth factor-β1 ו-Urokinase plasminogen activation.
בשנת 1938, או 85 שנה לאחר הזיהוי של PAP, התגלה שהפעילות של PAP גדלה בצירקולציה של אנשים עם סרטן גרורתי של הערמונית (Gutman ו-Gutman ב-J Clin invest משנת 1938). עלייה זו ברמת PAP הייתה בולטת במיוחד בחולים עם גרורות בעצמות (Small וחב' ב-J Clin Oncol משנת 2006, ו-Sheridan וחב' ב-Am J Surg Pathol משנת 2007). מאוחר יותר נמצא ש-PAP יכול לשמש ביוכימית כסמן להצלחת או כישלון הטיפול (Veeramani וחב' ב-Endocr Relat Cancer משנת 2005). בהקשר זה, מעודדים ממצאי קבוצה שוודית פיתחה מדד microRNA כממצא מוקדם לסרטן ערמונית עם התקדמות אגרסיבית (Larne וחב' ב־Int J Cancer משנת 2012). מאידך גיסא, ביו-סמנים חדשים, כגון human glandular kallikrein 2 (להלן hk2) (Becker וחב' ב-J Urol משנת 2000), urokinase plasminogen activator (להלן uPA) והקולטן שלו (להלן uPAR), transforming growth factor-beta 1 (להלן TGF-β1) (Truong וחב' ב-Hum Pathol משנת 1993), interleukin-6 והקולטן שלו (Hobisch וחב' משנת 1998) זוהו ועשויים לבוא במקום PSA לאבחון טוב יותר, לקביעת דרגת המחלה ולנטר את הצלחת הטיפול (Kraus וחב' ב-Diagn Pathol משנת 2010). PCA3 ו-T2:ERG הוצעו כביו-סמנים חדשים לסרטן הערמונית (Young וחב' ב-Am J Clin Pathol משנת 2012). PCA3 הוא RNA שאינו מקודד שמוצאים ברמות גבוהות בסרטן הערמונית בהשוואה לתאי ערמונית בריאים. T2:ERG הוא איחוי של הגן TMPRSS2 המווסת על ידי אנדרוגנים ועל ידי האונקוגן ERG. מצוי ב-50% ממקרי סרטן הערמונית, יש השערה שגן זה שעבר איחוי הוא בעל תפקיד בהתפתחות סרטן הערמונית.
PAP אנושי
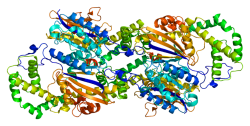
PAP אנושי הוא גליקופרוטאין מופרש בעל משקל מולקולרי של 100 קילו-דלטון המסונתז בתאי האפיתל של הבלוטה (Vihko וחב' ב-Clin Chem משנת 1978). האנזים הוא בעל פעילות פוספטאז בתנאים חומציים (pH 4-6) (Zelivianski וחב' ב-Biochem Biophys Res Commun משנת 1998). הפעילות האנזימטית של PAP מתרחשת כאשר PAP יוצר הומו-דימר המורכב משתי תת-יחידות שאינן פעילות קטליטית (50kDa) הקשורות על ידי קשרים לא-קוולנטיים (Kuciel וחב' ב-Biochem Int משנת 1990, ו-Lee וחב' ב-Biochem J משנת 1991). כל תת-יחידה מורכבת משני מקטעים. המקטע הגדול יותר מסוג α/β מורכב ממקטע מרכזי בעל 7 גְּדִילים מעורבים של beta sheet ו-α-helices בשני צדדיו, בעוד שהמקטע הקטן יותר מכיל 6 α-helices, והוא נוצר בעיקר על ידי חריגות של המקטע המרכזי (Ortlund וחב' ב-Biochemistry משנת 2003). קשרי המימן שבין תת-היחידות הם השרשרת הצדדית של Gln 33 הקשורוה ל-His 67, השרשרת הצדדית Gln 40 הקשורה לשרשרת של Val 97, והשרשרת הצדדית של His 112 הקשורה לשרשרת של Asp 76 (Jakob וחב' ב-Prostate משנת 2000). לאחר הקיטוע של 32 חומצות האמינו המהוות את הפפטיד הסיגנלי של PAP, אנזים זה הופך לבערך 41KDa שהיא הצורה הבשלה שלו. למונומר של PAP יש 6 שיירים משומרים של ציסטאין היוצרים שלושה קשרים די-סולפידים (Cys129-Cys340, Cys183-Cys281 ו־Cys315-Cys319), ביחד עם שלושה אתרים של N-linked glycosylation. סכריד עשיר ב-mannose נקשר לשיירים Asn61 ו-Asn301, בעוד ששייר Asn188 עובר סיאליזציה באופן חלקי. אתרי גליקוזילציה אלה משומרים בכל PAPs של היונקים. Ostanin מצא (Ostanin וחב' ב-J Biol Chem משנת 1994) ש-PAP אנושי הוא בעל הומולוגיה של 99% עם PAP של פנתרים, 94% הומולוגיה עם PAP של קופים, 91% הומולוגיה עם PAP של פרות, 81% הומולוגיה עם PAP של חולדות ו-80% הומולוגיה עם PAP של עכברים.
הפעולה העיקרית של PAP היא לגרום לדה-פוספורילציה של מאקרו-מולקולות בעזרת שיירים קטליטיים (His12 ו־Asp258) הממוקמים בשסע בין שני המקטעים. היסטידין (H257) ושיירי ארגינין בעמדות 11, 15, 54 ו-79, חשובים גם הם לפעילות PAP. המנגנון של הדה-פוספורילציה על ידי PAP, דומה לזה של fructose-2,6-bisphosphatase (Okar וחב' ב-Biochemistry משנת 200). שייר ה-His 12 פועל כנוקלאופיל ומתאחד עם המצע ליצירה של phosphohistidine כתוצר ביניים. בנקודה זו, לצורך המיחזור של האנזים בתהליך הדה-פוספורילציה, Asp258 מבצע הידרוליזה של phosphohistidine (Sharma ו-Juffer ב-Chem, commun משנת 2009). בין המצעים המזוהים נכללים AMP ,phosphotyrosine ,phosphocreatine ו-ErbB-2. כיוון ש-PAP הוא בעל פוטנציאל לפעול כ-protein tyrosine phosphatase, יכולים להיות מצעים אחרים שעדיין לא זוהו.
הביטוי הרקמתי של PAP
החלבון PAP נמצא בריכוז של בערך 0.5 מיליגרם/גרם משקל יבש של רקמת הערמונית (Goldfarb וחב' ב-J Urol משנת 1986), ובריכוז של בערך 1 מיליגרם/מ"ל בנוזל הזרע. הביטוי של PAP כרוך בהורמון טסטוסטרון. PAP יכול להימצא בכמויות גדולות באנשים עם סרטן הערמונית בדרגת Gleason גבוהה. כאשר משווים לרקמה אחרת, ה-mRNA של PAP גבוה פי-50 עד 5,000 ברקמת ערמונית בריאה, ופי-110 עד 6,000 גבוהה יותר ברקמת ערמונית סרטנית. PAP יכול להימצא ברקמות אחדות פרט לערמונית, כגון במוח, בכליות, בכבד, בריאות, בשלייה, בבלוטות הרוק, בטחול, בתירואיד ובטימוס. PAP נעדר מרקמת קרצינומה של השד, בניגוד לרמת שד בריאה שם PAP יכול להתגלות.
הוראות לביצוע הבדיקה
אין לצרוך מולטי-ויטמינים או תוספי מזון המכילים ביוטין (ויטמין B7), או תכשירים לשיער, לציפורניים או לעור 12 שעות לפני נטילת הדם, במבחנה כימית (פקק אדום). ניתן ליטול דם במבחנת ג'ל. את הנסיוב (נוזל עליון לאחר הסרכוז) יש להעביר למבחנת פלסטיק לצורך העברת הדגימה למעבדה. יציבות הדגימות: דגימה מקוררת (מועדפת) - 7 ימים; דגימה קפואה יציבה למשך 180 יום.
שיטת המדידה: בדיקה אוטומטית בשיטת Chemiluminescent Immunometric.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק