חסר חמור בפקטור Severe factor XI deficiency - XI
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| חסר חמור בפקטור XI | ||
|---|---|---|
| Severe factor XI deficiency | ||
| יוצר הערך | ד"ר אופירה סלומון
|
|
גורם קרישה XI נתגלה ב-1953 על ידי רוזנטל וחב'. בעבר נקרא חסר בגורם קרישה XI המופיליה C (Hemophilia C). רמת גורם קרישה XI נמוכה בדם גורמת לדימום לאחר חבלה או לאחר התערבות פולשנית, במיוחד באזורים פיברינוליטיים (Fibrinolytic). אולם, רמה גבוהה גורמת לעלייה בשכיחות אירועי הפקקת הן במערכת הוורידית והן במערכת העורקית. ייתכן שלחסר חמור בגורם קרישה XI יש יתרון אבולוציוני (Evolutionary) לנוכח ירידה בשכיחות אירועים מוחיים איסכמיים ופקקת ורידים עמוקה. הבנה של תפקוד גורם קרישה XI כמייצב הקריש וכמונע את פירוקו הביאה למחקרים קליניים העוסקים בפיתוח נוגדנים לגורם קרישה XI, באירועים שבהם קיימים סיכונים לאירועי פקקת ותסחיף. פותח נוגדן, שמטרתו לנטרל את גורם קרישה XI ובכך למנוע המשך יצירת הקריש, מבלי שייגרם דימום. עד כה תכשיר זה ניתן לחיות מעבדה בלבד.
אפידמיולוגיה
בישראל שכיחות חסר מלא בפקטור XI בקרב יהודים אשכנזים היא 1:400 ושכיחות לנשאים 1:10. השכיחות בעולם לחסר מלא היא 1:1,000,000.
אטיולוגיה
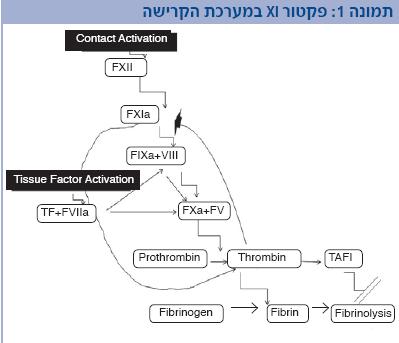
פקטור XI הוא מרכיב חשוב בהמשך יצירת הקריש ויציבותו. פקטור XI משופעל על ידי תרומבין, שהוא האנזים הגורם להפיכת פיברינוגן לפיברין. בהמשך, התרומבין ממשיך להיות משופעל גם על ידי פקטור XI משופעל ולאחר התהוות קריש ראשוני על ידי Factor FVIIa & Tissue Factor בנוכחות פקטור V ופקטור X פעיל (במערכת Extrinsic Pathway), או על ידי פקטור VIII ופקטור IX בנוכחות פקטור V ופקטור X פעיל (במערכת Intrinsic Pathway) (תמונה 1). יציבות הקריש מיוחסת באופן בלתי ישיר לפקטור XI ונובעת מעלייה בפעילות (Tissue Activatable Fibrinolysis Inhibitor) TAFI (בשל המשך ייצור התרומבין, המונע קישור הפלזמינוגן לפברין והפיכתו לפלזמין, ומכאן ירידה בפיברינוליזיס). הגן לפקטור XI נמצא בכרומוזום 4, מיוצר בכבד כפרואנזים ומחצית חייו כ-52 שעות (2,1).
פקטור XI נתגלה ב-1953 על ידי רוזנטל וחב'. בעבר נקרא חסר בפקטור XI המופליה C, אולם בשונה מהמופיליה A (חסר בגורם קרישה VIII) או המופיליה B (חסר בגורם קרישה IX), מועבר חסר פקטור XI כ-Autosomal Recessive Trait. מסיבה זאת, זכרים ונקבות חולים במידה שווה. כמו כן, בשונה מההמופיליה הקלאסית (A ו-B) החולים אינם מדממים ספונטנית אלא לאחר טראומה או לאחר פרוצדורה כירורגית, ובעיקר בפרוצדורות המערבות אזורים פיברינוליטיים (לאחר כריתת שקדים, עקירת שן וניתוחים במערכת השתן) (3).
בדרך כלל חסר בפקטור XI הוא תורשתי, ועד כה תוארו 180 מוטציות בגן לפקטור XI([1]). ייתכן חסר נרכש בפקטור XI הנגרם על ידי התפתחות נוגדן המנטרל את פעילות הפקטור. תוארו חולים שפיתחו נוגדנים לפקטור XI בעקבות מחלת זאבת ובסרטן. ניתן לחשוד בקיומם של נוגדנים כאשר מיהול עם פלזמה רגילה לא יתקן את רמת הפקטור (1). כיום זוהו כ-180 מוטציות בעולם, מתוכן 5 מוטציות נמצאו כ"אב קדמון" (Founder Effect) באוכלוסיות, שתיים מהן בקרב היהודים. במצב הומוזיגוטי במוטציה Glu117stop המכונה Type II, לא ייווצר חלבון, ולכן רמת פקטור XI לא ניתנת למדידה. המוטציה נמצאת בקרב יהודים ממקור אשכנזי ובשכיחות קטנה יותר ביהודים ממקור עיראקי וכן בשכיחות נמוכה יותר גם בקרב פלסטינאים. המוטציה השנייה השכיחה היא וPhe283Leu המכונה Type III. במוטציה זאת במצב הומוזיגוטי נוצר חלבון לא פעיל, והפרשתו לפלזמה נמוכה. רמת פקטור XI במצב זה הוא בממוצע 10%. מוטציה זו זוהתה רק ביהודים ממקור אשכנזי. במצב של Compound Heterozygote (Type II/III) רמת פקטור XI בדם בממוצע היא כ-3%-2%(6). בישראל קיימות מוטציות נוספות בשיעור של כ-3% מבין חסרי פקטור XI. המוטציה הבולטת היא Type I. שתי מוטציות "אב קדמון" (Founder Effect) אותרו בצרפתים ממקור בסקי - Cys38Arg, מננט - Gln88stop ומבריטניה - Cys128stop(1).
קליניקה
בקרב אוכלוסייה עם חסר חמור בפקטור XI נמצא, לאחרונה, שיש ירידה בשכיחות תחלואה בשבץ מוחי איסכמי (7) וירידה בשכיחות לפקקת ורידים עמוקה (8). אולם, נמצא כי אוכלוסייה זו אינה מוגנת בפני אוטם שריר הלב (9). אחד ההסברים לכך הוא השינוי בכלי דם ברקמות שונות (Vascular Beds)(10). לנוכח האמור לעיל, לא מפתיע איפה שחסר קשה ברמת הפקטור יקנה יתרון אבולוציוני.
בעכברי Knock-Out to FXI במודל Ferric Chloride לפקקת בווריד הנבוב התחתון נמצאה עמידות להתפתחות פקקת לעומת עכברים רגילים(11). תופעה דומה נראתה גם במודל עורקי(12). בארנבות האיצה הזרקת נוגדן Antisense לפקטור XI פירוק קריש בווריד הג'וגולרי(13).
אבחנה
חשד לחסר בפקטור XI מתגלה כיום לאחר שנמצאת הארכה ב-Activated Partial Thromboplastin Time) aPTT). הארכה גבולית חשודה לחסר חלקי, אולם הארכה משמעותית מצביעה על חסר מלא. יש לוודא שאכן מדובר בחסר בפקטור XI ולא בחסרים אחרים, כחסר בפקטור VIII, פקטור IX, vWD או פקטור XII שגורמים גם הם להארכה ב-aPTT. כיום, רוב החולים עם חסר בפקטור XI מתגלים לאחר שנמצאה הארכה ב-aPTT בבדיקת דם, המתבצעת לפני התערבות כירורגית. בעבר, הסיבה השכיחה לאבחון חסר בפקטור XI נבעה מדימומים בעת פרוצדורה כירורגית או אחריה, כמו גם לאחר עקירת שן.
אנו מגדירים חסר חמור בפקטור XI כרמת פעילות של הפקטור בפלזמה לא גבוהה מ-15%. מבחינת שכיחות הדמם, אין הבדלים בשכיחות זאת, אם מדובר ברמת פעילות בפלזמה של 1% ואם מדובר ב-15% (3).
חולים עם רמת פקטור XI >1% עלולים לפתח נוגדנים נגד הפקטור לאחר טיפול בפלזמה, לאחר קבלת תרכיז פקטור ) XI4) או לאחר חשיפה ל-Anti D immunoglobulin (5).
טיפול
כיום, הטיפול בחולים עם חסר מלא בפקטור XI ניתן לפני התערבות ניתוחית. הטיפול בפלזמה ניתן לחולים ללא נוגדן או בעלי חסר ב-IgA חמור (אם אין פלזמה חסרת IgA) או תרכיז בפקטור XI (טרם אושר על ידי ה-FDA). יש לציין, שאומנם טיפול בתרכיז בטוח יותר מבחינת זיהומים, אולם קיימת עלייה בהישנות האירועים התרומבואמבוליים עם השימוש בו, ולכן התכשיר לא ניתן בישראל. בחולים עם נוגדן לפקטור XI ניתן לתת rFVIIa (Recombinant Factor VIIa) במינונים נמוכים ביותר ושונים מאוד מהמינון הנהוג לתת בחולים עם המופיליה קלאסית (14) מאחר שאירועים תרומבואמבוליים נצפו בחולים עם חסר מלא בפקטור XI בעת מתן מינונים גבוהים של rFVIIa. ואכן, ההסבר לתופעה זו מבוסס על מודל in vitro של Thrombin Generation המראה שבחולים הלוקים בחסר פקטור XI רמות נמוכות של rFVIIa ינרמלו Thrombin Generation בהשוואה להיעדר תגובה במינון זהה בחולי המופיליה קלאסית (15).
מאחר ש-rFVIIa מפעיל את התרומבין בדרך ה-Extrinsic Pathway, כלומר מבצע by Pass על Intrinsic Pathway, בעתיד ועם הכנסת rFVIIa גנרי ייתכן שהתוויה לשימוש ב-rFVIIa תינתן לכל החולים עם חסר קשה בפקטור XI גם ללא נוגדנים, ובכך ניתן יהיה למנוע אירועי Transfusion Lung Injury) TRALI), זיהומים, Volume Overload ואלרגיות למוצרי דם.
באשר לחולים עם חסר חלקי בפקטור XI, בדרך כלל חולים אלו אינם מדממים, ולעתים קשה לאבחן אותם, מאחר שה-aPTT יכול להיות בטווח התקין. תיתכן שכיחות לדמם אם יש לחולים אלה הפרעה המוסטטית נוספת. לכן, מומלץ לבצע הערכה המוסטטית מלאה חד-פעמית בחולים עם חסר חלקי בפקטור הזקוקים לניתוח. כיום, מומלץ לבדוק רמת von Willebrand Factor, תפקודי טסיות ורמת פיברינוגן.
בחולים עם רמות גבוהות של פקטור XI נמצא סיכון כפול לפתח פקקת ורידית (16), אולם בספרות הדעות חלוקות לגבי קשר בין רמות גבוהות של הפקטור לאוטם שריר הלב. כמו כן, נמצא קשר בין רמות גבוהות של פקטור XI לאירוע מוחי (17).
חשוב לציין, שלאחרונה נמצאו רמות גבוהות של פקטור XI פעיל באחד מתכשירי האימונוגלובולינים (Omrigam) שהורדו מהמדף. כידוע, רמות גבוהות של FXIa מגבירות את יצירת התרומבין באופן משמעותי, וייתכן שזו הסיבה לעלייה בשכיחות האירועים התרומבואמבוליים.
כיום, נמצא בפיתוח הנוגדן נגד פקטור XI מסוג Antisense שעד כה נוסה בחיות מעבדה (18) ומנע אירועים תרומבוטיים. כמו כן, התכשיר אף האיץ פירוק של קריש לאחר שניתן, לאחר שנוצר קריש ראשוני, הן במערכת הוורידית והן במערכת העורקית, ללא התגברות הדמם.
פרוגנוזה
דגלים אדומים
ביבליוגרפיה
- Duga S, Salomon O. Factor XI Deficiency. Semin Thromb Hemost 2009;35(4):416-425
- von dem Borne PA, Meijers JC, Bouma BN. Feedback activation of factor XI by thrombin in plasma results in additional formation of thrombin that protects fibrin clots from fibrinolysis. Blood 1995;86:3035-3042
- Salomon O, Steinberg DM, Seligshon U. Variable bleeding manifestations characterize different types of surgery in patients with severe factor XI deficiency enabling parsimonious use of replacement therapy. Haemophilia 2006;12:490-493
- Salomon O, Zivelin A, Livnat T, et al. Prevalence, causes, and characterization of factor XI inhibitors in patients with inherited factor XI deficiency. Blood 2003;101:4783-4788
- Zucker M, Zivelin A, Teitel J, et al. Induction of an inhibitor antibody to factor XI in a patient with severe inherited factor XI deficiency by Rh immune globulin. Blood 2008;111:1306-1308
- Asakai R, Chung DW, Ratnoff OD, et al. Factor XI (plasma thromboplastin antecedent) deficiency in Ashkenazi Jews is a bleeding disorder that can result from three types of point mutations. Proc Natl Acad Sci USA 1989;86:7667-7667
- Salomon O, Steinberg DM, Koren-Morag N, et al. Reduced incidence of ischemic stroke in patients with severe factor XI deficiency.Blood. 2008;111:4113-7.
- Salomon O, Steinberg DM, Zucker M, et al. Patients with severe factor XI deficiency have a reduced incidence of deep-vein thrombosis. Thromb Haemost 2010 in press
- Salomon O, Steinberg DM, Dardik R, et al. Inherited factor XI deficiency confers no protection against acute myocardial infarction. J Thromb Haemost 2003;1:658-661
- Rosenberg RD, Aird WC. Vascular-bed--specific hemostasis and hypercoagulable states. NEJM 1999;340:1555-1564
- Wang X, Smith PL, Hsu MY, et al. Effects of factor XI deficiency on ferric chloride-induced vena cava thrombosis in mice. J Thromb Haemost 2006;4:1982-1988
- Minnema MC, Friederich PW, Levi M, et al. Enhancement of rabbit jugular vein thrombolysis by neutralization of factor XI. In vivo evidence for a role of factor XI as an anti-fibrinolytic factor. J Clin Invest 1998;101:10-14
- Wang X, Cheng Q, Xu L, et al. Effects of factor IX or factor XI deficiency on ferric chloride-induced carotid artery occlusion in mice. J Thromb Haemost 2005;3:695-702
- Livnat T, Tamarin I, Mor Y, et al. Recombinant activated factor VII and tranexamic acid are haemostatically effective during major surgery in factor XI-deficient patients with inhibitor antibodies. Thromb Haemost 2009;102:487-492
- Livnat T, Zivelin A, Martinowitz U, et al. Prerequisites for recombinant factor VIIa-induced thrombin generation in plasmas deficient in factors VIII, IX or XI. J Thromb Haemost 2006;4:192-200
- Meijers JC, Tekelenburg WL, Bouma BN, et al. High levels of coagulation factor XI as a risk factor for venous thrombosis. NEJM 2000;342:696-701
- Yang DT, Flanders MM, Kim H, et al. Elevated factor XI activity levels are associated with an increased odds ratio for cerebrovascular events. Am J Clin Pathol 2006;126:411-415
- Zhang H, Löwenberg EC, Crosby JR, et al. Inhibition of the intrinsic coagulation pathway factor XI by antisense oligonucleotides: a novel antithrombotic strategy with lowered bleeding risk. Blood 2010;In press
קישורים חיצוניים
- חסר חמור בפקטור XI: האם הוא יתרון אבולוציוני?, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר אופירה סלומון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק