טיפול בזיהום כרוני בנגיף דלקת כבד C - קווים מנחים
|
| |
|---|---|
| קווים מנחים לטיפול בזיהום כרוני בנגיף דלקת כבד C 2012 | |
| תחום | זיהומיות, גסטרואנטרולוגיה |
| תאריך פרסום | דצמבר 2012 |
| יוצר הערך | החברה הישראלית לחקר הכבד |
| ניירות עמדה מתפרסמים ככלי עזר לרופא/ה ואינם באים במקום שיקול דעתו/ה בכל מצב נתון. כל הכתוב בלשון זכר מתייחס לשני המגדרים. | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – הפטיטיס
הכותבים
- אלי צוקרמן - היחידה למחלות כבד, מרכז רפואי כרמל ומחוז חיפה וגליל מערבי, שירותי בריאות כללית, הפקולטה לרפואה רפפורט, הטכניון, חיפה
- ריפעת ספדי - היחידה למחלות כבד, בית חולים הדסה עין כרם, והפקולטה לרפואה של האוניברסיטה העברית, ירושלים
- רן אורן - המכון לגסטרואנטרולוגיה ומחלות כבד, בית חולים הדסה עין כרם, והפקולטה לרפואה של האוניברסיטה העברית, ירושלים
- אורן שבולת - היחידה למחלות כבד, מרכז רפואי סוראסקי והפקולטה לרפואה סאקלר, אוניברסיטת תל אביב, רמת אביב
- יעקב ברוך - יחידת הכבד, רמב"ם, הקריה הרפואית לבריאות האדם והפקולטה לרפואה רפפורט, הטכניון, חיפה
- רפאל ברוק- היחידה למחלות כבד, מרכז רפואי סוראסקי והפקולטה לרפואה סאקלר, אוניברסיטת תל אביב, רמת אביב
- יואב לוריה - היחידה למחלות כבד, בית חולים שערי צדק, ירושלים
- רן טור־כספא - המכון למחלות כבד, מרכז רפואי רבין, קמפוס בילינסון, פתח תקווה והפקולטה לרפואה סאקלר, אוניברסיטת תל אביב, רמת אביב
- סייף אבו מוך - היחידה למחלות כבד, בית חולים הלל יפה, חדרה
- דני שובל - היחידה למחלות כבד, בית חולים הדסה עין כרם, והפקולטה לרפואה של האוניברסיטה העברית, ירושלים
- זיו בן ארי - יו"ר החברה הישראלית לחקר הכבד, המכון למחלות כבד, מרכז רפואי שיבא, תל השומר והפקולטה לרפואה סאקלר, אוניברסיטת תל אביב, רמת אביב
תקציר
הטיפול המקובל כנגד זיהום כרוני בנגיף דלקת כבד C, Standard Of Care therapy (SOC), כולל טיפול ב-Pegylated interferon alphas (pegIFNa-2a/2b) וב-Ribavirin (RBV) למשך 24–48 שבועות, בהתאם לגנוטיפ הנגיפי. טיפול זה כרוך בהשפעות לוואי ומוביל להשגת SVR) Sustained Virologic Response) רק ב־50-40 אחוזים מהמטופלים עם גנוטיפ 1. פיתוח תרופות נוגדות נגיפים (אנטי-ויראליות) הפועלות ישירות נגד אתרים החיוניים למעגל החיים של נגיף הפטיטיס C, ה-Direct Acting Antiviral agents (DAAs) הוביל לפריצת דרך בטיפול בזיהום הכרוני בנגיף. DAAs מסווגים לשתי קבוצות עיקריות: מעכבי פולימרזות ומעכבי פרוטיאזות. תוצאות מחקרים קליניים מעידות על כך שטיפול בתרופות החדשות מקבוצת מעכבי הפרוטיאזות (Telaprevir, Boceprevir) במישלב עם SOC במטופלים עם גנוטיפ 1, הוביל לשיפור משמעותי בשיעור השגת SVR בקרב מטופלים שטופלו לראשונה ("נאיביים") (70 אחוזים) ובמטופלים "מנוסים". הטיפול במעכבי הפרוטיאזה מאפשר קיצור של משך הטיפול בקבוצות מטופלים מסוימות. על פי הנחיות משרד הבריאות בישראל, המישלב בין Telaprevir (Incivo) או Victrelis) Boceprevir) לבין pegIFNa-2a/2b וריבווירין הוא היום סטנדרט הטיפול החדש בזיהום כרוני בנגיף דלקת כבד C, גנוטיפ 1. מוצגים בזאת המלצות ועדה מקצועית מטעם החברה הישראלית לטיפול הסטנדרטי החדש בזיהום כרוני בנגיף דלקת כבד C (הפטיטיס C), גנוטיפ 1.
הקדמה
הטיפול המקובל לזיהום כרוני בנגיף דלקת כבד C, Standard Of Care therapy (SOC), כולל טיפול ב-Pegylated interferon alphas (pegIFNa-2a pegIFNa-2b) וב-Ribavirins (RBV) למשך 24–48 שבועות, בהתאם לגנוטיפ הנגיפי. טיפול זה כרוך בהשפעות לוואי ומוביל להשגת SVR) Sustained Virologic Response) רק ב־50-40 אחוזים מהמטופלים עם גנוטיפ 1. פיתוח תרופות נוגדות נגיפים הפועלות ישירות נגד אתרים החיוניים למעגל החיים של נגיף דלקת כבד C, ה-DAAs) Direct Acting Antiviral agents), הוביל לפריצת דרך משמעותית בטיפול בזיהום הכרוני בנגיף.
DAAS מסווגים לשתי קבוצות עיקריות: מעכבי פולימרזות ומעכבי פרוטיאזות. תוצאות מחקרים קליניים מעידות על כך, שטיפול במטופלים עם גנוטיפ 1 בתרופות החדשות מקבוצת מעכבי הפרוטיאזות במישלב עם SOCT, הוביל לשיפור משמעותי בשיעור השגת SVR בקרב מטופלים שטופלו לראשונה ("נאיביים"), בקרב מטופלים שלא הצליחו להשיג אצלם SVR בטיפול קודם ("מנוסים") ובקרב מטופלים חולי צמקת הכבד הנחשבים "קשים" לטיפול. הטיפול במעכבי הפרוטיאזה גם מאפשר קיצור של משך הטיפול בקבוצות מטופלים מסוימות. הטיפול במעכבי הפרוטיאזה כרוך בהתפתחות השפעות לוואי נוספות, בפרוטוקול טיפול מורכב, בתגובות בין־ תרופתיות, בהתמודדות עם ההיענות של המטופל ובהופעת עמידות לתרופות החדשות. כמו כן יש להקפיד על ניטור מדוקדק של הטיפול.
מושגים והגדרות
- (Rapid Virological Response) RVR: HCV RNA לא מדיד (שלילי) בשבוע 4 לטיפול (**HCV RNA > 10-15 IU*/ml)
- (Early Virological Response) EVR : ירידה של יותר מ-2log10 ב־HCV RNA בשבוע 12 לטיפול
- (Sustained Virological Response) SVR: HCV RNA לא מדיד בשבוע 24 לאחר סיום הטיפול (החלמה)
- Partial response: ירידה של יותר מ-2log10 ב-HCV RNA בשבוע 12, אך בדיקת PCR (Polymerase Chain Reaction) חיובית בשבוע 24. (הערה: בחלק מהמטופלים בדיקת HCV RNA איכותית ולא כמותית. אם ה-PCR חיובי בשבוע 24 ייחשבו כ-Null responders)
- Null response: ירידה ב-HCV RNA של פחות מ־2log10 בשבוע 12 לטיפול
- Relapse: HCV RNA לא מדיד בסיום הטיפול, אך בדיקת PCR הייתה חיובית במהלך 24 השבועות מתום הטיפול
- Breakthrough: עלייה ברמת HCV RNA תוך כדי טיפול > מ-1log10 יחסית לרמה הנמוכה ביותר שנמדדה בטיפול
- Treatment-naive patients: מטופלים "נאיביים" לטיפול - לא טופלו בעבר
- Treatment-experienced patients: מטופלים "מנוסים" בטיפול - קיבלו טיפול בעבר ולא הצליחו להשיג SVR. קבוצה זאת כוללת את ה-Non responders (Partial או Null) ואת ה-Relapsers
- (Response-Guided Therapy (RGT: טיפול מונחה תגובה - התאמת משך הטיפול לקצב ולמהירות התגובה הווירולוגית באופן אישי
- (Extended RVR (eRVR: תגובה וירולוגית מהירה מורחבת - מתייחס לטיפול משולב במעכבי הפרוטיאזות. הגדרתו משתנה בהתאם לתרופה: HCV RNA לא מדיד (< IU/ml 10-15) בשבוע 4–12 לטיפול משולב עם Telaprevir או בשבוע 8–24 לטיפול משולב עם Boceprevir
- Lead in: מתייחס לטיפול ב-Boceprevir בלבד. ב־4 השבועות הראשונים של הטיפול המשולב, ניתן טיפול ב-pegiFNα ו-RBV בלבד
*IU - International Units
**ml - Mililiter
התרופות נוגדות הנגיפים הישירות - IDAAs
ה-NS3/4A serine protease הוא חלבון רב־תכליתי, החיוני לעיבוד ולחיתוך רב־החלבון הנגיפי באזור NS3-NS5, והוא מאפשר יצירת חלבונים שונים המשתתפים בשכפול הנגיף[1]. על כן עיכוב הפרוטיאזה NS3/4A מעכב את שכפול הנגיף. שתי התרופות הראשונות מקבוצת ה-DAAS השייכות לקבוצת מעכבי הפרוטיאזה NS3/4A Ns3-serine protease inhibitors: (Incivo) (TVR) Telaprevir ו-(BOC) Boceprevir (Victrelis) אושרו לטיפול על ידי ה-FDA (Food and Drug Administration) האמריקאי וה-EMA (European Medicines Agency) במאי וביוני 2011, בהתאמה, והן נכללות בטיפול כקו ראשון לזיהום כרוני ב-HCV גנוטיפ 1. מינואר 2012 התרופות נכללות בסל הבריאות בישראל לטיפול ב-HCV גנוטיפ 1 בהוריות (התוויות) מסוימות שתפורטנה בהמשך.
שתי התרופות נבדלות באופן הטיפול, בניטור הדרוש ובהשפעות הלוואי. טיפול חד תרופתי (מונו־תרפי) בתרופות אלו מוביל לברירה (Selection) מהירה של מוטנטים עמידים במהלך הימים הראשונים לטיפול. הטיפול ב-pegiFNα וב-RBV חיוני כ-Back-bone לטיפול נוגד הנגיפים המשולב[2][3][4].
בהתבסס על נתונים אלו ניתן לקבוע, כי המישלב בין TVR או BOC לבין 2a/2b-pegiFNα + weightbased RBV הוא היום סטנדרט הטיפול החדש בזיהום כרוני בנגיף דלקת כבד C, גנוטיפ 1.
מטופלים "נאיביים" לטיפול - Treatment-naive subjects
Incivo) (TVR) Telaprevir) - תוצאות מחקרים שלב III: במחקרים אלו השוו החוקרים בין טיפול משולש של TVR/PEG/RBV במשך 8–12 שבועות ואחריו SOC לעוד 36 שבועות, לבין טיפול ב-SOC בלבד בקבוצת הבקרה. בזרועות הטיפול המשולש ל־8 ו־12 שבועות (T8PR ו- T12PR), שיעור השגת ה-SVR היה גבוה משמעותית לעומת מטופלים שקיבלו SOC בלבד: 69 אחוזים ו־75 אחוזים, בהתאמה, לעומת 44 אחוזים[5]. קיצור משך הטיפול מ־48 ל־24 שבועות במטופלים שהשיגו eRVR, לא פגם בהשגת SVR - 92 אחוזים לעומת 88 אחוזים, בהתאמה[6]. שיעור המטופלים שהשיג eRVR הגיע ל־57 אחוזים. בקרב מטופלים עם צמקת כבד המוגדרים "קשים" לטיפול, 62 אחוזים השיגו SVR בעזרת הטיפול המשולש בהשוואה ל־38 אחוזים בקבוצה הבקרה.
Victrelis) (BOC) Boceprevir) - הטיפול ב-BOC כולל בשלב טיפול ראשון SOC למשך 4 שבועות (Lead-in) ואחריו טיפול משולש ב-BOC/PEG/RBV[7]. מתוצאות מחקרים שלג III: שיעור ה-SVR היה 66 אחוזים בזרוע הטיפולית המשולשת, 63 אחוזים בזרוע ה-RGT במטופלים שהשיגו eRVR ו־37 אחוזים בקבוצת הבקרה. שיעור המטופלים שהשיג eRVR הגיע ל־55 אחוזים. בקרב מטופלים הלוקים בצמקת הכבד, שיעור המטופלים שהשיגו SVR בעזרת הטיפול המשולש היה 52 אחוזים בהשוואה ל־38 אחוזים בקבוצה שטופלה ב-SOC בלבד. בשתי התרופות (BOC או TVR), קיצור משך הטיפול על פי RGT במטופלים עם צמקת הכבד פגם ביכולת להשיג SVR ואין לקצר את משך הטיפול אצלם[5][7][8].
מטופלים "מנוסים" בטיפול - Treatment-experienced subjects
תוצאות טיפול נשנה ב-SOC למטופלים אלה היו מאכזבות: שיעור השגת SVR בקרב Relapsers היה נמוך מ־30 אחוזים ובקרב Null-responders עמד על כ־6 אחוזים בלבד[9].
Incivo) (TVR) Telaprevir) - במחקר הוכללו 663 מטופלים "מנוסים"[10] (Relapsers, Partial responders, Null responders). משך הטיפול היה 48 שבועות. שיעור ה-SVR היה 66-64 אחוזים לעומת 17 אחוזים בקבוצת הבקרה. שיעור השגת SVR היה גבוה מאוד בקבוצת Relapsers ועמד על 88-83 אחוזים לעומת 24 אחוזים בקבוצת הבקרה. בקבוצת SVR ה- Partial responders היה 59-54 אחוזים לעומת 15 אחוזים בקבוצת הבקרה, ובקבוצת Null responded שיעורו היה 29–33 אחוזים לעומת 5 אחוזים בקבוצת הבקרה. בקבוצת Relapsers שהשיגו eRVR, אפשר לקצר את משך הטיפול מ־48 ל־24 שבועות בלבד, ועדיין להשיג שיעור דומה של SVR. בקבוצת Null responders וה-Partial responders אין לקצר את משך הטיפול.
HCV RNA (extended Rapid Virological Response) eRVR בלתי מדיד (< IU/ml 15-10) בשבוע 4 ו-12 לטיפול ב-Telaprevir (lncivo) או בשבוע 8–12 לטיפול ב-Victrelis (Boceprevir).
Incivo: בחולים "נאיביים" או Relapsers ללא צמקת שהשיגו eRVR משך הטיפול 24 שבועות בסך הכל.
Victrelis: בחולים "נאיביים" ללא צמקת שהשיגו eRVR משך הטיפול 28 שבועות בסך הכל. בחולים "מנוסים" (Relapsers או Partial responders בלבד) ללא צמקת שהשיגו eRVR משך הטיפול 36 שבועות בסך הכל.
Pegylated interferon-alpha=PR ו-Ribavirin.
HCV RNA (extended rapid virological response) eRVR בלתי מדיד (< IU/ml 15-10) בשבוע 4 ו־12 לטיפול.
Ribavirin =PR ו-pegylated interferon-α
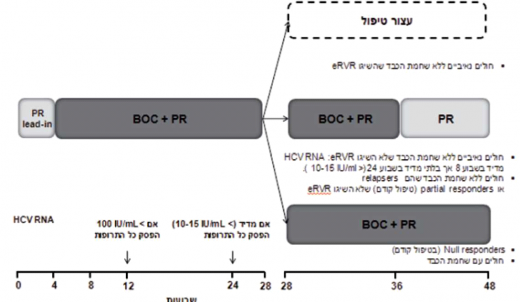
Victrelis) (BOC) Boceprevir) - במחקר הוכללו 403 מטופלים עם גנוטיפ 1 שלא השיגו SVR בטיפול קודם[11]. השילוב של BOC בטיפול הוביל לשיפור ניכר בהשגת SVR: 75-69 אחוזים בקבוצת ה-Relapsers לעומת 29 אחוזים בקבוצת הבקרה, 52-40 אחוזים בקבוצת Partial responders לעומת 7 אחוזים בקבוצת הבקרה, ו־38 אחוזים בקבוצת Null responders. בקבוצת Relapsers וה-Partial responders שהשיגו eRVR ניתן היה לקצר את משך הטיפול מ־48 ל־24 שבועות ולהשיג את אותם שיעורי SVR. Null responders מומלץ לא לקצר את משך זמן הטיפול.
לסיכום, שילוב מעכבי הפרוטיאזה עם SOC לטיפול בזיהום כרוני ב-HCV גנוטיפ 1 הוביל לשיפור משמעותי בהשגת SVR בקרב מטופלים "נאיביים" בשיעור של 30 אחוזים (לעומת ה-SOC) ולשיפור בשיעור של 24–64 אחוזים בקבוצת ה"מנוסים".
היענות לטיפול והשפעות לוואי: השפעות הלוואי השכיחות בטיפול ב-TVR הן גרד בקרב 45–50 אחוזים מהמטופלים (לעומת 36 אחוזים בקבוצת הבקרה), תפרחת בקרב 56 אחוזים (לעומת 32 אחוזים), בחילה ב־43-40 אחוזים (לעומת 31 אחוזים) ואנמיה ב־39-37 אחוזים (לעומת 19 אחוזים). רק ב־4 אחוזים הייתה התפרחת חמורה[8][9][10][11]. תופעות של Steven-Johnson או Drug Related Eruption With Systemic Symptoms) DRESS) נדירות (פחות מ-1 אחוזים) וחייבו הפסקה מיידית של הטיפול.
השפעות הלוואי בעקבות טיפול ב-BOC: אנמיה ב־49 אחוזים מהמטופלים (לעומת 29 אחוזים בקבוצת הבקרה) והפרעות בחוש הטעם (Dysgeusia) ב־37-43 אחוזים (לעומת 18 אחוזים)[8]. נוסף לכך, היה צורך להפסיק את הטיפול ל־13-12 אחוזים מכלל המטופלים שיעור שהיה דומה לטיפול עם SOCT.
עמידות למעכבי פרוטיאזה - Resistance to protease inhibitors
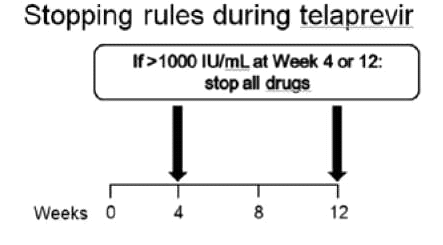
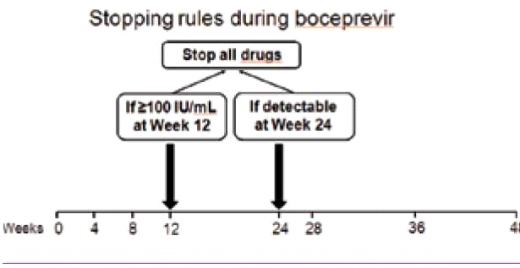
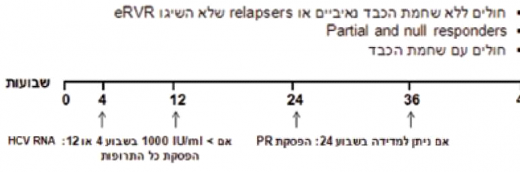
קצב השכפול המהיר של HCV מוביל למוטציה, הגורמת לשינוי מרחבי באתרי הקישור של Ns3-serine proteased למעכבי הפרוטיאזה, מפחיתה את יעילות TVR ו-BOC[12][13], וגורמת ל-Virologic breakthrough ולכישלון של הטיפול, כפי שנצפה ב־10-5 אחוזים מהמטופלים[5]. על מנת למנוע או למזער את בעיית העמידות נקבעו נקודות ציון להפסקה מוקדמת של הטיפול אם התגובה הווירולוגית אינה מספקת ("Stopping rules") (תרשים 1).
תגובה בין-תרופתית: שתי התרופות עוברות חילוף חומרים (מטבוליזם) במערכת הציטוכרום P450 CYP3A4[14][15], יש לבדוק לגבי כל תרופה שמטפלים בה אם דווח על תגובה בין־תרופתית בינה לבין אחת משתי התרופות BOC או TVR. המידע בנושא זה נמצא בעלון רישום התרופות וכן באתר האינטרנט: אתר FDA.
גורמים המשפיעים על השגת תגובה וירולוגית ממושכת (SVR): הגורמים הקשורים בהשגת SVR: גיל צעיר (< 40 שנה), מדד מסת גוף (30 > Body mass index), היעדר לייפת משמעותית, היעדר השמנת כבד ועמידות לאינסולין, מטופלים שאינם שייכים לגזע השחור, גנוטיפ שאינו 1 ועומס נגיפי בסיסי נמוך[16]. בנוסף, פולימורפיזם של נוקליאוטיד יחיד בגן המקדד Interleukin IL28B) 28B) מנבא תגובה לטיפול[17]. מסתבר, כי תגובה וירולוגית מהירה בשבוע 4 (RVR) מהווה גורם מפתח בחיזוי השגת SVR וחשובה אף יותר מהגורמים הבסיסיים לפני טיפול[16].
HCV RNA - (extended rapid virological response) eRVR בלתי מדיד (< IU/ml 100) בשבוע 8 ו־24 לטיפול.
Ribavirin =PR ו-Pegylated interferons
BOC = Boceprevir.
הערה: בחולים "מנוסים" שהשיגו eRVR (כלומר "Early responders"), הטיפול המשולש הכולל PR + Victrelis יימשך עד שבוע 36 בלבד בתנאי שאינם Null responders לטיפול קודם.
הנחיות לטיפול
- על פי החלטת ועדת סל הבריאות: טיפול משולב ב-Pegylated Ribavirin ,Interferon-a-2a/2b ומעכב פרוטיאזה, [Boceprevir Victrelis או Telaprevir) Incivo)], יינתן למטופלים הבאים הלוקים בזיהום כרוני בנגיף דלקת כבד C, גנוטיפ 1:
- "נאיביים" עם לייפת הכבד בדרגה F2-4
- "מנוסים" שנכשלו בהשגת SVR בטיפול סטנדרטי קודם ב-peg-IFNa וב-RBV, כולל טיפול נשנה. קבוצת מטופלים אלו כוללת Partial or null Non-responders) responders) ו-Relapsers בכל דרגת לייפת הכבד
- התרופות Victrelis או Incivo יינתנו במישלב עם peg-iFNa-2a/2b ו-RBV על פי משקל גוף (15 מיליגרם/קילוגרם) ולא כטיפול יחידני
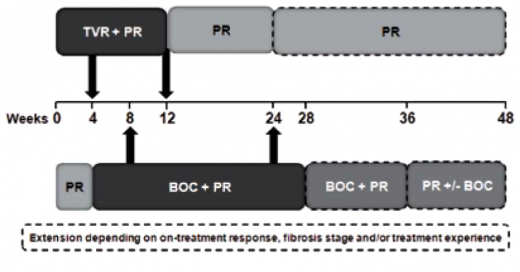
- אופן הטיפול בתרופות מעכבות הפרוטיאזות: הטיפול בתרופות אלה, Victrelisn ו-Incivo, כולל נקודות זמן להפסקה מוקדמת של הטיפול (Stopping rules) (תרשים 1) ולהחלטות לגבי קיצור משך טיפול [(Response Guided Therapy (RGT)] (תרשים 2). נקודות הזמן שונות לכל אחת מהתרופות. מטרתה של הפסקת טיפול מוקדמת היא למנוע התפתחות זנים עמידים של הנגיף, וכן למנוע חשיפה מיותרת להשפעות לוואי כאשר הסיכוי להשיג SVR זניח. מטרת ה-RGT היא להשיג SVR גבוה בטיפול קצר יותר
- Incivo - מינון התרופה הוא 750 מיליגרם (2 טבליות, כל טבליה 375 מיליגרם) כל 8 שעות, ויש ליטול אותה עם מזון עתיר שומן (20 גרם שומן). בכל המטופלים, "נאיביים" ומנוסים", הטיפול אמור להימשך 48 שבועות. ב־12 השבועות הראשונים, הטיפול משולש וכולל Incivon RBV ,pegiFNa, וב־36 השבועות הבאים הטיפול כולל I pegiFNa־RBV בלבד (SOC) (תרשים 3). אם בשבוע 4 או 12 לטיפול רמת ה-HCV RNA גבוהה מ־IU/ml 1,000, מופסק הטיפול כולו (תרשימים 1 ו־3). בקבוצת המטופלים ללא צמקת הכבד, "נאיביים" או "מנוסים", שחוו הישנות של הזיהום הנגיפי (Relapsers) ואשר השיגו 10-15IU/mL > HCV RNA] ,eRVR (בלתי מדיד) בשבוע 4 ו־12 לטיפול], ניתן לקצר את משך הטיפול הכולל ל־24 שבועות מבלי לפגוע בסיכויים להשגת SVR. בכל יתר המטופלים יימשך הטיפול 48 שבועות.
- Victrelis - מינון התרופה 800 מיליגרם (4 טבליות, כל טבליה 200 מיליגרם) 3 פעמים ביום (כל 7–9 שעות) עם אוכל. לכל המטופלים, ב־4 השבועות הראשונים הטיפול כולל SOC בלבד (lead-in pegiFNa-2a/2b :(phase במישלב עם RBV מותאם למשקל גוף (15 מיליגרם/קילוגרם). בהמשך, ניתן טיפול משולש הכולל pegiFNa ,Victrelisn ,RBV למשך 24–44 שבועות (תרשים 4). למטופלים "נאיביים" ללא צמקת הכבד שהשיגו IU/mL 10–15 > HCV RNA] eRVR (בלתי מדיד) בשבוע 8 ו־24 לטיפול] אפשר לקצר את משך הטיפול ל־28 שבועות בלבד (תרשים 4). במטופלים "נאיביים" ו"מנוסים" (Partial responders או Relapsers) שלא הצליחו להשיג eRVR, יימשך הטיפול המשולש 32 שבועות (עד שבוע 36) ולאחריו יינתן טיפול SOC בלבד למשך 12 שבועות נוספים (עד שבוע 48) (תרשים 4). הטיפול במטופלים הסובלים מצמקת הכבד ובמטופלים "מנוסים" שהוגדרו Null responders הטיפול יימשך 48 שבועות, ב־44 מהם יינתן טיפול משולש. הטיפול במטופלים "מנוסים" (Partial responders or Relapsers) ללא צמקת שהשיגו eRVR, הטיפול המשולש נמשך 32 שבועות ומופסק (סך הכל 36 שבועות טיפול) (תרשים 4). במטופלים שרמת HCV RNA שלהם גבוהה מ־IU/ml 100 בשבוע 12 לטיפול או מדידה בשבוע 24 יש להפסיק את הטיפול (תרשים 1).
- כללים להפסקת טיפול:
- Incivo - אם בשבוע 4 או 12 לטיפול המשולב רמת HCV RNA > IU/ml 1,000, יש להפסיק את הטיפול כולו (תרשים 1א)
- Victrelis - אם בשבוע 12 לטיפול רמת HCV RNA > IU/ml 100 או מדידה בשבוע 24 לטיפול (> IU/ml 15-10) יש להפסיק את הטיפול כולו (תרשים 1ב). בדיקת רמת HCV RNA מבוצעת ב-PCR רגיש עם סף רגישות לגילוי של IU/ml 10–15
- הגדרת חומרת המחלה - דרגת הלייפת: הערכת חומרת המחלה לקביעת רמת הלייפת I F0-1־F2-4 מתבצע באחת מ־3 השיטות הבאות לפחות:
- שתי השיטות הלא פולשניות (2 ו־3) נכללות בסל הבריאות החל מינואר 2012, אך הן מאושרות לביצוע חד פעמי בלבד ולפני טיפול נוגד נגיפים ב־"נאיביים" בלבד. קביעת חומרת המחלה תהיה תקפה שנתיים מתאריך ביצועה. אם קיים פער בין התוצאות בשיטות שונות, חומרת המחלה תיקבע על פי התוצאה החמורה יותר.
- טיפול בהשפעות לוואי:
- אנמיה - אין להפחית את מינון מעכב הפרוטיאזה (Victrelis או Incivo). בירידת רמת ההמוגלובין < 10 גרם/דציליטר יש להפחית את מינון ה-RBV. אם הפחתת המינון אינה משפרת את האנמיה, יש להוסיף טיפול באריתרופויאטין (Erythropoietin). רצוי שהקטנת מינון RBV תתבצע לאחר שהושגה תגובה וירולוגית. לא מומלצת הפסקה זמנית של הטיפול, אלא הקטנת מינון RBV. אם למרות הפחתת מינון RBV והוספת אריתרופויאטין מתפתחת אנמיה המסכנת את החולה (Hb < 8.5 g/dL), יש להפסיק את הטיפול כולו.
- תפרחת וגרד - אם מדובר בתפרחת קלה־בינונית (< 50 אחוזים משטח הגוף) מומלץ להשתמש בקרם לחות ובמשחות/קרם של קורטיקוסטרואידים וכן מומלץ טיפול פומי בנוגדי־היסטמינים. רצוי מאוד להתייעץ עם רופא עור שעבר הכשרה ספציפית לטיפול בהשפעות הלוואי של TVR. בחולה עם תפרחת חמורה (> 50 אחוזים משטח הגוף) (Grade 3 toxicity), יש להפסיק את הטיפול במעכב הפרוטיאזה. אם לא חל שיפור תוך כמה ימים או במצבים של Steven-Johnson או DRESS, יש להפסיק מייד את הטיפול כולו. אם מופיעה השפעת לוואי המחייבת הפסקת מעכב הפרוטיאזה (BOC או TVR), ניתן להמשיך בטיפול ב-pegiFNa/RBV (בתנאי שהושגה תגובה וירולוגית)
- תסמינים בפי הטבעת-חלחולת (אנו-רקטליים) - מומלץ לתת סיבים תזונתיים, Loperamide ומשחה מקומית המכילה הידרוקורטיזון.
- מניעת עמידות למעכבי הפרוטיאזה וטיפול בה: יש להקפיד על כללי הפסקת הטיפול כפי שפורטו קודם. יש להפסיק לתת מעכב פרוטיאזה למטופלים שנצפה אצלם Breakthrough וירולוגי. אם יש השפעות לוואי המחייבות הפסקת הטיפול באינטרפרון ו/או Ribavirin, יש להפסיק את הטיפול כולו. אם לא הושגה תגובה וירולוגית (SVR) או אם נצפה Virological breakthrough בטיפול במעכב פרוטיאזה אחד, אין לנסות טיפול במעכב הפרוטיאזה השני
- בדיקת פולימורפיזם של IL28B: בדיקה זו עשויה לסייע לחיזוי שיעור התגובה לטיפול לפני התחלתו, אולם אין להשתמש בה לקבלת החלטה על סוג הטיפול (SOC או טיפול "משולש") או על קיצור משך הטיפול. עבור מטופלים עם גנוטיפ 1, F0-1, בדיקת פולימורפיזם של IL28B עשויה לסייע להחליט אם להתחיל טיפול נוגד נגיפים SOC או להמתין לעתיד
- Vitamin D: המידע שהצטבר בספרות מצביע על ירידה בשיעור השגת SVR בקרב מטופלים עם רמה נמוכה של ויטמין D. מומלצת בדיקת רמת ויטמין D לפני התחלת הטיפול נוגד הנגיפים.
- למטופלים שתימצא בהם רמת ויטמין D נמוכה (< nanogram/mililiter 30 או < nanomole/Liter 75), יש להתחיל טיפול בוויטמין D במינון 2,000 יחידות ליממה החל מחודש לפני התחלת הטיפול נוגד הנגיפים ועד סיומו, תוך ניטור רמת הוויטמין D כל 3 חודשים במהלך הטיפול
- הוריות נגד לטיפול במעכבי הפרוטיאזות:
- מטופלים שלקו בעבר בהשפעות לוואי חמורות שהובילו להפסקת מוקדמת של הטיפול ב-PegiFNa ו-RBV
- נשים בהיריון או גברים שבנות זוגן בהריון ומתן במקביל של תרופות אחרות העוברות מטבוליזם דרך CYP3A4/5
- ניטור בדיקות דם תוך כדי הטיפול: נוסחת תאי דם ("ספירת דם") כל שבועיים עד שבוע 8 ולאחר מכן אחת לחודש, בנוסף להוריות לניטור שפורסמו במסמך הקודם, המצוי באתר החברה הישראלית לחקר הכבד
- טיפול בזיהום כרוני בנגיף דלקת כגד (הפטיטיס) C, גנוטיפ 2 או 3 או גנוטיפ 1 ומחלת כגד קלה (דרגת פיברוזיס F0-1): למטופלים אלה יינתן הטיפול על פי הקווים המנחים שהוצגו באתר החברה הישראלית לחקר הכבד בשנת 2011. הטיפול כולל I PegiFN-a2a/2b) SOC־RBV) וטיפול מונחה תגובה (RGT) בקבוצת מטופלים מסוימת
- אוכלוסיות מטופלים מיוחדות נוספות: לגבי מטופלים הסובלים מזיהום משולב ב-HCV ו-HIV (Human Immunodeficiency Virus), מטופלים לאחר השתלת כבד, מטופלים הסובלים ממחלת כבד מתקדמת או מטופלים בני פחות מ־18 שנים, אין מספיק מידע ויש להמתין עד להשלמת תוצאות המחקרים ב־2/3 Phase הבוחנים את השימוש ב-DAAS בקרב מטופלים אלו
ביבליוגרפיה
- Marcellin P, Forns X, Goeser T & al, Telaprevir is effective given every 8 or 12 hours with ribavirin and peginterferon alfa-2a or -2b to patients with chronic hepatitis c. Gastroenterology, 2011, 140;459-68.
- ↑ Thimme R, Lohmann V & Weber F, A target on the move: innate and adaptive immune escape strategies of hepatitis C virus. Antiviral Res, 2006;69:129-41.
- ↑ McHutchinson JG, Manns MP, Muir AJ & al, Telaprevir for previously treated chronic Hcv infection. PROVE 3 Study Team. N Engl J Med, 2010,362:1292-303.
- ↑ 3. Lawitz E, Rodrigues-Torres M, Muir AJ & al, Antiviral effects and safety of telaprevir, peginterferon alfa-2a, and ribavirin for 28 days in hepatitis c patients. j Hepatology, 2008;49:163-69.
- ↑ Hezode C, Forestier N, Dusheiko G & al, Telaprevir and peginterferon with or without ribavirin for HCV infection. PR0VE2 Study Team. N Engl J Med, 2009; 360:1839-50.
- ↑ 5.0 5.1 5.2 Jacobson I, McHutchinson JG, Dusheiko G & al, ADVANCE Study Team. Telaprevir for previously untreated chronic hepatitis C virus infection. N Engl J Med, 2011;364:2405-16.
- ↑ Sherman KE, Flamm SL, Afdhal NE & al, iLLUMiNATE Study Team. Response-guided telaprevir combination treatment for hepatitis c virus infection. N Eng J Med, 2011;365:1014-24.
- ↑ 7.0 7.1 Kwo PY, Lawitz EJ, McCone J & al, Efficacy of boceprevir, an Ns3 protease inhibitor, in combination with interferon alfa-2b and ribavirin in treatment-naive patients with genotype 1 hepatitis c infection (SPRiNT-1): an open-label, randomized, multicentre phase 2 trial. Lancetm, 2010; 376:705-16.
- ↑ 8.0 8.1 8.2 Poordad F, McCone J, Bacon BR & al, Boceprevir for untreated chroniv HCV genotype 1 infection. SPRiNT-2. N Engl J Med, 2011; 364:1195-206.
- ↑ 9.0 9.1 Jensen DM, Marcellin P, Freilich B & al, Re-treatment of patients with chronic hepatitis c who do not respond to peginterferon -a2b: a randomized trial. Ann intern Med, 2009;150:528-540
- ↑ 10.0 10.1 11. Zeuzem S, Andreone P, Pol S & al, REALiZE study Team. Telaprevir for retreatment of HCV infection. N Engl J Med, 2011; 364:2417-28.
- ↑ 11.0 11.1 Bacon B, Gordon S, Lawitz E & al, Boceprevir for previously treated chronic HCV genotype 1 infection (RESPOND-2). N Engl J Med, 2011; 364:1207-17.
- ↑ Sarrazin C & Zeuzem S, Resistance to direct antiviral agents in patients with hepatitis c virus infection. Gastroenterology, 2010; 138:447-462.
- ↑ Zeuzem S, Long-term follow-up of patients with chronic hepatitis c treated with telaprevir in combination with peginterferonalfa-2a and ribavirin: interim analysis of the EXTEND study [abstract 227]. Hepatology 2010, 52(suppl.1.):436A.
- ↑ Garg V, van Heeswijk R, Lee JE & al, Effect of telaprevir on the pharmacokinetics of cyclosporine and tacrolimus. Hepatology, 2011; 54:20-27.
- ↑ Lee JE, van Heeswijk R, Alves K & al, Effet of hepatitis c virus protease inhibitor telaprevir on the pharmacokinetics of amlodipine and atorvaststin. Antimicrob Agents chemother, 2011, 55:4569-74.
- ↑ 16.0 16.1 Berg T, Sarrazin C, Herrmann E & al, Prediction of treatment outcome in patients with chronic hepatitis C:significance of baseline parameters and viral dynamics during therapy. Hepatology, 2003; 37:600-609.
- ↑ Ge D, Fellay J, Thompson AJ & al, Genetic variation in iL28B predicts hepatitis C treatment-induced viral clearance. Nature, 2009; 461:391-401.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק