טיפול תרופתי בחסרי האנזים G6PD - הנחיה קלינית
|
| ||
|---|---|---|
| טיפול תרופתי באנשים חסרי האנזים G6PD | ||
| [[File:|250px]]Property "Image page" (as page type) with input value "File:" contains invalid characters or is incomplete and therefore can cause unexpected results during a query or annotation process. | ||
| הוועדה המקצועית | האיגוד הישראלי לרפואת ילדים האיגוד הישראלי לפרמקולוגיה קלינית | |
| תחום | המטולוגיה, משפחה | |
| קישור | באתר ההסתדרות הרפואית | |
| תאריך פרסום | 2003, עדכון - 2011 | |
| הנחיות קליניות מתפרסמות ככלי עזר לרופא/ה ואינן באות במקום שיקול דעתו/ה בכל מצב נתון | ||
לאור חוסר האחידות הקיימת ברשימות התרופות האסורות לשימוש במטופלים חסרי האנזים G6PD (Glucose-6-Phosphate Dehydrogenase), הוקמה ועדה מטעם ההסתדרות הרפואית, אשר כללה נציגים מתחומים שונים: רפואת ילדים, רפואת משפחה, המטולוגיה ילדים, המטולוגיה מבוגרים, רפואה פנימית, פרמקולוגיה קלינית ורוקחים.
בחדש נובמבר 2001 פורסם בעיתון ״הרפואה״ קול קורא לציבור הרופאים לשתף את הועדה בניסיונם לגבי תרופות הגורמות המוליזה בחולים חסרי האנזים G6PD.
בהתבסס על סקירת ספרות רחבה ועל הדיווחים והתגובות שהתקבלו, הוכנה רשימה מעודכנת של התרופות האסורות על חולים החסרים את האנזים G6PD.
בהנחיה זו הסברים מדוע תרופות מסוימות אשר היו ״מיתוסים״ הוצאו מרשימת התרופות האסורות לשימוש בחסרי האנזים G6PD והותרו לשימוש במינון רגיל ומקובל.
לדעת חברי הוועדה, דרושה אחידות לגבי המידע הנמסר להורים ולחולים בנוגע לחסר האנזים G6PD, מהותו, אופן השפעתו על חיי היומיום ודרכי ההתמודדות במצבים של המוליזה. הוועדה גיבשה דף הסבר המיועד להורים, אשר ילדם נמצא/ה חסר/ת האנזים G6PD, שיימסר בידיהם בשחרור מבית החולים לאחר הלידה.
אנו ממליצים כי דף ההסבר יופץ גם במרפאות לבריאות האם והילד, אצל רופאי המשפחה, מרפאות ילדים ומחלקות פנימיות בבתי החולים. מוצעות שתי גרסאות למכתב:
גרסה מקוצרת - בה מתומצתים הכללים עליהם יש להקפיד לגבי ילדים/מבוגרים חסרי האנזים G6PD, וגרסה מפורטת - להורים/מטופלים המעוניינים לדעת יותר על חוסר באנזים G6PD.
לבסוף, ממליצה הוועדה על הקמת מרכז לרישום ודיווח של המוליזה על רקע טיפול תרופתי באנשים חסרי האנזים G6PD.
מן הראוי לציין כי לא בכל בית־חולים נערכת בדיקת סקר לחסר האנזים G6PD. הועדה ממליצה בזאת לבצע בדיקה זו (מדם טבורי) לכל ילוד בכל בית־חולים.
מבוא
חוסר באנזים G6PD הוא החסר האנזימטי הנפוץ ביותר בבני אדם.
חסר זה הוא, למעשה, קבוצה של פגמים תורשתיים, בעטיים פעילות האנזים G6PD בכדוריות הדם ירודה בצורה משמעותית, ולאחר חשיפה לשורה של כימיקלים ותרופות נגרמת אנמיה המוליטית על רקע הרס הכדוריות האדומות[1],[2],[3],[4],[5].
חסר האנזים נמצא בשכיחות הגבוהה ביותר באוכלוסיות ממוצא אפריקני, ים תיכוני ואסייתי, אך גם בתפוצה עולמית. קיימים טיפוסים רבים של האנזים הפגוע, הנבדלים זה מזה מבחינה גנטית, אלקטרופורטית (Electrophoresis) וקלינית. הטיפוסים השכיחים לחסר האנזימטי הם G6PD A, המצוי בשחורים ממוצא אפריקני, והטיפוס הים תיכוני המצוי באוכלוסייה הלבנה. הצורות הקשות יותר של חסר G6PD הן נדירות יותר, והן קשורות באנמיה המוליטית לא ספרוציטית[6],[7].
בישראל נפוץ הטיפוס הים תיכוני, השכיח בארצות הים התיכון ובתת היבשת ההודית.
הגורמים ההמוליטים בחסר האנזים G6PD הם בעיקר מצבי דחק, תרופות ואכילה של גרגירי פול. אולם, טרם נקבע גודל השפעתו של כל גורם. לכן נושא השימוש בתרופות בחולים חסרי האנזים G6PD הוא מקור לוויכוח בנוגע לחלקן בהמוליזה מבחינה איכותית וכמותית.
בשנת 2003 פורסם נייר העמדה הראשון בנושא זה, אשר מטרתו היתה ליצור הנחיות אחידות אשר יקלו על הרופאים המטפלים בחולים חסרי האנזים G6PD בקבלת החלטות לגבי הטיפול התרופתי, אשר יינתן להם. החלטנו לסקור שוב את הספרות ולבדוק האם חלו שינויים בהנחיות לעומת שנת 2003. להלן מובאות ההנחיות המעודכנות.
תפקיד האנזים
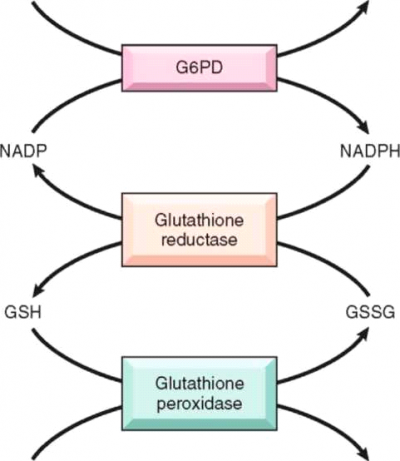
G6PD הוא אנזים מפתח בתחזוקת התא ובשמירה על תפקודו וחיוניותו. תפקוד האנזים חשוב במיוחד בכדורית הדם האדומה. האנזים מזרז את השלב הראשון במסלול Hexametaphosphate, בהפיכת גלוקוז-6-פוספאט (Glucose 6 phosphate) ל-Phosphogluconate-6 ומחזר את ה-NADP ל-NADPH. בכדורית האדומה מסלול זה הוא המקור היחיד ל-NADPH, אשר הנו חיוני להגנת התא מפני נזק חימצוני, אשר הכדוריות האדומות חשופות אליו במיוחד. למרות שהחסר באנזים קיים בכל התאים בגוף, ההתבטאות של החסר הינה בראש ובראשונה המוליזה כיוון שלכדוריות האדומות אין מקור אלטרנטיבי ל-NADPH. בנוסף, פעילות האנזים יורדת עם הזדקנות התא ובתאים בהם האנזים פגום הוא מגביל את אורך חיי התא. בעת התרחשות ההמוליזה נוצרים גופיפי היינץ, שהם חלקי המוגלובין יחד עם מרכיבי משתית חלבוניים, המצריכים נוכחות חמצן ליצירתם. נראה כי התרופות מגדילות את העקה החמצונית הקיימת בכדורית הדם האדומה וכך נוצרים רדיקלים חופשיים וכן רמה נמוכה של H2O2, אשר גורמים לחמצון הגלוטטיון (Glutathione) ולעליה ברמה הדי-סולפידית של הגלוטטיון (GSSG, Glutathione disulfide) או להתרכבות ההמוגלובין עם הגלוטטיון, ליצור דיסולפיד מורכב, אשר מערער את יציבות ההמוגלובין, גורם ליצירת קשרים די-סולפידים אחרים בתוכו ולהתפרקות ההמוגלובין[1],[2],[3],[4],[5],[6],[7].
לצורך תיקון נזקי החמצון ושמירה על שלמות המבנה של הכדוריות האדומות יש צורך בגלוטטיון מחוזר בכמות מספקת, כלומר אספקה של NADPH. בחסר האנזים הכדורית לא מסוגלת לעמוד בקצב החיזור הרצוי, עולה ההעקה החמצונית בכדורית ונוצרים גופיפי היינץ. גופיפי היינץ פוגעים בגמישות הממברנה וביכולתה של הכדורית להתאים את עצמה לסביבה. לכן הכדוריות נהרסות בקלות ומוצאות מזרם הדם.
גנטיקה וביוכימיה
הגן לאנזים G6PD ממופה בכרומוזום X. האנזים G6PD מורכב, כנראה, מ־2 תת יחידות שוות. האנזים התקין, G6PD B, הוא הטיפוס הנפוץ ביותר בכל קבוצות האוכלוסייה שנבדקו. חסר בפעילות האנזימטית נובע בדרך כלל מהפחתה או חוסר ייצור, ירידה בפעילות עקב שנוי מבני (מוטאציות). הסיבות השכיחות לחסר האנזימטי הן, כנראה, עליה בפירוק האנזים בשילוב עם ירידה בפעילות האנזים, אך קיימים טיפוסים של חסר אנזימטי עם ירידה בפעילות בלבד[1].
בקרב האוכלוסייה ממוצא אפריקני, שכיח טיפוס אחר של האנזים הנקרא +G6PD A, אשר קיים ב־40-20 אחוז מכרומוזומי X אך נמצא גם בקרב 13-11 אחוז מהשחורים האמריקניים. טיפוס זה שונה מהטיפוס G6PD B הרגיל בחומצה אמינית אחת. ישנם טיפוסים רבים נוספים שהם נורמלים אך שונים מורפולוגית מטיפוס B.
מוטאציות
זוהו כ־400 מוטאציות הכרוכות בירידה בפעילות האנזים. סוגים אלו נבדלים זה מזה במגוון תכונות, כולל רמת פעילות האנזים והשארית האנזימטית הפעילה הקיימת, ניידות אלקטרופורטית, זיקה לסובסטראט ואנלוגים שלו, יציבות בחימום piH אופטימאלי. נציין את שני הסוגים החשובים ביותר לענייננו:
הסוג האפריקני G6PD A
החוסר באנזים אצל אפריקנים הוא קל יחסית, כ־15-10 אחוז מפעילות האנזים עדיין קיים. בקרב אפרו־אמריקאים תדירות התבטאות הגן היא כ־20%. כיום ידוע כי חסר זה מצוי גם במכסיקו ודרום אירופה. לסוג זה של חסר אנזימטי חשיבות קלינית בכל הנוגע למתן תרופות מסוימות, כיוון שמרבית ארועי ההמוליזה עקב שימוש בתרופות מסוימות דווחו בחולים עם חסר מסוג -A, שאיננו קיים בישראל[5].
הסוג הים תיכוני
צורת החסר הנפוצה ביותר בישראל היא הצורה הים תיכונית. שכיחות החסר האנזימטי היא כ-20% בקרב אנשים ממוצא עיראקי ויכולה להגיע לכדי 60% בקרב יהודים ממוצא כורדי.
מספר מחקרים אחרים מצאו בישראל סוגים נוספים של החסר: G6PD Bat-Yam, G6PD Ashdod, G6PD Ramat-Gan ו-G6PD Bnei-Brak, כולם קשורים לאנמיה המוליטית לא כרונית. הסוג G6PD Lifta נמצא דומה לצורה הים תיכונית, ולבסוף, סוג Tel-Hashomer הדומה לטיפוס -A הנפוץ יותר בשחורים. יש לציין כי כל הטיפוסים הללו נבדלים בתכונותיהם הביוכימיות.
במקרה של הטיפוס -A והטיפוס הים תיכוני האנזימים מיוצרים בכמות נורמלית או קרוב לנורמלית, אבל יציבותם ירודה ביותר, וכן פעולתם ירודה יותר. לכדוריות הדם בטיפוסים אלו יש אחוז הישרדות קרוב לנורמלי. במקרה של טיפוס -A הדבר נובע מהתנגדות להשפעה המעכבת של NADPH ובמקרה של הטיפוס הים תיכוני, מדובר בזיקה גבוהה במיוחד ל-NADP ולגלוקוז-6-פוספאט.
אבחנה
אבחנה של חסר G6PD תלויה בהדגמה של פעילות אנזימטית ירודה במבחן כמותי או בבדיקת סקירה. בדיקה של פעילות האנזים נעשית על ידי מדידת חיזור NADP ל- NADPH באמצעות ספקטרופוטומטר (Spectrophotometer) על סגול. קיימים מבחני סקירה ויזואלים. המבחן הפלואורוסצנטי הוא מבחן הסקירה הפשוט, האמין והרגיש ביותר. במבחן זה, המבוסס על הפלואורסצנטיות של NADPH, מוסיפים NADP וגלוקוז-6-פוספאט להמוליזט של הכדוריות האדומות, ולאחר זמן קצר מטפטפים את התערובת על נייר סופג ובודקים אותו תחת אור על סגול. פלואורסצנטיות מעידה על נוכחות NADPH, שנקשר על ידי G6PD.
לעתים קיים קושי באבחון הטרוזיגוטיות מכיוון שהתאים מציגים תמונה מעורבת מבחינת פעילות האנזים, אך באמצעות שיטות היסטוכימיות המדגימות פעילות אנזימטית לגבי כל תא ותא או על ידי מבחנים ביוכימיים במצע תאים, ניתן להתגבר על הבעיה.
במצבים של אנמיה לא ספרוציטית, הזיהוי יעשה על ידי שיטות ביוכימיות בהם נקבע בתנאים הסטנדרטים ה-Km של האנזים לגבי NADP וגלוקוז-6-פוספאט, ה-pH האופטימלי והניידות האלקטרופורטית[1],[2],[3],[4],[5],[6],[7].
קליניקה
מרבית הפרטים חסרי האנזים G6PD אינם מבטאים כל סימן קליני, אך בזכרים הומוזיגוטיים לחסר האנזים G6PD מהטיפוסים -A והים תיכוני, תהיה המוליזה כרונית קלה מאוד. אורך חיי הכדוריות האדומות יורד ל-100 ימים, וריכוז ההמוגלובין נמוך בכ-1 gr/dl (gram/deciliter), בהתאמה[1].
הביטוי הקליני העיקרי בחסרי האנזים G6PD הוא אנמיה המוליטית, בדרך כלל חולפת, עם היפרבילירובינמיה (Hyperbilirubinemia) בלתי ישירה.
הגורמים ההמוליטים בחוסר האנזים G6PD הם שונים: אכילת פול, מתן תרופות מסוימות ומצבי דחק - בעיקר מחלות חום ומחלות זיהומיות.
- Favism - אנמיה המוליטית המתרחשת לאחר אכילת גרגירי פול (Fava beans). כל החולים הסובלים מ-Favism הם חסרי האנזים, אך לא כל חסרי האנזים יסבלו מ-Favism כתוצאה מאכילת פול. תופעת ה-Favism מתרחשת בעיקר בילדים מתחת לגיל 5 שנים וכמעט איננה מתרחשת במבוגרים. תמס הדם בשל ה-Favism יכול לגרום למוות.
- בישראל זו תופעה נפוצה ולעיתים שאיפת אדי הפול המתבשל או מעבר ליד שדה פול מספיקים כדי לגרום להמוליזה. זוהו שני מרכיבים בגרגירי הפול הגורמים להמוליזה (Isouramil ,Divicine), אך המנגנון המדויק איננו ידוע עדיין. בכמות קטנה (עד 2.5 גרם) מחומצנות קבוצות תיוליות (-SH) ומדלדל מאגר הגלוטטיון המחוזר של כדוריות הדם. בכמות גדולה יותר נפגע מסלול המטבוליזם של כדורית הדם והסידן המצטבר פוגע במבנה ובגמישות של כדורית הדם.
- צהבת של הילוד - אחד מהמצבים בהם החוסר באנזים G6PD הוא מסוכן ביותר ויכול להסתיים בקרניקטרוס (Kernicterus), במוות או בשיתוק מוחין. הקשר הנסיבתי שבין צהבת של הילוד והחסר באנזים G6PD הוכח ללא צל של ספק, אך קרוב לודאי אין מדובר בהמוליזה בלבד, אלא כנראה חוסר תפקוד האנזים בכבד הבלתי בשל של הילוד. הסיכון לפתח צהבת של הילוד שונה בין אוכלוסיות שונות ובסביבות שונות.
הגורם החשוב ביותר הקשור בקבלת תרופות הוא השפעת מצבי דחק, בעיקר מחלות זיהומיות, המשפיעים על התפתחות האנמיה ההמוליטית בחולים חסרי G6PD:
- מחלות זיהומיות - בימים הראשונים להתפתחות מחלה זיהומית אצל חסרי G6PD יכולה להופיע אנמיה בצורה פתאומית. אנמיה המוליטית אופיינית יותר במקרים של דלקת ריאות חיידקית, אך גם טיפוס הבטן וזיהומים הנגרמים על ידי Rickettsiosis, Salmonella, E.Coli, Streptococcus pneumoniae Hemolytic ונגיפים כמו EBV ו-CMV עלולים לגרום לאנמיה המוליטית. האנמיה ההמוליטית בעקבות זיהום היא מתונה בדרך כלל וחולפת עם נסיגת התהליך הזיהומי.
- שימוש בתרופות - אנמיה המוליטית כתוצאה משימוש בתרופות אצל חסרי G6PD מתחילה 3-1 ימים לאחר מתן התרופה, ריכוז ההמוגלובין יורד בכ-4-3 gr/dl. בחולה מטיפוס -A ההמוגלובין יחזור לרמה נורמלית תחת המשך מתן התרופה באותם המינונים. אצל חולים עם חסר מהטיפוס הים תיכוני התהליך חמור יותר ואז יש להפסיק את מתן התרופה. יש המייחסים לאנמיה ההמוליטית הנגרמת משימוש בתרופות חלק חשוב בתחלואה הקשורה בחסר G6PD אך למעשה מחלות זיהומיות מהוות חלק חשוב יותר. קיים קושי בהוכחת הפעילות ההמוליטית של תרופות על חולים חסרי G6PD משום שמבחנים In-vitro הקיימים כיום אינם מספקים, וטרם נמצא מודל חיה טוב לבדיקת ההשפעות ההמוליטיות של תרופות על חסרי האנזים.
מטרות הוועדה ואופן פעולתה
קיימת אי הסכמה בקרב החוקרים לגבי התרופות האסורות בשימוש בחסרי G6PD, ומהן התרופות בהן ניתן להשתמש ללא חשש[8],[9],[10]. המקורות המצוטטים בנושא זה הם מצומצמים וישנים, ורובם מסתמכים על אותן טבלאות.
ועדה מטעם ההסתדרות הרפואית שהוקמה בשנת 2002 שמה לה למטרה לעדכן את הרשימה, והוציאה הנחיות קליניות לטיפול תרופתי בחולים חסרי G6PD.
לאור חוסר האחידות הנמשך בישראל ובעולם לגבי התרופות האסורות בשימוש בחולים אלה בוצעה השנה סקירת ספרות מקיפה על ידיי צוות היחידות לפרמקולוגיה קלינית במרכז הרפואי אסף הרופא ובמרכז הרפואי קפלן. הסקירה כללה את כל המחקרים הקליניים, עבודות מעבדה, דיווחי המקרה, וניירות עמדה שפורסמו בספרות העולמית במשך 50 השנים האחרונות וכללו התייחסות לטיפול תרופתי בחולים חסרי G6PD. תוצאות עבודה מקיפה זו פורסמו כהנחיות קליניות בעיתונות מדעית מובילה, ועל סמך העבודה גובש נייר עמדה זה.
- Youngster I, Arcavi L, Schechmaster R, Akayzen Y, Popliski H, Shimonov J, Beig S, Berkovitch M. Medications and glucose-6-phosphate dehydrogenase deficiency: an evidence-based review. Drug Saf. 2010 Sep 1;33(9):713-26.
מסקנות הוועדה
תרופות האסורות לשימוש בחולים חסרי האנזים G6PD
- Methylene Blue[11],[12],[13],[14],[15],[16].
- Nitrofurantoin (Macrodantin®, Uvamin®)[2],[7],[17],[18],[19],[20],[21]
- Phenazopyridine (Sedural®)[22],[23],[24],[25],[26],[27],[28]
- Primaquine (Primaquine®)[2],[3],[29],[30],[31],[32]
- Dapsone (Avlosulfon®)[11],[33],[34],[35],[36]
- Rasburicase[37],[38]
- Toulidine Blue [11],[39],[40]
תרופות האסורות לשימוש בחולים חסרי האנזים G6PD, אך אינן נמצאות בשימוש קליני בישראל:
- Acetanilid
- Phenylhydrazine
- Niridazole
- Sulfapyridine
תרופות מותרות לשימוש
תרופות שבעבר נחשבו לא בטוחות לשימוש אך בעקבות סקירת הספרות הוצאו מן הרשימה וכעת ניתן להשתמש במינון רגיל גם בחולים חסרי האנזים G6PD:
- Acetaminophen (Paracetamol} - תרופה אנלגטית ואנטיפירטית נפוצה. ישנם מספר דיווחים על המוליזה בחסרי G6PD בעקבות מתן Acetaminophen, אך בקריאה מדוקדקת של הדיווחים מסתבר שבכל המקרים מדובר במתן מינוני יתר משמעותיים[41],[42],[43]. במחקר מעבדתי התרופה לא קיצרה את אורך חיי הכדוריות האדומות[17],[18]. נראה כי במינון מקובל אין מניעה ממתן תרופה זו לחסרי האנזים.
- אספירין - Acetylsalicylic acid - נראה כי מינון גבוה במיוחד של אספירין מביא לקיצור לא משמעותי באורך חיי הכדורית האדומה בחסרי G6PD. במחקרים רבים נטען כי ההמוליזה המתרחשת (אם בכלל) תוך שימוש במינון רגיל של אספירין (עד 50 מ״ג לק״ג (מיליגרם/קילוגרם) משקל גוף ביום) נובעת מהמחלה הזיהומית והחום, ולא על רקע השימוש בתרופה[16]. בניסוי שבו ניתנה התרופה לנבדקים שקיבלו כדוריות אדומות מסומנות חסרות G6PD מן הטיפוסים -A והים תיכוני, לא נמצא הרס של הכדוריות האדומות[17]. בעבודה אחרת, ניתן אספירין במינונים של 50 מ״ג לק״ג במשך 4 ימים לחסרי G6PD בריאים שחורים ולבנים, ולא נצפתה אצלם המוליזה. המחברים מסיקים, שלגבי הטיפוסים השכיחים של חסר G6PD, שאינם קשורים באנמיה המוליטית כרונית, אין לאספירין השפעה המוליטית[10]. אולם, בעבודה אחרת נמצא, שכאשר הדגירו כדוריות אדומות חסרות G6PD בנוכחות אספירין או H2O2 בנפרד, לא נצפתה המוליזה, אך בשילוב של שניהם, נצפה הרס של הכדוריות האדומות ביחס ישר לריכוז האספירין. המחברים הסיקו, כי במצב חימצוני, כמו למשל בזמן זיהום חד, תהיה לאספירין השפעה המוליטית על חסרי G6PD[18][16],[44],[45].
- לגבי השימוש באספירין במינון נמוך לאורך זמן, כטיפול אנטיתרומבוטי, נבדקה ההשפעה של מתן אספירין במינון של 250 מ״ג ליום במשך שלושה חודשים ל-44 חסרי G6PD מן הטיפוס הים תיכוני, ובכל מהלך אותו זמן לא נמצאה אצלם כל עדות להמוליזה. שני נבדקים חלו במהלך התקופה במחלת חום דמוית שפעת, והמשיכו את הטיפול באספירין, וגם במקרים אלה לא נצפתה המוליזה. מכאן, שאספירין הוא בטוח לחסרי G6PD[19].
- Aminopyrine - תרופה אנלגטית, אנטיפירטית (Antipyretic) ונוגדת דלקת. ישנו דיווח אחד בספרות על המוליזה בעקבות מתן התרופה בחולה חסר G6PD[17], אך בעבודות מאוחרות יותר נבדקו 171 מקרים של מתן התרופה בחולי חסר G6PD ללא תופעות לוואי משמעותיות[20]. על סמך ממצאים אלה אנו מסיקים שניתן להשתמש בתרופה ללא חשש במינונים המקובלים.
- Antipyrine - תרופה אנלגטית ואנטיאינפלמטורית המשמשת לטיפול מקומי בתכשירים המיועדים לאזניים. ישנו בספרות דיווח אחד בלבד על המוליזה לאחר נסיון אובדני ונטילת מינון גבוה במיוחד של התרופה[46]. על סמך הספרות הקיימת אין מניעה ממתן תכשיר זה לחולי חסר ב-G6PD.
- Ascorbic acid (ויטמין C) - גורם לירידה של רמות ה-GSH בכדוריות אדומות חסרות G6PD, ובעל השפעה מחמצנת על המוגלובין וחלבונים אחרים. דיווחים קיימים על המוליזה בחסרי G6PD בעקבות מינונים גבוהים של ויטמין Mega dosing) C) אולם, במינונים תרפויטיים אין סכנה במתן ויטמין C לחסרי 50-52) G6PD[47][48],[49]. במחקרים מעבדתיים נצפתה השפעה על אורך כדוריות הדם האדומות רק במינונים הגבוהים פי מאה מהמינון הטיפולי המקובל.
- Chloramphenicol - כדוריות מסומנות חסרות G6PD מטיפוס -A שנתנו לנבדקים לא הושפעו מתרופה זו[20]. אולם היו מספר דיווחים על אנמיה בחולים חסרי האנזים G6PD, בעיקר מהטיפוס הים תיכוני, אשר קיבלו מנות טיפוליות של Chloramphenicol. רוב הדיווחים היו בחולים אשר קיבלו את התרופה על רקע של טיפוס הבטן או מחלת חום, אשר יכולות להיות הגורם להמוליזה בפני עצמן. במחקר שבוצע על חולים עם חסר אנזימטי חמור מהטיפוס הקנטוני והסיני, הראו כי כדוריות דם של חולים אשר חלו בטיפוס הבטן ולא טופלו, היו בעלות אורך חיים קצר מהרגיל. לעומת זאת, כדוריות דם אצל אותם חולים עם טיפוס הבטן אשר טופלו ב-Chloramphenicol, היו בעלות אורך חיים נורמלי. כלומר, לפי עבודות אלו ולפי מאמרו של Beutler אפשר לתת Chloramphenicol במינון טיפולי לאנשים חסרי האנזים G6PD [4],[17],[20],[47],[50].
- Chloroquine - תכשיר אנטי מלריה, ממשפחת ה-4-אמינוקווינולונים, שנמצא, בניסויים עם כדוריות אדומות מסומנות חסרות G6PD, שאינה גורמת לאנמיה המוליטית אצל חסרי G6PD מן הטיפוסים -A, ים תיכוני, ו-Canton. ישנם מספר דיווחים בספרות על המוליזה בחולים חסרי G6PD שנטלו Chloroquine בשילוב עם תרופות אחרות כנגד מלריה. ניתן להסיק שכטיפול בודד אין מניעה ממתן Chloroquine, אך יש להיזהר כאשר התרופה ניתנת בשילוב עם תרופות אחרות לחולים חסרי G6PD[4],[7],[17],[51],[52].
- Metamizole (Dipyrone) - איננו מופיע באף רשימה, אך בעלון לרופא מופיעה אזהרה לגבי שימוש בתרופה באנשים חסרי G6PD. נמצא דיווח בודד על אנמיה המוליטית כתוצאה משימוש בתרופה. בסקירה מקפת שנערכה ומתוך התגובות שקיבלנו, לא נמצא קשר ודאי בין התרופה להמוליזה, ולכן אין איסור להשתמש בתרופה, במינון הרגיל המקובל, באנשים חסרי האנזים G6PD[20].
- Dimercaptosuccinic acid (DMSA, Succimer) - למרות מקרה מדווח אחד של המוליזה בעקבות מתן DMSA[53], ישנם מספר עבודות שבדקו את השפעת התרופה על כדוריות הדם האדומות של חולי חסר G6PD ולא מצאו כל השפעה[54].
- Furazolidine - תרופה אנטיבקטריאלית הניתנת בעיקר לדלקות מעיים חיידקיות וטפיליות. ישנו דיווח בודד על נער עם חסר G6PD שפיתח המוליזה וצהבת בעקבות מתן התרופה, אך בעבודה מאוחרת יותר נמצאו 23 דיווחים על מתן התרופה בחולים חסרי G6PD, ולא תוארו ארועי המוליזה[20]. כפי הנראה ניתן לתת את התרופה בבטחה לחולים אלה[55].
- Glibenclamide (Glyburide) - סולפנילאוריאה (Sulfonylurea) מדור שני המשמש לטיפול בסכרת מסוג 2. ידוע כי התרופה גורמת במקרים מסויימים לאנמיה המוליטית על רקע אוטואימוני. ישנם שני דיווחים בספרות על המוליזה בחולים חסרי G6PD. לא נראה ששכיחות ההמוליזה בחולי G6PD מוגברת בהשוואה לאוכלוסייה ללא חסא אנזימטי, וניתן לתת את התרופה לחולים אלה בבטחה במינונים הרגילים[56],[57],[58].
- Isoniazid - Ferredoxin המשמש בעיקר כטיפול נגד שחפת. ישנם 3 דיווחים בספרות על המוליזה בחולים חסרי G6PD שטופלו בתרופה זו[59], אם זאת עבודות מעבדה לא הדגימו השפעה של התרופה על אורך חיי כדוריות אדומות ללא G6PD[17]. בהתאם לסקירה והמלצות של באטלר[7] אין מניעה משימוש בתרופה זו במינון המקובל בחולי חסר G6PD.
- Isosorbide dinitrate - תרופה הניתנת לחולים אנגינוטיים. ישנו דיווח אחד על המוליזה בשני חולים עיראקיים עם חסר G6PD[60]. עם זאת, במבחן תגר חוזר כעבור מספר שבועות לא נצפתה כל המוליזה באותם חולים. אין דיווחים נוספים בספרות, וניתן לרשום תרופה זו במינון המקובל לחולים עם חסר G6PD.
- Nalidixic acid - תרופה זו עלולה לגרום אנמיה המוליטית באוכלוסייה הכללית. ישנם 3 דיווחים על המוליזה בחולים חסרי G6PD[61],[62],[63], ולאור זאת קיימת אזהרה בעלון התרופתי. יש לציין ששלושת החולים סבלו מזיהום חיידקי חמור, שבעצמו עלול לגרום המוליזה בחולים חסרי G6PD. לאור מיעוט הדיווחים בתרופה בעלת שימוש נרחב, ניתן להסיק כי במינון המקובל אין מניעה ממתן התרופה לחולים חסרי G6PD .
- Ciprofloxacin ,Levofloxacin ,Norfloxacin ו-Ofloxacin - פלורוקווינולונים (Fluoroquinolones), נגזרות של Nalidixic acid. על סמך סקירת הספרות, לא נמצאו דיווחים על המוליזה בחולים חסרי G6PD שנטלו תרופות אלו. ישנם מספר דיווחים על אנמיה בחולים ללא חסר אנזימטי. בהוראות היצרן מופיעה אזהרה לגבי מתן התרופות בחולים חסרי G6PD, אך אזהרה זו נכתבה על סמך דיווחי המוליזה עקב מתן Nalidixic acid, וכפי הנראה אינם רלבנטיים למתן קווינולונים[63],[64],[65].
- Quinacrine hydrochloride - תרופה הניתנת לעיתים נדירות לחולי מלריה. על סמך עבודות מעבדה[17] ודיווחים קליניים[32], אין מניעה משימוש בתרופה זו בחולי G6PD.
- Quinine - תרופה נפוצה למלריה. לא נצפה אפקט המוליטי כאשר התרופה ניתנה לחולים חסרי G6PD או לחיות מעבדה עם חסר אנזימטי[4],[17].
- Sulfacetamide - קיים בישראל בתכשירים למתן עיני. לא נמצאו דיווחים לגבי השפעתו על חולים חסרי G6PD. מותר לתת לאנשים חסרי האנזים G6PD.
- Sulfanilamide - תרופה בעלת תכונות כימיות דומות ל-Sulfamethoxazole. ישנו דיווח על המוליזה בשני חולים חסרי G6PD שטופלו בתרופה[66]. יש לציין שלתרופה יש תופעת לוואי של המוליזה בעד 12% מהאוכלוסייה הכללית[66],[67],[68]. בכל מקרי ההמוליזה בחסרי G6PD ניתנו מינונים הגבוהים פי ארבעה מהמינון המקובל. הרושם הוא שהתרופה בטוחה לשימוש במינון המרגיל.
- Sulfasalazine - תכשיר הכולל בתוכו 2 מרכיבים: 5-Aminosalicylic acid ו-Sulfapyridine. נמצאה השפעה המוליטית על חסרי A מטיפוס G6PD. אולם בעבודות אחרות, כולל עבודה מישראל, מדווחים מקרים של אנמיה עם יצירת גופיפי היינץ אצל מטופלים שאינם חסרי G6PD, וההשערה הייתה, שלתרופה יכולת לפגוע גם במערכת האנזימטית הנורמלית. כמו כן, המינון, בו נמצאה פגיעה המוליטית משמעותית בכדוריות האדומות החסרות G6PD היה קרוב למינון הטוקסי של התרופה, ובמינונים התרפויטיים לא נצפתה המוליזה בחסרי G6PD מטיפוס -A. מוסכם, של Sulfapyridine השפעה המוליטית על חסרי G6PD, אולם לגבי מינון תרפויטי של Sulfasalazine, כנראה שאין השפעה המוליטית, לפחות לא על חסרי G6PD מטיפוס -A. לא קיימת אזהרה לגבי התרופה ב-Micromedex. קיימים מספר דיווחים, אך נראה כי במינונים טיפוליים מקובלים אין השפעה המוליטית, לפחות לא בסדר גודל השונה מזה הקיים באוכלוסייה הרגילה[17],[20],[69],[70],[71].
- Sulfisoxazole - כמו עם תרופות אחרות ממשפחה זו ישנם דיווחים על המוליזה בחסרי G6PD, אך בכל המקרים מדובר במינונים גבוהים במיוחד[7]. אין מניעה ממתן התרופה במינון המקובל.
- (Trimethoprim/Sulfamethoxazole (TMX-SMZ) - לא נמצאו דיווחים חד משמעיים לגבי השפעת התרופה בחולים חסרי G6PD. השפעות ההמוליטיות שנצפו היו במינונים הגבוהים מן המקובל, אך במינונים מקובלים לא נצפתה המוליזה. כמו כן ההמוליזה שהתרחשה בנוכחות התרופה יכולה היתה להיות על רקע מחלות זיהומיות בעטיין ניתן הטיפול. מחקר אשר בדק האם ניתן לתת את התרופה Cotrimoxazole במינונים רגילים (בילדים עד 40 מ״ג לק״ג ליום ובמבוגרים עד 800 מ״ג Sulfamethoxazole ליום) מצא כי שיעור התרחשות האנמיה ההמוליטית בחולים חסרי G6PD היה זהה לזה של האוכלוסייה הרגילה. לפי עבודות אלו אין להימנע מטיפול בתרופה זו בחולים חסרי האנזים G6PD. יש לציין כי במקרים של זיהום ב-Pneumocystis carinii זוהי תרופת הבחירה בילדים (כאשר החלופה Dapsone גם היא בעייתית בחולים חסרי G6PD[7],[17],[72].
חומרים כימיים האסורים בסביבת חולים חסרי G6PD
- Naphthalene - חומר ביתי להרחקת עש מארונות בגדים
- TNT (Trinitrotoluene) - חומר המשמש לייצור חומרי נפץ
הצעות לדפי הסבר
לדעת חברי הוועדה, דרושה אחידות לגבי המידע הנמסר להורים ולחולים בנוגע לחסר האנזים G6PD, מהותו, אופן השפעתו על חיי היומיום ודרכי ההתמודדות במצבים של המוליזה. חוסר האחידות ברשימות הניתנות בכל אחד מבתי החולים בארץ גורם לבלבול רב וחוסר וודאות מצד ההורים לילדים חסרי האנזים.
לפיכך, גיבשה הועדה דף הסבר המיועד להורים, אשר ילדם נמצא/ה חסר/ת האנזים G6PD, שימסר בידיהם עם צאתם מבית החולים לאחר הולדת הילד/ה. לדעתנו, רצוי כי הדף יופץ גם בטיפות החלב, אצל רופאי המשפחה, מרפאות ילדים ומחלקות פנימיות בבתי החולים. לדף הסבר שתי גרסאות:
לדף הסבר שתי גרסאות:
- גרסה מקוצרת - בה מתומצתים הכללים עליהם יש להקפיד לגבי ילדים חסרי האנזים G6PD.
- גרסה מפורטת - להורים המעונינים לדעת יותר לגבי חוסר באנזים G6PD.
אנו פונים בזאת לציבור הרופאים/ות בארץ לדווח על תופעות של המוליזה על רקע טיפול תרופתי כלשהו במטופלים חסרי האנזים G6PD.
את הדיווחים יש להפנות למרכז לייעוץ תרופתי בבי״ח ״אסף הרופא״ טלפון 08-9779309 פקס 08-9779138
הצעה לדף הסבר מקוצר להורים
הורה יקר/ה,
בבדיקת הדם שנערכה לבנכם/בתכם נמצא חסר באנזים G6PD (גלוקוז־6־פוספאט דה־הידרוגנאז).
מהו אנזים ה-G6PD?
אנזים ה-G6PD נמצא בכל תאי הגוף ושומר עליהם מפני נזקי החמצון, הנגרמים כתוצאה מחילוף חומרים בגוף. אנזים זה חשוב במיוחד לתפקודם התקין של כדוריות הדם האדומות, משום ששם חילוף החומרים מוגבר וקיים חשש לנזקי חמצון. כאשר קיים חוסר באנזים, קשה לכדורית הדם לבצע את חילוף החומרים כיאות, דבר המסב לה נזק ומגביל את אורך חייה.
קיימים מספר סוגים של חוסר באנזים G6PD. בארץ נפוץ מאד חוסר אנזים G6PD, הקרוי גם ״הטיפוס הים תיכוני״.
כיצד בא לידי ביטוי חסר באנזים G6PD?
חוסר באנזים G6PD אינו מסוכן ואינו גורם נזק כל עוד מתנהגים נכון. עלולה להיגרם אנמיה (ירידת ערך ההמוגלובין) עם הופעת צהבת, שתן כהה או חיוורון קיצוני במצבים של מחלת חום, מחלה זיהומית או מחלה קשה אחרת. כל אלה הם סימנים לפירוק מהיר של כדוריות דם אדומות וירידה חדה ברמת ההמוגלובין (אנמיה). פירוק מהיר של כדוריות דם אדומות יכול גם להתרחש אצל תינוקות מיד לאחר הלידה ומתבטא בצהבת של הילוד.
כיצד מטפלים באנמיה ובפירוק כדוריות הדם האדומות?
ברוב המקרים האנמיה איננה חמורה ולא יידרש כל טיפול. לעיתים רחוקות קצב פירוק כדוריות הדם האדומות מהיר ויש צורך במתן עירוי דם.
כפי שצוין, החוסר באנזים ה-G6PD אינו מסוכן ולכן ישנן מספר הגבלות מצומצמות ביותר שיש להקפיד עליהן:
- אסור לילדכם לאכול פול - במידה והילד/ה אכל/ה (או בא/ה במגע עם פול) יש לפנות מיד לרופא.
- אסור לילדכם לבוא במגע עם נפטלין (חומר המשמש נגד עש הבגד).
- אסור לילדכם ליטול את התרופות הבאות:
- Avlosulfon) Dapsone) - (דפסון - אבלוסולפון) - תרופה נדירה הניתנת במצבים של זיהומים מיוחדים אשר אינם מגיבים לטיפול אחר.
- Methylene Blue - (מתילן בלו) תרופה הניתנת רק באשפוז למצבים מאד מיוחדים.
- Macrodantin, Uvamin) Nitrofuantoin) - (ניטרופורנטוין - מקרודנטין, יובאמין) - אנטיביוטיקה בשימוש בעיקר בדלקות בדרכי שתן.
- Sedural) Phenazopyridine) - (פנזופירידין - סדורל) - תרופה הניתנת במצבים של דלקת בדרכי השתן לשם הקלת הכאב.
- Primaquine) Primaquine) - (פרימקווין) - תרופה הניתנת לטיפול ומניעת מלריה.
- Rasburicase - (רסבוריקאז) - תרופה הניתנת במסגרת טיפול במחלות ממאירות.
- Toluidine Blue - (טולואידין בלו) - תרופה הניתנת לעיתים נדירות בזמן ביצוע הדמייה של בלוטת התריס.
- Septrin ,Resprim, Diseptyl, Sulfatrim) Trimethoprim/Sulfamethoxazole) - (סולפטרים, דיספטיל, רספרים, ספטרין) - אנטיביוטיקה בשימוש במצבים שונים. אין התווית נגד לשימוש בתרופה זו במינון רגיל בחולים חסרי האנזים G6PD. במינון מוגבר התרופה עלולה לגרום לפירוק כדוריות דם אדומות, לכן רצוי להעדיף טיפול חלופי במידת האפשר.
בכל טיפול רפואי (רופא מטפל, רופא שיניים, מתן זריקה, חיסון או כל טיפול אחר) יש ליידע את הרופא המטפל על העובדה שלילדכם חוסר באנזים G6PD.
האם קיימת מגבלה במידה והאם מניקה ולילד/ה יש חסר באנזים G6PD?
ההגבלות על האם המיניקה במצב זה הן מועטות.
- במידה ולילדך חסר באנזים G6PD - לא לאכול פול כל עוד הנך מיניקה.
- לא להיניק תינוק חסר האנזים G6PD במידה והנך נוטלת את אחת התרופות שהוזכרו למעלה מכיוון שהן
עלולות לעבור לתוך חלב האם ולגרום לאנמיה אצל התינוק היונק.
חשוב מאד
יש לידע את הרופא המטפל על החסר באנזים בכל קבלת תרופה. יש לשים לב בכל נטילת תרופה לשם החומר הפעיל בתרופה, מכיוון ששמות מסחריים משתנים ומתחדשים.
בכל חשיפה לאחד מהגורמים שהוזכרו (פול, נפטלין, תרופות) יש להיוועץ מיד עם הרופא המטפל.
הצעה לדף הסבר לבוגר עם חסר האנזים G6PD
מטופל/ת יקר/ה,
בבדיקת הדם שנערכה לך נמצא חסר באנזים G6PD (גלוקוז־6־פוספאט־דה־הידרוגנאז).
מהו אנזים ה־G6PD?
אנזים ה-G6PD נמצא בכל תאי הגוף ושומר עליהם מפני נזקי החמצון, הנגרמים כתוצאה מחילוף חומרים. אנזים זה חשוב במיוחד לתפקוד התקין של כדוריות הדם האדומות. כאשר קיים חוסר באנזים G6PD, והכדורית האדומה נחשפת למצב של חמצון יתר (העלולים לקרות במחלות עם חום גבוה או בעת נטילת תרופות מסוימות שיפורטו להלן), קשה לכדורית הדם לבצע את חילוף החומרים כיאות, דבר המסב לה נזק. במצבים בהם נדרש תפקוד מוגבר של האנזים, כמו במחלות חום או בשימוש במספר תרופות, אין לכדורית האדומה יכולת להתמודד עם נזקי החמצון, והיא מתפרקת.
קיימים מספר סוגים של חוסר באנזים G6PD. בארץ נפוץ מאד חוסר אנזים G6PD, הקרוי גם ״הטיפוס הים תיכוני״.
כיצד בא לידי ביטוי חסר באנזים G6PD?
חוסר באנזים G6PD אינו מסוכן ואינו גורם נזק כל עוד מתנהגים נכון. מרבית החולים אינם סובלים מחסר דם כרוני. בעת לקיחת תרופות מסוימות או בזמן מחלה זיהומית חריפה עלול להופיע חסר דם (אנמיה, ירידת ערך ההמוגלובין) עם חולשה קיצונית, הופעת צהבת ושתן כהה. כל אלה יכולים להיות סימנים לפירוק מהיר של כדוריות דם אדומות וירידה חדה ברמת ההמוגלובין.
כיצד מטפלים באנמיה ובפירוק כדוריות הדם האדומות?
ברוב המקרים האנמיה איננה חמורה ולא יידרש כל טיפול. באם האנמיה הופיעה לאחר חשיפה לתרופה, הרופא המטפל ישקול את הקשר לתרופה ואת הצורך להפסיקה. לעיתים רחוקות קצב פירוק כדוריות הדם האדומות מהיר ויש צורך במתן עירוי דם.
אז מה עושים ביומיום?
החוסר באנזים ה-G6PD אינו מסוכן אם מקפידים על מספר כללים:
- יש להימנע מאכילת פול .
- להימנע ממגע עם נפטלין (חומר המשמש נגד עש הבגד).
- יש להימנע מנטילת התרופות הבאות:
- Avlosulfon) Dapsone) - (דפסון - אבלוסולפון) - תרופה נדירה הניתנת במצבים של זיהומים מיוחדים אשר אינם מגיבים לטיפול אחר.
- Methylene Blue - (מתילן בלו) תרופה הניתנת רק באשפוז למצבים מאד מיוחדים.
- Macrodantin, Uvamin) Nitrofuantoin) - (ניטרופורנטוין - מקרודנטין, יובאמין) - אנטיביוטיקה בשימוש בעיקר בדלקות בדרכי שתן.
- Sedural) Phenazopyridine) - (פנזופירידין - סדורל) - תרופה הניתנת במצבים של דלקת בדרכי השתן לשם הקלת הכאב.
- Primaquine) Primaquine) - (פרימקווין) - תרופה הניתנת לטיפול ומניעת מלריה.
- Rasburicase - (רסבוריקאז) - תרופה הניתנת במסגרת טיפול במחלות ממאירות.
- Toluidine Blue - (טולידין בלו) - תרופה הניתנת לעיתים נדירות בזמן ביצוע הדמייה של בלוטת התריס.
- Septrin ,Resprim, Diseptyl, Sulfatrim) Trimethoprim/Sulfamethoxazole) - (סולפטרים, דיספטיל, רספרים, ספטרין) - אנטיביוטיקה בשימוש במצבים שונים. אין התווית נגד לשימוש בתרופה זו במינון רגיל בחולים חסרי האנזים G6PD. במינון מוגבר התרופה עלולה לגרום לפירוק כדוריות דם אדומות, לכן רצוי להעדיף טיפול חלופי במידת האפשר.
בכל טיפול רפואי (רופא מטפל, רופא שיניים, מתן זריקה, חיסון או כל טיפול אחר) יש ליידע את הרופא המטפל על העובדה שלילדכם חוסר באנזים G6PD.
האם קיימת מגבלה בהנקת ילד/ה עם חסר באנזים G6PD?
ההגבלות על האם המיניקה במצב זה הן מועטות.
- במידה ולילדך חסר באנזים G6PD - לא לאכול פול בכל תקופת ההנקה.
- לא להיניק תינוק חסר האנזים G6PD במידה והנך נוטלת את אחת התרופות שהוזכרו למעלה מכיוון שהן עלולות לעבור לתוך חלב האם ולגרום לאנמיה אצל התינוק היונק.
חשוב מאד
יש לידע את הרופא המטפל על החוסר באנזים בכל קבלת תרופה.
יש לשים לב בכל נטילת תרופה לשם החומר הפעיל בתרופה, מכיוון ששמות מסחריים משתנים ומתחדשים.
בכל חשיפה לאחד מהגורמים שהוזכרו (פול, נפטלין, תרופות) יש להיוועץ מיד עם הרופא המטפל.
ביבליוגרפיה
מקורות הספרות הקיימים לגבי טיפול תרופתי בחולים חסרי G6PD , על בסיסן בוצעה הסקירה
- Walz B, Riecken B. A young man with acute generalized jaundice and intermittent epigastric pain. [Abstract] Dtsch Med Wochenschr 2008;133: 129-32.
- Shahidi NT, Westring DW. Acetylsalicylic acid- induced hemolysis and its mechanism. J Clin Invest 1970;49: 1334-40.
- McCaffrey RP, Halsted CH, Wahab MFA, et al.. Chloramphenicol induced hemolysis in Caucasian glucose-6- phosphate dehydrogenase deficiency. Ann Intern Med 1971;74: 722-6.
- Chan TK, Chesterman CN, McFadzean AJ, et al. The survival of glucose-6-phosphate dehydrogenase-deficient erythrocytes in patients with typhoid fever on Chloramphenicol therapy. J Lab Med 1971;77: 177-84.
- Markowitz N, Saravolatz LD. Use of trimethoprim-sulfamethoxazole in a glucose-6-phosphate dehydrogenase deficient population. Rev Infect Dis 1987;Suppl2: S218-S225.
- ↑ 1.0 1.1 1.2 1.3 1.4 Cappellini MD, Fiorelli G. Glucose-6-phosphate dehydrogenase deficiency. Lancet 208;5: 64-74
- ↑ 2.0 2.1 2.2 2.3 2.4 Beutler E. G6PD deficiency. Blood 1994;843: 613-36
- ↑ 3.0 3.1 3.2 3.3 Alving AS, Carson PE, Flanagan CL, et al. Enzymatic deficiency in primaquine-sensitive erythrocytes. Science. 1956;124: 484-5.
- ↑ 4.0 4.1 4.2 4.3 4.4 4.5 Beutler E. The hemolytic effect of Primaquine and related compounds. A review. Blood 1959;14: 103-39.
- ↑ 5.0 5.1 5.2 5.3 Mason PJ. New insights into G6PD deficiency. Br J Haematol 1996;94: 585-91.
- ↑ 6.0 6.1 6.2 Burka ER. Infectious disease: a cause of hemolytic anemia in glucose-6 phosphate dehydrogenase deficiency. Ann Intern Med 1969;70: 222-5.
- ↑ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 7.7 Beutler E. Glucose-6- phosphate dehydrogenase deficiency. N Engl J Med 1991;324: 169-74.
- ↑ Lichtman MA, Beutler E, Kipps TJ, et al. Williams hematology. 7th ed. USA: McGraw-Hill; 2006.
- ↑ Kliegman RM, Behrman RE, Jenson HB &Stanton BF. Nelson textbook of pediatrics. 18th ed. Philadelphia: WB Saunders Co; 2007
- ↑ 10.0 10.1 Fauci AS, Braunwald E, Kasper DL, et al. Harrison's principles of internal medicine, 17th Ed. USA: McGraw-Hill; 2008
- ↑ 11.0 11.1 11.2 Beutler E. Abnormalities of the hexose monophosphate shunt. Semin Hematol 1971;8: 311-347
- ↑ Rosen PJ, Johnson C, Mcgehee WG et al. Failure of methylene blue treatment in toxic methemoglobinemia. Association with glucose-6-phosphate dehydrogenase deficiency. Ann Intern Med 1971;75: 83-6
- ↑ Gauthier TW. Methylene blue-induced hyperbilirubinemia in neonatal glucose-6-phosphate dehydrogenase (G6PD) deficiency. J Matern Fetal Med 2000;9: 252-4
- ↑ Foltz LM, Dalal BI, Wadsworth LD, et al. Recognition and management of methemoglobinemia and hemolysis in a G6PD-deficient patient on experimental anticancer drug Triapine. Am J Hematol 2006;81: 210-211
- ↑ Mandi G, Witte S, Meissner P, et al. Safety of the combination of chloroquine and methylene blue in healthy adult men with G6PD deficiency from rural Burkina Faso. Trop Med Int Health 2005;10:32-8
- ↑ 16.0 16.1 16.2 Meissner PE, Mandi G, Witte S, et al. Safety of the methylene blue plus chloroquine combination in the treatment of uncomplicated falciparum malaria in young children of Burkina Faso. Malar J 2005;4: 45 שגיאת ציטוט: תג
<ref>בלתי־תקין; השם "הערה16" הוגדר מספר פעמים עם תוכן שונה- ↑ 17.00 17.01 17.02 17.03 17.04 17.05 17.06 17.07 17.08 17.09 17.10 Chan TK, Todd D, Tso SC. Red cell survival studies in glucose-6- phosphate dehydrogenase deficiency. Bull Hong Kong Medical Association 1974;26: 41-8
- ↑ 18.0 18.1 18.2 Chan TK, Todd D,Tso SC. Drug-induced haemolysis in glucose-6-phosphate dehydrogenase deficiency. Br Med J 1976;2: 1227-1229
- ↑ 19.0 19.1 Lavelle KJ, Atkinson KF, Kleit SA. Hyperlactatemia and hemolysis in G6PD deficiency after nitrofurantoin ingestion. Am J Med Sci 1976;272: 201-4
- ↑ 20.0 20.1 20.2 20.3 20.4 20.5 20.6 Herman J, Ben-Meir S. Overt hemolysis in patients with glucose-6- phosphate dehydrogenase deficiency: a survey in general practice. Isr J Med Sci 1975;11; 340-46
- ↑ Powell RD, DeGowin RL, Alving AS. Nitrofurantoin-induced hemolysis. J Lab Clin Med 1963;62: 1002-3
- ↑ Mercieca JE, Clarke MF, Phillips ME, et al. Acute haemolytic anaemia due to phenazopyridine hydrochloride in G-6-PD deficiency subject. Lancet 1982;2: 564
- ↑ Tishler M, Abramov A. Phenazopyridine-induced hemolytic anemia in a patient with G6PD deficiency. Acta Haematol 1983;70(3): 208-9
- ↑ Galun E, Oren R, Glikson M, et al. Phenazopyridine-induced hemolytic anemia in G-6-PD deficiency. Drug Intell Clin Pharm 1987;21: 921-2
- ↑ Jeffrey WH, Zelicoff AP, Hardy WR. Acquired methemoglobinemia and hemolytic anemia after usual doses of phenazopyridine. Drug Intell Clin Pharm 1982;16: 157
- ↑ Noonan HM, Kimbrell M, Ben Johnson WB, et al. Phenazopyridine-induced hemolytic anemia. Urology 1983;21: 623-624
- ↑ Nathan DM, Siegel AJ, Bunn HF. Acute methemoglobinemia and hemolytic anemia with phenazopyridine: possible relation to acute renal failure. Arch Internal Med 1977;137: 1636-8
- ↑ Fincher ME, Campbell HT. Methemoglobinemia and hemolytic anemia after phenazopyridine hydrochloride (Pyridium) administration in end-stage renal disease. Southern Medical Journal 1989;82: 372-4
- ↑ Charles LJ. Observations on the haemolytic effect of primaquine in 100 Ghanaian children. Ann Trop Med Parasitol 1960;54: 460-70
- ↑ Greenberg MS, Wong H. Studies on the destruction of glutathione-unstable red blood cells. The influence of fava beans and primaquine upon such cells in vivo. J Lab Clin Med 1961;57: 733-46
- ↑ George JN, Sears DA, McCurdy PR, et al. Primaquine sensitivity in Caucasians: hemolytic reactions induced by primaquine in G-6-PD deficient subjects. J Lab Clin Med 1967;70: 80-93
- ↑ 32.0 32.1 Krudsood S, Wilairatana P, Tangpukdee N, et al. Safety and tolerability of elubaquine [bulaquine, CDRI 80/53] for treatment of Plasmodium vivax malaria in Thailand. Korean J Parasitol 2006;44: 221-8
- ↑ Degowin RL, Eppes RB, Powel RD, et al. The haemolytic effects of diaphenylsulfone [DDS] in normal subjects and in those with glucose-6-phosphate-dehydrogenase deficiency. Bull WHO 1966;35: 165-179
- ↑ Grossman S, Budinsky R, Jollow D. Dapsone-induced hemolytic anemia: role of glucose-6-phosphate dehydrogenase in the hemolytic response of rat erythrocytes to N-hydroxydapsone. J Pharmacol Exp Ther 1995;273: 870-7
- ↑ Sheehy TW: Supplemental sulfone (Dapsone) therapy. Arch Intern Med 1967; 119: 561
- ↑ Fanello CI, Karema C, Avellino P, et al. High risk of severe anaemia after chlorproguanil-dapsone+artesunate antimalarial treatment in patients with G6PD [A-] deficiency. PLoS ONE 2008;3: e4031
- ↑ Brant JM. Rasburicase: an innovative new treatment for hyperuricemia associated with tumor lysis syndrome. J oncol nurs 2002;6: 12-16
- ↑ Browning LA, Kruse JA. Hemolysis and methemoglobinemia secondary to Rasburicase administration. The annals of pharmacotherapy 2005;39; 1932-5
- ↑ Marquez A, Todd M. Acute hemolytic anemia and agranulocytosis following intravenous administration of toluidine blue. Am Pract Dig Treat1959;10: 1548-50
- ↑ Teunis BS, Leftwich EI, Pierce LE. Acute methemoglobinemia and hemolytic anemia due to Toluidine Blue. Arch Surg 1970;101: 527-531
- ↑ Cottafava F, Nieri S, Franzone G, et al. Double blind trial between placebo and Paracetamol in children with G6PD deficiency. Ped Med Chir 1990;12: 631-8
- ↑ Sklar GE. Hemolysis as a potential complication of acetaminophen overdose in a patient with glucose-6-phosphate dehydrogenase deficiency. Pharmacotherapy 2002;22: 656-8
- ↑ Wright RO, Perry HE, Shannon NW. Hemolysis after acetaminophen overdose in a patient with glucose-6-phosphate dehydrogenase deficiency. J Toxicol Clin Toxicol 1996;34: 731-4
- ↑ Stockman JA, Lubin B, Oski FA. Aspirin-induced hemolysis: the role of concomitant oxidant [H2O2] challenge. Pediatr Res 1978;12: 927-31
- ↑ Shalev O. Long-term low-dose aspirin is safe in glucose-6- phosphate dehydrogenase deficiency. DICP 1991;25: 1074-5
- ↑ Kanetaka T, Oda T. Toxic liver injuries. Acta Pathol Jpn 1973;23:617-27
- ↑ 47.0 47.1 Prankerd TAJ. Hemolytic effects of drugs and chemical agents. Clin Pharmacol Ther 1963;4: 334-50
- ↑ Campbell GD, Steinberg MH, Bower JD. Letter. Ascorbic acid induced hemolysis in G6PD deficiency. Ann Intern Med 1975;82: 810
- ↑ Udomratn T, Steinberg MH, Campbell GD Jr, et al. Effects of Ascorbic acid on glucose-6-phosphate dehydrogenase-deficient erythrocytes: studies in an animal model. Blood. 1977;49: 471-5
- ↑ Barkshi S, Singh J. Acute hemolytic anemia in typhoid fever. Indian J Pediatr 1972;39: 270-3
- ↑ Choudhry VP, Ghafary A, Zaher M, et al. Drug-induced haemolysis and renal failure in children with glucose-6-phosphate dehydrogenase deficiency in Afghanistan. [Abstract] Ann Trop Paediatr 1990;10: 335-8
- ↑ Gaetani GD, Mareni C, Ravazzolo R, et al. Haemolytic effect of two sulphonamides evaluated by a new method. Br J Haematol 1976;32: 183-91
- ↑ Gerr F, Frumkin H, Hodgins P. Hemolytic anemia following succimer administration in glucose-6-phosphate dehydrogenase deficient patient. Clin Toxicol 1994; 32(5): 569-575
- ↑ Graziano JH, Lolacono NJ, Moulton T, et al. Controlled study of meso-2,3-dimercaptosuccinic acid for the management of childhood lead intoxication. J Pediatr 1992;120: 133-9
- ↑ Rajkondawar VL, Modi TH, Mishra SN. Drug induced acute haemolytic anaemia in glucose-6-phosphate dehydrogenase deficiency subjects. J Assoc Physicians India 1968;16: 589-93.
- ↑ Abbate SL, Hoogwerf BJ. Hemolytic anemia associated with Sulfonylurea use. Diabetes Care 1990;13: 904-5.
- ↑ Meloni G, Meloni T. Glyburide-induced acute hemolysis in a G6PD-deficient patient with NIDDM. Br J Haematol 1996 Jan;92: 159-60.
- ↑ Vinizo S, Andres E, Perrin AE, et al. Glibenclamide-induced acute hemolytic anemia revealing a G6PD-deficiency. Diabetes Res Clin Pract 2004;64: 181-3
- ↑ McCurdy PR, Donohoe RF. Pyridoxine-responsive anemia conditioned by Isonicotinic acid hydrazide. Blood 1966;27: 352-362
- ↑ Aderka D, Garfinkel D, Bograd H, et al. Isosorbide dinitrate-induced hemolysis in G6PD-deficient subjects. Acuta Haemat 1983; 69: 63-64.
- ↑ Mandal BK, Stevenson J. Letter. Hemolytic crisis caused by nalidixic acid. Lancet 1970;1: 614.
- ↑ Belton EM, Jones RV. Letter. Hemolytic anemia due to nalidixic acid. Lancet 1965;2: 691.
- ↑ 63.0 63.1 Oh YR, Carr-Lopez SM, Probasco JM, et al. Levofloxacin-induced autoimmune hemolytic anemia. Ann Pharmacother 2003 ;37: 1010-3.
- ↑ Lim S, Alam MG. Ciprofloxacin-induced acute interstitial nephritis and autoimmune hemolytic anemia. Ren Fail 2003;25: 647-51.
- ↑ Carmoi T, Bordier L, Bonnefoy S, et al. Ofloxacin is contraindicated in case of G6PD deficiency: is it evidenced based? Rev Med Interne 2009;30: 355-7.
- ↑ 66.0 66.1 Dern RJ, Beutler E, Alving AS. The hemolytic effect of primaquine. J Lab & Clin Med 1955;45: 30-39.
- ↑ Wood WB Jr. Anemia during sulfanilamide therapy. JAMA 1938;11: 1916-19.
- ↑ Wintrobe M. Clinical hematology, Philadelphia 1951; Lea & Febringer p. 434.
- ↑ Szeinberg A, Pras M, Sheba C, et al. The hemolytic effect of various sulfonamides on subjects with a deficiency of glucose-6-phosphate dehydrogenase of erythrocytes. Isr J Med Sci 1959;18: 176.
- ↑ Cohen SM, Rosenthal DS, Karp PJ. Ulcerative colitis and erythrocyte G6PD deficiency. Salicylazosulfapyridine-provoked hemolysis. JAMA 1968;205: 528-30.
- ↑ Kaplinsky N, Frankl O. Salicylazosulphapyridine-induced Heinz body anemia. Acta Haematol 1978;59: 310-4.
- ↑ Chan TK, McFadzean JS. Hemolytic effect of trimethoprim-sulfamethoxazole in G6PD deficiency. Trans R Soc Trop Med Hyg 1974;68: 61-2.
קישורים חיצוניים
- נייר עמדה זה נכתב על סמך סקירה זו
- Youngster I, Arcavi L, Schechmaster R, Akayzen Y, Popliski H, Shimonov J, Beig S, Berkovitch M. Medications and glucose-6-phosphate dehydrogenase deficiency: an evidence-based review. Drug Saf. 2010 Sep 1;33(9):713-26.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק