טרומבוספונדין - Thrombospondin - 2
| מדריך בדיקות מעבדה | |
| טרומבוספונדין-2 | |
|---|---|
| Thrombospondin-2 | |
| שמות אחרים | TSP2 , CISP (corticotropin-induced secreted protein), THBS2 |
| מעבדה | כימיה בדם |
| תחום | אינטראקציה בינתאית, מדד לגילוי מוקדם של סרטן בלוטת הלבלב, עיכוב אנגיוגניות |
| טווח ערכים תקין | 12-17 ננוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
Thrombospondins
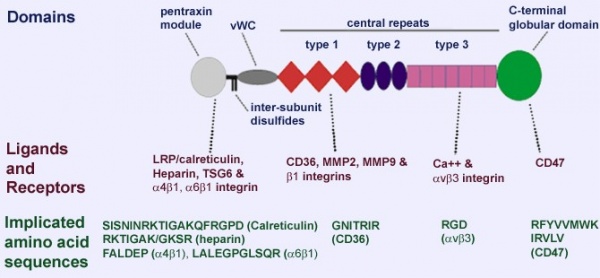
טרומבוספונדינים הם גליקו-פרוטאינים המורכבים ממספר מקטעים הפועלים על פני תאים ובמרווח ה-ECM (extracellular matrix). TPS-2 הוא גליקופרוטאין קושר-סידן בעל משקל מולקולארי של 150 קילו-דלטון, ומשמש כמווסת של אינטראקציה בין-תאית בבעלי חוליות (Bornstein ו-Sage ב-Curr Opin Cell Biol משנת 2002, Murphy-Ullrich ב-J Clin Invest משנת 2001, Armstrong ו- Bornsteinב-Matrix Biol משנת 2003, ו-Elzie ו- Murphy-Ullrich ב- Int J Biochem Cell Biol משנת 2004). הטרומבוספונדינים מתחלקים ל-2 תת-משפחות, A ו-B, בהתאם למבנה המולקולרי שלהם. 2 הטרומבוספונדינים, TSP1 ו-TSP2, מכילים מקטע N טרמינאלי, מקטע vWC, שלושה רצפים חוזרים על עצמם (repeats) של TSP1, שלושה מקטעים דמויי EGF, שלושה מקטעים חוזרים על עצמם של TSP3, ומקטע C טרמינאלי. שני טרומבוספונדינים אלה הם טרימרים מכונסים בקשרי –S-S-. (תרשים למטה)
תת המשפחה B של טרומבוספונדינים המסומנים כ-TSP-3 ו-TSP-4, וכן COPP או cartilage oligomeric matrix protein הידוע גם כ-TSP-5, נבדלים בכך שהם מכילים אזורים N-טרמינאליים ייחודיים, בכך שהם חסרים את מקטע vWC, וכן את ה-TSP1 repeats, ומכילים 4 עותקים של מקטעים דמויי-EGF, והם מכונסים כפנטמרים. הגן THBS2 המקודד ל-TSP2 זוהה במקור על ידי סריקה של ספריית פיברובלסטים מאדם. הגן ממוקם בעמדה 6q27 והוא מכיל 23 אֶקסונים, כאשר גודלו 38,261 בסיסים. ה-cDNA המקודד ל-TSP2 מראה הומולוגיה ניכרת לזה המקודד ל-TSP1.
ה-cDNA של TSP2 אנושי מקודד לקודמן (precursor) בעל משקל מולקולארי של 129,955 דלטון המכיל 1,172 חומצות אמינו, הכולל רצף-איתות (signal sequence) בן 18 חומצות אמינו, המלווה על ידי מקטע N-טרמינאלי קושר הפארין, ולאחריו motif של אוליגומריזציה, מקטע vWC בודד, שלושה repeats של TSP type-1, שלושה repeats דמויי-EGF, שבעה repeats של TSP type-3, וקצה C טרמינאלי דמוי לקטין (LaBell ו-Byers ב-Genomics משנת 1993). ה-TSP2 האנושי הוא בעל זהות של 88-90% ברצף עם ה-TSP2 ממקור בקר, עכבר וחולדה. TSP2 מווסת את יצירת משתית הקולאגן על ידי שינוי התנהגות הפיברובלסטים במהלך ההתפתחות העוברית אך גם בתחומים של תהליכי remodeling ביצור הבוגר (Kyriakides וחב' ב- J Histochem Cytochemמשנת 1998, ו- Anilkumar וחב' ב-J Cell Sci משנת 2002).
פעילות פיזיולוגית של TSP2
מחקרים הראו שעכברים טרנסגניים נטולי TSP2 היו נורמאליים למראית עין בהיותם עירניים ופוריים אם כי למעשה הכילו מספר שינויים פנוטיפיים. האחרונים כללו אי-סדירות ברקמת החיבור שהתבטאה בעור שביר, גידים וליגמנטים רפויים, וכוח-מתיחה מופחת, הכרוכים בפגם בפיברילו-גנזה של קולאגן. זנבם של עכברים אלה היה גמיש באופן בלתי-רגיל, ועצמותיהם הארוכות היו עבות ודחוסות יותר מהרגיל במיוחד בחלק הפנימי של עצמות אלו (Hankenson ב-Bone משנת 2006). עכברים מוטנטים אלה הראו גם זמני דימום לא רגילים, ונמצא בהם גידול במספר כלי הדם מה שמצביע על פעילות אנטי-אנגיוגנית של TSP2. עדות נוספת התומכת ביכולת TSP2 לעכב אנגיוגנזה מגיעה על ידי הזרקת גידולים מסוג קרצינומת תאי קשקש (SCC) המבטאים באופן יציב TSP2, לתוך הדרמיס של עכברים nude, מה שהביא לעיכוב של הגידול הסרטני. האזורים סביב הגידולים המבטאים TSP2 היו נקרוטיים בה בשעה שהצפיפות ומספר כלי הדם בגידולים אלה היו מופחתים. מספר פגמים נצפו בתגובות של עכברים החסרים TSP2 למספר עקות ספציפיות. נצפתה בהם עליה בתגובה דלקתית של העור, הגברה בצפיפות הווסקולארית בדרמיס, ברקמת השומן ובבלוטת ההרת (טימוס). פיברובלסטים שבודדו מעכברי TSP2 Null היו פגומים בכושר הספיחה שלהם. במודלים של תגובה לפציעה, עכברים אחרונים אלה, היו בעלי וסקולאריות מוגברת של אזורי הפציעה, עם פעילות מוגברת של MMP2 ושל MMP9, ונמצאה בהם יכולת מוגברת של ריפוי פצעים.
הטרימריזציה של TSP2 נחוצה להתקשרות התלויה-בסידן של חלבון זה לתאים, וליכולת ההתרופפות התאחיזה הבינתאית, בעוד שהמקטע הקושר-הפארין אחראי ליכולת ההתנתקות של התאים מנקודות התאחיזה שלהם (Misenheimer וחב' ב-Biochemistry משנת 2003, ו- Murphy-Ullrich וחב' ב-J Biol Chem משנת 1993). המקטע הקושר-הפארין מתווך גם בקישור של TSP2 ל-integrin α3β1 ול-integrin α6β1 על פני תאי אנדותל בכלי דם נימיים, וכן בקישור ל-integrin α4β1 על פני כלי-דם גדולים ( Calzada וחב' ב-Circ Res משנת 2004, ו-Calzada וחב' ב-J Biol Chem משנת 2003). שלושה פרגמנטים של TSP2 (מקטע קושר-הפארין, oligomerization motif ומקטע vWC) מסייעים להישרדות של תאי אנדותל, לשגשוגם ולכימוטקסיס שלהם. בגוף, TSP-2 באורך מלא חוסם תהליכי אנגיוגנזה של הגידול הסרטני, ומשרה אפופטוזיס של תאי אנדותל וסקולאריים (Noh וחב' ב- J Invest Dermatol משנת 2003, ו-Streit וחב' ב-USA Proc Natl Acad Sci ב-1999). כמו כן, TSP2 נקשר ל-MMP-2 ומסייע לפינוי של MMP-2 על ידי הקולטן ה-scavenger הידוע כ-LRP (Yang וחב' ב-J Biol Chem משנת 2001.) HPRG פועל כקולטן "הסחה" (decoy) על ידי מניעת האינטראקציה של TSP2 עם CD36 על פני מקרופאגים ועל פני תאי אנדותל בכלי דם קטנים (Simantov וחב' ב-Matrix Biol משנת 2005).
הסינתזה של TSP2 מתרחשת בעיקר ברקמות חיבור של העובר המתפתח אך גם ביצור הבוגר, כאשר באחרון TSP2 מיוצר גם בתגובה לפציעה רקמתית וכן בהקשר להופעת גידולים סרטניים. למרות אי הסדירויות בפיברילוגנזה של קולאגן, שבירות עור, רִפְיוֹן גידים וסיבים שמוצאים בעכברים טרנסגניים החסרים TSP2, לא נראה ש-TSP2 תורם ישירות לשלמות המבנית של אלמנטים ברקמת החיבור. כחלופה, עדויות חדשות תומכות במנגנון פעולה "ממרחק" של TSP- 2, דהיינו על ידי מודולציה של פעילות וביו-זמינות של פרוטאזות וגורמי גדילה בסביבה הפרי-תאית, וכנראה על ידי אינטראקציה עם קולטנים על פני תאים. הביטוי הבולט ביותר של TSP2 מופיע ברקמת העצם.
בעכברים החסרים TSP2 מוצאים תבנית בלתי-אופיינית של יצירת החלק הפנימי (endocortical) ומעטפת העצם (periosteal) בתגובה למעמסה מכנית. הביטוי של TSP2 נמצא במחקרים שונים במספר סוגי סרטן כגון סרטן שד פולשני, מלנומה ממאירה מפושטת, הפרשות פלאורליות ממאירות, בצוואר הרחם של עכברות הרות, באי-ספיקה מוחית, בסרטן אגרסיבי של שחלות, בסרטן קיבה, בקרצינומה של תאי כליה, בסרטן של האנדומטריום, בסרטן המעי הגס, בסרטן עור מושרה על ידי כימיקלים, באוסטאו-סרקומה, באדנומה המיוצרת בהשפעת אלדוסטרון בתלות ב-ACTH ובסרטן הוושט. לעומת זאת, חלה ירידה בסינתזה של TSP2 בקרצינומה של השחלות מסוג serous papillary, בקרצינומה של בלוטות הרוק, בסרטן פולשני של צוואר הרחם, וב- NSCLC. (Oshika וחב' ב-Clin Cancer Res משנת 1998).
הצורה המופרשת הבשלה של TSP2 מכילה את השיירים 19-1,172 של הקודמן, והיא בעלת משקל מולקולרי 150–160 קילו-דלטון ומכילה 7 אתרי קישור דמויי-אספרגין (Asn) אליהם קשורות שרשרות אוליגו-סכרידיות, כמו גם מספר משתנה של שיירי טריפטופן (Trp) המעגנים שרשרות סוכריות בהן mannose הוא הסוכר הנקשר ל-type-1 repeats. ניתוח המבנה הגבישי בעזרת קרני-X של הקצה ה-C טרמינאלי של TSP2, העלה שכאשר ה-type-3 repeats גדושים עם סידן, הם עוטפים את המקטע הגלובולרי ה-C טרמינאלי. המודולים המבניים של TSP2 דומים לאלה של TSP1, עם גרדיאנט גדל של הומולוגיה מרצף חומצות האמינו החל מהקצה ה-N טרמינאלי (זהות של 38%) וכלה במקטע ה-C טרמינאלי (82% זהות) (Bornstein וחב' ב-J Biol Chem משנת 1991, ו-Laherty וחב' באותו כתב עת משנת 1992). תבניות הביטוי של TSP1 ו-TSP2 ברורות אך גם שונות ברקמות עובריות בהשוואה לעכברים מתפתחים (Liska וחב' ב-J Cell Physiol משנת 1994).
Chen וחב' תיארו בשנת 1996 ב-J Biol Chem שהם בטאו את TSP2 של עכבר במערכת של נגיף baculo כהומוטרימר המחובר בקשרים די-סולפידיים, הם מצאו ש-TSP2 מסייע לספיחה לתאי אנדותל, לתאי osteosarcoma, ולתאי קרצינומה של המעי הגס על ידי מנגנונים דומים אך לא זהים לאלה של TSP1. הספיחה של TSPs לתאים אלה עושה שימוש בפרוטאוגליקן דוגמת heparan sulfate, וכן αβ3 integrin והיא מווסתת על ידי +2Ca. אחד ההבדלים העיקריים בין פעילויות הספיחה של TSP1 ו-TSP2 היא הרגישות הדיפרנציאלית של שני TSPs אלה לעיכוב הספיחה על ידי הפארין. במערכת ספיחה אחרת, בה תאים אדרנו-קורטיקאליים משמשים כמקור, TSP2 ממקור בקר (הידוע גם כ-SICP או corticotropin-induced secreted protein) מראה תכונות מעכבות ספיחה (Pellerin וחב' ב-Mol Cell Endocrinol משנת 1994).
כיוון ש-TSP1 הוא בעל פעילויות ביולוגיות מגוונות, ואילו TSP2 בנוסף לתפקודיו הייחודיים, יכול לווסת את תפקודי TSP1, ניתן לשער שהיחס של TSP1 ל-TSP2 בעיקר בתחום ריכוזיהם מווסת על ידי ביטויים ותקופת מחצית החיים שלהם. TSP1 מופרש מתוך ה-α granules של טסיות-דם, בשעת השפעול של תאים אלה (Mosher ב-Ann Rev Biochem משנת 1990, ו-Lowler וחב' ב-J Biol Chem משנת 1978). TSP1 מיוצר גם על ידי שורות תאים נורמאליות ומותמרות (Raugl וחב' ב-J Cell Biol משנת 1982, ו-Jaffe וחב' ב-Proc Natl Acad Sci USA משנת 1983), בעוד שהיצירה של TSP1 מוגברת באופן דרמטי על ידי גורמי גדילה, הרי שהביטוי של TSP2 הוא קונסטיטוטיבי (Bornstein וחב' ב-Proc Natl Acad Sci USA משנת 1991). נמצא ש- TSP1 ממקור טסיות יכול להיקשר לתאים ולחדור למשתית החוץ-תאית (ECM) (על ידי McKeown וחב' ב-J Cell Biol משנת 1984, ו-Murphy-Ullrich ו-Mosher ב-Semin Thromb Hemostasis משנת 1987), או להיות מפונה על ידי תאים דרך אנדוציטוזה ופירוק בתוך הליזוזומים (Sun וחב' ב-Semin Thromb Hemostasis משנת 1992, ו- Murphy-Ullrich וחב' ב-J Biol Chem משנת 1988, ו-Godyna וחב' ב-J Cell Biol משנת 1995).
מחקריו של Paul Bornstein וקבוצתו ב-J Biol Chem משנת 1991, מרמזים ליכולת של TSP2 להיקשר למגוון קולטנים כגון CD36 ,CD47,heparan sulfate ,LRP ,GPIIb/IIIa וכן למספר integrins. ממצאים אלה אושרו על ידי Chen וחב' ב-J Biol Chem משנת 1996.
אחד התנאים ליכולת הקישור של TSP1 לפני תאים, החדרתו לתוכם ופירוקו בליזוזומים הוא heparan sulfate של ממברנת התאים, שותף סינרגיסטי ל-heparan sulfate במנגנון האחרון הוא LRP או low density lipoprotein receptor-related protein. ניתן לשער על סמך ההומולוגיה בין TSP1 ו-TSP2 שהמטבוליזם של שניהם דומה. אך מסתבר שמקטע הקצה ה-N טרמינאלי המתווך בקישור להפארין הוא דווקא המקטע עם ההומולוגיה הנמוכה ביותר בין 2 חלבונים אלה. לכן, ניתן גם לשער שהמטבוליזם של TSP1 ו-TSP2 שונה. לכן בחנו Chen וחב' נושא שה ודווחו על ממצאיו ב-J Biol Chem משנת 1995. כאשר סומן בעזרת יוד רדיו-אקטיבי TSP2 ריקומביננטי מעכבר, הוא נקשר לתאי 3T3, הוא הופנם לתוך תאים אלה והתפרק במסלול שניתן לעכב על ידי chloroquine.
נמצא ש-TSP1 אנושי, TSP1 ריקומביננטי מעכבר ו-TSP2 ריקומביננטי מעכבר, התחרו זה בזה במהלך הדגרדציה בתוך תאי 3T3. הפירוק של TSP2 היה פחות רגיש לעיכוב על ידי הפארין מאשר הפירוק של TSP1. נתון זה הוא בהסכמה עם ההבדלים בזיקת TSP1 ו-TSP2 להפארין. הפירוק התוך-תאי של TSP2 נמצא אטי יותר בתרביות של תאים של תאי שחלה של Chinese hamster (או CHO) מאשר בתרביות תאי 3T3 החסרים heparan sulfate או בתאים המטופלים עם האנזים heparitinase בהשוואה לתאים לא מטופלים. הפירוק של TSP2 עוכב על ידי נוגדנים כנגד LRP, או על ידי 39KDa receptor-associated protein שהוא אנטגוניסט ידוע של LRP. מחקר זה מצביע על כך ש-TSP1 ו-TSP2 עוברים מטבוליזם על ידי מנגנון משותף של הפנמה אל תוך התא (internalization), המסתייע על ידי heparin sulfate ו-LRP.
TSP2 ואנגיוגניות
מחקרים מראים ש-TSP2 מסוגל לעכב את תהליך ה-angiogenesis על ידי הגבלת השגשוג של תאי אנדותל בכך שהוא משרה בתאים אלה אפופטוזיס. TSP2 יכול להיות פעיל במודולציה של אנזימי MMP ובכך להשפיע על ההרכב של המשתית החוץ-תאית (ECM). מחקרם של Krady וחב' ב-Am J Pathol משנת 2008, נועד לבחון את ההשערה לפיה TSP2 מסוגל על ידי וויסות MMPs להשפיע על האינטראקציה בין תאי אנדותל לבין ECM. חוקרים אלה הראו ש TSP2, אך לא TSP1, הגביל angiogenesis על ידי הפחתת הפעילות הג'לטינוליטית in situ. בחינה של תפקיד TSP2 באנגיוגניות פיזיולוגית in vivo, על ידי כְּרִיתָה של עורק הירך השמאלי בעכברים מהונדסים גנטית המשוללים TSP-2 בהשוואה לעכברי-בר, העלתה שבעכברים משוללי TSP2 היה שיקום מואץ של זרימת הדם, שניתן לייחס בחלקו ליצירה מוחשת של רשת עורקית בשרירי החלק העליון של הרגל דווקא בעכברים ללא TSP2. השינויים הנצפים נכרכו בביטוי טמפורלי של TSP2 בשריר האיסכמי של עכברי הבר. סך התצפיות המתוארות מוליכות למסקנה שהפעילות בה TSP-2 גורם למודולציה של של ECM, היא חלק מהמנגנון דרכו מעוכב תהליך האנגיוגניות הפיזיולוגי.
המשמעות של רמת TSP2 בגילוי מוקדם של pancreatic ductal adenocarcinoma (או PDAC)
סרטן בלוטת הלבלב הוא סוג הסרטן הרביעי במעלה בגרימת מוות בארצות הברית, מאובחן לרוב בשלביו המאוחרים, כאשר טיפול מרפא כבר בלתי אפשרי. מדי שנה מתגלים בארצות הברית כ-53,000 מקרים חדשים של המחלה. Zaret וחב' מ-Penn ו-Petersen וחב' ב-Mayo Clinic זיהו שילוב של 2 סמנים שעשויים לאפשר גילוי מוקדם של סרטן הלבלב (Sci Transl Med משנת 2017). זיהוי 2 סמנים אלה רלוונטי בעיקר באלה עם גורם סיכון מוגבר לסרטן הלבלב כגון אלה עם בן-משפחה מקרבה ראשונה שלקה במחלה, או אלה הלוקים באופן פתאומי בסוכרת מעל גיל 50 שנה. מחקר זה הסתייע בתצפית משנת 2013 על ידי Kim במעבדתו של Zaret, שיצר מודל תאי אנושי של התקדמות סרטן הלבלב, על ידי שימוש בתאי גזע ליצירת שורת-תאים (cell line) שמקורה היה מטופל עם PDAC בשלב מתקדם. תאים אלה בתרבית, הפרישו 2 סמנים כבר בשלבים המוקדמים של PDAC.
תוך שימוש בשיטת ELISA נבחנו דגימות פלזמה ממטופלים עם דרגות שונות של PDAC, כמו גם ממטופלים עם מחלת לבלב שפירה, וכן מביקורת של אנשים בריאים. סך הכול השתתפו במחקר 749 נבדקים: 20 מתוכם ב-phase 1 של המחלה, 189 מתוכם ב-phase 2a של המחלה, ו-537 מתוכם ב-phase 2b של המחלה.
חוקרים במרכז הרפואי Beth Israel Deaconess בראשות Libermann זיהו וגם תיקפו דרך לזיהוי מוגבר סרטן הלבלב ולהבדילו ממחלת לבלב בלתי ממאירה, במאמר שפורסם ב-2017 ב-Oncotarget. על פי Libermann, כיוון שבלמעלה מ-90% ממקרי סרטן הלבלב הם מתגלים כבר בשלב הגרורתי של המחלה כאשר ישנן רק חלופות טיפוליות מצומצמות, יש לגילוי מוקדם של המחלה השפעה משמעותית על הערכת תוחלת החיים של הלוקים בסרטן הלבלב. כושר הניבוי וההבדלה בין סרטן בלוטה בשלביו המוקדמים לבין נגעים פנקראטיים שפירים או בלוטת לבלב תקינה לחלוטין נקבע במחקר זה כבעל רגישות של 94-95% וספציפיות של 89-90%.
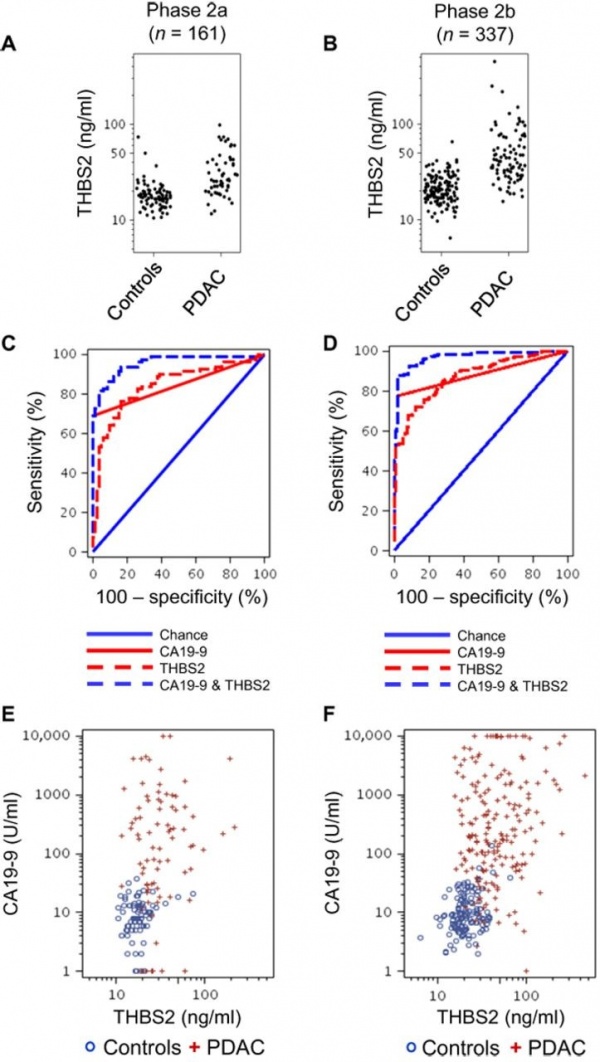
A) ריכוזי THBS2 (TSP2) בנסיוב של אנשים בריאים ובחולים עם PDCA בשלב IIa של המחלה;
B) בשלב IIb של המחלה;
C ו-D) עקומות ROC של חולים עם PDAC בשלב IIa ו-IIb בהתאמה, בהשוואה לבריאים;
E ו-F –ריכוזי CA19-9 ביחס ל-THBS2 בבריאים ובחולים בשלב IIa (E) ובשלב IIb של המחלה (F).
התפקיד של TSP2 כמווסת אקסוגני של אנגיוגניות ודלקת בגלומרולו-נפריטיס (Daniel וחב' ב-J Am Soc Nephrol משנת 2007)
החלבון TSP2 מבוטא במהלך התפתחות הכליות (Iruela-Arispe וחב' ב-Dev Dyn משנת 1993), אך נראה שהמבנה והתפקוד של הכליה הבשלה אינם מושפעים בעכברים טרנסגניים משוללי TSP2 (על פי Kyriakides ווחב' ב-J Cell Biol משנת 1998). בעכברים פגומים אלה מוצאים תהליך לא-סדיר של פיברילוגנזה של קולאגן בעור ובגידים, וצפיפות מוגברת של כלי-דם במספר רקמות, מה שמדגיש את תפקידו של TSP2 כמעכב אנגיוגניות in vivo. תפקידו של TSP2 נחקר במודל בעכברים של נפריטיס על רקע נוגדנים עצמיים ל-GBM או glomerular basement membrane, שהשווה עכברי-בר לעכברים טרנסגניים החסרים TSP2. העכברים ללא TSP-2 נבחנו לתפקוד הכליות, להתרחבות המשתית הקורטיקלית הכלייתית, להסננה של תאי דלקת, כמו גם לשגשוג ולאפופטוזיס וכן לדִּלּוּל הקפילרות לאחר השריית מחלת anti-GBM. בעוד שהקורטקס הכלייתי בעכברי הביקורת לא הראה כל צביעה ניתנת לגילוי של TSP2 מעל צביעת הרקע, הביטוי של חלבון זה היה בולט משמעותית במחלת anti-GBM. חסר של TSP2 הביא לתגובה דלקתית מוחשת ומוגברת, שבאה לביטוי בהסננה של תאי +CD4 וכן תאי +CD8 וכן מונוציטים ומקרופאגים.
בנוסף, נצפו שקיעה של פיברין גלומרולארי ותגובה של re-modeling של המשתית, שהשתקפו על ידי צביעה של קולאגנים מסוג I ו-IV, וכן תגובה של שגשוג בתוך האינטרסטיציום הכלייתי. שינויים אלה היו מלווים על ידי הגברה בפעילות האנזים MMP-2, וצביעה מוגברת של α-smooth muscle actin בעכברים החסרים TSP2. התגובה של שגשוג של האנדותליום הסב-אבובי (peritubular) הייתה מואצת ומוגברת, שהביאה למהפך בדלּוּל הקפילארי בעכברים נטולי TSP-2, בעוד שמותם של תאים אינטרסטיציאלים היה דומה לזה שנמצא בעכברי-בר. המסקנה של ניסוי זה הייתה שחסר של החלבון המשתיתי TSP2 בעכברים, החיש והגביר מספר תגובות לפגיעה כלייתית, תוך ההדגשה ש-TSP2 הוא מרכיב אנטי-אנגיוגני אנדוגני חשוב, בנוסף להיותו מווסת משמעותי של פעילות האנזים MMP-2 במחלת כליות.
התפקוד של TSP2 כמווסת אנדוגני של אנגיוגניות ודלקת ב-rheumatid arthritis (על פי Park וחב' ב-Am J Pathol משנת 2004)
מרבית התאים הרקמתיים בתרחיש של rhematoid synuvitis הם פיברובלסטים בנוזל הסינוביאלי. לא היה ידוע אם תאים אלה קשורים לתהליך האנגיוגניות, פיברובלסטים זוהו כמקור עיקרי של TSP2 (על פי Kyriakides וחב' ב-J Histochem Cytochem משנת 1998). נראה ש-TSP2 פחות חשוב לשלמות המבנית של המשתית, ועיקר תפקידו במודולציה של הזמינות והפעילות של גורמי-גדילה ואנזימים בסביבה הסב-תאית (Bornstein וחב' ב-Matrix Biol משנת 2000, ו-Lawler ב-Curr Opin Cell Biol משנת 2000, ו-Kyriakides ו-Bornstein ב-Thromb Haemost משנת 2003). ידוע שעכברים חסרי TSP2 הם בעלי אי-סדירות ברקמת החיבור, עם סדר לקוי של הפיברילות בקולאגן, צפיפות עצם מוגברת, ותפקוד לקוי של טסיות הדם הגורם לבעיות דימום (Kyriakides וחב' ב-J Cell Biol משנת 1998).
תפקידו של TSP2 כמעכב פיזיולוגי של אנגיוגניות תועד על ידי בעכברים חסרי TSP2 בהם נמצאה צפיפות מוגברת של קפילארות דם בדרמיס, ברקמת השומן התת-עורית ובטימוס, ואולי אף באופן מרשים יותר בתרחישים של מודלים בהם הושרתה פציעה, והתברר שהתגובה לפציעה זו ותהליך הריפוי היו מהירים, שהרי תהליכים אלה תלויים על וסקולריזציה מהירה (Agah וחב' ב-Am J Pathol משנת 2002). בעכברים חסרי TSP2 הייתה מוגברות דרמטית בהופעת קרצינומה של העור (Hawighorst וחב' ב-EMBO J משנת 2001). כמו ניכרה בעור של עכברים אלה תגובה דלקתית מתמשכת מהסוג של delayed-type hypersensitivity (על פי Lange-Asschenfeldt וחב' ב-Blood משנת 2002). המחקר של Park וחב' הראה ש-TSP-2 הוא בעל תפקיד רגולטורי במצבים דלקתיים כרוניים של RA. רקמות סינוביאליות עם תסנינים דלקתיים דיפוזיים הכילו רמות גבוהות של TSP2, בעוד שרקמות סינוביאליות עם צברים של תאי T ו-B יצרו TSP2 ברמות נמוכות. מחקר זה מצא שפרט לתכונות האנטי-אנגיוגניות של TSP2, חלבון זה עיכב גם את יצירתם של מתווכים מקדמי דלקת, אינטרפון-γ ו-TNF-α, וכמו כן הישרה המעטת מספרם של תאי T ברקמות.
רמות גבוהות של TSP2 כרוכות בפרוגנוזה גרועה במטופלים עם אי-ספיקת לב עם מקטע פליטה שמור (Kimura וחב' ב-Heart Vessels משנת 2016)
בלב היפרטנסיבי יש ביטוי גבוה של TSP2. בלב היפרטנסיבי מזהים לעיתים קרובות פיברוזיס אינטרסטיציאלית, וזהו מאפיין של הלב המצוי באי-ספיקה עם מקטע פליטה שמור (HFpEF). חוקרים אלה יצאו מהנחה שרמות גבוהות של TSP2 בנסיוב, יכולות לנבא פרוגנוזה גרועה של חולים עם HFpEF. במחקר זה נמדדו בנסיוב רמות TSP2 בשיטת ELISA ב-150מטופלים עם HFpEF, ונמצאה בהם רמה ממוצעת של 19.2 ננוגרם/מיליליטר (בטווח שבין 14.4-26.0). משתתפי המחקר חולקו לשתי קבוצות של בעלי TSP2 גבוה או נמוך. הלחץ הנמדד בעלייה השמאלית על ידי pulmonary capillary wedge pressure, והרמות בצירקולציה של brain natriuretic peptide (או BNP) וכן של טרופונין T, נמצאו מוגברות משמעותית בקבוצת הנבדקים עם רמה מוגברת של TSP2. עקומת הישרדות על פי Kaplan-Meier, הראתה סיכון גבוה להתרחשות של אירועים קרדיו-וסקולאריים חמורים בקבוצת בעלי רמה גבוהה של TSP2. כמו כן נמצא ששילוב של רמת TSP2 גבוהה ורמת BNP מעל 100 פיקוגרם/מיליליטר, היה כרוך עם שיעור ההישרדות הגרוע ביותר. ניתוח התוצאות על ידי mutivariate Cox proportional hazard analysis, זיהה שרמות BNP ו-TSP2 הם מנבאים בלתי-תלויים של אירועים קרדיו-וסקולאריים ותמותה.
מדד וסמן לגילוי מוקדם של סרטן בלוטת הלבלב
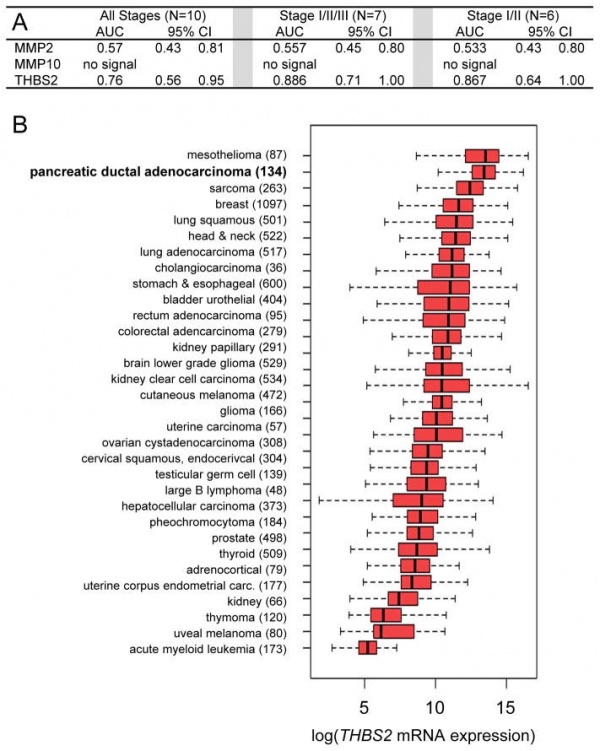
TSP2 נבחן ב-746 דגימות פלזמה של חולי סרטן, וקבוצת ביקורת בריאה בשיטת ELISA. במחקר שהתפרסם בשנת 2017 ב-Sci Transl Med, מצאו Zaret וחב' שרמות TSP2 בשילוב עם רמות המדד המקובל והמאוחר יותר CA19-9 היו אמינות בגילוי מוקדם של סרטן בלוטת הלבלב מסוג PDAC (pancreatic ductal adenocarcinoma). שילוב 2 מדדים אלה שיפר גם את היכולת להבדיל בין מקרי סרטן הלבלב לבין מקרים של פנקראטיטיס. במדגם נכללו 20 חולים ב-phase I של המחלה, 189 חולים ב-phase IIa ו-537 חולים ב-phase IIb, והוא הראה שהריכוזים בפלזמה של TSP2 יכלו להבדיל בין שלושת השלבים של PDAC עם receiver operating characteristic (ROC) של 0.76-0.87. כאשר משלבים את מדידת TSP2 עם זו של CA19-9 שהוא הסמן המקובל של PDAC, התקבל ערך ROC של 0.96 במקרים של phase IIa וערך של 0.97 במקרים של phase IIb. מדידה משולבת של TPS-2 ו-CA19-9 הייתה מסוגלת להבדיל בין ממאירויות intraductal papillary mucinous ו-PDAC לבין פנקראטיטיס תוך שיפור היכולת המבדילה של מדידה יחידנית של CA19-9.
TPS2 וסוגי סרטן שונים
פרוגנוזה: ביטוי מופחת של TSP2 נכרך עם התקדמות תהליך הסרטני בחלק אם כי לא בכל סוגי הסרטן. במחקר של 37 מקרי glioma, חסר של ביטוי TSP2 היה כרוך באופן משמעותי עם דרגה היסטולוגית גבוהה יותר (p=0.0019), ועם עלייה בצפיפות כלי הדם המזינים גידול זה (p<0.0001). במחקר של 61 מקרים של סרטן המעי הגס, נמצא שתאי הסרטן המבטאים TSP2 נטו פחות לשלוח גרורות לכבד, בהשוואה לגידולים שלא ביטאו TSP2 (p=0.02).
תאי סרטן המעי הגס שהם שליליים ל-TSP2 וחיוביים ל-VEGF, מראים הגברה משמעותית במספר כלי הדם שלהם וצפיפותם בסטרומה (p<0.0001). בנוסף, מחקר שכלל 10 מקרים של צוואר רחם תקין ו-78 מקרים של סרטן צוואר הרחם בשלביו החודרניים, מצא שהביטוי של TSP2 mRNA בצוואר הרחם התקין היה גבוה משמעותית מזה שנמצא במקרי סרטן צוואר הרחם (p=0.032) על פי Kodama וחב' ב- Clin Cancer Res משנת 2001.
מאידך גיסא TSP2 היה מבוטא בחוזקה בסדרה של גרורות של מלנומה, אך לא בגידולים הראשוניים, וב-55 דגימות של גידולים סרטניים של האנדומטריום הביטוי של TSP2 היה משמעותית גבוה יותר בממאירויות שהראו חדירה לצוואר הרחם ולכלי הדם בקשרי הלימפה בהשוואה לתאי סרטן רירית הרחם שביטוי TSP2 בהם היה נמוך (p=0.029 ו-p=0.009, בהתאמה).
עם זאת, מספר הדגימות שנבחנו לגבי כל אחד מסוגי מסרטן המפורטים למעלה, קטן מדי מכדי שניתן יהיה להעריך בעזרתן את הערך הפרוגנוסטי של ביטוי TSP2.
אונקוגנזה: מוטציות סומטיות של THBS2 לא אותרו בבירור בסוגי סרטן אנושיים, אך אובדן של ביטוי של TSP2 בגין היפרמתילציה של ה-promoter שלו דווח במחקר על קרצינומות באנדומטריום. Loss of heterozygosity (LOH) באתר 6q15-27 נמצא במחקר על קרצינומה של בלוטות הרוק ונכרך ב-8 מתוך 9 מקרים בהם היה אובדן של ביטוי TSP2. מודלים בעכברים טרנסגניים מאשרים את פעילות הדיכוי של THBS2 בהקשר של תהליך סרטני. התקדמות גידולי עור סרטניים המושרים באופן כימי, מואצת בעכברים משוללי TSP-2, ויש קצב מוגבר של גרורות תאים סרטניים לבלוטות הלימפה. צמיחת הגידול הסרטני ותהליך האנגיוגניות, מושהים ופוחתים כאשר TSP2 מבוטא ביתר במודל זה של עכברים. מודלים בעכברים שימשו לברר אפשרות של שימוש תרפויטי ב-TSP-2 להגביל את שגשוג הגידול הסרטני ואת התהליך האנגיוגני. מודלים אלה עשו שימוש בגישה תאית, בה cDNA של TSP2 הוחדר על ידי transfection למגוון של תאים סרטניים כולל גליובלסטומה, פיברוסרקומה, squamous cell carcinoma, וסרטן השד (Bertin וחב' ב- Cancer Res משנת 1997). כתוצאה מפעולה זו, תאים סרטניים המבטאים ביתר TSP2 אשר הוזרקו מתחת לעור בעכברים עם חסך-חיסוני, ביטאו שגשוג מופחת כמו גם אנגיוגניות מופחתת.
השעתוק של הגן THBS2 במספר סוגי סרטן באדם, מדוכא על ידי היפר-מתילציה. ה-mRNA של TSP2 עובר upregulation על ידי תרכובות מחומצנות פעילות (ROS) כגון Hox-A5 (Whitcomb וחב' ב Clin Cancer Res משנת 2003), וכן על ידי ACTH, TGFβ ו-cerivastatin, ובתנאי תרבית תאים in vitro על ידי דרגת צפיפות גדולה של התאים (confluency). לעומת זאת, downregulation של mRNA של TSP2 מתרחש על ידי עיכוב של מסלול התוך-תאי p38 MAPK המושרה על ידי TGFβ, או על ידי פגיעה במסלול Smad על ידי dexamethasone, או על ידי ביטוי מוגבר של ATF3, או בתאי אדם מודבקים על ידי נגיף HPV, או בתאים מודבקים עם CMV או בתאי סרקומה המבטאים ביתר את ה-tissue factor. האונקוגן c-myb משפיע על הביטוי של TSP2 על ידי וויסות post-translational של יציבות ה-mRNA.
TSP2 מופרש מתאים אך הוא נמצא רק באופן זמני ב-ECM ומוחדר במהירות לתוך פיברובלסטים לאחר שהוא נקשר לקולטנים על פני התא בתוכו הוא עובר פירוק בדומה לפירוק של TSP1 במנגנון התלוי ב-LRP וב-HSPG, ובקינטיקה דומה. TSP2 נקשר לליגנדים ב-ECM הכוללים את TGFβ-1, הפארין, MMP2, פרוטאוגליקנים של הפאראן סולפאט, TSG6, וגליקופרוטאין עתיר היסטידין. הקולטנים על פני התא אליהם נקשר TSP2 כוללים את CD36 (Petrik וחב' ב-Biol Reprocuct משנת 2002) ו-CD47, וכן LDL receptor-related protein-1, כמו גם לשלושה סוגי integrin כולל α-Vβ-3, α-4/β-1 ו-α-6/β-1. בניגוד לTSP1, לא משפעל TSP2 את TGFβ-1 הלטנטי, אך בדומה ל-TSP1 גם TSP2 מכיל שני מוֹדולים הקושרים סידן באופן קואופרטיבי.
TSP2 מעודד או מעכב בתלות בקונטקסט ובתאים המעורבים ספיחת תאים, שגשוגם, תנועתם והישרדותם. TSP2 הוא מעכב חזק של אנגיוגניות בהיקשרו לקולטן CD36. עם זאת, הקצה ה-N טרמינאלי שלו הוא בעל פעילות פרו-אנגיוגנית בתיווך β-1 integrins. תוך מעורבות של α-4β-1, בדומה ל-TSP1 גם TSP2 משתתף במודולציה של התנהגות תאי T בתנאי in vitro. ל-TSP2 יש גם יכולת לעודד כימוטקסיס, לעודד את ביטוי הגן ל-MMP, וסייע לכושר הספיחה של תאי T. במודל של סינוביום ראומטואידי, לתרפיה בעזרת TSP2 הייתה השפעה נוגדת-דלקת in vivo, על ידי שנמנעה הסננה של תאי-T. בנוזל השדרה (CSF), הפרשה של TSP2 על ידי אסטרוציטים, מעודדת סינפטוגנזה.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק