טריפסינוגן - Trypsinogen
| מדריך בדיקות מעבדה | |
| טריפסינוגן | |
|---|---|
| Trypsinogen | |
| שמות אחרים | Immunoreactive trypsinogen , Trypsin-like immunoreactivity |
| מעבדה | כימיה בדם |
| תחום | הערכת תפקוד או פתולוגיה של בלוטת הלבלב |
| טווח ערכים תקין | בבריאות תקינה-10.0-57.0 ננוגרם/מ"ל; בפנקראטיטיס כרונית-46.0 ננוגרם/מ"ל או פחות; בפנקראטיטיס חריפה- 92.0-850.0 ננוגרם/מ"ל; ב--total pancreatectomy פחות מ- 1.4ננוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
גילוי תחלואה של בלוטת הלבלב; כמו כן בבדיקות סקר יילודים מתבצעת בדיקה זו לגילוי לייפת כיסתית (CF). בדיקת טריפסינוגן יכולה להידרש גם במקרים של meconium ileus, מצב בו ישנה חסימת מעי ביילודים כאשר צואתם הראשונה (meconium) סמיכה וצמיגה אפילו יותר מאשר meconium רגיל, מה שעלול לגרום לחסימה ב-ileum. רוב היילודים עם meconium ileus נחשדים כלוקים ב-CF. כמו כן מתבצעת לעתים בדיקת רמת טריפסינוגן בילדים ומבוגרים עם תסמינים של אי-ספיקה של בלוטת הלבלב, הבאה לביטוי בשלשולים עיקשים, צואה שומנית מצחינה, ספיגה לקויה, וחסר ויטמינים.
בסיס ביוכימי של פעילות טריפסינוגן
טריפסינוגן הוא צורת הקודמן (precursor) או הזימוגן של האנזים העיכולי הפרוטאוליטי טריפסין.
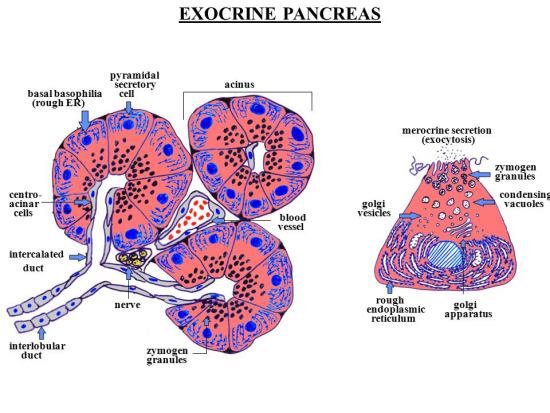
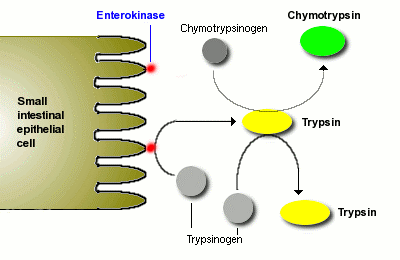
טריפסינוגן מיוצר בבלוטת הלבלב ומופיע במיץ הלבלב עם אנזימי עיכול אחרים כמו ליפאזה, עמילאזה ו-chymotrypsinogen. טריפסינוגן המשתחרר מהלבלב למעי הדק, משופעל על ידי אנזים enteropeptidase הנמצא ברירית המעי ליצירת טריפסין. כאשר טריפסין משופעל, הוא עשוי לסייע בהפיכת יותר טריפסינוגן לטריפסין על ידי פעילותו הפרוטאליטית המבקעת את הקשר הפפטידי בצד הקרבוקסילי של חומצות אמינו בסיסיות כגון ליזין וארגינין.
הפיזיולוגיה של טריפסינוגן בבריאות מלאה
טריפסין מסונתז כטריפסינוגן, שהוא קודמן בלתי-פעיל, ברטיקולום האנדופלזמי הגס, והוא מועבר בטרנספורט ל-Golgi, לעיבוד סופי. טריפסינוגן תמיד מסונתז ביחד ונארז עם PSTI או pancreatic secretory trypsin inhibitor כאשר האחרון מונע שפעול טרם-עת של טריפסינוגן.
עם הגעתו של טריפסינוגן ל-Golgi, הוא עובר דחיסה עם אנזימים מעכלים נוספים לתוך גרעיני חלקיקים, ונארזים לתוך גרנולות זימוגן. האנזימים הדחוסים יציבים ומושפעים רק מפעילות מינימלית של שפעולם בתוך גרנולות הזימוגן. ברגע שתאי ה-acinus מקבלים גירוי להפרשה, גרנולות זימוגן מופרשות אל תוך ה-lumen של הצינור הפנקראטי ודרכו עוברים האנזימים המעכלים לתוך התריסריון. בתוך התריסריון פעילות של אנטרו-פפטידאזה (הידוע גם כאנטרו-קינאזה המיוצר ברירית של התריסריון) משפעלת את טריפסינוגן על ידי ביקוע של 15 חומצות אמינו מהקצה ה-N טרמינאלי של טריפסינוגן ליד שייר ליזין, כאשר הפפטיד המבוקע ידוע כ-TAP או trypsinogen activation peptide. הסרת TAP משרה שינוי קונפורמציה המביא ליצירת טריפסין פעיל (Abita וחב' ב-Eur J Biochem משנת 1969).
- שינוי הקונפורמציה נעשה כדלקמן
לאחר הביקוע של טריפסינוגן בעמדה 15, חודר שייר 16 שהוא הקצה החדש לתוך בקע בו קבוצת ה-α-amino יוצרת צמד יוני עם שייר אספרטאט לד האתר הפעיל של serine, וגורם גם לשינויי קונפורמציה של שיירים נוספים. קבוצת האמינו של שייר גליצין-193 מכוונן עצמו לעמדה המשלימה את ה"חור" האוקסי-אניוני של האתר הפעיל, ובכך משפעל את טריפסין. כיוון שטריפסין גם כן מבקע את הקשר הפפטידי לאחר שייר ארגינין או ליזין, הוא יכול לבקע מולקולת טריפסינוגן אחרת, ותהליך השפעול ליצירת טריפסין הופך להיות תהליך אוטו-קטליטי (Thomas ו-Creighton ב-Proteins , Freeman & Co משנת 1993).
אמצעי הגנה מפני שפעול מוקדם מדי של טריפסינוגן
טריפסין נוצר במקור בגרסה הלא פעילה של טריפסינוגן כדי למנוע את פעילותו הפרוטאוליטית המוקדמת מדי עוד בבלוטת הלבלב, שם הוא עלול לפגוע ברקמת הבלוטה על ידי עיכול-עצמי. בלבלב תקין בערך 5% מהטריפסינוגן משופעלים, ויש מספר אמצעים למניעת שפעול לא רצוי זה. טריפסינוגן נארז בלבלב בתוך גרנולות זימוגן שהממברנות שלהם עמידות בפני עיכול אנזימטי. אמצעי נוסף היא הנוכחות של מעכבים כגון BPTI או bovine pancreatic trypsin inhibitor וכן SPINK1 או serine protease inhibitor Kazal-type 1, הנקשרים לכל מולקולת טריפסין הנוצרת ומנטרלים אותה. גם התהליך האוטו-קטליטי בו טריפסין יכול לשפעל טריפסינוגן, הוא תהליך אטי, בגלל נוכחות של מטען חשמלי שלילי ניכר ב-hexapeptide בקצה ה-N טרמינלי השמור של טריפסינוגן, מה שגורם לדחייה חשמלית של האספרטאט המופיע בבקע של מולקולת טריפסין ואחראי לספציפיות של פעילות טריפסין (Voet ו-Voet ב-Biochemistry John Wiley & Sons משנת 1995).
איזופורמים של טריספסינוגן
בנוזל הפנקראטי ניתן למצוא 3 איזופורמים של טריפסינוגן: הטריפסינוגן הקטיוני, האניוני, ומה שידוע כ-meso trypsinogen, המהווים 23.1%, 16.0% ו-0.5% מכלל החלבונים המופרשים מהלבלב, בהתאמה (Scheele וחב' ב-Gastroenterology משנת 1981). צורות אחרות של טריפסינוגן נמצאות בבעלי חיים אחרים.
טריפסינוגן במצבי מחלה
פנקראטיטיס עלולה להיות תוצאה של שפעול לא מתאים של טריפסינוגן בבלוטת הלבלב. מספר סוגים של פנקראטיטיס יכולים להיות קשורים עם צורות מוטנטיות של טריפסינוגן. מוטציה בעמדה 117 של ארגינין של טריפסינוגן קטיוני הרגישה לטריפסין, נחשבת כזו המשחקת תפקיד בפנקראטיטיס תורשתית, שהיא צורה נדירה של פנקראטיטיס על בסיס פגם גנטי המופיעה כבר בגיל צעיר. מוטציה זו הגורמת לביטול נקודת הביקוע התקנית של טריפסינוגן, עלולה לגרום לאובדן שליטה ולאפשר עיכול-עצמי הגורם לפנקראטיטיס (Whitcomb וחב' ב-Nature Genetics משנת 1996). מוטציות נוספות שהתגלו אף הן עלולות להיות קשורות לפתוגנזה של פנקראטיטיס (Rebours וחב' ב-Digest Liver Dis משנת 2011).
פנקראטיטיס היא מחלה דלקתית של בלוטת הלבלב, שמתחילה בתאים האצינריים וגורמת לסבל ואף לתמותה (Pandol וחב' ב-Gstroenterology משנת 2007). כבר בשנת 1896 הציע הפתולוג Hans Chiari שפנקראטיטיס חריפה אינה נובעת כתוצאה מזיהום, אלא במנגנון שהלבלב הורס את עצמו בתהליך של עיכול עצמי, ומאז הפך השפעול של טריפסין שלא בעתו למוקד של מחקר להבנת הפתו-ביולוגיה של פנקראטיטיס. שפעול טרם-עת של טריפסין הודגם במודלים של פנקראטיטיס חריפה בחיות (Lerch ו-Gorelick ב-Med Clin North Am משנת 2000, Mithofer וחב' ב-Am J Physiol משנת 1998, Saluja וחב' ב-Am J Physiol משנת 1987 ו-Lee וחב' באותו כתב עת משנת 1999).
שפעול מוקדם של טריפסינוגן בפנקראטיטיס חריפה
על פי Letch וחב' ב-Med Clin משנת 2000, השפעול המרבי של טריפסינוגן מתרחש ב-pH שבין 4.5 ו-5.5., שעה שהפירוק המרבי של טריפסינוגן מתבצע ב-pH גבוה יותר. התפקיד של ה-pH בשפעול של טריפסינוגן על ידי האנזים cathepsin B נלמד לאורך ספקטרום רחב של מצבי pH שונים, ונמצא שהאנזים הפרוטאוליטי האחרון מגלה פעילות בין pH5.0 ל-pH8.0. ההפרשה האקסוקרינית של חלבוני הלבלב המחושבת לתא בודד, גדולה יותר מהפרשה אקסוקרינית דומה של כל בלוטה או רקמה אחרת בגוף.
המיקום התוך-אצינרי של שפעול טריפסין במהלך פנקראטיטיס חריפה
פרקציונציה תוך תאית ואנליזה של תמצית פנקראטית מיד לאחר תחילת התהליך של פנקראטיטיס, סיפקו נתונים באשר למיקומו של הטריפסינוגן המשופעל. מחקרים אלה הצביעו על התפקיד של cathepsin B שהוא אנזים ליזוזומאלי המסוגל לשפעל טריפסינוגן (Hofbauer וחב' ב-Am J Physiol משנת 1998). נתון זה הוביל לפיתוח של מה שמכונה "Co-localization hypothesis", הקובע שבהתרחשות פנקראטיטיס חריפה אנזימים ליזוזומאליים וזימוגנים מתאחים ליצירה של מבנים הקרויים co-localization organelles. יתרה מכך, הועלתה הנחה שבתוך האורגנלות הללו האנזים cathepsin B משפעל טריפסינוגן לטריפסין.
מחקרים הראו ששפעול טרם-עת של טריפסינוגן מתרחש במבנים הקשורים לממברנה, הדומים לבועיות (vesicles) הנוצרות על ידי קו-לוקליזציה של זימוגן וליזוזומים. בבועיות אלו הפרוטאזה הליזוזומאלית cathepsin B משפעלת טריפסינוגן, והטריפסין שנוצר יכול לשפעל אנזימים עיכוליים אחרים בתוך התאים האצינריים, כנראה בדרך דומה לזו ששפעול זה מתבצע בתריסריון. מחקרים in vitro שהדגימו ש-cathepsin B יכול לשפעל טריפסינוגן, תומכים בתיאוריה של פעילות אנזים זה in vivo (על פי Saluja וחב' ב-Gastroenterology משנת 1997,ו-Teich וחב' באותו כתב עת משנת 2002). נראה שבחסר של cathepsin B פחות מ-1% של טריפסינוגן עובר הידרוליזה, אך שפעול טריפסינוגן על ידי cathepsin B אינו מהווה צעד פתוגני במטופלים עם פנקראטיטיס תורשתית עם המוטציות D22G ו-K23R.
תפקידו של טריפסין בפנקראטיטיס חריפה
משך עשרות שנים השפעול התוך-אצינרי של טריפסין נחשב אירוע המפתח בפנקראטיטיס חריפה, בתמיכה של מספר תצפיות. עיכוב של טריפסין על ידי מעכבי פרוטאזה לא ספציפיים במיוחד, הגן מפני נזק בהתרחשות של פנקראטיטיס חריפה (Van Acker וחב' ב-Am J Physiol Gastrointest Liver Physiol מהשנים 2002 ו-2007). יתרה מכך, עיכוב של שפעול טריפסינוגן על ידי עיכוב פעילות cathepsin B, או על ידי השמטה של הגן המקודד ל-cathepsin B, גם כן הפחית את הנזק לבלוטת הלבלב בפנקראטיטיס חריפה, מה שמרמז גם כן לחשיבות של שפעול טריפסינוגן בגרימת הנזק ללבלב (Halangk וחב' ב-J Clin Invest משנת 2000). במחקר האחרון של Halangk וחב' הודגם שעכברי knock out מזן CB KO המשוללים פעילות cathepsin B, סובלים מכמות מופחתת של נמק בלבלב מאשר עכברי WT.
התמיכה החזקה ביותר לתפקיד המרכזי של טריפסין, באה מהזיהוי של מוטציות בגן PRSS1 של הטריפסינוגן קטיוני בפנקראטיטיס תורשתית המועברת בהורשה אוטוזומאלית-דומיננטית (Whitcomb וחב' ב-Nature Genet משנת 1996. המחקרים הביוכימיים in vitro על מוטציות R122H בטריפסינוגן ההומני הקטיוני הכרוכות בפנקראטיטיס, הראו שוואריאנט זה של טריפסינוגן הוא בעל נטייה מוגברת לשפעול-עצמי, וכן שהוא עמיד להידרוליזה על ידי chymotrypsin C (על פי Teich וחב' ב-Hum Mutat משנת 2006). יחד עם זאת, למוטציה זו יש השפעות פליאוטרופיות, ואין כל הוכחה ישירה שמוטציה זו משפיעה ישירות על הגברת פעילות תוך-תאית של טריפסין באנשים עם פנקראטיטיס תורשתית (Archer וחב' ב-Gastroenterology משנת 2006). יתרה מזאת, אלה עם מוטציה זו אינם סובלים מפנקראטיטיס מתמשכת אלא מהתקפים אפיזודיים של המחלה.
כמו כן, במודל עכבר של פנקראטיטיס תורשתית שנוצר על ידי ביטוי טרנסגני של טריפסינוגן עם מוטציית R122H, לא נצפה שפעול מוגבר של טריפסינוגן, מה שמרמז על השפעתם של גורמים אחרים. מוטציית R122H נמצאה מגבירה את התדירות של השפעול העצמי של טריפסין (Gaiser וחב' ב-Gut משנת 2011, ו-Kereszturi וחב' ב-Hum Mutat משנת 2009). מחקרים על מוטציה אחרת של PRSS1, הידועה כ-R116C, פענחו מנגנון שונה לחלוטין של נזק לתאים אצינריים, שאינו קשור כלל לשפעול של טריפסינוגן. מוטציה אחרונה זו משרה התקפלות שגויה (misfolding) של טריפסינוגן. בה בשעה שמופיעים נתונים גנטיים ואפידמיולוגיים הכורכים פנקראטיטיס לשפעול של טריפסינוגן, הולכת ומתבררת ההשערה שפרט למקרה הספציפי של פנקראטיטיס תורשתית ושל ציסטיק פיברוזיס, אין סבירות להנחה שקים מנגנון גנטי פשטני לפנקראטיטיס חריפה, אלא מדובר ביחסי גומלין בין גורמים גנטיים, סביבתיים והתפתחותיים, הקובעים את מידת הרגישות, ההתפתחות והחומרה של פנקראטיטיס.
על פי Gaiser וחב' הביטוי של פעילות של טריפסין בלבלב מספקת להשרות פנקראטיטיס חריפה. מחקר זה הראה שדי היה ביטוי קונסטיטוטיבי נמוך או מתון של הגן PRSS2 המקודד בחולדות לטריפסינוגן אניוני בתאים האצינריים, להשרות פנקראטיטיס. לעומת זאת Wartmann וחב' במחקרם ב-Gastroenterology משנת 2010, הראו שבעכברי knock out עם חסר האנזים cathepsin L, יש אמנם שפעול מוגבר בהרבה של טריפסינוגן, אך במקביל קיימת הפחתה משמעותית בנזק ללבלב, מה שמצביע על כך שלשפעול של טריפסינוגן עשוי להיות אפילו תפקיד הגנתי במהלך התרחשות פנקראטיטיס על ידי השמדה של טריפסינוגן ואנזימים פרוטאוליטים אחרים.
על מנת לקבל מידע נוסף על תפקידו של טריפסין בפנקאטיטיס חריפה, יצרו Dawra וחב' (Gastroenterology משנת 2011) עכבר knock out חדש החסר את איזופורם-7 של טריפסינוגן (שהוא שווה הערך של הטריפסינוגן הקטיוני באדם, PRSS1. בזן זה של עכבר לא מוצאים שפעול תוך-אצינרי פתולוגי של טריפסין בפנקראטיטיס חריפה, מה שמצביע על איזופורם-7 של טריפסינוגן (T7) כאחראי לשפעול הפתולוגי של טריפסין. באופן מרתק, נמצא שבעכברי knock out ללא T7 (או -/-T), נמצא שהנמק בתאים אצינריים בשעת השריית פנקראטיטיס חריפה על ידי cerulein או על ידי L-ארגינין, פוחת לכמחצית הנמק שמוצאים בעכברים עם T7 (או +/+T). גם בניסויים in vitro נמצא שתאים אצינריים החסרים T7 אינם עוברים נמק, כאשר הם מגורים על ידי cerulein במינון גבוה. ממצאים אלה מרמזים שטריפסין אחראי רק באופן חלקי לנמק בתאים אצינריים במהלך פנקראטיטיס חריפה, והדלקת המקומית והסיסטמית מתרחשות באופן בלתי תלוי בטריפסין (Hietaranta וחב' ב-Biochem Biophys Res Commun משנת 2001). נראה אם כן שטריפסין נדרש רק לאתחול הנזק, בה בשעה שמסלולים דלקתיים בלתי-תלויים בטריפסין, (ובעיקר גורם השעתוק NF-κB, קובעים את התקדמות המחלה ואת חומרתה.
פרט לשפעול טרם-עת של טריפסינוגן, שפעול של NF-κB תוך אצינרי נמצא גורם לנזק פנקראטי מקומי, כמו גם לדלקת סיסטמית (Baumann וחב' ב-J Clin Invest משנת 2007, ו-Chen וחב' ב-Gastroenterology משמנת 2002). נזק הקשור ל-NF-κB היה עקבי בכל התאים האצינריים אפילו בהיעדר טריפסין בעכברי -/-T, מה שמצביע על כך שיש ל- NF-κB תפקיד שאינו תלוי בטריפסין בנזק האצינרי. התווכים התאיים הדלקתיים המסיסים דוגמת TNF-α, שהוא תוצר של מסלול ה-NF-κB, נמצא משרה באופן ישיר שפעול טרם-עת של טריפסינוגן ונמק של תאי לבלב אצינריים, מה שמרמז על תרומה של איתותים דלקתיים באתחול המחלה ובהתקדמותה (Sendler וחב' ב-Gut משנת 2013). לכן שפעול של NF-κB יכול אף הוא להיות אירוע מוקדם האחראי להתקדמות של הפגיעה הסיסטמית. עובדה זו נתמכת על ידי מחקר חשוב נוסף, שהדגים הפחתה חלקית בנמק האצינרי במהלך פנקראטיטיס בעכברים החסרים את יחידת p50 של NF-κB או p50-/- (על פי Altavilla וחב' ב-Lab Invest משנת 2003). מחקר של Gukovskaya וחב' ב-Gastroenterology משנת 2002, מצא שנויטרופילים שגויסו בשעת התהליך הדלקתי היו מסוגלים לשפעל טריפסין בתא האצינרי, באופן שהיה תלוי בפעילות האנזים הנויטרופילי NAPDH oxidase מה שמרמז על המעורבות של תאי חיסון כגון נויטרופילים בהחשת הנזק לתאים האצינריים.
התפקיד של טריפסין בפנקראטיטיס כרוני
תוך שימוש בעכברים -/-T ניתן היה ללמוד על תפקידו של טריפסין בפנקראטיטיס כרונית (Pandol וחב' ב-Gastroenterology משנת 2013). תוך שימוש במודל ה-celulein של פנקאטיטיס כרונית, נמצאו רמות דומות של נזק לתאים אצינריים ותהליך של לייפת (fibrosis) בעברים האמורים וכן בעכברי wild type C57BL/6, מה שמצביע על שפעול בלתי-תלוי של טריפסין הקשור לנמק האצינרי, ולשפעול של תאי stellate בפנקראטיטיס כרונית. בחינה נוספת של הסתננות של תאי T ושפעול של NF-κB (Saluja וחב' ב-Am J Physiol משנת 1987). נמצא שתהליכים אלה היו ברי-השוואה בין עכברי -/-T, לבין עכברי WT, מה שתומך בהשערה שדלקת עקבית המונעת על ידי תהליכים התלויים ב- NF- κB יכולים להוליך לפנקראטיטיס כרונית אפילו בהיעדר טריפסין (Lee ןחב' ב-Am J Physiol משנת 1999). אין ספק שטריפסין חיוני לאתחול של פנקראטיטיס כרונית, אם כי תרומתו למנגנון המחלה כנראה מוערכת יתר על המידה.
המשמעות של תוצאות חריגות של רמת טריפסינוגן בדם
רמה מוגברת של טריפסינוגן עלולה לבטא פנקראטיטיס חריפה; לייפת כיסתית (cystic fibrosis); סרטן בלוטת הלבלב; יצירה בלתי נורמאלית של אנזימי בלוטת הלבלב. רמות נורמאליות או נמוכות אך במידה מתונה של טריפסינוגן יכולות לשקף תרחיש של פנקראטיטיס כרונית. בפגים או אף ביילודים שנולדו במועדם, אך תהליך לידתם היה מסובך (stressful delivery), רמות טריפסינוגן בדם עלולות להיות מוגברות. רמות גבוהות של טריפסינוגן לאחר לידה רגילה יכולות להחשיד ל-CF. תינוקות עם רמות מוגברות של טריפסינוגן בלידה, אמורים לעבור בדיקת מעקב נוספת לאחר מספר שבועות על מנת לאשש את הממצא הראשוני. באלה עם CF, רמת טריפסינוגן יכולה לשקף את חומרת המחלה. רמת טריפסינוגן, אינה נחשבת אבחנתית, שכן יש מספר לא קטן של מקרים עם תוצאות חיוביות כזובות (false positives), וכן מפגעים שאינם CF או הקשורים לפקוד לקוי של הלבלב, בהם מתקבלת תוצאה מוגברת של טריפסינוגן בדם. במקרים אלה יש לבצע מבחן זיעה, או אנליזה של מוטציה בגן הרלוונטי ל-CF.
למרות שנזק ללבלב מיוחס בדרך כלל לשפעול טרם-עת של הזימוגן בתוך התאים האצינריים של הבלוטה, קיימים מנגנונים נוספים התורמים לנזק הפנקראטי. גם שפעול של פרוטאזות חוץ-תאיות, הגדלה של החדירות (permeability) הווסקולארית, ונזק לתאי האנדותל הווסקולארי, כל אלה הם מאפיינים של פנקראטיטיס ונמצאו תורמים להיווצרות בצקת בלבלב, להפחתה של שפיעת הדם בבלוטה, לנזק איסכמי, ולהתקדמות המחלה. גם רדיקלים חופשיים הלולים להסב נזק, התגלו בבלוטה מיד לאחר האתחול של פנקראטיטיס ואכן במודלים של חיות מעבדה, טיפול עם מנטרלי (scavengers) רדיקלים חופשיים שיפר את מהלך המחלה הניסויית שהושרתה בחיות. לבסוף, ההפרשה של ציטוקינים על ידי התאים האצינריים ועל ידי תאי דלקת משופעלים, והביטוי של גורמי ספיחה (adhesion factors) מסייעים לתגובה הדלקתית המזיקה, המתחילה תוך מספר שעות אחרי התחלת התהליך של פנקראטיטיס בחיות.
למסקנות אלו הגיעו Steinberg ו-Anderson ככר בשנת 1984 במאמרם ב-Digest Dis Sci. הם עשו שימוש בערכה החדשה של RIA שיצאה אז לשוק (Cis Trypsik) בבדיקות של רמת טריפסינוגן באוכלוסיות מטופלים שונות, ותוצאות מדידות אלה היו כדלקמן: רמה נמוכה של טריפסינוגן (פחות מ-10 ננוגרם/מ"ל) נמצאה ב-69.2% מתוך 13 נבדקים עם אי-ספיקה פנקראטית כרונית (CPI), ב-100% מתוך 10 נבדקים עם כריתה מלאה של הלבלב, אך רק ב-14% מבין 14 נבדקים עם סרטן הבלוטה. רמה נמוכה של טריפסינוגן לא נמצאה באף לא אחד מקבוצת ביקורת של נבדקים בריאים, או בנבדקים המטופלים המרפטות חוץ בשל בעיות קליניות לא רלוונטיות. ממצאים אחרונים אלה מצביעים על כך שרמות נמוכות של טריפסינוגן, מצביעות על פנקראטיטיס כרונית עם דרגת ספציפיות גבוהה.
הוראות לביצוע הבדיקה
אין כל הכנות מיוחדות לפני נטילת הדם, אם כי יש הגורסים שצום של 8 שעות מומלץ כי סוג המזון יכול להשפיע על הפרשת טריפסינוגן מהלבלב. רצוי גם במידת האפשר לא לצרוך תרופות, צמחי מרפא ויטמינים או תוספים שונים וסמים אסורים 3 ימים לפני הבדיקה. ניתן לבצע את הבדיקה בנסיוב (נטילת הדם במבחנה כימית פקק אדום או צהוב כמו גם מבחנת ג'ל או בפלזמה (מבחנת ספירת-דם, פקק סגלגל עם EDTA). בשני המקרים יש לסרכז את הדגימה לא יאוחר משעתיים לאחר נטילת הדם. הדגימה יציבה לאחר הסרכוז והפרדת הנוזל מהכדוריות בטמפרטורת החדר למשך שעתיים, בקירור למשך 24 שעות, ובהקפאה למשך 90 יום. כיוון שרמת טריפסינוגן בדם מוגברת בדרך כלל במהלך היום או לאחר ארוחות, רצוי ליטול דם בשעת בוקר מוקדמת כאמור לפני ארוחה ולאחר צום של 8 שעות, ובנטילת דם מעקב של יילודים רצוי שהדבר יתבצע לפני הנקה. הבדיקה מתבצעת בדרך כלל בשיטת RIA כמותית.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק