הבדלים בין גרסאות בדף "טרשת רב-מערכתית - Systemic Sclerosis"
| (69 גרסאות ביניים של 5 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
{{מחלה | {{מחלה | ||
| − | |תמונה=[[קובץ: | + | |תמונה=[[קובץ:תופעת ריינו.jpg|320px]] |
| − | |כיתוב תמונה= | + | |כיתוב תמונה=תופעת ריינו |
|שם עברי=טרשת רב-מערכתית | |שם עברי=טרשת רב-מערכתית | ||
|שם לועזי=Systemic Sclerosis | |שם לועזי=Systemic Sclerosis | ||
| − | |שמות נוספים=סקלרוזיס סיסטמית, טרשת מערכתית, סקלרודרמה | + | |שמות נוספים=Systemic scleroderma, Diffuse scleroderma{{ש}} |
| + | סקלרוזיס סיסטמית, טרשת מערכתית, סקלרודרמה | ||
|ICD-10={{ICD10|M|34||m|30}} | |ICD-10={{ICD10|M|34||m|30}} | ||
|ICD-9={{ICD9|710.1}} | |ICD-9={{ICD9|710.1}} | ||
|MeSH={{MeSH|D012595}} | |MeSH={{MeSH|D012595}} | ||
| − | |יוצר הערך= | + | |יוצר הערך=פרופסור אלכסנדרה בלביר{{ש}}[[קובץ:Reumatology_(2).jpg]] |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| − | + | {{הרחבה|סקלרודרמה}} | |
| − | '''טרשת רב-מערכתית''' | + | '''Scleroderma או טרשת רב-מערכתית (SSc'''{{כ}}''', Systemic Sclerosis)''' היא מחלה כרונית [[מחלה אוטואימונית|אוטואימונית]] (Autoimmune), מתאפיינת בהתעבות העור כתוצאה מהצטברות סיבי [[Collagen]]. שקיעת Collagen מתרחשת בעור, בדפנות כלי הדם הקטנים ובאיברים הפנימיים. כתוצאה מכך נוצרת הפרעה באספקת דם לרקמות, שינוי במבנה של רקמות ואיברים ובסופו של תהליך הצטלקות של רקמות ואיברים פנימיים (ריאות, לב, כליות, [[מערכת העיכול]], ועוד). הפרוגנוזה של המחלה נקבעת על פי מעורבות האיברים החיוניים, ובעיקר הריאות, הלב והכליות{{הערה|שם=הערה1|Denton CP, Khanna D. Systemic sclerosis. Lancet. 2017 Oct 7;390(10103):1685-1699. doi: 10.1016/S0140-6736(17)30933-9. 2.}}. |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | הפרוגנוזה של המחלה נקבעת על פי מעורבות האיברים החיוניים | ||
== אפידמיולוגיה == | == אפידמיולוגיה == | ||
| − | + | Scleroderma היא מחלה נדירה. על פי נתונים מארצות הברית, שכיחות המחלה היא 2.6 מקרים ל-10,000 איש (0.026 האחוז). כל שנה מאובחנים בין 2 עד 5 מתוך 100,000 מקרים חדשים. המחלה שכיחה הרבה יותר בקרב נשים (ביחס של נשים לגברים; שלוש עד 6 נשים לגבר אחד); הופעתה של המחלה נדירה בקרב ילדים וקשישים. במרבית המקרים הביטויים הראשונים של המחלה מופיעים בגילאי 30–50 לחיים. שכיחות המחלה בקרב קרובי משפחה מדרגה ראשונה גבוהה יותר (1.6-1.3 אחוזים) מהשכיחות באוכלוסייה הכללית. מחקר של הגנום האנושי (GWAS{{כ}}, Genome-Wide Association Studies) ומחקרים גנטיים על קבוצות גדולות של חולי Scleroderma הצביעו על שינוים במבנה של הגנים (Genes){{כ}} GSDMA{{כ}} (Gasdermin A) ו-PRDM1{{כ}} (Positive Regulatory Domain containing 1) בקרב חולי Scleroderma; המשמעות הקלינית של תגלית זו טרם הובהרה. | |
| − | |||
== אטיולוגיה == | == אטיולוגיה == | ||
| − | [[קובץ:טלנגיאקטזיות.jpg|שמאל|300px]] | + | [[קובץ:טלנגיאקטזיות.jpg|שמאל|300px|ממוזער|'''טלנגיאקטזיות''']] |
| − | |||
| − | ''' | + | Scleroderma היא מחלה שהגורם לה אינו ידוע. חלה התקדמות בהבנת מנגנונים העיקרים של Scleroderma: הפרעה במערכת האוטואימונית, הפרעה בכלי הדם (Vascular) ו-[[Fibrosis]]: |
| + | #'''הפרעה אוטואימונית''' - ב-Scleroderma היא מגוונת. הפרעה בתפקוד [[ספירת דם - Complete blood count#לימפוציטים (Lymphocytes)|לימפוציטים]] מסוג B{{כ}} (B type Lymphocytes) מובילה ליצירת נוגדנים עצמיים, הכוללים נוגדנים לגרעין ([[ANA]]{{כ}}, Antinuclear Antibodies), ונוגדנים אופייניים ל-Scleroderma כגון נוגדנים ל-Topoisomerase{{כ}} ([[SCL-70]] או ATA), נוגדנים ל-Centromere{{כ}} (ACA), ונוגדנים ל-RNA 3 Polymerase {{כ}}([[RANP-3]]); יש עוד רשימת נוגדנים אופייניים ל-Scleroderma אך בשלב זה טרם הוחל שימוש שוטף בהם.{{ש}}בין המנגנונים של Scleroderma פעילות של תאי דלקת כמו לימפוציטים מסוג T, בזרם הדם לימפוציטים מסוג T מפרישי ציטוקינים מקדמי דלקת עם מאפייני דלקת מסוג Th1{{כ}} (T helper 1). לימפוציטים מסוג T שבודדו מהעור והרקמות של חולי Scleroderma מבטאים אופי של Th2 הכולל הפרשה מוגברת של ציטוקינים המקדמים תהליך הצטלקות (Fibrosis), כגון Monocyte Chemotactic Protein-1) ,MCP-1) ואינטרלויקינים (Interleukins, [[אינטרלויקין 6 Interleukin|IL-6]], [[IL-4]], [[IL-10]]). כמו כן, בקרב החולים הודגמו רמות גבוהות של הקולטן ל-PDGF{{כ}} (Platelet-Derived Growth Factor), המזוהה עם הופעה של גנים מקדמי Fibrosis על פני תאים פיברובלסטים (Fibroblasts) | ||
| + | #'''הפרעה וסקולרית (Vascular)''' - מתבטאת בשפעול של תאי אנדותל (שכבה פנימית של כלי דם) ושינוים במבנה כלי דם קטנים. בקרב החולים הודגמו רמות גבוהות של [[von Willebrand Factor]], אחד מגורמים אחראים עם היצרות של כלי דם ו[[הפרעות קרישה]]. הפגיעה בכלי הדם גורמת להפרעה באספקת דם (Ischemia) ונמק של הרקמות. כתגובה לפגיעה בכלי הדם, מתקיימת הפרשה מוגברות של [[VEGF]]{{כ}} (Vascular Endothelial Growth Factor) אך למרות זאת בנייה מחודשת כלי הדם הקטנים אינה תקינה ובמקום נימים תקינים נוצרים נימי דם ענק (Giant capillaries) פגומים. נימי דם ענק אלו ניתן לראות כעור או ריריות של חולי Scleroderma בצורה של "כוכבית", הנקראות טלאנגיאקטזיות (Telangiectasia). {{ש}}Scleroderma מתאפיינת בהפרעה של האיזון בין חומרים ביולוגיים מכווצים כלי דם ומרחיבים כלי דם, לטובת המכווצים. נמצא קשר בין ערכים מוגברים של Endothelin-1, מכווץ כלי הדם החזק ביותר, לחומרת [[Raynaud's phenomenon|תופעת Raynaud]], כיבים באצבעות, יתר לחץ דם ריאתי (Pulmonary Arterial Hypertension ,[[יתר לחץ דם ריאתי|PAH]]), והמשבר הכלייתיים בקרב חולי Scleroderma. {{כ}}Endothelin-1 גם אחראי על קידום Fibrosis והתרבות של תאי שריר חלק ושאר שכבות בדופן של כלי הדם עם היצרות של נימי דם ועורקים קטנים. ב-Scleroderma נמצא מחסור במרחיבים של כלי דם פוטנטיים כגון פרוסטציקלינים (Prostacyclins): {{כ}}[[פרוסטגלנדין - Prostaglandin - D2|PGI2]]{{כ}} (Prostaglandin I2) ו-Nitric Oxide) [[NO]]). כתוצאה מכך, בחלק מנימי דם מתפתח עיבוי דופן, היצרות ומספרם יורד. ההשלכות הקליניות של התהליך כוללות פצעים ונמק בעור, הופעת PAH, התפתחות של [[RENAL CRISIS|משבר כלייתי]], פגיעה בלב, במערכת העיכול | ||
| + | #'''Fibrosis''' - הוא סימן מובהק של Scleroderma, הוא בולט בעור אך גם מתרחש באיברים הפנימיים וברקמות שונות. בטבע, בתנאים של אירוע דלקת או Ischemia מופעל תהליך שפעול תאי פיברובלסטים האחראים על ריפוי פצעים על ידי יצירת סיבי Collagen. ב-Scleroderma, פיברובלסטים מתפקדים ביתר שאת והופכים למיו-פיברובלסטים (Myofibroblasts) המייצרים עודפים של Collagen תהליך זה מבוקר על ידי ציטוקינים מקדמי-Fibrosis, כגון - TGF-β ({{כ}}β Transforming Growth Factor){{כ}}, CTGF{{כ}} (Connective Tissue Growth Factor){{כ}} ו-6-IL | ||
| − | + | הושם דגש על תפקוד מפתח של פיברובלסטים, תאי אנדותל של כלי דם בריאות, תאי אפיתל (תאים שמצפים דופן של חללי ריאות קטנטנים (Alveoli) בתאים פריציטים (Pericytes) (פריציטים מקשרים בין אנדותל ואפיתל) בשילוב עם תהליכי דלקת במעורבות ריאות ב-Scleroderma (מחלת ריאות אינטרסטיציאלית, [[Interstitial Lung Disease]], ILD) ו-Fibrosis ריאתית ([[Pulmonary Fibrosis]], PF). כתוצאה מהפרעה משולבת ברקמת ריאות, פיברובלסטים רבים נמשכים לאזורי הפגיעה ומבצעים "תיקון" לא מוסדר ולא מבוקר לנזק הקיים. במהלך פעילותם, פיברובלסטים בריאות הופכים למיו-פיברובלסטים, המייצרים כמויות מוגזמות של סיבי Collagen הצטלקות של רקמת ריאות ופגיעה בתפקוד הנשימתי. בנוסף, תאי דלקת שונים כמו מקרופאגים (Macrophages) ולימפוציטים מגויסים לאתר הפציעה ומשחררים מתווכים מקדמי Fibrosis; כך מתרחשים תהליכי גירוי בלתי פוסקים ולא מבוקרים של פעילות יתר של פיברובלסטים ומיו-פיברובלסטים עם התקדמות ה-Fibrosis בריאות. תהליך ה-Fibrosis בריאות תלוי בפעילות יתרה של מספר ציטוקינים כמו VEGF{{כ}}, PDGF{{כ}}, [[FGF]] {{כ}}(Fibroblast Growth Factor) ו-TGF-β וגם בפעילות ירודה של תססים מסוג MMP{{כ}} ([[Metalloproteinase]]) האחראים על פירוק של Collagen ורקמה פיברוטית. הבנה של מנגנון זה הוביל לפיתוח תרופות שמעכבות את ההגעה של פיברובלסטים לריאות. דיכוי הפעילות של פיברובלסטים ומיו-פיברובלסטים בריאות מאפשר לעצור את שרשרת האירועים שמובילה ל-Fibrosis ולמנוע נזק לרקמת הריאות{{הערה|שם=הערה2|Khanna D, Tashkin DP, Denton CP, et al. Etiology, Risk Factors, and Biomarkers in Systemic Sclerosis with Interstitial Lung Disease. Am J Respir Crit Care Med. 2020 Mar 15;201(6):650-660. }}. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== קליניקה == | == קליניקה == | ||
| − | + | [[קובץ:Sclerodactyly1.jpg|שמאל|300px|ממוזער|'''Sclerodactyly, מחלת עור נרחבת (עיבוי עור קשה בידיים ואמות)''']] | |
| − | + | [[קובץ:Sclerodactyly2.jpg|שמאל|300px|ממוזער|'''פצע באצבע''']] | |
| − | # ''' | + | [[קובץ:Sclerodactyly3.jpg|שמאל|300px|ממוזער|'''קלצינוזיס בצילומי רנטגן''']] |
| − | # ''' | + | [[קובץ:טלאנגיאקטזיה.png|שמאל|300px|ממוזער|'''טלאנגיאקטזיה''']] |
| − | + | [[קובץ:טלאנגיאקטזיה1.png|שמאל|300px|ממוזער|'''שינוים פיברוטיים (מחלת ריאות אינטרסטיציאלית) בבדיקת HRCT''']] | |
| − | + | '''למחלת Scleroderma שתי צורות עיקריות בהתאם לחומרת המעורבות של עור:''' | |
| − | + | #'''Scleroderma מוגבלת (LcSSc'''{{כ}}, '''Limited Cutaneous Systemic Sclerosis)''' מופיעה בכ-66 אחוזים מכלל החולים; היא מתאפיינת במעורבות עורית מוגבלת לאזורים היקפיים (כפות ידיים, אמות, פנים, וחלקי הרגל מתחת לברך). LcSSc בעלת מהלך איטי יותר, והיא כוללת תופעת Raynaud והופעת [[כיבים]] בקצות האצבעות (Digital Ulcers, DU). עם הזמן, נוצרת פגיעה במערכת העיכול ובחלק מהחולים יכול להתפתח יתר לחץ דם ריאתי, [[Calcinosis]] (שקיעת גושי סידן בעור ורקמות שהוא חומר דמוי גיר). פורסמו דיווחים על שכיחות לא מבוטלת של מחלת ריאות אינטרסטיציאלית בקרב חולים עם צורת Scleroderma מוגבלת אשר הם נשאים נוגדנים ל-[[נוגדנים ל-anti-Scl-70|70-SCL]] | |
| − | + | #'''Scleroderma נרחבת (DcSSc'''{{כ}}''', Diffuse Cutaneous Systemic Sclerosis)''' מופיעה בכ-33 אחוזים מקרב חולי Scleroderma ובה עיבוי העור מופיע בצורה מפושטת (בנוסף למעורבות פנים, אצבעות ידיים וכפות רגליים, עיבוי העור מופיע גם בזרועות וירכיים, ובעור הבטן והחזה). מהלך של Scleroderma נרחבת סוער יותר, ומתאפיין בהסננה דלקתית של אזורי עור נרחבים. העור הופך לבצקתי ומאבד מגמישותו; החולים מתלוננים על עקצוץ ו[[גרד]], ולעיתים אף על הרגשת "שרפה" וכאבים מפושטים בעור. הבצקת העורית בולטת יותר באצבעות ובכפות הידיים (Puffy Fingers/Puffy Hands). מתיחות העור עלולה להגביל את החולים בתנועת המרפקים, הכתפיים והירכיים ואף בתנועות נשימתיות של בית חזה. בחלק מהמקרים ניתן לחוש ברשרוש בזמן הנעת המפרקים בבדיקה פיזיקלית (Tendon Friction Rubs) כתוצאה ממעורבות נרתיקי גידים בדלקת וב-Fibrosis. לחולים עם Scleroderma נרחבת, תופעות מערכתיות כגון חולשה, עייפות וכאבי מפרקים ושרירים. בכשליש מחולי Scleroderma נרחבת מופיעה מעורבות שרירים, בצורת דלקת ([[Myositis]]) או בצורת איבוד נפח של שרירים (דלדול שרירים) . סמני Myositis כוללים כאבים וחולשה של שרירי הגפיים, עלייה ברמות אנזימי השריר ([[קראטין קינאזה - Creatine kinase|CPK]]{{כ}}, Creatine Phospho Kinaseׂׂׂׂ{{כ}}ׂ), [[אלדולאזה - Aldolase|Aldolase]] וטראנסאמינאזות (Transaminases {{כ}}-[[אספרטאט טרנסאמינאזה - Aspartate transaminase|AST]],{{כ}} Aspartate Aminotransferase | |
| + | {{כ}} /[[אלנין טרנסאמינאזה - Alanine transaminase|ALT]], {{כ}}Alanine Aminotransferase), הפרעה אופיינית בבדיקת אלקטרומיוגרפית ([[EMG]]{{כ}}, Electromyography), איבוד נפח שרירים וירידה בכוח גס של שרירים. בבדיקת הדמיה תהודה מגנטית ([[MRI]]{{כ}}, Magnetic Resonance Imaging) ניתן לאבחן סימני דלקת, נזק ודלדול של שרירים. מעורבות של ריאות (ILD, PF), לב וכליות שכיחות יותר בצורת Scleroderma הנרחבת. הופעת כיבים באצבעות, מעורבות מערכת העיכול, Calcinosis שכיחים ב-Scleroderma נרחבת | ||
| + | #'''Scleroderma ללא ביטוים בעור (Scleroderma sine Scleroderma)''' היא צורה נדירה של Scleroderma (2-1 אחוזים מכלל החולים) אך גם בה יש [[Raynaud syndrome|תסמונת Raynaud]], נמצאים נוגדנים ומעורבות איברים פנימיים אופייניים ל-Scleroderma בעיקר מערכת העיכול ויתר לחץ דם ריאתי | ||
=== שלבי הופעת המחלה === | === שלבי הופעת המחלה === | ||
| + | רוב נתיבי מנגנוני ה-Scleroderma מתקיימים במקביל. מעורבות של כלי דם בצורה של התקפי Raynaud יכולה להקדים ביטוים אחרים של Scleroderma בחודשים ואפילו בשנים. בחלק מהחולים כבר בשלב זה יהיה ניתן למצוא בדם נוגדנים מסוג ANA וגם את אחד הנוגדנים ספציפיים ל-Scleroderma{{כ}} [SCL-70{{כ}}, [[ACA]]{{כ}} (Anti-cardiolipin antibodies){{כ}}, [[RNAP-3]]{{כ}} (RiboNucleic Acid Polymerase)]. בשלבים מוקדמים עיבוי עור הפנים יוצר מראה "צעיר", היעלמות של קמטים והגבלה במפתח הפה. עם הזמן, עיבוי העור ברוב האזורים נסוג, אבל יכולים להישאר שינוים בצבע העור לכיוון שחום יותר או להפך, עם היעדר פיגמנט והלבנה בצורת "מלח ופלפל". השפתיים מאבדות מהעסיסיות, פתח הפה נהיה קטן יותר ונוצרים קמטים אנכיים אופייניים סביב הפה. | ||
| − | + | עם התקדמות Scleroderma יכול להופיע קיבעון של המפרקים (קונטרקטורות, Contractures), שינוי בצורת האצבעות (Sclerodactyly) ונסיגה של קצות האצבעות (Acro-osteolysis) והופעת Calcinosis בעור ורקמות רכות האופייניים לשתי הצורות של Scleroderma, מוגבלת ונרחבת. הבדלים במהלך קליני של מחלה "צעירה" (עד 5–7 שנות מחלה) ומחלה "מאוחרת" בולטים בעיקר ב-Scleroderma נרחבת (DcSSc); הבדלים אלו פחות בולטים במחלה מסוג Scleroderma מוגבלת (LcSSc). | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | '''לא כל החולים מציגים את כל התופעות של Scleroderma.''' | |
| − | |||
| − | את הפגיעה העורית ניתן לאמוד בעזרת המדד | + | === מעורבות עורית - Scleroderma === |
| + | עיבוי העור הוא הביטוי המובהק של Scleroderma. את הפגיעה העורית ניתן לאמוד בעזרת המדד על שם Rodnan{{כ}} (mRSS{{כ}}, Modified Rodnan Skin Score) בבדיקה ידנית. לפי שיטה זו, מחלקים את שטח הגוף ל-17 אזורים (פנים, חזה, בטן, זרועות, אמות, כפות ידיים, אצבעות הידיים, ירכיים, שוקיים, כפות הרגליים) ונותנים ציון בין 0 לבין 3 לכל אזור על פי חומרת העיבוי של העור. מדד mRSS מתייחס לסכום הכולל של נקודות בכל האזורים; מדד mRSS מעל 12 או עליה מהירה בmRSS (מעל 5 נקודות) בפרקי זמן קצרים מעידים על מעורבות נרחבת ומנבא מחלה קשה יותר. הימצאות של נוגדנים ל-70-SCL או RNA-3 מזוהה עם מעורבות עור נרחבת. | ||
| − | ביופסיית עור בשלבים המוקדמים של | + | ביופסיית עור בשלבים המוקדמים של Scleroderma מדגימה הסננה של העור והרקמות התת-עוריות על ידי תאי דלקת ושקיעה של סיבי Collagen סביבם. עם השנים עיבוי העור נסוג במידה מסוימת, אך מותיר עור צלקתי, עם שינויים בצבע באזורים הנגועים. השינויים באצבעות (Sclerodactyly) אינם הפיכים; עיוותים של אצבעות וקיבעון (קונטרקטורות) במפרקים גורמים להפרעה בתפקוד הידיים ולהגבלה בטווח התנועה במפרקים. |
| − | + | מעורבות עורית פוגעת באופן קשה באיכות החיים של החולים, הן במישור הפיזי והן במישור הנפשי. לחולים קשה לקבל את השינויים החלים בגופם, והם סובלים מהערכה עצמית נמוכה ולעיתים אף מ[[חרדה|חרדות]], [[נדודי שינה - Insomnia|נדודי שינה]] ו[[דיכאון]]. | |
| − | + | טיפול ב-Scleroderma נרחבת הוא אתגר. במחקר קליני מבוקר (RCT{{כ}}, Randomized Controlled Trial) נמצא ש-[[Methotrexate]] עוזר במחלת עור נרחבת{{הערה|שם=הערה3|Pope JE, Bellamy N, Seibold JR, et al. A randomized, controlled trial of methotrexate versus placebo in early diffuse scleroderma. Arthritis Rheum. 2001 Jun;44(6):1351-8. }}. | |
| − | + | ב-RCT שמטרתם הייתה בדיקת יעילות של [[Cyclophosphamide]] ו-[[Mycophenolate Mofetyl]] ({{כ}}[[Cellcept]]) במחלת ריאות אינטרסטיציאלית, נבדקה גם השפעתן על העור; Cyclophosphamide ו-Cellcept שיפרו את המצב של העור בצורה משמעותית{{הערה|שם=הערה4|Volkmann ER, Tashkin DP, LeClair H, et al. Treatment With Mycophenolate and Cyclophosphamide Leads to Clinically Meaningful Improvements in Patient-Reported Outcomes in Scleroderma Lung Disease: Results of Scleroderma Lung Study II. ACR Open Rheumatol. 2020 Jun;2(6):362-370. }}. | |
| − | [[ | + | דווח כי טיפול בקרני אור אולטרה סגול (Ultra-Violet ,[[טיפול פוטותרפיה ו-PUVA במחלות עור - הנחיה קלינית - Phototherapy and PUVA in skin diseases|UV]]) עשויות לסייע להתרככות העור בחולים עם Scleroderma נרחבת. בעקבות מידע מדעי שהצטבר נערכו מספר RCT עם טיפולים ביולוגיים שונים. במחקרים שונים, מחקר ASSET{{כ}} (Adolescents' Social Stresses, Emotions, and Thoughts) עם [[Abatacept]] (מכוון לתאי T לימפוציטים), מחקרים FocuSSced{{כ}} (A Study of the Efficacy and Safety of Tocilizumab in Participants With Systemic Sclerosis) ו-FaSScinate{{כ}} (Safety and efficacy of Subcutaneous tocilizumab in Systemic Sclerosis) עם [[Tocilizumab]] (מכוון לקולטנים ל6-IL){{כ}}{{הערה|שם=הערה6|Khanna D, Denton CP, Lin CJF, et al. Safety and efficacy of subcutaneous tocilizumab in systemic sclerosis: results from the open-label period of a phase II randomised controlled trial (faSScinate). Ann Rheum Dis. 2018 Feb;77(2):212-220.}}{{הערה|שם=הערה7|Khanna D, Lin CJF, Furst DE, et al; focuSSced investigators. Tocilizumab in systemic sclerosis: a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir Med. 2020 Oct;8(10):963-974. }}, מחקר RISE-SSc{{כ}} (Riociguat in patients with early diffuse cutaneous systemic sclerosis) עם [[Riociguat]] (ממריץ Guanylate cyclase{{כ}}){{הערה|שם=הערה8|Khanna D, Allanore Y, Denton CP, et al. Riociguat in patients with early diffuse cutaneous systemic sclerosis (RISE-SSc): randomised, double-blind, placebo-controlled multicentre trial. Ann Rheum Dis. 2020 May;79(5):618-625. }} ומחקר CORBUS עם [[T:Lenabasum|Lenabasum]] (מכוון לקולטנים קנאביואידים, Cannabinoids{{כ}}){{הערה|שם=הערה9|Spiera R, Hummers L, Chung L, et al. Safety and Efficacy of Lenabasum in a Phase II, Randomized, Placebo-Controlled Trial in Adults With Systemic Sclerosis. Arthritis Rheumatol. 2020 Aug;72(8):1350-1360. }} נבדקה השפעתה של תרופת מחקר על עיבוי העור לפי שינוי של מדד Rodnan או על פי מדד מורכב ממספר נתונים CRISS{{כ}} (Combined Response Index in Diffuse Cutaneous Systemic Sclerosis); מחקרים לא השיגו נקודת יעד ראשונית (Primary endpoint). בסדרות קטנות לא מבוקרות דווח על הטבה במצב העור בעקבות טיפול ב-[[Rituximab]] מכוון לנוגדן [[CD20]] מוצג על פני לימפוציטים מסוג B{{כ}}{{הערה|שם=הערה10|Tang R, Yu J, Shi Y, et al. Safety and efficacy of Rituximab in systemic sclerosis: A systematic review and meta-analysis. Int Immunopharmacol. 2020 Jun;83:106389. }}. דווח על יעילות של [[T:Romilkimab|Romilkimab]] (נוגדן המכוון לנטרל IL-4 /IL-13) לטיפול במעורבות של עור ב-Scleroderma{{כ}}{{הערה|שם=הערה11|Allanore Y, Wung P, Soubrane C, et alP; Investigators. A randomised, double-blind, placebo-controlled, 24-week, phase II, proof-of-concept study of romilkimab (SAR156597) in early diffuse cutaneous systemic sclerosis. Ann Rheum Dis. 2020 Dec;79(12):1600-1607. }}. פורסמו תוצאות של RCT אירופאי (ASTIS{{כ}}, The Autologous Stem Cell Transplantation International Scleroderma){{כ}}{{הערה|שם=הערה12|van Laar JM, Farge D, Sont JK, et al; EBMT/EULAR Scleroderma Study Group. Autologous hematopoietic stem cell transplantation vs intravenous pulse cyclophosphamide in diffuse cutaneous systemic sclerosis: a randomized clinical trial. JAMA. 2014 Jun 25;311(24):2490-8. }} ואמריקאי (SCOT{{כ}}, Scleroderma: Cyclophosphamide Or Transplantation){{הערה|שם=הערה13|Sullivan KM, Goldmuntz EA, Keyes-Elstein L, et al; SCOT Study Investigators. Myeloablative Autologous Stem-Cell Transplantation for Severe Scleroderma. N Engl J Med. 2018 Jan 4;378(1):35-47. }} על טיפול בהשתלת תאי האב של מח העצם ([[HSCT]]{{כ}}, Hematopoietic Stem-Cell Transplantation) בחולים עם מחלת עור דוהרת. טיפול ב-HSCT הראה הטבה משמעותית בעור, הטבה במצב הריאות ובהישרדות לטווח הארוך; הערכה מערכתית קפדנית לפני HSCT ובחירה של חולים מתאימים להשתלה (ללא מעורבות לב או מעורבות ריאות משמעותית) אפשרו שיפור בתוצאות התחלואה והתמותה הקשורים לפעולה עצמה ושיפרו את שיעורי ההישרדות במהלך שנות המעקב. טיפולים משלימים כמו פיזיותרפיה, הידרותרפיה וריפוי בעיסוק מהווים חלק חשוב מהטיפול הכללי בפגיעה העורית, ומסייעים בשמירה על גמישות העור, גידים ומפרקים. לביטויים עוריים מסוימים, כגון טלאנגיאקטזיות, שינויים בצבע העור ו-Calcinosis טרם נמצא טיפול יעיל. |
| − | [[ | ||
| − | + | '''סיכום:''' | |
| − | + | המעורבות העורית מהווה ביטוי קליני מובהק של Scleroderma. ברוב המקרים, חומרת הפגיעה בעור תואמת את חומרת המעורבות של מפרקים, שרירים ואיברים חיוניים. | |
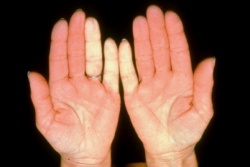
| − | + | ===תופעת Raynaud === | |
| + | [[קובץ:תופעת ריינו.jpg|שמאל|300px|ממוזער|'''תופעת ריינו''']] | ||
| + | תופעה Raynaud היא ביטוי הכרחי של Scleroderma. תופעה זו יכולה להקדים ביטויים אחרים של המחלה בשנים רבות, בעיקר בצורתה המוגבלת. ב-Scleroderma נרחבת תסמונת Raynaud מופיעה במקביל או בסמוך להופעה של עיבוי העור. ביטוי עיקרי של תופעת Raynaud הוא שינוי חולף בצבע עור: חוור-לבן, כחול-סגול ואדום נובע מהתכווצות של נימי דם במצבים של קור או התרגשות. לרוב התקפי תופעת Raynaud מתרחשים באצבעות הידיים, פחות שכיחה מעורבות אצבעות ברגליים ועוד יותר נדירים התקפי Raynaud בקצה האף, לשון, פטמה. [[עישון]] סיגריות הוא גורם הסיכון המיוחס לחומרת הביטוי של תופעת Raynaud והכיבים. | ||
| − | + | '''תופעת Raynaud ראשונית''' – מופיעה אצל אנשים ללא היסטוריה של מחלת רקמות חיבור (Connective Tissue Disease, CTD) או הפרעות קרישה או הפרעה באספקת דם לעורקים ([[Peripheral Vascular Disease]]). תסמונת Raynaud ראשונית שכיחה בקרב נשים צעירות, וב-30 אחוזים מהמקרים קיים סיפור משפחתי. בתסמונת Raynaud ראשונית אין שינויים מבניים בכלי הדם, לא מוצאים נוגדנים עצמיים ואין סיבוכים כמו Ischemia, כיבים, או נמק. בדיקת נימי דם העוריים סביב מיטת הציפורן בהגדלה בעזרת מכשיר קפילרוסקופ (Capillaroscopy) מדגימה נימי דם תקינים. | |
| − | + | '''תופעת Raynaud משנית''' – מופיעה כביטוי של מחלות אוטואימוניות (Autoimmune) או בעקבות הפרעות קרישה או מחלות כלי דם. בתופעת Raynaud משנית ל-CTD (כולל Scleroderma) ההתקפים מופיעים בתדירות גבוהה ובעוצמה רבה יותר, התקפים מלווים בהרגשת נימול או דקירות בקצות האצבעות. ב-Scleroderma, תופעת Raynaud נובעת מעיבוי ניכר בדופן נימי דם ועורקים, היצרות וסגירה שלהם עם ההפרעה באספקת הדם לרקמות. בחולים עם הופעת תופעת Raynaud חדשה הימצאות נוגדנים עצמיים כמו ANA ונוגדנים ספציפיים 70-SCL{{כ}}, ACA{{כ}}, RNAP-3 מעלים חשד ל-Scleroderma. בתופעת Raynaud על קרע Scleroderma בדיקת קפילרוסקופיה מדגימה את השינויים האופייניים למחלה כולל הופעת דימום מחוץ לנימי דם, נימי דם ענקיים "Giant Capillaries", ירידה במספר ואף היעלמות של נימי דם עם הופעת נימים בעלי צורה מופרעת. במחקר תצפיתי VEDOSS{{כ}} (Very Early Diagnosis of Systemic Sclerosis) של קבוצה אירופאית לחקר Scleroderma{{כ}} EUSTAR ({{כ}}[https://eustar.org European Scleroderma Trials and Research group]{{כ}}){{הערה|שם=הערה14|Minier T, Guiducci S, Bellando-Randone S, et al; EUSTAR co-workers; EUSTAR co-workers. Preliminary analysis of the very early diagnosis of systemic sclerosis (VEDOSS) EUSTAR multicentre study: evidence for puffy fingers as a pivotal sign for suspicion of systemic sclerosis. Ann Rheum Dis. 2014 Dec;73(12):2087-93. }} שילוב של תופעת Raynaud עם בדיקת ANA חיובית והופעת נפיחות באצבעות (Puffy Fingers) ניבא התפתחות של מחלת רקמות חיבור בכ-40 אחוזים מהמקרים. במקרים בהם נמצאו אחד מהנוגדנים האופייניים ל-Scleroderma (70-SCL או ACA) בשילוב עם שינויים אופייניים בבדיקת קפילרוסקופיה, הסיכוי להתפתחות של Scleroderma היה 7.4 אחוזים בשנה ראשונה, 29.3 אחוזים אחרי 3 שנים ו-44.1 אחוזים אחרי 5 שנים. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | [ | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
=== כיבים באצבעות (Digital Ulcers, DU) === | === כיבים באצבעות (Digital Ulcers, DU) === | ||
| + | [[קובץ:כיבים באצבעות.jpg|שמאל|300px|ממוזער|'''כיבים באצבעות''']] | ||
| + | [[קובץ:Pitting Scar.jpg|שמאל|300px|ממוזער|'''Pitting Scar''']] | ||
| + | כיבים בעור מופיעים במחצית מחולי ה-Scleroderma. מיקומם בדרך כלל בקצות האצבעות אך הם עשויים להופיע גם במקומות בהם העור מתוח: מעל מפרקי כפות הידיים או מעל המרפקים. הופעת פצעים בבהונות הרגליים יחסית נדירה. שליש מהחולים סובלים מכיבים חוזרים בעלי אופי עקשני עם נמק ונטייה לזיהום ברקמות. לאחר ריפוי הכיבים, נותרת בקצות האצבעות צלקת עגולה וקעורה, הנקראת Pitting Scar. | ||
| − | + | הכיבים משפיעים באופן משמעותי על איכות החיים בשל עוצמת הכאבים הגבוהה והירידה בתפקוד הכללי במיוחד בתפקוד הידיים. בשאלונים להערכת תפקוד כללי בשם SHAQ ({{כ}}Scleroderma Health Assessment Questionnaire) חולים רבים דיווחו על השפעה ניכרת בפעילות יום-יומית כללית ובזאת שתלויה בתפקוד הידיים. | |
| − | |||
| − | + | מטרות הטיפול בכיבים הן ריפוי ושיפור איכות החיים של המטופלים. חשוב לשמור על היגיינה טובה של הידיים, לשמן אותן עם קרם לחות, למנוע פצעים טראומטיים ולהפסיק עישון. | |
| − | + | לטיפול בתסמונת Raynaud משתמשים במרחיבים כלי דם כגון [[T:Calcium channel blockers - C08|חוסמי תעלות סידן]], [[מעכבי ACE]]{{כ}} (Angiotensin Converting Enzyme) ותרופות נוגדות דיכאון בשל השפעתן החיובית על הרחבה של כלי דם קטנים. חולים שאינם משתפרים עם טיפול פומי, נזקקים לטיפול בעירוי לווריד של [[Iloprost]]. ב-RCT מתן של עירוי Iloprost לחולי Scleroderma הביא לשיפור משמעותי בתדירות וחומרת התקפי Raynaud וקידום ריפוי פצעים. עם סימני זיהום בפצע, משתמשים ב[[אנטיביוטיקה]] (רצוי בהתאם לתוצאות תרבית מהפצע) מקומי או סיסטמי. במקרים קשים, ייתכן צורך בהטריה כירורגית של הרקמות הנמקות. במקרים של Ischemia קשה ונמק עמידים לטיפול יש צורך בבדיקות קרישה, בהערכה של מומחה כלי דם והדמיה של העורקים בעזרת [[Ultrasound]] או אנגיוגרפיה ([[Angiography]]). במקרים של Ischemia עמידה לטיפול ניתן לשקול סימפטקטומיה ([[Sympathectomy]]) ושימוש ב[[תא לחץ]]. במקרים של הפרעות קרישה, מומלץ להוסיף טיפול בנוגדי קרישה (זריקות [[Clexane]], [[T:Enoxaparin|Enoxaparin]]). שני RCT הראו יעילות של [[Bosentan]] {{כ}}(Tracleer){{כ}}{{הערה|שם=הערה15|Matucci-Cerinic M, Denton CP, Furst DE, Mayes MD, Hsu VM, Carpentier P, Wigley FM, Black CM, Fessler BJ, Merkel PA, Pope JE, Sweiss NJ, Doyle MK, Hellmich B,Medsger TA Jr, Morganti A, Kramer F, Korn JH, Seibold JR. Bosentan treatment of digital ulcers related to systemic sclerosis: results from the RAPIDS-2 randomised, double-blind, placebo-controlled trial. Ann Rheum Dis. 2011 Jan;70(1):32-8.}} המעכב קולטנים ל-Endothelin-1, במניעת הופעה של כיבים חדשים בקרב חולי Scleroderma. דווח על יעילות של [[Sildenafil]] מעכב של Phosphodiesterase{{כ}} (PDE-5, {{כ}}Phosphodiesterase type 5 inhibitor) על כיבים איסכמיים (Ischemic) עמידים לטיפול. | |
| − | |||
| − | |||
| − | [ | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | כ | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | במקרים קשים ייתכן צורך בהטריה כירורגית של הרקמות הנמקות. במקרים עמידים לטיפול יש צורך בהערכה של מומחה כלי דם והדמיה של העורקים בעזרת | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
=== מעורבות איברים פנימיים === | === מעורבות איברים פנימיים === | ||
| − | + | מעורבות האיברים הפנימיים היא הקובעת את חומרת המחלה ואת הפרוגנוזה. המעורבות הראייתית היא הגורם העיקרי למוות בקרב חולי ה-Scleroderma, ולאחריה המעורבות הלבבית, הכלייתית, ומעורבות מערכת העיכול. | |
| − | מעורבות האיברים הפנימיים היא הקובעת את חומרת המחלה ואת הפרוגנוזה. המעורבות | ||
==== מעורבות ריאתית ==== | ==== מעורבות ריאתית ==== | ||
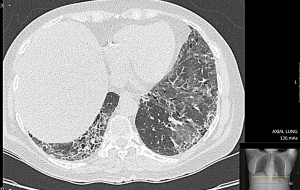
| + | מעורבות הריאות בחומרה שונה מופיעה בכ-80 אחוזים מחולי Scleroderma, ב20–30 אחוזים מהם למעורבות ריאות השלכת קלינית ניכרת. מעורבות ריאות בדרך כלל מתבטאת במחלת ריאות אינטרסטיציאלית. כ-60 אחוזים מהחולים עם ILD ו-PF הם חולים עם מחלת Scleroderma נרחבת; בכ-40 אחוזים מחולים עם ILD וPF מחלת העור היא מוגבלת. נוגדני 70-SCL מזוהים עם ILD ו-PF בקרב חולי Scleroderma נרחבת ומוגבלת. שכיחות של ILD ו-PF בקרב חולים עם מחלת Scleroderma מוגבלת הנושאים נוגדנים מסוג ACA נמוכה. בשלבים המוקדמים של Scleroderma, בעיקר בנוכחות נוגדנים מסוג 70-SCL, מתפתחת דלקת בדופן נאדיות הריאה הנקראת [[Alveolitis]]. עם התקדמות של Alveolitis מתפתחת Fibrosis ריאתית. מעורבות ריאתית משמעותית גורמת באופן בלתי נמנע ליתר לחץ דם ריאתי ומצוקה לבבית. | ||
| − | + | בשלבים המוקדמים הסתמנות של ILD אינה ספציפית ולרוב סמויה. כשליש מהחולים מתלוננים על [[שיעול - Cough|שיעול]] יבש, ממושך וטורדני ו[[קושי בנשימה|קשיי נשימה]] במאמץ, [[כאבים בחזה - גישה - Approach to chest pain|מיחושים לא ספציפיים בחזה]], [[חולשה]] ו[[עייפות]]. עם התקדמות השינויים הפיברוטיים בריאות, מופיע חוסר אוויר במאמץ קטן ובמנוחה. לרוב החולים יש. בבדיקה פיזיקלית שומעים חרחורים יבשים מעל בסיסי הריאות. בשלבים המתקדמים של ה-Fibrosis בריאות וירידה בריווי החמצן בדם, מופיעים סימנים של [[אי ספיקת לב]] ימין (גודש ורידי צוואר, הפרעות קצב הלב, הגדלת כבד, מיימת ובצקות ברגליים. בדיקת בית החזה בעזרת צילומי רנטגן איננה רגישה לגילוי של ILD; הבדיקה המומלצת לגילוי ולהערכה של ILD היא בדיקת טומוגרפיה ממוחשבת ברזולוציה גבוהה של בית החזה (High Resolution Computer Tomography ,HRCT). בדיקת HRCT מאפשרת לקטלג שינוים אינטרסטיציאליים בשדות ריאות כמו "זכוכית מט" ([[Ground Glass Opacities]], GGO), שינוים רשתיים (Reticular Changes) או שינוים בצורת "חלת דבש" (Honey Combing), והרחבה של הסמפונות ((Traction Bronchiectasis. לשינויים אינטרסטיציאליים בריאות מספר צורות; בהכשר ל-CTD השכיחות ביניהן [[NSIP]]{{כ}} (Non-Specific Interstitial Pneumonia) ו-[[UIP]]{{כ}} (Usual Interstitial Pneumonia). ב-Scleroderma, יותר שכיחה NSIP ופחות שכיחה צורה של UIP; ל-UIP התקדמות ה-Fibrosis עמוקה יותר לעומת NSIP. קיימת התאמה בין חומרת השינויים ב-HRCT וירידה במדדי תפקודי נשימה; פגיעה ביותר מ-20 אחוזים משטחי הריאות, המודגמת ב-HRCT, מנבאת שיעורי תחלואה ותמותה גבוהים יותר בקרב חולי Scleroderma. הומלץ על ביצוע HRCT של בית החזה לכל חולה Scleroderma חדש ומעקב סדיר אחרי שינויים בפרקי זמן נדרשים (בין 6–12 חודשים), בייחוד בחולה עם גורמי סיכון לILD) Scleroderma נרחבת, הימצאות נוגדנים 70-SCL). הפרעה בתפקודי נשימה נמצאה בכ-25 אחוזים מהחולים כבר ב-3 השנים הראשונות מתחילת ה-Scleroderma. בין המדדים העיקריים להערכת מצב הריאות בחולי Scleroderma בדיקת נפח FVC {{כ}}(Forced Vital Capacity) ובדיקת חילופי גזים DLCO{{כ}} (Diffusing Capacity of the Lungs For Carbon Monoxide). ירידה מקבילה ב-FVC ו-DLCO מצביעה על קיומה של ILD. ערכי DLCO ו-FVC נחשבים ירודים כאשר הם מתחת ל-80 אחוזים מהתקן ביחס לגיל, מין וגובה. ירידה מעבר ל-50 אחוזים מצביעה על פגיעה ראייתית קשה ומנבאת שיעור תמותה גבוה ב-3 השנים הבאות. ירידה של כ-10 אחוזים ב-FVC וכ-15 אחוזים בDLCO בפרקי זמן קצרים נחשבת כסמן למחלת ILD מתקדמת. חולי Scleroderma עם ILD מתקשים בהליכה של 6 דקות ([[6 Minute Walk Test|Minute Walk Test {{כ}}6]]); מרחק הליכה הנמוך מ-300 מטר וירידה בריווי חמצן הנמדדת באצבע בעזרת מכשיר [[Oxymeter]] לפני ואחרי המאמץ מעיד על מעורבות ריאות משמעותית. לבדיקת שטיפת סמפונות אין תרומה משמעותית לאבחנה של ILD, לרוב נעזרים בה בחשד למחלת ריאות אחרת (זיהום וכדומה). [[ביופסיה]] פתוחה מריאה איננה חובה בחשד ל-ILD; לרוב ביופסיה מתבצעת לצורכי מחקר או במקרים בהם אבחנה של ILD מוטלת בספק. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | בבדיקה | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | ==== | + | מטרת הטיפול ב-ILD היא בלימה של תהליך דלקתי ו-Fibrosis ריאתי, שיפור ב[[תפקודי ריאות|תפקודי הנשימה]], בתפקוד הכללי, באיכות החיים, ובהישרדות של החולים. בשני RCT,{{כ}} Scleroderma Lung Study{{כ}} 1 ו-2{{כ}} (SLS-2, SLS-1){{כ}}{{הערה|שם=הערה16|Tashkin DP, Elashoff R, Clements PJ, et al; Scleroderma Lung Study Research Group. Effects of 1-year treatment with cyclophosphamide on outcomes at 2 years in scleroderma lung disease. Am J Respir Crit Care Med. 2007 Nov 15;176(10):1026-34. }}{{הערה|שם=הערה17|Tashkin DP, Roth MD, Clements PJ, et al; Sclerodema Lung Study II Investigators. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma-related interstitial lung disease (SLS II): a randomised controlled, double-blind, parallel group trial. Lancet Respir Med. 2016 Sep;4(9):708-719. }} דווח על יעילות של [[Cyclophosphamide]] ו-[[Mycophenolate Mofetil]] בחולים עם ILD על רקע Scleroderma. ב-RCT{{כ}} SENSCIS{{כ}} (Nintedanib for Systemic Sclerosis–Associated Interstitial Lung Disease), (מעקב [[Tyrosine Kinase]] ברקמת ריאות) [[Nintedanib]]{{הערה|שם=הערה18|Distler O, Highland KB, Gahlemann M, et al; SENSCIS Trial Investigators. Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. N Engl J Med. 2019 Jun 27;380(26):2518-2528. }} האט משמעותי ירידה בנפחי הריאות (FVC) עד 50 אחוזים בהשוואה ל-Placebo. ב-RCT INBUILD{{כ}} (Nintedanib in Progressive Fibrosing Interstitial Lung Diseases){{כ}}{{הערה|שם=הערה19|Flaherty KR, Wells AU, Cottin V, et al; INBUILD Trial Investigators. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med. 2019 Oct 31;381(18):1718-1727.}} בקרב חולים עם מחלת ריאות פיברוטית אידיופתית (Interstitial Pulmonary Fibrosis ,[[IPF]]) ו-ILD בקבוצה של מחלות CTD כולל Scleroderma, [[תסמונת שיוגרן - Sjögren's syndrome|תסמונת Sjogren]]{{כ}}, [[Dermatomyositis]], [[דלקת מפרקים - Arthritis|דלקת מפרקים]], טיפול ב-Nintedanib הביא להאטה משמעותית של הידרדרות בערכי FVC במחצית מהחולים. דווח על שיפור במצב הריאות בבדיקות דימות ובתפקודי נשימה בחולים שעברו HSCT במסגרת RCT על טיפול ב-Scleroderma נרחבת. חולי Scleroderma רבים סובלים ממעורבות של הושט על רקע [[GERD|Reflux]] אשר יכול לגרום לשאיפת תוכן קיבה למערכת נשימה (Aspiration). הומלץ על שימוש במעקבי חומצה מסוג Proton Pump Inhibitors {{כ}}([[T:Proton pump inhibitors - A02BC|PPI]]) למניעת השלכות של Reflux ושאיפות. חיוני [[הפסקת עישון|להפסיק עישון]], לבצע [[פעילות גופנית]] ארובית מתונה, התעמלות ו[[שיקום נשימתי]] במכוני ריאות מוכרים. לחולים עם ILD הומלץ ביצוע [[חיסון נגד חיידק הפנוימוקוקוס|חיסון נגד דלקת ריאות]] [[T:Pneumovax-23|Pneumovax-23]] ו-[[13-T:Prevenar|13-Prevenar]] ו[[חיסון נגד שפעת|חיסון נגד שפעת עונתית]]. בעקבות התפשטות מגפת ה-COVID-19 ([[נגיף קורונה]]) לחולים עם ILD הומלץ על חיסון נגד נגיף קורונה. בחולים עם ILD מתקדמת וסימנים של PAH, הומלץ על טיפול תומך בחמצן וטיפול באי ספקת לב. במקרים בהם פגיעה בריאות היא קשה עם מצוקה נשימתית, יש מקום לשקול השתלת ריאה. |
| − | + | '''סיכום:''' | |
| − | + | ב-Scleroderma מחלת ריאות אינטרסטיציאלית מופיעה בשנים הראשונות מתחילת Scleroderma, בעיקר ב-Scleroderma נרחבת והמצאות נוגדנים SCL-70. התסמינים הקליניים של ILD אינם ספציפיים ויכולים להיות מוסתרים על ידי ביטוים של Scleroderma. ישנה חשיבות רבה לגילוי מוקדם של ILD ולהערכה קלינית מסודר כולל מעקב אחרי שינוים ב-HRCT תפקודי נשימה. טיפול מוקדם עשוי למנוע את התפשטות של Fibrosis בריאות, לשמור על תפקודי הנשימה ולמנוע הידרדרות נשימתית ולבבית. בין הטיפולים המומלצים Cyclophosphamide או Mycophenolate Mofetil בהתחשבות בביטוים אחרים של Scleroderma (עור, מפרקים, שרירים, לב). המקום של [[טיפולים ביולוגיים]] ו-HSCT לטיפול ב-ILD בחולי Scleroderma טרם הובהר. טיפול ב-Nintedanib מאט קצב הידרדרות של תפקודי נשימה ומונע התפשטות של Fibrosis בריאות. | |
==== יתר לחץ דם ריאתי ==== | ==== יתר לחץ דם ריאתי ==== | ||
| + | יתר לחץ דם ריאתי נחשב לאחד הביטויים הקשים של Scleroderma, עם שיעורי תחלואה ותמותה גבוהים. 15-10 אחוזים מהחולים מפתחים PAH בעל משמעות קלינית. ב-Scleroderma נרחבת PAH לרוב מופיעה משנית ל-ILD מתקדמת; PAH שכיחה יותר ב-Scleroderma מוגבלת בת מהלך ממושך. ביטוים קליניים של PAH אינם ספציפיים: עייפות, מיחושים בבית החזה וקשיי נשימה במאמץ. עם התקדמות המחלה, מופיעים קשיי נשימה במאמצים קלים ואף במנוחה ותחושת עילפון במאמץ. קוצר נשימה במנוחה, איבוד הכרה וסימנים של אי ספיקת לב ימין הם ביטויים מאוחרים של PAH. ב[[בדיקה גופנית]] סימנים מופיעים בשלב מאוחר כגון קול שני מודגש מעל העורק הריאתי וסימנים של אי ספיקת לב ימין. ב[[אקג]] מופיעים סטייה ימנית של ציר הלב וסימני עומס על חדר ימין. בצילום חזה רואים הרחבת כלי דם בשערי הריאות ומיעוט כלי דם בפריפריה. [[אקו לב]] (Echocardiography, Echo) במנוחה היא בדיקה בחירה לגילוי של PAH עם הערכת לחץ בעורקי הריאה בצורה עקיפה. האבחנה של PAH מבוססת על מדידה ישירה של הלחץ בעורק הריאה באמצעות צנתור לב ימין. במהלך הצנתור מודדים באופן ישיר לחץ הדם בעורק הריאתי, בפרוזדור ובחדר ימין; בנוסף מודדים ומפל לחצים בין צד ימין וצד שמאל של הלב (לחץ יתד), תפוקת לב ימין ועוד פרמטרים נוספים. עליה של לחץ ממוצע בעורק הריאה מעל 20 מילימטרים כספית (ממ"כ) במנוחה או 25 ממ"כ במאמץ מוגדרת כ-PAH. בהיעדר לחץ יתד מוגבר (Wedge Pressure גדול מ-15 ממ"כ) העלייה בלחץ הריאתי נקשרת למעורבות הריאות; עליה בלחץ יתד מעל 15 ממ"כ מצביעה על מעורבות של הלב במחלה. במהלך [[צנתור לב - Heart Catheterization|צנתור]] גם נבדקים השפעת התרופות והעמידות של לב ימין להעמסת נוזלים. | ||
| − | + | PAH נובע מפגיעה בשכבת האנדותל בנימי דם של הריאה, המלווה בהפרעה באיזון בין החומרים המכווצים את כלי הדם ולחומרים המרחיבים את כלי הדם הריאתיים. בקרב חולי Scleroderma הסובלים מ-PAH נמצאו רמות גבוהות של [[אנדותלין - Endothelin|Endothelin-1]], מכווץ כלי הדם החזק ביותר, וחסר של מרחבי כלי דם חזקים כמו Nitric Oxide ו-[[Prostacyclin]]. כתוצאה מכך, נימי דם מתכווצים, מתקיים שגשוג תאי שריר החלק בדופן שלהם והדופן נהיה מתעבה עם היצרות ניכרת עד לסגירה מלאה של כלי דם והפרעה זרימת הדם בנימי דם ועורקים של ריאות. כתוצאה מכך הלחץ במערכת עורקי הריאה עולה עד לפגיעה בתפקוד וכישלון של הלב הימני. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | ל-PAH מהלך מתקדם עם תוחלת החיים קצרה עד 2.5 שנים מעת האבחון, לכן לגילוי מוקדם של PAH חשיבות עליונה. חולים עם Scleroderma צריכים לעבור הערכה קלינית חוזרת בפרקי זמן מוגדרים, הכוללת הערכה תפקודית לפי New York Heart Association{{כ}} (NYHA), בדיקה גופנית, תפקודי נשימה ואקו לב. בחולים עם PAH בבדיקת תפקודי נשימה ישנה ירידה בממד לחילוף גזים בריאות (DLCO), בבדיקת הליכה 6 דקות ישנה ירידה במרחק הליכה וירידה בריווי חמצן בסיום ההליכה. להערכה של PAH ומצב לבבי משתמשים בסמנים ביולוגיים כגון [[פפטיד מוחי נתריורטי - Brain natriuretic peptide|BNP]]{{כ}} (Brain natriuretic peptide) ומקבילו NT- pro-BNP{{כ}} (N-Terminal-pro hormone BNP), רמתם עולה ב-PAH ומצוקה לבבית; ישנה התאמה בין רמת BNP\PRO-BNP לחומרת PAH, חומרת אי ספיקת לב והצפי לתגובה לטיפול. | |
| − | + | לתרופות לטיפול ב-PAH תכונות של מרחיבים חזקים של כלי דם אך גם יכולת למנוע שגשוג של תאי השריר החלק בדופן של כלי הדם בריאות ובדרך הזו יכולת למנוע היצרות של נימי דם ועורקים בריאות. מקטלגים טיפולים תרופתיים ב-PAH לפי מנגנוני הפעולה: | |
| + | #קבוצת פרוסטציקלינים סינתטיים: [[Epoprostenol]]{{כ}} ([[Flolan]]) הניתן תוך-ורידית דרך משאבה, [[Iloprost]] הניתן תוך ורידית דרך משאבה או בשאיפה, [[Treprostinil]]{{כ}} (Remodulin) הניתן תוך ורידית או תת-עורית דרך משאבה או בשאיפה. הוחל שימוש ב-[[Selexipag]]{{כ}} (Uptravi){{כ}}{{כ}}{{הערה|שם=הערה20|Gaine S, Chin K, Coghlan G, Channick R, et al. Selexipag for the treatment of connective tissue disease-associated pulmonary arterial hypertension. Eur Respir J. 2017 Aug 17;50(2):1602493. }}, תרופה פומית הפועלת כ-Agonist של קולטן ל-Prostacyclin ובדרך זו מגבירה את כמות ופעילות הפרוסטציקלינים | ||
| + | #תרופות המעכבות את Endothelin-1{{כ}} (Endothelin Receptor Antagonists, ERA){{כ}}; [[Bosentan]] {{כ}}(Tracleer), מעכב בלתי סלקטיבי של קולטנים ל-Endothelin-1 (קולטני A ו-B) ו-[[Ambrisentan]] {{כ}}(Volibris){{כ}}{{הערה|שם=הערה21|Pan Z, Marra AM, Benjamin N, et al. Early treatment with ambrisentan of mildly elevated mean pulmonary arterial pressure associated with systemic sclerosis: a randomized, controlled, double-blind, parallel group study (EDITA study). Arthritis Res Ther. 2019 Oct 26;21(1):217. }} מעכב בררני של קולטן A ל-Endothelin-1, ו-[[Maicitentan]]{{כ}} (Opsumit){{כ}}{{הערה|שם=הערה22|Galiè N, Jansa P, Pulido T, et al. SERAPHIN haemodynamic substudy: the effect of the dual endothelin receptor antagonist macitentan on haemodynamic parameters and NT-proBNP levels and their association with disease progression in patients with pulmonary arterial hypertension. Eur Heart J. 2017 Apr 14;38(15):1147-1155. }}, מעקב דואלי של Endothelin-1 | ||
| + | #תרופות מעכבות Phosphodiesterase{{כ}} 5{{כ}} ([[T:Drugs used in erectile dysfunction - G04BE|5-PDE]]) הגורמות ליצירה של Cyclic Guanosine Monophosphate{{כ}} ([[cGMP]]) אחד המרחיבים החזקים של כלי הדם הודות לעליה של רמת Nitric Oxide, בהם [[Sildenafil]]{{כ}} (Revatio) ו- Tadalafil{{כ}} ([[Cialis]]). {{כ}}[[Riociguat]]{{כ}} (Adampas){{כ}}{{הערה|שם=הערה23|Humbert M, Coghlan JG, Ghofrani HA, et al. Riociguat for the treatment of pulmonary arterial hypertension associated with connective tissue disease: results from PATENT-1 and PATENT-2. Ann Rheum Dis. 2017 Feb;76(2):422-426. }} הוא ממריץ המסיס [[Guanylate Cyclase]]{{כ}} (sGC) המגביר מחזורי Cyclic Guanosine Monophosphate{{כ}} (cGMP) ויצירה של Nitric Oxide | ||
| − | + | {{ש}}טיפול ב-PAH ניתן בהתאם לתוצאות של צנתור לב ימין ועל פי דרגה תפקודית לפי NYHA. בחולים עם PAH והפרעה תפקודית בדרג קלה (II-I Class NYHA), הטיפול המומלץ כולל שימוש תרופות מסוג ERA, מעכבים PDE-5, Selexipag, Riociguat ושאיפה של Prostacyclin סינתטי. במהלך המעקב החולים עם PAH כולל אקו לב, תפקודי נשימה כולל מבחן הליכה 6 דקות, בדיקות דם לרמת BNP או Pro-BNP; במקרים של חוסר תגובה לטיפול מתבצע צנתור לב ימין חוזר ובהתאם לתוצאות יישקל טיפול מוגבר. מתגבשת המלצה לטפל ב-PAH עם שילובי תרופות עם מנגנוני פעולה שונים במטרה למנוע התקדמות של PAH ולשמר את הדרגה התפקודית והמדדים ההמודינמיים. בחולים עם PAH גבוה והפרעה ניכרת בתפקודית (NYHA Class III-IV), הטיפול המועדף יהיה במתן פרוסטציקלינים סינתטיים לווריד או תת-עור בהזלפה ללא הפסקה בשילוב עם תרופות נוספות. חולים עם כשל לב ימין על רקע PAH מקבלים טיפול תומך בחמצן, משתנים ([[Spironolactone]], [[Furosemide]]), תרופות להסדרת קצב הלב ועוד. במצבים של PAH קשה וסמני אי ספיקת לב ימין נשקלת אפשרות של [[השתלת ריאה]]. | |
| − | + | '''סיכום:''' | |
| − | + | יתר לחץ דם ריאתי הוא סיבוך קשה של Scleroderma, עם השפעה שלילית על איכות החיים ושיעורי תחלואה ותמותה גבוהים. ערנות של הצוות המטפל עשויה להביא לגילוי מוקדם של PAH על ידי אקו לב. האבחנה של PAH ומעקב מבוססים על תוצאות צנתור לב ימני. הצלחת הטיפול תלויה בחומרת PAH והירידה התפקודית על פי ה-NYHA. מעקב אחרי PAH בקרב חולי Scleroderma כולל הערכה קלינית, תפקודי נשימה, בדיקות מדדים, ואקו לב ודורש שיתופי פעולה בין דיסציפלינות שונות (ראומטולוג, רופא ריאות, קרדיולוג). התחלת טיפול מוקדם ככל האפשר ושילובי תרופות עשויים להביא לשיפור תפקודי, דחייה של הידרדרות, ושיפור של תוחלת החיים{{הערה|שם=הערה24|Young A, Nagaraja V, Basilious M, et al. Update of screening and diagnostic modalities for connective tissue disease-associated pulmonary arterial hypertension. Semin Arthritis Rheum. 2019 Jun;48(6):1059-1067. }}. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
==== מעורבות מערכת העיכול ==== | ==== מעורבות מערכת העיכול ==== | ||
| + | מעורבות מערכת העיכול שכיחה מאוד בקרב חולי Scleroderma; יש לה השפעה ניכרת על איכות החיים. השינויים המתרחשים במערכת העיכול נובעים ממנגנוני המחלה: פגיעה בכלי דם קטנים ובחיבור בין העצבים ושריר החלק בדופן של אברי עיכול אשר יוצרים ליקויים קשים בתנועתיות של דרכי העיכול. ההסתמנות הקלינית והטיפול תלויים בחלק של מערכת העיכול אשר נפגע{{הערה|שם=הערה25|Braun-Moscovici Y, Brun R, Braun M. Systemic Sclerosis and the Gastrointestinal Tract-Clinical Approach. Rambam Maimonides Med J. 2016;7(4):e0031. }}. | ||
| + | *'''פגיעה בחלל הפה''' כוללת נסיגה של השפתיים ושל החניכיים, קושי בביצוע היגיינה של הפה (צחצוח שיניים, טיפולי שיניים). 14 אחוזים עד 25 אחוזים מחולי Scleroderma סובלים מיובש קשה בחלל הפה כתוצאה מ-Fibrosis של בלוטות הרוק | ||
| + | *'''מעורבות של הוושט''' (Reflux, פגיעה בהחזר ושטי Gastro Esophageal Reflux Disease, GERD) דווחה בקרב 70–90 אחוזים מהחולים. התלונות העיקריות הן [[צרבת]], הפרעות בליעה (תחילה עם אוכל מוצק, בהמשך גם עם אוכל נוזלי), הרגשת שובע מוקדם, חוסר תיאבון וירידה במשקל. Reflux נובע מחולשה של שרירי הושט, הושט פעור, והתוכן החומצי של הקיבה חוזר אליו באופן חופשי. ה-Reflux גורם לדלקת, כיבים, הצטלקות ברירית הושט, היצרות ושינויים במבנה של הרירית ([[Barret's esophagus|Barret's Esophagus]]). פגיעה קשה בוושט תואמת חומרה של מעורבות ריאות (ILD); עקב הגעת תוכן חומצי של קיבה לדרכי נשימה העליונות ואפילו לריאות (Aspiration). מומלץ לבצע הערכה של מצב הושט בתחילת Scleroderma בכלל החולים בהתאם לתלונות החולה והיא כוללת [[גסטרוסקופיה]], [[מנומטריה]] (בדיקת לחצים בושט), [[pH מטריה]] (בדיקת חומציות בושט), [[בליעת בריום|בליעת Barium]] ובדיקת איזוטופים להתרוקנות הקיבה. להקלת תסמיני Reflux הומלץ להקפיד על צריכת מאכלים שאינם מגבירים את חומציות הקיבה, לאכול מנות קטנות בפרקי זמן קצרים, להימנע משכיבה למשך ארבע שעות לאחר הארוחה ולישון עם ראש מורם. הטיפול התרופתי כולל תרופות PPI במינונים גבוהים. דווח על הטבה של תסמיני Reflux והפרעות בליעה הודות שילוב של PPI ומתן [[T:Domperidone|Domperidone]] {{כ}}([[Motilium]]). דווח על טיפול בעירוי אימונוגלובולינים (IVIG, [[IVIG|Immunoglobulins]]) במקרים של הפרעת בליעה קשה עם סמנים של מעורבות שרירים (Myositis). במקרים קשים של Reflux, עמידים לטיפול תרופתי, ניתן לשקול ניתוח [[פונדופלסטיה]] (Fundoplasty) | ||
| + | *'''פגיעה בקיבה''' מתבטאת לרוב בדימומים סמויים מכלי הדם השטחיים של הקיבה ([[GAVE]], {{כ}}Gastric Antral Vascular Ectasia). שכיחות גבוהה יותר של GAVE נמצאה בחולים עם נוגדנים מסוג [[RNAP-3]]{{כ}} (RNA polymerase III), שניהם ניבאו הופעת משבר כיליתי. ב[[גסטרוסקופיה]] רירית הקיבה מקבלת מראה של "אבטיח". הדימומים מהקיבה עלולים לגרום ל[[אנמיה מחוסר ברזל]] בחומרה שונה, עם תסמינים כמו חולשה ועייפות. בירור אנמיה כולל [[אנדוסקופיה]] של דרכי העיכול העליונות (גסטרוסקופיה). הטיפול ב-GAVE כולל צריבה של כלי הדם המדממים בלייזר עם תוספת גז ארגון בעת ביצוע גסטרוסקופיה. טיפול תומך כולל עירויי ברזל; במקרים של אנמיה קשה סימפטומטית ייתכן צורך במתן מוצרי דם. {{ש}}מעורבות הקיבה עשויה לכלול גם האטה במעבר תוכן הקיבה למעי. ניתן לאבחן זאת בבליעת בריום או בליעת מזון המסומן באיזוטופ. הטיפול כולל תרופות המשפרות את התנועתיות של הקיבה כגון [[Metoclopramide]] {{כ}}([[Pramin]]), [[Erythromycin]] ו-Motilium | ||
| + | *'''פגיעה במעי''' עשויה לכלול את המעי הדק, המעי הגס, ואזור ה-Anus ופי הטבעת. מעורבות מעי נובעת מפגיעה בשריר החלק והפרעה בתנועתיות המעי, וצמיחה של חיידקים אנאירוביים בחלל המעי Small Intestinal Bacterial Overgrowth {{כ}}(SIBO){{כ}}{{הערה|שם=הערה26|Pittman N, Rawn SM, Wang M, et al. Treatment of small intestinal bacterial overgrowth in systemic sclerosis: a systematic review. Rheumatology (Oxford). 2018 Oct 1;57(10):1802-1811.}}. חולים סובלים מ[[שלשולים]], תפיחות בבטן, תת-ספיגה, [[ירידה במשקל]], [[חסר ברזל]] ו[[חסר ויטמין B12|חסר ויטמין B<sub>12</sub>]]. {{כ}}Fibrosis בקטעים שונים של דופן המעי עלולה להוביל לאירועים חוזרים של [[חסימת מעי]], ואף להופעת בועות אוויר בדופן המעי ([[Intestinalis Pneumatosis]]). חסימת מעיים ו-Pneumatosis היא מצב חירום רפואי בעל השלכות קשות. אבחנה של מעורבות מעי מבוססת על קליניקה, בדיקת נשיפה (סבילות [[אי סבילות ללקטוז|Lactose]] ופירוק סוכרים) ובדיקות דימות שונות. יש שכיחות גבוהה של [[מחלת צליאק|מחלת Celiac]] בקרב חולי Scleroderma, בעיקר עם מחלת עור מוגבלת והמצאות נוגדנים מסוג ACA; בכל חולה עם Scleroderma עם תסמינים של מעורבות המעי הדק ו/או אנמיה מחוסר ברזל יש צורך לבדוק נוגדנים ל-[[Gliadin]] (בדיקות למחלת Celiac). טיפול במעורבות של מעי הדק ו-SIBO כולל מתן סדרות קצרות של [[אנטיביוטיקה]] רחבת-טווח או מתן [[T:Rifaximin|Rifaximin]], האנטיביוטיקה שלא נספגת במעי אך פועלת מקומי. לחולים עם הפרעות ספיגה מטפלים עם תוספות ברזל וויטמינים חיוניים ([[חומצה פולית]], [[ויטמין B12|ויטמין B<sub>12</sub>]], [[ויטמין D]], [[ויטמין B1|ויטמין B<sub>1</sub>]]) . דווח על שימוש ממושך ב[[פרוביוטיקה - Probiotic|פרוביוטיקה]] עם שיפור בתסמיני SIBO. הנושא של Microbiota ו[[השתלת צואה]] במקרים קשים של מעורבות המעי ב-Scleroderma נמצאים בשלבי מחקר וטרם הושגו מסקנות קליניות. במקרים של תת-ספיגה קשה, ירידה מתמדת וקשה במשקל, אירועים של חסימת מעיים או Pneumatosis, יש צורך בהזנה תוך-ורידית ([[TPN]],{{כ}} Total Parenteral Nutrition). מעורבות המעי הגס נוטה להתבטא בעצירות ושלשולים לסירוגין עם הרחבה של חלל החלחולת. בדומה לקיבה, עלולים להופיע במעי הגס טלנגיאקטזיות עם נטייה לדמם ולאנמיה של חסר ברזל. אבחון של מעורבות המעי הגס מבוסס על תוצאות של דימות וקולונוסקופיה. דלדול השרירים באזור פי הטבעת וה-Anus עלול להוביל לאי שליטה בסוגרים בקרב 10 אחוזים מהחולים. במקרים של מעורבות אנו-רקטלי (Anorectal), יש צורך ב[[רקטוסקופיה]], על קול ([[Ultrasound]]) של האזור האנלי (Anal) ומנומטריה של הסוגר האנלי. הטיפול במעורבות של המעי הגס הוא תסמיני (להקלת תסמינים). הטיפול באי שליטה על הסוגר האנאלי כולל תרגילי [[פיזיותרפיה]], [[ביופידבק]], הכנסת קוצב חיצוני; יעילותם של ניתוחים באזור האנו-רקטלי שרויה במחלוקת. דווח על השפעה טובה של עירוי אימונוגלובולינים (IVIG) בחולים עם מעורבות המעי הדק, המעי הגס ואי שליטה על סוגרים כביטוי לפגיעה בתנועתיות של המעי, בעיקר בשילוב של Scleroderma ופגיעה בשריר{{הערה|שם=הערה27|Raja J, Nihtyanova SI, Murray CD, et al. Sustained benefit from intravenous immunoglobulin therapy for gastrointestinal involvement in systemic sclerosis. Rheumatology (Oxford). 2016 Jan;55(1):115-9. }}{{הערה|שם=הערה28|Sanges S, Rivière S, Mekinian A, et al. Intravenous immunoglobulins in systemic sclerosis: Data from a French nationwide cohort of 46 patients and review of the literature. Autoimmun Rev. 2017 Apr;16(4):377-384. }} | ||
| + | *'''פגיעה בכבד''' דווחה בכ-15 אחוזים מהחולים עם Scleroderma מוגבלת בעיקר כשחמת הכבד [[Primary Biliary Cirrhosis]]{{כ}} (PBC), צורה של מחלה פיברוטית בדרכי המרה. מהלך המחלה בדרך כלל שפיר וכולל עלייה ברמות אנזימי הכבד הכולסטטיים (Cholestatic) והופעה של נוגדנים למיטוכונדריה ([[נוגדנים אנטי מיטוכונדריאלים - Anti mitochondrial antibodies|Anti-Mitochondrial Antibodies]]) | ||
| − | + | '''סיכום:''' | |
| − | + | פגיעה במערכת העיכול שכיחה בקרב החולי Scleroderma והיא מערבת חלל הפה, הושט, הקיבה, המעי הדק, מעי הגס ואזור אנו-רקטלי{{הערה|שם=הערה29|Gyger G, Baron M. Systemic Sclerosis: Gastrointestinal Disease and Its Management. Rheum Dis Clin North Am. 2015 Aug;41(3):459-73. }}. הפגיעה בהם נובעת מ-Fibrosis ודלדול של שריר החלק בדופן המעי, מה שמוביל להפרעה בתנועתיות של חלקי מערכת העיכול השונים, לרוב כפגיעה משולבת. הביטויים העיקריים כוללים GERD, דמם מרירית הקיבה, שלשולים, [[עצירות]], אי שליטה על סוגרים ותת ספיגה. הטיפול בהפרעות הושט והקיבה מתמקד במעכבי משאבת הפרוטונים ותרופות משפרות תנועתיות של דרכי העיכול; במקרים של GAVE, SIBO, תת-ספיגה, PBC יינתן טיפול בהתאם. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
==== מעורבות כלייתית ==== | ==== מעורבות כלייתית ==== | ||
| + | מעורבות כליות ב-Scleroderma לרוב מתבטאת כמשבר כיליתי; בחלק מהחולים השורדים משבר כיליתי, יכולה עם הזמן להתפתח [[אי ספיקת כליות כרונית]]. משבר כלייתי (SRC{{כ}}, [[Scleroderma Renal Crisis]]) הוא סיבוך חד וקשה של Scleroderma, הוא מתרחש בכ-15 אחוזים מכלל החולים, בעיקר ב-Scleroderma נרחבת ובשלבים המוקדמים של המחלה (עד 4–5 שנים מתחילת Scleroderma). המשבר הכלייתי עשוי להיות הביטוי הראשון של Scleroderma בכ-20 אחוזים מהחולים. במחקרים תצפיתיים נמצא שטיפול במינונים גבוהים של [[סטרואידים]] קדם להופעת של משבר כלייתי. בין גורמים נוספים המזוהים עם משבר כלייתי Scleroderma נרחבת עם מהלך דוהר, דלקת מפרקים וגידים, [[דלקת בקרום הלב]] (Pericarditis) ו[[אנמיה]]; במרבית החולים נמצאים נוגדנים מסוג [[נוגדנים למרכיבי הגרעין - Anti nuclear antibodies|ANA]] עם צביעת גרעין מגורגרת (Speckled Pattern); במחצית מהחולים עם משבר כיליתי הודגמו נוגדנים מסוג RNAP-3. | ||
| − | + | המנגנון של המשבר הכלייתי אינו לגמרי ברור, אך חושבים שהפרעה בתפקוד של אנדותל בנימי דם ועלייה ברמות Endothelin-1 הן הגורמים העיקריים לעיבוי הדופן, להיצרות ולסגירה של כלי הדם הקטנים בכליה. ההפרעה באספקת הדם לכליה מובילה לשגשוג התאים במערכת החוץ-גלומרולרית (Juxtaglomerular Apparatus), ולהפרשה מוגזמת של [[רנין - Renin|Renin]] ו-[[Angiotensin]] (מכווצים כלי הדם החזקים ביותר). המאפיינים העיקריים של המשבר הכלייתי כוללים הופעה של יתר לחץ דם מערכתי "חדש" (מעל 150/85 ממ"כ) והפרעה בתפקוד הכלייתי עם ירידה ניכרת במתן שתן ואף הפסקת מתן שתן. הביטויים הקליניים אינם ספציפיים כמו כאבי ראש, הפרעות ראיה ובחילות במקרים קלים ו[[הקאות]], מצוקה נשימתית, [[אובדן הכרה|איבוד הכרה]] ו[[פרכוסים]] כביטוי לפגיעה במערכת עצבים מרכזית על רקע יתר לחץ דם ([[Hypertensive Encephalopathy]]) במקרים קשים. יתר לחץ הדם מערכתי עלול לגרום לצבירת נוזלים ולהתפתחות של [[בצקות|בצקות ברגליים]], גודש ואף [[בצקת ריאות]], [[הפרעות קצב]], וחולשה קיצונית. בבדיקות המעבדה רואים [[אנמיה המוליטית]] (Microangioathic Hemolytic Anemia) עם שברי תאים אדומים בבדיקת ספירת דם, ירידה במספר הטסיות ועלייה ברמות Renin ו[[קראטינין|-Creatinin]]. ב[[בדיקת שתן כללית - Urinalysis|בדיקת שתן]] אופייני למצוא חלבון, כדוריות דם אדומות וגלילים מגורענים. ביופסיה כלייתית מתבצעת רק במקרים בהם קיימת אבחנה מבדלת עם מחלות כליה אחרות (Vasculitis או [[זאבת]]); לביופסיה של כליה ב-Scleroderma אופייניים סימני Ischemia של גלומרולים, נמק פיברינואידי של העורקים ונימי דם וקרישי דם שנוצרים בנימי דם ועורקים קטנים הצרים. | |
| − | + | הטיפול במשבר הכלייתי כולל איזון קפדני של לחץ הדם, כאשר טיפול הבחירה הוא ב[[T:ACE inhibitors, plain - C09A|מעכבי ACE{{כ}}]] ( [[אנזים מהפך אנגיוטנסין - Angiotensin converting enzyme|Angiotensin Converting Enzyme]]); תוספת של [[חוסמי תעלות סידן]] ומעכבי ACE עשויה לסייע באיזון של לחץ דם סיסטמי. למרות הטיפול האינטנסיבי, כ-25 אחוזים מהחולים מפתחים אי ספיקת כליות חמורה ונזקקים לדיאליזה. לעומת זאת, עם הזמן כמחצית מהחולים משקמים את התפקוד הכלייתי ונגמלים מ[[דיאליזה]] תוך 1–3 שנים. אחרי שנתים-שלוש רק חלק מהחולים נזקקים ל[[השתלת כליה]]. | |
| − | + | '''סיכום:''' | |
| − | + | משבר כלייתי הוא סיבוך נדיר אך קשה של Scleroderma, הוא צפוי בעיקר בחולים עם Scleroderma נרחבת סוערת, המצאות נוגדנים Speckled pattern ANA וRNAP-3. יש להימנע מטיפול במינונים גבוהים של סטרואידים בחולים עם Scleroderma, בעיקר במקרים של Scleroderma נרחבת דוהרת ובחולים עם נוגדנים RNAP-3. בחולים עם גורמי סיכון למשבר כיליתי יש צורך במעקב קפדני אחר לחצי הדם. הופעת עליה בלחץ הדם הסיסטמי מעלה חשד למשבר כיליתי, בעת הפרעות בתפקודי הכליות ואנמיה המוליטית קובעים אבחנה של משבר כיליתי. טיפול הבחירה במשבר כיליתי הוא במעכבי ACE. חולים עם אי ספיקת כליות חמורה עלולים להזדקק לדיאליזה, אך יש סיכוי לשיקום התפקוד הכלייתי ב-2–3 שנים הבאות. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
==== מעורבות מערכות נוספות ==== | ==== מעורבות מערכות נוספות ==== | ||
| − | + | *'''תסמונת התעלה הקרפלית''' ([[Carpal Tunnel Syndrome]] ,CTS) היא תסמונת המתבטאת בכאבים ונימול באצבעות 1-2-3 בשעות הלילה. נפיחות בידיים ודלקת בנרתיקי הגידים המכופפים בשורשי כפות הידיים היוצרות לחץ על העצב המדיאני, מה שמוביל למחושים בידיים כולל [[נימול]], עקצוץ וכאבים. האבחנה מתבססת על הסימנים הקליניים, תמונה אופיינית בבדיקה על קולית (Ultrasound) ובדיקה של הולכה עצבית (Electromyography ,[[EMG]]). הטיפול ב-CTS הוא מתן [[נוגדי דלקת לא סטרואידלים|תרופות נוגדות דלקת]] כולל הזרקה מקומית של סטרואידים בשילוב עם פיזיותרפיה וריפוי בעיסוק. טיפול ניתוחי שמור למקרים של כישלון הטיפול התרופתי. הופעת סימנים של CTS בשתי ידיים יחד עם תסמונת Raynaud מעלים חשד למחלת רקמות חיבור כולל Scleroderma | |
| − | + | *'''נוירלגיה טריגמינלית''' ([[Trigeminal Neuralgia]]) נובעת מ-Ischemia של העצב הטריגמינלי ובאה לידי ביטוי ככאב חזק בלחיים ובלסתות, לרוב, דו צדדי (פיזור של העצב הטריגמינלי) | |
| − | + | *'''הפרעת שמיעה''' ([[ירידה בשמיעה]] ו[[חרשות]]) הוא סיבוך נדיר של Scleroderma אשר מתפתח בעקבות Ischemia של עצב השמיעה ושינוים פיברוטיים באוזן התיכונה | |
| − | + | *'''תסמונת יובש''' ([[Sicca syndrome]]) מתבטאת ביובש קשה בעיניים, בפה ובריריות. יובש זה נובע מ-Fibrosis של בלוטות הרוק והדמע | |
| − | + | *'''הפרעה בתפקוד המיני''' בגברים נגרמת על ידי Ischemia ו-Fibrosis של גופים קוורנוטיים (Cavernous) באיבר המין של וגורמת ל[[הפרעה בזקפה|ליקוי בזקפה]]. נשים מתלוננות על קושי בפעילות מינית בשל יובש בדרכי המין. כאבים והגבלות תנועה במערכת המוסקולוסקלטלית, שינוים חיצוניים, עייפות וירידה בחשק המיני אופייניים לשני מינים | |
| − | + | *'''הפרעות במתן שתן''' כמו דחיפות או הפרעות בהתרוקנות של שלפוחית השתן תוארה בחולי Scleroderma; הן נובעות משינוים פיברוטיים בשלפוחית השתן עם קיבולת ירודה והפרעות בהתכווצות של השלפוחית | |
| − | + | *'''הפרעות במצב הרוח''' שכיחות בקרב חולי Scleroderma בצורת [[חרדה]], [[הפרעות שינה]] ו[[דיכאון]]. בין הגורמים להפרעות נפשיות חולים מציינים [[כאב כרוני]], הגבלה תפקודית, צורך בבדיקות מרובות, ביקורים תדירים במוסדות רפואיות, שימוש כרוני בתרופות, שינוי במראה החיצוני, הפרעות בתפקוד המיני, שינוי בתנאי העבודה ותגובה של בני משפחה וחברים. תמיכה של צוות המטפלים כולל שיחות עם פסיכולוג, תמיכה של בני משפחה וסביבה יכולים לעזור; במקרים קשים יותר יש צורך בטיפול תרופתי | |
== אבחנה == | == אבחנה == | ||
| + | האבחנה של Scleroderma מבוססת על ההסתמנות הקלינית בהתאם לקריטריונים לסיווג של 2013 אשר פתחו על ידי ארגונים ראומטולוגיים של אמריקה ואירופה (ACR/EULAR{{כ}}, American College of Rheumatology/European League Against Rheumatism){{כ}}{{הערה|שם=הערה30|van den Hoogen F, Khanna D, Fransen J, et al. 2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European League against Rheumatism collaborative initiative. Arthritis Rheum. 2013 Nov;65(11):2737-47. }}. לפי קריטריונים החדשים קיימים שמונה סעיפים של תופעות עם ניקוד משתנה. לפי כך אבחנה של Scleroderma מבוססת על צבירת 9 נקודות כאמור מעורבות נרחבת של העור נותנת ישר 9 נקודות; במקרים של מחלת עור מוגבלת משתמשים בסכום הכולל עם ניקוד לפי כל סעיף באופן פרטני (לפי טבלת ניקוד) שכוללים מעורבות עור, מעורבות כל דם, מעורבות ריאות ויתר לחץ דם ריאתי והמצאות של נוגדנים ספציפיים (ATA, ACA, RNAP-3){{כ}}{{הערה|שם=הערה31|Kowal-Bielecka O, Fransen J, Avouac J, et al; EUSTAR Coauthors. Update of EULAR recommendations for the treatment of systemic sclerosis. Ann Rheum Dis. 2017 Aug;76(8):1327-1339. }}. | ||
| − | האבחנה של | + | == אבחנה מבדלת של Scleroderma סיסטמית == |
| − | + | *בשלבים המוקדמים קשה להבדיל Scleroderma ממחלות אוטואימוניות אחרות; במהלך מעקב עם התבטאות ברורה יותר קלינית ומידה על נוגדנים אופייניים האבחנה של Scleroderma תהיה מבוססת ומוצקה | |
| − | + | *בניגוד ל-Scleroderma סיסטמית עם מעורבות עור ואיברים פנימיים קיימת צורה של Scleroderma "ממוקמת", Localized Scleroderma שבה מופיעים נגעים עוריים של עיבוי עור ושינוי צבע העור במקומות שונים. בביופסיית עור מהנגעים נמצאים אותם שינוים כמו בביופסיה של עור ב-Scleroderma סיסטמית: עיבוי עור, ריבוי תאי דלקת ושקיעה של סיבי [[Collagen]]. בניגוד ל-Scleroderma סיסטמית, ב-Scleroderma ממוקמת אין תסמונת Raynaud, אין מעורבות של איברים פנימיים ואין נוגדנים עצמיים. התופעה של Scleroderma ממוקמת שכיחה בקרב ילדים ומתבגרים, ומופיעה במבוגרים רק במקרים נדירים. לקבוצה זו שייכת Morphea, המתבטאת ברבדים סגלגלים או מעוגלים של עור מעובה עם שינויי צבע עור, ו-Linear Scleroderma, צורה קווית העשויה להופיע באזור הפנים ונקראת "de Sabre Coup" או לאורך הגפה. אם נגעים של מורפיאה גדולים או רבים או במקרים של Scleroderma ליניארית המערבות תת-עור, אזורי מפרקים, ניתן טיפול בעירוי סטרואידים ([[T:SoluMedrol|SoluMedrol]]) במינון גבוה, תרופות מדכאות חיסון, [[פוטותרפיה]], פיזיותרפיה, ו[[ריפוי בעיסוק]] | |
| − | + | * קיימים מספר מצבים דמוי-Scleroderma. בהם: | |
| − | + | **Bushke Scleroderma מתבטאת בעיבוי עורי המזכיר את זה של Scleroderma, אך לחולים אין תסמונת Raynaud, אין נוגדנים אופייניים ל-Scleroderma ולרוב העור באצבעות הידיים שמור. השינויים בביופסיה ב Bushke Scleroderma שונים וכוללים שקיעת מוצין ולא Collagen | |
| − | + | **Eosinophilic fasciitis מתאפיינת בעיבוי עורי המלווה במעורבות של מעטפת השרירים. החולים סובלים מכאבי פרקים ועיבוי עורי באמות, כפות הידיים והשוקיים המלווים בהגבלה ניכרת בתנועה. בבדיקות דם נמצא מספר גבוה של אאוזינופילים. בביופסיה של מעטפת השריר ניתן לראות ריבוי תאי דלקת ואאוזינופילים. | |
| − | == | + | ==מעקב וטיפול ב-Scleroderma סיסטמית == |
| + | חולים ב-Scleroderma סיסטמית זקוקים למעקב קפדני הכולל בדיקות עור תכופות וניטור של המערכות החיוניות כולל מדידת לחץ דם סיסטמי, מעקב אחרי משקל, הערכת עור לפי מדד Rodnan, בדיקות דם ושתן תכופות, מעקב אחרי המצב הנשימתי והלבבי על ידי אקג, אקו לב, תפקודי נשימה, HRCT חזה ועוד. | ||
| − | + | אין טיפול כוללני למחלת Scleroderma סיסטמית, מטפלים בחולי Scleroderma לפי התסמינים של המערכות המעורבות עם דגש על גילוי מוקדם וטיפול מוקדם במטרה לשפר את מצב החולים ולמנוע נזקים עתידיים. גישה לחולים עם מעורבות עור נרחבת או מוגבלת, לחולים עם מחלה "צעירה" (7-5 שנים) ומחלה בת שנים רבות איננה זהה. לאור הנדירות של המחלה וביטויים המגוונים, הומלץ על ריכוז של חולים במרכזים עם צוותים רב מקצועים, בעלי ניסיון בטיפול ב-Scleroderma. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== פרוגנוזה == | == פרוגנוזה == | ||
| + | פרוגנוזה במחלת Scleroderma תלויה בהרבה גורמים. לחולים עם מעורבות עור מפושטת, חולים ממין זכר או גיל מבוגר, חולים עם מעורבות ריאות, יתר לחץ דם ריאתי, מעורבות של הלב או הכליות מחלה קשה יותר ותוחלת החיים ירודה בהשוואה לאוכלוסייה כללית. | ||
== דגלים אדומים == | == דגלים אדומים == | ||
| − | |||
== ביבליוגרפיה == | == ביבליוגרפיה == | ||
| − | < | + | <blockquote> |
| − | + | {{הערות שוליים|יישור=שמאל}} | |
| − | + | </blockquote> | |
| − | + | {{שש}} | |
| − | + | {{ייחוס|פרופסור אלכסנדרה בלביר, מנהלת [http://www.rambam.org.il/מחלקות+ומרפאות/אגף+פנימי/ריאומטולוגיה/default.htm היחידה לראומטולוגיה], [http://www.rambam.org.il/ המרכז הרפואי רמב"ם], [http://www.rheumatology.org.il/ האיגוד הישראלי לראומטולוגיה]}} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | {{רישיון cc}} | ||
[[קטגוריה:ראומטולוגיה]] | [[קטגוריה:ראומטולוגיה]] | ||
[[קטגוריה:פנימית]] | [[קטגוריה:פנימית]] | ||
| + | [[קטגוריה:האיגוד הישראלי לראומטולוגיה|*, טרשת]] | ||
גרסה אחרונה מ־05:37, 9 במאי 2021
| טרשת רב-מערכתית | ||
|---|---|---|
| Systemic Sclerosis | ||
| ||
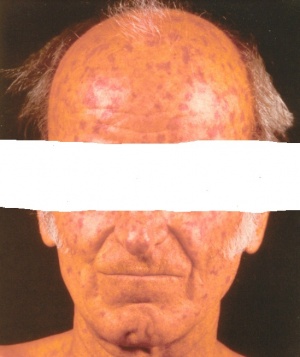
תופעת ריינו
| ||
| שמות נוספים | Systemic scleroderma, Diffuse scleroderma סקלרוזיס סיסטמית, טרשת מערכתית, סקלרודרמה |
|
| ICD-10 | Chapter M 34. | |
| ICD-9 | 710.1 | |
| MeSH | D012595 | |
| יוצר הערך | פרופסור אלכסנדרה בלביר
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סקלרודרמה
Scleroderma או טרשת רב-מערכתית (SSc, Systemic Sclerosis) היא מחלה כרונית אוטואימונית (Autoimmune), מתאפיינת בהתעבות העור כתוצאה מהצטברות סיבי Collagen. שקיעת Collagen מתרחשת בעור, בדפנות כלי הדם הקטנים ובאיברים הפנימיים. כתוצאה מכך נוצרת הפרעה באספקת דם לרקמות, שינוי במבנה של רקמות ואיברים ובסופו של תהליך הצטלקות של רקמות ואיברים פנימיים (ריאות, לב, כליות, מערכת העיכול, ועוד). הפרוגנוזה של המחלה נקבעת על פי מעורבות האיברים החיוניים, ובעיקר הריאות, הלב והכליות[1].
אפידמיולוגיה
Scleroderma היא מחלה נדירה. על פי נתונים מארצות הברית, שכיחות המחלה היא 2.6 מקרים ל-10,000 איש (0.026 האחוז). כל שנה מאובחנים בין 2 עד 5 מתוך 100,000 מקרים חדשים. המחלה שכיחה הרבה יותר בקרב נשים (ביחס של נשים לגברים; שלוש עד 6 נשים לגבר אחד); הופעתה של המחלה נדירה בקרב ילדים וקשישים. במרבית המקרים הביטויים הראשונים של המחלה מופיעים בגילאי 30–50 לחיים. שכיחות המחלה בקרב קרובי משפחה מדרגה ראשונה גבוהה יותר (1.6-1.3 אחוזים) מהשכיחות באוכלוסייה הכללית. מחקר של הגנום האנושי (GWAS, Genome-Wide Association Studies) ומחקרים גנטיים על קבוצות גדולות של חולי Scleroderma הצביעו על שינוים במבנה של הגנים (Genes) GSDMA (Gasdermin A) ו-PRDM1 (Positive Regulatory Domain containing 1) בקרב חולי Scleroderma; המשמעות הקלינית של תגלית זו טרם הובהרה.
אטיולוגיה
Scleroderma היא מחלה שהגורם לה אינו ידוע. חלה התקדמות בהבנת מנגנונים העיקרים של Scleroderma: הפרעה במערכת האוטואימונית, הפרעה בכלי הדם (Vascular) ו-Fibrosis:
- הפרעה אוטואימונית - ב-Scleroderma היא מגוונת. הפרעה בתפקוד לימפוציטים מסוג B (B type Lymphocytes) מובילה ליצירת נוגדנים עצמיים, הכוללים נוגדנים לגרעין (ANA, Antinuclear Antibodies), ונוגדנים אופייניים ל-Scleroderma כגון נוגדנים ל-Topoisomerase (SCL-70 או ATA), נוגדנים ל-Centromere (ACA), ונוגדנים ל-RNA 3 Polymerase (RANP-3); יש עוד רשימת נוגדנים אופייניים ל-Scleroderma אך בשלב זה טרם הוחל שימוש שוטף בהם.
בין המנגנונים של Scleroderma פעילות של תאי דלקת כמו לימפוציטים מסוג T, בזרם הדם לימפוציטים מסוג T מפרישי ציטוקינים מקדמי דלקת עם מאפייני דלקת מסוג Th1 (T helper 1). לימפוציטים מסוג T שבודדו מהעור והרקמות של חולי Scleroderma מבטאים אופי של Th2 הכולל הפרשה מוגברת של ציטוקינים המקדמים תהליך הצטלקות (Fibrosis), כגון Monocyte Chemotactic Protein-1) ,MCP-1) ואינטרלויקינים (Interleukins, IL-6, IL-4, IL-10). כמו כן, בקרב החולים הודגמו רמות גבוהות של הקולטן ל-PDGF (Platelet-Derived Growth Factor), המזוהה עם הופעה של גנים מקדמי Fibrosis על פני תאים פיברובלסטים (Fibroblasts) - הפרעה וסקולרית (Vascular) - מתבטאת בשפעול של תאי אנדותל (שכבה פנימית של כלי דם) ושינוים במבנה כלי דם קטנים. בקרב החולים הודגמו רמות גבוהות של von Willebrand Factor, אחד מגורמים אחראים עם היצרות של כלי דם והפרעות קרישה. הפגיעה בכלי הדם גורמת להפרעה באספקת דם (Ischemia) ונמק של הרקמות. כתגובה לפגיעה בכלי הדם, מתקיימת הפרשה מוגברות של VEGF (Vascular Endothelial Growth Factor) אך למרות זאת בנייה מחודשת כלי הדם הקטנים אינה תקינה ובמקום נימים תקינים נוצרים נימי דם ענק (Giant capillaries) פגומים. נימי דם ענק אלו ניתן לראות כעור או ריריות של חולי Scleroderma בצורה של "כוכבית", הנקראות טלאנגיאקטזיות (Telangiectasia).
Scleroderma מתאפיינת בהפרעה של האיזון בין חומרים ביולוגיים מכווצים כלי דם ומרחיבים כלי דם, לטובת המכווצים. נמצא קשר בין ערכים מוגברים של Endothelin-1, מכווץ כלי הדם החזק ביותר, לחומרת תופעת Raynaud, כיבים באצבעות, יתר לחץ דם ריאתי (Pulmonary Arterial Hypertension ,PAH), והמשבר הכלייתיים בקרב חולי Scleroderma. Endothelin-1 גם אחראי על קידום Fibrosis והתרבות של תאי שריר חלק ושאר שכבות בדופן של כלי הדם עם היצרות של נימי דם ועורקים קטנים. ב-Scleroderma נמצא מחסור במרחיבים של כלי דם פוטנטיים כגון פרוסטציקלינים (Prostacyclins): PGI2 (Prostaglandin I2) ו-Nitric Oxide) NO). כתוצאה מכך, בחלק מנימי דם מתפתח עיבוי דופן, היצרות ומספרם יורד. ההשלכות הקליניות של התהליך כוללות פצעים ונמק בעור, הופעת PAH, התפתחות של משבר כלייתי, פגיעה בלב, במערכת העיכול - Fibrosis - הוא סימן מובהק של Scleroderma, הוא בולט בעור אך גם מתרחש באיברים הפנימיים וברקמות שונות. בטבע, בתנאים של אירוע דלקת או Ischemia מופעל תהליך שפעול תאי פיברובלסטים האחראים על ריפוי פצעים על ידי יצירת סיבי Collagen. ב-Scleroderma, פיברובלסטים מתפקדים ביתר שאת והופכים למיו-פיברובלסטים (Myofibroblasts) המייצרים עודפים של Collagen תהליך זה מבוקר על ידי ציטוקינים מקדמי-Fibrosis, כגון - TGF-β (β Transforming Growth Factor), CTGF (Connective Tissue Growth Factor) ו-6-IL
הושם דגש על תפקוד מפתח של פיברובלסטים, תאי אנדותל של כלי דם בריאות, תאי אפיתל (תאים שמצפים דופן של חללי ריאות קטנטנים (Alveoli) בתאים פריציטים (Pericytes) (פריציטים מקשרים בין אנדותל ואפיתל) בשילוב עם תהליכי דלקת במעורבות ריאות ב-Scleroderma (מחלת ריאות אינטרסטיציאלית, Interstitial Lung Disease, ILD) ו-Fibrosis ריאתית (Pulmonary Fibrosis, PF). כתוצאה מהפרעה משולבת ברקמת ריאות, פיברובלסטים רבים נמשכים לאזורי הפגיעה ומבצעים "תיקון" לא מוסדר ולא מבוקר לנזק הקיים. במהלך פעילותם, פיברובלסטים בריאות הופכים למיו-פיברובלסטים, המייצרים כמויות מוגזמות של סיבי Collagen הצטלקות של רקמת ריאות ופגיעה בתפקוד הנשימתי. בנוסף, תאי דלקת שונים כמו מקרופאגים (Macrophages) ולימפוציטים מגויסים לאתר הפציעה ומשחררים מתווכים מקדמי Fibrosis; כך מתרחשים תהליכי גירוי בלתי פוסקים ולא מבוקרים של פעילות יתר של פיברובלסטים ומיו-פיברובלסטים עם התקדמות ה-Fibrosis בריאות. תהליך ה-Fibrosis בריאות תלוי בפעילות יתרה של מספר ציטוקינים כמו VEGF, PDGF, FGF (Fibroblast Growth Factor) ו-TGF-β וגם בפעילות ירודה של תססים מסוג MMP (Metalloproteinase) האחראים על פירוק של Collagen ורקמה פיברוטית. הבנה של מנגנון זה הוביל לפיתוח תרופות שמעכבות את ההגעה של פיברובלסטים לריאות. דיכוי הפעילות של פיברובלסטים ומיו-פיברובלסטים בריאות מאפשר לעצור את שרשרת האירועים שמובילה ל-Fibrosis ולמנוע נזק לרקמת הריאות[2].
קליניקה
למחלת Scleroderma שתי צורות עיקריות בהתאם לחומרת המעורבות של עור:
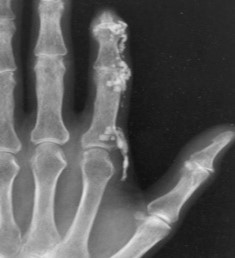
- Scleroderma מוגבלת (LcSSc, Limited Cutaneous Systemic Sclerosis) מופיעה בכ-66 אחוזים מכלל החולים; היא מתאפיינת במעורבות עורית מוגבלת לאזורים היקפיים (כפות ידיים, אמות, פנים, וחלקי הרגל מתחת לברך). LcSSc בעלת מהלך איטי יותר, והיא כוללת תופעת Raynaud והופעת כיבים בקצות האצבעות (Digital Ulcers, DU). עם הזמן, נוצרת פגיעה במערכת העיכול ובחלק מהחולים יכול להתפתח יתר לחץ דם ריאתי, Calcinosis (שקיעת גושי סידן בעור ורקמות שהוא חומר דמוי גיר). פורסמו דיווחים על שכיחות לא מבוטלת של מחלת ריאות אינטרסטיציאלית בקרב חולים עם צורת Scleroderma מוגבלת אשר הם נשאים נוגדנים ל-70-SCL
- Scleroderma נרחבת (DcSSc, Diffuse Cutaneous Systemic Sclerosis) מופיעה בכ-33 אחוזים מקרב חולי Scleroderma ובה עיבוי העור מופיע בצורה מפושטת (בנוסף למעורבות פנים, אצבעות ידיים וכפות רגליים, עיבוי העור מופיע גם בזרועות וירכיים, ובעור הבטן והחזה). מהלך של Scleroderma נרחבת סוער יותר, ומתאפיין בהסננה דלקתית של אזורי עור נרחבים. העור הופך לבצקתי ומאבד מגמישותו; החולים מתלוננים על עקצוץ וגרד, ולעיתים אף על הרגשת "שרפה" וכאבים מפושטים בעור. הבצקת העורית בולטת יותר באצבעות ובכפות הידיים (Puffy Fingers/Puffy Hands). מתיחות העור עלולה להגביל את החולים בתנועת המרפקים, הכתפיים והירכיים ואף בתנועות נשימתיות של בית חזה. בחלק מהמקרים ניתן לחוש ברשרוש בזמן הנעת המפרקים בבדיקה פיזיקלית (Tendon Friction Rubs) כתוצאה ממעורבות נרתיקי גידים בדלקת וב-Fibrosis. לחולים עם Scleroderma נרחבת, תופעות מערכתיות כגון חולשה, עייפות וכאבי מפרקים ושרירים. בכשליש מחולי Scleroderma נרחבת מופיעה מעורבות שרירים, בצורת דלקת (Myositis) או בצורת איבוד נפח של שרירים (דלדול שרירים) . סמני Myositis כוללים כאבים וחולשה של שרירי הגפיים, עלייה ברמות אנזימי השריר (CPK, Creatine Phospho Kinaseׂׂׂׂׂ), Aldolase וטראנסאמינאזות (Transaminases -AST, Aspartate Aminotransferase
/ALT, Alanine Aminotransferase), הפרעה אופיינית בבדיקת אלקטרומיוגרפית (EMG, Electromyography), איבוד נפח שרירים וירידה בכוח גס של שרירים. בבדיקת הדמיה תהודה מגנטית (MRI, Magnetic Resonance Imaging) ניתן לאבחן סימני דלקת, נזק ודלדול של שרירים. מעורבות של ריאות (ILD, PF), לב וכליות שכיחות יותר בצורת Scleroderma הנרחבת. הופעת כיבים באצבעות, מעורבות מערכת העיכול, Calcinosis שכיחים ב-Scleroderma נרחבת
- Scleroderma ללא ביטוים בעור (Scleroderma sine Scleroderma) היא צורה נדירה של Scleroderma (2-1 אחוזים מכלל החולים) אך גם בה יש תסמונת Raynaud, נמצאים נוגדנים ומעורבות איברים פנימיים אופייניים ל-Scleroderma בעיקר מערכת העיכול ויתר לחץ דם ריאתי
שלבי הופעת המחלה
רוב נתיבי מנגנוני ה-Scleroderma מתקיימים במקביל. מעורבות של כלי דם בצורה של התקפי Raynaud יכולה להקדים ביטוים אחרים של Scleroderma בחודשים ואפילו בשנים. בחלק מהחולים כבר בשלב זה יהיה ניתן למצוא בדם נוגדנים מסוג ANA וגם את אחד הנוגדנים ספציפיים ל-Scleroderma [SCL-70, ACA (Anti-cardiolipin antibodies), RNAP-3 (RiboNucleic Acid Polymerase)]. בשלבים מוקדמים עיבוי עור הפנים יוצר מראה "צעיר", היעלמות של קמטים והגבלה במפתח הפה. עם הזמן, עיבוי העור ברוב האזורים נסוג, אבל יכולים להישאר שינוים בצבע העור לכיוון שחום יותר או להפך, עם היעדר פיגמנט והלבנה בצורת "מלח ופלפל". השפתיים מאבדות מהעסיסיות, פתח הפה נהיה קטן יותר ונוצרים קמטים אנכיים אופייניים סביב הפה.
עם התקדמות Scleroderma יכול להופיע קיבעון של המפרקים (קונטרקטורות, Contractures), שינוי בצורת האצבעות (Sclerodactyly) ונסיגה של קצות האצבעות (Acro-osteolysis) והופעת Calcinosis בעור ורקמות רכות האופייניים לשתי הצורות של Scleroderma, מוגבלת ונרחבת. הבדלים במהלך קליני של מחלה "צעירה" (עד 5–7 שנות מחלה) ומחלה "מאוחרת" בולטים בעיקר ב-Scleroderma נרחבת (DcSSc); הבדלים אלו פחות בולטים במחלה מסוג Scleroderma מוגבלת (LcSSc).
לא כל החולים מציגים את כל התופעות של Scleroderma.
מעורבות עורית - Scleroderma
עיבוי העור הוא הביטוי המובהק של Scleroderma. את הפגיעה העורית ניתן לאמוד בעזרת המדד על שם Rodnan (mRSS, Modified Rodnan Skin Score) בבדיקה ידנית. לפי שיטה זו, מחלקים את שטח הגוף ל-17 אזורים (פנים, חזה, בטן, זרועות, אמות, כפות ידיים, אצבעות הידיים, ירכיים, שוקיים, כפות הרגליים) ונותנים ציון בין 0 לבין 3 לכל אזור על פי חומרת העיבוי של העור. מדד mRSS מתייחס לסכום הכולל של נקודות בכל האזורים; מדד mRSS מעל 12 או עליה מהירה בmRSS (מעל 5 נקודות) בפרקי זמן קצרים מעידים על מעורבות נרחבת ומנבא מחלה קשה יותר. הימצאות של נוגדנים ל-70-SCL או RNA-3 מזוהה עם מעורבות עור נרחבת.
ביופסיית עור בשלבים המוקדמים של Scleroderma מדגימה הסננה של העור והרקמות התת-עוריות על ידי תאי דלקת ושקיעה של סיבי Collagen סביבם. עם השנים עיבוי העור נסוג במידה מסוימת, אך מותיר עור צלקתי, עם שינויים בצבע באזורים הנגועים. השינויים באצבעות (Sclerodactyly) אינם הפיכים; עיוותים של אצבעות וקיבעון (קונטרקטורות) במפרקים גורמים להפרעה בתפקוד הידיים ולהגבלה בטווח התנועה במפרקים.
מעורבות עורית פוגעת באופן קשה באיכות החיים של החולים, הן במישור הפיזי והן במישור הנפשי. לחולים קשה לקבל את השינויים החלים בגופם, והם סובלים מהערכה עצמית נמוכה ולעיתים אף מחרדות, נדודי שינה ודיכאון.
טיפול ב-Scleroderma נרחבת הוא אתגר. במחקר קליני מבוקר (RCT, Randomized Controlled Trial) נמצא ש-Methotrexate עוזר במחלת עור נרחבת[3].
ב-RCT שמטרתם הייתה בדיקת יעילות של Cyclophosphamide ו-Mycophenolate Mofetyl (Cellcept) במחלת ריאות אינטרסטיציאלית, נבדקה גם השפעתן על העור; Cyclophosphamide ו-Cellcept שיפרו את המצב של העור בצורה משמעותית[4].
דווח כי טיפול בקרני אור אולטרה סגול (Ultra-Violet ,UV) עשויות לסייע להתרככות העור בחולים עם Scleroderma נרחבת. בעקבות מידע מדעי שהצטבר נערכו מספר RCT עם טיפולים ביולוגיים שונים. במחקרים שונים, מחקר ASSET (Adolescents' Social Stresses, Emotions, and Thoughts) עם Abatacept (מכוון לתאי T לימפוציטים), מחקרים FocuSSced (A Study of the Efficacy and Safety of Tocilizumab in Participants With Systemic Sclerosis) ו-FaSScinate (Safety and efficacy of Subcutaneous tocilizumab in Systemic Sclerosis) עם Tocilizumab (מכוון לקולטנים ל6-IL)[5][6], מחקר RISE-SSc (Riociguat in patients with early diffuse cutaneous systemic sclerosis) עם Riociguat (ממריץ Guanylate cyclase)[7] ומחקר CORBUS עם Lenabasum (מכוון לקולטנים קנאביואידים, Cannabinoids)[8] נבדקה השפעתה של תרופת מחקר על עיבוי העור לפי שינוי של מדד Rodnan או על פי מדד מורכב ממספר נתונים CRISS (Combined Response Index in Diffuse Cutaneous Systemic Sclerosis); מחקרים לא השיגו נקודת יעד ראשונית (Primary endpoint). בסדרות קטנות לא מבוקרות דווח על הטבה במצב העור בעקבות טיפול ב-Rituximab מכוון לנוגדן CD20 מוצג על פני לימפוציטים מסוג B[9]. דווח על יעילות של Romilkimab (נוגדן המכוון לנטרל IL-4 /IL-13) לטיפול במעורבות של עור ב-Scleroderma[10]. פורסמו תוצאות של RCT אירופאי (ASTIS, The Autologous Stem Cell Transplantation International Scleroderma)[11] ואמריקאי (SCOT, Scleroderma: Cyclophosphamide Or Transplantation)[12] על טיפול בהשתלת תאי האב של מח העצם (HSCT, Hematopoietic Stem-Cell Transplantation) בחולים עם מחלת עור דוהרת. טיפול ב-HSCT הראה הטבה משמעותית בעור, הטבה במצב הריאות ובהישרדות לטווח הארוך; הערכה מערכתית קפדנית לפני HSCT ובחירה של חולים מתאימים להשתלה (ללא מעורבות לב או מעורבות ריאות משמעותית) אפשרו שיפור בתוצאות התחלואה והתמותה הקשורים לפעולה עצמה ושיפרו את שיעורי ההישרדות במהלך שנות המעקב. טיפולים משלימים כמו פיזיותרפיה, הידרותרפיה וריפוי בעיסוק מהווים חלק חשוב מהטיפול הכללי בפגיעה העורית, ומסייעים בשמירה על גמישות העור, גידים ומפרקים. לביטויים עוריים מסוימים, כגון טלאנגיאקטזיות, שינויים בצבע העור ו-Calcinosis טרם נמצא טיפול יעיל.
סיכום:
המעורבות העורית מהווה ביטוי קליני מובהק של Scleroderma. ברוב המקרים, חומרת הפגיעה בעור תואמת את חומרת המעורבות של מפרקים, שרירים ואיברים חיוניים.
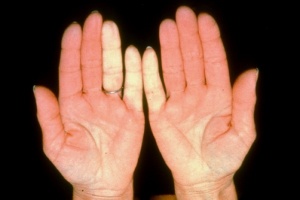
תופעת Raynaud
תופעה Raynaud היא ביטוי הכרחי של Scleroderma. תופעה זו יכולה להקדים ביטויים אחרים של המחלה בשנים רבות, בעיקר בצורתה המוגבלת. ב-Scleroderma נרחבת תסמונת Raynaud מופיעה במקביל או בסמוך להופעה של עיבוי העור. ביטוי עיקרי של תופעת Raynaud הוא שינוי חולף בצבע עור: חוור-לבן, כחול-סגול ואדום נובע מהתכווצות של נימי דם במצבים של קור או התרגשות. לרוב התקפי תופעת Raynaud מתרחשים באצבעות הידיים, פחות שכיחה מעורבות אצבעות ברגליים ועוד יותר נדירים התקפי Raynaud בקצה האף, לשון, פטמה. עישון סיגריות הוא גורם הסיכון המיוחס לחומרת הביטוי של תופעת Raynaud והכיבים.
תופעת Raynaud ראשונית – מופיעה אצל אנשים ללא היסטוריה של מחלת רקמות חיבור (Connective Tissue Disease, CTD) או הפרעות קרישה או הפרעה באספקת דם לעורקים (Peripheral Vascular Disease). תסמונת Raynaud ראשונית שכיחה בקרב נשים צעירות, וב-30 אחוזים מהמקרים קיים סיפור משפחתי. בתסמונת Raynaud ראשונית אין שינויים מבניים בכלי הדם, לא מוצאים נוגדנים עצמיים ואין סיבוכים כמו Ischemia, כיבים, או נמק. בדיקת נימי דם העוריים סביב מיטת הציפורן בהגדלה בעזרת מכשיר קפילרוסקופ (Capillaroscopy) מדגימה נימי דם תקינים.
תופעת Raynaud משנית – מופיעה כביטוי של מחלות אוטואימוניות (Autoimmune) או בעקבות הפרעות קרישה או מחלות כלי דם. בתופעת Raynaud משנית ל-CTD (כולל Scleroderma) ההתקפים מופיעים בתדירות גבוהה ובעוצמה רבה יותר, התקפים מלווים בהרגשת נימול או דקירות בקצות האצבעות. ב-Scleroderma, תופעת Raynaud נובעת מעיבוי ניכר בדופן נימי דם ועורקים, היצרות וסגירה שלהם עם ההפרעה באספקת הדם לרקמות. בחולים עם הופעת תופעת Raynaud חדשה הימצאות נוגדנים עצמיים כמו ANA ונוגדנים ספציפיים 70-SCL, ACA, RNAP-3 מעלים חשד ל-Scleroderma. בתופעת Raynaud על קרע Scleroderma בדיקת קפילרוסקופיה מדגימה את השינויים האופייניים למחלה כולל הופעת דימום מחוץ לנימי דם, נימי דם ענקיים "Giant Capillaries", ירידה במספר ואף היעלמות של נימי דם עם הופעת נימים בעלי צורה מופרעת. במחקר תצפיתי VEDOSS (Very Early Diagnosis of Systemic Sclerosis) של קבוצה אירופאית לחקר Scleroderma EUSTAR (European Scleroderma Trials and Research group)[13] שילוב של תופעת Raynaud עם בדיקת ANA חיובית והופעת נפיחות באצבעות (Puffy Fingers) ניבא התפתחות של מחלת רקמות חיבור בכ-40 אחוזים מהמקרים. במקרים בהם נמצאו אחד מהנוגדנים האופייניים ל-Scleroderma (70-SCL או ACA) בשילוב עם שינויים אופייניים בבדיקת קפילרוסקופיה, הסיכוי להתפתחות של Scleroderma היה 7.4 אחוזים בשנה ראשונה, 29.3 אחוזים אחרי 3 שנים ו-44.1 אחוזים אחרי 5 שנים.
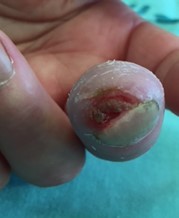
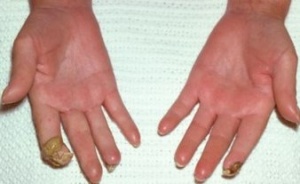
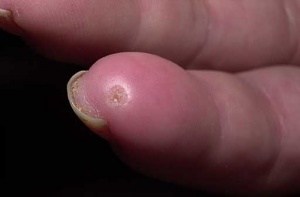
כיבים באצבעות (Digital Ulcers, DU)
כיבים בעור מופיעים במחצית מחולי ה-Scleroderma. מיקומם בדרך כלל בקצות האצבעות אך הם עשויים להופיע גם במקומות בהם העור מתוח: מעל מפרקי כפות הידיים או מעל המרפקים. הופעת פצעים בבהונות הרגליים יחסית נדירה. שליש מהחולים סובלים מכיבים חוזרים בעלי אופי עקשני עם נמק ונטייה לזיהום ברקמות. לאחר ריפוי הכיבים, נותרת בקצות האצבעות צלקת עגולה וקעורה, הנקראת Pitting Scar.
הכיבים משפיעים באופן משמעותי על איכות החיים בשל עוצמת הכאבים הגבוהה והירידה בתפקוד הכללי במיוחד בתפקוד הידיים. בשאלונים להערכת תפקוד כללי בשם SHAQ (Scleroderma Health Assessment Questionnaire) חולים רבים דיווחו על השפעה ניכרת בפעילות יום-יומית כללית ובזאת שתלויה בתפקוד הידיים.
מטרות הטיפול בכיבים הן ריפוי ושיפור איכות החיים של המטופלים. חשוב לשמור על היגיינה טובה של הידיים, לשמן אותן עם קרם לחות, למנוע פצעים טראומטיים ולהפסיק עישון.
לטיפול בתסמונת Raynaud משתמשים במרחיבים כלי דם כגון חוסמי תעלות סידן, מעכבי ACE (Angiotensin Converting Enzyme) ותרופות נוגדות דיכאון בשל השפעתן החיובית על הרחבה של כלי דם קטנים. חולים שאינם משתפרים עם טיפול פומי, נזקקים לטיפול בעירוי לווריד של Iloprost. ב-RCT מתן של עירוי Iloprost לחולי Scleroderma הביא לשיפור משמעותי בתדירות וחומרת התקפי Raynaud וקידום ריפוי פצעים. עם סימני זיהום בפצע, משתמשים באנטיביוטיקה (רצוי בהתאם לתוצאות תרבית מהפצע) מקומי או סיסטמי. במקרים קשים, ייתכן צורך בהטריה כירורגית של הרקמות הנמקות. במקרים של Ischemia קשה ונמק עמידים לטיפול יש צורך בבדיקות קרישה, בהערכה של מומחה כלי דם והדמיה של העורקים בעזרת Ultrasound או אנגיוגרפיה (Angiography). במקרים של Ischemia עמידה לטיפול ניתן לשקול סימפטקטומיה (Sympathectomy) ושימוש בתא לחץ. במקרים של הפרעות קרישה, מומלץ להוסיף טיפול בנוגדי קרישה (זריקות Clexane, Enoxaparin). שני RCT הראו יעילות של Bosentan (Tracleer)[14] המעכב קולטנים ל-Endothelin-1, במניעת הופעה של כיבים חדשים בקרב חולי Scleroderma. דווח על יעילות של Sildenafil מעכב של Phosphodiesterase (PDE-5, Phosphodiesterase type 5 inhibitor) על כיבים איסכמיים (Ischemic) עמידים לטיפול.
מעורבות איברים פנימיים
מעורבות האיברים הפנימיים היא הקובעת את חומרת המחלה ואת הפרוגנוזה. המעורבות הראייתית היא הגורם העיקרי למוות בקרב חולי ה-Scleroderma, ולאחריה המעורבות הלבבית, הכלייתית, ומעורבות מערכת העיכול.
מעורבות ריאתית
מעורבות הריאות בחומרה שונה מופיעה בכ-80 אחוזים מחולי Scleroderma, ב20–30 אחוזים מהם למעורבות ריאות השלכת קלינית ניכרת. מעורבות ריאות בדרך כלל מתבטאת במחלת ריאות אינטרסטיציאלית. כ-60 אחוזים מהחולים עם ILD ו-PF הם חולים עם מחלת Scleroderma נרחבת; בכ-40 אחוזים מחולים עם ILD וPF מחלת העור היא מוגבלת. נוגדני 70-SCL מזוהים עם ILD ו-PF בקרב חולי Scleroderma נרחבת ומוגבלת. שכיחות של ILD ו-PF בקרב חולים עם מחלת Scleroderma מוגבלת הנושאים נוגדנים מסוג ACA נמוכה. בשלבים המוקדמים של Scleroderma, בעיקר בנוכחות נוגדנים מסוג 70-SCL, מתפתחת דלקת בדופן נאדיות הריאה הנקראת Alveolitis. עם התקדמות של Alveolitis מתפתחת Fibrosis ריאתית. מעורבות ריאתית משמעותית גורמת באופן בלתי נמנע ליתר לחץ דם ריאתי ומצוקה לבבית.
בשלבים המוקדמים הסתמנות של ILD אינה ספציפית ולרוב סמויה. כשליש מהחולים מתלוננים על שיעול יבש, ממושך וטורדני וקשיי נשימה במאמץ, מיחושים לא ספציפיים בחזה, חולשה ועייפות. עם התקדמות השינויים הפיברוטיים בריאות, מופיע חוסר אוויר במאמץ קטן ובמנוחה. לרוב החולים יש. בבדיקה פיזיקלית שומעים חרחורים יבשים מעל בסיסי הריאות. בשלבים המתקדמים של ה-Fibrosis בריאות וירידה בריווי החמצן בדם, מופיעים סימנים של אי ספיקת לב ימין (גודש ורידי צוואר, הפרעות קצב הלב, הגדלת כבד, מיימת ובצקות ברגליים. בדיקת בית החזה בעזרת צילומי רנטגן איננה רגישה לגילוי של ILD; הבדיקה המומלצת לגילוי ולהערכה של ILD היא בדיקת טומוגרפיה ממוחשבת ברזולוציה גבוהה של בית החזה (High Resolution Computer Tomography ,HRCT). בדיקת HRCT מאפשרת לקטלג שינוים אינטרסטיציאליים בשדות ריאות כמו "זכוכית מט" (Ground Glass Opacities, GGO), שינוים רשתיים (Reticular Changes) או שינוים בצורת "חלת דבש" (Honey Combing), והרחבה של הסמפונות ((Traction Bronchiectasis. לשינויים אינטרסטיציאליים בריאות מספר צורות; בהכשר ל-CTD השכיחות ביניהן NSIP (Non-Specific Interstitial Pneumonia) ו-UIP (Usual Interstitial Pneumonia). ב-Scleroderma, יותר שכיחה NSIP ופחות שכיחה צורה של UIP; ל-UIP התקדמות ה-Fibrosis עמוקה יותר לעומת NSIP. קיימת התאמה בין חומרת השינויים ב-HRCT וירידה במדדי תפקודי נשימה; פגיעה ביותר מ-20 אחוזים משטחי הריאות, המודגמת ב-HRCT, מנבאת שיעורי תחלואה ותמותה גבוהים יותר בקרב חולי Scleroderma. הומלץ על ביצוע HRCT של בית החזה לכל חולה Scleroderma חדש ומעקב סדיר אחרי שינויים בפרקי זמן נדרשים (בין 6–12 חודשים), בייחוד בחולה עם גורמי סיכון לILD) Scleroderma נרחבת, הימצאות נוגדנים 70-SCL). הפרעה בתפקודי נשימה נמצאה בכ-25 אחוזים מהחולים כבר ב-3 השנים הראשונות מתחילת ה-Scleroderma. בין המדדים העיקריים להערכת מצב הריאות בחולי Scleroderma בדיקת נפח FVC (Forced Vital Capacity) ובדיקת חילופי גזים DLCO (Diffusing Capacity of the Lungs For Carbon Monoxide). ירידה מקבילה ב-FVC ו-DLCO מצביעה על קיומה של ILD. ערכי DLCO ו-FVC נחשבים ירודים כאשר הם מתחת ל-80 אחוזים מהתקן ביחס לגיל, מין וגובה. ירידה מעבר ל-50 אחוזים מצביעה על פגיעה ראייתית קשה ומנבאת שיעור תמותה גבוה ב-3 השנים הבאות. ירידה של כ-10 אחוזים ב-FVC וכ-15 אחוזים בDLCO בפרקי זמן קצרים נחשבת כסמן למחלת ILD מתקדמת. חולי Scleroderma עם ILD מתקשים בהליכה של 6 דקות (Minute Walk Test 6); מרחק הליכה הנמוך מ-300 מטר וירידה בריווי חמצן הנמדדת באצבע בעזרת מכשיר Oxymeter לפני ואחרי המאמץ מעיד על מעורבות ריאות משמעותית. לבדיקת שטיפת סמפונות אין תרומה משמעותית לאבחנה של ILD, לרוב נעזרים בה בחשד למחלת ריאות אחרת (זיהום וכדומה). ביופסיה פתוחה מריאה איננה חובה בחשד ל-ILD; לרוב ביופסיה מתבצעת לצורכי מחקר או במקרים בהם אבחנה של ILD מוטלת בספק.
מטרת הטיפול ב-ILD היא בלימה של תהליך דלקתי ו-Fibrosis ריאתי, שיפור בתפקודי הנשימה, בתפקוד הכללי, באיכות החיים, ובהישרדות של החולים. בשני RCT, Scleroderma Lung Study 1 ו-2 (SLS-2, SLS-1)[15][16] דווח על יעילות של Cyclophosphamide ו-Mycophenolate Mofetil בחולים עם ILD על רקע Scleroderma. ב-RCT SENSCIS (Nintedanib for Systemic Sclerosis–Associated Interstitial Lung Disease), (מעקב Tyrosine Kinase ברקמת ריאות) Nintedanib[17] האט משמעותי ירידה בנפחי הריאות (FVC) עד 50 אחוזים בהשוואה ל-Placebo. ב-RCT INBUILD (Nintedanib in Progressive Fibrosing Interstitial Lung Diseases)[18] בקרב חולים עם מחלת ריאות פיברוטית אידיופתית (Interstitial Pulmonary Fibrosis ,IPF) ו-ILD בקבוצה של מחלות CTD כולל Scleroderma, תסמונת Sjogren, Dermatomyositis, דלקת מפרקים, טיפול ב-Nintedanib הביא להאטה משמעותית של הידרדרות בערכי FVC במחצית מהחולים. דווח על שיפור במצב הריאות בבדיקות דימות ובתפקודי נשימה בחולים שעברו HSCT במסגרת RCT על טיפול ב-Scleroderma נרחבת. חולי Scleroderma רבים סובלים ממעורבות של הושט על רקע Reflux אשר יכול לגרום לשאיפת תוכן קיבה למערכת נשימה (Aspiration). הומלץ על שימוש במעקבי חומצה מסוג Proton Pump Inhibitors (PPI) למניעת השלכות של Reflux ושאיפות. חיוני להפסיק עישון, לבצע פעילות גופנית ארובית מתונה, התעמלות ושיקום נשימתי במכוני ריאות מוכרים. לחולים עם ILD הומלץ ביצוע חיסון נגד דלקת ריאות Pneumovax-23 ו-13-Prevenar וחיסון נגד שפעת עונתית. בעקבות התפשטות מגפת ה-COVID-19 (נגיף קורונה) לחולים עם ILD הומלץ על חיסון נגד נגיף קורונה. בחולים עם ILD מתקדמת וסימנים של PAH, הומלץ על טיפול תומך בחמצן וטיפול באי ספקת לב. במקרים בהם פגיעה בריאות היא קשה עם מצוקה נשימתית, יש מקום לשקול השתלת ריאה.
סיכום:
ב-Scleroderma מחלת ריאות אינטרסטיציאלית מופיעה בשנים הראשונות מתחילת Scleroderma, בעיקר ב-Scleroderma נרחבת והמצאות נוגדנים SCL-70. התסמינים הקליניים של ILD אינם ספציפיים ויכולים להיות מוסתרים על ידי ביטוים של Scleroderma. ישנה חשיבות רבה לגילוי מוקדם של ILD ולהערכה קלינית מסודר כולל מעקב אחרי שינוים ב-HRCT תפקודי נשימה. טיפול מוקדם עשוי למנוע את התפשטות של Fibrosis בריאות, לשמור על תפקודי הנשימה ולמנוע הידרדרות נשימתית ולבבית. בין הטיפולים המומלצים Cyclophosphamide או Mycophenolate Mofetil בהתחשבות בביטוים אחרים של Scleroderma (עור, מפרקים, שרירים, לב). המקום של טיפולים ביולוגיים ו-HSCT לטיפול ב-ILD בחולי Scleroderma טרם הובהר. טיפול ב-Nintedanib מאט קצב הידרדרות של תפקודי נשימה ומונע התפשטות של Fibrosis בריאות.
יתר לחץ דם ריאתי
יתר לחץ דם ריאתי נחשב לאחד הביטויים הקשים של Scleroderma, עם שיעורי תחלואה ותמותה גבוהים. 15-10 אחוזים מהחולים מפתחים PAH בעל משמעות קלינית. ב-Scleroderma נרחבת PAH לרוב מופיעה משנית ל-ILD מתקדמת; PAH שכיחה יותר ב-Scleroderma מוגבלת בת מהלך ממושך. ביטוים קליניים של PAH אינם ספציפיים: עייפות, מיחושים בבית החזה וקשיי נשימה במאמץ. עם התקדמות המחלה, מופיעים קשיי נשימה במאמצים קלים ואף במנוחה ותחושת עילפון במאמץ. קוצר נשימה במנוחה, איבוד הכרה וסימנים של אי ספיקת לב ימין הם ביטויים מאוחרים של PAH. בבדיקה גופנית סימנים מופיעים בשלב מאוחר כגון קול שני מודגש מעל העורק הריאתי וסימנים של אי ספיקת לב ימין. באקג מופיעים סטייה ימנית של ציר הלב וסימני עומס על חדר ימין. בצילום חזה רואים הרחבת כלי דם בשערי הריאות ומיעוט כלי דם בפריפריה. אקו לב (Echocardiography, Echo) במנוחה היא בדיקה בחירה לגילוי של PAH עם הערכת לחץ בעורקי הריאה בצורה עקיפה. האבחנה של PAH מבוססת על מדידה ישירה של הלחץ בעורק הריאה באמצעות צנתור לב ימין. במהלך הצנתור מודדים באופן ישיר לחץ הדם בעורק הריאתי, בפרוזדור ובחדר ימין; בנוסף מודדים ומפל לחצים בין צד ימין וצד שמאל של הלב (לחץ יתד), תפוקת לב ימין ועוד פרמטרים נוספים. עליה של לחץ ממוצע בעורק הריאה מעל 20 מילימטרים כספית (ממ"כ) במנוחה או 25 ממ"כ במאמץ מוגדרת כ-PAH. בהיעדר לחץ יתד מוגבר (Wedge Pressure גדול מ-15 ממ"כ) העלייה בלחץ הריאתי נקשרת למעורבות הריאות; עליה בלחץ יתד מעל 15 ממ"כ מצביעה על מעורבות של הלב במחלה. במהלך צנתור גם נבדקים השפעת התרופות והעמידות של לב ימין להעמסת נוזלים.
PAH נובע מפגיעה בשכבת האנדותל בנימי דם של הריאה, המלווה בהפרעה באיזון בין החומרים המכווצים את כלי הדם ולחומרים המרחיבים את כלי הדם הריאתיים. בקרב חולי Scleroderma הסובלים מ-PAH נמצאו רמות גבוהות של Endothelin-1, מכווץ כלי הדם החזק ביותר, וחסר של מרחבי כלי דם חזקים כמו Nitric Oxide ו-Prostacyclin. כתוצאה מכך, נימי דם מתכווצים, מתקיים שגשוג תאי שריר החלק בדופן שלהם והדופן נהיה מתעבה עם היצרות ניכרת עד לסגירה מלאה של כלי דם והפרעה זרימת הדם בנימי דם ועורקים של ריאות. כתוצאה מכך הלחץ במערכת עורקי הריאה עולה עד לפגיעה בתפקוד וכישלון של הלב הימני.
ל-PAH מהלך מתקדם עם תוחלת החיים קצרה עד 2.5 שנים מעת האבחון, לכן לגילוי מוקדם של PAH חשיבות עליונה. חולים עם Scleroderma צריכים לעבור הערכה קלינית חוזרת בפרקי זמן מוגדרים, הכוללת הערכה תפקודית לפי New York Heart Association (NYHA), בדיקה גופנית, תפקודי נשימה ואקו לב. בחולים עם PAH בבדיקת תפקודי נשימה ישנה ירידה בממד לחילוף גזים בריאות (DLCO), בבדיקת הליכה 6 דקות ישנה ירידה במרחק הליכה וירידה בריווי חמצן בסיום ההליכה. להערכה של PAH ומצב לבבי משתמשים בסמנים ביולוגיים כגון BNP (Brain natriuretic peptide) ומקבילו NT- pro-BNP (N-Terminal-pro hormone BNP), רמתם עולה ב-PAH ומצוקה לבבית; ישנה התאמה בין רמת BNP\PRO-BNP לחומרת PAH, חומרת אי ספיקת לב והצפי לתגובה לטיפול.
לתרופות לטיפול ב-PAH תכונות של מרחיבים חזקים של כלי דם אך גם יכולת למנוע שגשוג של תאי השריר החלק בדופן של כלי הדם בריאות ובדרך הזו יכולת למנוע היצרות של נימי דם ועורקים בריאות. מקטלגים טיפולים תרופתיים ב-PAH לפי מנגנוני הפעולה:
- קבוצת פרוסטציקלינים סינתטיים: Epoprostenol (Flolan) הניתן תוך-ורידית דרך משאבה, Iloprost הניתן תוך ורידית דרך משאבה או בשאיפה, Treprostinil (Remodulin) הניתן תוך ורידית או תת-עורית דרך משאבה או בשאיפה. הוחל שימוש ב-Selexipag (Uptravi)[19], תרופה פומית הפועלת כ-Agonist של קולטן ל-Prostacyclin ובדרך זו מגבירה את כמות ופעילות הפרוסטציקלינים
- תרופות המעכבות את Endothelin-1 (Endothelin Receptor Antagonists, ERA); Bosentan (Tracleer), מעכב בלתי סלקטיבי של קולטנים ל-Endothelin-1 (קולטני A ו-B) ו-Ambrisentan (Volibris)[20] מעכב בררני של קולטן A ל-Endothelin-1, ו-Maicitentan (Opsumit)[21], מעקב דואלי של Endothelin-1
- תרופות מעכבות Phosphodiesterase 5 (5-PDE) הגורמות ליצירה של Cyclic Guanosine Monophosphate (cGMP) אחד המרחיבים החזקים של כלי הדם הודות לעליה של רמת Nitric Oxide, בהם Sildenafil (Revatio) ו- Tadalafil (Cialis). Riociguat (Adampas)[22] הוא ממריץ המסיס Guanylate Cyclase (sGC) המגביר מחזורי Cyclic Guanosine Monophosphate (cGMP) ויצירה של Nitric Oxide
טיפול ב-PAH ניתן בהתאם לתוצאות של צנתור לב ימין ועל פי דרגה תפקודית לפי NYHA. בחולים עם PAH והפרעה תפקודית בדרג קלה (II-I Class NYHA), הטיפול המומלץ כולל שימוש תרופות מסוג ERA, מעכבים PDE-5, Selexipag, Riociguat ושאיפה של Prostacyclin סינתטי. במהלך המעקב החולים עם PAH כולל אקו לב, תפקודי נשימה כולל מבחן הליכה 6 דקות, בדיקות דם לרמת BNP או Pro-BNP; במקרים של חוסר תגובה לטיפול מתבצע צנתור לב ימין חוזר ובהתאם לתוצאות יישקל טיפול מוגבר. מתגבשת המלצה לטפל ב-PAH עם שילובי תרופות עם מנגנוני פעולה שונים במטרה למנוע התקדמות של PAH ולשמר את הדרגה התפקודית והמדדים ההמודינמיים. בחולים עם PAH גבוה והפרעה ניכרת בתפקודית (NYHA Class III-IV), הטיפול המועדף יהיה במתן פרוסטציקלינים סינתטיים לווריד או תת-עור בהזלפה ללא הפסקה בשילוב עם תרופות נוספות. חולים עם כשל לב ימין על רקע PAH מקבלים טיפול תומך בחמצן, משתנים (Spironolactone, Furosemide), תרופות להסדרת קצב הלב ועוד. במצבים של PAH קשה וסמני אי ספיקת לב ימין נשקלת אפשרות של השתלת ריאה.
סיכום:
יתר לחץ דם ריאתי הוא סיבוך קשה של Scleroderma, עם השפעה שלילית על איכות החיים ושיעורי תחלואה ותמותה גבוהים. ערנות של הצוות המטפל עשויה להביא לגילוי מוקדם של PAH על ידי אקו לב. האבחנה של PAH ומעקב מבוססים על תוצאות צנתור לב ימני. הצלחת הטיפול תלויה בחומרת PAH והירידה התפקודית על פי ה-NYHA. מעקב אחרי PAH בקרב חולי Scleroderma כולל הערכה קלינית, תפקודי נשימה, בדיקות מדדים, ואקו לב ודורש שיתופי פעולה בין דיסציפלינות שונות (ראומטולוג, רופא ריאות, קרדיולוג). התחלת טיפול מוקדם ככל האפשר ושילובי תרופות עשויים להביא לשיפור תפקודי, דחייה של הידרדרות, ושיפור של תוחלת החיים[23].
מעורבות מערכת העיכול
מעורבות מערכת העיכול שכיחה מאוד בקרב חולי Scleroderma; יש לה השפעה ניכרת על איכות החיים. השינויים המתרחשים במערכת העיכול נובעים ממנגנוני המחלה: פגיעה בכלי דם קטנים ובחיבור בין העצבים ושריר החלק בדופן של אברי עיכול אשר יוצרים ליקויים קשים בתנועתיות של דרכי העיכול. ההסתמנות הקלינית והטיפול תלויים בחלק של מערכת העיכול אשר נפגע[24].
- פגיעה בחלל הפה כוללת נסיגה של השפתיים ושל החניכיים, קושי בביצוע היגיינה של הפה (צחצוח שיניים, טיפולי שיניים). 14 אחוזים עד 25 אחוזים מחולי Scleroderma סובלים מיובש קשה בחלל הפה כתוצאה מ-Fibrosis של בלוטות הרוק
- מעורבות של הוושט (Reflux, פגיעה בהחזר ושטי Gastro Esophageal Reflux Disease, GERD) דווחה בקרב 70–90 אחוזים מהחולים. התלונות העיקריות הן צרבת, הפרעות בליעה (תחילה עם אוכל מוצק, בהמשך גם עם אוכל נוזלי), הרגשת שובע מוקדם, חוסר תיאבון וירידה במשקל. Reflux נובע מחולשה של שרירי הושט, הושט פעור, והתוכן החומצי של הקיבה חוזר אליו באופן חופשי. ה-Reflux גורם לדלקת, כיבים, הצטלקות ברירית הושט, היצרות ושינויים במבנה של הרירית (Barret's Esophagus). פגיעה קשה בוושט תואמת חומרה של מעורבות ריאות (ILD); עקב הגעת תוכן חומצי של קיבה לדרכי נשימה העליונות ואפילו לריאות (Aspiration). מומלץ לבצע הערכה של מצב הושט בתחילת Scleroderma בכלל החולים בהתאם לתלונות החולה והיא כוללת גסטרוסקופיה, מנומטריה (בדיקת לחצים בושט), pH מטריה (בדיקת חומציות בושט), בליעת Barium ובדיקת איזוטופים להתרוקנות הקיבה. להקלת תסמיני Reflux הומלץ להקפיד על צריכת מאכלים שאינם מגבירים את חומציות הקיבה, לאכול מנות קטנות בפרקי זמן קצרים, להימנע משכיבה למשך ארבע שעות לאחר הארוחה ולישון עם ראש מורם. הטיפול התרופתי כולל תרופות PPI במינונים גבוהים. דווח על הטבה של תסמיני Reflux והפרעות בליעה הודות שילוב של PPI ומתן Domperidone (Motilium). דווח על טיפול בעירוי אימונוגלובולינים (IVIG, Immunoglobulins) במקרים של הפרעת בליעה קשה עם סמנים של מעורבות שרירים (Myositis). במקרים קשים של Reflux, עמידים לטיפול תרופתי, ניתן לשקול ניתוח פונדופלסטיה (Fundoplasty)
- פגיעה בקיבה מתבטאת לרוב בדימומים סמויים מכלי הדם השטחיים של הקיבה (GAVE, Gastric Antral Vascular Ectasia). שכיחות גבוהה יותר של GAVE נמצאה בחולים עם נוגדנים מסוג RNAP-3 (RNA polymerase III), שניהם ניבאו הופעת משבר כיליתי. בגסטרוסקופיה רירית הקיבה מקבלת מראה של "אבטיח". הדימומים מהקיבה עלולים לגרום לאנמיה מחוסר ברזל בחומרה שונה, עם תסמינים כמו חולשה ועייפות. בירור אנמיה כולל אנדוסקופיה של דרכי העיכול העליונות (גסטרוסקופיה). הטיפול ב-GAVE כולל צריבה של כלי הדם המדממים בלייזר עם תוספת גז ארגון בעת ביצוע גסטרוסקופיה. טיפול תומך כולל עירויי ברזל; במקרים של אנמיה קשה סימפטומטית ייתכן צורך במתן מוצרי דם.
מעורבות הקיבה עשויה לכלול גם האטה במעבר תוכן הקיבה למעי. ניתן לאבחן זאת בבליעת בריום או בליעת מזון המסומן באיזוטופ. הטיפול כולל תרופות המשפרות את התנועתיות של הקיבה כגון Metoclopramide (Pramin), Erythromycin ו-Motilium - פגיעה במעי עשויה לכלול את המעי הדק, המעי הגס, ואזור ה-Anus ופי הטבעת. מעורבות מעי נובעת מפגיעה בשריר החלק והפרעה בתנועתיות המעי, וצמיחה של חיידקים אנאירוביים בחלל המעי Small Intestinal Bacterial Overgrowth (SIBO)[25]. חולים סובלים משלשולים, תפיחות בבטן, תת-ספיגה, ירידה במשקל, חסר ברזל וחסר ויטמין B12. Fibrosis בקטעים שונים של דופן המעי עלולה להוביל לאירועים חוזרים של חסימת מעי, ואף להופעת בועות אוויר בדופן המעי (Intestinalis Pneumatosis). חסימת מעיים ו-Pneumatosis היא מצב חירום רפואי בעל השלכות קשות. אבחנה של מעורבות מעי מבוססת על קליניקה, בדיקת נשיפה (סבילות Lactose ופירוק סוכרים) ובדיקות דימות שונות. יש שכיחות גבוהה של מחלת Celiac בקרב חולי Scleroderma, בעיקר עם מחלת עור מוגבלת והמצאות נוגדנים מסוג ACA; בכל חולה עם Scleroderma עם תסמינים של מעורבות המעי הדק ו/או אנמיה מחוסר ברזל יש צורך לבדוק נוגדנים ל-Gliadin (בדיקות למחלת Celiac). טיפול במעורבות של מעי הדק ו-SIBO כולל מתן סדרות קצרות של אנטיביוטיקה רחבת-טווח או מתן Rifaximin, האנטיביוטיקה שלא נספגת במעי אך פועלת מקומי. לחולים עם הפרעות ספיגה מטפלים עם תוספות ברזל וויטמינים חיוניים (חומצה פולית, ויטמין B12, ויטמין D, ויטמין B1) . דווח על שימוש ממושך בפרוביוטיקה עם שיפור בתסמיני SIBO. הנושא של Microbiota והשתלת צואה במקרים קשים של מעורבות המעי ב-Scleroderma נמצאים בשלבי מחקר וטרם הושגו מסקנות קליניות. במקרים של תת-ספיגה קשה, ירידה מתמדת וקשה במשקל, אירועים של חסימת מעיים או Pneumatosis, יש צורך בהזנה תוך-ורידית (TPN, Total Parenteral Nutrition). מעורבות המעי הגס נוטה להתבטא בעצירות ושלשולים לסירוגין עם הרחבה של חלל החלחולת. בדומה לקיבה, עלולים להופיע במעי הגס טלנגיאקטזיות עם נטייה לדמם ולאנמיה של חסר ברזל. אבחון של מעורבות המעי הגס מבוסס על תוצאות של דימות וקולונוסקופיה. דלדול השרירים באזור פי הטבעת וה-Anus עלול להוביל לאי שליטה בסוגרים בקרב 10 אחוזים מהחולים. במקרים של מעורבות אנו-רקטלי (Anorectal), יש צורך ברקטוסקופיה, על קול (Ultrasound) של האזור האנלי (Anal) ומנומטריה של הסוגר האנלי. הטיפול במעורבות של המעי הגס הוא תסמיני (להקלת תסמינים). הטיפול באי שליטה על הסוגר האנאלי כולל תרגילי פיזיותרפיה, ביופידבק, הכנסת קוצב חיצוני; יעילותם של ניתוחים באזור האנו-רקטלי שרויה במחלוקת. דווח על השפעה טובה של עירוי אימונוגלובולינים (IVIG) בחולים עם מעורבות המעי הדק, המעי הגס ואי שליטה על סוגרים כביטוי לפגיעה בתנועתיות של המעי, בעיקר בשילוב של Scleroderma ופגיעה בשריר[26][27]
- פגיעה בכבד דווחה בכ-15 אחוזים מהחולים עם Scleroderma מוגבלת בעיקר כשחמת הכבד Primary Biliary Cirrhosis (PBC), צורה של מחלה פיברוטית בדרכי המרה. מהלך המחלה בדרך כלל שפיר וכולל עלייה ברמות אנזימי הכבד הכולסטטיים (Cholestatic) והופעה של נוגדנים למיטוכונדריה (Anti-Mitochondrial Antibodies)
סיכום:
פגיעה במערכת העיכול שכיחה בקרב החולי Scleroderma והיא מערבת חלל הפה, הושט, הקיבה, המעי הדק, מעי הגס ואזור אנו-רקטלי[28]. הפגיעה בהם נובעת מ-Fibrosis ודלדול של שריר החלק בדופן המעי, מה שמוביל להפרעה בתנועתיות של חלקי מערכת העיכול השונים, לרוב כפגיעה משולבת. הביטויים העיקריים כוללים GERD, דמם מרירית הקיבה, שלשולים, עצירות, אי שליטה על סוגרים ותת ספיגה. הטיפול בהפרעות הושט והקיבה מתמקד במעכבי משאבת הפרוטונים ותרופות משפרות תנועתיות של דרכי העיכול; במקרים של GAVE, SIBO, תת-ספיגה, PBC יינתן טיפול בהתאם.
מעורבות כלייתית
מעורבות כליות ב-Scleroderma לרוב מתבטאת כמשבר כיליתי; בחלק מהחולים השורדים משבר כיליתי, יכולה עם הזמן להתפתח אי ספיקת כליות כרונית. משבר כלייתי (SRC, Scleroderma Renal Crisis) הוא סיבוך חד וקשה של Scleroderma, הוא מתרחש בכ-15 אחוזים מכלל החולים, בעיקר ב-Scleroderma נרחבת ובשלבים המוקדמים של המחלה (עד 4–5 שנים מתחילת Scleroderma). המשבר הכלייתי עשוי להיות הביטוי הראשון של Scleroderma בכ-20 אחוזים מהחולים. במחקרים תצפיתיים נמצא שטיפול במינונים גבוהים של סטרואידים קדם להופעת של משבר כלייתי. בין גורמים נוספים המזוהים עם משבר כלייתי Scleroderma נרחבת עם מהלך דוהר, דלקת מפרקים וגידים, דלקת בקרום הלב (Pericarditis) ואנמיה; במרבית החולים נמצאים נוגדנים מסוג ANA עם צביעת גרעין מגורגרת (Speckled Pattern); במחצית מהחולים עם משבר כיליתי הודגמו נוגדנים מסוג RNAP-3.
המנגנון של המשבר הכלייתי אינו לגמרי ברור, אך חושבים שהפרעה בתפקוד של אנדותל בנימי דם ועלייה ברמות Endothelin-1 הן הגורמים העיקריים לעיבוי הדופן, להיצרות ולסגירה של כלי הדם הקטנים בכליה. ההפרעה באספקת הדם לכליה מובילה לשגשוג התאים במערכת החוץ-גלומרולרית (Juxtaglomerular Apparatus), ולהפרשה מוגזמת של Renin ו-Angiotensin (מכווצים כלי הדם החזקים ביותר). המאפיינים העיקריים של המשבר הכלייתי כוללים הופעה של יתר לחץ דם מערכתי "חדש" (מעל 150/85 ממ"כ) והפרעה בתפקוד הכלייתי עם ירידה ניכרת במתן שתן ואף הפסקת מתן שתן. הביטויים הקליניים אינם ספציפיים כמו כאבי ראש, הפרעות ראיה ובחילות במקרים קלים והקאות, מצוקה נשימתית, איבוד הכרה ופרכוסים כביטוי לפגיעה במערכת עצבים מרכזית על רקע יתר לחץ דם (Hypertensive Encephalopathy) במקרים קשים. יתר לחץ הדם מערכתי עלול לגרום לצבירת נוזלים ולהתפתחות של בצקות ברגליים, גודש ואף בצקת ריאות, הפרעות קצב, וחולשה קיצונית. בבדיקות המעבדה רואים אנמיה המוליטית (Microangioathic Hemolytic Anemia) עם שברי תאים אדומים בבדיקת ספירת דם, ירידה במספר הטסיות ועלייה ברמות Renin ו-Creatinin. בבדיקת שתן אופייני למצוא חלבון, כדוריות דם אדומות וגלילים מגורענים. ביופסיה כלייתית מתבצעת רק במקרים בהם קיימת אבחנה מבדלת עם מחלות כליה אחרות (Vasculitis או זאבת); לביופסיה של כליה ב-Scleroderma אופייניים סימני Ischemia של גלומרולים, נמק פיברינואידי של העורקים ונימי דם וקרישי דם שנוצרים בנימי דם ועורקים קטנים הצרים.
הטיפול במשבר הכלייתי כולל איזון קפדני של לחץ הדם, כאשר טיפול הבחירה הוא במעכבי ACE ( Angiotensin Converting Enzyme); תוספת של חוסמי תעלות סידן ומעכבי ACE עשויה לסייע באיזון של לחץ דם סיסטמי. למרות הטיפול האינטנסיבי, כ-25 אחוזים מהחולים מפתחים אי ספיקת כליות חמורה ונזקקים לדיאליזה. לעומת זאת, עם הזמן כמחצית מהחולים משקמים את התפקוד הכלייתי ונגמלים מדיאליזה תוך 1–3 שנים. אחרי שנתים-שלוש רק חלק מהחולים נזקקים להשתלת כליה.
סיכום:
משבר כלייתי הוא סיבוך נדיר אך קשה של Scleroderma, הוא צפוי בעיקר בחולים עם Scleroderma נרחבת סוערת, המצאות נוגדנים Speckled pattern ANA וRNAP-3. יש להימנע מטיפול במינונים גבוהים של סטרואידים בחולים עם Scleroderma, בעיקר במקרים של Scleroderma נרחבת דוהרת ובחולים עם נוגדנים RNAP-3. בחולים עם גורמי סיכון למשבר כיליתי יש צורך במעקב קפדני אחר לחצי הדם. הופעת עליה בלחץ הדם הסיסטמי מעלה חשד למשבר כיליתי, בעת הפרעות בתפקודי הכליות ואנמיה המוליטית קובעים אבחנה של משבר כיליתי. טיפול הבחירה במשבר כיליתי הוא במעכבי ACE. חולים עם אי ספיקת כליות חמורה עלולים להזדקק לדיאליזה, אך יש סיכוי לשיקום התפקוד הכלייתי ב-2–3 שנים הבאות.
מעורבות מערכות נוספות
- תסמונת התעלה הקרפלית (Carpal Tunnel Syndrome ,CTS) היא תסמונת המתבטאת בכאבים ונימול באצבעות 1-2-3 בשעות הלילה. נפיחות בידיים ודלקת בנרתיקי הגידים המכופפים בשורשי כפות הידיים היוצרות לחץ על העצב המדיאני, מה שמוביל למחושים בידיים כולל נימול, עקצוץ וכאבים. האבחנה מתבססת על הסימנים הקליניים, תמונה אופיינית בבדיקה על קולית (Ultrasound) ובדיקה של הולכה עצבית (Electromyography ,EMG). הטיפול ב-CTS הוא מתן תרופות נוגדות דלקת כולל הזרקה מקומית של סטרואידים בשילוב עם פיזיותרפיה וריפוי בעיסוק. טיפול ניתוחי שמור למקרים של כישלון הטיפול התרופתי. הופעת סימנים של CTS בשתי ידיים יחד עם תסמונת Raynaud מעלים חשד למחלת רקמות חיבור כולל Scleroderma
- נוירלגיה טריגמינלית (Trigeminal Neuralgia) נובעת מ-Ischemia של העצב הטריגמינלי ובאה לידי ביטוי ככאב חזק בלחיים ובלסתות, לרוב, דו צדדי (פיזור של העצב הטריגמינלי)
- הפרעת שמיעה (ירידה בשמיעה וחרשות) הוא סיבוך נדיר של Scleroderma אשר מתפתח בעקבות Ischemia של עצב השמיעה ושינוים פיברוטיים באוזן התיכונה
- תסמונת יובש (Sicca syndrome) מתבטאת ביובש קשה בעיניים, בפה ובריריות. יובש זה נובע מ-Fibrosis של בלוטות הרוק והדמע
- הפרעה בתפקוד המיני בגברים נגרמת על ידי Ischemia ו-Fibrosis של גופים קוורנוטיים (Cavernous) באיבר המין של וגורמת לליקוי בזקפה. נשים מתלוננות על קושי בפעילות מינית בשל יובש בדרכי המין. כאבים והגבלות תנועה במערכת המוסקולוסקלטלית, שינוים חיצוניים, עייפות וירידה בחשק המיני אופייניים לשני מינים
- הפרעות במתן שתן כמו דחיפות או הפרעות בהתרוקנות של שלפוחית השתן תוארה בחולי Scleroderma; הן נובעות משינוים פיברוטיים בשלפוחית השתן עם קיבולת ירודה והפרעות בהתכווצות של השלפוחית
- הפרעות במצב הרוח שכיחות בקרב חולי Scleroderma בצורת חרדה, הפרעות שינה ודיכאון. בין הגורמים להפרעות נפשיות חולים מציינים כאב כרוני, הגבלה תפקודית, צורך בבדיקות מרובות, ביקורים תדירים במוסדות רפואיות, שימוש כרוני בתרופות, שינוי במראה החיצוני, הפרעות בתפקוד המיני, שינוי בתנאי העבודה ותגובה של בני משפחה וחברים. תמיכה של צוות המטפלים כולל שיחות עם פסיכולוג, תמיכה של בני משפחה וסביבה יכולים לעזור; במקרים קשים יותר יש צורך בטיפול תרופתי
אבחנה
האבחנה של Scleroderma מבוססת על ההסתמנות הקלינית בהתאם לקריטריונים לסיווג של 2013 אשר פתחו על ידי ארגונים ראומטולוגיים של אמריקה ואירופה (ACR/EULAR, American College of Rheumatology/European League Against Rheumatism)[29]. לפי קריטריונים החדשים קיימים שמונה סעיפים של תופעות עם ניקוד משתנה. לפי כך אבחנה של Scleroderma מבוססת על צבירת 9 נקודות כאמור מעורבות נרחבת של העור נותנת ישר 9 נקודות; במקרים של מחלת עור מוגבלת משתמשים בסכום הכולל עם ניקוד לפי כל סעיף באופן פרטני (לפי טבלת ניקוד) שכוללים מעורבות עור, מעורבות כל דם, מעורבות ריאות ויתר לחץ דם ריאתי והמצאות של נוגדנים ספציפיים (ATA, ACA, RNAP-3)[30].
אבחנה מבדלת של Scleroderma סיסטמית
- בשלבים המוקדמים קשה להבדיל Scleroderma ממחלות אוטואימוניות אחרות; במהלך מעקב עם התבטאות ברורה יותר קלינית ומידה על נוגדנים אופייניים האבחנה של Scleroderma תהיה מבוססת ומוצקה
- בניגוד ל-Scleroderma סיסטמית עם מעורבות עור ואיברים פנימיים קיימת צורה של Scleroderma "ממוקמת", Localized Scleroderma שבה מופיעים נגעים עוריים של עיבוי עור ושינוי צבע העור במקומות שונים. בביופסיית עור מהנגעים נמצאים אותם שינוים כמו בביופסיה של עור ב-Scleroderma סיסטמית: עיבוי עור, ריבוי תאי דלקת ושקיעה של סיבי Collagen. בניגוד ל-Scleroderma סיסטמית, ב-Scleroderma ממוקמת אין תסמונת Raynaud, אין מעורבות של איברים פנימיים ואין נוגדנים עצמיים. התופעה של Scleroderma ממוקמת שכיחה בקרב ילדים ומתבגרים, ומופיעה במבוגרים רק במקרים נדירים. לקבוצה זו שייכת Morphea, המתבטאת ברבדים סגלגלים או מעוגלים של עור מעובה עם שינויי צבע עור, ו-Linear Scleroderma, צורה קווית העשויה להופיע באזור הפנים ונקראת "de Sabre Coup" או לאורך הגפה. אם נגעים של מורפיאה גדולים או רבים או במקרים של Scleroderma ליניארית המערבות תת-עור, אזורי מפרקים, ניתן טיפול בעירוי סטרואידים (SoluMedrol) במינון גבוה, תרופות מדכאות חיסון, פוטותרפיה, פיזיותרפיה, וריפוי בעיסוק
- קיימים מספר מצבים דמוי-Scleroderma. בהם:
- Bushke Scleroderma מתבטאת בעיבוי עורי המזכיר את זה של Scleroderma, אך לחולים אין תסמונת Raynaud, אין נוגדנים אופייניים ל-Scleroderma ולרוב העור באצבעות הידיים שמור. השינויים בביופסיה ב Bushke Scleroderma שונים וכוללים שקיעת מוצין ולא Collagen
- Eosinophilic fasciitis מתאפיינת בעיבוי עורי המלווה במעורבות של מעטפת השרירים. החולים סובלים מכאבי פרקים ועיבוי עורי באמות, כפות הידיים והשוקיים המלווים בהגבלה ניכרת בתנועה. בבדיקות דם נמצא מספר גבוה של אאוזינופילים. בביופסיה של מעטפת השריר ניתן לראות ריבוי תאי דלקת ואאוזינופילים.
מעקב וטיפול ב-Scleroderma סיסטמית
חולים ב-Scleroderma סיסטמית זקוקים למעקב קפדני הכולל בדיקות עור תכופות וניטור של המערכות החיוניות כולל מדידת לחץ דם סיסטמי, מעקב אחרי משקל, הערכת עור לפי מדד Rodnan, בדיקות דם ושתן תכופות, מעקב אחרי המצב הנשימתי והלבבי על ידי אקג, אקו לב, תפקודי נשימה, HRCT חזה ועוד.
אין טיפול כוללני למחלת Scleroderma סיסטמית, מטפלים בחולי Scleroderma לפי התסמינים של המערכות המעורבות עם דגש על גילוי מוקדם וטיפול מוקדם במטרה לשפר את מצב החולים ולמנוע נזקים עתידיים. גישה לחולים עם מעורבות עור נרחבת או מוגבלת, לחולים עם מחלה "צעירה" (7-5 שנים) ומחלה בת שנים רבות איננה זהה. לאור הנדירות של המחלה וביטויים המגוונים, הומלץ על ריכוז של חולים במרכזים עם צוותים רב מקצועים, בעלי ניסיון בטיפול ב-Scleroderma.
פרוגנוזה
פרוגנוזה במחלת Scleroderma תלויה בהרבה גורמים. לחולים עם מעורבות עור מפושטת, חולים ממין זכר או גיל מבוגר, חולים עם מעורבות ריאות, יתר לחץ דם ריאתי, מעורבות של הלב או הכליות מחלה קשה יותר ותוחלת החיים ירודה בהשוואה לאוכלוסייה כללית.
דגלים אדומים
ביבליוגרפיה
- ↑ Denton CP, Khanna D. Systemic sclerosis. Lancet. 2017 Oct 7;390(10103):1685-1699. doi: 10.1016/S0140-6736(17)30933-9. 2.
- ↑ Khanna D, Tashkin DP, Denton CP, et al. Etiology, Risk Factors, and Biomarkers in Systemic Sclerosis with Interstitial Lung Disease. Am J Respir Crit Care Med. 2020 Mar 15;201(6):650-660.
- ↑ Pope JE, Bellamy N, Seibold JR, et al. A randomized, controlled trial of methotrexate versus placebo in early diffuse scleroderma. Arthritis Rheum. 2001 Jun;44(6):1351-8.
- ↑ Volkmann ER, Tashkin DP, LeClair H, et al. Treatment With Mycophenolate and Cyclophosphamide Leads to Clinically Meaningful Improvements in Patient-Reported Outcomes in Scleroderma Lung Disease: Results of Scleroderma Lung Study II. ACR Open Rheumatol. 2020 Jun;2(6):362-370.
- ↑ Khanna D, Denton CP, Lin CJF, et al. Safety and efficacy of subcutaneous tocilizumab in systemic sclerosis: results from the open-label period of a phase II randomised controlled trial (faSScinate). Ann Rheum Dis. 2018 Feb;77(2):212-220.
- ↑ Khanna D, Lin CJF, Furst DE, et al; focuSSced investigators. Tocilizumab in systemic sclerosis: a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir Med. 2020 Oct;8(10):963-974.
- ↑ Khanna D, Allanore Y, Denton CP, et al. Riociguat in patients with early diffuse cutaneous systemic sclerosis (RISE-SSc): randomised, double-blind, placebo-controlled multicentre trial. Ann Rheum Dis. 2020 May;79(5):618-625.
- ↑ Spiera R, Hummers L, Chung L, et al. Safety and Efficacy of Lenabasum in a Phase II, Randomized, Placebo-Controlled Trial in Adults With Systemic Sclerosis. Arthritis Rheumatol. 2020 Aug;72(8):1350-1360.
- ↑ Tang R, Yu J, Shi Y, et al. Safety and efficacy of Rituximab in systemic sclerosis: A systematic review and meta-analysis. Int Immunopharmacol. 2020 Jun;83:106389.
- ↑ Allanore Y, Wung P, Soubrane C, et alP; Investigators. A randomised, double-blind, placebo-controlled, 24-week, phase II, proof-of-concept study of romilkimab (SAR156597) in early diffuse cutaneous systemic sclerosis. Ann Rheum Dis. 2020 Dec;79(12):1600-1607.
- ↑ van Laar JM, Farge D, Sont JK, et al; EBMT/EULAR Scleroderma Study Group. Autologous hematopoietic stem cell transplantation vs intravenous pulse cyclophosphamide in diffuse cutaneous systemic sclerosis: a randomized clinical trial. JAMA. 2014 Jun 25;311(24):2490-8.
- ↑ Sullivan KM, Goldmuntz EA, Keyes-Elstein L, et al; SCOT Study Investigators. Myeloablative Autologous Stem-Cell Transplantation for Severe Scleroderma. N Engl J Med. 2018 Jan 4;378(1):35-47.
- ↑ Minier T, Guiducci S, Bellando-Randone S, et al; EUSTAR co-workers; EUSTAR co-workers. Preliminary analysis of the very early diagnosis of systemic sclerosis (VEDOSS) EUSTAR multicentre study: evidence for puffy fingers as a pivotal sign for suspicion of systemic sclerosis. Ann Rheum Dis. 2014 Dec;73(12):2087-93.
- ↑ Matucci-Cerinic M, Denton CP, Furst DE, Mayes MD, Hsu VM, Carpentier P, Wigley FM, Black CM, Fessler BJ, Merkel PA, Pope JE, Sweiss NJ, Doyle MK, Hellmich B,Medsger TA Jr, Morganti A, Kramer F, Korn JH, Seibold JR. Bosentan treatment of digital ulcers related to systemic sclerosis: results from the RAPIDS-2 randomised, double-blind, placebo-controlled trial. Ann Rheum Dis. 2011 Jan;70(1):32-8.
- ↑ Tashkin DP, Elashoff R, Clements PJ, et al; Scleroderma Lung Study Research Group. Effects of 1-year treatment with cyclophosphamide on outcomes at 2 years in scleroderma lung disease. Am J Respir Crit Care Med. 2007 Nov 15;176(10):1026-34.
- ↑ Tashkin DP, Roth MD, Clements PJ, et al; Sclerodema Lung Study II Investigators. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma-related interstitial lung disease (SLS II): a randomised controlled, double-blind, parallel group trial. Lancet Respir Med. 2016 Sep;4(9):708-719.
- ↑ Distler O, Highland KB, Gahlemann M, et al; SENSCIS Trial Investigators. Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. N Engl J Med. 2019 Jun 27;380(26):2518-2528.
- ↑ Flaherty KR, Wells AU, Cottin V, et al; INBUILD Trial Investigators. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med. 2019 Oct 31;381(18):1718-1727.
- ↑ Gaine S, Chin K, Coghlan G, Channick R, et al. Selexipag for the treatment of connective tissue disease-associated pulmonary arterial hypertension. Eur Respir J. 2017 Aug 17;50(2):1602493.
- ↑ Pan Z, Marra AM, Benjamin N, et al. Early treatment with ambrisentan of mildly elevated mean pulmonary arterial pressure associated with systemic sclerosis: a randomized, controlled, double-blind, parallel group study (EDITA study). Arthritis Res Ther. 2019 Oct 26;21(1):217.
- ↑ Galiè N, Jansa P, Pulido T, et al. SERAPHIN haemodynamic substudy: the effect of the dual endothelin receptor antagonist macitentan on haemodynamic parameters and NT-proBNP levels and their association with disease progression in patients with pulmonary arterial hypertension. Eur Heart J. 2017 Apr 14;38(15):1147-1155.
- ↑ Humbert M, Coghlan JG, Ghofrani HA, et al. Riociguat for the treatment of pulmonary arterial hypertension associated with connective tissue disease: results from PATENT-1 and PATENT-2. Ann Rheum Dis. 2017 Feb;76(2):422-426.
- ↑ Young A, Nagaraja V, Basilious M, et al. Update of screening and diagnostic modalities for connective tissue disease-associated pulmonary arterial hypertension. Semin Arthritis Rheum. 2019 Jun;48(6):1059-1067.
- ↑ Braun-Moscovici Y, Brun R, Braun M. Systemic Sclerosis and the Gastrointestinal Tract-Clinical Approach. Rambam Maimonides Med J. 2016;7(4):e0031.
- ↑ Pittman N, Rawn SM, Wang M, et al. Treatment of small intestinal bacterial overgrowth in systemic sclerosis: a systematic review. Rheumatology (Oxford). 2018 Oct 1;57(10):1802-1811.
- ↑ Raja J, Nihtyanova SI, Murray CD, et al. Sustained benefit from intravenous immunoglobulin therapy for gastrointestinal involvement in systemic sclerosis. Rheumatology (Oxford). 2016 Jan;55(1):115-9.
- ↑ Sanges S, Rivière S, Mekinian A, et al. Intravenous immunoglobulins in systemic sclerosis: Data from a French nationwide cohort of 46 patients and review of the literature. Autoimmun Rev. 2017 Apr;16(4):377-384.
- ↑ Gyger G, Baron M. Systemic Sclerosis: Gastrointestinal Disease and Its Management. Rheum Dis Clin North Am. 2015 Aug;41(3):459-73.
- ↑ van den Hoogen F, Khanna D, Fransen J, et al. 2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European League against Rheumatism collaborative initiative. Arthritis Rheum. 2013 Nov;65(11):2737-47.
- ↑ Kowal-Bielecka O, Fransen J, Avouac J, et al; EUSTAR Coauthors. Update of EULAR recommendations for the treatment of systemic sclerosis. Ann Rheum Dis. 2017 Aug;76(8):1327-1339.
המידע שבדף זה נכתב על ידי פרופסור אלכסנדרה בלביר, מנהלת היחידה לראומטולוגיה, המרכז הרפואי רמב"ם, האיגוד הישראלי לראומטולוגיה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק