הבדלים בין גרסאות בדף "כאב נוירופתי - תפקידם של סיבי עצב מטיפוס Aβ בכאב - Neuropathic pain - Aβ sensory neurons' role"
(דף חדש: {{ערך בבדיקה}} {{מחלה |תמונה= |כיתוב תמונה= |שם עברי=כאב נוירופתי - תפקידם של סיבי עצב מטיפוס Aβ |שם לועזי=Aβ...) |
|||
| (18 גרסאות ביניים של 4 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
| − | |||
| − | |||
{{מחלה | {{מחלה | ||
|תמונה= | |תמונה= | ||
| שורה 7: | שורה 5: | ||
|שם לועזי=Aβ - Neuropathic pain - Aβ sensory neurons' role | |שם לועזי=Aβ - Neuropathic pain - Aβ sensory neurons' role | ||
|שמות נוספים= | |שמות נוספים= | ||
| − | |ICD-10= | + | |ICD-10= M79.2 |
| − | |ICD-9= | + | |ICD-9= {{ICD9|729.2}} |
|MeSH= | |MeSH= | ||
|יוצר הערך=פרופ‘ מיכאל טל{{ש}}[[קובץ:TopLogoR.jpg|80px]] | |יוצר הערך=פרופ‘ מיכאל טל{{ש}}[[קובץ:TopLogoR.jpg|80px]] | ||
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| + | {{הרחבה|כאב נוירופתי}} | ||
| + | במצב פיזיולוגי תקין, תחושת ה[[כאב]] מקורה בדחפים עצביים (Nerve impulses) המתפתחים באקסונים שבקצה העצב התחושתי. אקסונים אלו מעצבבים את העור, את השרירים, את האיברים הפנימיים ואת שאר האיברים בפריפריה ושולחים דחפים המועברים למערכת העצבים המרכזית (Central Nerve System,{{כ}} CNS) בחוט השדרה ומשם לקליפת המוח (Cerebral Cortex) עד להכרה של תחושת כאב. בעוד שתחושת הכאב דורשת הימצאות במצב של הכרה, ישנן תגובות אוטונומיות-אוטומטיות לגירויים מכאיבים, כגון תנועת רתיעה ריפלקסורית, ו[[יתר לחץ דם מערכתי|עלייה בלחץ הדם]] וב[[עלייה בקצב הלב|קצב הלב]]. תגובות אינסטינקטיביות אלו אינן קשורות להכרה ולתחושת כאב, והן מופיעות לפני תחושת הכאב או שהן קיימות גם ללא תחושת כאב כלל. את המונח נוסיספציה (Nociception) טבע Sherrington בתחילת המאה העשרים, ובכך יצר הפרדה בין תחושת כאב שדורשת הימצאות בהכרה לבין תגובת נוסיספציה שאינה בהכרח מלווה בתחושת כאב. | ||
| + | |||
| + | סיבי העצב התחושתיים מאופיינים ומסווגים בהתאם לגירויים שאליהם הם מגיבים. בחלוקה המסורתית, סיבים המגיבים למגע הם בעלי סף גירוי נמוך [Low threshold (touch) afferent], עטופים ב[[מיאלין]] ובעלי מהירות הולכה גבוהה. לעומתם, הסיבים הנוסיספטורים שמקודדים ומעבירים תחושות כאב הם סיבים דקים מטיפוס C שאינם עטופים במיאלין, וסיבי Aδ העטופים בשכבה דקה של מיאלין ובעלי מהירות הולכה איטית באופן יחסי. החלוקה המסורתית לשני ערוצים תחושתיים מקבילים - האחד, של הולכת כאב בסיבים מטיפוס C ו-Aδ והשני, של תחושת מגע בסיבי Aβ – קרויה בשם Labeled line theory. נשאלת השאלה, האם ייתכן כי סיבי Aβ שאין להם באופן נורמלי את האלמנטים המקודדים נוסיספציה, בדומה לסיבי C, יכולים להשתנות בעקבות נזק עצבי או [[דלקת עצבית|דלקת]] ולהוות מקור ל[[כאב נוירופתי]]. | ||
| + | |||
| + | קיימים היום מספר טיעונים המחזקים את ההשערה כי סיבי Aβ המעבירים בדרך כלל תחושות מגע וויברציה משנים את אופיים לאחר נזק ו/או דלקת, ויכולים, בדומה לנוסיספטור, לגרום לתחושת כאב. | ||
| − | + | ==תופעת הירי האקטופי כמנגנון להסברת הכאב הנוירופתי== | |
| − | + | מוסכם על הכל כי ירי דחפים של פוטנציאלי פעולה המתפתחים במקום הנזק בעצב הפריפרי ובגוף תאי העצב הראשוניים בגנגליון הגבי (Dorsal root ganglion,{{כ}} DRG), הוא מקור ישיר לכאב או מקור הפועל בדרך עקיפה במנגנון של “ריגוש מרכזי“. ירי אקטופי זה, שמתפתח במקום לא טבעי לאחר נזק, מקובל כמנגנון עיקרי להסברת הכאב הנוירופתי, גם בקרב הרואים במנגנון הפריפרי כגורם עיקרי לכאב הנוירופתי, וגם בקרב הרואים בריגוש המרכזי כגורם עיקרי להתפתחותו. | |
| − | + | אולם, בהשערה כי ירי אקטופי זה עומד בבסיס המנגנון המסביר את הכאב הנוירופתי טמונה בעיה הנובעת מאופיו של הירי: הירי האקטופי המתפתח לאחר נזק מתפתח בעיקר בסיבי Aβ, ורק מאוחר יותר (ימים או שבועות) מתפתח גם ירי בסיבי C, ואילו הכאב המכני למגע קל מתפתח סימולטנית עם הופעת הירי האקטופי בסיבי Aβ. מתעוררת כאן שאלה - שהרי אם הירי האקטופי מתפתח ראשית בסיבי Aβ והוא הגורם לתחושת הכאב, כיצד ניתן להניח שהכאב מקורו בסיבי C? | |
| − | + | המתמודדים עם הבעיה נותנים שתי תשובות המסבירות את חוסר ההתאמה בין התפתחות ירי נרחב בסיבי Aβ לאחר נזק, לבין ההנחה המקובלת שסיבי C הם המקור לכאב: | |
| + | #בעת נזק עצבי מתפתח ירי בסיבי C, וגם אם הוא מועט, הוא זה הגורם לכאב. תשובה זו מתעלמת מהעובדה שהתפתח ירי משמעותי בסיבי Aβ | ||
| + | #בעת נזק עצבי מתפתח ירי באקסונים שאינם פגועים הנמצאים סמוך לעצב הניזוק, והם האחראים לכאב הנוירופתי. אקסונים אלו הם סיבי C | ||
| − | + | ==תפקידם של סיבי Aβ בכאב הנוירופתי== | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | ==כאב | + | ===כאב ממקור Aβ=== |
| − | כאב דינמי למגע | + | [[כאב דינמי למגע]] (Dynamic tactile allodynia) הוא תגובה מכאיבה מאוד להברשה או למגע קל של בד על העור, המתרחשת לאחר כווייה משיזוף יתר או משפשוף רציני עד כדי פציעה. רגישות מכנית למגע מסוג זה מאופיינת בתגובה מהירה מאוד לגירוי, שאינה מאפיינת את ההולכה האיטית של סיבי C. נוסף על כך, לא נמצאה עדות ניסויית לכך שסיבי C עוברים ריגוש למגע בעקבות נזק לעור. יש אמנם עדויות כי לאחר נזק בסיבי C מתפתח בהם ריגוש לגירויי חום, אולם אין עדות לרגישות מכנית למגע. כמו כן, בניסויים בהם בוצעה חסימה סלקטיבית של סיבי Aβ, היא הפסיקה את הרגישות המכנית למגע אף על פי שפעולתם של סיבי C לא נפגמה. עדויות אלו מצביעות על צורך במציאת גורם אחר, שאינו סיבי C, שיהווה מקור לכאב הנוירופתי למגע קל. כאב מסוג זה מכונה כאב ממקור Aβ. |
| − | ==מנגנון הפעולה של סיבי Aβ בכאב נוירופתי== | + | ===מנגנון הפעולה של סיבי Aβ בכאב נוירופתי=== |
שני מנגנונים עיקריים מוצעים להסברת תופעת הכאב במגע קל, במצבים של כאב נוירופתי: | שני מנגנונים עיקריים מוצעים להסברת תופעת הכאב במגע קל, במצבים של כאב נוירופתי: | ||
| − | # | + | # מנגנון המבוסס על אירועים בפריפריה, ומתואר בשינוי פנוטיפי-גנומי שעוברים תאי החישה הראשוניים בגנגליון הגבי. המנגנון מציע שבעקבות הנזק העצבי תאי חישה אלו משנים את תכונותיהם והופכים לתאי כאב - נוסיספטורים |
| − | # | + | # מנגנון המבוסס על שינויים במערכת העצבים המרכזית ומציע שמתפתחת בה עוררות יתר והגברה עצבית בעקבות הנזק, תופעה שנקראת ריגוש מרכזי, שכתוצאה ממנה כל גירוי קל המתאים להפעלת סיבי Aβ מתפרש ככאב |
| − | הירי האקטופי באזור הנוירומה ובתאי | + | הירי האקטופי באזור הנוירומה ובתאי החישה הראשוניים בגנגליון הגבי משפעל את שני המנגנונים המתפתחים לאחר הנזק - גם את הפריפרי וגם את המרכזי. כמו כן, נמצא שעיכוב הירי האקטופי מביא להקלה בהתנהגות הכאב. דרוש אפוא הסבר כיצד ירי מסוג זה גורם לשינוי פנוטיפי של תאי החישה ולריגוש מרכזי, ובעקבות כך לכאב. |
| − | + | [[קובץ:כאבנוירופתי.JPG|שמאל]] | |
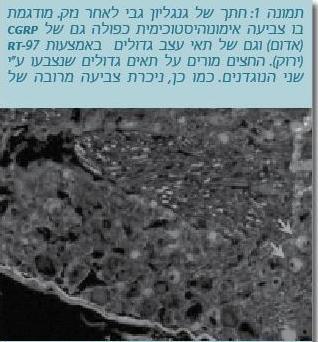
| − | נמצא כי תאי Aβ מייצרים | + | מניסויים שנערכו במודלים של נזק עצבי, נמצא כי התאים הגדולים בגנגליון הגבי מתחילים לייצר [[Substance P]] שהוא מוליך עצבי (Neurotransmitter) מתווך כאב המיוצר בדרך כלל על ידי התאים הקטנים של סיבי C שמעבירים כאב (Weissner et al. 2006). בניסויים שנערכו (תמונה 1), נמצא כי לאחר נזק עצבי, תאי Aβ מייצרים את המוליך העצבי [[Calcitonin Gene-Related Peptide]]{{כ}} (CGRP) שגם הוא לא אופייני לתא עצב שאינו תא כאב. שינויים פנוטיפיים מסוג זה, המגבירים יצירת מודולטורים של כאב בתאי Aβ, מועברים לקרן האחורית בחוט השדרה, ויכולים להפעיל ישירות את המעגל העצבי של סיבי כאב שם, כך שמגע קל יגרום לכאב. |
| − | + | כמו כן, ישנן עדויות המצביעות על התפתחות ריגוש מרכזי בחוט השדרה. נמצא שמתן של גירויים המתאימים לגירויי מגע ומפעילים תאי Aβ בחיות עם נזק עצבי גרמו לביטוי של [[C-Fos]] ו-[[Phospho-ERK]] בחוט השדרה. ביטויים אלו הם סימנים של ריגוש מרכזי, שבעקבותיו גם מגע קל גורם לכאב. הריגוש המרכזי אינו עומד בפני עצמו. הירי הפריפרי מהווה טריגר ראשוני לתהליך הריגוש והכרחי גם לשימורו. אם ייחסם מקור הירי על ידי אלחוש לדוגמה, הכאב ייעלם. | |
| − | לסיכום, סיבי Aβ | + | לסיכום, סיבי Aβ, שבאופן פיזיולוגי אחראיים על העברת תחושת מגע, מפתחים ירי אקטופי ספונטני בעקבות נזק עצבי, דבר הגורם לשינויים פנוטיפיים בתאי העצב התחושתיים בגנגליון הגבי. השינויים הפנוטיפיים באים לידי ביטוי ביצירה של מוליכים עצביים מתווכי כאב, שמועברים לחוט השדרה ופועלים שם ישירות. נוסף על כך, הירי האקטופי תורם להגברה העצבית בחוט השדרה ושומר את העוררות העצבית ברמה גבוהה כך שכל גירוי של מגע קל מתפרש ככאב. |
==ביבליוגרפיה== | ==ביבליוגרפיה== | ||
| − | |||
<blockquote> | <blockquote> | ||
<div style="text-align: left; direction: ltr"> | <div style="text-align: left; direction: ltr"> | ||
| שורה 68: | שורה 69: | ||
{{ייחוס|פרופ' מיכאל טל|תודות לפרופ' מרשל דבור ולתלמידת הדוקטור עדי ניצן-לוקס על תרומתם ועזרתם בדיונים ובניסויים בנושא; תודה לאורי טל על העזרה בעריכה לשונית}} | {{ייחוס|פרופ' מיכאל טל|תודות לפרופ' מרשל דבור ולתלמידת הדוקטור עדי ניצן-לוקס על תרומתם ועזרתם בדיונים ובניסויים בנושא; תודה לאורי טל על העזרה בעריכה לשונית}} | ||
| + | |||
| + | |||
<center>'''פורסם בכתב העת Israeli Journal of Pediatrics, אפריל 2009, גיליון מס' 20, מדיקל מדיה'''</center> | <center>'''פורסם בכתב העת Israeli Journal of Pediatrics, אפריל 2009, גיליון מס' 20, מדיקל מדיה'''</center> | ||
[[קטגוריה:כאב]] | [[קטגוריה:כאב]] | ||
[[קטגוריה:נוירולוגיה]] | [[קטגוריה:נוירולוגיה]] | ||
| − | [[קטגוריה:מדיקל מדיה | + | [[קטגוריה:מדיקל מדיה]] |
| + | [[קטגוריה:שיקום]] | ||
גרסה אחרונה מ־08:40, 15 בינואר 2019
| כאב נוירופתי - תפקידם של סיבי עצב מטיפוס Aβ | ||
|---|---|---|
| Aβ - Neuropathic pain - Aβ sensory neurons' role | ||
| ICD-10 | M79.2 | |
| ICD-9 | 729.2 | |
| יוצר הערך | פרופ‘ מיכאל טל
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – כאב נוירופתי
במצב פיזיולוגי תקין, תחושת הכאב מקורה בדחפים עצביים (Nerve impulses) המתפתחים באקסונים שבקצה העצב התחושתי. אקסונים אלו מעצבבים את העור, את השרירים, את האיברים הפנימיים ואת שאר האיברים בפריפריה ושולחים דחפים המועברים למערכת העצבים המרכזית (Central Nerve System, CNS) בחוט השדרה ומשם לקליפת המוח (Cerebral Cortex) עד להכרה של תחושת כאב. בעוד שתחושת הכאב דורשת הימצאות במצב של הכרה, ישנן תגובות אוטונומיות-אוטומטיות לגירויים מכאיבים, כגון תנועת רתיעה ריפלקסורית, ועלייה בלחץ הדם ובקצב הלב. תגובות אינסטינקטיביות אלו אינן קשורות להכרה ולתחושת כאב, והן מופיעות לפני תחושת הכאב או שהן קיימות גם ללא תחושת כאב כלל. את המונח נוסיספציה (Nociception) טבע Sherrington בתחילת המאה העשרים, ובכך יצר הפרדה בין תחושת כאב שדורשת הימצאות בהכרה לבין תגובת נוסיספציה שאינה בהכרח מלווה בתחושת כאב.
סיבי העצב התחושתיים מאופיינים ומסווגים בהתאם לגירויים שאליהם הם מגיבים. בחלוקה המסורתית, סיבים המגיבים למגע הם בעלי סף גירוי נמוך [Low threshold (touch) afferent], עטופים במיאלין ובעלי מהירות הולכה גבוהה. לעומתם, הסיבים הנוסיספטורים שמקודדים ומעבירים תחושות כאב הם סיבים דקים מטיפוס C שאינם עטופים במיאלין, וסיבי Aδ העטופים בשכבה דקה של מיאלין ובעלי מהירות הולכה איטית באופן יחסי. החלוקה המסורתית לשני ערוצים תחושתיים מקבילים - האחד, של הולכת כאב בסיבים מטיפוס C ו-Aδ והשני, של תחושת מגע בסיבי Aβ – קרויה בשם Labeled line theory. נשאלת השאלה, האם ייתכן כי סיבי Aβ שאין להם באופן נורמלי את האלמנטים המקודדים נוסיספציה, בדומה לסיבי C, יכולים להשתנות בעקבות נזק עצבי או דלקת ולהוות מקור לכאב נוירופתי.
קיימים היום מספר טיעונים המחזקים את ההשערה כי סיבי Aβ המעבירים בדרך כלל תחושות מגע וויברציה משנים את אופיים לאחר נזק ו/או דלקת, ויכולים, בדומה לנוסיספטור, לגרום לתחושת כאב.
תופעת הירי האקטופי כמנגנון להסברת הכאב הנוירופתי
מוסכם על הכל כי ירי דחפים של פוטנציאלי פעולה המתפתחים במקום הנזק בעצב הפריפרי ובגוף תאי העצב הראשוניים בגנגליון הגבי (Dorsal root ganglion, DRG), הוא מקור ישיר לכאב או מקור הפועל בדרך עקיפה במנגנון של “ריגוש מרכזי“. ירי אקטופי זה, שמתפתח במקום לא טבעי לאחר נזק, מקובל כמנגנון עיקרי להסברת הכאב הנוירופתי, גם בקרב הרואים במנגנון הפריפרי כגורם עיקרי לכאב הנוירופתי, וגם בקרב הרואים בריגוש המרכזי כגורם עיקרי להתפתחותו.
אולם, בהשערה כי ירי אקטופי זה עומד בבסיס המנגנון המסביר את הכאב הנוירופתי טמונה בעיה הנובעת מאופיו של הירי: הירי האקטופי המתפתח לאחר נזק מתפתח בעיקר בסיבי Aβ, ורק מאוחר יותר (ימים או שבועות) מתפתח גם ירי בסיבי C, ואילו הכאב המכני למגע קל מתפתח סימולטנית עם הופעת הירי האקטופי בסיבי Aβ. מתעוררת כאן שאלה - שהרי אם הירי האקטופי מתפתח ראשית בסיבי Aβ והוא הגורם לתחושת הכאב, כיצד ניתן להניח שהכאב מקורו בסיבי C?
המתמודדים עם הבעיה נותנים שתי תשובות המסבירות את חוסר ההתאמה בין התפתחות ירי נרחב בסיבי Aβ לאחר נזק, לבין ההנחה המקובלת שסיבי C הם המקור לכאב:
- בעת נזק עצבי מתפתח ירי בסיבי C, וגם אם הוא מועט, הוא זה הגורם לכאב. תשובה זו מתעלמת מהעובדה שהתפתח ירי משמעותי בסיבי Aβ
- בעת נזק עצבי מתפתח ירי באקסונים שאינם פגועים הנמצאים סמוך לעצב הניזוק, והם האחראים לכאב הנוירופתי. אקסונים אלו הם סיבי C
תפקידם של סיבי Aβ בכאב הנוירופתי
כאב ממקור Aβ
כאב דינמי למגע (Dynamic tactile allodynia) הוא תגובה מכאיבה מאוד להברשה או למגע קל של בד על העור, המתרחשת לאחר כווייה משיזוף יתר או משפשוף רציני עד כדי פציעה. רגישות מכנית למגע מסוג זה מאופיינת בתגובה מהירה מאוד לגירוי, שאינה מאפיינת את ההולכה האיטית של סיבי C. נוסף על כך, לא נמצאה עדות ניסויית לכך שסיבי C עוברים ריגוש למגע בעקבות נזק לעור. יש אמנם עדויות כי לאחר נזק בסיבי C מתפתח בהם ריגוש לגירויי חום, אולם אין עדות לרגישות מכנית למגע. כמו כן, בניסויים בהם בוצעה חסימה סלקטיבית של סיבי Aβ, היא הפסיקה את הרגישות המכנית למגע אף על פי שפעולתם של סיבי C לא נפגמה. עדויות אלו מצביעות על צורך במציאת גורם אחר, שאינו סיבי C, שיהווה מקור לכאב הנוירופתי למגע קל. כאב מסוג זה מכונה כאב ממקור Aβ.
מנגנון הפעולה של סיבי Aβ בכאב נוירופתי
שני מנגנונים עיקריים מוצעים להסברת תופעת הכאב במגע קל, במצבים של כאב נוירופתי:
- מנגנון המבוסס על אירועים בפריפריה, ומתואר בשינוי פנוטיפי-גנומי שעוברים תאי החישה הראשוניים בגנגליון הגבי. המנגנון מציע שבעקבות הנזק העצבי תאי חישה אלו משנים את תכונותיהם והופכים לתאי כאב - נוסיספטורים
- מנגנון המבוסס על שינויים במערכת העצבים המרכזית ומציע שמתפתחת בה עוררות יתר והגברה עצבית בעקבות הנזק, תופעה שנקראת ריגוש מרכזי, שכתוצאה ממנה כל גירוי קל המתאים להפעלת סיבי Aβ מתפרש ככאב
הירי האקטופי באזור הנוירומה ובתאי החישה הראשוניים בגנגליון הגבי משפעל את שני המנגנונים המתפתחים לאחר הנזק - גם את הפריפרי וגם את המרכזי. כמו כן, נמצא שעיכוב הירי האקטופי מביא להקלה בהתנהגות הכאב. דרוש אפוא הסבר כיצד ירי מסוג זה גורם לשינוי פנוטיפי של תאי החישה ולריגוש מרכזי, ובעקבות כך לכאב.
מניסויים שנערכו במודלים של נזק עצבי, נמצא כי התאים הגדולים בגנגליון הגבי מתחילים לייצר Substance P שהוא מוליך עצבי (Neurotransmitter) מתווך כאב המיוצר בדרך כלל על ידי התאים הקטנים של סיבי C שמעבירים כאב (Weissner et al. 2006). בניסויים שנערכו (תמונה 1), נמצא כי לאחר נזק עצבי, תאי Aβ מייצרים את המוליך העצבי Calcitonin Gene-Related Peptide (CGRP) שגם הוא לא אופייני לתא עצב שאינו תא כאב. שינויים פנוטיפיים מסוג זה, המגבירים יצירת מודולטורים של כאב בתאי Aβ, מועברים לקרן האחורית בחוט השדרה, ויכולים להפעיל ישירות את המעגל העצבי של סיבי כאב שם, כך שמגע קל יגרום לכאב.
כמו כן, ישנן עדויות המצביעות על התפתחות ריגוש מרכזי בחוט השדרה. נמצא שמתן של גירויים המתאימים לגירויי מגע ומפעילים תאי Aβ בחיות עם נזק עצבי גרמו לביטוי של C-Fos ו-Phospho-ERK בחוט השדרה. ביטויים אלו הם סימנים של ריגוש מרכזי, שבעקבותיו גם מגע קל גורם לכאב. הריגוש המרכזי אינו עומד בפני עצמו. הירי הפריפרי מהווה טריגר ראשוני לתהליך הריגוש והכרחי גם לשימורו. אם ייחסם מקור הירי על ידי אלחוש לדוגמה, הכאב ייעלם.
לסיכום, סיבי Aβ, שבאופן פיזיולוגי אחראיים על העברת תחושת מגע, מפתחים ירי אקטופי ספונטני בעקבות נזק עצבי, דבר הגורם לשינויים פנוטיפיים בתאי העצב התחושתיים בגנגליון הגבי. השינויים הפנוטיפיים באים לידי ביטוי ביצירה של מוליכים עצביים מתווכי כאב, שמועברים לחוט השדרה ופועלים שם ישירות. נוסף על כך, הירי האקטופי תורם להגברה העצבית בחוט השדרה ושומר את העוררות העצבית ברמה גבוהה כך שכל גירוי של מגע קל מתפרש ככאב.
ביבליוגרפיה
- Devor M. Response of nerves to injury in relation to neuropathic pain. In: McMahon SL, Koltzenburg M (eds). Wall and Melzack‘s textbook of pain, 5th ed. Churchill Livingstone, London 2006;905-927
- Devor M. Ectopic discharge in Abeta afferents as a source of neuropathic pain. Exp Brain Res 2009;196:115-128
- Tal M, Kim J, Back SK, et al. Onset of ectopic Wring in the Chung model of neuropathic pain coincides with the onset of tactile allodynia. In: Flor H, Kalso E, Dostrovsky JO (eds). Proceedings of the 11th world congress on pain, IASP Press, Seattle 2006;119–130
- Sherrington CS. The integrative action of the nervous system. Constable, London 1906
- Weissner W, Winterson BJ, Stuart-Tilley A, et al. Time course of substance P expression in dorsal root ganglia following complete spinal nerve transection. J Comp Neurol 2006;497:78–87
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופ' מיכאל טלותודות לפרופ' מרשל דבור ולתלמידת הדוקטור עדי ניצן-לוקס על תרומתם ועזרתם בדיונים ובניסויים בנושא; תודה לאורי טל על העזרה בעריכה לשונית


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק