הבדלים בין גרסאות בדף "כאב נוירופתי - תפקידם של סיבי עצב מטיפוס Aβ בכאב - Neuropathic pain - Aβ sensory neurons' role"
| שורה 13: | שורה 13: | ||
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| − | + | {{הרחבה|כאב נוירופתי}} | |
| − | במצב נורמלי, מקורה של תחושת | + | במצב נורמלי, מקורה של תחושת ה[[כאב]] היא באימפולסים עצביים המתפתחים באקסונים שבקצה העצב התחושתי. אקסונים אלו מעצבבים את העור, השרירים, איברים פנימיים ושאר איברים בפריפריה. האימפולסים מועברים למערכת העצבים המרכזית בחוט השדרה ומשם לקורטקס עד להכרה של תחושת כאב. נוסף על תחושת הכאב הדורשת הימצאות במצב של הכרה, יש תגובות אוטונומיות-אוטומטיות לגירויים מכאיבים, כמו תנועת רתיעה רפלקסורית, ועלייה בלחץ דם ובקצב הלב. תגובות אינסטינקטיביות אלו אינן קשורות להכרה ולתחושת כאב, והן מופיעות לפני תחושת הכאב או שהן קיימות גם ללא תחושת כאב כלל. את המונח “נוסיספציה“ טבע Sherrington בתחילת המאה הקודמת, ובכך יצר הפרדה בין תחושת כאב שדורשת הימצאות בהכרה לבין תגובת נוסיספציה שאינה בהכרח מלווה בתחושת כאב. |
סיבי העצב התחושתיים מאופיינים ומסווגים בהתאם לגירויים שאליהם הם מגיבים. בחלוקה הקלסית סיבים המגיבים למגע הם בעלי סף נמוך - Low Threshold (Touch) Afferent - עטופים מיאלין ובעלי מהירות הולכה גבוהה. לעומת זאת, הנוסיספטורים המקודדים והמעבירים תחושות כאב הם סיבים דקים ללא עטיפת מיאלין מטיפוס C, וסיבי Aδ העטופים בשכבה דקה של מיאלין ובעלי מהירות הולכה איטית יחסית. החלוקה הקלסית לשני ערוצים תחושתיים מקבילים - האחד, של הולכת כאב בסיבים מטיפוס C ו-Aδ והשני, של תחושת מגע בסיבי Aβ – קרויה בשם Labeled Line Theory. נשאלת השאלה: האם ייתכן כי סיבי Aβ שאין להם באופן נורמלי את האלמנטים המקודדים נוסיספציה, בדומה לסיבי C, יכולים להשתנות בעקבות נזק עצבי או דלקת ולהוות מקור לכאב נוירופתי? | סיבי העצב התחושתיים מאופיינים ומסווגים בהתאם לגירויים שאליהם הם מגיבים. בחלוקה הקלסית סיבים המגיבים למגע הם בעלי סף נמוך - Low Threshold (Touch) Afferent - עטופים מיאלין ובעלי מהירות הולכה גבוהה. לעומת זאת, הנוסיספטורים המקודדים והמעבירים תחושות כאב הם סיבים דקים ללא עטיפת מיאלין מטיפוס C, וסיבי Aδ העטופים בשכבה דקה של מיאלין ובעלי מהירות הולכה איטית יחסית. החלוקה הקלסית לשני ערוצים תחושתיים מקבילים - האחד, של הולכת כאב בסיבים מטיפוס C ו-Aδ והשני, של תחושת מגע בסיבי Aβ – קרויה בשם Labeled Line Theory. נשאלת השאלה: האם ייתכן כי סיבי Aβ שאין להם באופן נורמלי את האלמנטים המקודדים נוסיספציה, בדומה לסיבי C, יכולים להשתנות בעקבות נזק עצבי או דלקת ולהוות מקור לכאב נוירופתי? | ||
| שורה 22: | שורה 22: | ||
==ירי אקטופי== | ==ירי אקטופי== | ||
| − | מוסכם על הכל כי ירי של אימפולסים של פוטנציאלי פעולה המתפתחים במקום הנזק בעצב הפריפרי ובגוף תאי העצב הראשוניים בגנגליון הגבי (DRG), הם מקור ישיר לכאב או מקור הפועל בדרך עקיפה במנגנון של “ריגוש מרכזי“. ירי אקטופי זה שמתפתח במקום לא טבעי ולא נורמלי לאחר נזק, מקובל הן על הרואים במנגנון הפריפרי גורם עיקרי לכאב הנוירופתי, והן על הרואים ב“ריגוש המרכזי“ מנגנון עיקרי לכאב מסוג זה. אולם, בירי האקטופי כמנגנון למקור הכאב טמונה בעיה הנובעת מאופיו של הירי. הירי האקטופי המתפתח לאחר נזק, מתפתח בעיקר בסיבי Aβ ורק מאוחר יותר (ימים או שבועות) מתפתח ירי גם | + | מוסכם על הכל כי ירי של אימפולסים של פוטנציאלי פעולה המתפתחים במקום הנזק בעצב הפריפרי ובגוף תאי העצב הראשוניים בגנגליון הגבי (DRG), הם מקור ישיר לכאב או מקור הפועל בדרך עקיפה במנגנון של “ריגוש מרכזי“. ירי אקטופי זה שמתפתח במקום לא טבעי ולא נורמלי לאחר נזק, מקובל הן על הרואים במנגנון הפריפרי גורם עיקרי לכאב הנוירופתי, והן על הרואים ב“ריגוש המרכזי“ מנגנון עיקרי לכאב מסוג זה. אולם, בירי האקטופי כמנגנון למקור הכאב טמונה בעיה הנובעת מאופיו של הירי. הירי האקטופי המתפתח לאחר נזק, מתפתח בעיקר בסיבי Aβ ורק מאוחר יותר (ימים או שבועות) מתפתח ירי גם בסיבי C. הכאב המכני למגע קל מתפתח סימולטנית עם הופעת הירי האקטופי בסיבי Aβ. מתעוררת כאן שאלה - אם הירי האקטופי מתפתח ראשית בסיבי Aβ והוא הגורם לתחושת הכאב, הרי זה נוגד את הדוגמה שלפיה הכאב מקורו בסיבי C. |
| − | בסיבי C. הכאב המכני למגע קל מתפתח סימולטנית עם הופעת הירי האקטופי בסיבי Aβ. מתעוררת כאן שאלה - אם הירי האקטופי מתפתח ראשית בסיבי Aβ והוא הגורם לתחושת הכאב, הרי זה נוגד את הדוגמה שלפיה הכאב מקורו בסיבי C. | + | |
המתמודדים עם הבעיה נותנים שתי תשובות המסבירות את אי ההתאמה בין התפתחות של הירי הרב בסיבי Aβ לאחר נזק לבין המקובל שסיבי C הם המקור לכאב. | המתמודדים עם הבעיה נותנים שתי תשובות המסבירות את אי ההתאמה בין התפתחות של הירי הרב בסיבי Aβ לאחר נזק לבין המקובל שסיבי C הם המקור לכאב. | ||
| − | + | ||
| − | + | #מתפתח ירי בסיבי C, וגם אם הוא מועט, הוא זה הגורם לכאב. תשובה זו מתעלמת מהעובדה שהתפתח ירי משמעותי בסיבי Aβ. | |
| + | #מתפתח ירי באקסונים שאינם פגועים הנמצאים סמוך לעצב הניזוק, והם האחראים לכאב הנוירופתי. אקסונים אלה הם סיבי C. | ||
==כאב מסוג Aβ== | ==כאב מסוג Aβ== | ||
גרסה מ־08:30, 9 בנובמבר 2013
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| כאב נוירופתי - תפקידם של סיבי עצב מטיפוס Aβ | ||
|---|---|---|
| Aβ - Neuropathic pain - Aβ sensory neurons' role | ||
| יוצר הערך | פרופ‘ מיכאל טל
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – כאב נוירופתי
במצב נורמלי, מקורה של תחושת הכאב היא באימפולסים עצביים המתפתחים באקסונים שבקצה העצב התחושתי. אקסונים אלו מעצבבים את העור, השרירים, איברים פנימיים ושאר איברים בפריפריה. האימפולסים מועברים למערכת העצבים המרכזית בחוט השדרה ומשם לקורטקס עד להכרה של תחושת כאב. נוסף על תחושת הכאב הדורשת הימצאות במצב של הכרה, יש תגובות אוטונומיות-אוטומטיות לגירויים מכאיבים, כמו תנועת רתיעה רפלקסורית, ועלייה בלחץ דם ובקצב הלב. תגובות אינסטינקטיביות אלו אינן קשורות להכרה ולתחושת כאב, והן מופיעות לפני תחושת הכאב או שהן קיימות גם ללא תחושת כאב כלל. את המונח “נוסיספציה“ טבע Sherrington בתחילת המאה הקודמת, ובכך יצר הפרדה בין תחושת כאב שדורשת הימצאות בהכרה לבין תגובת נוסיספציה שאינה בהכרח מלווה בתחושת כאב.
סיבי העצב התחושתיים מאופיינים ומסווגים בהתאם לגירויים שאליהם הם מגיבים. בחלוקה הקלסית סיבים המגיבים למגע הם בעלי סף נמוך - Low Threshold (Touch) Afferent - עטופים מיאלין ובעלי מהירות הולכה גבוהה. לעומת זאת, הנוסיספטורים המקודדים והמעבירים תחושות כאב הם סיבים דקים ללא עטיפת מיאלין מטיפוס C, וסיבי Aδ העטופים בשכבה דקה של מיאלין ובעלי מהירות הולכה איטית יחסית. החלוקה הקלסית לשני ערוצים תחושתיים מקבילים - האחד, של הולכת כאב בסיבים מטיפוס C ו-Aδ והשני, של תחושת מגע בסיבי Aβ – קרויה בשם Labeled Line Theory. נשאלת השאלה: האם ייתכן כי סיבי Aβ שאין להם באופן נורמלי את האלמנטים המקודדים נוסיספציה, בדומה לסיבי C, יכולים להשתנות בעקבות נזק עצבי או דלקת ולהוות מקור לכאב נוירופתי?
בסקירה זו אביא טיעונים לאישוש ההשערה כי סיבי Aβ המעבירים בדרך כלל תחושות מגע וויברציה משנים את אופיים לאחר נזק ו/או דלקת, ובדומה לנוסיספטור יכולים לגרום לתחושת כאב.
ירי אקטופי
מוסכם על הכל כי ירי של אימפולסים של פוטנציאלי פעולה המתפתחים במקום הנזק בעצב הפריפרי ובגוף תאי העצב הראשוניים בגנגליון הגבי (DRG), הם מקור ישיר לכאב או מקור הפועל בדרך עקיפה במנגנון של “ריגוש מרכזי“. ירי אקטופי זה שמתפתח במקום לא טבעי ולא נורמלי לאחר נזק, מקובל הן על הרואים במנגנון הפריפרי גורם עיקרי לכאב הנוירופתי, והן על הרואים ב“ריגוש המרכזי“ מנגנון עיקרי לכאב מסוג זה. אולם, בירי האקטופי כמנגנון למקור הכאב טמונה בעיה הנובעת מאופיו של הירי. הירי האקטופי המתפתח לאחר נזק, מתפתח בעיקר בסיבי Aβ ורק מאוחר יותר (ימים או שבועות) מתפתח ירי גם בסיבי C. הכאב המכני למגע קל מתפתח סימולטנית עם הופעת הירי האקטופי בסיבי Aβ. מתעוררת כאן שאלה - אם הירי האקטופי מתפתח ראשית בסיבי Aβ והוא הגורם לתחושת הכאב, הרי זה נוגד את הדוגמה שלפיה הכאב מקורו בסיבי C.
המתמודדים עם הבעיה נותנים שתי תשובות המסבירות את אי ההתאמה בין התפתחות של הירי הרב בסיבי Aβ לאחר נזק לבין המקובל שסיבי C הם המקור לכאב.
- מתפתח ירי בסיבי C, וגם אם הוא מועט, הוא זה הגורם לכאב. תשובה זו מתעלמת מהעובדה שהתפתח ירי משמעותי בסיבי Aβ.
- מתפתח ירי באקסונים שאינם פגועים הנמצאים סמוך לעצב הניזוק, והם האחראים לכאב הנוירופתי. אקסונים אלה הם סיבי C.
כאב מסוג Aβ
כאב דינמי למגע - Dynamic Tactile Allodynia - הוא תגובה מכאיבה מאוד להברשה או למגע קל של בד על העור, לאחר כווייה משיזוף יתר או משפשוף רציני עד כדי פציעה. רגישות מכנית למגע מסוג זה מאופיינת בתגובה מהירה מאוד לגירוי שאינה מתאימה להולכה האיטית של סיבי C. נוסף על כך, בעקבות נזק לעור לא נמצאה עדות ניסוית לכך שסיבי C עברו ריגוש למגע. יש אומנם עדויות כי מתפתח בסיבי C ריגוש לגירויי חום לאחר נזק בהם, אולם אין עדות לרגישות מכנית למגע שמתפתחת בסיבי C. כמו כן, בניסויים שבהם בוצעה חסימה סלקטיבית של סיבי Aβ, הפסיקה החסימה את הרגישות המכנית למגע אף על פי שפעולתם של סיבי C לא נפגמה. עדויות אלו מצביעות על צורך לחפש גורם שאינו סיבי C היכול להיות מקור לכאב הנוירופתי למגע קל, ולכן מכנים כאב מסוג זה - כאב ממקור Aβ.
מנגנון הפעולה של סיבי Aβ בכאב נוירופתי
שני מנגנונים עיקריים מוצעים להסברת תופעת הכאב במגע קל, במצבים של כאב נוירופתי:
- המנגנון הראשון מבוסס על אירועים בפריפריה ומתואר בשינוי פנוטיפי-גנומי שעוברים תאי החוש הראשוניים בגנגליון הגבי (DRG), ואשר בעקבות הנזק העצבי הם משנים את תכונותיהם והופכים לתאי כאב - נוסיספטורים.
- המנגנון השני מבוסס על שינויים במערכת העצבים המרכזית שבהם מתפתחת עוררות יתר והגברה עצבית בעקבות הנזק, תופעה שנקראת "ריגוש מרכזי", וכתוצאה ממנה כל גירוי קל המתאים להפעלת סיבי Aβ מתפרש ככאב.
הירי האקטופי באזור הנוירומה ובתאי החוש הראשוניים בגנגליון משפעל את שני המנגנונים - הפריפרי והמרכזי - המתפתחים לאחר הנזק. כמו כן, עיכוב הירי האקטופי הביא להקלה בהתנהגות הכאב. אין כאן המקום להרחיב בנושא הירי האקטופי שהוא נושא ידוע ומוכר (Devor 2006), אולם יש להסביר כיצד ירי מסוג זה גורם לשינוי פנוטיפי של תאי החוש וגורם לריגוש מרכזי ובעקבות כך לכאב.
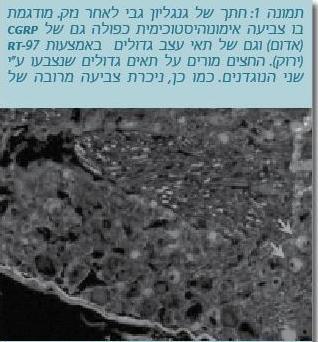
מניסויים שנערכו במודלים של נזק עצבי, נמצא כי התאים הגדולים בגנגליון הגבי מתחילים לייצר SP שהוא נוירוטרנסמיטור שמתווך כאב המיוצר בדרך כלל ע"י התאים הקטנים של סיבי C שמעבירים כאב (Weissner et al. 2006). מניסויים שערכנו (תמונה 1) נמצא כי תאי Aβ מייצרים לאחר נזק עצבי את הנוירוטרנסמיטור CGRP שגם הוא לא אופייני לתא עצב שאינו תא כאב. שינויים פנוטיפים מסוג זה המגבירים יצירת מודולטורים של כאב בתאי Aβ, מועברים לקרן הדורסלית בחוט השדרה, ויכולים להפעיל ישירות את המעגל העצבי של סיבי כאב שם, כך שמגע קל יגרום לכאב. כמו כן, יש עדויות המצביעות על התפתחות "ריגוש מרכזי" בחוט השדרה. לדוגמה, מתן של גירויים המתאימים לגירויי מגע המפעילים תאי Aβ בחיות עם נזק עצבי, גרמו לביטוי של C-Fos ו-Phospho-ERK בחוט השדרה. ביטויים אלו הם סימנים של "ריגוש מרכזי", שבעקבותיו גם מגע קל גורם לכאב.
ה"ריגוש המרכזי" אינו עומד בפני עצמו. הירי הפריפרי מהווה טריגר ראשוני לתהליך הריגוש, אבל הוא גם הכרחי לשימורו. אם ייחסם מקור הירי ע“י אלחוש לדוגמה, הכאב ייעלם.
לסיכום, סיבי Aβ שבמצב נורמלי מעבירים תחושת מגע, מפתחים ירי אקטופי ספונטני בעקבות נזק עצבי הגורם לשינויים פנוטיפיים בתאי העצב התחושתיים בגנגליון הגבי. השינויים הפנוטיפיים באים לידי ביטוי ביצירה של נוירוטרנסמיטורים המתווכים כאב שמועברים לחוט שדרה ופועלים שם ישירות. נוסף על כך, הירי האקטופי תורם להגברה העצבית בחוט השדרה ושומר את העוררות העצבית ברמה גבוהה כך שכל גירוי של מגע קל מתפרש ככאב.
ביבליוגרפיה
- Devor M. Response of nerves to injury in relation to neuropathic pain. In: McMahon SL, Koltzenburg M (eds). Wall and Melzack‘s textbook of pain, 5th ed. Churchill Livingstone, London 2006;905-927
- Devor M. Ectopic discharge in Abeta afferents as a source of neuropathic pain. Exp Brain Res 2009;196:115-128
- Tal M, Kim J, Back SK, et al. Onset of ectopic Wring in the Chung model of neuropathic pain coincides with the onset of tactile allodynia. In: Flor H, Kalso E, Dostrovsky JO (eds). Proceedings of the 11th world congress on pain, IASP Press, Seattle 2006;119–130
- Sherrington CS. The integrative action of the nervous system. Constable, London 1906
- Weissner W, Winterson BJ, Stuart-Tilley A, et al. Time course of substance P expression in dorsal root ganglia following complete spinal nerve transection. J Comp Neurol 2006;497:78–87
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופ' מיכאל טלותודות לפרופ' מרשל דבור ולתלמידת הדוקטור עדי ניצן-לוקס על תרומתם ועזרתם בדיונים ובניסויים בנושא; תודה לאורי טל על העזרה בעריכה לשונית


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק