הבדלים בין גרסאות בדף "לימפומה על שם הודג'קין - טיפול באדסטריס בחולים עם הישנות לאחר השתלת מח עצם - Hodgkin's lymphoma - Adcetris for treatment of patients with relapse after bone marrow transplant"
| שורה 37: | שורה 37: | ||
Brentuximab Vedotin הוא דוגמא לתרופה המשלבת נוגדן עם כימותרפיה. תפקידו של הנוגדן לשאת אה התרופה הכימותרפית אל תאי המטרה, במקרה שלנו לתאים הנושאים CD30, תאי ריד-סטרנברג. | Brentuximab Vedotin הוא דוגמא לתרופה המשלבת נוגדן עם כימותרפיה. תפקידו של הנוגדן לשאת אה התרופה הכימותרפית אל תאי המטרה, במקרה שלנו לתאים הנושאים CD30, תאי ריד-סטרנברג. | ||
| − | CD30 הוא חלבון טרנס ממברנלי ממשפחת TNF Receptors (קולטני Tumor Necrosis Factor). הוא מבוטא על תאי T ו-B משופעלים אך לא נייחים. ביטויו ברקמות בריאות הוא מינימלי ובתאי גידול ביטויו מוגבר, כך שהוא מהווה מטרה טובה לטיפול. הפעלת ה-CD30 באמצעות ליגנד מביאה לטרימריזציה שלו ויכולה להביא לתופעות שונות, בהן גם שגשוג ופרוליפרציה של תאים או אפופטוזיס (בתלות במולקולות הקוסטימולטריות). ניסיונות קודמים לשפעל את האנטיגן עם נוגדן בלבד (שאינו נושא כימותרפיה) הקרוי 30-SGN לא צלחו. | + | CD30 הוא חלבון טרנס ממברנלי ממשפחת TNF Receptors (קולטני Tumor Necrosis Factor). הוא מבוטא על תאי T ו-B משופעלים אך לא נייחים. ביטויו ברקמות בריאות הוא מינימלי ובתאי גידול ביטויו מוגבר, כך שהוא מהווה מטרה טובה לטיפול. הפעלת ה-CD30 באמצעות ליגנד (מקשר) מביאה לטרימריזציה שלו ויכולה להביא לתופעות שונות, בהן גם שגשוג ופרוליפרציה של תאים או אפופטוזיס (בתלות במולקולות הקוסטימולטריות). ניסיונות קודמים לשפעל את האנטיגן עם נוגדן בלבד (שאינו נושא כימותרפיה) הקרוי 30-SGN לא צלחו. |
התרופה SGN-35) BV) שפותחה כהמשך SGN-30-V מכילה 3 מרכיבים: | התרופה SGN-35) BV) שפותחה כהמשך SGN-30-V מכילה 3 מרכיבים: | ||
#נוגדן מסוג IGG1, חלקו אנושי וחלקו עכברי | #נוגדן מסוג IGG1, חלקו אנושי וחלקו עכברי | ||
| − | # | + | # MonoMethyl Auristatin E {{כ}}(MMAE) - מולקולה של אנטי-טובולין |
#מחבר (לינקר) - המקשר קוולנטית בין הנוגדן לבין 6 עד 8 מולקולות של MMAE, ונחתך על ידי פרוטאזה (איור 1). | #מחבר (לינקר) - המקשר קוולנטית בין הנוגדן לבין 6 עד 8 מולקולות של MMAE, ונחתך על ידי פרוטאזה (איור 1). | ||
גרסה מ־17:12, 28 במרץ 2016
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| ימפומה על שם הודג'קין - טיפול באדסטריס בחולים עם הישנות לאחר השתלת מח עצם | ||
|---|---|---|
| Hodgkin's lymphoma - Adcetris for treatment of patients with relapse after bone marrow transplant | ||
| יוצר הערך | ד"ר מירב קדמי | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – לימפומה
לימפומה מסוג הודג'קין (HL ,Hodgkin's lymphoma) היא מחלה נדירה המהווה כ-15% מכלל מקרי הלימפומה.
התא האופייני למחלה הוא תא ריד-סטרנברג (Reed-Sternberg). מדובר בגידול של לימפוציטים מסוג B, המבטאים לרוב אנטיגן (antigen) בשם CD30 על פני הממברנה בנוסף לאנטיגנים נוספים. המחלה מאופיינת במיעוט יחסי של תאי גידול וריבוי תאי דלקת באזור הגידול. המחלה נחלקת למספר תתי סוגים כשהשכיח ביותר הוא Nodular Sclerosis.
יש שני שיאים להופעה המחלה:
- האחד בעשור השלישי לחיים
- השני בעשור השמיני
מופע קליני אופייני בצעירים הוא מחלה גושית במיצר (mediastinum). לעיתים נדירות יותר המחלה מופיעה בשלבים מתקדמים יותר עם בלוטות מעל ומתחת לסרעפת ובאתרים חוץ נודליים (מחוץ לבלוטות הלימפה).
כ-80%-90% מהחולים עם לימפומה מסוג הודג'קין בשלבים מוקדמים (I-II) יחלימו ממחלתם עם טיפול במשלב כימותרפי (ABVD - Adriamycin, Bleomycin, Vincristine, Dacarbazine) וקרינתי סטנדרטי. במקרים של מחלה מפושטת בזמן האבחנה (שלב III-IV) שיעורי הריפוי עם פרוטוקולים כגון ABVD נמוך יותר ועומד על 60%-66%. טיפולים כימותרפיים אינטנסיביים כגון Escalated BEACOPP (Bleomycin, Etoposide, Adriamycin, Cyclophosphamide, Oncovin=Vincristine, Procarbazine, Prednisone) הניתנים לעיתים במקרים של מחלה מתקדמת משיגים שעורי ריפוי של מעל 80%, אך כרוכים ברעילות ניכרת, הן מיידית והן מאוחרת[1].
במקרים בהם המחלה לא הגיבה לטיפול ראשוני או, לחילופין, חזרה למרות הטיפול שניתן, עדיין ניתן להציל כשליש עד מחצית מהחולים על ידי טיפול כימותרפי מקו שני (פרוטוקולים שונים המבוססים בדרך כלל על Platinum או Gemzar) ולאחריו השתלת מח עצם עצמית[2]. חולים עם הישנות לאחר פחות משנה מאז הטיפול, כאלו שהיו עמידים מלכתחילה לטיפול ובאלו שנשנו עם מחלה בשלב III-IV או מחלה חוץ נודלית, נחשבים בעלי סיכון גבוה וסיכויי ההצלחה בטיפול קו שני אצלם נמוכה[3].
בחולים שמחלתם התקדמה או חזרה לאחר טיפול קו שני, או בחולים קשישים שלא יכולים לעמוד בטיפול אינטנסיבי שכולל השתלה עצמית, הטיפול המוצע הוא פליאטיבי. הישרדותם של חולים כאלו פחותה לרוב משנתיים.
בשנת 2011 אישר מנהל המזון והתרופות האמריקאי (FDA ,Food and Drug Administration), בהליך מזורז, טיפול חדשני בנוגדן נושא כימותרפיה לטיפול בחולי HL עם הישנות המחלה לאחר השתלה עצמית או בחולים שאינם מועמדים להשתלה עצמית - Brentuximab Vedotin (Adcetris). האישור התבסס על נתונים של מחקר מפאזה שנייה שהדגים תגובה טובה ב-75% מהחולים, כאשר 34% מהם הגיבו תגובה מלאה. הטיפול ניתן אחת ל-3 שבועות במינון של 1.8 מיליגרם (מ"ג)/קילוגרם (ק"ג)[4], [5].
מבנה, פעילות ותופעות לוואי של Brentuximab Vedotin (BV)
Brentuximab Vedotin הוא דוגמא לתרופה המשלבת נוגדן עם כימותרפיה. תפקידו של הנוגדן לשאת אה התרופה הכימותרפית אל תאי המטרה, במקרה שלנו לתאים הנושאים CD30, תאי ריד-סטרנברג.
CD30 הוא חלבון טרנס ממברנלי ממשפחת TNF Receptors (קולטני Tumor Necrosis Factor). הוא מבוטא על תאי T ו-B משופעלים אך לא נייחים. ביטויו ברקמות בריאות הוא מינימלי ובתאי גידול ביטויו מוגבר, כך שהוא מהווה מטרה טובה לטיפול. הפעלת ה-CD30 באמצעות ליגנד (מקשר) מביאה לטרימריזציה שלו ויכולה להביא לתופעות שונות, בהן גם שגשוג ופרוליפרציה של תאים או אפופטוזיס (בתלות במולקולות הקוסטימולטריות). ניסיונות קודמים לשפעל את האנטיגן עם נוגדן בלבד (שאינו נושא כימותרפיה) הקרוי 30-SGN לא צלחו.
התרופה SGN-35) BV) שפותחה כהמשך SGN-30-V מכילה 3 מרכיבים:
- נוגדן מסוג IGG1, חלקו אנושי וחלקו עכברי
- MonoMethyl Auristatin E (MMAE) - מולקולה של אנטי-טובולין
- מחבר (לינקר) - המקשר קוולנטית בין הנוגדן לבין 6 עד 8 מולקולות של MMAE, ונחתך על ידי פרוטאזה (איור 1).
- הנוגדן הנושא את המולקולות MMAE-n לתאי ההודגיקין (החיוביים, כאמור, ל-CD30) פועל במספר מנגנונים
- ראשית, ככל הנראה, עצם הקישור של הנוגדן לרצפרטור מעביר מסר אפופטוטי לגרעין, שכמובן מסייע לפעילות של התרופה הכימותרפית.
- שנית, הקומפלקס אנטיגן נוגדן עובר אנדוציטוזיס ומתאחה עם הליזוזומים, התרופה MMAE משתחררת ומונעת אח פעילותם של מיקרוטובולי הדרושים בתהליך התקין של חלקות התא.
- במו כן התרופה מופרשת מהתא למיקרו-סביבה של הגידול (התאים התומכים בגידול) ומונעת גם את התרבותם ואת האפקט התומך שיש להם על תאי הגידול[6].
הטיפול ב-BV ניתן באופן אמבולטורי אחת ל-3 שבועות במינון של 1.8 מ"ג/ק"ג. תופעות הלוואי העיקריות של התרופה הן הגובה אלרגית, נוירופתיה פריפירית (תופעת לוואי מוכרת של אנטי-טובולין), עייפות, תופעות גסטרואינטסטינליות, UTI, חום וכמו כן ירידה בספירות. ככלל זוהי תרופה שנסבלת היטב ומרבית המטופלים לא מתקשים לקבל אותה. למידע בטיחותי מלא, ניתן לעיין בעלון לרופא כפי שאושר ע"י משרד הבריאות[7].
מתקדים קליניים והתוויות בסל התרופות לברנטוקסימב ודוטין
התרופה BV רשומה כיום בארץ וכלולה בסל התרופות למטופלים עם HL שכשלו קו טיפולי שני לאחר השתלה עצמית או מטופלים שאינם מועמדים להשתלה עצמית כקו שלישי, בהתאם למחקר פאזה שניה שפורסם ב-2013[5]. הטיפול מאושר גם כטיפול קו שני בחולים עם Anaplastic T cell lymphoma, מחלה נדירה המבטאת CD30 שגם בה הוכחה יעילות של הטיפול במחקר פאזה שניה[8]. הטיפול ניתן למשך 16 מחזורים לכל היותר (כשנה של טיפול) אחה ל-3 שבועות. לעיתים בחולים צעירים הטיפול בתרופה משמש כגשר להשתלה אלוגנאית. החולה מטופל במספר מצומצם של מחזורי טיפול[3], [4], ואם השיג תגובה טובה על פי הדמיה ויש תורם מח עצם ומין ניתן להפנותו להשתלח מח עצם אלוגנאית[9].
מחקר ETHERA שפורסם במרץ 2015 בעיתון The Lancet הוא מחקר פרוםפקטיבי, רנדומלי ועיוור שבדק את השפעתו של טיפול קונסולידציה (מיצוק) ב-BV מול פלצבו בחולים עם HL מיד לאחר השתלה עצמית. המחקר עסק אך ורק במטופלים המצויים בסיכון גבוה לחזרת המחלה לאחר ההשתלה[10]. במחקר זה השתתפו 329 חולי HL מ-78 מרכזים רפואיים בארה"ב ואירופה. החולים קיבלו טיפול לאחר השתלת מח עצם עצמית ובתנאי שהיה להם לפחות גורם סיכון אחד מן הבאים:
- עמידות ראשונית לטיפול כימותרפי
- הישנות לאחר פחות משנה מסוף טיפול או הישנות עם מעורבות חוץ נודליח.
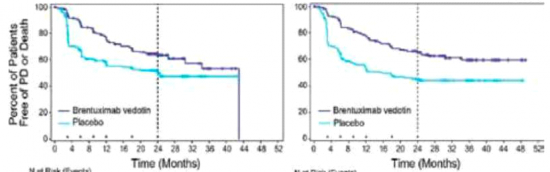
החולים חולקו באופן רנדומלי ועיוור לזרוע של BV 16 מחזורים או פלצבו ביחס של 1:1. סה"כ עברו 329 חולים רבדומיזציה, 164 לפלצבו ו-165 ל-BV. המטרה של המחקר הייחה להראות שיפור משמעותי ב-PFS (Progression Free Survival) בזרוע של ה-BV לעומת פלצבו. זמן זה הוגדר כזמן מהרנדומיזציה לתיעוד ראשון של התקדמות המחלה או מוות מכל סיבה. לאחר זמן מעקב חציוני של 30 חודשים נמצא שיפור ניכר ומשמעותי סטטיסטית של ה-PFS בקבוצה שקיבלה BV לעומת פלצבו של כ-43% (איור 2).
ה-PFS החציוני היה 42.9 חודשים בקבוצת ה-BV לעומת 24.1 חודשים בקבוצת הפלצבו, HR של 0.57 (0.40-0.81, 0.001=p>, בלומר הפחתה של 43% בסיכון להישנות המחלה. לא נמצא הבדל בין הקבוצות בהשרדות הכללית (Overall survival - OS)[10].
בכנס 13-ICML שנערך בלוגנו שוויץ, עודכנו עוד מספר תוצאות ממחקר זה. נעשתה אנליזה נפרדת מתוך מחקר זה של הקבוצה עם הפרוגנוזה הגרועה ביותר - חולים שהיו עמידים מלכתחילה לטיפול ראשוני. מדובר בקבוצה של חולים שמעולם לא היו ברמיסיה בשום שלב של הטיפול המהווה כ-60% מהאוכלוסייה המקורית שעברה רנדומיזציה (329 חולים). גם בקבוצה זו הראו החוקרים שיפור ניכר בהישרדות בחולים שקיבלו BV לעומת חולים שקיבלו פלצבו: ה-PFS בשנתיים השתפר מ-42% ל-60%. גם כאן לא נמצא הבדל ב-OS.
סיכום
למרות ש-HL היא לימפומה נדירה ובעלת פרוגנוזה טובה, ישנם מקרים של מטופלים עמידים לטיפול כימותרפי סטנדרטי או מקרים בהם המחלה נשנית למרות טיפול. כיון שלרוב מדובר במטופלים צעירים יש לשאוף לרפא את החולים גם כשמחלתם חזרה באמצעות כימותרפיה אגרסיבית והשתלת מח עצם עצמית. הישנות לאחר השתלה או עמידות ראשונית לטיפול כולל השתלה מהוות גורם פרוגנוםטי גרוע. בחולים עם הישנות לאחר השתלה, מהווה BV אפשרות טיפולית טובה ויעילה היכולה לעיתים לשמש גשר להשתלה אלוגנאית. BV נמצא בסל התרופות בהתוויה זו. לאחרונה הוכח שמתן של BV כטיפול מיצוק לאחר השתלה במטופלים בעלי סיכון גבוה להישנות או ההקדמות יכול להאריך באופן משמעותי את ה-PFS, זמן ההשרדות ללא התקדמות מחלה.
דגלים אדומים
ביבליוגרפיה
- ↑ Diehl, V., et al., Standard and increased-dose BEACOPP chemotherapy compared with COPP-ABVD for advanced Hodgkin's disease. New England Journal of Medicine, 2003. 348(24): p. 2386-2395.
- ↑ Lavoie, J.C., et al., High-dose chemotherapy and autologous stem cell transplan¬tation for primary refractory or relapsed Hodgkin lymphoma: long-term outcome in the first 100 patients treated in Vancouver. Blood, 2005.106(4): p. 1473-1478.
- ↑ 3.0 3.1 Sureda, A., et al., Prognostic factors affecting long-term outcome after stem cell transplantation in Hodgkin's lymphoma autografted after a first relapse. Ann Oncol, 2005.16(4): p. 625-33.
- ↑ 4.0 4.1 Chen, R.W., etal. Results from a pivotal phase II study of brentuximab vedotin (SGN-35) in patients with relapsed or refractory Hodgkin lymphoma (HL). in ASCO Annual Meeting Proceedings.
- ↑ 5.0 5.1 Younes, A., et al., Results of a pivotal phase II study of brentuximab vedotin for pa¬tients with relapsed or refractory Hodgkin's lymphoma. Journal of Clinical Oncology. 30(18): p. 2183-2189.
- ↑ Newland, A.M., etal., Brentuximab Vedotin: A CD30-Directed Antibody-Cytotoxic Drug Conjugate. Pharmacotherapy: The Journal of Human Pharmacology and Drug Therapy. 33(1): p. 93-104.
- ↑ Adcetris Prescribing Information as approved my Israeli MoH http://www.old. health.gov.il/units/pha rmacy/trufot/PerutTrufa.asp?Reg_Number=152 09 33991 OO&safa
- ↑ de Claro, R.A., etal., US Food and Drug Administration approval summary: bren-tuximab vedotin for the treatment of relapsed Hodgkin lymphoma or relapsed sys¬temic anaplastic large-cell lymphoma. Clinical Cancer Research. 18(21): p. 5845-5849.
- ↑ Chen, R., etal., Brentuximab vedotin enables successful reduced-intensity alio-geneic hematopoietic cell transplantation in patients with relapsed or refractory Hodgkin lymphoma. Blood. 119(26): p. 6379-6381.
- ↑ 10.0 10.1 Moskowitz, C.H., etal., Brentuximab vedotin as consolidation therapy after autologous stem-cell transplantation in patients with Hodgkin's lymphoma at risk of relapse or progression (AETHERA): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet, 2015.385(9980): p. 1853-1862.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר מירב קדמי, שרות הלימפומה, החטיבה להמטולוגיה והשתלות מח עצם, המרכז הרפואי ע"ש חיים שיבא, תל השומר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק