ליפופרוטאין בעל צפיפות גבוהה - High density lipoprotein - HDL
| מדריך בדיקות מעבדה | |
| ליפופרוטאין בעל צפיפות גבוהה | |
|---|---|
| High density lipoprotein HDL | |
| מעבדה | כימיה בדם |
| תחום | פרופיל שומנים בדם |
| יחידות מדידה | מיליגרם לדציליטר |
| טווח ערכים תקין | באוכלוסיה לבנה: דם טבורי - 6-53 (זכרים), 13-56 (נקבות); גיל 4-5 שנים - 30-66 (זכרים), 30-68 (נקבות); גיל 6-11 שנים - 34-73 (זכרים), 32-68 (נקבות); גיל 12-19 שנים - 31-63 (זכרים), 32-70 (נקבות); גיל 20-29 שנים - 28-69 (זכרים), 36-86 (נקבות); גיל 30-39 שנים - 26-68 (זכרים), 33-82 (נקבות); גיל 40-49 שנים - 26-72 (זכרים), 37-79 (נקבות); גיל 50-59 שנים - 26-74 (זכרים), 34-87 (נקבות); גיל 60-69 שנים - 28-71 (זכרים), 31-86 (נקבות); מעל גיל 70 שנה - 28-72 (זכרים), 32-83 (נקבות). באוכלוסייה שחורה (אפרו-אמריקנים): מעל גיל 10 שנים, ערכי HDL גבוהים יותר ב-10 מיליגרם לדציליטר בממוצע, בהשוואה לאוכלוסייה הלבנה. |
| יוצר הערך | פרופ' בן-עמי סלע |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – ליפופרוטאין
מטרת הבדיקה
בדיקת HDL-cholesterol (להלן HDL-C) נדרשת בדרך כלל כבדיקת follow up כאשר מתקבלת תוצאה מוגברת של סך-כולסטרול בבדיקת שגרה. בדיקת HDL-C אינה מתבצעת כשלעצמה, אלא כחלק מפרופיל ליפידים מלא המכיל גם מדידת סך-כולסטרול, LDL-cholesterol וטריגליצרידים, אם כחלק מבדיקת סקר-רפואי שגרתית בבריאות מלאה, או בתרחישים קליניים. מומלץ לבצע בדיקת פרופיל ליפידים למבוגרים, אחת ל-5 שנים. בדיקת HDL-C כחלק מפרופיל ליפידים, מומלצת לעתים יותר תכופות לאלה שיש להם אחד או יותר גורמי סיכון למחלת-לב, כדלהלן: עישון סיגריות, סוכרת, היפרטרופיה של החדר השמאלי, גיל שמעל 45 שנה בגברים או 55 שנה בנשים, מחלת לב ידועה או כאלה שכבר עברו התקף לב, סיפור משפחתי של מחלות לב בגברים מתחת לגיל 55 שנה או בנשים מתחת לגיל 65 שנה, יתר לחץ-דם שמעל 140/90.
רמת HDL-C נדרשת כחלק מהערכה קלינית-אטיולוגית, לאחר אירועים קרדיו-וסקולאריים משמעותיים כגון התקף-לב, אירוע מוחי, פקקת או תסחיף פקקתי, או בעקבות ממצאים פתולוגיים של עורקים כליליים, תרדמניים או אחרים בהליך אנגיו-גרפי. מדידת רמת HDL-Cחיונית להתבצע אחת לחודשים אחדים, כדי לנטר את יעילות טיפול התרופתי או את יעילות השינוי באורח חיים כשינויי דיאטה, פעילות גופנית והפסקת עישון, שנועדו לשיפור פרופיל הליפידים (הורדת LDL-C והעלאת רמת HDL-C).
בסיס פיזיולוגי
ליפופרוטאין בעל צפיפות גבוהה (HDL) הוא החלקיק הקטן ביותר מבין חמישה ליפופרוטאינים בדם, המאפשרים את התנועה של ליפידים בלתי מסיסים במים כמו כולסטרול וטריגליצרידים בנוזל הדם. באנשים בבריאות מלאה כ-30% מהכולסטרול בדם נישא על ידי HDL. אכן, הכילומיקרונים נחשבים לחלקיקים הגדולים ביותר, ולאחריהם על פי הגודל נמצא את IDL ,VLDL או intermediate density lipoprotein ואחריו LDL ו-HDL . אך גם HDL אינו חלקיק הומוגני בגודלו, וזוהו 5 תת-סוגים של HDL בהתאם לגודלם, כאשר הם מסומנים כ-HDL-3b ,HDL-3a ,HDL-2b ,HDL-2a ו-HDL-3c, בסדר יורד מהחלקיק הגדול ביותר לקטן ביותר.
החלקיק של HDL הוא הקטן מבין הליפופרוטאינים וגודלו בין 9-12 ננומטר, ומכיל בערך 50% חלבוןו-50% ליפיד, ומשקלו הסגולי נע בין 1.063-1.21 גרם למ"ל. הליפיד הדומיננטי ב-HDL מבחינה כמותית הוא פוספוליפיד, כאשר פוספטידיל-כולין (לציטין) הוא הפוספוליפיד העיקרי ומהווה בין 70-80% מכלל הפוספוליפידים ב-HDL. לציטין הוא בעל תפקיד חשוב כמגיב בריאקצית האסטריפיקציה של כולסטרול המתבצעת על ידי האנזים LCAT.
תהליך הטענת חלקיקי HDL בכולסטרול מייצר חלקיק ביניים הידוע כ-pre-β, וכאשר האנזים LCAT מבצע את האסטריפיקציה של כולסטרול בתוך חלקיק הביניים הזה, נוצרים חלקיקי-α בשלים של HDL, הריהם HDL3 ו-HDL2. באנשים עם בעיית חסר LCAT יש הצטברות של חלקיקי HDL החסרים כולסטרול-אסטר. בחלקיק הביניים של HDL מהווה apoE מרכיב דומיננטי, ולעומת זאת בחלקיק HDL הבשל מהווה apoA מרכיב דומיננטי עם נוכחות קטנה יותר של apoCו-apoE.
שני החלבונים העיקריים בחלקיק HDL הם apoA-I ו-apoA-II והם ממוקמים במעטפת החלקיק, יחסית קרובים אחד לשני. כיוון שחומצות אמינו טעונות חשמלית נוטות לקשור אליהן מים, הדבר הופך חלקיק זה למסיס במים, ובאופן כזה הוא נקשר בקלות לקולטנים שלו על פני מקרופאגים טעוני כולסטרול ברובד הטרשתי. כאשר הכולסטרול בכמות גדולה נקלט על ידי חלקיק ה-HDL, נפח החלקיק גדל כאשר ליפופרוטאין יחיד או שניים נוספים מצטרפים למבנה המוגדל ליצירתה-"HDL הגדול".
HDL נחשב לחלקיק הליפופרוטאיני הדחוס ביותר כיוון שהיחס בין חלבון לכולסטרול הוא הגבוה ביותר בחלקיק זה. הליפופרוטאיןHDL מסונתז בכבד כקומפלקס של אפוליפופרוטאינים ופוספוליפידים, ואלה מסוגלים לקלוט כולסטרול, ולשאת אותו מתוך התאים על ידי תגובה עם ATP-binding cassette transporter AI או ABCA1, הממוקם על מקרופאגים בדופן העורקים. בחסר של ABCAI נגרמת מחלת Tangier, או חסר משפחתי של HDL, וכולסטרול מצטבר ברקמות היקפיות.
בפלזמה מצוי האנזים LCAT או lecithin-cholesterol acyltransferase ההופך כולסטרול חופשי לכולסטרול-אסטר, שהיא נגזרת יותר הידרופובית של כולסטרול, ואז כולסטרול-אסתר נקלט לתוך הליבה של חלקיק HDL העני בליפידים. ומקנה לחלקיק HDL-C הבשל את צורתו הכדורית. כאשר חלקיק זה נע בצירקולציה של הדם הוא קולט עוד כולסטרול ופוספוליפידים מהתאים ומליפופרוטאינים אחרים, על ידי אינטראקציה עם הטרנספורטר ABCG1, או עם הטרנספורטר של פוספוליפידים, PLTP.
HDL-C מעביר כולסטרול מהפריפריה בעיקר לכבד, אך גם לאיברים מייצרי סטרואידים כמו בלוטת יותרת הכליה, הכליות והאשכים, שם כולסטרול משמש אבן בנין לסינתזה של סטרואידים. באיברים אלה נקשר HDL-C לקולטנים כגון scavenger receptor BI, המתווך בהוצאת מטען הכולסטרול מחלקיק ה-HDL-C. בבני אדם, במסלול של HDL-C משתתף גם החלבון הידוע כ-CETP או cholesteryl ester transfer protein, שתפקידו להמיר טריגליצרידים ממקור של חלקיק VLDL כנגד הנגזרת האסטרית של כולסטרול ממקור HDL-C. כתוצאה מתהליך השחלוף הזה של CETP, חלקיקי VLDL הופכים למעשה לחלקיקי LDL, המורחקים מהדם דרך מסלול הקולטנים של LDL. לעומת זאת הטריגליצרידים שהוטמעו בחלקיקי HDL אינם יציבים בחלקיק זה, ומתפרקים על ידי האנזים הכבדי או האנדותליאלי ליפאזה, באופן שחלקיקי HDLמתרוקנים ממטען הטריגליצרידים ויכולים להתחיל מחזור חדש של קליטת כולסטרול מהתאים. הכולסטרול המועבר לכבד מופרש לתוך המרה, ודרכה למעיים, או באופן ישיר או באופן בלתי-ישיר על ידי התקשרותו למלחי מרה.
המסלול דרכו מעביר HDL-C את הכולסטרול אותו הוא פורק מהמקרופאגים עמוסי הכולסטרול על דופן העורקים הטרשתיים, המכונים תאי קצף, ומחזיר אותו לכבד, ידוע כ-reverse cholesterol transfer, והוא נחשב לתהליך הגנתי קלאסי להפחתת התהליך האתרו-סקלרוטי. אך פרט לסגולתו של HDL בהעברת כולסטרול מהאתרומה הטרשתית לכבד, מייחסים ל-HDL יכולת לעכב תהליכי עקה חמצונית, עיכוב תהליכי דלקת, יכולת לעכב שפעול יתר של האנדותליום, פעילות אנטי-מיטוטית, פעילות פיברינוליטית ויכולת לעכב קרישת יתר וכן לעכב צימות של טסיות דם.
ההטרוגניות המשמעותית של HDL מודגמת בנוכחות של שני תת סוגים שלו, HDL2 שהוא עתיר ליפידים, ו-HDL3 הקטן והצפוף יותר, וכן 14 תת-מקטעים של HDL, בהתאם לשיטת הפרקציונציה. לדוגמה, בשיטות של אולטרה-צנטריפוגציה ניתן לבודד את HDL2 שצפיפותו 1.063-1.110 גרם למ"ל, לעומת HDL3 הכבד יותר, שצפיפותו 1.110-1.21 גרם לד"ל. נמצא ש-HDL2 מופיע בדם של נשים צעירות בריכוז הגבוה בערך פי-3 מאשר בדם של גברים. נראה ש-HDL2 מקנה הגנה טובה יותר מפני נזק לדופן העורק מאשר HDL3. נתונים אפידמיולוגיים מראים שאנשים עם רמה נמוכה יחסית של HDL2 חשופים יותר למחלת עורקים כלילית טרם-עת. לעומת זאת, החומרה של מחלת עורקים כליליים נמצא במתאם ישיר עם הרמות של חלקיקי HDL3הקטנים והצפופים, והיא נמצאת במתאם שלילי עם הריכוז של חלקיקי HDL בגדלים הממוצעים. יתרה מכך, באנשים עם תוחלת חיים ארוכה במיוחד, יש באופן משמעותי חלקיקי HDL2 שהם גדולים יותר ופחות צפופים.
ניתן לחלק את HDL לתת קבוצות LpA-I (המכיל רק ApoA-I), ול-LpA-I:A-II (המכיל חלקיקי apoA-I וגם apoA-II). חלקיק HDL משתתף בוויסות של הקטבוליזם של טריגליצרידים, ויצירת כולסטרול-אסטר, על ידי שהוא מספק את הקו-פקטורים המתאימים: apoC-II המשפעל את האנזים lipoprotein lipase, וכן apoC-III המעכב אנזים זה. אכן נתוני מחקרים משנת 2012 מצביעים על HDL עתיר ב-apoC-III כפרקציה המגדילה את הסיכון למחלת לב כלילית בעתיד.
תקופת מחצית החיים של HDL בפלזמה באנשים בריאים נאמדת בין 3.3-5.8 ימים. באלה עם מחלות כליה, נמרץ יותר התהליך הקטבולי של HDL, ולעומת זאת תהליך זה מופחת באלה עם רמות טריגליצרידים גבוהות, ובמיוחד באלה עם רמת כילומיקרונים גבוהה במיוחד.
נתונים אפידמיולוגיים
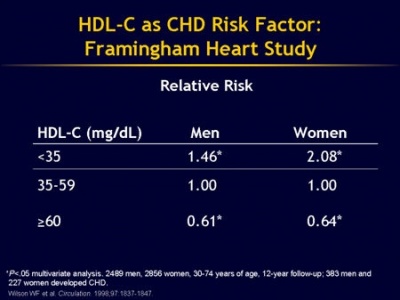
בגברים יש נטייה לרמות נמוכות יותר של HDL-C, וכן לחלקיקים קטנים יותר מאשר בנשים, ואכן שיעור מחלות לב טרשתיות גבוה יותר בגברים מאשר בנשים. ממצאים אפידמיולוגיים הראו שרמות HDL גבוהות (מעל 60 מיליגרם לד"ל) הם בעלי סגולות הגנה מפני מחלה קרדיו-וסקואלרית כגון שבץ מוחי איסכמי או אוטם שריר הלב. לעומת זאת רמות נמוכות (מתחת 40 מיליגרם לד"ל בגברים, או מתחת ל-50 מיליגרם לד"ל בנשים), מגבירות את הסיכון למחלה טרשתית.
גופי הרפואה והמחקר המובילים בארה"ב, ה- HIH כמו גם ה-National Cholesterol Education Program, הציגו את הרמות המומלצות של HDL-C (בצום):
- סף הנורמה הנמוך שלHDL-C לגברים הוא 40 מיליגרם לד"ל, ולנשים 50 מיליגרם לד"ל, כאשר רמה הנמוכה מערכי סף אלה מגבירה את הסיכון למחלת לב.
- ריכוזיHDL-C בין 40 ל-59 מיליגרם לד"ל נחשבים ערכי ביניים מבחינת הסיכון לתחלואת לב.
- ריכוזי HDL-C מעל 60 מיליגרם לד"ל נחשבים אופטימאליים, ונחשבים כמגנים בפני תחלואת לב.
נתונים ממחקר Framingham מצביעים על כך, שבכל רמה נתונה של LDL-C, הסיכון למחלת לב עלול לגדול פי-10 כאשר HDL-C יורד בריכוזו מהרמה הגבוהה ביותר שנרשמה במחקר זה לרמה הנמוכה ביותר שלו שנרשמה באותו מחקר. לעומת זאת, ברמה נתונה וקבועה של HDL-C, הסיכון למחלת לב גדל רק פי-3 כאשר רמת LDL-C עולה מהרמה הנמוכה ביותר לרמה הגבוהה ביותר, שנרשמה במחקר האמור. גם נבדקים עם רמות LDL נמוכות מאוד חשופים לסיכון מוגבר של מחלת לב, אם רמת HDL-C בדמם אינה גבוהה דייה.
ריכוזים אופטימאליים של סך-HDL-C ושל חלקיקי HDL-C גדולים
אחד הניסויים הקליניים המרכזיים בהם נבחן המתאם בין רמת HDL-C וגודל חלקיקי HDL-C לבין תחלואה קרדיו-וסקולארית היה ניסוי MESA או Multi-Ethnic Study of Atherosclerosis, שכלל למעלה מ-6,000 גברים ונשים בגיל 45-64 שנה מ-6 אזורים בארה"ב, בהשתתפות חוקרים מאוניברסיטאות קולומביה בניו-יורק, Johns Hopkins בבולטימור, Northwestern בשיקאגו, אוניברסיטת מינסוטה, Wake Forest ו-UCLA. המחקר החל בשנת 2000 וסיומו בשנת 2014, ותוצאות הביניים שלו הן כדלקמן:
- ברביעון העליון (מעל 75%) של אלה עם רמת HDL-C הגבוהה ביותר (מעל 34.9 מיליגרם לד"ל) נמצא השיעור הנמוך ביותר של אירועי מחלה קרדיו-וסקולארית.
- ברביעון השני (בין 50-75%) של אלה עם רמת HDL-C (בין 30.5-34.5 מיליגרם לד"ל) נמצא שיעור מתון של אירועי מחלה קרדיו-וסקולארית.
- ברביעון השלישי (בין 25-50%) של אלה עם רמת HDL-C (בין 26.7-30.5 מיליגרם לד"ל) נמצא שיעור גבולי-גבוה של אירועי מחלה קרדיו-וסקולארית.
- ברביעון התחתון (בין 0-25%) של אלה עם רמת HDL-C (מתחת ל-26.7 מיליגרם לד"ל) נמצא השיעור הגבוה ביותר של אירועי מחלה קרדיו-וסקולארית.
על פי נתוני NCEP, על כל ירידה של 5 מיליגרם לד"ל ברמת HDL-C מתחת לרמה הממוצעת, עולה הסיכון למחלת לב כלילית ב-25%. ממצאים נוספים של ניסוי MESA מתייחסים לרמת חלקיקי HDL-C הגדולים, הנחשבים כבעלי פוטנציאל הגנה גדול יותר מפני מחלה קרדיו-וסקולארית, שכן הם יכולים לשאת עימם לכבד כמות כולסטרול גבוהה ביותר.
- ברביעון העליון (מעל 75%) של אלה עם ריכוז מעל 7.3 מיליגרם לד"ל של חלקיקי HDL-Cגדולים, הם בעלי הסיכון הנמוך ביותר לאירועי מחלה קרדיו-וסקולארית.
- ברביעון השני (בין 50-75%) של אלה עם ריכוז בין 4.8-7.3 מיליגרם לד"ל של חלקיקי HDL-C גדולים, הם בעלי סיכון מתון לאירועי מחלה קרדיו-וסקולארית.
- ברביעון השלישי (בין 25-50%) של אלה עם ריכוז בין 3.1-4.8 מיליגרם לד"ל של חלקיקי HDL-C גדולים, הם בעלי סיכון גבולי-גבוה לאירועי מחלה קרדיו-וסקולארית.
- ברביעון התחתון (בין 0-25%) של אלה עם ריכוז נמוך מ-3.1 מיליגרם לד"ל של חלקיקי HDL-C גדולים, הם בעלי הסיכון הגבוה ביותר לאירועי מחלה קרדיו-וסקולארית.
יש לציין שלמרות שסקרים אפידמיולוגיים רבי-שנים כורכים רמות מוגברות של HDL עם הגנה בפני תחלואה קרדיו-וסקולארית, לא ניתן להדגים באופן חד-ערכי מתאם בין עלייה מדורגת ברמת HDL-C בדם לבין שיפור במדדי תחלואה זו. במלים אחרות, בעוד שרמות גבוהות של HDL-C עשויות ללכת בד בבד עם תחלואה קרדיו-וסקולארית מופחתת, לא ניתן היה להיווכח בהפחתת תחלואה על ידי טיפול תרופתי שנועד באופן ישיר להעלות רמת HDL-C בדם. בסוגיה זו כדאי להזכיר את הואריאנט של HDL-C הידוע כ-HDL-apoA1 Milano, כאשר אותם פרטים בודדים בהם הוא אותר, מצטיינים בתחלואה קרדיו-וסקולארית נמוכה ביותר, למרות שרמות HDL-C נמוכות ביותר בפרטים אלה, ורמת הטריגיצרידים גבוהה אצלם.
הגברת רמת HDL
- שינויים באורח חיים עשויים להעלות רמת HDL בפלזמה
- פעילות גופנית אירובית - פרסומים אחדים מצביעים על עלייה של כ-5% ברמת HDL תוך חודשיים מתחילת פעילות אירובית תדירה כגון הליכה נמרצת משך 30 דקות מדי יום (חמש פעמים בשבוע), ריצה קלה משך 5-10 דקות מדי יום, רכיבה על אופניים, שחייה, או משחקי כדור (טניס, כדורסל).
- הפחתת משקל - נתונים ממספר מחקרים מצביעים על כך שכל הפחתה במשקל של 2.7 ק"ג, מתורגמת לעליה של 1 מיליגרם לד"ל של HDL-C.
- הפסקת עישון - עשויה להעלות רמת HDL-C עד 10%.
- צריכת שומנים בריאים - יש להקפיד על צריכת שומנים רוויים שלא תעלה על 7% מסך צריכת הקלוריות היומית במזון, ולהעדיף שומני ציס-בלתי רוויים. יש להימנע ככל האפשר מצריכת שומני טרנס. שומנים חד-בלתי רוויים, או רב בלתי רוויים שנמצאים בזיתים, בבוטנים, ובשמני קנולה, משפרים את הפוטנציאל נוגד הדלקת של HDL. צריכה של טריגליצרידים עם חומצות שומן בעלות אורך שרשרת ממוצע כגון חומצה קפרואית, חומצה קפרילית וחומצה לאורית, מומלצת בהקשר לרמת HDL. חלק החומצות השומניות הרוויות מגבירות רמת HDL-C בדרגות שונות, אך גם מעלות את רמת LDL-C.
- שתייה קלה עד מתונה של כוסית אחת לנשים או שתי כוסיות לגברים של יין מדי יום עשויה להעלות מעט את רמת HDL.
- צריכת פריטי מזון עשירים בסיבים מסיסים, הפחתה בצריכה של סוכרים פשוטים, הגברת אכילת ירקות כיוון שאלה מכילים סטרולים כגון β-sitosterol ו-β-sitostanol, צריכת דגים עתירי חומצות אומגה-3, זרעי פשתן או שמן פשתן (flaxseed oil).
היבטים תרופתיים של טיפול בפיבראטים ובניאצין לשיפור רמת HDL-C
למרות שטיפול בפיבראטים הוכח במספר ניסויים קליניים כמעלה את רמת HDL, לא נמצאה ראייה מספקת שטיפול זה הוא בעל השפעה על מספר הפטירות מסיבות כלשהן. ניאצין (ויטמין B3) מגביר רמת HDL על ידי עיכוב בררני של הפעילות בכבד של האנזים 2 diacylglycerol acyltransferase, ועל ידי כך הפחתת הסינתזה של טריגליצרידים, והפחתת ההפרשה של VLDL, דרך התקשרות לקולטן HM74 הידוע גם כ-Niacin receptor 2, או לקולטן HM74A הידוע כ-Niacin receptor 1. מינון פרמאקולוגי יומי של 1-3 גרם של ניאצין אמנם מעלה רמת HDLA ב-10-30%, מה שהופך את ניאצין לתכשיר התרופתי היעיל ביותר להעלאת רמת HDL, ויש אמנם ראיות ניסוייות שטיפול בניאצין עשוי להפחית משמעותית את החמרת התהליך הטרשתי, כמו גם אירועים קרדיו-וסקולאריים.
- האם הכישלון של Torcetrapib מפריך את הגישה לפיה HDL מוגבר טוב מבחינה קרדיו-וסקולארית?
חברת Pfizer החליטה על ייצור תרופה שתעלה באופן ספציפי את רמת HDL על ידי חסימת הפעולה של CETP, החלבון המעביר כולסטרול מחלקיקי HDL לאלה של LDL וגם לחלקיקי VLDL, ובאופן זה לשמור את הכולסטרול ב-HDL, שישא אותו לכבד. התכשיר torcetrapib למעשה אושר לשיווק ב-2004-5, אך הוסר מהמדפים בשלהי 2006 ביזמת יצרנית התרופה, בעיקר בעקבות הניסוי הקליני ILLUMINATE שפורסם בראשית 2007 ב-NEJM: התכשיר אמנם הביא כמצופה להעלאת רמת HDL ב-65%, ואף הפחית את רמת LDL ב-20%, אך לא גרם במטופלים להפחתה משמעותית בתהליך הטרשתי, בהשוואה למטופלי אינבו.
יתרה מכך, הטיפול ב-torcetrapib אף הביא להעלאה קלה של 3-4 מ"מ כספית בלחץ הדם הסיסטולי, ואף העלה את מקרי אי ספיקת הלב ואירועי השבץ המוחי, ואת מספר ההתערבויות האנגיופלסטיות להרחבת כלי דם כליליים. ניסוי ILLUMINATE הופסק טרם עת מסיבות של בטיחות המשתתפים בו, שכן 82 מטופלים שקיבלו במהלכו טיפול משולב של torcetrapib וליפיטור נפטרו, לעומת 51 מקרי מוות בקרב מטופלים שקיבלו ליפיטור בלבד. הניסוי כלל מעל 15 אלף נבדקים, וכישלון תרופתי זה עורר כצפוי גלי תגובה והערכות על הסיבות לכישלונו, תוך ניסיון להבין מדוע הגישה המקובלת של "העלאת רמת HDL" לא הוכיחה את עצמה.
הסבר אפשרי לתוצאה הבלתי צפויה קשור לנטייתה של torcetrapib להשפיע על ההורמון אלדוסטרון ולגרום לעלייה קלה בלחץ הדם, בנוסף כנראה להשפעה טוקסית שיש לתכשיר זה על האנדותליום, שאינם קשורים להשפעתה על ה-HDL ועל תפקודו כחלקיק מגן. ביקורת אחרת שהושמעה הייתה בבחירת חברת Pfeizer באסטרטגיה של הגברת HDL דווקא על ידי חסימת CETP, חלבון הטרנספר המשפיע ומוזן הדדית על ידי מרכיבים רבים מדי במטבוליזם של שומני הדם.
גישה מודרנית אחרת הנבחנת כיום היא להגביר את מקטע ה-HDL על ידי הגברת הריכוז בדם של מרכיבו החלבוני apoA-1 על ידי מתן עירויים של חלבון זה לחולים עם תסמונת כלילית-לא-יציבה וטרשת מוכחת. גישה טיפולית מקורית אחרת נוסתה על ידי חברת Avant ממסטצ'וסטס שחיפשה דרך חיסונית לחסום את פעולת CETP, על ידי "חיסון" נגדו. אך כדי ל"חסן" כנגד CETP שהוא מרכיב חלבוני לגיטימי של הגוף, הייתה חייבת Avant לעשות סימולציה של תהליכים המתרחשים במחלות אוטואימוניות.
החיסון המתוכנן כנגד CETP היה צריך להשתמש בתחבולה שתגרום למערכת החיסון לתקוף מטרה שהיא בדרך כלל מתעלמת ממנה. כמו כן מטרה זו הייתה צריכה להיות ייחודית למולקולת CETP, כדי שלא תיווצר תגובה חיסונית שתתקוף באופן לא רצוי גם חלבונים אחרים. Alan Toole חוקר טרשת העורקים מאוניברסיטת קולומביה, זיהה בעבר קטע של 16 חומצות אמינו ב-CETP החיוני לתפקוד המולקולה, ואשר נבדל מכל רצף מוכר בחלבוני גוף אחרים.
כדי לגרום לתגובה חיסונית כנגד חלבון עצמי הזה, היה צורך להצמיד אותו לאנטיגן שמערכת החיסון מזהה כאיום ברוב המכריע של האוכלוסייה, לדוגמה אנטיגן הטטנוס. לשם כך "יצר" Toole פפטיד בעל 31 חומצות אמיניות, המשלב את 16 חומצות האמיניות הייחודיות של CETP שזיהה Toole, יחד עם 14 חומצות אמיניות מרעלן הטטנוס, וכן חומצה אמינית בודדת הקושרת בין שני עותקים של הפפטיד הזה ליצירת מולקולה יציבה ואימונוגנית מאוד.
הגישה החיסונית הזו של Avant ו-Toole נראית מבטיחה, כאשר האנטיגן בן-הכלאיים הזה, ש-Avant קראה לו בשם "חיסון "CETi-1, מעורר תגובה חיסונית חזקה כנגד טטנוס וכנגד מקטע ה-CETP. בארנבות חיסון CETi-1 העלה את ה-HDL ב-42 אחוזים, הפחית את ה-LDL ב-24% והפחית את אזורי הנגעים הטרשתיים ב- 40%. העתיד יוכיח אם גישה זו תהיה יעילה גם בבני-אדם.
פענוח תוצאות הבדיקה
מצבים קליניים בהם רמת HDL-C מוגברת: היפר-אלפא פרוטאינמיה משפחתית; מצבים בהם מפגעים ראשוניים יכולים לגרום לעלייה שניונית ברמת HDL-C: צמקת כבד ראשונית, הפאטיטיס כרונית, אלכוהוליזם, מצבי הרעלה כרוניים.
מצבים קליניים בהם רמת HDL-C נמוכה: היפו-אלפא ליפופרואינמיה משפחתית; מחלת Tangier, או וריאנטים אחרים של apo A-I, חסר משפחתי של האנזים LCAT. חסר משפחתי של CETP, חסר משפחתי של apo A-I עם או בלי חסר של CIII/apo A-I. חסר בקו-פקטור של ליפופרוטאין ליפאזה (apo C-II), מצב של a-beta-liproteinemia, היפו-אלפא-ליפופרוטאינמיה משפחתית (בה אף תועדו רמות HDL-C של 4-7 מיליגרם לד"ל), apo A-I Milano מחלת עין הדג, צורות שונות של היפר-טריגליצרידמיה.
מצבים בהם מפגעים ראשוניים יכולים לגרום לירידה שניונית ברמת HDL-C: סוכרת type-2 בלתי מאוזנת, מחלת לב כלילית בגיל צעיר, מפגעים הפאטו-צלולאריים, מחלת כבד חסימתית (כולסטאזיס), תסמונת נפרוטית, מחלת כליות כרונית, השמנת יתר, ממאירות, תסמונת Cushing.
תכשירים או פעולות המעלות רמת HDL-C באופן פיזיולוגי
אסטרוגנים, גלולות למניעת הריון, צריכה מתונה של אלכוהול, carbamazepine cimetidine, נגזרות של פיבראט דוגמת clofibrate ,gemfibrozil ו-fenofibrate. סטאטינים דוגמת lovastatin pravastatin ו-simvastatin נחשבים כבעלי פעילות מוגבלת בהעלאת רמת HDL, פנולברביטל, ציקלופניל, חוסמי אלפא דוגמת doxazosin ו-prazosin, אנטגוניסט של קולטני אלפא-1 דוגמת terazosin, חשיפה להידרוקרבונים מכילי כלור, phenytoin ו- terbutaline, ניאצין (חומצה ניקוטינית), תוספי מגנזיום, תכשירים הקולטים חומצות מרה על בסיס רזינים, דוגמת colestipol או cholestyramine, התכשיר Lovaza של GSK שהוא תערובת של אתיל-אסטרים של חומצות אומגה-3, בעיקר EPA ו-DHA. הפחתה במשקל במטופלים עם עודף משקל משמעותי, פעילות גופנית נמרצת, הפסקת עישון.
תוצאות מוגברות כתוצאה מהשפעה על האנליזה המעבדתית של HDL-C: דגימות ליפמיות, שימוש במלח מנגן בפרוצדורת ההשקעה של הנסיוב, מלווה על ידי מדידה אנזימטית של כולסטרול במערכת המכילה בופר פוספאט.
תכשירים או פעולות המפחיתות את רמת HDL-C באופן פיזיולוגי
אנדרוגנים, חוסמי בתא (בעיקר כאלה שאינם סלקטיביים), חומרים מְשֵתנים דוגמת תיאזידים או chlorothalidone, גלוקוקורטיקואידים, רטינואידים, אינטרפרון, מדרוקסיפרוג'סטרון, interleukin, ציקלוספורין, סטרואידים אנאבוליים דוגמת danazol, מעכבי פרוטאזה של HIV, פרוגסטינים, probucol ,chenodeoxycholic acid, מינון גבוה של cyproterone acetate ,isotretinoin ,etretinate.
כמו כן משפיעות להורדת HDL-C דיאטות עשירות בפחמימות או בחומצות שומן רב-בלתי רוויות, דיאטה דלה בשומנים, חוסר פעילות גופנית, מצבי דלקת או הידבקות בפתוגנים, עישון סיגריות, אירוע התקף-לב, שבץ מוחי, או הליך צנתור.
הוראות לביצוע הבדיקה
לצורך הבדיקה יש צורך להיות בצום של 12 שעות. ניתן להשתמש בנסיוב או בפלזמה ולצורך העניין ניתן ליטול את הדם במבחנה כימית (פקק אדום או צהוב) או מבחנת ספירת-דם (פקק סגלגל) המכיל 1 מיליגרם EDTA למ"ל דם, או מבחנת הפארין (פקק ירוק). בפירוש אין להשתמש במבחנות המכילות אוקסלאט, פלואוריד או ציטראט. מומלץ שהנבדק יישב משך 5 דקות לפני נטילת הדם, ויש להקפיד שחוסם העורקים לא ייכרך סביב הזרוע לפרק זמן ממושך. לאחר הסרכוז שצריך להתבצע תוך שעתיים, הדגימה יציבה עד 7 ימים בקירור, ולפרק זמן של חודשיים בהקפאה. יש להימנע מהקפאה והפשרה חוזרת. דגימת דם ליפמית במיוחד עלולה להשפיע על תוצאת המדידה של HDL-C.
את בדיקת HDL-C רצוי לבצע כאשר בנבדק אינו בעיצומה של מחלה חריפה, שכן רמת הכולסטרול נמוכה באופן זמני בפרק זמן זה, או לאחר התקף-לב, או בעת עקה שלאחר ניתוח או תאונה. מומלץ להמתין 4-6 שבועות אחר התרחישים המפורטים לפני ביצוע בדיקת HDL-C. כיוון שרמת כולסטרול עלולה להשתנות באופן משמעותי בעת הריון, יש להמתין להערכת רמת HDL-C עד 6 שבועות לאחר הלידה.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק