מבדק רמת האנזים Thiopurine methyltransferase
| מדריך בדיקות מעבדה | |
| מבדק רמת האנזים Thiopurine methyltransferase | |
|---|---|
| שמות אחרים | thiopurine S-methyltransferase, TPMT, TPMT Genotype, TPMT phenotype, TPMT rbc, myelotoxicity. |
| מעבדה | כימיה/טוקסיקולוגיה בדם או ברוק |
| טווח ערכים תקין | רמה נורמאלית: מעל 15.0 יחידות/מ"ל כדוריות אדומות; רמה נורמאלית-נמוכה: 10.1-14.9 יחידות/מ"ל RBC; רמה בנשאים הטרוזיגוטיים של החסר באנזים: 6.0-11.0 יחידות/מ"ל RBC; רמה בנשאים הומוזיגוטיים עם חסר באנזים: 0.0-5.9 יחידות/מ"ל RBC. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
בהתבסס על סקירת הספרות בתחום הטיפולים האונקולוגיים, בדיקת הגנוטיפ והפנוטיפ של האנזים thiopurine methyltransferase לגילוי מוטציות המשנות את רמת האנזים או פעילותו, נחשבת למבדק הכרחי קלינית, לפני התחלת הטיפול ב-azathiopurine (AZA) או בmercaptopurine-6 (MP-6), באם המינון המקובל של תכשירים אלה אינו משיג התגובה התרפויטית הצפויה.
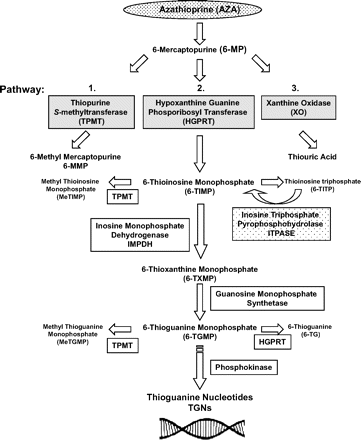
התיופורינים הם prodrugs המותמרים בתוך התאים ליצירת הנוקלאוטידים הציטו-טוקסיים מסוג thioguanine-6, לקבלת ההשפעה התרפויטית (Mcleod ו-Siva ב-Pharmacogenetics משנת 2002, ו-Higgs וחב' באותו כתב עת משנת 2010). לאחר נטילה פומית, AZA נספג במהירות במעי ועובר התמרה ל-MP-6 בתהליך לא-אנזימטי. כמתואר בתרשים למטה, שלושה מסלולים מתחרים על המטבוליזם של MP-6, והם: TPMT, קסנטין אוקסידאז (XO), ו- hypoxanthine guanine phosphoribosyltransferase (HGPRT). רוב המטבוליזם של MP-6 מתרחש בכבד (Zimm וחב' ב-N Eng J Med משנת 1983).
Azathioprine (שם מותג Imuran), המהווה prodrug של mercaptopurine-6 (שם מותג Purinethol), נחשב כתכשיר יעיל לדיכוי תגובת מערכת החיסון בטיפולים של מפגעי מעי דלקתיים, בפרט בחולים עם מחלה שאינה מגיבה לסטרואידים. לדוגמה, כ-50% מהמטופלים עם מחלת קרוהן זקוקים לסטרואידים במהלך הטיפול, ומתוכם כ-50% יפגינו עמידות לסטרואידים או לתלות בסטרואידים, ובהתאם יהיו מועמדים לטיפול immunosuppressive. טיפול ב-azathioprine מבטל את הצורך בקורטיקוסטרואידים בערך ב-75% מהמטופלים. בנוסף, azathioprine נחשב טיפול יעיל במפגעים של יצירת נׇצוּר (fistula).
אלא שהשימוש ב-azathioprine מוגבל הן בשל משך פעילותו הארוך (3-4 חודשים) והן בשל השפעתו הטוקסית לכבד, דיכוי מח העצם, פנקראטיטיס, כמו גם תגובות אלרגיות. יש הכורכים טיפול ממושך ב-azathioprione בממאירות. כתוצאה מתופעות לוואי אלו, פחות מ-5% מחולי קרוהן טופלו אי-פעם ב-azathioprine.
בדיקת פעילותו של TPMT לגילוי רמה נמוכה של האנזים נועדה למנוע טוקסיות חמורה לתאים הֶמׇאטופּויאטים במח העצם, העלולה לגרום ל-myelosuppression, כתוצאה מטיפול ב-azathioprine או ב-MP-6. מינון מופחת של תרופות אלה עשוי להפחית את הטוקסיות שלהן (Relling וחב' ב-Clin Pharmacol Ther משנת 2011).
בסיס פיזיולוגי
Azathioprine הוא אנלוג של purine המפריע לסינתזה של DNA ומעכב בעיקר את השגשוג של תאים המתחלקים במהירות, בעיקר אלה של מערכת החיסון. לפיכך, משמש תכשיר זה כמדכא של תאי חיסון בעיקר באלה העוברים ניתוח השתלת איברים, בעוד שהמטבוליט של azathioprine, הידוע כ-mercaptopurine-6, משמש לטיפול במחלות אוטו-אימוניות כמו גם ב-ALL או acute lymphoblastic leukemia, במחלות ראומטיות וכן במחלות מעי דלקתיות. במהלך המטבוליזם, האנזים hypoxanthine-guanine phosphoribosyltransferase או HGPRT, מסב את mercaptopurine-6 לאנלוג הציטוטקסי, הנוקלאוטיד thioguanine-6, בעוד שהאנזים thiopurine methyltransferase או TPMT גורם לאינאקטיבציה של mercaptopurine-6 על ידי המתילציה שלו ליצירת methylmercaptopurine-6.
בערך 11% מהאוכלוסייה הם בעלי פעילות מופחתת של TPMT, וכ-0.3% באוכלוסייה הם בעלי חסר מוחלט באנזים (Weinshilboum ו-Sladek ב- Am J Hum Genet משנת 1980). במטופלים אלה, מצטבר mercaptopurine-6 פעיל, וחלק גדול ממנו מותמר לאנלוג הציטוטוקסי, הנוקלאוטיד thioguanine-6, העלול לגרום לטוקסיות במח העצם ודיכוי תאים מיאלואידים (Maddocks וחב' ב-Lancet משנת 1986, ו-DiPiero וחב' ב-Cleve Clin J Med משנת 2015).
את הפעילות של TPMT בדם יכולה להימדד על ידי מגוון שיטות כגון HPLC, LC-MS/MS ושיטות איזוטופיות. יש להקפיד שהבדיקה צריכה למדוד את פעילות האנזים ולא את ריכוזו, שכן הפולימורפיזם הגנטי השכיח משפיע על פעילותו האנזימטית ולא בהכרח על רמת האנזים.
האנזים TPMT
TPMT הוא אנזים באדם המקודד על ידי הגן TPMT, והפסבדו-גן ממוקם באתר 18q21.1 (על פי Lee וחב' ב-Drug Metab Dispos משנת 1995). משקלו המולקולארי של TPMT הוא 32,000 דלטון. האנזים thiopurine methyltransferase גורם למתילציה של תרכובות thiopurine, כאשר ה-donor של שייר ה-methyl הוא S-adenosyl-L-methionine העובר התמרה ליצירת-S-adenosyl-L-homocysteine (על פי Weinshilboum ו-Sladek ב-Am J Hum Genet משנת 1980). תרופות ממשפחת ה-thiopurine כגון 6-mercaptopurine, וכן azathioprine ו-6-thioguanine משמשות הן בכימותרפיה בעיקר בטיפול בלאוקמיה לימפובלסטית חריפה (ALL) (על פי Marsh ב-Mol Diagn Ther משנת 2007), אך גם לדיכוי מערכת החיסון (immunosuppression) בטיפולים ב- IBS או במושתלי איברים. פולימורפיזם גנטי המשפיע על פעילות אנזים זה, כרוך בשינויים של רגישות ושל טוקסיות לתכשירי thiopurine בין מטופלים שונים.
פרמקולוגיה
TPMT מקטלז כאמור את ה-S-methylation של תיופורינים, אך מוטציות בגן של האנזים מפחיתות את יעילות המתילציה באופן המקטין את האינקטיבציה של 6MP, וכך גדלה טוקסיות התרופה במח העצם, מה שעלול לגרום לדיכוי תאים מיאלואידיים, לאנמיה, לנטייה לדימומים, ללאוקופניה, ולהדבקות בפתוגנים שונים (Fujita ו-Sasaki ב- Curr Drug Metab משנת 2007, וכן Oncea ו-Duley - Pharmacol Basis Therapeutics משנת 2008, ו-Evans ב- Ther Drug Monit משנת 2004).
מחקר של Sanderson ב-Gastroenterology משנת 2015 מצא שלמעלה מ-20% מהמטופלים עם IBD הפסיקו את הטיפול ב-thiopurine בגלל תופעות לוואי שהחמורה ביניהם לויקופניה.
שימוש דיאגנוסטי
מדידת פעילות TPMT מומלצת לפני התחלת הטיפול בתכשירי thiopurine. מטופלים עם פעילות נמוכה של האנזים (עד 10% מפעילותו הנורמאלית), ובמיוחד אלה עם חסר מוחלט של פעילות זו (עד 0.3% מפעילותו הנורמאלית), הנמצאים בסיכון מוגבר לטוקסיות למח העצם המושרית על ידי התרופה המצטברת שלא עברה מתילציה כחלק מהמטבוליזם שלה. Reuther וחב' מצאו שבערך 5% מכל הטיפולים ב-thiopurine נכשלים כתוצאה מטוקסיות זו (Eur J Clin Pharmacol משנת 2004). המטופלים המגלים אי-סבילות ל-TPMT יכולים להיות מזוהים על ידי מדידה שגרתית של פעילות אנזים זה בכדוריות הדם האדומות. קיימת שונות ניכרת בהשפעת המוטציה בגן TPMT, עם הבדלים אתניים בסוגי המוטציה האחראיים לתגובות השונות של המטופלים לתכשירים דוגמת MP-6. ואריאנטים גנטיים של TPMT נכרכו גם עם טוקסיות המושרית על ידי ציספלטין בילדים עד כדי איבוד שמיעה (Ross וחב' ב-Nat Genet משנת 2009). האנזים TPMT נמצא כיום ברשימת ה-FDA של סמנים פרמאקו-גנומיים העלולים לגרום לתופעות לוואי לא רצויות בטיפול בציספלטין.
הפעילות התרפויטית של הנוקלאוטידים מסוג thioguanine-6 נובעת מהאינקורפורציה שלהם לתוך ה-DNA והשראת אפופטוזיס של תאי T על ידי מודולציה של האיתות של Rac 1 החיוני לפעילויות תאיות רבות (Somerville וחב' ב-J Biol Chem משנת 2003). בנוסף, S-methyl-thiosine 5'-monophosphate או (MeTIMP), שנוצר על ידי מתילציה על ידי TPMT של TIMP-6 או thiosine monophosphate-6 שהוא תוצר ביניים במטבוליזם של MP-6, יכולים גם כן לגרום לציטוטוקסיות של thiopurine על ידי עיכוב de novo של סינתזת purine (על פי Cara וחב' ב-Med Sci Monit משנת 2004).
הפנוטיפ של TPMT
תופעות הלוואי של תכשירי thiopurine יוחסו להצטברות של רמות גבוהות של נוקלאוטידים של thioguanine (להלן TGNs) על פי Anstey וחב' ב-J R Soc Med משנת 1992, ו-Lennard וחב' ב-Lancet משנת 1990, והגורם הקובע ביותר של TGNs היא רמת TPMT. בשנת 1980 הראו Weinshilboum ו-Sladek ב-Am J Hum Genet, שפיזור הפעילות של TPMT בכדוריות אדומות הוא תלת-מודאלי, כאשר בערך 1 מכל 300 אנשים חסר באופן מוחלט את פעילות האנזים, ב-11% מהאנשים יש פעילות נמוכה של האנזים (intermediate), ואילו ב-89% מהאנשים פעילות האנזים תקינה, וזאת למרות שהוצע שדרגת החסר של TMPT באוכלוסייה גבוהה יותר (Ford וחב' ב-Ann Clin Biochem משנת 2004, ו-Holme וחב' ב-Q J Med משנת 2002).
מאז שהחלו בבדיקות סריקה של TPMT, הצטברו ראיות לכך שיש באוכלוסייה קבוצה רביעית המהווה בערך 2%, בה ניתן למצוא פעילות אולטרה-גבוהה של אנזים זה (Sanderson וחב' ב-Ann Clin Biochem משנת 2004, ו-Hindorf וחב' ב-Ther Drug Monit משנת 2004). בחולים עם לאוקמיה לימפובלסטית תופעה זו של רמות גבוהות באופן חריג של TPMT, יכולה לנבוע מעודף כרומוזומים בתאי הסרטן, הגורם לעותקים מרובים של אללים של האנזים, והגברה ניכרת של ביטויו (Cheng וחב' ב-Nat Genet משנת 2005).
הגנוטיפ של TPMT
השכיחות התלת-מודאלית של פעילות TPMT, היא תוצאה של פולימורפיזם גנטי. הגן של TMPT ממוקם על הזרוע הקצרה כרומוזום 6 באתר 6p22 ואורכו 34kb. הגן מורכב מ-9 introns ומ-10 exons, כאשר 8 מה-exons מקודדים עבור TPMT שהוא חלבון בעל 245 חומצות אמינו (Szumlanski וחב' ב-DNA Cell Biol משנת 1996). האלל לפעילות התקינה של האנזים (wildtype) מסומן כ-TPMT*1. עד כה תוארו 29 ואריאנטים שונים של אללים של TPMT, כאשר 16 מתוך אללים אלה כרוכים בדרגות חסר של פעילות האנזים והם כדלקמן: 25*, 21*, 16*, 15*, 14*, 13*, 12*, 11*, 6*, 5*, 4*, ,*3C ,*3D, *3A ,*3B ו-TPMT*2, ועוד 12 אללים החשודים כגורמים להפחתת רמת TPMT, והם כדלקמן: ,*17-20, *20, 22-24*, ו-TPMT*7-10 (על פי Krynetski וחב' ב-Proc Natl Acad Sci USA משנת 1995, Otterness וחב' ב-Clin Pharmacol Ther משנת 1997, Lindquist וחב' ב-Pharmacogenetics משנת 2004, Schaeffeler וחב' ב-Hum Mut משנת 2006 ו-Lindquist וחב' ב-Pharmacogenet Genomics משנת 2007).
רוב האללים הללו האחראיים לפעילות חסרה של TPMT הם נדירים, ובמקרים אחדים זוהו רק באנשים בודדים. בלבנים (caucasians), באסייתים ובאפרו-אמריקנים, 4 פולימורפיזמים אחראיים ל-80-95% מכלל המקרים של פעילות TPMT נמוכה, והם כדלקמן: TPMT*3A המאופיין על ידי מוטנט אללי כפול G460A על אקסון 7 ו-A719G על אקסון 10, (על פי Yates וחב' ב-Ann Intern Med משנת 1997, ו-Hon וחב' ב-Hum Mol Genet משנת 1999),TPMT*3B עם מוטציה G460A ו-TPMT*3C עם המוטציה A719G, ו-TPMT*2A עם מוטציה G238C על אקסון 5 (על פי Evans ב-Ther Drug Monit משנת 2004, ו-Yates וחב' ב-Ann Intern Med משנת 1997).
השימוש בבדיקות סריקה של TPMT
מטופלים עם חסר בפעילות TPMT נמצאים בסיכון מוגבר לפתח דיכוי של השורה המייאלואידית בהיותם מטופלים במינונים מקובלים של תכשירי thiopurine, ונרשמו אף מקרי מוות במצב זה (Clunie ו-Lennard ב-Rheumatology משנת 2004). במטופלים עם חסר האנזים, בדרך כלל מופיעה לאוּקוֹפּניה ימים אחדים לאחר הטיפול הראשון, אך תרחיש זה יכול להופיע גם לאחר פרק זמן ארוך יותר של חודש עד חודשיים (Anstey וחב' ב-Br J Dermatol, ו-Lennard ו-Lilleyman ב-Ther Drog Monit משנת 1996). על פי הנתונים של ה-MHRA הבריטי, אירעו בבריטניה בין השנים 1963 עד 2009 במטופלים ב-azathioprine עם חסר באנזים 138 מקרי מוות, 7 מקרי מוות במטופלים ב-mercaptopurine-6, ו-3 מקרי מוות במטופלים עם thioguanine-6.
מטופלים עם פעילות TPMT נמוכה שהם הטרוזיגוטיים לאללים מוטנטים של אנזים זה, הם בסיכון של 30-40% לפתח תופעות לא-רצויות בהיותם מטופלים במינון סטנדרטי של thiopurine, שכן באופן מעשי מטופלים אלה קיבלו מינון יתר של התרופה (Ansari וחב' ב-Aliment Pharmacol Ther משנת 2002, ו-Rolling וחב' ב- J Natl Cancer Inst משנת 1999, וכןCoenen וחב' ב-Gastroenterology משנת 2015). לעומתם, מטופלים עם רמות גבוהות מאוד של פעילות TPMT, עלולים לא להגיב למינונים המקובלים של thiopurines, והם אף בסכנה של נזק טוקסי לכבד כתוצאה מייצור מוגבר של מטבוליטים שהם תיופורינים שעברו מתילציה כגון מתיל-מרקפטופורין (MMP-6) על פי Lennard ו-Maddocks ב-J Pharm Pharmacol משנת 1983. בדיקת TPMT עשויה גם להפחית ריאקציות לא רצויות במטופלים עם פעילות TPMT נמוכה, ולשפר את יעילות התרופה במטופלים עם פעילות אולטרה-גבוהה של האנזים על ידי הפעלת מינון גבוה יותר של תכשיר.
המלצות עדכניות בבריטניה לגבי בדיקות סריקה של TPMT
השוואת ההנחיות לגבי טיפול ב-AZA בבריטניה מראה שוני בהמלצות לגבי מינון וניטור במפגעים השונים. לדוגמה, רק ההנחיות בתחום הדרמטולוגי ממליצות על מבדק מוקדם של TPMT והתאמת המינון על פי הסטאטוס של TPMT. בהנחיות להתנהלות במקרים של מחלות דלקתיות של המעי במבוגרים, לא מומלץ לבצע מבדק מוקדם של TPMT, זאת "כיוון שדורות של ניסיון מצאו ש-AZA בטיחותי בטיפולים במחלת קרוהן ובקוליטיס כיבית" (Carter וחב' ב-Gut משנת 2004). רשות הפורמולציות הבריטית (BNF), לא נותנת המלצות ספציפיות לגבי מבדק מוקדם של TPMT, אך היא מדגישה: " הסכנה ל-myelosuppression גדלה במטופלים עם פעילות TPMT נמוכה, במיוחד באותם מטופלים מאוד בודדים שהם הומוזיגוטים לפעילות אנזים נמוכה" ובמקרים אלה ממליצה הרשות הבריטית על התוויות-נגד במקרים של רגישות-יתר לטיפולים ב-AZA או ב-MP-6 (על פי Anon ב-BNM 58, London משנת 2009).
סקר לאומי בבריטניה של Fargher וחב' משנת 2007 ב-J Clin Pharm Ther, הראה ש-67% מהקלינאים הבריטים כן בדקו פעילות TPMT לפני התחלת טיפולים ב-AZA, כאשר בין הדרמטולוגים ההיענות הייתה הגבוהה ביותר (94%) ואילו בין הגסטרו-אנטרולוגים ההיענות הייתה של 60% ובקרב הראומטולוגים רק 47%. סקר זה מרמז על כך שרק בערך מחצית הרופאים הבריטיים מבצעים בדיקת TPMT לפני התחלת טיפולים. לאחרונה הופיעה בבריטניה הנחייה ב-Drugs & Therapeutics Bulletin משנת 2009, המבוססת על ניסוי TARGET שנערך במנצ'סטר והתפרסם באוקטובר 2009, על פיה כל המטופלים ב-azathioprine צריכים להיבדק לרמת TPMT כצעד של זהירות מתבקשת.
שיטות למדידת סריקה של TPMT
קיימות 2 אסטרטגיות לקבוע את הסטאטוס של TPMT, קביעת הפנוטיפ או קביעת הגנוטיפ. שתי הגישות לוקות גם בחסרונות והן מורכבות לביצוע מבחינה טכנית. ישנן מספר ערכות מסחריות זמינות, אם כי יש המשתמשים עדיין בשיטות ביתיות.
קביעת פנוטיפ של TPMT
פעילות TPMT באריתרוציטים נמצאה תואמת את זו שברקמות אחרות, כולל הכבד (Szumlanski וחב' ב-Pharmacogenetics משנת 1992, ו-Woodson וחב' ב-J Pharmacol Exp Ther משנת 1982). לכן למטרת phenotyping ניתן למדוד בפשטות פעילות TPMT על ידי אינקובציה של דם מלא או של תמצית (lysate) אריתרוציטים עם MP-6 או עם TG-6 עם תורם שייר מתילי דוגמת SAM או S-adenosyl-L-methionine ליצירת התוצרים מכילי שייר מתיל כגון MMP-6 או MTG-6 שהוא methylguanine-6 (על פי Weinshilbourn וחב' ב-Clin Chim Acta משנת 1978). תוצרים ממותלים אלה יכולים להתגלות במספר דרכים, כולל מדידה רדיוכימית, מס-ספקטרומטריה או על ידי HPLC על ידי גלאי בליעה (Anglicheau וחב' ב- J Chromatogr B Biomed Sci Appl משנת 2002), או על ידי גלאי פלואורסצנטי (Kroplin וחב' ב-Eur J Clin Pharmacol משנת 1998, ו-Ford וחב' ב-Ann Clin Biochem משנת 2006). כיום קיימת גם ערכה למדידת פעילות TPMT בשיטת ELISA.
יחידות המדידה של TPMT משתנות, מה שהביא לתחומי נורמה שונים בין המעבדות המבצעות בדיקה זו, אם כי באופן קלאסי פעילות האנזים מתייחסת למספר הכדוריות האדומות במבחנת הבדיקה או לרמת ההמוגלובין ב-lysate. פעילות TPMT יכולה לנבא בנבדקים תופעה של myelosuppression, אם כי נתוני רקע קדם-אנליטיים כגון משך השהות של הדגימה לפני ביצוע הבדיקה, יכולים להשפיע על פעילות האנזים, אם כי במקרה זה מדובר באנזים יציב יחסית המסוגל לשהות 7 ימים בטמפרטורת החדר ללא איבוד פעילות (Jeffray וחב' ב-Proc ACB Nat Meeting משנת 2004).
מדידת הפעילות של TPMT עלולה להיות קשה לשליטה, עם גורמים רבים המשפיעים על ריאקציית האנזים, כגון הריכוז והמקור של תורם המתיל SAM (על פי Ford וחב' ב-Ann Clin Biochem משנת 2009), טמפרטורת ומשך ההדגרה. גורמים משפיעים אלה עלולים לגרום לדיווח-יתר של תוצאות נמוכות כזובות. לא ברור עדיין אם גורמים-לא גנטיים כמן עיכוב על ידי תרופות או המצב הפיזיולוגי של הגוף בזמן ביצוע הבדיקה משפיעים באופן כללי על פעילות TPMT, או שהשפעה זו ספציפית לאיברים שונים (Ferroni וחב' ב-Eur J Clin Pharmacol משנת 1996). הכנה אופיינית של כדוריות אדומות למדידת TPMT כרוכה בשטיפות אחדות, שעשויות להרחיק תרופות מעכבות, אם כי פרוצדורה זו יכולה להפחית את המתאם בין רמת TPMT בכדוריות לבין זו הנמדדת באותו מטופל בכבד. יש להקפיד על כך שבמקרה של תרומת דם, כל מדידה של פעילות TPMT עלולה לא לשקף את רמת האנזים הזה במקבל תרומת הדם, אלא אם כן חולפים 120 יום מתאריך תרומת הדם (Ford וחב' ב-Clinical Case משנת 2004). יצוין שבכדוריות אדומות "מזדקנות" רמת פעילות האנזים TPMT נמוכה יחסית (Lennard וחב' ב-Br J Clin Pharmacol משנת 2001).
קביעת גנוטיפ של TPMT
קיימות דרכים אחדות לגילוי מוטציות בגן ל-TPMT שכוללות restriction digest (על פי Brouwer וחב' ב-Leukemia משנת 2001), שיטת SSCP או single strand conformational polymorphism (על פי Spire-Vayron de la Moureyre וחב' ב-Hum Mut משנת 1998), שיטת ARMS או amplification refractory mutation system (על פי Roberts וחב' ב-Clin Chim Acta משנת 2004), שיטת denaturing HPLC pyrosequencing (על פי Schaeffeler וחב' ב-Pharmacogenetics משנת 2004, ו-Haglund וחב' ב-Clin Chem משנת 2004), ושיטת היברידיזציה פלואורסצנטית (schutz וחב' ב- Clin Chem משנת 2000). חברת Qiagen מספקת ערכת real time artus TPMT LC PCR, לגילוי של *3A ,TPMT*2, *3B ו-*3C לשימוש במכשיר LightCycler.
יש לנקוט זהירות כאשר מתכננים primers עבור PCR לצורך אנליזה של TPMT, כיוון שישנם גם פסבדוגנים בלתי פעילים של TPMT על כרומוזום 18, שהם בעלי הומולוגיה של 96% עם הגן ל-TPMT (על פי Lee וחב' ב-Drug Metab Dispos משנת 1995). כיוון שפסבדו-גן בלתי פעיל זה של TPMT הוא חסר introns, נראה שלפחות primer אחד משלים את הרצף של ה-intron של TPMT, ומתגבר על הפרעה זו של הפסבדוגן.
שלא כמו בגישה הפנוטיפית, הגישה הגנוטיפית אינה מושפעת על ידי עירויי דם, או על ידי גורמים קדם-אנליטיים למרות שבמספר שיטות התוצאות מאוד תלויות בטיב ה-DNA בשימוש, וכן בטכניקת ה-restriction digest שהיא אמנם פשוטה לביצוע אך לא תמיד אמינה. במחקרים המוקדמים יותר, עיכול לא שלם של נקודת החיתוך על ידי Arc 1 בגלל נוכחות של מוטציית TPMT*3C, גרמה בדיווחי-יתר על מציאות של אללים מוטנטיים TPMT*B, שעה שלמעשה היה מדובר בנוכחות של האלל בעל המוטציה הכפולה TPMT*3A שהוא שכיח הרבה יותר (Ameyaw וחב' ב-Hum Mol Genet משנת 1999).
חיסרון עיקרי ברוב שיטות ה-genotyping הוא בכך שאין הן מזהות באיזה אלל מופיעה המוטציה. באופן היפותטי, מטופל עם גנוטיפ הומוזיגוטי לחסר פעילות TPMT, יכול להיות מוחמץ, לדוגמה, מטופל שהוא הטרוזיגוטי TPMT*1/*3A עם פעילות אנזים נמוכה, לא יכול להיות מובדל ממטופל עם סטאטוס של compound TPMT*3C/*3B heterozygous עם חסר בפעילות האנזים. ניתן להתגבר על מגבלה זו על ידי שימוש בשיטות בהן מככב RNA כגון אנליזה הידועה כ-multiplex induced heteroduplex, אך זאת רק כאשר DNA חסר באופן מוחלט, מה שקשה מאוד להשיג (Wood וחב' ב-Hum Mut משנת 2004).
סריקה של הגן השלם של TPMT שמקיפה באופן רוטיני את כל 29 האללים של TPMT, מסובכת מבחינה טכנית וגוזלת זמן רב. זאת בנוסף לשיקול שעדיין צריך להוכיח האם כל האללים הואריאנטים הללו אחראיים לחסר TPMT(על פי Tai וחב' ב-Am J Hum Genet משנת 1996, ו-Hamdan-Khali וחב' ב-Biochem Pharmacol משנת 2004). כיוון ש-TPMT*2, TPMT*3A ו-TPMT*3C מהווים 60-95% מהאללים המוטנטים לפעילות מופחתת של TPMTברוב האוכלוסיות, ה-genotyping שלTPMT מתבצע רק לאתר את המוטציות הללו. מעבדות Quest Diagnostics משתמשות בשיטת אמפליפיקציה של PCR למטרת genotyping של TPMT, ובעקבותיה SNPE או single nucleotide primer extension, לגילוי 4 הואריאנטים העיקריים של האנזים. בשיטת SNPE מכוונים לנוקלאוטידי המטרה 238, 460 ו-719, ולאחר מכן מתבצעת היברידיזציה על ידי קישור של אוליגו-נוקלאוטידים לחלקיקים זעירים (microspheres).
ה-FDA ממליץ לפני מתן טיפול ב-thiopurine לבצע בדיקת פנוטיפ או גנוטיפ של TPMT. לעומת זאת, ה-American College of Gastroenterology מעדיף דווקא את בדיקת הפנוטיפ של TPMT כיוון שמבדק זה נותן הערכה כמותית של פעילות האנזים במטופלים עם thiopurines במקרים של קוליטיס כיבית.
פתופיזיולוגיה
AZA, 6-MP ו-6-TG הם שלושה prodrugs בלתי-פעילים, המשמשים לטיפול במצבי מחלה מגוונים, שעוברים מטבוליזם על ידי 3 אנזימים שונים והופכים לשלושה נוקלאוטידים פעילים ביולוגית שונים של 6-thioguanine . התכשיר azathioprine (להלן AZA) עובר מטבוליזם והופך ל-6-MP, ואילו 6-MP מותמר ל-2 מטבוליטים בלתי-פעילים פרמאקולוגית, 6-thiouric acid על ידי האנזים xanthine oxidase, ו-6-methylmercapyourine (להלן 6-MMP) על ידי האנזים thiopurine S-methyltransferase (TPMT). מטופלים הומוזיגוטיים או compound heterozygous בהם פעילות האנזים TPMT נמוכה מאוד או חסרה לחלוטין, חשופים לפעילות טוקסית של תכשירים ממשפחת thiopurines במינונים קונבנציונאליים. מטופלים הטרוזיגוטים לפעילות האנזים חשופים לסיכון מוגבר לתופעות טוקסיות של תכשירי thiopurine, במינונים קונבנציונאליים. במטופלים ללא וואריאנטים עם מוטציות, תבוא לביטוי פעילות מלאה של האנזים TPMT, עם סיכון מקובל ונורמאלי לתופעות טוקסיות של thiopurine.
גנטיקה
הגן TPMT מועבר בהורשה אוטוזומאלית קו-דומיננטית. עד כה זוהו 29 אללים ואריאנטים של TPMT, שרובם נכרכו עם פעילות מופחתת של האנזים in vitro, אך רק אחדים מתוכם ידועים כבעלי השפעה קלינית (Ujiie וחב' ב-משנת Pharmacogenet Genomicsמשנת 2008(. הואריאנט השכיח ביותר באוכלוסייה הלבנה (5% מהלבנים נושאים אותו) הוא TPMT*3A, והוא כולל 2 שינויי קידוד בלתי-זהים: exon 7 A154T variant ו-exon 10 Y240C variant. הואריאנט השני הנפוץ ביותר TPMT*3C, מכיל רק את exon 10 variant, והוא שכיח יותר באוכלוסייה אסייתית (בשכיחות של 2%). הוואריאנט TPMT*3B הוא נדיר ומכיל רק את exon 7 variant (על פי Otterness וחב' ב- Clin Pharmacol Therמשנת 1997). גם הוואריאנט TPMT*2 או בכינויו האחר A80P, נדיר עם פעילות קטליטית מופחתת (Krynetski וחב' ב- Proc Natl Acad Sci USA משנת 1995. ואריאנטים אחרים, כמו TPMT*8 שכיחים יותר באוכלוסיות אפריקניות (בתדירות של 2% בערך) על פי Oliveira וחב' ב-Eur J Clin Pharmacol משנת 2007.
האללים הוואריאנטים עם פעילות מופחתת של האנזים אחראיים לכ-95% ממצבי פעילותו הנמוכה עד מתונה. בוואריאנט TPMT*3A, נוקלאוטיד G בעמדה 460 מותמר ל-A, וכך Ala בעמדה 154 מותמר ל-Thr. כמו כן הנוקלאוטיד A בעמדה 719 מותמר ל-G, וכך Tyr בעמדה 240 מותמר ל-Cys. בוואריאנט TPMT*2, נוקלאוטיד G בעמדה 238 מותמר ל-A, וכך Ala בעמדה 80 מותמר ל-Pro. בוואריאנט TPMT*3B, נוקלאוטיד G בעמדה 460, מותמר ל-A, וכך Ala בעמדה 154 מותמר ל-Thr. בוואריאנט TPMT*3C, נוקלאוטיד A בעמדה 719 מותמר ל-G, וכך Tyr בעמדה 240 מותמר ל-Cys.
מלבד הרקע הגנטי של הנבדק, ישנן סיבות נוספות לסכנה מוגברת של נזק טוקסי למח העצם (myelosuppression) כתוצאה מטיפול עם תכשירים תיו-פוריניים. אינטראקציות בין מספר תרופות עלולות לעכב את פעילות האנזים TPMT. בין התרופות הללו ניתן למנות את: א. תכשירי NSAIDs כגון ibuprofen, ketoprofen, naproxen ו- mefenamic acid; ב. תכשירים משתנים כגון furosemide ו-thiazides ; ג. תכשירים לטיפול בקוליטיס כיבית כגון sulfasalazine, mesalamine ו-olsalazine. ד. מעכבי חומצה בנזואית. לכן אין להשתמש בתרופות אלה לפחות 48 שעות לפני המבדק למדידת TPMT. למרות שבחינת הגנוטיפ של TPMT עשויה לנבא את הסיכון לדיכוי המייאלואידי, יש לבצע במקביל בדיקת CBC כוללת על מנת לאשש ממצא זה במהלך הטיפול בתכשירי thiopurine. למספר קטן של נבדקים יש רמות גבוהות של פעילות TPMT. משערים שבמקרם אלה יעילות הטיפול ב- thiopurine נמוכה יותר, אך לא קיימת עדיין הסכמה כיצד נתון זה צריך להתבטא בהנחיות הטיפול (ראו טבלה).
| פעילות TPMT גבוהה | פעילות TPMT תקינה | פעילות TPMT נמוכה | |
|---|---|---|---|
| >65 | 25-65 | <25 | יחידות/מיליליטר (U/mL) |
| כישלון טיפולי | סיכון נמוך של טוקסיות למח העצם | סיכון גבוה של טוקסיות למח העצם | כרוכה ב: |
| עשויה להידרש עלייה במינון מעבר למינון הסטנדרטי | אין | נדרשת הפחתה דרמטית במינון (ב-80 עד 90%) | תיקון מוצע של המינון |
בטבלה הבאה יש התייחסות ל-2 מטבוליטים של thiopurin שהתגלו בדם הנבדק ומשמעות ריכוזיהם:
| המטבוליט בכדוריות אדומות | טווח תרפויטי | משמעות התוצאות |
|---|---|---|
| 6-TGN | 230-400 pmol/8 x 108 RBC | ריכוז 6-TGN הנמוך מ-230 pmol/8 x 108 RBC, יכול להצביע על תגובה מופחתת לטיפול.
ריכוז 6-TGN הגבוה מ-400 pmol/8 x 108 RBC, יכול להצביע על סיכון מוגבר ללויקופניה. |
| 6-MMPN | <5700 pmol/8 x 108 RBC | ריכוז 6-MMPN הגבוה מ-5700 pmol/8 x 108 RBC, יכול להצביע על סיכון מוגבר לטוקסיות לכבד. |
אפידמיולוגיה
- תדירות האלל על בסיס אתני
| אתניות | TPMT *3C | TPMT *3B | TPMT *3A | TPMT *2 |
|---|---|---|---|---|
| אפריקאנית | 0.0495 | 0 | 0.00198 | 0.000792 |
| אסייתית | 0.0157 | 0 | 0.000112 | 0 |
| Caucasian | 0.004205 | 0.000461 | 0.0356 | 0.0019 |
| ים תיכונית | 0.00545 | 0.00426 | 0.0254 | 0.00408 |
| מקסיקנית | 0.00888 | 0.0069 | 0.0533 | 0.00592 |
| מזרח תיכונית | 0.00562 | 0.00562 | 0.0114 | 0.00749 |
- תרופות המדכאות את רמת הפעילות של TPMT
מתן סימולטני של allopurinol, naproxen, ibuprofen, ketoprofen, furosemide, sulfasalazine, mesalamine, olsalazine, mefenamic acid, מעכבי חומצה בנזואית ודיורטיקה מקבוצת התיאזידים.
- Genotyping של TPMT ברוק
יש למלא ברוק מבחנה בנפח של 2 מ"ל. השיטה הנהוגה לגילוי מוטציות בגן ל-TPMT כאשר החומר המתקבל הוא רוק, ידועה כ-PCR 5'-Nuclease End-point Allelic discrimination analysis.
הוראות לביצוע הבדיקה
אין כל הכנות מיוחדות של הנבדק לפני לקיחת הדם. לקיחת הדם צריכה להתבצע במבחנת ליתיום הפארין (פקק ירוק) או במבחנת ספירת דם (EDTA פקק סגלגל). אין לסרכז, ויש לאחסן את הדם המלא בקירור לפני שליחתו המיידית למעבדה בתנאי קירור. אין להקפיא את הדם. הדגימה יציבה בתנאי קירור (2-8 מעלות) למשך 6 ימים. דגימת דם המוליטית במיוחד יש לפסול. שיטת הבדיקה: Liquid Chromatography-Tandem Mass Spectrometry (LC-MS/MS).


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק