הבדלים בין גרסאות בדף "מחלות המטואונקולוגיות - טיפול אימונותרפי ב-Hemato-oncological diseases - immunotherapy with - CAR-T Cell"
(←ראו גם) |
|||
| (48 גרסאות ביניים של 3 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
| − | |||
{{מחלה | {{מחלה | ||
| − | |תמונה= | + | |תמונה=CAR T-cell Therapy.svg |
|כיתוב תמונה= | |כיתוב תמונה= | ||
| + | <div style="text-align: left; direction: ltr"> | ||
| + | Chimeric Antigen Receptor T Cell production and infusion <br>1. T cells are isolated from a patient's blood<br>2. A new gene encoding a chimeric antigen receptor are incorporated into the T cells<br>3. Engineered T cells now are now specific a desired target antigen<br>4. Engineered T cells are expanded in tissue culture<br>5. Engineered T cells are infused back into the patient | ||
| + | </div> | ||
|שם עברי=מחלות המטואונקולוגיות - טיפול אימונותרפי ב-CAR-T Cell | |שם עברי=מחלות המטואונקולוגיות - טיפול אימונותרפי ב-CAR-T Cell | ||
| − | |שם לועזי= | + | |שם לועזי=Hemato-oncological diseases - immunotherapy with - CAR-T Cell |
|שמות נוספים=CAR-T Cell Therapy - אימונותרפיה תאית פורצת דרך לטיפול במחלות המטואונקולוגיות | |שמות נוספים=CAR-T Cell Therapy - אימונותרפיה תאית פורצת דרך לטיפול במחלות המטואונקולוגיות | ||
|ICD-10= | |ICD-10= | ||
|ICD-9= | |ICD-9= | ||
|MeSH= | |MeSH= | ||
| − | |יוצר הערך=פרופסור ארנון נגלר | + | |יוצר הערך=נוצר על ידי פרופסור ארנון נגלר{{ש}}נערך ועודכן בספטמבר 2022 על ידי ד"ר אורי גרינבוים |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
| − | + | ==הקדמה - מהם תאי CAR-T== | |
| + | תאי Chimeric Antigen Receptor T , בקיצור: CAR-T הם תאי T, אשר עברו שינוי שמאפשר להם לזהות גידולים ולהתקיף אותם. תאי T הם תאים של מערכת החיסון (מקבוצת ה[[ספירת דם - Complete blood count#לימפוציטים (Lymphocytes)|לימפוציטים]]), אשר תפקידם הוא מלחמה בוירוסים, וכן בתאים עם [[סרטן|שינויים סרטניים]]. עם זאת, אצל חולי סרטן, תאי ה T אינם מזהים את תאי הסרטן, או שאינם מסוגלים לחסלם, ומחלת הסרטן ממשיכה להתפתח בגוף. | ||
| − | + | במהלך ייצור תאי CAR-T, נאספים לימפוציטים, מהמטופל, ואלו עוברים הנדסה גנטית במעבדה. לתאי ה-T מוכנס מקטע [[DNA]]{{כ}} (Deoxyribonucleic Acid) אשר גורם להם לבטא קולטן המזהה את הגידול, וגם כאשר הם מתרבים, תאי הבת מבטאים את הקולטן. כאשר הם מושתלים בחזרה לחולה- הם מתקיפים את הגידול ומחסלים אותו (איור 1). | |
| − | + | בתהליך משתמשים בתאי ה-T של החולים, ולכן זהו טיפול מותאם אישית, הדורש ייצור ספציפי של התאים לכל מטופל. עם זאת, הקולטן הוא קולטן כללי, המתאים למטרה שמשותפת בדרל כלל לכל הגידולים מאותו סוג. לדוגמה: קיימים טיפולי CAR-T כנגד [[לימפומה]] ו[[לוקמיה]] של תאי B – המציגים כולם חלבון בשם [[CD19]]. תאי ה CAR-T מציגים קולטן שמזהה את ה-CD19 על הגידול, וכך הם מצליחים לזהות ולהתקיף את תאי הגידול. מאושרים בעולם טיפולי CAR-T כנגד מטרה נוספת: BCMA{{כ}} (B-cell Maturation Antigen), שנמצא על תאי [[מיאלומה נפוצה - Multiple myeloma|מיילומה נפוצה]], ובתהליכי פיתוח סוגים רבים נוספים של קולטנים המכוונים כנגד מטרות שונות על מגוון גידולים. | |
| − | + | התאים פותחו לראשונה על יד צוותו של פרופ' זליג אשחר במכון ויצמן, ובהמשך עבר הפיתוח לארצות הברית, שם התבצעו רוב המחקרים שהובילו לאישור ורישום התכשירים השונים. | |
| − | + | [[קובץ:CART 1.png|ממוזער|מרכז|600 פיקסלים|איור 1.]] | |
| − | |||
| − | + | ==מהלך הטיפול== | |
| + | התאים שישמשו לייצור CAR-T נאספים במשך מספר שעות על ידי מכונת אפרזיס, ונשלחים למרכזי הייצור (איור 2). הטיפולים המסחריים המאושרים בישראל מיוצרים מחוץ לישראל, אך למספר מרכזים רפואיים קיימת גם מעבדה המאפשרת ייצור עצמי, ללא משלוח מחוץ לישראל, בדרך כלל במסגרת מחקרים קליניים על טיפולים חדשים או התוויות חדשות. | ||
| − | + | בזמן ההמתנה לייצור התאים, שאורכת (בטיפולים המסחריים) כ-3–4 שבועות, לעיתים יש צורך במתן טיפול מגשר, לשליטה במחלה עד להגעת הטיפול. | |
| − | + | כ-5 ימים לפני הטיפול, המטופל מתאשפז ומקבל [[כימותרפיה]] לשלושה ימים. מטרת הכימותרפיה אינה כנגד הגידול עצמו, אלא לצורך הורדת כמות הלימפוציטים בגופו של המטופל. על ידי כך, מתאפשרת קליטה של תאי ה CAR-T, אשר מתרבים בצורה יעילה עם התאוששות שאר הלימפוציטים בגוף. לאחר יומיים הפסקה מסיום הכימותרפיה, מתבצעת ההשתלה, בה התאים ניתנים בעירוי הדומה למנת דם, במשך כ 15–30 דקות, תוך מעקב וניטור המטופל. | |
| − | |||
| − | + | בהמשך, במשך כ-10 ימים, המטופל נשאר בהשגחה למעקב וטיפול בתופעות הלוואי שעלולות לקרות לאחר הטיפול. הטיפול ב CAR-T בדרך כלל חד פעמי, ואם המטופל מגיב, אין צורך בטיפולים נוספים למחלתו, אלא במעקב בלבד. | |
| − | + | [[קובץ:CART 2.png|ממוזער|מרכז|600 פיקסלים|איור 2]] | |
| − | |||
| − | + | ==תופעות הלוואי של הטיפול== | |
| + | לכל סוג CAR-T (המתאפיין בקולטן שהוא מציג), ישנו פרופיל תופעות לוואי מעט שונה. ההסבר להלן מתייחס בעיקר לתאים עם קולטנים המזהים את חלבון ה-CD19 ומשמשים לטיפול בגידולים של תאי B. שתי תופעות הלוואי העיקריות של הטיפול ב CAR-T הן: | ||
| − | == | + | ===סערת ציטוקינים (Cytokine Release Syndrome ,CRS)=== |
| − | + | כאשר מזהים תאי CAR-T את תאי הגידול, הם מתחילים להתרבות במהירות, תוך שחרור חומרים רבים המעוררים ומגייסים תאים אחרים של מערכת החיסון. חומרים אלו, המכונים ציטוקינים, גורמים לשפעול של תאים נוספים, המפרישים גם הם ציטוקינים, ונוצרת תגובה חיסונית חזקה, ולעיתים סוערת. התגובה מתבטאת כמעט תמיד בחום גבוה, ולעיתים (בדומה לתגובה לזיהום), יכולה אף לגרום לפגיעה נוספת באיברים שונים בגוף. במקרים קשים יותר, תיתכן ירידת לחץ דם או חמצון הדם, הדורשת טיפול אינטנסיבי למניעת נזק בלתי הפיך. קיימים תכשירים שנועדו לחסום את פעולת הציטוקינים, תוך המשך פעולת תאי ה-CAR-T כנגד הגידול. התרופה העיקרית בשימוש היא [[Tocilizumab]] ({{כ}}[[Actemra]]), שגורמת להפחתת סערת הציטוקינים על ידי חסימת Interleukin-6{{כ}} ([[אינטרלויקין 6 Interleukin|IL-6]]), אחד הציטוקינים שמובילים את התגובה החיסונית. במקרה של CRS קשה יותר, נעשה שימוש גם [[סטרואידים|בסטרואידים]], המפחיתים את עוצמת הפעילות של תאי ה T עד לרגיעה בתגובה החיסונית. | |
| − | + | ===רעילות נוירולוגית (ICANS, {{כ}}Immune effector Cell-Associated Neurotoxicity syndrome )=== | |
| + | הציטוקינים שמופרשים על ידי התאים, יכולים גם להשפיע על מערכת העצבים המרכזית. במקרה זה, הם עלולים לגרום ל[[בלבול]], [[ירידה בקואורדינציה]] וקושי בכתיבה או [[קושי בריכוז|ריכוז]]. לעיתים רחוקות יותר חלה ירידה במצב ההכרה, ולעיתים נדירות אף הופעת [[פרכוסים]]. הטיפול בתופעות אלו הוא בדרך כלל במתן סטרואידים לזמן קצוב, להורדת הפעילות החיסונית עד לשיפור בתסמינים. | ||
| − | + | שתי תופעות אלו- CRS ו-ICANS, נשלטות כמעט תמיד על ידי הטיפול התומך, ונדיר שנגרם נזק בלתי הפיך בגללן. לרוב, התופעות חולפות לאחר מספר ימים, והמטופל משתחרר לביתו. | |
| − | + | תופעות נוספות בעקבות הטיפול יכולות להיות ירידה מתמשכת בספירות הדם (בעיקר ב[[נויטרופילים]]) עקב הפעילות החיסונית, וכן לעיתים נדירות שפעול-יתר של מערכת החיסון (HLH). גם הסיכון לזיהומים גבוה לאחר טיפול CAR-T ולעיתים קרובות דורש טיפול מונע לזיהומים למשך תקופה ממושכת. | |
| − | == | + | ==מחקרים ראשונים== |
| + | לאחר פיתוח ראשוני במכון ויצמן, עבר המשך הפיתוח והמחקר הקליני לארצות הברית. פותחו דורות מתקדמים יותר של תאים, המסוגלים להתרבות בגוף ביעילות רבה, ואף להישאר פעילים זמן ממושך יותר. הטיפולים ניתנו לראשונה לחולי [[CLL]]{{כ}} (Chronic Lymphocytic Leukemia) ו-[[ALL]]{{כ}} (Acute Lymphocytic Leukemia), ובהמשך ל[[לימפומה שאינה הודג'קין - Non-hodgkin lymphoma|לימפומה של תאי B]], ומיאלומה נפוצה. קיימים מחקרים רבים ברחבי העולם, לסוגי גידולים שונים, מטרות שונות, ואף תאים מתורם זר שיקלו על הייצור והאספקה של התאים. | ||
| + | |||
| + | גם בגידולים סולידיים ישנם מחקרים ברחבי העולם בטיפול CAR-T. המחקרים הראשונים לא הראו יעילות משמעותית, ונכון למועד כתיבת מאמר זה, נמצאים בפיתוח ראשוני תאים שיוכלו להתגבר על דחיה חיסונית, ומחסומים שונים של תאי הגידול בפני פעילות תאי CAR-T. | ||
| + | |||
| + | ==טיפולים המאושרים בסל הבריאות בישראל== | ||
| + | נכון ל-2022, מאושרים בסל הבריאות בישראל הטיפול וההתוויות הבאות: | ||
| + | *[[Tisagenlecleucel]] ({{כ}}[[t:Kymriah|Kymriah]]): מיוצרת על ידי חברת Novartis. רשומה בסל הבריאות ל[[Large B cell lymphoma|לימפומה של תאי B גדולים]], לקו שלישי, וכן ל[[לויקמיה של תאי B]] אצל ילדים ומבוגרים צעירים (עד גיל 26) לקו שלישי | ||
| + | *[[Axicabtagene ciloleucel]] ({{כ}}[[t:Yescarta|Yescarta]]): מיוצרת על ידי חברת Gilead. רשומה בסל הבריאות ללימפומה של תאי B גדולים, לקו שלישי | ||
| + | *[[Brexucabtagene autoleucel]] ({{כ}}[[t:Tecartus|Tecartus]]): מיוצרת על ידי חברת Gilead. מאושרת ללימפומה של תאי מעטפת ([[Mantle cell lymphoma]]) בקו שלישי | ||
| + | |||
| + | הטיפול ב-CAR-T ניתן בישראל במרכזי ההשתלות איכילוב, בילינסון, הדסה, סורוקה, רמב"ם ותל השומר. בחלק מהמרכזים ישנם מחקרים על מתן CAR-T בייצור מקומי שלא בהתוויות המאושרות בסל הבריאות, כגון במיאלומה נפוצה, גידולים אחרים של תאי B, או קווים מוקדמים יותר. | ||
| + | ==הטיפולים המאושרים ב FDA== | ||
| + | רשות התרופות האמריקאית, ה-FDA, אישרה טיפולים נוספים בטכנולוגית CAR-T. סביר כי רבים מטיפולים אלו יאושרו גם בסל הבריאות הישראלי בשנים הקרובות. הטיפול המאושרים נכון ל-2022 ב-FDA{{כ}} (Food and Drug Administration) הם:{{ש}} | ||
| + | {| class="wikitable" | ||
| + | !שם מסחרי!!שם גנרי!!חלבון המטרה!!התוויה ואוכלוסייה!!קו טיפול | ||
| + | |- | ||
| + | |rowspan="3"|Tisagenlecleucel | ||
| + | |rowspan="3"|Kymriah | ||
| + | |rowspan="3"|CD19 | ||
| + | |לויקמיה של תאי B- ילדים ומבוגרים צעירים||3 ומעלה | ||
| + | |- | ||
| + | |לימפומה של תאי B גדולים||3 ומעלה | ||
| + | |- | ||
| + | |לימפומה פוליקולרית||3 ומעלה | ||
| + | |- | ||
| + | |rowspan="2"|Axicabtagene ciloleucel | ||
| + | |rowspan="2"|Yescarta | ||
| + | |rowspan="2"|CD19 | ||
| + | |לימפומה של תאי B גדולים||2 ומעלה | ||
| + | |- | ||
| + | |לימפומה פוליקולרית||3 ומעלה | ||
| + | |- | ||
| + | |Lisocabtagene maraleucel||Breyanzi||CD19||לימפומה של תאי B גדולים||2 ומעלה | ||
| + | |- | ||
| + | |rowspan="2"|Brexucabtagene autoleucel | ||
| + | |rowspan="2"|Tecartus | ||
| + | |rowspan="2"|CD19 | ||
| + | |לויקמיה של תאי B - מבוגרים||3 ומעלה | ||
| + | |- | ||
| + | |לימפומה של תאי המעטפת||3 ומעלה | ||
| + | |- | ||
| + | |Idecabtagene vicleucel||Abecma||BCMA||מיאלומה נפוצה||לאחר שימוש ב 4 תרופות קודמות | ||
| + | |- | ||
| + | |Ciltacabtagene autoleucel||Carvykti||BCMA||מיאלומה נפוצה||לאחר שימוש ב 4 תרופות קודמות | ||
| + | |} | ||
| + | |||
| + | ==פיתוחים עתידיים== | ||
| + | טכנולוגית CAR-T מתפתחת בקצב מסחרר, ונמצאת בפיתוח למגוון רחב של מחלות. מעבר להתוויות הנזכרות לעיל, במחקרים קליניים נמצאים תאי CAR-T כנגד לימפומה של תאי T,{{כ}} Hodgkin, וכן גידולים סולידיים רבים. במחקרים טרום קליניים נבדקת האפשרות לדורות מתקדמים של CAR-T שיכולים להפריש חומרים המעודדים את פעילות התאים, או פוגעים ביכולת הגידול להתחמק מתאי CAR-T. בנוסף נבדקים כיווני פעולה נוספים של התאים, כנגד [[מחלות אוטו-אימוניות]], [[אי ספיקת לב]], ומחלות נוספות. | ||
| − | + | הטיפול ב CAR-T הביא למהפכה בטיפול בסרטן, ובפרט בגידולים המטולוגים. על אף אתגרים רבים כגון תופעות לוואי סוערות וייחודיות, וכן עלויות גבוהות של התכשירים, הטיפול צפוי להיות נפוץ יותר ויותר, ולהתרחב להתוויות נוספות, וכך לאפשר מתן טיפול מתקדם ויעיל לחולים רבים. | |
| + | ==ביבליוגרפיה== | ||
| + | <div style="text-align: left; direction: ltr"> | ||
| + | #IEC Therapy Toxicity Assessment and Management (also known as CARTOX) – Adult- version 4 (approved 5/2020). Downloaded on 05/09/22 | ||
| + | #ASTCT Consensus Grading for Cytokine Release Syndrome and Neurologic Toxicity Associated with Immune Effector Cells, Lee, Daniel W. et al, Biology of Blood and Marrow Transplantation, Volume 25, Issue 4, 625 - 638 | ||
| + | #FDA package inserts for Yescarta and Kymriah | ||
| + | #How I Manage: Pathophysiology and Management of Toxicity of Chimeric Antigen Receptor T-Cell Therapies, Patrick M. Reagan and Sattva S. Neelapu, Journal of Clinical Oncology 2021 39:5, 456-466 | ||
| + | #Use of Chimeric Antigen Receptor T Cell Therapy in Clinical Practice for Relapsed/Refractory Aggressive B Cell Non-Hodgkin Lymphoma: An Expert Panel Opinion from the American Society for Transplantation and Cellular Therapy. Jain T, Bar M, Kansagra AJ, Chong EA, Et al. Biol Blood Marrow Transplant. 2019 Dec;25(12):2305-2321. | ||
| + | #Efficacy and safety of CD19-directed CAR-T cell therapies in patients with relapsed/refractory aggressive B-cell lymphomas: Observations from the JULIET, ZUMA-1, and TRANSCEND trials. Westin, JR, Kersten, MJ, Salles, G, et al. Am J Hematol. 2021; 96( 10): 1295- 1312. | ||
| + | </div> | ||
| + | ==ראו גם== | ||
| + | '''*למידע וכתבות נוספות בנושא, אנא כנסו [https://www.mymed.co.il/indication/lymphoma?utm_source=wikiref&utm_medium=link&utm_campaign=onc_lymphoma_lymphoma_wikirefua&utm_content=lymphoma_wikirefua ללינק]''' | ||
| + | {{שש}} | ||
| + | {{ייחוס|פרופסור ארנון נגלר, מומחה ברפואה פנימית והמטולוגיה, מנהל המערך ההמטולוגי, השתלת מח עצם ובנק דם חבל הטבור, המרכז הרפואי שיבא. נערך ועודכן בספטמבר 2022 על ידי ד"ר אורי גרינבוים, אחראי תחום טיפולים תאיים בסרטן, המרכז הרפואי האוניברסיטאי סורוקה}} | ||
| + | |||
<center>'''פורסם ב[http://medicalmagazines.co.il/issue16/index.html?r=19 מגזין מדיק לסל שירותי הבריאות 2019], נובמבר 2018'''</center> | <center>'''פורסם ב[http://medicalmagazines.co.il/issue16/index.html?r=19 מגזין מדיק לסל שירותי הבריאות 2019], נובמבר 2018'''</center> | ||
| − | |||
| − | |||
[[קטגוריה:המטולוגיה]] | [[קטגוריה:המטולוגיה]] | ||
גרסה אחרונה מ־15:46, 18 באוקטובר 2022
הקדמה - מהם תאי CAR-T
תאי Chimeric Antigen Receptor T , בקיצור: CAR-T הם תאי T, אשר עברו שינוי שמאפשר להם לזהות גידולים ולהתקיף אותם. תאי T הם תאים של מערכת החיסון (מקבוצת הלימפוציטים), אשר תפקידם הוא מלחמה בוירוסים, וכן בתאים עם שינויים סרטניים. עם זאת, אצל חולי סרטן, תאי ה T אינם מזהים את תאי הסרטן, או שאינם מסוגלים לחסלם, ומחלת הסרטן ממשיכה להתפתח בגוף.
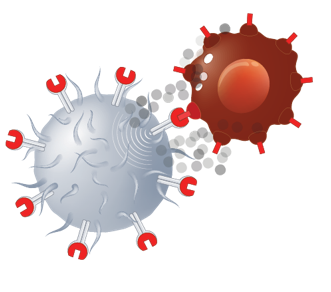
במהלך ייצור תאי CAR-T, נאספים לימפוציטים, מהמטופל, ואלו עוברים הנדסה גנטית במעבדה. לתאי ה-T מוכנס מקטע DNA (Deoxyribonucleic Acid) אשר גורם להם לבטא קולטן המזהה את הגידול, וגם כאשר הם מתרבים, תאי הבת מבטאים את הקולטן. כאשר הם מושתלים בחזרה לחולה- הם מתקיפים את הגידול ומחסלים אותו (איור 1).
בתהליך משתמשים בתאי ה-T של החולים, ולכן זהו טיפול מותאם אישית, הדורש ייצור ספציפי של התאים לכל מטופל. עם זאת, הקולטן הוא קולטן כללי, המתאים למטרה שמשותפת בדרל כלל לכל הגידולים מאותו סוג. לדוגמה: קיימים טיפולי CAR-T כנגד לימפומה ולוקמיה של תאי B – המציגים כולם חלבון בשם CD19. תאי ה CAR-T מציגים קולטן שמזהה את ה-CD19 על הגידול, וכך הם מצליחים לזהות ולהתקיף את תאי הגידול. מאושרים בעולם טיפולי CAR-T כנגד מטרה נוספת: BCMA (B-cell Maturation Antigen), שנמצא על תאי מיילומה נפוצה, ובתהליכי פיתוח סוגים רבים נוספים של קולטנים המכוונים כנגד מטרות שונות על מגוון גידולים.
התאים פותחו לראשונה על יד צוותו של פרופ' זליג אשחר במכון ויצמן, ובהמשך עבר הפיתוח לארצות הברית, שם התבצעו רוב המחקרים שהובילו לאישור ורישום התכשירים השונים.
מהלך הטיפול
התאים שישמשו לייצור CAR-T נאספים במשך מספר שעות על ידי מכונת אפרזיס, ונשלחים למרכזי הייצור (איור 2). הטיפולים המסחריים המאושרים בישראל מיוצרים מחוץ לישראל, אך למספר מרכזים רפואיים קיימת גם מעבדה המאפשרת ייצור עצמי, ללא משלוח מחוץ לישראל, בדרך כלל במסגרת מחקרים קליניים על טיפולים חדשים או התוויות חדשות.
בזמן ההמתנה לייצור התאים, שאורכת (בטיפולים המסחריים) כ-3–4 שבועות, לעיתים יש צורך במתן טיפול מגשר, לשליטה במחלה עד להגעת הטיפול.
כ-5 ימים לפני הטיפול, המטופל מתאשפז ומקבל כימותרפיה לשלושה ימים. מטרת הכימותרפיה אינה כנגד הגידול עצמו, אלא לצורך הורדת כמות הלימפוציטים בגופו של המטופל. על ידי כך, מתאפשרת קליטה של תאי ה CAR-T, אשר מתרבים בצורה יעילה עם התאוששות שאר הלימפוציטים בגוף. לאחר יומיים הפסקה מסיום הכימותרפיה, מתבצעת ההשתלה, בה התאים ניתנים בעירוי הדומה למנת דם, במשך כ 15–30 דקות, תוך מעקב וניטור המטופל.
בהמשך, במשך כ-10 ימים, המטופל נשאר בהשגחה למעקב וטיפול בתופעות הלוואי שעלולות לקרות לאחר הטיפול. הטיפול ב CAR-T בדרך כלל חד פעמי, ואם המטופל מגיב, אין צורך בטיפולים נוספים למחלתו, אלא במעקב בלבד.
תופעות הלוואי של הטיפול
לכל סוג CAR-T (המתאפיין בקולטן שהוא מציג), ישנו פרופיל תופעות לוואי מעט שונה. ההסבר להלן מתייחס בעיקר לתאים עם קולטנים המזהים את חלבון ה-CD19 ומשמשים לטיפול בגידולים של תאי B. שתי תופעות הלוואי העיקריות של הטיפול ב CAR-T הן:
סערת ציטוקינים (Cytokine Release Syndrome ,CRS)
כאשר מזהים תאי CAR-T את תאי הגידול, הם מתחילים להתרבות במהירות, תוך שחרור חומרים רבים המעוררים ומגייסים תאים אחרים של מערכת החיסון. חומרים אלו, המכונים ציטוקינים, גורמים לשפעול של תאים נוספים, המפרישים גם הם ציטוקינים, ונוצרת תגובה חיסונית חזקה, ולעיתים סוערת. התגובה מתבטאת כמעט תמיד בחום גבוה, ולעיתים (בדומה לתגובה לזיהום), יכולה אף לגרום לפגיעה נוספת באיברים שונים בגוף. במקרים קשים יותר, תיתכן ירידת לחץ דם או חמצון הדם, הדורשת טיפול אינטנסיבי למניעת נזק בלתי הפיך. קיימים תכשירים שנועדו לחסום את פעולת הציטוקינים, תוך המשך פעולת תאי ה-CAR-T כנגד הגידול. התרופה העיקרית בשימוש היא Tocilizumab (Actemra), שגורמת להפחתת סערת הציטוקינים על ידי חסימת Interleukin-6 (IL-6), אחד הציטוקינים שמובילים את התגובה החיסונית. במקרה של CRS קשה יותר, נעשה שימוש גם בסטרואידים, המפחיתים את עוצמת הפעילות של תאי ה T עד לרגיעה בתגובה החיסונית.
רעילות נוירולוגית (ICANS, Immune effector Cell-Associated Neurotoxicity syndrome )
הציטוקינים שמופרשים על ידי התאים, יכולים גם להשפיע על מערכת העצבים המרכזית. במקרה זה, הם עלולים לגרום לבלבול, ירידה בקואורדינציה וקושי בכתיבה או ריכוז. לעיתים רחוקות יותר חלה ירידה במצב ההכרה, ולעיתים נדירות אף הופעת פרכוסים. הטיפול בתופעות אלו הוא בדרך כלל במתן סטרואידים לזמן קצוב, להורדת הפעילות החיסונית עד לשיפור בתסמינים.
שתי תופעות אלו- CRS ו-ICANS, נשלטות כמעט תמיד על ידי הטיפול התומך, ונדיר שנגרם נזק בלתי הפיך בגללן. לרוב, התופעות חולפות לאחר מספר ימים, והמטופל משתחרר לביתו.
תופעות נוספות בעקבות הטיפול יכולות להיות ירידה מתמשכת בספירות הדם (בעיקר בנויטרופילים) עקב הפעילות החיסונית, וכן לעיתים נדירות שפעול-יתר של מערכת החיסון (HLH). גם הסיכון לזיהומים גבוה לאחר טיפול CAR-T ולעיתים קרובות דורש טיפול מונע לזיהומים למשך תקופה ממושכת.
מחקרים ראשונים
לאחר פיתוח ראשוני במכון ויצמן, עבר המשך הפיתוח והמחקר הקליני לארצות הברית. פותחו דורות מתקדמים יותר של תאים, המסוגלים להתרבות בגוף ביעילות רבה, ואף להישאר פעילים זמן ממושך יותר. הטיפולים ניתנו לראשונה לחולי CLL (Chronic Lymphocytic Leukemia) ו-ALL (Acute Lymphocytic Leukemia), ובהמשך ללימפומה של תאי B, ומיאלומה נפוצה. קיימים מחקרים רבים ברחבי העולם, לסוגי גידולים שונים, מטרות שונות, ואף תאים מתורם זר שיקלו על הייצור והאספקה של התאים.
גם בגידולים סולידיים ישנם מחקרים ברחבי העולם בטיפול CAR-T. המחקרים הראשונים לא הראו יעילות משמעותית, ונכון למועד כתיבת מאמר זה, נמצאים בפיתוח ראשוני תאים שיוכלו להתגבר על דחיה חיסונית, ומחסומים שונים של תאי הגידול בפני פעילות תאי CAR-T.
טיפולים המאושרים בסל הבריאות בישראל
נכון ל-2022, מאושרים בסל הבריאות בישראל הטיפול וההתוויות הבאות:
- Tisagenlecleucel (Kymriah): מיוצרת על ידי חברת Novartis. רשומה בסל הבריאות ללימפומה של תאי B גדולים, לקו שלישי, וכן ללויקמיה של תאי B אצל ילדים ומבוגרים צעירים (עד גיל 26) לקו שלישי
- Axicabtagene ciloleucel (Yescarta): מיוצרת על ידי חברת Gilead. רשומה בסל הבריאות ללימפומה של תאי B גדולים, לקו שלישי
- Brexucabtagene autoleucel (Tecartus): מיוצרת על ידי חברת Gilead. מאושרת ללימפומה של תאי מעטפת (Mantle cell lymphoma) בקו שלישי
הטיפול ב-CAR-T ניתן בישראל במרכזי ההשתלות איכילוב, בילינסון, הדסה, סורוקה, רמב"ם ותל השומר. בחלק מהמרכזים ישנם מחקרים על מתן CAR-T בייצור מקומי שלא בהתוויות המאושרות בסל הבריאות, כגון במיאלומה נפוצה, גידולים אחרים של תאי B, או קווים מוקדמים יותר.
הטיפולים המאושרים ב FDA
רשות התרופות האמריקאית, ה-FDA, אישרה טיפולים נוספים בטכנולוגית CAR-T. סביר כי רבים מטיפולים אלו יאושרו גם בסל הבריאות הישראלי בשנים הקרובות. הטיפול המאושרים נכון ל-2022 ב-FDA (Food and Drug Administration) הם:
| שם מסחרי | שם גנרי | חלבון המטרה | התוויה ואוכלוסייה | קו טיפול |
|---|---|---|---|---|
| Tisagenlecleucel | Kymriah | CD19 | לויקמיה של תאי B- ילדים ומבוגרים צעירים | 3 ומעלה |
| לימפומה של תאי B גדולים | 3 ומעלה | |||
| לימפומה פוליקולרית | 3 ומעלה | |||
| Axicabtagene ciloleucel | Yescarta | CD19 | לימפומה של תאי B גדולים | 2 ומעלה |
| לימפומה פוליקולרית | 3 ומעלה | |||
| Lisocabtagene maraleucel | Breyanzi | CD19 | לימפומה של תאי B גדולים | 2 ומעלה |
| Brexucabtagene autoleucel | Tecartus | CD19 | לויקמיה של תאי B - מבוגרים | 3 ומעלה |
| לימפומה של תאי המעטפת | 3 ומעלה | |||
| Idecabtagene vicleucel | Abecma | BCMA | מיאלומה נפוצה | לאחר שימוש ב 4 תרופות קודמות |
| Ciltacabtagene autoleucel | Carvykti | BCMA | מיאלומה נפוצה | לאחר שימוש ב 4 תרופות קודמות |
פיתוחים עתידיים
טכנולוגית CAR-T מתפתחת בקצב מסחרר, ונמצאת בפיתוח למגוון רחב של מחלות. מעבר להתוויות הנזכרות לעיל, במחקרים קליניים נמצאים תאי CAR-T כנגד לימפומה של תאי T, Hodgkin, וכן גידולים סולידיים רבים. במחקרים טרום קליניים נבדקת האפשרות לדורות מתקדמים של CAR-T שיכולים להפריש חומרים המעודדים את פעילות התאים, או פוגעים ביכולת הגידול להתחמק מתאי CAR-T. בנוסף נבדקים כיווני פעולה נוספים של התאים, כנגד מחלות אוטו-אימוניות, אי ספיקת לב, ומחלות נוספות.
הטיפול ב CAR-T הביא למהפכה בטיפול בסרטן, ובפרט בגידולים המטולוגים. על אף אתגרים רבים כגון תופעות לוואי סוערות וייחודיות, וכן עלויות גבוהות של התכשירים, הטיפול צפוי להיות נפוץ יותר ויותר, ולהתרחב להתוויות נוספות, וכך לאפשר מתן טיפול מתקדם ויעיל לחולים רבים.
ביבליוגרפיה
- IEC Therapy Toxicity Assessment and Management (also known as CARTOX) – Adult- version 4 (approved 5/2020). Downloaded on 05/09/22
- ASTCT Consensus Grading for Cytokine Release Syndrome and Neurologic Toxicity Associated with Immune Effector Cells, Lee, Daniel W. et al, Biology of Blood and Marrow Transplantation, Volume 25, Issue 4, 625 - 638
- FDA package inserts for Yescarta and Kymriah
- How I Manage: Pathophysiology and Management of Toxicity of Chimeric Antigen Receptor T-Cell Therapies, Patrick M. Reagan and Sattva S. Neelapu, Journal of Clinical Oncology 2021 39:5, 456-466
- Use of Chimeric Antigen Receptor T Cell Therapy in Clinical Practice for Relapsed/Refractory Aggressive B Cell Non-Hodgkin Lymphoma: An Expert Panel Opinion from the American Society for Transplantation and Cellular Therapy. Jain T, Bar M, Kansagra AJ, Chong EA, Et al. Biol Blood Marrow Transplant. 2019 Dec;25(12):2305-2321.
- Efficacy and safety of CD19-directed CAR-T cell therapies in patients with relapsed/refractory aggressive B-cell lymphomas: Observations from the JULIET, ZUMA-1, and TRANSCEND trials. Westin, JR, Kersten, MJ, Salles, G, et al. Am J Hematol. 2021; 96( 10): 1295- 1312.
ראו גם
*למידע וכתבות נוספות בנושא, אנא כנסו ללינק
המידע שבדף זה נכתב על ידי פרופסור ארנון נגלר, מומחה ברפואה פנימית והמטולוגיה, מנהל המערך ההמטולוגי, השתלת מח עצם ובנק דם חבל הטבור, המרכז הרפואי שיבא. נערך ועודכן בספטמבר 2022 על ידי ד"ר אורי גרינבוים, אחראי תחום טיפולים תאיים בסרטן, המרכז הרפואי האוניברסיטאי סורוקה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק