מחלת הנסן - Hansen's disease
| מחלת הנסן | ||
|---|---|---|
| Hansen's disease | ||
| ||
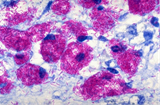
Mycobacterium Leprae - חיידק מחלת הנסן
בצביעה מיקרוסקופית בשיטת Ziehl–Neelsen | ||
| שמות נוספים | צרעת/Leprosy | |
| ICD-10 | Chapter A 30. | |
| ICD-9 | 030 | |
| MeSH | D007918 | |
| יוצר הערך | ד"ר ליאון גלעד | |
מחלת הנסן (Hansen's disease) (צרעת, בלטינית: Leprosy) היא אחת המחלות העתיקות ביותר הידועות למין האנושי. על פי נתוני ארגון הבריאות העולמי (World Health Organization, WHO), בשנת 2006, הושגו יעדי המערכה למיגור המחלה והומלץ לשלב את הטיפול בחולי הנסן במסגרת מערכות הבריאות הרגילות על ידי רופאי העור, שכן באופן טבעי, רופאי העור צפויים להיות הראשונים שיפגשו בחולים עם הופעת מחלתם. בקרב ציבור המומחים למחלה קיימת מחלוקת קשה ביחס לנתוני ארגון הבריאות העולמי ויש הטוענים שהם מושפעים משיקולים של כלכלת בריאות ופוליטיקה.
מבוא
מחלת הנסן, היא אחת המחלות העתיקות ביותר הידועות למין האנושי. העדויות המוקדמות ביותר לקיומה מופיעות בכתבים מהמאות השישית והרביעית לפני הספירה, מהודו וסין. במחקר בשיטות מתקדמות של ביולוגיה מולקולארית (Molecular biology) שהתפרסם לאחרונה, נמצאו ראיות המצביעות על אפשרות כי מקור המחלה הוא במזרח אפריקה ולא במזרח הרחוק[1]. המחלה ככל הנראה הובאה לאגן הים התיכון ולאירופה על ידי גיסותיו של אלכסנדר מוקדון שחזרו ממסעות הכיבושים במזרח הרחוק.
המחלה והחולים בה סבלו במשך מאות שנים מדיעות קדומות שליליות. הכורח להרחקה מהציבור נבע בין השאר מקישור מוטעה ל"צרעת" המקראית. גם בימינו, למרות התקדמות ההבנה של המחלה וגורמיה, רבה הבורות בנושא והדיעות הקדומות השליליות עדיין נפוצות ומכבידות על גילוי החולים והטיפול בהם.
אפידמיולוגיה
בעולם חיים כיום כ-15-12 מיליוני אנשים שחלו במחלת הנסן וטופלו עד לפני מספר שנים במרפאות יחודיות, חלקם במוסדות מבודדים שהנציחו את הדיעות הקדומות השליליות. בתחילת שנות ה-90, לאחר שהיה ברור שנמצא טיפול תרופתי יעיל למחלה, והוחל בחלוקתו חינם בכל העולם, הכריז ארגון הבריאות העולמי על מערכה עולמית למיגור המחלה עד שנת 2000, שמשמעותה הורדת שכיחות המחלה בארצות אנדמיות (Endemic) לפּחות מחולה אחד ל-10,000 תושבים. על פי נתוני WHO בשנת 2006, הושגו יעדי המערכה והמאמץ לגילוי חולים חדשים וטיפול בהם הופסק. במקביל לכך, כדי לשפר את שילובם בחברה, הומלץ לשלב את הטיפול בחולי הנסן במסגרת מערכות הבריאות הרגילות בכל העולם וספציפית יותר – על ידי רופאי העור במערכות אלה, שכן באופן טבעי, בשל העובדה שהסתמנות המחלה מתחילה לרוב בעור, רופאי העור צפויים להיות הראשונים שיפגשו בחולים עם הופעת מחלתם.
בקרב ציבור המומחים קיימת מחלוקת קשה ביחס לנתוני ארגון הבריאות העולמי. מחלוקת זו נובעת בחלקה מקשיים אובייקטיביים של ניהול סטטיסטיקה אמינה של המחלה בשל תכונותיה – שיוזכרו בהמשך, ובחלקה מכך שעל השיקולים הקליניים ואופן איסוף, עיבוד והצגת הנתונים הסטטיסטיים השפיעו שיקולים של כלכלת בריאות ופוליטיקה.
בישראל רשומים נכון לזמן כתיבת המאמר כ-200 חולים במחלת הנסן. בכל שנה מתגלים כ-10-5 מקרים חדשים, רובם מקרב עולים חדשים או פועלים זרים שהגיעו מארצות אנדמיות. לעיתים מתגלים גם חולים ילידי הארץ שככל הנראה נדבקו במחלה בישראל.
החולים מטופלים במסגרת טיפול יום, בפיקוח "המרכז הארצי למחלת הנסן" שבירושלים, ובמסגרת קופות החולים.
אטיולוגיה
מדובר במחלה גרנולומטוטית (Granulomatous disease), זיהומית, כרונית, של בני אדם, המהווים ככל הנראה את המאגר העיקרי של המחלה בטבע. מחולל המחלה, החיידק Mycobacterium Leprae, הוא קרוב משפחה של מחולל השחפת והחיידק הראשון שהתגלה כגורם מחלה באדם.
החיידק Mycobacterium Leprae התגלה לראשונה על ידי הרופא Armauer Hansen שהיה רופא במוסד לחולים במחלת הנסן בנורווגיה (Norway) בשלהי המאה ה-19. בשנת 1873 הוא פרסם את תצפיותיו וקשר לראשונה בין נוכחות חיידק למחלה בבני אדם. ראשוניות התצפית גרמה לכך שחלפו שנים רבות עד שהקהילה הרפואית הסכימה לקבל את תגליתו. החיידק הוא מתג גרם חיובי, עמיד לחומצה, אלכוהול ועיכול על ידי Macrophages בזכות קרום שומני דו שכבתי העוטף את דופן התא. קצב החלוקה שלו הוא האיטי מבין כל החיידקים הידועים עד כה ועומד על חלוקה אחת כל 16-12 יום. עם השלמת מיפוי הגנום של החיידק, בשנת 2001, התברר מהשוואה לקרובי משפחתו, כי במהלך התפתחותו איבד כמעט את כל הגנים האחראים לתחזוקתו (House keeping genes) והפך לחיידק תוך תאי אובליגטורי (Obligatory) עם זיקה לתאי המערכת המונוציטית (Monocytes) ולתאי Schwann המרכיבים את מעטפות העצבים בגוף. גנים (Genes) נוספים שנעלמו במהלך התפתחותו הפכו את החיידק לטפיל כמעט אידאלי (Ideal) שאינו גורם לחולים הנושאים אותו גם במספרים עצומים (עד 1013 חיידקים באדם) לחוש כאבים או חום. הסתגלותו של החיידק לטמפרטורות נמוכות של 330-27 מעלות צלזיוס גרמה לכך שהמקומות המועדפים להתרבותו הם מעטפות העצבים ההיקפיים (Peripheral), העור, האשכים והעיניים. קצב ההתרבות האיטי שלו גורם לכך שהשינויים שהוא גורם בגוף החולים כל כך איטיים עד שלעיתים קרובות החולים כלל אינם ערים ואינם שמים להם לב.
פתוגנזה
ביטויי המחלה הם תוצאה של מאזן בין תגובת מערכת החיסון של החולה והתרבות החיידקים. תגובה תאית יעילה מצליחה לקטול את החיידקים, להגביל את פיזורם ולהקנות חיסון מפני הדבקה עתידית. תגובה הומוראלית (Humoral) אינה יעילה ומאפשרת לחיידקים להתרבות באין מפריע ולהגיע למספרים עצומים ופיזור נרחב בעור ובעצבים ההיקפיים. בעוד בחולים המגיבים תגובה יעילה- הביטויים הקליניים מוגבלים במספרם. בחולים שמערכת החיסון שלהם מגיבה בצורה הומוראלית בלבד, ביטויי המחלה מפושטים וסימטריים (Symmetrical) ועלולים להופיע 30-3 שנה לאחר מועד ההדבקה וייתכן שאף יותר.
קליניקה
המחלה מסתמנת לרוב עם הופעה של נגע או נגעים עוריים העשויים להופיע במגוון גדלים, כשהם מוסננים בחלקם, בעלי גוון או צבע שונה מסביבתם, מוגבלים בחדות או בצורה פחות ברורה והעור בהם נטול או מופחת תחושה, נטול הזעה ולעיתים נטול תשעורת. במהלך המחלה נגרמת פגיעה בעצבים ההיקפיים ובעקבות זאת נגרמים חסרים תחושתיים, מוטוריים (Motor) ואוטונומיים (Autonomic) בידיים, ברגליים ובעיניים.
המחלה היא ברת טיפול והחולים בה יכולים להחלים החלמה שלמה כאשר הם מקבלים טיפול נכון ובמועד, וסכנת ההדבקות בה בקרב האוכלוסיה הכללית היא נמוכה ביותר.
אחת המכשלות הגדולות באבחון המוקדם של המחלה הוא חוסר המודעות לקיומה ומאפייניה בקרב ציבור הרופאים האחראיים לרפואה הראשונית.
לכ-99 אחוזים מהאוכלוסיה חסינות מולדת הגורמת לניטרול (Neutralization) ה-Inoculum הראשוני ומיגור הזיהום בטרם הספיק לקנות אחיזה. בכ-5 אחוזים מהאוכלוסיה מופיע לאחר החשיפה/הדבקה ביטוי קליני בלתי ספציפי (Specific) המוגדר Indeterminate ומתבטא בנגעים Erythematous עדינים ובודדים שאינם אבחנתיים וחולפים לרוב לאחר שמערכת החיסון גוברת על הזיהום. בכאחוז אחד מן הנחשפים מצליחים החיידקים לגבור על מערכת החיסון ולגרום לביטויים קליניים של המחלה. הביטויים הקליניים מגוונים מאוד ונעים בין שני קטבים. בקוטב האחד המכונה Tuberculoid מגיבה מערכת החיסון תגובה תאית יעילה והביטויים הקליניים הם נגעים בודדים, מוגבלים בחדות, נטולי תחושה, שיער או הזעה ולרוב ניתן למצוא עצב היקפי מוגדל בקרבתם. בקוטב השני המכונה Lepromatous מגיבה מערכת החיסון תגובה הומוראלית שאינה יעילה בהתמודדות עם החיידקים, המצויים בתוך תאי השורה המונוציטית ובתאי Schwann, וכתוצאה מכך החיידקים מצליחים להתרבות ומסנינים את העור והעצבים ההיקפיים בכל הגוף. ביטויי צורה זו של המחלה עלולים להופיע שנים לאחר ההדבקה בדמות נגעים עוריים מפושטים וסימטריים, רבדים מוסננים עם גבול לא חד, הגדלה ניכרת של תנוכי האזניים, דלדול שיער הגבות תחילה ובהמשך אף כלל שיער הגוף וכן פגיעה עצבית המתבטאת בירידה בתחושה בכפות וגבות הידיים והרגלים ובשלבים מאוחרים יותר פגיעות מוטוריות וקריסה של גשר האף. בין שני קטבים אלו ביטויי המחלה מהווים ספקטרום (Spectrum) רציף של צורות ביניים המכונות Borderline, ובהם פחות נגעים, עם גבול חד, פיזור אסימטרי (Asymmetrical), מעורבות עצבים ספורים ומספרי חיידקים קטנים במשטחים מהעור המתאימים לצורת ביניים הקרובה יותר לקוטב ה-Tuberculoid. לעומת זאת, נגעים רבים, ללא גבול חד, בפיזור סימטרי, מעורבות עצבים רבים וריבוי חיידקים במשטחים מהעור מעידים על צורת ביניים הקרובה יותר לקוטב ה-Lepromatous. כאשר ביטויי המחלה מגוונים באופן שאינו מאפשר להגדיר אם מדובר בצורה הקרובה יותר לאחד הקטבים – צורה זו מוגדרת צורת ביניים "אמצעית" או "אמיתית" (Mid or True Borderline).
החולים במחלה עלולים לפתח שני סוגים של מצבי דלקת – הנובעים למעשה מחוסר איזון של מערכת החיסון. מצבים אלו קרויים "ריאקציות" (Reactions) והם יכולים להופיע במהלך הטיפול התרופתי וגם שנים לאחר השלמתו. ריאקציה מסוג 1 "Type I", המופיעה אצל חולים בצד ה-Tuberculoid, היא ריאקציה הנגרמת כאשר מערכת החיסון התאית הופכת משופעלת וגורמת לדלקת חריפה בכל מקום בו מצויים חיידקים בעור ובעצבים ההיקפיים. ירידה פתאומית בתפקוד העצבים המעורבים עם או בלי כאבים, או אודם ונפיחות התופעות העוריות הן מסימני ההיכר שלה. בהעדר טיפול נוגד דלקת הריאקציה מסוג 1 עלולה לגרום לנזקים בלתי הפיכים לטווח הארוך. ריאקציה מסוג 2 "Type II" המכונה גם בשם Erythema Nodosum Leprosum (ENL) ומופיעה בחולי צרעת היא למעשה מחלה של קומפלקסים אימוניים (Immune complexes) – נוגדנים הקושרים אנטיגנים (Antigens) ומשלים בזרם הדם ואשר שוקעים בכלי דם קטנים בכל הגוף, כולל באברים פנימיים. סביב קומפלקסים אלה נוצרים מוקדי דלקת המופיעים בעור, בכל הגוף, בגלים של 10 ימים של Nodules דמויי עקיצות, רגישות וכואבות ומלווים בחום סיסטמי (Systemic) מוגבר והרגשה כללית רעה, לעיתים גם בדלקת של האשכים (Orchitis) והענבייה (Uveitis).
אבחנה
האבחנה מתבססת על סימנים קליניים על אף שכלים מעבדתיים יכולים לעזור לאשש את האבחנה.
האבחנה נעשית כאשר אחד מהממצאים הגופניים הבאים קיים בנוסף לביופסית (Biopsy) עור משולי הנגע העורי המאשרת נוכחות מתגים יציבי חומצה:
- נגעים אדמומיים או עם ירידה בפיגמנטציה (Hypopigmentation)
- נגע או נגעים עוריים עם ירידה או חוסר תחושתי
- ירידה או חוסר תחושתי בכפות ידיים או רגליים
- נגעים לא כואבים או כוויות לא כואבות בכפות ידיים או רגליים
- גוש או נפיחות של תנוכי האזניים או הפנים
- עצבים היקפיים מוגדלים ורגישים
באיזורים בהם המחלה אנדמית והיא מזוהה לעייתים קרובות באופן קליני, אבחנה הנעשית על בסיס הביטויים הקליניים בלבד יכולה להיות מספקת. לעומת זאת, באיזורים שבהם המחלה פחות שכיחה, ביופסיה עורית יכולה לעזור באישוש האבחנה ו/או לפסול סיבות מחלה אחרות.
טיפול
בתחילת שנות ה-40 של המאה הקודמת התגלתה לראשונה תרופה שהוכחה כבעלת פעילות ויעילות בטיפול במחולל המחלה. התרופה Dapsone, הוכנסה בתחילת שנות ה-50 לשימוש, אך למרות התקוות הרבות שנתלו בה, התברר תוך זמן לא רב כי החיידקים מצליחים לפתח עמידות במהירות רבה. תרופות נוספות שהתגלו היו ה-Lamprene (Clofazimine) שפותחה בשלהי שנות ה-50 מנגזרת של צבע אדום וה-Rifampicin שפותחה בתחילת שנות ה-60. האחרונה התבררה עד מהרה כיעילה ביותר ובקטריצידית (Bactericide) עד כדי כך שמנה בודדת חיסלה 99.9 אחוזים מהחיידקים. יחד עם זאת גם לתרופה זו התגלו עמידויות ובעקבות זאת הוחלט בתחילת שנות ה-80, על ידי צוות מומחים, על גישה רב תרופתית.
מתן משולב של טיפול מקביל ב-3 התרופות הללו הוכח עד מהרה כיעיל במיוחד. הוחלט שהטיפול בחולים שהוגדרו כ"מרובי חיידקים" (ראו בהמשך הערך) יימשך לפחות 24 חודשים (עד 36 חודשים): מנה אחת לחודש של 600 מיליגרם (מ"ג) Rifampicin, 300 מ"ג Lamprene ו-100 מ"ג Dapsone ובשאר ימי החודש: מנה יומית של 50 מ"ג Lamprene ו-100 מ"ג Dapsone. בחולים עם צורת ה-Tuberculoid של המחלה הוחלט על טיפול של 6 חודשים עד 9 חודשים המורכב ממנה חודשית של Rifampicin ומנה יומית של 100 מ"ג Dapsone בלבד. טיפול זה נמצא יעיל ובטוח והתברר כי הוא מונע מן החיידקים לפתח עמידות לתרופות המרכיבות אותו. גם שיעור ההתלקחויות לאחר השלמת הטיפול ירד ל-0.1 האחוז ב-9 שנים. בשנים האחרונות התגלו אנטיביוטיקות יעילות נוספות ובהן Minocycline, Ofloxacin, Clarithromycin ו-Levofloxacin.
הטיפול האנטיביוטי מהווה חלק קטן מסך הטיפול הנדרש במחלה זו. החולים דורשים מעקב קפדני לזיהוי מוקדם של ריאקציות וכאשר הן מתרחשות הטיפול בהן מורכב ביותר, עלול להמשך זמן רב ודורש מיומנות וסבלנות רבה, כדי לגרום להפוגה ולמנוע נזקים משניים.
לאחר השלמת הטיפול יש להמשיך ולעקוב אחר החולים למשך 10-5 שנים לפחות כדי לזהות בעוד מועד התפתחות ריאקציה מאוחרת או התלקחות מחודשת של הזיהום, במידה וכזו תתרחש.
חלק נוסף והממושך ביותר בטיפול בחולים הוא הטיפול למניעת נכויות. בשל הדגירה הממושכת של המחלה עד להופעת הסתמנות קלינית, האבחון המאוחר גורם לכך שרבים מהחולים מאובחנים כאשר כבר יש חסרים משמעותיים בתפקוד העצבים ההיקפיים ונחוץ מעקב וטיפול מתמשך כדי למנוע החמרת הנזקים והתפתחות נזקים ונכויות בלתי הפיכות.
המערכה למיגור המחלה
מאז הכנסת הטיפול הרב תרופתי, MDT (Multi Drug Therapy) לשימוש בתחילת שנות ה-80 של המאה הקודמת התברר הן לעובדי מערכות הבריאות והמטפלים בחולי הנסן והן לחולים עצמם כי לא רק שהטיפול יעיל ביותר, יעילות הטיפול נשמרה גם במעט החולים שחזרו והתלקחו לאחר סיום הטיפול וכמעט שלא התגלו עמידויות חדשות לתרופות המרכיבות אותו. ממצאים אלה גרמו לאופטימיות רבה ולאמונה כי ניתן לגבור על המחלה ולמגרה ובעקבותיהם הוכרז בועידה ה-44 של ארגון הבריאות העולמי, בשנת 1991 על מערכה למיגור המחלה כבעיית בריאות ציבור עד שנת 2000. יעד שכיחות המחלה שנקבע היה מתחת לחולה אחד ל-10,000 אנשים בעולם. המחשבה בבסיס החלטה זו הייתה שכאשר שכיחות המחלה תרד מתחת לנתון זה המחלה תגווע מעצמה.
ההשלכות המיידיות של הכרזה זו של ארגון הבריאות העולמי היו שיפור בתווית השלילית של החולים ובמודעות הציבור מחד, ומאידך, מתוך הבנה כי מדובר במחלה ברת מיגור ואשר עומדת בפני חיסול, פחתו משמעותית ביותר תקציבי המחקר המיועדים לחקר המחלה וגם בקרב החוקרים הצעירים – פחות ופחות אנשים פנו לעסוק בה, מתוך הבנה כי מדובר במחלה גוועת.
כבר בתחילת המערכה הוחלט על ידי ארגון הבריאות העולמי לשנות את אופן מדידת מספר החולים. עד אז היה נהוג לספור את החולים לפי אלו אשר קיבלו טיפול במהלך השנה (כלומר, חולה הוגדר כאדם המקבל טיפול למחלה). ההחלטה הייתה לעבור למדידה נקודתית (Point prevalence) אשר תכלול רק את החולים שקיבלו טיפול בחודש דצמבר של כל שנה. כבר כתוצאה מחשבון פשוט זה חלה ירידה מאוד משמעותית במספרי החולים המדווחים. בהמשך החליט ארגון הבריאות העולמי מסיבות "מעשיות" של מחסור בטכנאים מיומנים בארצות האנדמיות, לנטוש את משטחי העור וספירת המתגים עמידי החומצה בהם - כמאפיין לאבחון וסיווג המחלה ולעבור במקום זאת לסיווג המחלה על פי מספר הנגעים העוריים. כאשר לחולה פחות מ-5 נגעים עוריים הוא מוגדר כ"מְעוט חיידקים" (PauciBacillary - PB) ומעל ל-5 נגעים החולה יהיה מוגדר כ"מרובה חיידקים" (MultiBacillary - MB). בשנת 1998 ולאור הנתונים אודות ההצלחה של תכנית הטיפול, המליצה ועדת מומחים של ארגון הבריאות העולמי לקצר את משך הטיפולים לחולים מרובי חיידקיים (MB) מ-24 חודשים ל-12 חודשים, לחולים מעוטי חיידקים (PB) ל-6 חודשים ולחולים עם נגע בודד הטיפול יכלול מנה בודדת של Rifampicin, Ofloxacin ו-Minocycline (ROM) [2]. התוצאה המיידית הייתה צמצום נוסף ודרמטי במספרי החולים הרשומים, שכן כאמור, חולים רשומים הם אך ורק חולים המקבלים טיפול למחלה. קיצור תקופת הטיפול מ-24 ל-12 חודשים לחולי MB גרם לכך שמספר חולי MB הרשומים ירד במחצית וגרם לשיפור סטטיסטי מרשים בעיקר בארצות בהן אחוז גבוה של חולי MB כמו ברזיל (Brazil) ואינדונזיה (Indonesia). טיפול ה-ROM שיפר את הסטטיסטיקה בהודו שבה מספר גדול יחסית של חולים עם נגע בודד.
במקביל לשיפור הסטטיסטי ולנתונים המעודדים על התקדמות במגמת המיגור של המחלה התעוררו שאלות בקרב המטפלים במחלת הנסן בנוגע לרקע ולוודאות שיש לגבי יעילות נוהל הטיפולים החדש. מתוך הכרת הביולוגיה של מחלת הנסן ותקופות הדגירה הארוכות שלה, ברור כי לצורך הסקת מסקנות תקפות ומשמעותיות אודות יעילותם של נהלים טיפוליים במחלה זו נדרשים מחקרים ממושכים במיוחד. עם זאת, זמן קצר לאחר שינוי נוהל הטיפול החלו להופיע ממצאים מדאיגים[3].
בשנת 2000 התברר שהיעד הושג בארצות רבות אם כי לא בארצות האנדמיות שבהן מרוכזים רוב חולי מחלת הנסן בעולם (85 אחוזים): הודו, ברזיל, ניגריה (Nigeria), מיאנמאר (Myanmar), מדגסקר (Madagascar) ואינדונזיה (ראו תרשים).
עם נתוני השיפור והירידה בשכיחות המחלה על פי רישומי ארגון הבריאות העולמי, התברר כי הארעות המחלה בעצם לא ירדה אלא נשארה קבועה, סביב 600,000-500,000 מקרים חדשים לשנה עד 1995 ולאחר מכן נרשמה עליה הדרגתית בהארעות עד לשיא של קרוב ל-720,000 מקרים חדשים בשנת 2000. עלייה זו היתה משנית להגברת המאמצים לגילוי חולים חדשים ולעלייה במודעות הציבור למחלה. הוחלט על סיסמא חדשה – "המאמץ האחרון" (The Final Push) המרמזת על כך שהמחלה תמוגר עד שנת 2005. בשנת 2001 הכריז WHO על מיגור המחלה ברמה העולמית, מאחר וכאמור ב-27 הארצות האנדמיות ביותר שיעור ההארעות לא ירד בין השנים 1999-1985, וכן מספרי החולים החדשים וההארעות היו בעליה ב-6 הארצות שבהן התגלו 88 אחוזים מהמקרים החדשים בעולם.
בשנת 2006 הכריז WHO כי המטרה הושגה ושכיחות המחלה בעולם ירדה אל מתחת ליעד (0.3 מקרים ל-10,000 אנשים) ובנוסף, בארצות האנדמיות בהן השכיחות היתה גבוהה מיעד המטרה נרשמה ירידה (מ-122 ל-9 מקרים ל-10,000 אנשים). בעקבות זאת העולם נכנס לעידן שלאחר המיגור – "Post elimination era" - עידן שבו נסגרו המרכזים הייעודיים לטיפול במחלת הנסן והטיפול בחולים עבר למסגרות הבריאותיות הרגילות, וליתר דיוק לידי רופאי העור שבמסגרות אלה[4].
השלכות המערכה למיגור המחלה
מדידת שכיחות והמצאות המחלה על פי Point Prevalence (הימצאות נקודתית) במקום Incidence (היארעות) גורמת ליצירת תמונה "ורודה" ולא מציאותית של מצב המחלה בעולם. בשל הצגת הנתונים השגויה התקבל הרושם שניתן לקצר את משך הטיפול. התוצאה היא משך טיפול קצר מדי אשר לדעת רוב המומחים אינו מספיק להשגת הפוגה מלאה אלא רק לדיכוי המחלה עד להתלקחות חוזרת בחלק לא מבוטל מהחולים, ואף חושף את החולים לשכיחות גבוהה יותר של ריאקציות הרסניות. תוצאה אחרת של המערכה היא שינוי תודעתי עולמי אשר גרם לשיפור במצב החולים מבחינת הדיעות הקדומות השליליות, עקב ההכרה כי מדובר במחלה הניתנת לריפוי. מאידך, התפיסה כי המחלה מוגרה כביכול, גורמת לירידה במודעות לקיום המחלה בקרב עובדי בריאות וכתוצאה מכך יתכן איחור באבחון מקרים חדשים על חשבונם של חולים נדבקים נוספים ונזקים קשים יותר לחולים אשר אובחנו מאוחר. גם הנזקים להיקף ורמת המחקר הבסיסי של מחלת הנסן משליכים על היכולת להוסיף ולהתקדם בהבנת המחלה ובשיפור הטיפול וההתמודדות עימה. ההיסטוריה הרפואית מלמדת שמעולם לא מוגרה מחלה חיידקית על ידי אמצעי טיפולים אנטיביוטיים בלבד וגם התובנות שלנו אודות הביולוגיה המיוחדת של מחלת הנסן מחזקות את ההבנה שהמחלה אינה ניתנת למיגור באמצעים אנטיביוטיים בלבד[5].
המצב המתואר גורם לחשש אצל רוב המומחים למחלה בעולם כי המשך המדיניות הנוכחית תהפוך את ההתלקחות וההחמרה האפידמית של מחלת הנסן לבלתי נמנעות. לאור כל הנתונים הללו, ברור כי לרופאי העור תפקיד חשוב בהתמודדות עם האיום. על רופאי העור להיות מודעים לקיומה של המחלה, לביטויים הקליניים שלה ולצורך לאבחן אותה בשלבים מוקדמים ככל האפשר. חשוב לחשוב על האפשרות כאשר קיימים ממצאים קליניים אשר צריכים לעורר חשד במיוחד בקרב עולים, עובדים זרים ושאר מהגרים מארצות אנדמיות ובמיוחד בקרב נשים הרות מקרב אוכלוסיות אלה. גם בקרב מגעים של בני אוכלוסיות בסיכון יש לזכור את האפשרות ולחשוב עליה.
בישראל הטיפול מרוכז על ידי המרכז הארצי למחלת הנסן בירושלים והחולים מטופלים על פי עקרונות הטיפול שהונחו בתחילת שנות ה-80 של המאה הקודמת. בכל מקרה של חשד למחלת הנסן יש להפנות את החולים לבדיקה במרכז הארצי, שם תתבצע האבחנה ויוחלט על תכנית טיפול מתאימה.
פרוגנוזה
מהנתונים הנפרשים בפנינו ניתן לחזות מספר התפתחויות. עם השיפור בתוחלת החיים של חולים נשאי HIV (כתוצאה מהשיפור בטיפול התרופתי בהם), צפויה עליה, ככל הנראה, במספר החולים הסובלים במקביל גם ממחלת הנסן. נראה כי חולי HIV רבים היו נשאים גם של M. Leprae אך מותם, לאחר זמן קצר, ממחלת ה-AIDS (Acquired ImmunoDeficiency Syndrome) מנע הופעת ביטויים קליניים של מחלת הנסן. עם זאת, ככל הנראה לא מדובר בשינוי משמעותי מבחינה אפידמיולוגית ומבחינת בריאות הציבור. לעומת זאת, נראה כי צפויה עלייה משמעותית בשכיחות ההתלקחויות החוזרות של המחלה, עקב טיפול חלקי בלבד – ומשך טיפול קצר מדי וכתוצאה מכך עלייה גם במספר החולים החדשים שיידבקו, וכן, איחור באבחון חולים חדשים עקב פירוק של מרכזי ידע ומומחיות והעלמות המחלה מן התודעה של ספקי הבריאות. כמו כן צפוייה עלייה משמעותית בשיעור הריאקציות והנכויות הנובעות מהן על רקע שחרור מוקדם מדי מטיפול ומעקב.
בתחום המחקר, לאחר שהושלם מיפוי ה-Genome של מחולל המחלה בשנת 2001 ובשילוב עם התקדמות בתחומים שונים של מחקר בסיסי כגון השלכות של מידע חדש אודות מנגנוני ההשפעה של HLA (Human Leukocyte Antigen) על פעילות תאי T ותגובתם לאנטיגנים שונים חלה התקדמות במספר תחומים. זוהו אנטיגנים ספציפיים חדשים שישמשו בעתיד לאבחון סרולוגי (Serologic) של הדבקה/חשיפה למחלת הנסן, זוהו אנטיגנים ספציפיים חדשים שצפויים להיות יעילים בזיהוי שפעול תאי T ספציפיים למחלת הנסן. פותחו בדיקות PCR (Polymerase Chain Reaction) לזיהוי כמויות מזעריות של מחולל המחלה ברקמות חולים ומגעים (מערכת כזו פותחה גם במרכז הישראלי למחלת הנסן ובעזרתה אובחן חולה MB טרם הופעת ביטויים קליניים אבחנתיים כלשהם). נמשך המאמץ לפיתוח חיסון יעיל ואולי אף חיסון טיפולי שיוכל לגרום למערכת החיסון של חולי הנסן להתמודד עם המחלה בעצמה. נמשך גם המאמץ לפיתוח אמצעים אבחנתיים אובייקטיביים, מהירים ופשוטים למחלת הנסן, דוגמת ערכה ביתית לבדיקת היריון וניסויים קליניים ראשונים של אמצעים אלה צפויים להתחיל בימים אלה. כמו כן, מתקיימים מחקרים לבחינת נהלים טיפוליים חדשים באמצעות אנטיביוטיקות חדשות ולזיהוי אנטיביוטיקות חדשות ויעילות לטיפול במחלה.
פרוגנוזה
דגלים אדומים
ביבליוגרפיה
- ↑ Marc Monot, N.H., Thierry Garnier, et al., On the Origin of Leprosy. SCIENCE, 2005. 308: p. 1040-1042.
- ↑ Recent advances in the control programs and therapy of leprosy. N.P.Rao, Indian J Dermatol Venereoleprol, 2004, 70:5, pp: 269-276
- ↑ Treatment of Leprosy: science or politics? Bernard Naafs, Trop Med Int Health 11:3 pp 268–278
- ↑ Special issue on the role of dermatologists in leprosy elimination and post elimination era. Leprosy review 2007, 78:1
- ↑ Leprosy: too complex a disease for a simple elimination paradigm. D.N.J.Lockwood, S.Suneetha, Bulletin of the WHO 2005;83:230-235
המידע שבדף זה מבוסס על מידע שנכתב באתר רשת רפואה, על ידי ד"ר ליאון גלעד, המנהל הרפואי, המרכז הארצי למחלת הנסן, ירושלים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק