הבדלים בין גרסאות בדף "מיאלומה נפוצה - Multiple myeloma"
(←הטיפול) |
|||
| שורה 73: | שורה 73: | ||
הפרעות כגון: (4;14), (14;16), (14;20), TP53,del17, 1p,1q t -קשורות עם סיכון גבוה יותר. | הפרעות כגון: (4;14), (14;16), (14;20), TP53,del17, 1p,1q t -קשורות עם סיכון גבוה יותר. | ||
| − | == | + | ==טיפול == |
הטיפול מיועד רק לחולים אשר עונים להגדרה של מיאלומה נפוצה פעילה (CRAB). קיימים כיום מחקרים אשר בודקים האם טיפול מוקדם במצב של מיאלומה רדומה עם סימני סיכון גבוהים ובעידן התרופות החדשות הינו יעיל ומוצדק. לעת עתה ,אין עדיין תשובה לשאלה זו, לכן ההנחיות הבינלאומיות נשארו כפי שהיו בעבר. | הטיפול מיועד רק לחולים אשר עונים להגדרה של מיאלומה נפוצה פעילה (CRAB). קיימים כיום מחקרים אשר בודקים האם טיפול מוקדם במצב של מיאלומה רדומה עם סימני סיכון גבוהים ובעידן התרופות החדשות הינו יעיל ומוצדק. לעת עתה ,אין עדיין תשובה לשאלה זו, לכן ההנחיות הבינלאומיות נשארו כפי שהיו בעבר. | ||
גרסה מ־11:34, 16 במרץ 2014
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| מיאלומה נפוצה | ||
|---|---|---|
| Multiple myeloma | ||
| יוצר הערך | ד"ר מרב לייבה | |
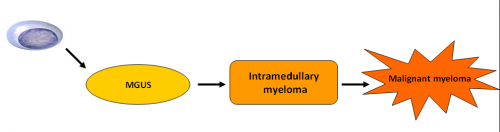
מיאלומה נפוצה הינה מחלה אשר מקורה בלימפוציטים מסוג B בשלים אשר התמיינו לתאי פלסמה. המחלה מתאפיינת בשגשוג שבטי של תאי פלסמה במח העצם אשר מפרישים נוגדן חד שבטי הנמצא בדם ובשתן. המחלה פוגעת במח העצם, בעצמות, בכליות ובמערכת החיסון. כיום חושבים כי מיאלומה נפוצה מתפתחת ברוב המקרים ממצב טרום ממאיר (MGUS, Monoclonal Gammopathy of Undetermined Significant) אשר מתפתח למצב של מיאלומה רדומה ולבסוף למיאלומה תסמינית (תמונה 1). שינויים גנטיים רב שלביים ושינויים בסביבה המקומית של תאי הפלסמה גורמים לתאי הפלסמה הטרום ממאירים לעבור ממצב של תאים טרום ממאירים לתאים ממאירים.
אפידמיולוגיה
מיאלומה נפוצה היא הממאירות השנייה בשכיחותה מבין הממאירויות ההמטולוגיות (10% מבין הממאירויות ההמטולוגיות). בארצות המערביות היארעות המחלה היא 4-5/100,000 מקרים חדשים לשנה. קיימת עליה בשכיחות מיאלומה נפוצה בשנים האחרונות, כנראה בשל הגילוי המוקדם, ועליית גיל האוכלוסיה. זוהי מחלה של הגיל המבוגר, עליה חדה בשכיחות מעל גיל 50, רוב החולים הם מעל גיל 70 (גיל הממוצע באבחנה הוא 62 שנים). המחלה מעט שכיחה יותר בגברים לעומת נשים.
אטיולוגיה
האטיולוגיה אינה ידועה. בין הסיבות המוצעות כמעלות את הסיכון להופעת המחלה הן:
- חשיפה לקרינה מייננת (שכיחות גבוהה יותר בניצולי הירושימה ונאגסקי),
- חשיפה לחומרי הדברה.
- חשיפה לבנזן ומתכות בתעשיה.
יש מחקרים סותרים לגבי סיכון מוגבר באנשים עם עודף משקל, שתיית אלכוהול ועישון, אך טענות אילו טרם הוכחו במחקרים גדולים.
קליניקה
המחלה מתייצגת לעיתים רבות ע"י כאבי עצמות (80%), אנמיה (ירידה בייצור כדוריות הדם האדומות וההמוגלובין, 70%), עליה ברמות הסידן בדם (לא שכיח), אי ספיקת כליות (20-40%) וזיהומים חוזרים.
ישנם חולים אשר מתגלים באקראי בבדיקות הדם והינם א-תסמינים. לרוב בחולים אלו מדובר במחלה רדומה או במצב הטרום ממאיר (MGUS,Smoldering Myeloma)
MGUS הינו מצב טרום ממאיר אשר אינו מוגדר כמחלה, ולרוב אינו עובר למצב ממאיר. רק באחוז אחד מהחולים לשנה, עובר מצב זה למצב של מיאלומה נפוצה פעילה. עיקר המעבר למיאלומה הינו בשלוש - חמש שנים הראשונות מהאבחנה.
- הבדיקות שיש לבצע בחשד למיאלומה נפוצה
- בדיקות דם+ שתן:
- ספירת דם+ כימיה מלאה כולל לקטאט דהידרוגנאזה (LDH ,Lactate DeHydrognase), סך חלבון בדם, אלבומין,גלובולין, תפקודי כליות, אלקטרופורזה ( Electrophoresis) של חלבוני הדם, אימונופיקסציה (Immune fixation), רמות נוגדנים בדם, שרשרות קלות חופשיות בדם, איסוף שתן ל24 שעות לחלבון+ בנס ג'ונס (Bence Jones), בטא 2 מיקרוגלובולין (Microglobulins).
- הדמיות:
- צילומי שלד: גולגולת קדמי+ צדדי, חזה קדמי+צדדי, עמוד שידרה לכל אורכו, אגן + זרועות + ירכיים.
- באם הכאבים ממוקמים לאיזור מסוים יש להשלים MRI או CT מכוונים לאותו איזור.
- לחילופין כאשר קיים גוש באיזור מסוים מומלץ לבצע PET CT לשלול גושים נוספים.
- ביופסיית מוח עצם+ שאיבת מחט עדינה + בדיקת כרומוסומים+ FISH (Fluorescence In Situ Hybridization).
אבחנה
האבחנה של מיאלומה נעשית ע"י שילוב של בדיקות הדם, צילומי השלד ו\או ההדמיות ושל ביופסיית מוח העצם.
- בכדי לאבחן מיאלומה דרושים שלושה תנאים
- ביופסיית מוח עצם אשר בה הודגם ריבוי תאי פלסמה חד שבטיים, מעל 10% .
- חלבון חד שבטי בדם או בשתן או הפרעה ביחס ובמספר המוחלט של השרשרות הקלות החופשיות בדם
- קיימת פגיעה באחד מאברי המטרה המתייצגת כ-CRAB ( C = Calcium (elevated), R = Renal failure, A = Anemia, B = Bone lesions): ערכי סידן מוגברים\ אנמיה\נגעים נקביים(Lytic) בעצמות\אי ספיקת כליות
חולים אשר עונים לסעיפים 1+2, אך אינם סובלים מפגיעה באברי מטרה (CRAB) אינם מוגדרים כמיאלומה פעילה אלא כמיאלומה רדומה ואינם זקוקים, ע"פי ההגדרות הנהוגות כיום, לתחילת טיפול מיידי אלא כאשר נמצאים בסיכון גבוה.
שלבי המחלה (ISS)
- שלב I- בטא 2 מיקרוגלובולין מתחת ל3.5, אלבומין מעל 3.5
- שלב II - בטא 2 מיקרוגלובולין מעל 3.5 או אלבומין מתחת 3.5
- שלב III- בטא 2 מיקרוגלובולין מעל 5.5
בנוסף קיימים שינויים גנטים תאיים (Cytogenetics) המשפיעים על התנהגות המחלה והתגובה לטיפול :
הפרעות כגון: (t(11;14, וכן היפרפלואידיות (Hyperploidy) –קשורות עם סיכון נמוך יותר.
הפרעות כגון: (4;14), (14;16), (14;20), TP53,del17, 1p,1q t -קשורות עם סיכון גבוה יותר.
טיפול
הטיפול מיועד רק לחולים אשר עונים להגדרה של מיאלומה נפוצה פעילה (CRAB). קיימים כיום מחקרים אשר בודקים האם טיפול מוקדם במצב של מיאלומה רדומה עם סימני סיכון גבוהים ובעידן התרופות החדשות הינו יעיל ומוצדק. לעת עתה ,אין עדיין תשובה לשאלה זו, לכן ההנחיות הבינלאומיות נשארו כפי שהיו בעבר.
במהלך עשר השנים האחרונות, הטיפול במיאלומה עבר שינוי מהותי, עם הופעת תרופות חדשות כגון: הThalidomide, הLenalidomide (Revlimid) והBortezomib (Velcade), אשר שיפרו באופן ניכר את ההישרדות ללא מחלה ואת סך ההישרדות של חולי המיאלומה, בהשוואה לטיפולים שניתנו לפני עידן הThalidomide.
בארץ ובעולם, טיפול קו ראשון כולל בדרך כלל Bortezomib, שהינו טיפול ביולוגי מכוון אשר מעכב את הפרוטאוזום (החלקיק התאי האחראי על פירוק החלבונים בתא).
- יש מספר משלבים מקובלים המכילים Bortezomib
- בורטזומיב בשילוב עם ציקלופוספמיד+ דקסהמטזון= VCD (Bortezomib-Cyclophosphamide-Dexamethasone )
- בורטזומיב + תלידומיד+ דקסהמטזון=VTD (Bortezomib-Thalidomide-Dexamethasone )
- באנשים מבוגרים : בורטזומיב+ מלפלן+ דקסהמטזון=VMP (Bortezomib-Melphalan-Dexamethasone )
Bortezomib ניתן בעירוי לוריד או לחלופין בזריקה תת עורית לבטן. הטיפול ניתן פעם-פעמיים בשבוע. מחזור טיפולי מכיל ארבע מנות Bortezomib. תופעות לוואי עיקריות של Bortezomib: חולשה, נוירופאטיה (פגיעה בקצות העצב המתבטאת כנימול\דקירות, בכפות ידיים ורגליים), צבירת נוזלים, ירידה בטסיות הדם .
הThalidomide היא תרופה ביולוגית אשר שייכת למשפחת האימונודולורטורים (Immunomodulators) ופועלת במספר מנגנונים , פועלת כנגד תאי המיאלומה וכן מעוררת את מערכת החיסון כנגד תאי המיאלומה. הטיפול ב- Thalidomide ניתן באופן פומי , כל יום 50—200 מ"ג ליממה . תופעות הלוואי העיקריות של Thalidomide: נוירופאטיה המתבטאת בכאבים בכפות ידיים ורגליים, עצירות , עייפות .
Revlimid היא תרופה ביולוגית השייכת גם היא למשפחת האימונומודולטורים, ניתנת פומית ובעלת שיעור נמוך יותר של תופעות לוואי לעומת Thalidomide. התרופה אינה גורמת נוירופאטיה, אך עלולה לגרום לירידה משמעותית בספירות הדם ובשל כל לדיכוי חיסוני.
Cyclophosphamide ו-Melphalan (Alkeran) הן תרופות המשתייכות למשפחת הכימוטרפיה (Alkylating agents) אשר עשויות לגרום לבחילות, ירידה בספירות הדם, ודיכוי חיסוני. במינונים הניתנים במיאלומה תרופות אילו אינן גורמות בדרך כלל לנשירת שיער. Melphalan אינו ניתן לאנשים מתחת לגיל 65 כטיפול ראשוני מאחר ופוגע ביכולת לאסוף תאי אב לצורך השתלת מוח עצם עצמית.
לאחר כארבעה – שישה מחזורי טיפול באחד מן המשלבים הנ"ל, החולים מתחת לגיל 65 ,אשר אינם סובלים ממחלות רקע קשות , עוברים איסוף תאי אב והשתלת מוח עצם עצמית. חולים מעל גיל 65 בדרך כלל ממשיכים עד לסיום שמונה–עשרה מחזורי טיפול באחד המשלבים הנ"ל. לאחר השתלת מוח עצם עצמית ו\או בחולים מבוגרים אשר סיימו כשמונה מחזורי טיפול, החולים מועמדים לטיפול מיצוק, שני מחזורי טיפול נוספים באחד המשלבים הנ"ל, אשר מטרתם להעמיק את התגובה לטיפול ולהוריד עוד יותר את מסת המחלה.
קיימים מחקרים אשר הראו יתרון במתן טיפול אחזקה לאחר המיצוק, ע"י Revlimid בכדורים או לחלופין ע"י Bortezomib, מנה אחת לשבועיים, עד להתקדמות המחלה.
למרות השיפור בשרידות, עדיין לא הגענו לריפוי המחלה, ולצערנו חלק מהחולים, בעיקר אילו אשר נמצאים בקבוצת הסיכון הגבוהה,נשנים מוקדם ואף נמצאים בסיכון לתמותה.
חולים אשר נשנים בדרך כלל מטופלים ע"י Revlimid באופן פומי עד התקדמות המחלה או מועמדים להשתתף במחקר הכולל שילוב בין תרופות קיימות וחדישות.
בשנה האחרונה איגוד התרופות והמזון האמריקאי אישר את השימוש בשתי תרופות חדשות לחולי מיאלומה אשר מחלתם נשנתה, ולאחר שקיבלו את התרופות הקיימות :ה-Carfilzomib שהינה שייכת למשפחת מעכבי הפרוטאוזום, הינה מעכב בלתי הפיך של הפרוטאוזום ובעל יעילות גם בחלק מהחולים שלא הגיבו בעבר או התקדמו תוך כדי הטיפול ב-Bortezomib;Pomalidomide, דור חדש של אימונומודולטורים, גם כן בעל יעילות בחלק מהחולים אשר לא הגיבו או התקדמו תוך כדי הטיפול ב-Revlimid .
בנוסף קיימות תרופות חדשות אשר נמצאות עתה בשלבי מחקר מתקדם הכוללות מעכבי פרוטאוזום נוספים, חלקם פומיים, וכן תרופות ממשפחות חדשות , כגון נוגדנים ( Elotuzumab=נוגדן כנגד 1CS), נוגדן כנגד CD38 (Daratumumab), מעכבי היסטון דאציטלז, Bendamustine, מעכבי HSP-90 ( Heat Shock Proteins), מעכבי הקישור .
סיכום
הטיפול במיאלומה עבר שינוי מהותי בעשור האחרון, עם הופעת התלידומיד,הלנלידומיד והבורטזומיב, אשר שיפרו באופן ניכר את ההישרדות ללא מחלה ואת סך ההישרדות של חולי המילומה. עם זאת, גם עם השימוש בתרופות אילו,עדיין לא הושג ריפוי של המחלה. ההתקדמות שהושגה בעשור האחרון נזקפת בעיקר לפיתוח של התרופות החדשות, ולא לשינוי מינון או צורת המתן של התרופות שהיו קיימות קודם לכן. משום כך ניתן לצפות כי התקדמות משמעותית נוספת תושג ,לפחות בחלקה, על ידי פיתוח של משפחות חדשות של תרופות .
קיימים מספר רב של תכשירים הנמצאים היום במחקר טרום קליני ובשלבים ראשוניים ומתקדמים של מחקר קליני. חלק מן התרופות המבטיחות ביותר בתחום זה הינן גירסאות של התרופות הקיימות.
לסיכום, נראה כי הנסיון שצברנו בטיפול ב-Bortezomib, Thalidomide וב-Lenalidomide כשלד של הטיפול במיאלומה מלמד כי אף תרופה לא תוכל לעמוד לבדה כטיפול במיאלומה אלא בשילוב עם תרופות אחרות. מישלבים המכילים טיפולים חדשים ושיגרתיים כנראה ישארו אבני הדרך בטיפול במיאלומה בכדי להעמיק את שיעור, עומק ומשך התגובה.
ביבליוגרפיה
- Palumbo, A. and K. Anderson, Multiple myeloma. N Engl J Med. 364(11): p. 1046-60.
- Vij R, W.M., Orlowski R et al., Initial results of PX-171-004, an open label, single arm, phase II study of carfilzomib(CFZ) in patient with rtelpased myeloma(MM). Blood, 2008. 112, (Abstr 865).
- Jagannath S, Vij R, Stewart AK, et al. Initial results of PX-171-003, an open-label, single arm, phase II study of carfilzomib(CFZ)in patients with relapsed refractory multiple myeloma(MM). Blood, 2008;. 112: 864
- Lacy MQ, Hayman SR, Gerttz MA, et al. Pomalidomide(CC4047) plus low dose dexamethasone (pom/dex) is highly effective therapy in relapsed multiple myeloma. Blood 2008; 112: 866s
- Badros A, Philip S, Neisvisky R, et al. Phase I trial of suberoylanilide hydroxamic acid(SAHA) plus bortezomib (Bort) in relapsed multiple myeloma(MM) patients. Blood 2007; 110:354A
- Weber DM, Jagannath S, Mazumder A, et al. Phase I trial of oral vorinostat (suberoylanilide hydroxyamic acid, SAHA) in combination with bortezomib in patients with advanced multiple myeloma. Blood 2007; 110:335A
- Ponisch W, Rozanski M,Goldschmidt H, et al. Combined bendamustine, prednisolone and thalidomide for refractory or relapsed multiple myeloma after autologous stem-cell transplantation or conventional chemotherapy: results of a Phase I clinical trial. Br J Haematol 2008;143:191-200
- Hidshima T, Catly I, Raje N, et al. Inhibition of AKT induces significant downregulation of surviving and cytotoxicity in human multiple myeloma. Br J Haematol. 2007; 138:783-91.
- Richardson PG, Lonial S, Jakubowiak A, et al. Perifosin (KRX-0401) plus low dose Dexamethasone is active in patients with relapsed and refractory multiple myeloma(MM): Perifosine MM Investigator Group phase II multicenter study update: Haematologica. 2007;92:155
- Richardson P, Chanan-Khan A, Lonial S, et al. A multicenter phase I clinical trial of tanespimycin(KOS-953)+ bortezomib(BZ): encouraging activity and manageable toxicity in heavily pre-treated patients with relapsed refractory multiple myeloma(MM). 2006 Annual Meeting of American Society of Hematology; Orlando, FL; December 2006.
- Tai UT, Dillon M, Song W, Leiba M, et al. Anti-CS1 humanized monoclonal antibody HuLuc63 inhibits myeloma cell adhesion and induces antibody dependent cellular cytotoxicity in bone marrow milieu. Blood. 2008;112: (1329-1337)
- Jakubowiak AJ, Don M Benson DM, Bensinger W, Siegel DS, et al. Elotuzumab In combination with Bortezomib In patient with Relapsed Refractory Multiple Myeloma: Updated Results of Phase 1 Study. Annual Meeting of American Society of Hematology; December 2010. II-203p
המידע שבדף זה נכתב על ידי ד"ר מרב לייבה, אחראית המרפאה למילומה נפוצה במכון המטולוגי במרכז הרפואי שיבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק