מיאלופראוקסידז - Myeloperoxidase
| מדריך בדיקות מעבדה | |
| מיאלופראוקסידז | |
|---|---|
| Myeloperoxidase | |
| שמות אחרים | MPO |
| מעבדה | כימיה בדם |
| תחום | מדד רב-תחומי בנושאי הדבקות מיקרוביאליות, והערכה קרדיו-וסקולארית |
| טווח ערכים תקין | רף עליון של תחום הנורמה 400–440 פיקומול/ליטר. |
| יוצר הערך | פרופ' בן-עמי סלע |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – אלח דם
בסיס פיזיולוגי
האנזים myeloperoxidase (להלן MPO), הוא פראוקסיזאזה המקודדת באדם על ידי הגן MPO הממוקם בכרומוזום 17 במיקום 17q23.1 (על פי Inazawa וחב' ב-Cytogenet Cell Genet משנת 1989). גודלו של גן זה הוא כ-11kb, והוא מורכב מ-11 introns ומ-12 exons, אנזים זה הנחשב מעודד-דלקת (proinflammatory), הוא הֶמוֹ-פרוטאין ליזוזומאלי הנמצא בעיקר בגרגירים (granules) האזוּרוֹפיליים של גרנולוציטים נויטרופיליים, שם הם מהווים כ-3% מכלל המסה של האנזים בגוף, כפי שמצאו Schultz ו-Kaminker כבר בשנת 1962 במאמרם ב- Arch Biochem Biophys, וכן בליזוזומים של מונוציטים בהם כמות MPO היא כשליש מזו שבנויטרופילים (Nichols ו-Bainton ב-Lab Invest משנת 1973). ל-MPO יש פיגמנט ממקור heme שמקנה לו את צבעו הירוק, כאשר הוא מופיע בהפרשות עשירות בנויטרופילים כגון מוגלה או צורות ריר מסוימות.
ההיסטוריה של גילוי MPO
אנזים זה החל לרתק מחקר כבר ב-1860 כאשר Edwin Klebs ביצע ניסוי מקורי על ידי ערבוב תמצית מצמח guaiacum עם מוגלה מה שהביא להופעת צבע כחול, ומסקנתו הייתה שלויקוציטים במוגלה מכילים אוקסידאזה. אחריו היה הצרפתי Linossier שפרסם ב-1898 ב-Soc Biol Paris את ממצאיו, שעל ידי הוספה של מי-חמצן לתערובת זו, עוצמת הצבע הכחול מתגברת. מכאן הוא הסיק שהאנזים הלויקוציטרי הוא למעשה peroxidase, המשתמש במי חמצן לחמצֵן את הפוליפנול הצמחי, guaiaconic acid, ולהפכו ל-quinone הנותן צבע חזק. בשנת 1920 פרסם Graham לראשונה ב-NY State J Med, על שחרור של פראוקסידאזה מגרגירים ציטופלזמטיים של נויטרופילים בעת פגוציטוזיס. בראשית שנות ה-40 בודד Agner לראשונה את הפראוקידאזה הזו ממוגלת כלבים וכינה אותה verdoperoxidase בגלל צבעה הירוק (Adv Enzymol משנת 1943), אך באותה שנה Theorell ו-Akeson שינו את שם האנזים ל-myeloperoxidase, כדי לשקף את מוצאו מתאים מייאלואידים, ולהבדיל בינו לבין אנזים חום-ירוק ממקור של חלב הידוע כ-lactoperoxidase.
בשנת 1960, פרסמו Hirsh ו-Cohn את תהליך הדה-גרנולציה בפאגוציטים, שבמהלכו הממברנות של הגרגירים הציטופלזמטיים מתאחות עם האברון הפגוציטי (phagosome). הממברנה המשותפת עוברת קרע ותכולת הגרגירים נשפכת אל תוך ה-phagosome. בידוד גרגירים מגרנולוציטים של ארנבת, הוכיח שהם מכילים מספר hydrolases, המסייעים בהשמדת מיקרו-אורגניזמים הנבלעים על ידי פגוציטים. Hirsch כינה את החלבון האנטי-מיקרוביאלי phagocytin, וחלבון זה כונה על ידי Skarnes ו-Atson במאמר משנת 1956 ב-J Exp Med בשם leukin. בשנת 1970 הראה Klebanoff שאחד מהאנזימים ההידרוליטיים הללו הנשפכים לפגוזום הוא MPO. בשנת 1958 דיווח Agner ב-Acta Chem Scand לראשונה על קבלת גבישים של MPO טהור, והוא גם היה זה שדיווח ש-MPO נמצא בנויטרופילים בריכוז המהווה 1-2% ממשקלם היבש של תאים אלה.
מבנה האנזים MPO
בצורתו המקורית לאחר תרגום ל-RNA, החלבון הנוצר הוא בעל משקל מולקולארי משוער של 80,000 דלטון (Nauseef וחב' ב-Eur J Hematol משנת 1988), ולאחר ביקוע פרוטאוליטי של 41 חומצות אמיניות המהוות את ה-signal peptide, עובר חלבון זה -N-linked glycosylation עם אינקורפורציה של שרשרות צדדיות של פחמימות עשירות בסוכר mannose (על פי Stromberg וחב' ב-Eur J Cell Biol משנת 1986), ליצירה של apoproMPO בלתי פעיל, בעל משקל מולקולארי של 89–90 אלף דלטון. חלבון ביניים זה יוצר קומפלקס ברטיקולום האנדופלזמי עם חלבונים קושרי-סידן כגון calnexin ו-calreticulin, המשמשים כ-chaperones שהם חלבונים המסייעים לחלבונים אליהם הם קשורים להתקפל בצורה נכונה.
לאחר החדרת גרעין heme, החלבון הקודמן (precursor) apoproMPO עובר הסבה לצורה האנזימטית הפעילה של proMPO (על פי Nauseef וחב' ב-J Biol Chem משנת 1998). הרחקה של 125 חומצות אמינו מהמקטע ה-N-טרמינאלי על ידי פרוטאוליזה, מביאה ליצירה של חלבון בעל משקל מולקולארי של 72–75 אלף דלטון, וחלבון ביניים זה עובר ביקוע נוסף ליצירת שרשרת כבדה (α) בת 467 חומצות אמינו, עם משקל מולקולארי של 57 אלף דלטון, וכן ליצירת תת-יחידה בת 112 חומצות אמינו שהיא השרשרת הקלה (β) עם משקל מולקולארי של 12 אלף דלטון. שתי תת-יחידות אלו נקשרות ביניהן על ידי קשרים דיסולפידיים, והמולקולה השלמה היא למעשה טטרמר המכיל 2 שרשרות כבדות שעברו גליקוזילציה, ו-2 שרשרות קלות ללא גליקוזילציה, ובסך הכול היא בת משקל מולקולארי של כ-150 אלף דלטון. פרט לשרשרות הסוכריות, השרשרת הכבדה α מכילה גרעין heme (על פי Olsen ו-Little ב-Biocem J משנת 1984), ובהתאם מולקולת MPO מכילה 2 מולקולות ברזל.
כיוון שהשרשרת הכבדה של MPO משתנה בגודלה (variable), ניתן למצוא 3 איזופורמים של MPO השונים ביניהם בגודל השרשרת הכבדה (Mathy-Hartert וחב' ב-Can J Vet Res משנת 1998). מולקולת MPO מכילה אתר קושר סידן, המכיל 7 ליגנדים, היוצרים קונפורמציה פירמידאלית פּנטגונאלית. אחד מהליגנדים הוא שייר ה-carbonyl של חומצת האמינו Asp בעמדה 96, ונראה שקישור הסידן חיוני למבנה של האתר הפעיל של MOP, שכן Asp96 סמוך לשייר His95, שחשיבותו קטליטית.
האנזים MPO יכול להיות מופרש אל מחוץ לתאים על ידי זליגה, עוד לפני אטימה הרמטית של הפגוזום המתפתח. MPO הוא אנזים מאוד בסיסי עם נקודה איזואלקטרית מעל 10.0, ולכן הוא נקשר חזק למשטחים טעונים שלילית, שהם רוב המיקרואורגניזמים הנבלעים על ידי הפאגוציט. כאשר MPO משתחרר מהתא, הוא יכול לעבור אינאקטיבציה על ידי תוצרים מחמצנים של מערכת הנשימה (על פי Edwards וחב' ב-Biochem J משנת 1987, וכן King וחב' ב-J Leukoc Biol משנת 1997). לחלופין, האנזים יכול להתפנות מהנוזל החוץ-תאי על ידי שהוא נקלט על ידי מקרופאגים תוך ריאקציה עם הקולטן ל-mannose (על פי Schmekel וחב' ב-Inflammation משנת 1990, וכן Shepherd ו-Hoidal ב- Am J Respir Cell Mol Biol משנת 1990).
תפקידו התקין של MPO
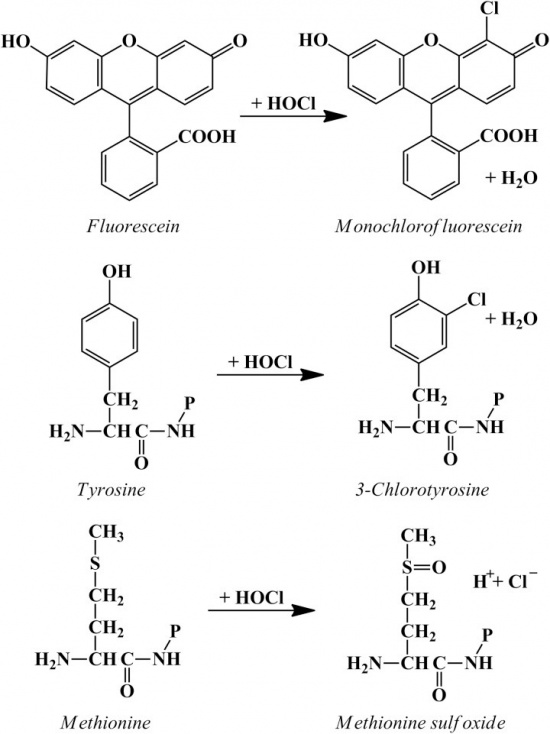
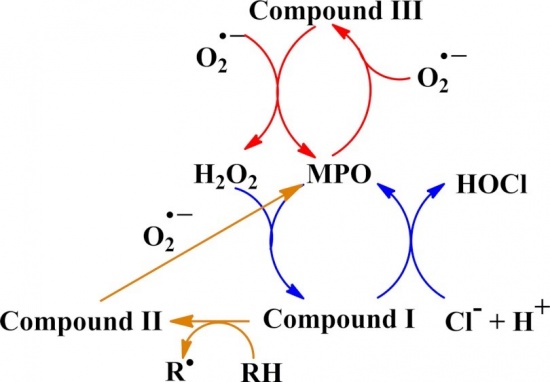
כאשר נויטרופילים משופעלים בעת פגוציטוזה, הם עוברים תהליך שנהוג להתייחס אליו כאל respiratory burst, בו נוצרות נגזרות פעילות של חמצן, כגון סופראוקסיד, ומי-חמצן שהם רעילים לחיידקים המוחדרים בתהליך פגוציטוזה אל ה-phagosome של הנויטרופילים. בין המערכות האנטי-מיקרוביאליות המשופעלות ב-phagosome נמצא גם את ה-MPO, המופרש ל-phagosome בעת תהליך הדה-גרנולציה, כמו גם H2O2 ו-halide שהוא בדרך כלל כלוריד. ניסויים בשנות ה-60 הראו ש-MPO מקטלז את ההפיכה של מי-חמצן ויוני כלוריד ליצירת hypochlorous acid או HOCl, המוביל ליצירה של כלור טוקסי, של כלוראמינים, רדיקאלים הידרוקסילים, ו-ozone.
ריאקציה זו פעילה פי-50 יותר מאשר מי-חמצן בהרג של חיידקים. מתברר ש-MPO מסוגל גם להביא לכלורינציה ישירה של חיידקים ולהרגם במנגנון זה. בנוסף להרג חיידקים, יצירת HOCl מסוגלת להשמיד פטריות, טפילים, חד-תאיים, נגיפים, תאי סרטן, תאי NK, תאים אדומים וטסיות דם. ייתכן ש MPO הוא גם בעל תפקיד בהחלשת תגובות דלקתיות על ידי וויסות תאי NK, על ידי הפחתת קשירת פפטידים לקולטנים כמוטקטיים, וכן על ידי חמצון עצמי ואינאקטיבציה של תוצרי תאים פולי-מורפו-נוקלאריים, כגון chemotaxins ו-α-1 proteinase inhibitor.
תפקידים נוספים של MPO כוללים יצירה של נגזרי כלור של טירוזיל, יצירת tyrosine peroxide, סיוע להצמדת תאים מייאלואידים דרך מולקולות β2-integrins וחמצון של ליפופרוטאינים בנסיוב, מה שיכול להצביע על תפקיד אפשרי של MPO בתהליך טרשת העורקים. יש ראיות ניסוייות לכך שאנשים עם מחלה כלילית יציבה, הם בעלי סיכון מוגבר לאירוע קרדיו-וסקולארי אם רמות MPO בדמם מוגברות.
יש להבדיל בין MPO לבין EPO או eosinophilic peroxidase, אנזים שונה המיוצר על ידי גן אחר. פרטים עם חסר ב-MPO בנויטרופילים ומונוציטים, הם בעלי רמות תקינות של EPO באיאוזינופילים.
משמעות התוצאות
רמה מוגברת של MPO היא בעלת יכולת ניבוי של microscopic polyangitis (להלן MPA) בנבדקים עם תוצאות שליליות של נוגדני antinuclear לאבחון Systemic lupus erythematosus, או ממצא שלילי לאיתור נוגדנים כנגד glomerular basement membrane (תסמונת Goodpasture). תוצאה שלילית של רמת MPO נמוכה, מקטינה את הסיכוי שמדובר ב-MPA (Klebanoff ב-J Leukoc Biol משנת 2005). למרות שרמות MPO לרוב נופלות בעקבות טיפול מוצלח של MPA, אין עדיין הנחיות מחייבות למדידת MPO בתרחיש קליני זה.
למרות שלא ניתן להבדיל בין MPA לבין סיבות אחרות לכשל כליות מתקדם או למחלה סיסטמית כגון Wegener granulomatosis, תסמונת Goodpasture או lupus nephritis, יש לבצע מדידת MPO במשותף עם בדיקות אבחוניות נוספות בהערכה ראשונית של נבדקים אלה. הבדיקות המומלצות בהקשר זה הן רמת נוגדנים כנגד MPO, antineutrophil cytoplasmic antibodies (ANCA), ורמת נוגדנים כנגד proteinase 3 או PR3. מבדק ANCA מזהה 2 סוגי נוגדנים: ציטופלזמטיים (cANCA) הספציפיים ל-PR3, ופרינוקלאריים (pANCA) הספציפיים ל-MPO.
הספציפיות האבחונית של MPO לתרחיש של MPA, מגיעה עד 95%, אך מומלץ שתוצאות חיוביות המתקבלות בשיטת EIA, תאושרנה בשיטת בדיקה נוספת, כגון בדיקת pANCA שעשויה לאשש תוצאה חיובית של MPO במקרים של MPA עם ספציפיות של 97%. עם זאת, תוצאות חיוביות של MPO דווחו בנבדקים עם SLE, עם תסמונת Goodpasture וכן עם תסמונת Churg-Strauss. לכן הקלינאי חייב לשלול את האבחונים האחרים כדי להגדיל את הספציפיות ואת ערך הניבוי החיובי (ppv) של תוצאת MPO המתקבלת.
לנוכחות נוגדנים עצמיים כנגד MPO יוחסו צורות אחדות של vasculitis, ובעיקר crescentic glomerulonephritis ותסמונת Churg-Strauss. הגילוי נעשה על ידי זיהוי סב-גרעיני של p-ANCAs, בניגוד לזיהוי בציטופלזמה של c-ANCAs המכוונים כנגד האנזים PR3, הכרוכים בחוזקה עם Wegener's granulomatosis.
האפידמיולוגיה של חסר ב-MPO
תפקידו העיקרי של MPO הוא הרג חיידקים. למרות שאנזים זה בודד לראשונה בשנת 1941, והחסר שלו תואר לראשונה בשנת 1954, הוא לא זכה לתשומת לב קלינית עד שנת 1966, זאת כיוון שרק חלק קטן מאלה עם חסר MPO הם בעלי יכולת מוגבלת להרוג חיידקים, ורוב אלה עם חסר זה הם א-תסמיניים. בארצות הברית הראו מחקרי סקר שחסר מלא או חלקי של האנזים מופיע בתדירות של 1 ל-1,400-2,000 איש באוכלוסייה. מחקרים במדינות שונות מצביעים על חסר מלא או חלקי של האנזים ב-1 מתוך אוכלוסייה של 2,727 איש. ביפן לדוגמה, שכיחות חסר זה נמצאה נמוכה בהרבה, ועל פי Petrides ו-Nauseef, חסר מלא נמצא במדינה זו ב-1 מתוך 57,135, וחסר חלקי מופיע של ב-1 מתוך 17,501 איש. עד שנות ה-70, ד֭ווחו רק 15 מקרים של חסר ב-MPO בעולם כולו, זאת כיוון שרוב המקרים היו א-תסמיניים, ולכן היה רק מיעוט של נבדקים לרמת MPO. אך טכניקות מעבדה מודרניות, ובעיקר אפליקציות נרחבות יותר של flow cytometry אוטומטי לקביעת תכונות של כדוריות דם לבנות, אפשרו בדיקות סקר של אוכלוסיות גדולות לקביעת חסר אפשרי של MPO (Marchetti וחב' ב-Jpn J Infect Dis משנת 2004).
הרג חיידקים בחסר של MPO
נויטרופילים החסרים MPO מסוגלים באופן נורמאלי להביא לפגוציטוזה של רוב החיידקים, אך היכולת של נויטרופילים אלו להרוג חיידקים נמוכה בדרגות שונות. לגבי חיידקים דוגמת Staph aureus, Serratia ו-E coli, הריגתם על ידי נויטרופילים משוללי-MPO מוחלשת בתחילה, אך מגיעה לרמות הרג נורמאליות לאחר פרק זמן. נתון זה מוכיח שמנגנון חלופי ואיטי יותר של הרג חיידקים פועל בתאים אלה בחסר MPO.
לא ניתן להרוג את הקורים המרכיבים את תפטיר הפטריות (hyphal elements) Aspergillus fumigatus ו-Candida albicans, אך הנבגים (spores) של A fumigatus ושל C albicans יכולים להיהרג במנגנון בלתי-תלוי. מסקנת נתונים אלה היא שהרג חיידקים אינה בהכרח מהווה בעיה למטופלים עם חסר MPO, אם כי ההרג של מספר פטריות כן עלול להיות בעייתי, בתלות בדרגת החסר של האנזים.
משמעות של MPO בתחלואות שונות: חסר גנטי של MPO הוא אחד התנאים לחסר חיסוני (immune deficiency) על פי Kutter וחב' ב-Acta hematol משנת 2000. נויטרופילים פולימורפנוקלאריים (PMN) מייצגים את התאים הדומיננטיים בתגובה חריפה להדבקה בקטריאלית. פעילות אנטי-מיקרוביאלית יעילה, מייצגת את הפעולה המשותפת של גורמים אנטי-בקטריאלים בפלזמה, עם זו של מולקולות נושאות חמצן פעיל, שמקורן ב-PMN, ובהן החלבון האזוּרוֹפילי MPO. העיכוב או החסר של מערכת ה-MPO-H2O2-halide מפחיתה באופן ניכר את יכולת תאי PMN להרוג מגוון של חיידקים, מה שמרמז לכך את העמדה הבכירה של MPO בהירארכיה של הפעילות האנטי-בקטריאלית של PMN. אכן, הפגמים הקליניים החשובים ביותר, מודגמים במטופלים החסרים את היכולת לייצר ROS או reactive oxygen species, כמו שמוצאים ב-chronic granulomatous disease.
חוקרים באירופה העריכו נבדקים עם חסר מוחלט של MPO ומצאו שבערך מחציתם סבלו מסיבוכים זיהומיים כאשר ב-10% מבין אלה נמצאו זיהומים מסכני-חיים, בעוד שחציים האחר היו א-תסמיניים. ההשערה היא שכיוון שאחוז ניכר מבין אלה עם חסר מלא או חלקי של MPO אינם סובלים מנטייה מוגברת לזיהומים, נראה שבלויקוציטים פולי-מורפו-נוקלאריים (PMNs) קיימים מנגנונים בלתי-תלויים שיכולים לתפקד למילוי החסר ב-MPO. נראה אם כן שזיהומים חמורים אינם שכיחים ומתרחשים בפחות מ-5% של אנשים עם חסר MPO. רוב המחלות הזיהומיות הן פטרייתיות (בעיקר Candida albicans או Candida tropicalis) המופיעות בחולי סוכרת. מטופלים ללא סוכרת סובלים רק לעיתים נדירות מזיהומים במקרי חסר MPO, אך הסיבה לכך לא ידועה.
לכן מומלץ שהקלינאי יברר אפשרות של חסר MPO במקרים של זיהומי פטרייתיות חודרניים. במטופלים ללא פגיעה ידועה במערכת החיסון שלהם שעלולה גם להיגרם מטיפול כימותרפי או בקורטיקו-סטרואידים, או באלה עם סוכרת. כללית, פגיעה במערכת החיסון בעקבות חסר ב-MPO נחשבת מתונה, והיא אמנם הוסרה מרשימת ה-Primary Immundeficiency Diseases על ידי האיגוד האימונולוגי הבינלאומי בשנת 2005.
היכולת המוגבלת להרוג סוגי פטריות מסוימים על ידי נויטרופילים החסרים MPO, אינה משותפת לכל סוגי הפטריות. ניסויים in vitro הראו ש-Candida albicans, Candida krusei, Candida tropicalis ו-Candida stellatoidea, אינם יכולים להיות מושמדים על ידי נויטרופילים חסרי MPO, אך לעומתם מיני קנדידה אחרים כגון Candida glabrata, Candida parapsilosis ו-Candida pseudotropicalis, יכולים להיות מושמדים על ידי תאי PMN, ללא תלות ב-MPO.
הקשר בין חסר ב-MPO לממאירות
מספר מחקרים בלתי תלויים מצאו קשר חזק בין חסר MPO לממאירויות שונות. בניסויים in vitro נמצא שנויטרופילים החסרים MPO היו בעלי כושר מופחת להשמדת תאים סרטניים (Marchetti וחב' ב-Hum Mutat משנת 2004). כמו כן נמצא שנויטרופילים ברקמה הריאתית מפרישים MPO בתגובה לנזק ריאתי שניוני לחשיפה לעשן סיגריות. נמצא ש-MPO מסוגל להמיר מטבוליטים של benzo[a]pyrene ממקור עשן טבק לקרצינוגנים פעילים יותר. לכן בהקשר זה, רמות מופחתות של MPO דווקא מקטינות את הסיכון לסרטן ריאות (Molin ו-Stendahl ב-Acta Med Scand משנת 1979).
מוטציות ב-MPO
המקרים המולדים של חסר ב-MPO יכולים להיגרם על ידי מספר מוטציות שמתוכן נזכיר את R569W, Y173C, M251T, G501S ו-R499C. מוטציה R569W היא הפגם השכיח ביותר המוכר , בו טריפטופן משחלף ארגינין בקודון 569. טריפטופן אינו מסוגל ליצור קשרים אלקטרוסטטיים. רוב המטופלים עם מוטציה זו מוגדרים כ-compound heterozygotes, אם כי תועד מקרה אחד שהיה הומוזיגוטי למוטציה. במקרה של מוטציה זו חל מעצור בשלב ה-apopro-MPO, וכך האנזים אינו מבשיל, בלתי פעיל אנזימטית, ואינו מועבר לגרנולות האזורופיליות בתא (Nauseef ב-Hematol Oncol Clin North Am משנת 1988).
במוטציה Y173C שייר ציסטאין משחלף טירוזין בקודון 173. שינוי זה מוביל ליצירת אתר נוסף לקשר די-סולפידי תוך-מולקולארי מה שגורם להתקפלות (folding) בלתי נורמאלית של החלבון. לפיכך, apopro-MPO הופך ל-pro-MPO פגום, הנלכד על ידי ה-chaperone המולקולארי calnexin ונכלא ברטיקולום האנדופלזמי, שם הוא מתפרק (DeLeo וחב' ב-J Clin Invest משנת 1998). במוטציה M251T נוצרות אמנם תת-יחידות בשלות של האנזים, אך פעילותו האנזימטית מאוד נמוכה. מוטציה G501S היא מוטציית missense, הגורמת לפגיעה בגומחה (pocket) הקושרת את גרעין ה-heme. מוטציה זו התגלתה במטופל ביפן, עם חסר מוחלט של האנזים (Nauseef ב-J Lab Clin Med משנת 1999).
מוטציה R499C נגרמת על ידי שחלוף של ארגינין על ידי ציסטאין באזור הקידוד של exon 9. גם מוטציה זו זוהתה במטופל יפני עם חסר מוחלט של MPO, שלא ניתן היה לגלות בשיטת Western blot (על פי Nauseef וחב' ב-J Leukoc Biol משנת 1998). המוטציות הנרכשות של MPO פחות שכיחות מהמוטציות המולדות, כאשר מוטציה נרכשת יכולה להיות זמנית, והתיקון באנזים יכול להתרחש בהתפוגג הסיבה שגרמה לפגם באנזים. בדרך כלל המוטציות הנרכשות גורמות לחסר חלקי באנזים, והן מופיעות רק בחלק מהנויטרופילים.
פתו-פיזיולוגיה של חסר מוּלד של MPO
חסר מולד של MPO נחשב בתחילה נוהג על פי המתווה הקלאסי של הורשה אוטוזומאלית-רצסיבית. זוהו מספר מוטציות גנטיות הגורמות לחסר MPO, אך אין ספק שמוטציות נוספות עדיין לא זוהו. קיימת סברה שרוב אלה עם חסר האנזים יכולים להיחשב כ- compound heterozygotes, דהיינו שיש בהם מוטציות שונות על כל אלל, אחת מכל הורה. חלק מהמוטציות גורמות לפגמים posttranslational, ומוטציות אחרות (שעדיין אינן מוגדרות בבירור) גורמות כנראה לפגמים pretranslational, כנראה כתוצאה משינויי מבנה באזורים הרגולטוריים של הגן MPO. מספר חוקרים הציעו מודל דו-גני בו יש אינטראקציה של 2 גנים, כגון יצירה של גן ושל גן רגולטורי. מובן שהבסיס הגנטי של מצב זה הוא הטרוגני ומורכב, וממתין להבהרות נוספות.
מצבים העלולים לגרום לחסר נרכש של MPO
חסר של MPO במצבים נרכשים הוא בדרך כלל זמני, ומתפוגג כשאר הסיבה הנרכשת לחסר זה נחלשת או נעלמת. כמו כן, חסר נרכש של MPO הוא בדרך כלל חלקי בו מעורבים רק חלק מה-PMNs (Marcetti וחב' ב-Hum Mutation משנת 2004).
- המצבים הבאים יכולים לגרום לחסר נרכש של MPO
היריון, הרעלת עופרת (המעכבת סינתזה של ה-heme שהוא מרכיב של ה-MPO הבשל), חסר ברזל, זיהום חמור שהוא שניוני לשפעול של PMN ו"צריכה" של MPO, סוכרת, מחלות תרומבוטיות, השתלת כליה, ותרחיש הידוע כ-Neural lipofuscinosis. תרופות ציטוטוקסיות, ומספר תכשירים מונעי-דלקת כגון dapson, sulfapyridine ו-5-aminosalicylic acid. כמו כן, מספר מפגעים המאטולוגיים וסרטנים יכולים לגרום לחסר נרכש של MPO, בעיקר אלה הקשורים לבּשלוּת של גרנולוציטים כגון,AML CML, polycythemia vera ומחלת הודג'קין. כמו כן עלולים לגרום לחסר נרכש של MPO מפגעים כמו אנמיה אפלסטית, myelodyplastic syndrome, אנמיה מגלובלסטית רפרקטורית ו-myelofibrosis עם מטאפלזיה מיאלואידית.
MPO ותחלואה קרדיו-וסקולארית
מחקר ראשוני משנת 2003 הציע ש-MPO יכול לשמש מנבא רגיש של MI במטופלים המתאשפזים עם כאבי חזה. מאז התפרסמו למעלה מ-150 מחקרים המאוששים את הנתון לפיו מדידה של MPO ושל CRP היא בעלת משמעות בתרחישים אלה. Heslop וחב' ב-J Am Coll Cardiol משנת 2010, דווחו על כך שמדידה משולבת של MPO ו-CRP, היא בעלת יכולת ניבוי טובה יותר מאשר מדידה יחידנית של CRP.
מחקרים עדכניים מדווחים על קשר בין רמות מוגברות של MPO לבין חומרת מחלת עורקים כליליים (Zhang וחב' ב-JAMA משנת 2001). גם Heslop וחב' דווחו בשנת 2010 ב- J Am Coll Cardiol שרמות מוגברות של MPO יותר מאשר הכפילו את הסיכון לתמותה ממחלה קרדיו-וסקולארית במעקב של 13 שנים. הועלתה השערה ש-MPO משחק תפקיד משמעותי בהתפתחות רבדים (plaques) טרשתיים וגורם לבדים אלה לאי-יציבות (Nicholls ו-Hazen ב- Arteriosclerosis Thromb Vasc Biol משנת 2005, ו-Lau ו-Baldus ב-Pharmacol The משנת 2006).
האנזים MPO מקטלז את יצירתם של ROS שיש להם השפעה על רמת nitric oxide וממילא על הרחבת כלי-דם, ועל תפקודם של תאי אנדותל (Vita וחב' ב-Circulation משנת 2004). המולקולה NO משמשת כמצע פיזיולוגי לפראוקסידאזות (Abu-Saud ו-Hazen ב-J Biol Chem משנת 2000). הולך ומתגבר העניין בקשר האפשרי בין רמה מוגברת של MPO לבין אי-ספיקת-לב (HF). מספר מחקרים הראו ש-MPO עשוי לספק הערכה פרוגנוסטית בתרחישים של כאבים בחזה ותסמונת כלילית חריפה (ACS) על פי Brennan וחב' ב-N Eng J Med משנת 2003, ו-Cavusoglu וחב' ב-Am J Cardiol משנת 2007, ו-Baldus וחב' ב-Circulation משנת 2003). מחקר שהתבצע בעיר Norfolk דיווח על כך שרמה סיסטמית של MPO ניבאה סיכון להתפתחות מחלה קרדיו-וסקולארית ומוות בנבדקים בגיל הביניים שהיו לכאורה בריאים (Meuwese וחב' ב-J Am Coll Cardiol משנת 2007).
תפקיד פתוגני פוטנציאלי של MPO בהתפתחות שיבוש תפקודי של החדר השמאלי ואי ספיקת לב גם כן השתמע ממחקרים אחדים (Macatta וחב' ב-J Am Coll Cardiol משנת 2007, ו-Tang וחב' ב-Am J Cardiol משנת 2006 וב-J Am Coll Cardiol משנת 2007). בבני-אדם הרמה הסיסטמית של MPO עלתה במטופלים עם אי-ספיקה כרונית סיסטולית, והייתה במתאם עם אי-תפקוד דיאסטולי באופן שהיה בלתי תלוי בגיל או ברמת brain natriuretic peptide. מחקרים נוספים הראו ש-MPO סיסטמי בנבדקים עם MI או עם אי-ספיקת לב כרונית סיסטולית, יכולה לנבא אירועים קליניים בתחום הקרדיו-וסקולארי באנשים לכאורה בריאים.
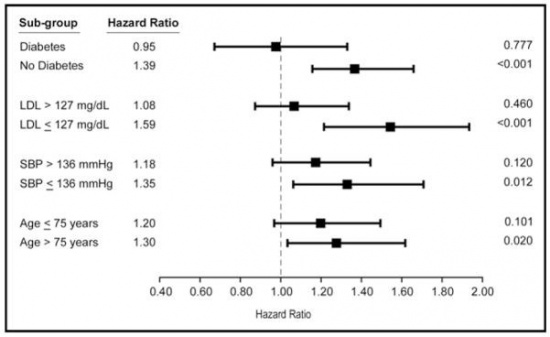
Tang וחב' פרסמו ב-Am J Cardiol משנת 2009 את מחקרם על המשמעות של MPO סיסטמי מוגבר בהקשר של המשמעות הפרוגנוסטית לנבא HF בנבדקים מבוגרים בריאים לכאורה. רמות MPO נמדדו ב-3,733 דגימות דם של אלה שהגיעו להערכה במסגרת ה-CHS (Cardiovascular Health Study). מבין אלה, 569 נבדקים פיתחו HF במהלך תקופה של 7.2±2.3 שנים של מעקב. נבדקים ברבעון (quartile) הגבוה ביותר של רמות MPO (מעל 432 פיקומול/ליטר) היו בעלי סיכון גבוה יותר ב-34% לפתח HF, לאחר התאמה לגיל, מגדר, התרחשות קודמת של MI, לחץ-דם סיסטולי, עישון, רמות LDL, סוכרת, וכל מחלה קרדיו-וסקולארית תת-קלינית (עם מובהקות סטטיסטית של 0.013p<). הסיכון היה אף גבוה יותר (46%) אם ההתאמה כללה ערכי CRP ו-cystatin C. פילוח התוצאות הראה שהמתאם בין רמות MPO לבין הסיכון ל-HF היה חזק יותר בנבדקים ללא גורמי-סיכון קרדיו-וסקולאריים מסורתיים (גיל מתחת 75 שנה, לחץ-דם סיסטולי מתחת ל-136 מ"מ כספית, ללא סוכרת וללא מחלה קרדיו-וסקולארית תת-קלינית), כפי שמתואר בתרשים למטה:
ערכות למדידת פעילות MPO בניטרופילים
- ערכת Cayman-שעושה שימוש במצע הכרומוגני TMB או 3,3’,5,5’-tetramethylbenzidine, שכאשר MPO מגיב איתו, נוצר תוצר ריאקציה בצבע כחול שניתן למדוד ספקטרו-פוטומטרית באורך גל של 650 ננומטר. כאשר עוצמת הצבע המתקבל פרופורציונית לכמות MPO בדגימה. מעכב ספציפי של MPO הידוע כ-4-aminobenzhydrazide נכלל אף הוא בערכה, ומשמש לאימות הספציפיות של הבדיקה. היה מקובל להשתמש ב-azide לעיכוב האנזים, אם כי התברר ש-4-ABH או 4-aminobenzoic acid hydrazide, הוא מעכב יותר ספציפי (על פי Kettle וחב' ב-Biochem J משנת 1997).
- ערכה לבדיקה קולורימטרית פועל על פי העיקרון ש-MPO מחמצן טירוזין תוך שימוש ב-H2O2 כגורם המחמצן. בערכה זו, ה-HClO הנוצר מ-H2O2 ומ-Cl, מגיב עם taurine ליצירה של taurine chloramine, המגיב בהמשך עם TNB2 להרחקת הצבע באורך גל 412 ננומטר. ערכה זו מספקת שיטה מהירה, פשוטה, רגישה ואמינה לנפח בדיקות גדול של פעילות MPO. ניתן להשתמש בערכה זו למדידה של פעילות MPO בריכוז נמוך של mU0.05 לכל באר בפלטת ELISA.
שיטות מעבדה
הנוכחות והריכוז של MPO יכולים להיקבע תוך שימוש במספר שיטות, כולל צביעות היסטוכימיות, אימונו-ציטומטריה, ו-flow cytometry. בתלות בשיטה יש לוודא שאוקסידאזה המופרשת מתאים אאוזינופילים (EPO) אינה משפיעה בקבלת תוצאות false positive (על פי Nauseef וחב' ב-J Leukoc Biol משנת 1998). השיטה הקלה ביותר היא להכין משטח של דם היקפי בו ניתן לצבוע לנוכחות פראוקסידאזה בניטרופילים (Petrides ב-J Mol Med משנת 1998). מבחן אחר הידוע כ-DHR או כ-Dihydrorhodamine 123, פועל בשיטת flow cytometry ומשמש ליצירת תוצרי ביניים מחמצנים פעילים בנבדקים עם חשד לחסר חיסוני. שיטה זו קלה לביצוע ואמינה יותר משיטת החיזור של nitroblue tetrazolium לאבחון של CGD או chronic granulomatous disease. בנקודת זמן זו, אין להשתמש במבחן DHR לגילוי חסר ב-MPO, בגלל רגישותו הנמוכה בגילוי חסר חלקי של האנזים. אם תוצאת בדיקת DHR מתאימה לאבחון CGD, אך ההיסטוריה הקלינית של הנבדק תואמת יותר חסר של MPO, יש לבצע בדיקות מעבדה נוספות של ריצוף גנטי או של צביעה תוך-תאית עם נוגדן כנגד MPO (על פי Petrides ו-Nauseef ב-J Mol Med משנת 1998).
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות שונות
- בדיקות מעבדה - מחלות בקטריאליות/ זיהום בקטריאלי-אלח-דם
- בדיקות מעבדה - תחלואת לב וכלי-דם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק