הבדלים בין גרסאות בדף "מערכות מיפוי אלקטרואנטומיות בתלת מימד של הלב - Three dimensional electroanatomical mapping of the heart"
| שורה 135: | שורה 135: | ||
| − | {{ייחוס|ד"ר רון סלע, היחידה לאלקטרופיזיולוגיה וקוצבים, | + | {{ייחוס|ד"ר רון סלע, היחידה לאלקטרופיזיולוגיה וקוצבים, המחלקה הקרדיולוגית, [http://www.wgh.org.il/ בית החולים לגליל המערבי], נהריה}} |
<center>'''פורסם בכתב העת Israeli Journal of Pediatrics, אפריל 2011, גיליון מס' 1, מדיקל מדיה'''</center> | <center>'''פורסם בכתב העת Israeli Journal of Pediatrics, אפריל 2011, גיליון מס' 1, מדיקל מדיה'''</center> | ||
גרסה מ־17:12, 2 ביולי 2012
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – הפרעת קצב
| מערכות מיפוי אלקטרואנטומיות בתלת מימד של הלב | ||
|---|---|---|
| Three dimensional electroanatomical mapping of the heart | ||
| יוצר הערך | ד"ר רון סלע
|
|
בדיקה אלקטרו-פיזיולוגית (Electrophysiology Testing) וצריבה באמצעות גלי רדיו (Radiofrequency Ablation) הם היום פתרון טיפולי למגוון רחב של הפרעות קצב.
בעבר טופלו בעיקר הפרעות קצב פשוטות יחסית לצריבה עם אזור מוגדר היטב לצריבה (סוגים שונים של SVT, כגון Atrioventricular Nodal Reentry Tachycardia או Atrioventricular Reentry Tachycardia), אך היום ניתן לטפל בהפרעות קצב מורכבות יותר, כמו רפרוף פרוזדורים לא טיפוסי, פרפור פרוזדורים וטכיקרדיה חדרית. הפרעות קצב אלו קשורות לעתים למחלה מבנית (סטרוקטורלית) משמעותית של הלב, כמו פגמים מולדים לאחר אוטמים בשריר הלב או לאחר ניתוחים בלב. כדי לטפל באותן הפרעות קצב מורכבות פותחו מספר מערכות מיפוי, (Electroanatomic Mapping) EAM, המאפשרות לרופא לרשום פעילות חשמלית תוך-לבבית מקומית ביחס למיקום אנטומי תלת-ממדי בתוך חלל הלב, בזמן הפרעת הקצב. מספר מערכות למיפוי אלקטרואנטומי קיימות היום. טכנולוגיות אלו מאפשרות לאתר באופן מדויק את מוקד הפרעת הקצב, להגדיר באופן תלת-ממדי את האזור בלב שממנו מגיעה הפרעת הקצב, לאפשר מניפולציה של קתטר אבלציה, ולציין את מיקומו בצורה מדויקת וללא צורך בשיקוף ובשימוש בקרינת רנטגן. מערכות אלו מפשטות את שלב המיפוי ומעלות את אחוז הצלחת הפעולה, במיוחד בהפרעות קצב מורכבות הקשורות לאזורים אנטומיים מורכבים.
נעזרים במערכות למיפוי אלקטרואנטומי בתלת-ממד כאשר המקור להפרעת הקצב נמצא ליד אזור אנטומי חשוב, והחשש הוא מפגיעה באזור חשוב זה בזמן האבלציה, ולכן מערכת ה-EAM יכולה לסמן את אותו אזור חשוב כדי להימנע מפגיעה בו בזמן הצריבה.
כמו כן, כאשר הפרעת קצב מורכבת קשורה לאזור צלקתי התורם ליצירה של Macroreentry, מערכת המיפוי יכולה לעזור ב"חשיפת" אותו אזור צלקתי שמהווה את מקור הפרעת הקצב.
יש הפרעות קצב שאינן יציבות המודינמית, ולכן במצב זה לא ניתן לבצע מיפוי קונוונציונלי בזמן הפרעת הקצב, והמערכת למיפוי בתלת-ממד מאפשרת למפות בצורה טובה יותר מאשר שיקוף בלבד את אותם אזורים "חשודים" שהם חלק ממנגנון יצירת הפרעת הקצב.
יתרון משמעותי נוסף הוא הירידה בצורך בשימוש בשיקוף ובקרינת רנטגן (Fluoroscopy) כדי לוודא את מיקומו של קתטר האבלציה בצורה מדויקת. היתרון הוא הן לפציינט והן למפעיל. ואכן, מחקרים רבים הראו ירידה משמעותית בזמן השיקוף בפעילות עם מערכות אלו לעומת מיפוי קונוונציונלי.
החיסרון במערכות אלו הוא עלותן הגבוהה יחסית והצורך בהכנה נוספת הכרוכה בתפעול המערכות הנ"ל.
CARTO Mapping System
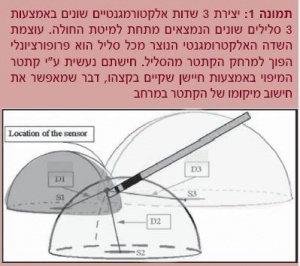
מערכת ה-CARTO (Biosense, Diamond Bar, CA, USA) מופעלת באמצעות שדה מגנטי בעל עוצמה נמוכה (5 x 10-6 to 5 x 10-5 Tesla) הנוצר בנפרד משלושה סלילים המונחים מתחת למיטת החולה במעין מבנה של משולש עם 3 קודקודים (סלילים). עוצמת השדה המגנטי מכל סליל נמדדת ע"י חיישן הנמצא בקצה קתטר המיפוי. עוצמת השדה המגנטי הנוצר מכל סליל היא פרופורציונלית הפוכה למרחק שבין החיישן לאותו סלילי. מכאן שע"י אינטגרציה של מרחק קתטר המיפוי מכל אחר מהסלילים (המתורגם מעוצמת השדה המגנטי מכל סליל) ניתן למקם את הקתטר במרחב (תמונה 1).
לקתטר יש חלק דיסטלי ופרוקסימלי, וקצהו יכול לגרום לצריבה (אבלציה) באמצעות גלי רדיו (RF). ניתן להזיז את הקתטר בחלל הלב כדי לרשום את עוצמת הפעילות החשמלית האנדו קרדיאלית המקומית, לתזמן אותה, ובו בזמן לרשום נקודות ציון במרחב וליצור מבנה גאומטרי בתלת-ממד.
מחקרים בבני אדם הצביעו על דיוק מערכת CARTO בכל הנוגע לבניית המודל הגאומטרי בתלת-ממד, מפת האקטיווציה של הפעילות החשמלית בזמן הפרעת הקצב והדיוק במיקום בתמונת התלת ממד (Spatial Precision).
המערכת יכולה גם לציין באופן מדויק מבנים אנטומיים חשובים שלא נרצה לפגוע בהם בזמן אבלציה (כמו Bundle of His), אזורים של צלקת (באמצעות Voltage Map) וכלי דם (סינוס קורונרי - CS, ורידים ריאתיים - PVs וכו).
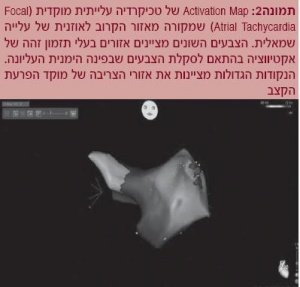
כדי ליצור מפת אקטיווציה (התקדמות הדפולריזציה בחלל הלב הנדגם) נבחר אזור ייחוס שרירותי (Timing Reference) היכול להיות מאלקטרודה של אק"ג או רישום מתוך קתטר קבוע באותו חלל שנדגם (Intra cardiac electrogram - EGM), ואז במהלך דגימות מאזורים שונים בתוך אותו חלל, התיזמון של הרישום בנקודות השונות נמדד ביחס לתזמון של ה-Reference וכך נוצרת מפת אקטיווציה על פני המפה האנטומית בתלת-ממד (תמונה 2).
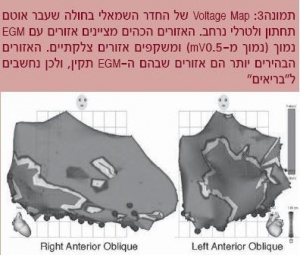
ניתן לזהות אזורים צלקתיים (Scar Mapping) ע"י מעקב אחר האמפליטודה של הפוטנציאל המקומי שבו נמצא הקתטר. באזורים צלקתיים האמפליטודה תהיה נמוכה יותר מאשר באזורים "בריאים".
החשיבות שביצירת ה-Scar Map היא שאזורים צלקתיים הם כר ליצירת מעגלי Reentry ולהפרעות קצב חוזרות ולעתים אף לא יציבות המודינמית, כך שלא ניתן למפות את הפרעות הקצב בזמן הפרעת הקצב, ולכן ישנה חשיבות רבה ליצירת Scar Mapping במיוחד במצבים אלו (תמונה 3).
CARTO Merge היא אופציה נוספת המאפשרת השלכה של מבנה בתלת-ממד שנבנה באמצעות דימות (CT אוMRI ) לפני הפעולה על מבנה בתלת-ממד שנוצר בזמן אמת ע"י מערכת ה-CARTO, כך ששני המבנים התלת-ממדיים עוברים מעין מיזוג (Merging). תהליך זה עוזר למפעיל להבין טוב יותר חללים אנטומיים מורכבים (למשל, מבנה העלייה השמאלית ואזורי החיבור בין ורידי הריאה לעלייה השמאלית בזמן אבלציה של פרפור פרוזדורים) (תמונה 4).
מערכת ה-EnSiteNavX. (Endocardial Solutions, St Jude Medical, Inc, St Paul, MN, USA), גם היא מערכת למיפוי אלקטרואנטומי.
עקרון מערכת זו בנוי על העברת זרמים נמוכים ומדידת התנגדויות דרך מדבקות הנמצאות על גוף החולה בצירים שונים. מדידת המתח וההתנגדות בכל קתטר הנוצר מהזרמים המופקים מאותן מדבקות מאפשרות את מדידת המרחק מאותן מדבקות ומכאן את מיקומו במרחב. בצורה זו ניתן למקם כל אחד מהקתטרים במרחב. ניתן ליצור גאומטריה בתלת-ממד של חללי הלב ע"י הזזת הקתטר לאורך צדו האנדוקרדיאלי של אותו חלל.
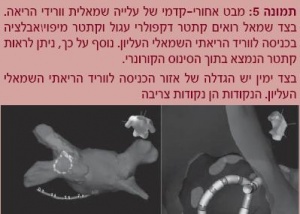
גם מערכת זו, בדומה למערכת ה-CARTO, הוכיחה את יעילותה בהורדת זמן השיקוף וקרינת הרנטגן, קיצור זמן הפעולה ושיפור דיוקה (תמונה 5).
Noncontact mapping
מערכת מיפוי שנעשה בה שימוש בקתטר המכיל מערך של מספר רב של אלקטרודות (Multi-Electrode Array - MEA), (Ensite, Endocardial Solutions Inc, St Paul, MN, USA) המאפשר רישום בו-זמני של האקטיווציה החשמלית ממספר אזורים.
ה-MEA הוא למעשה בלון הניתן לניפוח. על שטח פניו ממוקמות 64 אלקטרודות (תמונה 6). מערך צפוף זה של אלקטרודות מאפשר מיפוי מדויק של הפרעת קצב אפילו באמצעות פעימה בודדת של הפרעת הקצב.
הפעילות החשמלית הנמדדת ע"י ה-MEA מושלכת על אותו חלל גאומטרי שבו מתבצעת הדגימה, ומשקפת את הפעילות החשמלית של הצד האנדוקרדיאלי של אותו חלל.
מערכת זו הוכיחה במספר מחקרים על חיות את דיוקה כמשקפת את הפעילות החשמליח האנדוקרדיאלית המתקבלת מה-MEA (הן מבחינת התזמון והן מבחינת עוצמות הרישום).
היתרון של מערכת ה-Ensite Non-Contact Mapping הוא שהיא מאפשרת רישום פעילות חשמלית ממספר רב של אזורים בו-זמנית מפעימה בודדת בלבד. דבר זה מאפשר למפות פעימות עלייתיות או חדריות בודדות או אריתמיות לא ממושכות (Non-Sustained Arrhythmias) או הפרעות קצב לא יציבות המודינמית.
החיסרון של מערכת זו הוא שדיוקה הולך וקטן כאשר מרחקה מהאזור הנדגם הוא גדול יותר. במרחק של 50 מ"מ מהאזור הנדגם דיוקה נפגע באופן משמעותי. כמו כן, עקב גודלה של מערכת זו, יש לעתים קשיים במיקום המערכת בחלל הנדגם.
סיכום
קיימות מספר מערכות למיפוי אלקטרואנטומי בתלת-ממד המסייעות במיפוי הפרעות הקצב ובטיפול בהן באמצעות צריבה. לכל מערכת יש הטכנולוגיה שלה, היתרונות והחסרונות שלה.
הצורך בשימוש במערכות אלקטרואנטומיות ספציפיות תלוי במידע שבו אנו מעוניינים לקבל מהמערכת (Activation Mapping, Substrate Mapping, Cardiac Geometry) ובסוג הפרעת הקצב שאנו מעוניינים למפות. מערכות אלו מאפשרות לקבל מידע חשוב למפעיל ומסייעות באופן משמעותי לתהליך מיפוי הפרעת הקצב והבנת מקורה, והיא מורידה באופן משמעותי את החשיפה לקרינת רנטגן. עם זאת, יש לזכור שהיא אינה מחליפה את הצורך של ההבנה והפירוש הזהיר והמדויק של המידע המתקבל ממערכות אלו ומערכות ניטור אחרות המצריכות הבנה של עקרונות האלקטרופיזיולוגיה.
ביבליוגרפיה
- Deepak Bhakta, John M Miller. Principles of Electroanatomic Mapping. Indian Pacing and Electrophysiology Journal 2008; 8(1):32-50
- Earley M, Showkathali R, Alzetani M, et al. Radiofrequency ablation of arrhythmias guided by non-fluoroscopic catheter location: A prospective randomizedtrial. Eur Heart J 2006;27:1223-1229
- Kirchhof P, Loh P, Eckardt L, et al. A novel nonfluoroscopic catheter visualization system (LocaLisa) to reduce radiation exposure during catheter ablation of supraventricular tachycardias. Am J Cardiol 2002;90:340-343
- Kopelman H, Prater S, Tondato F, et al. Slow pathway catheter ablation of atrioventricular nodal re-entrant tachycardia guided by electroanatomical mapping: a randomizedcomparison to the conventional approach. Europace 2003;5:171-174
- Sporton S, Earley M, Nathan A, et al. Electroanatomic versus fluoroscopic mapping forcatheter ablation procedures: a prospective randomized study. J Cardiovasc Electrophysiol 2004;15:310-315
- Kottkamp H, Hugl B, Krauss B, et al. Electromagnetic versus fluoroscopic mapping of the inferior isthmus for ablation of typical atrial flutter. A prospective randomized study. Circulation 2000;102:2082-2086
- Schenider M, Ndrepepa G, Dobran I, et al. LocaLisa catheternavigation reduces fluoroscopy time and dosage in ablation of atrial flutter: A prospective randomized study. J Cardiovasc Electrophysiol 2003;14:587-590
- Ventura R, Rostock T, Klemm H, et al. Catheter ablation of common-type atrial flutter guided by three-dimensional right atrial geometry econstruction andcatheter tracking using cutaneous patches: a randomized prospective study. J Cardiovasc Electrophysiol 2004;15:1157-1161
- Willems S, Weiss C, Ventura R, et al. Catheter ablation of atrial flutter guided by electroanatomic mapping (CARTO): A randomized comparison to theconventional approach. J Cardiovasc Electrophysiol 2000;11:1223-1230
- Estner H, Deisenhofer I, Luik A, et al. Electrical isolation of pulmonary veins in patients with atrial fibrillation: reduction of fluoroscopy exposure and procedure duration by the use of a non-fluoroscopic navigation system (NavX). Europace 2006;8:583-587
- Macle L, Jais P, Scavee C, et al. Pulmonary vein disconnection using the LocaLisa three-dimensional nonfluoroscopic catheter imaging system. J Cardiovasc Electrophysiol 2003;14:693-697
- Rotter M, Takahashi Y, Sanders P, et al. Reduction of fluoroscopy exposure and procedure duration during ablation of atrial fibrillation using a novelanatomical navigation system. Eur Heart J 2005;26:1415-1421
- Gepstein L, Hayam G, Ben-Haim S. A novel method for nonfluoroscopic catheter-based electroanatomical mapping of the heart. In vitro and in vivo accuracy results.Circulation 1997;95:1611-1622
- Shpun S, Gepstein L, Hayam G, et al. Guidance of radiofrequency endocardial ablation with real-time three-dimensional magnetic navigation system. Circulation 1997;96:2016-2021
- Hayam G, Gepstein L, Ben-Haim S. Accuracy of the in vivo determination of location Usinga new nonfluoroscopicelectroanatomical mapping system. PACE (Abstract) 1996;19:712
- Smeets J, Ben-Haim S, Rodriguez L, et al. New method for nonfluoroscopicendocardial mapping in humans. Accuracy assessment and first clinical results. Circulation 1998;97:2426-2432
- Krum D, Goel A, Hauck J, et al. Catheter location, tracking, cardiac chamber geometry creation, and ablation using cutaneous patches. J Interv Card Electrophysiol 2005;12:17-22
- Packer D. Three-dimensional mapping in interventional electrophysiology: techniques andtechnology. J Cardiovasc Electrophysiol 2005;16:1110-1116
- Gornick C, Adler S, Pederson B, et al. Validation of a new noncontact catheter system for electroanatomic mapping of left ventricular endocardium. Circulation 1999;99:829-835
- Schilling R, Peters N, Davies D. Simultaneous endocardial mapping in the human left ventricle using a noncontact catheter. Comparison of contact and reconstructed electrogramsduring sinus rhythm. Circulation 1998;98:887-898
- De Groot N, Bootsma M, van der Velde E, et al. Three-dimensional catheter positioning during radiofrequency ablation in patients: first application of a real-time positionmanagement system. J CardiovascElectrophysiol 2000;11:1183-1192
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר רון סלע, היחידה לאלקטרופיזיולוגיה וקוצבים, המחלקה הקרדיולוגית, בית החולים לגליל המערבי, נהריה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק