מצליבי פירידיניום - Pyridinium crosslinks
| מדריך בדיקות מעבדה | |
| מצליבי פירידיניום | |
|---|---|
| Pyridinium crosslinks | |
| מעבדה | כימיה בשתן |
| תחום | הערכת אוסטאופורוזה, מחלת Paget ומפגעי עצם אחרים |
| יחידות מדידה | מיקרומול' /מול' קראטינין |
| טווח ערכים תקין | מדדים נבדקים: pyridinolinium (להלן Pyd)ו-deoxypyridinolinium (להלן Dpyd) טווח ערכים תקין של pyridinolinium: בגיל 0-11 חודשים - 353-560; בגיל 1-3 שנים - 108-400; בגיל 4-9 שנים - 117-325; בגיל 10-14 שנים - 101-299; בגיל 15-18 שנים - 40-148; במבוגרים מעל גיל 18 שנים - 20-50; בנשים לפני גיל חידלון הווסת - 22-89. טווח ערכים תקין של deoxy-pyridinolinium: בגיל 0-11 חודשים - 46-113; בגיל 1-3 שנים - 19-94; בגיל 4-9 שנים - 22-83; בגיל-10-14 שנים - 15-70; בגיל 15-18 שנים - 12-23; במבוגרים מעל גיל 18 שנים - 5-14; בנשים לפני גיל חידלון הווסת - 4-21. |
| יוצר הערך | פרופ' בן-עמי סלע |
בסיס פיזיולוגי
אוסטאופורוזה, אך גם מחלות עצם אחרות כגון פג'ט, osteogenesis imperfecta וכן-hyperparathyroidism, מאופיינות על ידי דעיכה בתכולת המינראלים של העצם, ופגיעה במיקרו-סטרוקטורה שלו. ממצאים אלה מחלישים את חוזק העצם, מובילים לשברים ולמגבלות ולנכות קשה. מה שבולט במפגעים אלה היא התגברות תהליכי ספיגת העצם על תהליכי בנייתה.
למרות שאוסטאופורוזה מזוהה בדרך כלל עם נשים בגיל המעבר, היא פוגעת גם בגברים בגיל מתקדם, ואף בצעירים כתוצאה מטיפול בתרופות סטרואידיות ואחרות. המחלה הכלל-גופית היא בעיקר בהקשר של מנופאוזה וזקנה, אך יכולה להיגרם באזורי עצם ממוקדים יותר, בעיקר בחולי סרטן, בשלב גרורתי של המחלה. בארה"ב כ-30% מהנשים הלבנות בגיל המעבר סובלות מאוסטאופורוזה לדרגותיה, כאשר בכל שנה יתווספו שם כ-250,000 מקרים חדשים של שברים בצוואר הירך בנשים אלה.
אוסטאופורוזה נגרמת בחולי סרטן גם מפעולת הפפטיד PTHrP או PTH related protein, המיוצר ומופרש מתאי הסרטן. PTHrP גורם להתמיינות של תאים בשלב קדם-אוסטאוקלסטי לתאים אוסטאוקלסטים, מה שתורם לפירוק רקמת העצם. PTHrP פועל בדומה ל-PTH על אותם קולטנים, אך אינו נתון לאותה בקרה לה נתון ההורמון הפארא-תירואידי. בנשים מניקות מוצאים ריכוזי PTHrP גבוהים, ויצירתם מושרית על ידי ההורמון פרולקטין, במטרה לגייס סידן מרקמת העצם לצורך היצירה המוגברת של חלב אם.
התאים האוסטאוקלסטים המפרישים חומרים מפרקי עצם, הם תאים רב גרעיניים הגדולים בהשוואה לתאים האוסטאובלסטים, התאים בוני העצם המסנתזים קולאגן ואוסטאוקלצין, ואחראיים למינרליזציה של העצם. למעשה, אוסטאובלסטים כמו גם תאי סטרומה של העצם אחראיים להתמיינות של קדם-אוסטאוקלסטים והפיכתם לאוסטאובלסטים. בעצם הבוגרת תהליכי בניית עצם ופירוקה נעשים ללא-הרף במקביל, והם נמצאים תחת בקרה של ויטמין D, ההורמון PTH וקלציטונין.
כאמור, החלבון העיקרי של העצם, קולאגן, בנוי משֶזֶר של שלוש שרשראות חלבוניות היוצרות מבנה תלת-גדילי, הקרוי טרופוקולאגן, כאשר יחידות של האחרון המחוברות ביניהן יוצרות מיקרופיברילות ופיברילות. המבנה התלת-גדילי מורכב משתי שרשראות 1α ומשרשרת אחת α2. יצירת ה-triplet הגדילי, מתחילה בתוך תא האוסטאובלסט, על ידי הכוונה של הקצה הקרבוקסילי עתיר שיירי ציסטאין שיוצרים קשרים די-סולפידיים. הקולאגן מופרש כקדם-קולאגן, ואילו יצירת הסליל מושלמת מחוץ לאוסטאובלסט. הקולאגן הוא חלבון עשיר מאוד בחומצות האמינו גליצין, פרולין והידרוקסי-פרולין.
מדדים ביוכימיים מקובלים להערכת חילוף החומרים של רקמת עצם
שלוש גישות אבחוניות מקובלות להערכת מפגעים במטבוליזם של רקמת העצם: ביופסיית עצם, מדידת צפיפות העצם ומדידת סמנים ביוכימיים ספציפיים לרקמה זו. לאחרונה מתגבר השימוש במדידת סמנים ביוכימיים אלה, הן בשל הרתיעה מהליך ביופסיה חודרני, וכן מפאת היעילות המוגבלת של מדידת צפיפות העצם שאמנם משמעותית לאבחון אוסטאופורוזה, אך אינה מספקת מידע על תהליכים דינאמיים של בניית עצם או ספיגתה.
סמנים של בניית עצם
- מדידת ריכוז האנזים alkaline phosphatase, וקביעה אלקטרופורטית של האיזואנזים הסגולי לעצם. אנזים זה מיוצר על ידי תאים יוצרי עצם-אוסטאובלסטים, ותפקידו לספק מינראלים לתהליך המינרליזציה.
- מדידת רמת osteocalcin החלבון הלא-קולאגני השכיח ביותר בעצם (1-2% מכלל תכולת החלבון בעצם), שהוא פפטיד בן 49 חומצות אמינו המופרש מאוסטיאובלסטים, ותפקידו לשמר הומאוסטזיס של משק הסידן ומינרלים אחרים. הוא עשיר בחומצה גלוטמית אליה נקשר סידן.
- קביעת רמת הפרופפטיד ה-C טרמינאלי של קולאגן (PICP) או קביעת רמת הפרופפטיד ה-N טרמינאלי של קולאגן (PINP).
סמנים של פרוק או ספיגת עצם המואצת במחלות קטאבוליות של העצם כגון אוסטאופורוזה או פאג'ט
- הידרוקסיפרולין, חומצת אמינו אופיינית לקולאגן, המהווה 12-14% מתכולת חומצות האמינו של חלבון זה, אך אינה נחשבת לסמן ספציפי במיוחד.
- מדידת תוצרי פירוק של קולאגן בנקודת הצילוב עם ליזין, שניתן למדוד כ-N-terminal telopeptide או NTX , או כ- carboxy terminal telopeptide או CTX.
לבדיקות שלמעלה יש מגבלות לא מעטות, שיפורטו להלן: מדידת סך-הפעילות של פוספאטזה בסיסית משמשת אכן מדד יעיל, שכן עלייה ברמתה מופיעה לדוגמה במחלת Paget, בשל יצירת עצם מוחשת, כמו גם במצבים עם עלייה משמעותית בפעילות אוסטאובלסטית, כגון osteitis fibrosa, הבאה לביטוי בפעילות יתר של בלוטות יותרת התריס, או באוסטאומלציה. לעומת זאת, באוסטאופורוזה עם שינויים שלדיים ביוכימיים פחות בולטים, העלייה ברמת האיזואנזים האמור יכולה להיות זניחה, ביחס לסך-פעילות הפוספאטזה ממקור הכבד והמעי. שיטות האלקטרופורזה המקובלות להפרדה ביו איזואנזימים ממקור עצם או כבד אינן יעילות, ושימוש חדשני יותר בנוגדנים חד-שבטיים המגיבים ספציפית רק עם האנזים ממקור עצם, אינו רווח במעבדות שגרה קליניות.
אוסטאוקלצין, נוצר בלעדית באוסטאובלסט, ומקובל שריכוזו בנסיוב עולה במקביל ליצירת עצם מוגברת. אך ייתכן שמבנים חלקיים של אוסטאוקלצין המופיעים בנסיוב, משקפים תהליך של ספיגת עצם. למרות שמקובל שפפטיד זה משקף פעילות אוסטאובלסטית מוגברת, הרי במצב של כשל כלייתי, רמתו בנסיוב מוגברת באופן חריג. בנוסף, גרורות ממאירות בשלד אינן מביאות בהכרח לעלייה ברמת אוסטאוקלצין בנסיוב, וקיימת אי-הסכמה לגבי תנודות מחזוריות משמעותיות ברמת חלבון זה במשך שעות היממה.
מחקר בו השוו מגוון מבדקים על בסיס שימוש בנוגדנים לאוסטאקלצין במצבים פתולוגיים שונים, העלה שבחולים עם אוסטאופורוזה, יתר פעילות של בלוטת התריס, יתר פעילות ראשונית של בלוטת יותרת-התריס (PHPT או primary hyperparathyroidism), או באלה עם מחלת Paget, מחלה ממארת עם גרורות לעצם ודלקת פרקים שיגרונתית RA)), ערכי אוסטאוקלצין בנסיוב היו גבוהים משמעותית מערכי קבוצת הבקרה. לעומת זאת בנשים עם עם אוסטאופורוזה של גיל חידלון הווסת, ערכי אוסטאוקלצין הראו רמות גבוהות או נמוכות מהערכים התקינים. במחלת Paget מהות המפגע באי-התאמה בין יצירת עצם וספיגתו, ובכך מוסברת אי-רגישותו של אוסטאוקלצין כמדד לעוצמת המחלה, או לתגובה לטיפול תרופתי.
קולאגן-מרכיב מרכזי בעצם
קולאגן מיוצר כמולקולת קודמן, פרוקולאגן, המכילה 2 תוספי-פפטידים בקצוות ה-C וה-N טרמינאליים. שני פפטידי-קצה אלה מופרדים הידרוליטית לפני השתלבות הקולאגן כסיב לתוך מרקם העצם, ומדידתם יכולה לשמש להערכת הפעילות האוסטאובלסטית ויצירת העצם, והיא נעשית באמצעות נוגדנים חד-שבטיים. כן פותח תבחין נוסף למדידת telopeptide, שהוא מקטע פפטידי של קצה מולקולת הקולאגן, והוא אימונוגני ביותר. לא ברור האם מדידה זו משקפת תהליך של בניית עצם או ספיגתה, אך ברור שתבחין זה הוא בעל פוטנציאל מעבדתי רב.
ראוי לאזכר גם את הנגזר הסוכרי של הידרוקסיליזין, ה-hydroxylysine galactosyl, המופיע בסוגי קולאגן שוני, אך ריכוזו גבוה פי 5-7 בקולאגן העצם בהשוואה לקולאגן העור.
נראה שהתבחין שהיה נפוץ ביותר עד אמצע שנות ה-90 להערכת ספיגה מוגברת או הרס גרורתי של רקמת עצם, היה קביעת רמת 4hydroxyproline בשתן. חומצה אמינית יוצאת דופן זו ייחודית לקולאגן, ובמחלות כמו Paget או אוסטאופורוזה, הפרשתה לשתן מוגברת משמעותית. אולם, המגבלה של שיטה זו היא בכך, שהידרוקסיפרולין המווה מרכיב בכל סוגי הקולאגן, כחלק מסחוס, עצם או זה של רקמות עור ואחרות, ולכן רמתו עלולה לשקף מפגעים כספחת (פסוריאזיס) ואחרים. כמו כן צריכת מזון עתיר ג'לטין או זה מן החי, תתרום משמעותית לרמת הידרוקסיפרולין בשתן.
נגזרות פירידיניום-מרכיבי קולאגן בסחוס ובעצם
המחקר לאיתור סמנים להרס רקמת עצם מתמקד בקולאגן העצם, כמקור למולקולות ייחודיות שמשתחררות בעת התהליך הקאטאבולי. כבר ב-1978 דיווח Hayashi על כך שאחד הקשרים המְצָלבים בחלבון קולאגן, ה-pyridolin, שהוא נגזר של 3hydroxypyridine, מופיע רק בסיבי קולאגן חוץ-תאיים בעצם ובסחוס. מולקולת הקולאגן, כמו זו של פיברין, מיוצרת על ידי קִשרי הצלבה (crosslinks) קוולנטיים, המצמידים סיבי טרופוקולאגן המהווים את חלבון השלד הזה. קשרים אלה נוצרים על ידי חיבורם של 2 שיירים של הידרוקסיליזין ושייר אחד של ליזין אל מולקולת פירידין, כאשר תוצר ההצלבה ידוע כפירידינולין או בשמו המלא hydroxylysyl pyridinoline (להלן Pyd). נראה ש-4 שיירים על כל שרשרת טרופוקולאגן יכולים להשתתף ביצירת קשרי הצלבה אלה: שני שיירי הליזין בקמות ה-C וה-N טרמינאליים של החלבון, וכן שני שיירי הידרוקסיליזין בעמדות 87 ו-930 בטרופוקולאגן.
קשרי צילוב בקולאגן ובחלבון elastin מתרחשים דרך שיירי lysyl ו-hydroxylysyl על ידי האנזים lysyl oxidase. לראשונה תארו Fujimoto וחב' את הבידוד והאפיון של חומר פלואורסצנטי בגיד אכילס של בקר וכינו אותו pyridinoline. כבר חוקרים אלה קבעו שפירידינולין מופיע רק בקולאגן ממקור עצם וסחוס, אך נעדר לחלוטין מקולאגן של רקמת עור. זאת ועוד, פירידינולין לא נמצא בקולאגן "צעיר" שסונתז זה עתה, והוא נוצר במהלך ההבשלה של סיבי קולאגן מקשרי הצלבה של aldimine, שהוא imine אנאלוגי לאלדהיד ונוסחתו R-CH=N-R’.
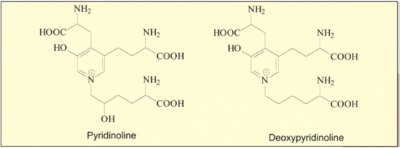
Pyd מהווה אם כן מיצלב תלת-ערכי, והוא מהווה את חלק הארי בקשרים הבין-שרשרתיים בקולאגן ממקור סחוס, וכן בקולאגן העצם. מאוחר יותר התגלתה בשנת 1987 על ידי Robbins ו-Duncan, נגזרת נוספת של Pyd, ה-deoxypyridinolin, שהוא למעשה lysylpyridinoline (להלן Dpyd). המייחד את Dpyd הוא בכך שהוא מופיע בעיקר בקולאגן העצם, אך גם בדנטין, בגיד ובקולאגן דופן העורק, שהן רקמות עם שיעור קאטאבולי נמוך. בכך הפך Dpyd לכאורה לסמן המיוחל בהיותו משקף בלעדית פירוק של קולאגן העצם. ריכוזו של מיצלב Pyd בקולאגן (type 1) של עצם "בוגרת" גבוה פי 3.5 עד פי-4 מזה של Dpyd. נוסחאות Pyd ו-Dpyd מופיעות בתרשים הבא:
יש חשיבות רבה לעובדה שאף לא אחד משני מצלבי פירידיניום אלה מצוי בקולאגן העור, שהוא התורם הנכבד ביותר לתוצרי פירוק קולאגן בשתן, ובהתאם יש להם עדיפות רבה על פני מדד כמו הידרוקסיפרולין. יתרה מכך, Pyd ו-Dpyd, משתחררים רק בפירוק של רקמת עצם בשלה ובוגרת, ולא מפירוק קולאגן שיוצר זה-עתה תוך יצירת רקמת עצם חדשה. יתרון נוסף למצליבי-פירידיניום בכך, שבהשתחררם ממרקם העצם אינם עוברים קטאבוליזם לתוצרי פירוק נוספים, והם ניתנים לזיהוי ומדידה. פרט חשוב אחר הוא בכך, שמדידות Pyd ו-Dpyd, אינן מושפעות כלל מאכילת מזון כלשהו בתקופת בדיקת דגימת השתן.
מדידת רמות Pyd ו-Dpyd בשתן במחלות מטאבוליות של העצם
הידע המשמעותי על 2 מדדים אל, ובחינת יעילותם האבחונית החלה שתחילת שנות ה-90, כאשר הדיווחים הראשונים הצביעו על עלייה משמעותית בהפרשת Pyd ו-Dpyd בשתן של חולי Paget, או אלה עם PHPT או עם אוסטאומלציה תזונתית. ראוי לציין, שהשוואת החולים עם בקרה של נבדקים בריאים תואמי-גיל חשובה במיוחד, שכן מירב המחלות המוזכרות, מזוהות עם גיל מתקדם יחסית, בו צפויה הפרשה מוגברת של Pyd ו-Dpyd, בגין תהליכי דלדול רקמת עצם. אכן, נמצאו עליות משמעותיות ביותר ברמת Pyd ו-Dpyd בשלושת המצבים האחרונים.
במחלת Paget רמתם הממוצעת של Pyd ו-Dpyd המבוטאת כמיקרומול'/מול' קראטינין, הייתה ±119.2 164.9, ו-80.4±57.4, בהתאמה; ב-PHPT נמצאו ערכים של 119.5±61.2 ו-52.5±25.9, בהתאמה, ובאוסטאומלציה נמצאו ערכים של 125.1±49.0 ו-54.8±18.9, בהתאמה, כל זאת על רקע ערכי קבוצת בקרה של 25.2±3.1 ל-Pyd ו-7.2±0.9 ל-Dpyd בהתאמה, הבדל ברמת מובהקות של p‹0.001. הדגמה מאלפת לגבי המובהקות של 2 מדדים אלה לספיגת עצם נערכה בחולה Paget בשלב חריף של המחלה, שטופל במשך 12 שבועות בביפוספונאט pamidronate המעכב סגולית פעילות אוסטאוקלסטית:
מרמה ממוצעת של בערך פי-5 מערכי התקן לפני הטיפול, ירדו Pyd ו-Dpyd החל משבוע אחד מתחילת הטיפול, ובהמשך באופן עקבי עד כדי שהגיעו קרוב לערכים תקינים לאחר 5 שבועות של טיפול. לשם השוואה, ערכי alkaline phosphatase בחולה זה נמדדו במקביל, וירידתם הייתה מתונה בהרבה, תוך שהגיעו לתחום ערכי התקן רק לאחר 9 שבועות של טיפול תרופתי, שהביא לשיפור הדרגתי בתסמינים הקליניים. יתרון נוסף בהקשר זה למדידת Pyd ו-Dpyd צפוי בחולים עם PHPT, בהם רמות alkaline phosphatase לא תמיד מוגברות, ולכן אנזים זה אינו יכול לשמש למעקב אחר שינויים קליניים לאחר טיפול תרופתי.
מדד חשוב כשלעצמו הוא היחס בין ערכי Pyd ו-Dpyd בשתן, ולא רק ערכיהם המוחלטים. מהעובדה שיחס זה בשתן של בריאים הנע בדיווחים שונים בין3.5-4.0, זהה לחלוטין ליחס בין 2 מצליבים אלה ברקמת העצם, מסיקים שלמרות הנוכחות הנרחבת של Pyd ברקמות חוץ-גרמיות כסחוס וגיד, עיקר התרומה לרמת Pyd בשתן אכן נובעת מרקמת העצם. בחולים בדלקת מפרקים שיגרונתית (RA), עולה ביותר היחס Pyd/Dpyd בשתן, שכן תרומת Pyd מהרקמות הלא-גרמיות גבוהה משמעותית. במדידת היחס בין Pyd ל-Dpyd בשתן של חולי Paget נמצא ערך של 2.4±0.6 שהוא נמוך בהרבה מהיחס שנמדד בשתן של בריאים, 4.1±1.3, זאת כיוון הרמה הגדולה יחסית של Dpyd בשתן של חולי Paget, בגין הרס רקמת העצם.
כיוון שההבדל בין Pyd ל-DPyd הוא בכך, ששייר אחד של הידרוקסיליזין בראשון, משוחלף בשייר של ליזין באחרון, יש להניח שהיחס הנמוך של Pyd ל-DPyd ב-Paget משקף חסר בהידרוקסילמיה של שיירי חליזין בסליל הקולאגן, על ידי פעילות מופחתת של האנזים lysyl hydroxylase,. ההנחה היא, שהגורם לכך הוא ריכוז מקומי גבוה של יוני סידן, הידוע כמעכב פעולת האנזים האחרון.
Seibel וחב' הישוו את רמות Pyd ו-Dpyd בשתן של 87 מאובחנים עם PHPT לפני ואחרי ניתוח כריתת יותרת בלוטת התריס, וכן בקבוצת בקרה של בריאים תואמת גיל ומין. ממוצע הפרשת Pyd בקבוצת החולים הבלתימנותחים נקבע כ-46.8±2.7 מיקרומול'/מול' קראטינין, ואילו זה של Dpyd נקבע כ-17.6±1.3, רמות מוגברות משמעותית (p‹0.001), בהשוואה לקבוצת הבקרה של בריאים, בה ערכי Pyd ו-Dpyd הממוצעים נקבעו כ-31.1±10.4 ו-8.8±3.8, בהתאמה. ערכי Pyd ו-Dpyd שנמדדו בחולי PHPT לאחר הניתוח, חזרו כמעט במלואם לאלה שבקבוצת הבקרה: 34.5±2.5 ו-9.4±0.8, בהתאמה.
היתרון במדידת מצליבי פירידיניום בולט ביתר שאת, שהרי רמת הידרוקסיפרולין שנמדדה במקביל, לא פחתה משמעותית שבועיים אחרי הניתוח, ואילו רמת alkaline phosphatase לא השתנתה כלל בארותה נקודת זמן. מעקב אחר השינוי במדדים אלה עד שנתיים לאחר הניתוח, הבליט את הרגישות ואת מיידיות התגובה של Pyd ו-Dpyd בהשוואה להידרוקסיפרולין ולאנזים האמור. יצוין, שקצב ועוצמת החזרה לערכים תקינים היו גדולים יותר עם Dpyd מאשר עם Pyd, וזאת כצפוי, שהרי הראשון נמצא מתבטא בלעדית ברקמת עצם.
מצליבי קולאגן חופשיים וקשורים
מצליבי פירידיניום מופרשים לשתן האדם כמולקולות חופשיות (40-45%) או כמולקולות קשורות לאוליגו-פטידים שמקורם או בפפטידים קצרים של קולאגן או בפפטידים ארוכים יותר שיכולים להגיע עד למשקל מולקולארי של 10,000 דלטון. כיוון שהיחס בין מצליבי פירידיניום חופשיים לקשורים המופרשים לשתן, הוא קבוע באנשים בריאים וכן באלה הסובלים ממחלות מטבוליות של העצם, מגרורות לעצם או באלה עם מחלת פרקים שיגרונתית, נראה שניתן לקבוע את רמת Pyd ו-Dpyd חופשיים, ואין צורך מעשי להתייחס לסך רמת מולקולות אלה, חופשיות וקשורות.
מצליבי פירידיניום ואוסטאופורוזה בנשים
במחקר, רחב יריעה בדקו Seibel וחב' רמות Pyd ו-DPyd ומדדי עצם ביוכימיים אחרים בארבע קבוצות נשים: נשים בריאות לפני גיל חידלון הווסת (קב' א'), נשים בריאות לאחר גיל חידלון הווסת (קב' ב'), נשים עם אוסטופורוזה (קב' ג'), או מטופלות באסטרוגנים (קב' ד'). כצפוי, רמות 2 מצליבי הפירידיניום ןכן הידרוקסיפרולין בשתן, כמו גם אוסטאוקלצין בדם עלו משמעותית בקב' ב' וג' בהשוואה לאלה שבקבוצה א', וטיפול באסטרוגנים החזיר את ערכי מדדים אלה לרמות שנמדדו בקב' א'. לעומת זאת, בהשוואה לנשים בריאות וכאלו עם אוסטאופורוזה לאחר חידלון הווסת, נצפו עליות ברמת Pyd ו-Dpyd כמו גם ברמת סידן בשתן, אל לא נצפו שינויים ברמת אוסטאוקלצין או הידרוקסיפרולין. עיבוד ממצאי מחקר זה על בסיס מדויק של גיל, ומספר השנים לאחר הפסקת הווסת, מראה שרק Dpyd מאפשר אבחנה משמעותית בין נשים בריאות ואלו עם אוסטאופורוזה (קב' ב' ו-ג'), והוא אף הגיב באופן המהיר והבולט ביותר מרגע תחילת הטיפול התרופתי.
בסקר דו-לאומי, רב מוסדי נבחנו מצליבי פירידיניום כמדדים רגישים להרס עצם ב-60 נשים בשלב המוקדם לאחר הפסקת הווסת, בהשוואה לקבוצת נשים תואמות גיל לפני הפסקת הווסת. בקבוצה הראשונה נמדדו עליות משמעותיות של 62% ברמת Pyd (מובהקות של p‹0.001), ו-82% ברמת Dpyd (מובהקות של p‹0.001). רמות מוגברות אלה הגיבו מיידית לטיפול הורמוני בנשים אלו, עד לחזרה מלאה של Pyd ו-Dpyd לרמות שנמדדו בנשים מהקבוצה השנייה. Christiansen וחב' הממונים על המחקר האחרון, ממליצים אפוא על שימוש במדדים אלה בשל החיוניות של מדד רגיש לתהליכים מוקדמים של ספיגת עצם מפאת החסר באסטרוגן בתחילת גיל המעבר.
משמעות מדידות Pyd ו-Dpyd באבחון תהליכים גרורתיים בעצם
החשיבות של מדד מעבדתי אמין המבטא הרס מוקדם של ריקמת-עצם בגין תהליך גרורתי, ניזונה מנתון אפידמיולוגי רב-חשיבות: כ-27% מכלל חולי הסרטן מפתחיל תהליך גרורתי בעצמות השלד. יתרה מכך, ב-84% מבין אלה עם סרטן הערמונית, ב-73% מתוך הלוקות בסרטן השד ובכשליש ממאובחני סרטן הריאה, תפלס הגרורה את דרכה אל העצם בהשוואה לאיברים אחרים.
הרצון לאבחן תחילת אירוע גרורתי ברקמת העצם, בשלב מקדים לגילויו באמצעי דימות, לא בא על סיפוקו על ידי מדידת הידרוקסיפרולין בשתן; אכן רמתו עלתה בחולים עם גרורות מפותחות, אך רבים המצבים שהערכים לא היו חריגים, ולכן מדד זה לא נכלל במגוון הבדיקות של מרפאות מעקב אונקולוגי.
בסקר שנערך בנשים עם סרטן השד, חלקן עם גרורות מאובחנות בעצם ואחרות ללא גרורות ידועות, נמדדו בשתן ערכי Pyd ו-Dpyd. הממצא המפתיע מעט בסקר זה, מתייחס ליתרון היחסי של Pyd על Dpyd באבחון שלב של גרורות בעצם בהשוואה לשלב הטרום-גרורתי. לגבי Pyd נמצא, שרמתו הממוצעת בשתן של חולות סרטן-שד עם גרורות, הייתה 67.1 ± 102.3 מיקרומול'/מול' קראטינין, שהיא משמעותית גבוהה יותר מזו של חולות ללא גרורות (17.2 ± 44.5), ומזו של נבדקות בקרה בריאות (9.3 ± 31.7). לעומת זאת, רמת ה-Dpyd באלה עם גרורות נמדדה כ-17.2 ± 24.2, שהייתה אומנם גבוהה מזו שבקבוצת החולים ללא גרורות (7.4 ± 12.3), אך לא באופן משמעותי סטטיסטית. משמעות המובהקות הנמוכה יותר של Dpyd בשתן של חולי הסרטן עם או בלי גרורות אינה ברורה, וייתכן שגרורות זעירות שאבחונן בעת הסקר המצוטט לא התאפשר, היו מתגלות בדיעבד מאוחר יותר. יחד עם זאת, ראוי לציין ש-Dpyd מוגבר בשתי קבוצות חולות הסרטן האמורות, יכול להצביע על ספיגת עצם מוגברת בהשפעת PGE2 או TNFα, הנוצרים בהשראת השאת הראשונית, והם בעלי השפעה ידועה בהגדלת ספיגת העצם.
בסקר דו-לאומי רב-מוסדי של Lipton וחב' הושוו רמות Pyd ו-Dpyd בחולי סרטן מסוגים שונים עם או בלי גרורות בעצם. שני מדדים אלה היו גבוהים משמעותית בין חולי הסרטן, בהשוואה לקבוצת בקרה של בריאים, אך גם כאן נצפו רמות מוגברות של Pyd ו-Dpyd גם בחולים ללא גרורות מאובחנות, אם כי בדרגה פחותה מזו שבחולים עם גרורות. בהתאם, ערכי Pyd בקבוצות נושאי הגרורות נקבעו כ-2.2 ± 30.4, לעומת 4.2 ± 40.5 בקבוצת משוללי הגרורות, ו-4.2 ± 13.8 בקבוצת הבקרה הבריאה. לגבי DPyd באותן קבוצות נבדקים, נקבעו ערכים של 0.6 ± 9.1, לעומת 1.1 ± 12.1 ו-0.4 ± 4.8, בהתאמה.
נראה שהשימוש בשני המדדים, Pyd ו-Dpyd, תואם היבטים מגוונים של בחינת תהליכי ספיגת עצם. חולי multiple myeloma שטופלו בביפוספונאט risedronate למניעת ההרס האופייני של רקמת עצם, נוטרו משך 6 חודשי הטיפול לרמת Pyd ו-Dpyd. אכן, 2 המדדים הגיבו 7 ימים מתחילת הטיפול בירידה עקבית שהתייצבה במשך הטיפול על 50% מרמת Pyd ו-22% מרמת Dpyd לפני מתן התרופה, בהתאמה טובה עם מדדים היסטולוגיים ודנסיטומטריים של העצם. מסקנה דומה לגבי יעילות 2 מצליבי פירידיניום בניטור ספיגת עצם, הניב מחקר בחולי סרטן עם יתר-סידן שטופלו בתרופה האנטי-אוסטאוקלסטית, pamidronate.
מחקר נוסף השווה רמות Pyd ו-Dpyd וכן הידרוקסיפרולין, ב-27 חולים עם שגשוג טָב של הערמונית, ב-29 מטופלים עם שאת מקומית הערמונית, וב-26 עם סרטן הערמונית וגרורות מתועדות בעצם. הפרשת Pyd ו-Dpyd הייתה גבוהה בקבוצת החולים עם הגרורות באופן משמעותי ביותר בהשוואה לחולים עם שגשוג טָב של הבלוטה. לעומת זאת, רמות הידרוקסיפרולין לא הראו כל שונות בין שלוש קבוצות הנבדקים. זאת ועוד, רמת Pyd ו-Dpyd תאמה ישירות את תוצאות סריקת Soloway של העצם, בה בשעה שמדידת האנטיגן PSA הראתה מתאם נמוך.
שיקולים טכנולוגיים של מדידת מצליבי פירידיניום
כיום השיטה המקובלת למדידת Pyd ו-Dpyd היא על ידי הפרדתם על עמודה בשיטת HPLC תוך ניצול התכונות הפלואורסצנטיות של של שני נגזרי פירידיניום אלה, ושימוש בגלאי פלואורסצנטי.
גישה אחרת היא במדידת נגזרי פירידיניום בשיטת ELISA תוך שימוש בנוגדנים ל-2 נגזרים אלה. מגבלה של שיטה זו היא בכך שקשיים בהכנת נוגדנים חד-שבטיים ספציפיים ל- Pyd ול-Dpyd מחייבת לעתים שימוש בנוגדנים רב-שבטיים שאינם מבדילים בין השניים, ולכן תבחין ELISA מעניק הערכה כוללת של שינויים ברמתם בשתן.
מחקר של Bonte וחב' משנת 2010 בחן את המתאם בין רמת Pyd בשתן ואת התגובה לטיפול באוסטאופורוזה שנמדדה בשיטת DEXA או dual energy X-ray absorbtiometry. במחקר נכללו 87 מטופלים הסובלים מאוסטאופורוזה של גיל חידלון הווסת המטופלים תרופתית (קבוצה א'), וקבוצה של 102 נשים בגיל חידלון הווסת ללא אוסטאופורוזה (קבוצה ב'). כל הנבדקות נמדדו לרמת Pyd בשתן בשיטת ELISA כמו גם נבדקו לצפיפות העצם (BMD), בשיטת DEXA בחוליות הגב L1-L4, וכן בצוואר הירך, בזמן תחילת הטיפול, וכן 6 ו-12 חודשים מתחילת הטיפול:
רמת Pyd בקבוצה א' (ביחידות מיקרומול'/מול' קראטינין) בזמן אפס נקבעה כ-19.9 ± 52.6, לעומת 32.6 ±11.9 לאחר 6 חודשי טיפול, ו-12.2 ± 28.9 לאחר 12 חודשי טיפול. רמת Pyd בקבוצה ב' בזמן אפס נקבעה כ-10.2 ± 29.6, כאשר לאחר 6 חודשי טיפול נקבעו ערכים של 10.7 ± 30.0, ואילו לאחר 12 חודשי טיפול נרשם ערך של 10.3±29.0. העלייה בנתוני-BMD במהלך המעקב הייתה פחות מרשימה.
בדיקת סמני עצם טובה לחולה הבודד ומאפשרת מעקב אחר התגובה לטיפול. השיטה המקובלת לאבחון אוסטאופורוזיס היא מדידת צפיפות עצם, BMD, בשיטת DXA. אבל האפשרות לראות שינויים היא רק לאחר תקופה ארוכה, לפחות 9 חודשים, וגם אז השינוי מאוד קטן. אם בודקים באמצעות מצליבי פירידיניום כבר אחרי 1.5-3 חודשים ניתן לראות ירידה משמעותית בפרוק העצם.
ההפרשה בשתן של מצליבי פירידיניום היא בעלת אופי צירקדיאני
מחקר שבחן הפרשת Pyd ו-Dpyd בשתן במשך 24 שעות היממה, בדק גברים בריאים, נשים בריאות וכן מטופלים משני המינים הסובלים מאוסטאופורוזה. ב-3 קבוצות נבדקים אלה, נמצא פרופיל הפרשה צירקדיאני רק בגברים בריאים, אך לא נמצא פרופיל הפרשה צירקדיאני מובהק בנשים בריאות או בלוקים באוסטאופורוזה, אם כי ניכרה גם בשתי הקבוצות האחרונות נטייה להבדלים בהפרשת מצליבי פירידיניום אלה במשך שעות היממה בדומה לממצאים עם גברים בריאים.
השוואה של ערכי מצליבי קולאגן אלה בשעות היום והערב המוקדמות (בין השעות 1000 ו-2000), ובשעות הלילה והבוקר המוקדמות (בין השעות 2000 ו-1100), העלתה שבשעות הלילה והבוקר הייתה באופן משמעותי הפרשה מוגברת של מצליבי קולאגן אלה, גם בנבדקים בריאים וגם באלה הסובלים מאוסטאופורוזה. יתרה מכך, ההבדל בהפרשת Pyd בשתן בין שעות הלילה-בוקר לבין הפרשתו בשעות היום-ערב, היה גדול משמעותית בחולי אוסטאופורוזה מאשר בנבדקים בריאים. הפרשת Pyd ו-Dpyd הייתה גבוהה ב-22.6% וב-10.7%, בהתאמה, בשעות הלילה-בוקר בהשוואה להפרשתם בשעות היום-ערב בנשים בריאות, אך באלה עם אוסטאופורוזה ההבדלים היו אף גבוהים יותר: הפרשת Pyd הייתה גדולה ב-51.2% , וזו של Dpyd ב-25.5%, בשעות לילה-בוקר לעומת יום-ערב.
תנאים קדם-אנליטיים המשפיעים על מדידת מצליבי פירידיניום
כדי להפיק מידע מרבי ממדידת Pyd ו-Dpyd יש לקחת בחשבון מספר פרמטרים קדם-אנליטיים שיכולים להשפיע על הפרשת מולקולות אלה בשתן. בין הגורמים המשפיעים ניתן למנות את המדדים הבאים:
- גיל-בשנות הילדות והבחרות כאשר מתרחש גידול וצמיחה של השלד, ולכן את הערכים הגבוהים ביותר נקבל בשנת החיים הראשונה, ולאחריה יש ירידה בהפרשה של 2 המדדים האמורים, עם עלייה קלה בתקופת הבשלות המינית, ולאחריה שוב דעיכה בערכים הנמדדים הנותרים נמוכים יחסית בפרטים מבוגרים בריאים.
- מין-לאחר גיל ההבשלות המינית ערכי מצליבי פירידיניום מעט גבוהים יותר בקרב נערות, כאשר בנשים הנכנסות לשלב גיל המעבר עולים הערכים הנותרים גבוהים יחסית לנשים צעירות לאורך כל פאזת המנופאוזה. בנשים הרות או מניקות הערכים הנמדדים גבוהים יותר, בעיקר לקראת הלידה או בחודש הראשון להנקה. הערכים בקרב גברים נותרים קבועים עד גיל 60 שנה, ולאחר גיל זה הערכים גדלים במקצת.
- שברי שלד- בתחום זמן של עד שנה אחת מהתרחשות השבר יעלו משמעותית את הפרשת מצליבי פירידיניום בשתן.
- תקופת השנה-ערכי המצליבים נוטים להיות גבוהים יותר במהלך חודשי החורף, ונמוכים יותר בחודשי הקיץ.
- טיפול בקורטיקו-סטרואידים מעלה את רמת מצליבי פירידיניום בשתן, בעוד שטיפול נוגד ספיגה עם ביפוספונאטים מפחית את רמתם בשתן.
- מנוחה ממושכבת באנשים המוגבלים למיטה, נוטה להעלות הפרשת 2 המולקולות האמורות בשתן.
הוראות לביצוע הבדיקה
כיוון שרמת מצליבי קולגן בשתן משתנה במהלך שעות היממה, באופן שיותר Pyd ו-Dpyd מופרשים בשעות הלילה והבוקר מאשר בשעות היום והערב, ההמלצה היא על איסוף דגימת שתן של 24 שעות, על מנת לקבל ערך ממוצע ואמין יותר של שני מצליבי קולאגן אלה. אם מסיבות לוגיסטיות יש קושי באיסוף שתן של 24 שעות, יש להקפיד על נטילת שתן חד-פעמי שני של בוקר לאחר היקיצה, והתרוקנות של "שתן הלילה".
איסוף של 24 שעות צריך להיות במיכל המכיל 25 מ"ל של תמיסת 6 מול' לליטר של HCl, מוגן מאור, שכן הורדת ה-pH של השתן מסייעת לייצוב המולקולות הנמדדות. ידוע ש-Pyd ו-Dpyd המומסים במים או בתמיסות מימיות, רגישים מאוד לקרינת UV, ויכולים לעבור פירוק מלא לאחר 6 שעות חשיפה לאור. הפירוק בחשיפה לאור גדול יותר לגבי המולקולות החופשיות, מאשר לגבי המולקולות הקשורות לחלבון, והוא גדול יותר בדרגת החומציות הרגילה של השתן, לכן רצוי להחמיצו. יש לשמור את דגימת השתן מקוררת, ואם המדידה אינה מתבצעת בטווח של 7 ימים, יש להקפיא את הדגימה בטמפרטורה של מינוס 20 מעלות וכך נשמרת יציבות Pyd ו-Dpyd למשך 6 חודשים. אין מגבלה לגבי מספר ההקפאות וההפשרות של דגימת השתן, מבחינת יציבות Pyd ו-Dpyd.
רוב השיטות האימונולוגיות מוגדרות כ-EIA או enzyme immunoassays, המודדות Pyd חופשי או קשור, או את סך Pyd ו-Dpyd חופשיים, או את סך Pydו-Dpyd קשורים. לעומת זאת בשיטות הכרומאטוגרפיות, יש צורך קודם כל לבצע הידרוליזה חומצית לצורך מדידת סך מצליבי פירידיניום שכן מולקולות אלה נודדות על פני העמודה בעת הכרומטוגרפיה באופן שונה בהיותן חופשיות או קשורות.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק