נוגדי קרישה חדשים למניעת אירוע מוחי בחולים עם פרפור עלייתי - New oral anticoagulants for the prevention of stroke in patient with atrial fibrillation
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| נוגדי קרישה חדשים למניעת אירוע מוחי בחולים עם פרפור עלייתי | ||
|---|---|---|
| New oral anticoagulants for the prevention of stroke in patient with atrial fibrillation | ||
| יוצר הערך | ד"ר יורי גלודמן, פרופ' יוסף רוזנמן | |
באוכלוסייה החולים הסובלים מאירוע מוחי איסכמי, מהווה פרפור עלייתי את הסיבה בכ-20% מהמקרים[1]. בהשוואה לסיבות אחרות (יל"ד, מחלה טרשתית של עורקי הצוואר וכד'), מתאפיין אירוע מוחי על רקע פרפור עליות בתמותה גבוהה יותר, פגיעה נוירולוגית קשה יותר ושיעור גבוה יותר של הישנות המחלה. טיפול נוגד קרישה יעיל ביותר למניעת אירועי מוח בחולים עם פרפור עלייתי ועד לאחרונה היווה את הטיפול הנפוץ והמקובל. המגבלות של מעכבי ויטמין K הן חלון טיפולי צר וצורך במעקב מעבדתי צמוד, איחור בתחילת הפעולה, צורך בדיאטה מיוחדת ואינטראקציה עם מספר רב של תרופות[1] , [2]. חוסר איזון INR בחולים עם פרפור עלייתי משקף סיכון מוגבר לאירוע תסחיפי או דמם.
מטרת הפיתוח של נוגדי הקרישה החדשים בשנים האחרונות הייתה לתה מענה למגבלות הטיפול במעכבי ויטמין K. נוגדי הקרישה החדשים מחולקים לפי מנגנון פעולתם לשתי קבוצות: מעכבים ישירים של טרומבין (dabigatran) ומעכבים ישירים של פקטור rivaroxaban, apixaban, edoxaban) Xa) . בניגוד למעכבי ויטמין K המשפיעים על מספר פקטורי קרישה (II, VII, IX, X), הפעולה של נוגדי הקרישה החדשים מתאפיינת בעיכוב של פקטור קרישה בודד.
מאפיינים פרמקולוגיים
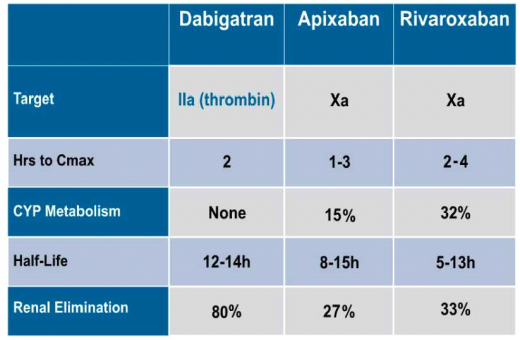
(Pradaxa (Dabigatran הוא מעכב ישיר של טרומבין (פקטור IIa); (Rivaroxaban) Xarelto ו- (Apixaban) Eliquis הם מעכבים ישירים של פקטור Xa. הזמן להשגת ריכוז השיא בנסיוב (Time to peak plasma concentration) הוא כ־ 1־4 שעות ואינו שונה משמעותית בין התרופות. הפינוי של Pradaxa הוא כלייתי בעיקר (80%), Xarelto ו-Eliquis מתפנות ברובן דרך הכבד (67%־73%). זמן מחצית החיים דומה בין התכשירים (12-14 שעות ל- Pradaxa, 5-13 שעות ל- Xarelto ו- 8-15 שעות ל-Eliquis) אך בחולים המטופלים ב-Pradaxa עלול זמן זה להתארך בנוכחות אי ספיקה כליתית דרגה III ופינוי קראטינין (Creatinine Clearance, CrCl) של 30-50mL/min ומעלה. מתן Pradaxa אינו מומלץ בחולים עם אי ספיקה כליות ו-CrCl פחות מ-30 mL/min, בעוד שמתן מעכבים ישירים של פקטור Xa (Xarelto, Eliquis) אינו מומלץ בחולים עם אי ספיקת כליות ו- CrCl פחות מ-mL/min15. בחולים עם אי ספיקת כליות כרונית ו- CrCl פחות מ- 50mL/min, מומלץ על מתן מינון מופחת של נוגדי הקרישה החדשים.
מחקרים קליניים עיקריים
(Pradaxa (Dabigatran
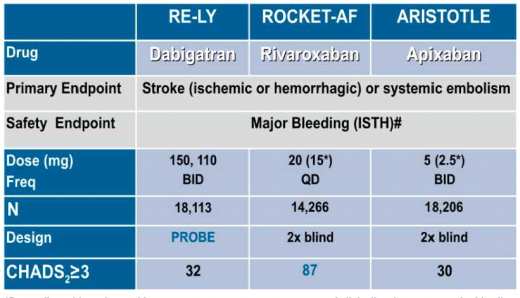
במחקר RELY נבדקה Pradaxa בשני המינונים (150 מ"ג פעמיים ביום ו-110 מ"ג פעמיים ביום) מול (Coumadin (Warfarin בקרב 18,113 מטופלים הסובלים מפרפור עלייתי (שאינו משני למחלה מסתמית) בנוכחות גורם סיכון אחד לפחות לאירוע מוחי לפי שיטת ניקוד 2 CHADS (אי ספיקת לב, יתר לחץ-דם, גיל מעל 75, סוכרת ואירוע תסחיפי בעבר) [3]. לאחר תקופת מעקב של שנתיים, הראתה Pradaxa במינון של 150 מ"ג פעמיים ביום ירידה של 34% בשיעור של אירועים מוחיים איסכמיים ותסחיפים סיסטמיים בהשוואה ל- Coumadin (0.001 > P) וירידה של 74% בשיעור של דמם מוחי (0.001 > P). שיעור כלל הדימומים היה דומה לזה שבקבוצת המטופלים ב- Coumadin, אך נמצא שיעור גבוה יותר של דימומים ממערכת העיכול (1.5% בשנה בזרוע של Pradaxa לעומת 1% בשנה בזרוע של Coumadin, 0.001 > P) ועלייה במספר של התקפי הלב (0.74% בשנה בזרוע של Pradaxa לעומת 0.53% בשנה בזרוע של Coumadin, 0.048 =P). Pradaxa במינון של 110 מג' פעמיים ביום נמצא יעיל באותה מידה כמו Coumadin במניעת אירועים מוחיים איסכמיים ותסחיפים סיסטמיים עם ירידה של 20% בשיעור של דימומים משמעותיים.
(Xarelto (Rivaroxaban
במחקר ROCKET-AF נבדק Xarelto מול Coumadin בקרב 14,264 מטופלים הסובלים מפרפור עלייתי (שלא על רקע מחלה מסתמית) והמצויים בסיכון גבוה במיוחד לאירוע מוחי לפי ניקוד 2 CHADS (ממוצע 3.5 נקודות). לאחר תקופת המעקב של 1.8 שנים, Xarelto נמצא לא פחות יעיל (אך לא יותר יעיל) מ- Coumadin במניעה של אירועים מוחיים איסכמיים ותסחיפים סיסטמיים עם ירידה של 33% בשיעור של דימומים מוחיים (0.02 = P). שיעורם של כלל הדימומים לא היה שונה מזה שבקבוצת המטופלים ב- Coumadin, אולם נצפתה ירידה משמעותית בשיעור הדימומים הקטלניים (0.2% בשנה בזרוע של Xarelto לעומת 0.5% בשנה בזרוע של Coumadin, 0.003 = p) ועליה בדימומים ממערכת העיכול [4].
(Eliquis (Apixaban
יעילות התרופה במניעה של אירועים מוחיים איסכמיים בהשוואה ל- Aspirin ו- Coumadin נבדקה בשני מחקרים קליניים גדולים. במחקר AVERROES נבדקה Eliquis לעומת Aspirin בקרב 5,599 מטופלים הסובלים מפרפור עלייתי (שאינו משני למחלה מסתמית) בנוכחות גורם סיכון אחד לפחות לאירוע מוחי לפי שיטת ניקוד CHADS2 [5]. המחקר הופסק טרם זמנו לאחר תקופת המעקב של 1.1 שנה עקב יעילות מובהקת של Eliquis עם ירידה של 55% בשיעור של אירועים מוחיים איסכמיים ותסחיפים סיסטמיים (0.001 > p), ללא (!) הבדל בין הקבוצות בשיעור של כלל הדימומים הקשים והדימומים המוחיים.
במחקר ARISTOTLE [6] נבדקה Eliquis מול Coumadin בקרב 18,201 מטופלים הסובלים מפרפור עלייתי (שלא על רקע מחלה מסתמית) בנוכחות גורם סיכון אחד לפחות לאירוע מוחי לפי שיטת CHADS2 (ממוצע 2.1 נקודות). לאחר תקופת מעקב של 1.8 שנה, Eliquis בהשוואה ל- Coumadin גרם לירידה של 21% בשיעור של אירועים מוחיים איסכמיים ותסחיפים סיסטמיים (0.01 = p), ירידה של 50% בשיעור הדימומים המוחיים (0.001 > p), ירידה של 31% בשיעור של דימומים משמעותיים (p< 0.001) וללא עלייה בשיעור הדימומים ממערכת העיכול (בניגוד ל-Pradaxa ו- Xarelto). יתרה מזו, נצפתה ירידה של כ-11% בתמותה הכללית (0.047 = P), אשר לא נצפתה במחקרים עם נוגדי הקרישה האחרים.
סיכום המחקרים
בהשוואה בלתי ישירה בין שלוש התרופות החדשות[7], נמצא כי ההבדלים הם קטנים ומשמעותם מוטלת בספק. Pradaxa במינון של 150 מ"ג נמצאה יעילה יותר במניעת אירועי מוח בהשוואה ל- Xarelto. Pradaxa במינון 110 מ"ג ליום ו- Eliquis היו קשורים בירידה בשיעור הדימומים הקשים. Pradaxa נמצאה קשורה לעליה בשיעור התקפי הלב, בעיקר בהשוואה ל- Xarelto. לא מן הנמנע שממצאים אלה קשורים להבדלים באוכלוסיית הנבדקים, לשוני בקריטריונים להכללה במחקר עם ולהגדרת התוצאות.
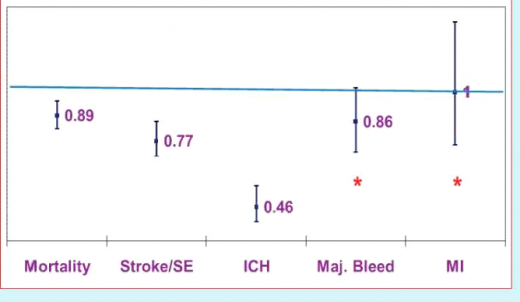
ניתוח של 12 מחקרים (עם סך הכל 54,875 מטופלים) על נוגדי הקרישה החדשים בהשוואה ל- Coumadin[8], הראה ירידה בתמותה הכללית (RR 0.89; 95%cl, 0.83-0.96), בתמותה הקרדיו־וסקולרית (0.82-0.98 .RR 0.89; 95%CI) ובשיעור של אירועים מוחיים ותסחיפים סיסטמיים (0.70-0.86 ,RR 0.77; 95%CI). זאת בשילוב עם הנטייה להורדת שיעור הדימומים המשמעותיים (RR 0.86; 95%CI, 0.72-1,02) וירידה משמעותית ומרשימה בדימומים מוחיים (-0.39 ,RR 0.46; 95%CI 0.56). לא נמצא הבדל בשיעור של התקפי הלב (0.75-1.33 RR 1.00; 95%CL), אך לא הייתה אחידות בממצא זה בין המחקרים שנבדקו. על סמך מחקרים אלה, אושרו Pradaxa, Xarelto ו- Eliquis למניעת אירועים מוחיים בחולים הסובלים מפרפור עלייתי שלא על רקע מחלה מסתמית (הכוונה בעיקר להיצרות המסתם הדו-צניפי (mitral valve stenosis) ומסתמים תותבים), הן בארצות הברית והן במדינות אירופה.
תפקודי קרישה והערכת מידת האנטיקואגולציה בנוכחות נוגדי הקרישה החדשים
טיפול בנוגדי הקרישה החדשים אינו דורש, כאמור, מעקב מעבדתי שגרתי. בדיקות קרישה שגרתיות (INR/PT, PTT) מופרעות בדרך כלל גם בחולים הנוטלים נוגדי קרישה חדשים, אולם מידת ההפרעה המעבדתית אינה משקפת באופן ישיר את רמת האנטיקואגולציה המושגת ע"י הטיפול[9] , [10]. הערכה מדויקת של מידת האנטיקואגולציה עלולה להיות נחוצה וחיונית במצבים הבאים:
- התפתחות של דמם משמעותי
- חשד לכישלון טיפולי (התפתחות אירוע תסחיפי תחת הטיפול)
- צורך בניתוח או התערבות דחופה
- צורך בהתאמת מינון במקרים חריגים
השפעת נוגדי הקרישה החדשים על בדיקות קרישה שגרתיות
- INR/PT: אינם מושפעים ממעכבים ישירים של טרומבין (Pradaxa) ואינם משקפים את רמת האנטיקואגולציה. מעכבים ישירים של פקטור Xa (Xarelto, Eliquis) גורמים להארכת INR/PT אולם לא ניתן להשתמש בתוצאה להערכה של רמת הפעילות [11] , [12].
- PTT: הארכת PTT מאפיינת את כל נוגדי הקרישה החדשים, אולם הבדיקה רגישה יותר ויכולה לשמש להערכת מידת האנטיקואגולציה בחולים המטופלים ב- Pradaxa: ערכי PTT תקינים מעידים על אפקט אנטיקואגולנטי קל או פרופיל קרישה תקין [13] , [14].
- (Ecarin Clotting Time (ECT, (Thrombin Time (TT: בדיקות אלו רגישות ביותר להערכת מידת הפעילות של Pradaxa ואינן מושפעות מהמעכבים הישירים של פקטור Xa[15].
תחת הטיפול בנוגדי הקרישה החדשים ניתן לצפות בירידה של רמת פיברינוגן, עלייה ברמות של Protein C ,Protein S ו-Lupus antigoagulant אולם תוצאות אלו אינן אבחנתיות ומוגדרות כחיובי-כוזב (False-positive)[16]. הערכה מדויקת של מידת הפעילות של Pradaxa ניתן לקבל כאמור בעזרת בדיקת TT (Hemoclot assay) או ECT, בעוד ש- anti-Xa assay מיועד להערכה מדויקת של הפעילות של Xarelto ו- Eliquis.[17] , [18]
מעבר בין נוגדי קרישה שונים ונוגדי הקרישה החדשים
במטופלים הנוטלים מעכבי ויטמין K ניתן להתחיל עם נוגדי הקרישה החדשים באופן מיידי כאשר INR יורד מתחת ל-2, או למחרת כש- iNR הוא 2.5-2. המעבר מנוגדי הקרישה החדשים למעכבי ויטמין K דורש חפיפה של מספר ימים עד להשגת ערך INR טיפולי לאור התחלה פעולה מאוחרת. חשוב לזכור כי INR מושפע ממעכבים ישירים של פקטור xa (Xarelto, Eliquis), לכן מומלץ לבדוק INR בתקופה של החפיפה:
- זמן קצר לפני נטילת המנה הקבועה של Xarelto ו- Eliquis.
- כ- 24 שעות לאחר נטילת המנה האחרונה של Xarerlto ו- Eliquis, בעת הפסקתן המוחלטת.
בחולים המטופלים ב- Heparin, ניתן להתחיל עם נוגדי הקרישה החדשים בעת הפסקה הטיפול ב- Heparin. בחולים המטופלים בזריקות (Clexane (Low molecular weight heparin, ניתן להתחיל עם נוגדי הקרישה החדשים בזמן המתוכנן למתן הזריקה הבאה.
במעבר בין נוגד קרישה חדש אחד לנוגד קרישה חדש אחר, ניתן להתחיל את השני במועד המנה הבאה של הראשון. התייחסות מיוחדת מתחייבת בנוכחות תפקוד כלייתי לקוי במידה בינונית/ קשה[19].
חשיבות ההיענות לטיפול וגישה ל"מנה המפוספסת"
טיפול בנוגדי הקרישה החדשים אינו מחייב מעקב מעבדתי שגרתי. עם זאת, לאור זמן מחצית החיים הקצר, השפעתן על מערכת קרישה חולפת לאחר 24-12 שעות תוך עליית הסיכון לאירוע תסחיפי. עקב כך, מקבלת היענות מתמשכת לטיפול משנה חשיבות בקרב המטופלים הנוטלים את נוגדי הקרישה החדשים.
- אי נטילת מנה בודדת: במקרה זה אין לקחת מנה כפולה בהמשך. במטופלים הנוטלים טיפול פעם ביום (Xarelto), ניתן לקחת את "המנה המפוספסת" עד 12 שעות מהמועד המתוכנן, אולם מעל 12 שעות יש להמתין עד מועד המנה הבאה. במטופלים הנוטלים תרופה פעמיים ביום (Pradaxa, Eliquis), ניתן לקחת את "המנה המפוספסת" עד 6 שעות לאחר המועד המתוכנן, אלם מעל 6 שעות יש להמתין עד מועד המנה הבאה.
- נטילה של מנה כפולה: מטופלים הנוטלים תרופה פעם ביום (Xarelto) ימשיכו טיפול וייטלו את המנה המתוכננת הבאה במועד המתוכנן. במטופלים הנוטלים טיפול פעמיים ביום (Pradaxa, Eliquis), מומלץ לדלג על המנה הבאה ולאחר מכן להמשיך בסדר הרגיל.
- אי וודאות לגבי נטילת המנה: במטופלים נוטלים טיפול פעם ביום (Xarelto), יש צורך ב"מנת השלמה" ובהמשך נטילת המנה הבאה במועד המתוכנן. במטופלים הנוטלים תרופה פעמיים ביום (Pradaxa, Eliquis), אין צורך ב"מנת השלמה" והמנה הבאה תינטל כמתוכנן.
דימומים בחולים הנוטלים את נוגדי הקרישה החדשים
למרות שהמחקרים על נוגדי הקרישה החדשים הראו ירידה בשיעור הדימומים בהשוואה למעכבי ויטמין K, מטופלים הנוטלים את התרופות החדשות מצויים כמובן גם הם בסיכון לדמם. בניגוד לחלק מהאנטיקואגולנטים האחרים, לא קיים עדיין אנטידוט לנוגדי הקדשה החדשים. בשלבי פיתוח ומחקר נמצאים נוגדנים מונוקלונליים ל- Pradaxa ו-Recombinant factor Xa-1 לנטרול הפעולה של Xarelto ו- Eliquis.[20] [21]
הגישה לחולה המדמם כוללת:
- הערכת המצב הכללי וההמודינמי, הערכת רמת האנטיקואגולציה, התפקוד הכלייתי והזמן שחלף מעת נטילה המנה האחרונה.
- איתור מקור הדמם.
- תיקון הפרעת קרישה לפי הצורך.
היות שהתרופות החדשות משפיעות על פקטורי קרישה אקטיביים, לא ברור האם מתן של מוצרי הדם המכילים פקטורי קרישה פסיביים (PCC - Prothrombin Complex Concentrate, FFP - Fresh Frozen Plasma, rVIIa recombinant factor) הינו יעיל, ועל כן הוא אינו מומלץ באופן שגרתי לעצירת הדמם. תכשירים אלה לא נבדקו במחקרים קליניים, וזאת למרות שמחקרים in-vitro הראו תיקון של הפרעה המעבדתית הנגרמת ע"י נוגדי הקרישה החדשים [22] , [23].
פחם פעיל מפחית ספיגת Pradaxa מהקיבה ומומלץ לשימוש בחולה המדמם עד שעתיים מעת נטילת התרופה[24]. אין מידע בספרות לגבי מתן פחם פעיל למטופלים המדממים תחת הטיפול במעכבי פקטור Xa. ניתן לשקול ביצוע המודיאליזה דחופה בחולים המדממים תחת הטיפול ב- Pradaxa, בפרט בנוכחות אי ספיקת כליות מתקדמת. לאור קישור גבוה לחלבונים והיות שהפינוי העיקרי של המעכבים הישירים של פקטור Xa אינו כלייתי, המודיאליזה אינה מומלצת גם בנוכחות דמם פעיל תחת תרופות אלו[25]. Protamine sulfate וויטמין K אינם משפיעים על נוגדי הקרישה החדשים ואינם מומלצים לטיפול במקרי הדמם. ניתן לשקול מתן Desmopressin במקרים מיוחדים, אף כי גם טיפול זה אינו מבוסס על מחקר בחולים.
מקרה של דמם קל (דימום אפי, עורי) יטופל שמרנית בעזרת הפעלת לחץ ודחייה של המנה הבאה של נוגד הקרישה. במקרה של דימום בחומרה בינונית (ממערכת העיכול, מערכת השתן וכדומה) מומלץ להפסיק זמנית את הטיפול בנוגדי הקרישה החדשים ולנסות להשתלט על הדימום בעזרת פעולה פולשנית (טיפול מקומי, צריבה וכו') או בניתוח. מתן נוזלים, דם, FFP (אם הוא חיוני להגדלת נפח הדם) מומלץ על פי שיקול דעת קליני. במקדם מסוימים במטופלי Pradaxa ניתן לשקול כאמור מתן פחם פעיל וביצוע המודיאליזה דחופה.
חולים המפתחים דימום קשה או מסכן חיים זקוקים לניטור צמוד, מתן טיפול תומך בהתאם למצבם (מתן נוזלים, דם, FFP, ואזופרסורים וכד') בשילוב עם עצירת דימום בדרך פולשנית /ניתוחית. במקרה של דמם כזה, מומלץ מתן APCC- Activated Prothrombin Complex Concentrate (תרכיז של פקטורי קרישה אקטיביים - Xa, IXa, VIIa, IIa) למרות היעדר מחקרים קליניים רנדומאליים. ההמלצה מבוססת על מחקרים מעבדתיים על בעלי חיים ומתנדבים בריאים [26] , [27].
הפסקה וחידוש של נוגדי הקרישה החדשים בשל פעולה פולשנית או ניתוח
ניהול הטיפול בנוגדי קרישה לפני פעולה פולשנית או ניתוח הוא בעיה נפוצה. מחד, אי הפסקת הטיפול גורמה לעליה בשיעור הדימומים במהלך ואחרי הפעלה הפולשנית או הניתוח. מאידך, הפסקת הטיפול מעלה את הסיכון לאירוע תסחיפי, בעיקר בהקשר לניתוחים גדולים. בהשוואה למעכבי ויטמין K, ניהול הטיפול בנוגדי הקרישה החדשים לפני הניתוח הוא נוח וקל יותר. עקב פעילות מהירה ומחצית חיים קצרה יחסית אין בדרך כלל צורך בטיפול מגשר בעת הפסקת הטיפול בנוגדי הקרישה החדשים . מטופלים בעלי סיכון גבוה במיוחד לאירוע תסחיפי יזדקקו בכל זאת לטיפול מגשר ע"י Heparin או Clexane לפרק זמן קצר[28].
פעולות וניתוחים אלקטיביים
המועד האופטימאלי להפסקת הטיפול בנוגדי הקרישה במקרים אלו תלוי ב-3 גורמים עיקריים:
- הסיכון לדמם.
- זמן מחצית חיים של נוגד הקרישה.
- התפקוד הכלייתי (המשפיע על זמן הפינוי).
פעולות פולשניות עם סיכון נמוך לדמם הן: אנדוסקופיה של מערכת העיכול, ברונכוסקופיה, ציסטוסקופיה, היסטרוסקופיה, ארטרוסקופיה, ביופסית בלוטת התריס והשד, צינתור כלילי, השתלת קוצב לב קבוע, בדיקה אלקטרופיזיולוגית כולל אבלציה של פרפור עלייתי.
ניתוחים עם סיכון נמוך לדמם הם: כריתת רחם, כריתת כיס מרה, תיקון בקע, הסרת גידולים ממאירים עוריים, ניתוחים אורטופדיים (כף יד, כף רגל, כתף), ניתוח ירוד (קטרקט), עקירת שיניים[29] , [30].
פעולות פולשניות וניתוחים עם סיכון גבוה לדמם הם: ניתוחים קרדיו-וסקולריים, ניתוחים אורטופדיים (החלפת מפרקים, למינקטומיה), ניתוחי ראש וצוואר, כריתת השד, כריתת ערמונית, כריתת פוליפים ממערכת העיכול, ביופסיות כבד וכליה וכל ניתוח אחר הנמשך מעל 45 דקות[30] , [31].
הפסקת הטיפול ב- Pradaxa לפני פעולה פולשנית או ניתוח: היות שזמן מחצית החיים של התרופה תלוי בתפקוד הכלייתי, במקרים של פעולה פולשנית או ניתוח עם סיכון נמוך לדמם, מומלץ להפסיק את הטיפול ב- Pradaxa 24-48 שעות לפני ההתערבות במטופלים עם תפקוד כלייתי תקין או מופחת במידה קלה (CrCl 50-80mL/min), ו- 48-72 שעות לפני ההתערבות במטופלים עם תפקוד כלייתי מופחת במידה בינונית (CrCl 30-50mL/min) [19] , [32] , [33]. במקרים של פעולה פולשנית או ניתוח עם סיכון גבוה לדמם, מומלץ להפסיק את הטיפול ב- Pradaxa 3 ימים לפני ההתערבות במטופלים עם תפקוד כלייתי תקין או מופחת במידה קלה, ו- 4-5 ימים לפני ההתערבות במטופלים עם תפקוד הכלייתי מופחת במידה בינונית [19] , [24] , [34]. במקרים מורכבים ניתן להיעזר בבדיקות תפקודי קרישה (PTT או TT).
הפסקת הטיפול במעכבים ישירים של פקטור Xa (Xarelto, Eliquis) לפני פעולה פולשנית או ניתוח: במקרים של פעולה פולשנית או ניתוח עם סיכון נמוך לדמם, מומלץ להפסיק את Xarelto ו- Eliquis 48-24 שעות לפני ההתערבות במטופלים עם תפקוד כלייתי תקין או מופחת במידה קלה (CrC1>50mL/min). במטופלים עם אי ספיקת כליות בינונית ויותר מתקדמת (CrCl 15-50mL/min), מומלץ להפסיק את התרופות האלו 72-48 שעות לפני ההתערבות. במקרים של פעולה פולשנית או ניתוח עם סיכון גבוה לדמם, מומלץ להפסיק לקיחת Xarelto ו- Eliquis 3 ימים לפני ההתערבות במטופלים עם CrCl>50mL/min, ו-4 ימים לפני ההתערבות במטופלים עם אי ספיקת כליות מתקדמת (CrCl 15-50mL/min) [19] , [28] , [35].
חידוש הטיפול בנוגדי הקרישה החדשים לאחר פעולה פולשנית או ניתוח: מומלץ לחדש את הטיפול 24 שעות אחרי התערבות עם סיכון נמוך לדמם, ו-72-48 שעות אחרי ההתערבות עם סיכון גבוה לדמם. טיפול מגשר עם Clexane מומלץ במצבים הבאים:
- מטופלים שאינם מסוגלים ליטול תרופות דרך הפה לאחר ניתוח כגון לאחר ניתוח כריתת קיבה, בנוכחות Paralytic ileus או כל מצב אחר היכול להשפיע על ספיגת התרופה במערכת העיכול.
- מטופלים עם סיכון גבוה במיוחד לאירוע תסחיפי. [36] , [37]
התערבות דחופה בחולים הנוטלים את נוגדי הקרישה החדשים
במקרה של התערבות דחופה, יש להעריך את פרופיל הקרישה (TT/PTT ל- Pradaxa, PT ,ורמת Xa למעכבים ישירים של פקטור Xa) והתפקוד הכלייתי ולברר את זמן נטילת המנה האחרונה של התרופה. יש לדחות במידת האפשר את הניתוח לפרק זמן של מחצית חיים אחת או שתיים של התרופות החדשות. במטופלים ב- Pradaxa יש לשקול מתן פחם פעיל ואף ביצוע דיאליזה דחופה. אין לתת מוצרי דם (FFP, PCC, aPCC, rVIIa) לפני או במהלך הניתוח לצורך מניעת הדימומים אלא במקרה של התפתחות דמם משמעותי. יש להימנע מביצוע הרדמה ספינלית עד 48 שעות מנטילת המנה האחרונה של נוגד קרישה חדש [38].
היפוך קצב חשמלי בחולים הנוטלים את נוגדי הקרישה החדשים
- Relative Risk: NOACs vs. Warfarin .1 ט־ף
על פי מחקר RELY, היפוך קצב חשמלי במקרה של פרפור עלייתי במטופלים הנוטלים Pradaxa נחשב כבטוח מבחינת השיעור של אירועים תסחיפיים ודימומים בהשוואה למעכבי ויטמין K, ובלבד שניתן לקבל מידע מהימן על לקיחת התרופה טרם ההיפוך. מידע מקביל על מעכבים ישירים של פקטור Xa אינו מספיק מהימן לכן במטופלים הנוטלים Xarelto או Eliquis מומלץ לבצע בדיקת אקו לב דרך הוושט לשלילת נוכחות קרישי הדם בחללי הלב לפני היפוך קצב חשמלי[39].
סיכום
נוגדי הקרישה החדשים מאפשרים טיפול יעיל ובטוח בהשוואה לנוגדי ויטמין K לצורך מניעת אירועים מוחיים בחולים עם פרפור עלייתי. שיעור הסיבוך הקשה של דמם מוחי נמוך במיוחד, והוא מאפיין את כל התכשירים הזמינים. נוגדי הקרישה החדשים מאפשרים מתן טיפול אנטי-קואגולנטי בחולים רבים אשר אינם מתאימים (או אינם מוכנים) לטיפול בנוגדי ויטמין K. יש לציין כי הניסיון שהצטבר עם נוגדי ויטמין K והיכולת לתקן במהירות את הפרעת הקרישה בנוכחות דמם חריף או לצורך ניתוח דחוף מהווים יתרון בהשוואה לנוגדי הקרישה החדשים. יתרונות התכשירים החדשים אינם מצדיקים שימוש בנוגדי ויטמין K (למעט במצבים חריגים במיוחד). הכרת התכשירים החדשים, גיבוש פרוטוקולים כדורים להתמודדות במצבים בעייתיים ומידע ופיתוחים עתידים יאפשרו טיפול יעיל ובטוח יותר למרבית החולים הנזקקים לנוגדי קרישה.
ביבליוגרפיה
- ↑ 1.0 1.1 Camm AJ, LipGYH, Atar Detal. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation Eur Heart J 2012;33:2719-47.
- ↑ Ezekowitz MD, Connolly SJ, Parekh A, et al. Rationale and design of RE-LY: randomized evaluation of long-term anticoagulant therapy, warfarin, compared with dabigatran. Am Heart J 2009;157:805-10
- ↑ Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361:1139-51.
- ↑ Patel MR, Mahaffey KW, Garg J, etal. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011:365:883-9
- ↑ Connolly SJ, Eikelboom J, JoynerC etal. Apixaban in patients with atrial fibrillation. N Engl J Med 2011; 364:806 -17.
- ↑ Granger CB, Alexander JH, McMurray JJ, et al. ARISTOTLE Committees and Investigators. Apixaban vs. warfarin in patients with atrial fibrillation. N Engl J Med 2011:365:981-992
- ↑ LipGYH, LarsenTB, Skjoth F et al. Indirect comparisons of new oral anticoagulant drugs for efficacy and safety when used for stroke prevention in atrial fibrillation, J Am Coll Cardiol 2012;60:738-46.
- ↑ Dentali F, Riva N, Crowther M etal. Efficacy and safety of the novel oral anticoagulants in atrial fibrillation: A systematic review and meta-analysis of the literature. Circulation published online October 15,2012.
- ↑ Van Ryn J, Stangier J, Haertter S, atal. Dabigatran etexilate-a novel, reversible, oral direct thrombin inhibitor: interpretation of coagulation assays and reversal of anticoagulant activity. Thromb Haemost 2010:103:1116-1127.
- ↑ Huisman MV, Lip GY, Diener HC, Brueckmann M, van Ryn J, Clemens A. Dabigatran etexilate for stroke prevention in patients with atrial fibrillation: resolving uncertainties in routine practice. Thromb Haemost 2012; 107:838-847.
- ↑ Eriksson Bl, Quinlan DJ,WeitzJI. Comparative pharmacodynamics and pharmacokinetics of oral direct thrombin and factor xa inhibitors in development, Clin Pharmacokinet 2009; 48:1 -22.
- ↑ Samama MM, GuinetC. Laboratory assessment of new anticoagulants. Clin Chem Lab Med 2011;49:761-772.
- ↑ LindahlTL, Baghaei F, Blixter IF, etal. Effects of the oral, direct thrombin inhibitor dabigatran on five common coagulation assays. Thromb Haemost 2011; 105:371-378.
- ↑ Freyburger G, Macouillard G, Labrouche S, et al. Coagulation parameters in patients receiving dabigatran etexilate or rivaroxaban: two observational studies in patients undergoing total hip or total knee replacement. Thromb Res 2011; 127:457-465.
- ↑ Stangier J, Feuring M. Using the HEMOCLOT direct thrombin inhibitor assay to determine plasma concentrations of dabigatran. Blood Coagul Fibrinolysis 2012; 23:138-143
- ↑ Funk DM, Coagulation assays and anticoagulant monitoring, Hematology Am Soc Hematol Educ Program. 2012;2012:460-5
- ↑ Raghavan N, Frost CE, Yu Z, et al. Apixaban metabolism and pharmacokinetics after oral administration to humans. Drug Metab Dispos 2009:37:74-81.
- ↑ Rohde G. Determination of rivaroxaban - a novel, oral, direct Factor Xa inhibitor-in human plasma by high-performance liquid chromatography-tandem mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci 2008; 872:43-50.
- ↑ 19.0 19.1 19.2 19.3 Heidbuchel H,VerhammeP,AlingsM.EHRA practical guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation
- ↑ Van Ryn J, LitzenburgerT, Waterman A, etal. Dabigatran anticoagulant activity is neutralized by an antibody selective to dabigatran in in vitro and in vivo models. J Am Coll Cardiol 2011;57: E1130.
- ↑ Lu G, DeGuzrnan FR, LakhotiaS, etal. Recombinant antidote for reversal of anticoagulation by factor Xa inhibitors. ASH Annual Meeting Abstracts 2008; 112:983.
- ↑ Zhou W, Schwarting S, lllanes S, et al. Hemostatic therapy in experimental intracerebral hemorrhage associated with the direct thrombin inhibitor dabigatran. Stroke2011;42:3594-3599.
- ↑ Eerenberg ES, Kamphuisen PW, Sijpkens MK, et al. Reversal of rivaroxaban and dabigatran by prothrombin complex concentrate: a randomized, placebo-controlled, crossover study in healthy subjects. Circulation 2011; 124:1573-1579.
- ↑ 24.0 24.1 van Ryn J, Stangier J, Haertter S, atal. Dabigatran etexilate-a novel, reversible, oral direct thrombin inhibitor: interpretation of coagulation assays and reversal of anticoagulant activity. Thromb Haemost 2010;103:1116-1127.
- ↑ Stangier J, Rathgen K, Stahle H, etal. Influence of renal impairment on the pharmacokinetics and pharmacodynamics of oral dabigatran etexilate: an openlabel, parallel-group, single-centre study. Clin Pharmacokinet 2010;49:259 268
- ↑ Gruber A, Marzec UM, Buetehorn U, etal. Potential of activated prothrombin complex concentrate and activated factor VII to reverse the anticoagulant effects of rivaroxaban in primates. ASH Annual Meeting Abstracts 2008; 112:3825,
- ↑ Escolar G, Arellano-RodrigoE, Reverter JC, etal. Reversal of apixaban induced alterations of hemostasis by different coagulation factor concentrates: studies in vitro with circulating human blood. Circulation 2012; 126:520-521.
- ↑ 28.0 28.1 Pierre Sie, Charles M. Samamab, Anne Godier etal. Surgery and invasive procedures in patients on long-term treatment with direct oral anticoagulants: Thrombin orfactor-Xa inhibitors. Recommendations of the Working Group on perioperative haemostasis and the French Study Group on thrombosis and haemostasis. Archives of Cardiovascular Disease 12011) 104,669—676
- ↑ Douketis JD. Pharmacologic properties of the new oral anticoagulants: a clinician-oriented review with a focus on perioperative management. Curr Pharm Des. 2010; 16(311:3436-3441
- ↑ 30.0 30.1 Douketis JD, Spyropoulos AC, Spencer FA, et al. Perioperative management of antithrombotic therapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th Ed.: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012:141(2 Suppl):e326Se350S
- ↑ Douketis JD, Johnson JA, Turpie AG. Lowmolecular- weight heparin as bridging anticoagulation during interruption of warfarin: assessment of a standardized periprocedural anticoagulation regimen. Arch Intern Med.2004; 164(12):!319-1326.
- ↑ Alikhan R, etal. The acute management of haemorrhage, surgery and overdose in patients receiving dabigatran. Emerg Med J 2013;0:1-6. D0L10.1136/ emermed -2012-201976
- ↑ Graeme J. Hankeyand John W. Eikelboom. Dabigatran Etexilate: A New Oral Thrombin Inhibitor. Circulation. 2011;123:1436-1450
- ↑ Pradaxa (dabigatran etexilate mesylate) capsules (prescribing information]. Ridgefield, CT: Boehringer Ingelheim Pharmaceuticals, Inc; 2012.
- ↑ Alex C. Spyropoulos and James D. Douketis. Howl treat anticoagulated patients undergoing an elective procedure or surgery.Blood, 2012 120; 2954-2962
- ↑ Golembiewski J, Chernin E, Chopra T. Prevention and treatment of postoperative nausea and vomiting. Am J Health Syst Pharm. 2005; 62(12): 1247-1260; quiz 1261-1262.
- ↑ Stangier J, Stahle H, Rathgen K, Fuhr R. Pharmacokinetics and pharmacodynamics of the direct oral thrombin inhibitor dabigatran in healthy elderly subjects. Clin Pharmacokinet. 2008; 47(1): 47-59.
- ↑ Gogarten W,Vandermeulen E, Van Aken H, etal. Regional anaesthesia and antithrombotic agents: recommendations of the European Society of Anaesthesiology. Eur J Anaesthesiol 2010; 27:999—1015.
- ↑ Camm AJ, Lip GYH, Atar D etal. 2012 focused update of the ESC Guidelines forthe management of atrial fibrillation Eur Heart J 2012;33:2719-47.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר יורי גלוזמן ופרופ' יוסף רוזנמן, המערך הקרדיולוגי, המרכז הרפואי ע"ש וולפסון, חולון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק