נוגדנים כנגד היסטון - Anti histone antibodies
| מדריך בדיקות מעבדה | |
| נוגדנים כנגד היסטון | |
|---|---|
| Anti histone antibodies | |
| שמות אחרים | Autoantibodies to histone |
| מעבדה | בדיקת אימונולוגיה בדם |
| תחום | הערכה של מחלת lupus סיסטמית |
| טווח ערכים תקין | תוצאה שלילית - <1.0 Units; תוצאה גבולית - 1.0-1.5 Units; תוצאה חיובית - >1.5 Units. היחידות מבוססות באופן שרירותי על נסיוב ביקורת חיובי. ערכי הייחוס רלוונטיים לכל קבוצות הגיל. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הערכת מטופלים החשודים ל-drug-induced lupus.
נוגדנים עצמיים כנגד היסטון, הם תת-קבוצה של משפחת הנוגדנים האנטי-גרעיניים (anti-nuclear antibody) המכוונים ספציפית כנגד תת-יחידות של היסטון או כנגד קומפלקסים של היסטון (Muller ב-Histone Auto-antibodies משנת 2014). נוגדנים אלה התגלו באוניברסיטת רוקפלר על ידי Henry Kunkel ואנשיו במסגרת מחקריהם בנושא Lupus erythematosus (Holman וחב' ב- Bull NY Acad Medמשנת 1959, ו-Holmanet וחב' ב- Lupus Erythematosus משנת 1960). נוגדנים עצמיים כנגד היסטון עדיין משמשים סמן ל-SLE, אך הם גם כרוכים במחלות אוטו-אימוניות אחרות כגון תסמונת Sjogren, דרמטו-מיוזיטיס או rheumatoid arthritis.
היסטון
ראיות למציאות של היסטונים התגלו כבר בשנת 1884 במחקריו של אלברכט קוסל שדווח על בידוד של מרכיב שניתן למיצוי על ידי חומצה, והוא דמוי peptone, מגרעיני תאים של אווז. רק בשנת 1974 תואר המבנה האוליגומרי הספציפי של קומפלקסים של היסטון והיותו מרכיב של כרומטין. היה זה פייר שמבון בשטרסבורג שלמד את מבנה הנוקלאוזום, והראשון שטבע את השם היסטון. גם הגילוי של המרכיב H5 של היסטון נעשה בשטרסבורג ודווח בשנת 1976 על ידי Crane-Robinson וחב', כאשר המבנה המדויק של היסטון מאדם ועכבר התברר בראשית שנות ה-80.
המינוח של מקטעי היסטון השונים אומץ באופן אוניברסלי בשנת 1974. הוא היה מבוסס על התנהגות מקטעים אלה בכרומטוגרפיה. ארבעת מקטעי היסטון העיקריים הם H2A, H2B, H3 ו-H4. מקטעי היסטון המשמשים כמקשרים של מקטעי היסטון האחרים הם H5 ו-H1, וכן H1°. למעשה, כל מקטע של היסטון מורכב ממספר איזו-חלבונים או וריאנטים, המוגדרים לדוגמה כ-H3.1, H2A.X, H2AZ וכן macro-H2A1 או H2A2, וכן H1b. מספר וריאנטים כמו H1°, H5, CENP-A (הידוע גם כ-centromeric H3 variant), H1t, TH2B, כמו גם H2BFWT או H3t, מופיעים רק בבעלי חיים אחדים. כל המקטעים ההיסטוניים, פרט ל-H2B ו-H3, עברו אצטילציה בקצה ה-N-טרמינאלי שלהם.
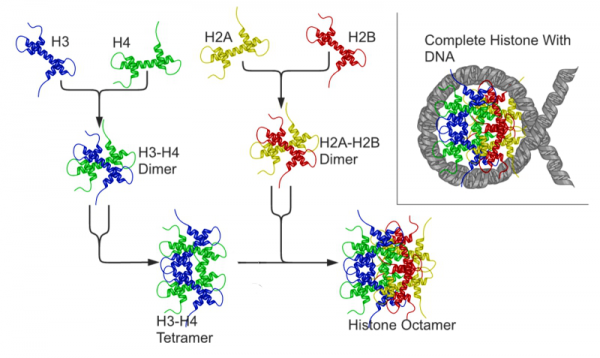
היסטונים הם קומפלקסים של חלבונים סביבם כרוך ה-DNA בתאי אאוקריוטים בלבד ליצירת נוקלאוזומים. נוגדנים כנגד היסטון יכולים לזהות את הקומפלקס האוקטמרי של היסטון או את כל אחת מתת היחידות של היסטון כמתואר בתרשים למטה:
תכונות פיזיולוגיות של היסטונים
היסטון הוא חלבון טעון חיובית החיוני לאריזת ה-DNA. שתי חומצות האמינו הדומיננטיות של היסטון הן ליזין וארגינין, לכן ההיסטונים הם המרכיבים הבסיסיים ביותר של כרומטין. ההיסטונים הם חלבונים מאוד משומרים ב-species השונים. הם בעלי מבנה גלובולרי ונקשרים לשיירי הפוספאט של DNA. זוהו 5 סוגי היסטון: H3 ו-H4 היוצרים דימר וטטרמר, ו-H2A ו-H2B היוצרים אף הם דימר וטטרמר. הסוג החמישי H1 מקשר את הטטרמרים ליצירת octamer (Cozzani וחב' ב- Autoimmune Dis משנת 2014). חמשת סוגי ההיסטון מאופיינים על ידי ההבדלים במשקלם המולקולרי הנע בין 11 ל-23 קילו-דלטון, וכן לפי תכולת הליזין והארגינין שלהם.
היסטונים מסייעים ל-DNA להיות ארוז באופן קומפקטי במיוחד בכרומוזום, ואמנם היות ה-DNA מלופף בצמידוּת סביב ההיסטונים מאפשר לחומצת הגרעין שאורכה בפריסה מלאה 1.8 מטר להידחס לתוך גרעין תא שאורכו מספר ננומטרים. הקומפלקס של DNA במארז עם היסטון הוא הכרומטין. קיימת מעורבות היסטונים בבקרת התבטאות הגנים, שכן אזורים בכרומוזום בהם הגנים פעילים במיוחד ארוזים באופן רופף יותר סביבי ההיסטון, ואילו אזורים בכרומוזום בהם גנים פחות פעילים, אריזתם סביב ההיסטונים מהודקת יותר.
היסטונים נמצאים בכל גרעיני תאים אאוקריוטיים עם מספר יוצאי-דופן, כיוון שלדוגמה שמרים אינם מכילים H1. כל גרעין של תא דיפלואידי ביונקים מכיל בערך 40% של DNA (שהם כ-5X109bp של DNA), 40% היסטון, ו-20% של חלבונים לא-היסטוניים ו-RNA. H1° מצטבר בתאים בלתי מתחלקים או בתאים שהושרו באופן כימי לעבור התמיינות (דיפרנציאציה). היסטונים ספציפיים של תאי נבט (germ cells) לא נמצאים ב-oocytes, או שהם נמצאים בריכוזים נמוכים בהרבה מאשר בשלבים דומים של תאי נבט בגברים.
כעת כבר ברור שבגרעין, משחקים היסטונים תפקיד מפתח של איתותים באירועים רגולטוריים חיוניים. מספר וריאנטים של היסטון מבוטאים בסוגי תאים שונים, כגון תאי זרע מתפתחים, בהם הם משנים את המבנה העדין של הנוקלאוזום. היסטונים עוברים מספר שינויים post-translational, כגון פוספורילציה, מתילציה, דה-אימינציה/ציטרולינציה, אצטילציה, ubiquitination, ו-poly (ADP-ribosyl) ation המשתנה עם סוגי חיות שונים, עם הרקמות, והשלב של מחזור התא (Cosgrove וחב' ב-Nat Struct Mol Biol משנת 2004). שינויים אלה מתרחשים בעיקר בקצוות ה-N-טרמינלים, אך גם במקטעים הגלובולאריים, ורק לעיתים נדירות בקצוות ה-C טרמינלים (Margueron וחב' ב-Curr Opin Gen Dev משנת 2005). שינויים אלה משפיעים באופן דרמטי על מבנה הכרומטין ועל אגירת DNA, על ידי השינוי באינטראקציה של היסטון-DNA כדי לסייע לתהליך השעתוק, הרפליקציה של DNA ותהליכי התיקון ב-DNA. מספר מודיפיקציות בהיסטון מופיעות או נעלמות במהלך אפופטוזיס, והייתה סברה שדחיסה ופרגמנטציה של כרומטין אפופטותי יכולים להיות תוצאה של מודיפיקצות אלו. מספר מודיפיקציות post-translational פגומות של היסטון נמצאו במודלים של לופוס בעכבר (Carcia וחב' ב-J Proteome res משנת 2005).
תכונות עיקריות של היסטונים מבלוטת התימוס של בקר, ומיקומם של האפיטופים
| מקטע | מ. מולקולרי | מספר חומצות אמינו | שייר N-טרמינאלי | אוטו-אפיטופים בתאי B (אדם ועכבר) |
|---|---|---|---|---|
| H1b | 26,500 | 220 | Ac-Ser | 74-94, 144-159, 170-185, 197- 212, 204-218. |
| H2A | 14,000 | 125 | Ac-Ser | 1-20, 65-85, 91-129. |
| H2B | 13,770 | 129 | Pro | 1-25, 21-38. |
| H3 | 15,340 | 135 | Ala | 1-21, 40-55, 47-64, 53-70, 64-78, 111-130, 130-135. |
| H4 | 11,280 | 102 | Ac-Ser | 1-29, 28-42. |
נוגדנים עצמיים כנגד היסטונים (AHA)
AHA הם חלק ממשפחת הנוגדנים העצמיים כנגד מרכיבי הגרעין. הם יכולים להיות מסוג IgM או IgG, או שהם מכילים סדרה הטרוגנית של 2 סוגי האימונוגלובולינים. בעזרת נוגדנים אלה זוהו אפיטופים של היסטונים, הממוקמים בעיקר בקצה ה-N טרמינלי של H2A,H2B, H3 ו-H4, וכן בקצה ה-C טרמינלי של H3 ו-H1, אזורים החשופים בעיקר בכרומטין. אזורים אנטיגניים אלה זהים בדרך כלל לאלה המזוהים על ידי נוגדנים המגיבים באופן מאוד נדיר בארנבות ניו זילנדיות לבנות (NZW), כנגד נוקלאוזומים וכנגד תערובת של היסטונים הנמצאת בקומפלקס עם RNA. כשמזריקים היסטונים ללא RNA, תערובות של ההיסטונים גורמות ליצירת נוגדנים המגיבים באופן מאוד נדיר עם אנטיגנים ממקור היסטון, מה שתומך בדעה שקומפלקסים של כרומטין-היסטון, או DNA-היסטון, הם שמייצרים את הגירוי האימונוגני ליצירת AHA.
נוגדנים עצמיים להיסטון יכולים להגיב עם כל אחד מחמשת סוגי ההיסטון (Borchers וחב' ב-Ann NY Acad Sci משנת 2007, ו-Vasoo ב-Lupus משנת 2006). נוגדנים עצמיים לכלל ההיסטונים נוצרים על ידי מנגנון לא ברור באלה המטופלים במספר תרופות (בעיקר procainamide, hydralazine, quinidine, α-methyldopa, פניצילאמין, ו-isoniaside. למטופלים אלה יכולים להיות תסמינים וסימנים הדומים לאלה של SLE, ולמפגע זה מתייחסים כאל drug-induced lupus. מטופלים אלה יימצאו חיוביים לנוגדנים עצמיים להיסטון, אך שליליים לנוגדנים עצמיים ל-dsDNA. לעומת זאת, באלה עם SLE קלאסי, נמצא נוגדנים עצמיים כנגד היסטון, וכן כנגד dsDNA.
נוגדנים כנגד היסטון יכולים להגיב הן עם תת-היחידות של היסטון, אך גם עם הקופמלקסים השונים, כולל עם הדימר H2A-H2B או עם הטטרמר H3-H4. יש ראיות לכך שנוגדני אנטי-היטון מסוג IgG או IgM הנוצרים כתוצאה מחשיפה לתרופות שונות, הם ספציפים לאפיטופים של קומפלקסים שונים של היסטון (Burlingame ו-Rubin ב-J Clin Invest משנת 1991). היסטונים שעברו מודיפיקציה ניכרת נמצאו מעודדים תגובה חיסונית גדולה יותר (Dema וב' ב- Autoantibodies in SLEמשנת 2016). AHA יכולים להתגלות כצביעה הומוגנית-דיפוזית של הגרעין בתאיHEp-2, על ידי צביעה אימונו-פלואורסצנטית בלתי ישירה. עם זאת, נוגדנים-עצמיים כנגדds-DNA יכולים להביא לצביעה דומה, לכן חיוני לבצע בדיקה משלימה. ניתן לזהות AHA בעזרת Western immunoblotting, dot-immunoassay או בשיטת ELISA. אלו הן שיטות קלות לביצוע, יעילות ורגישות לגילוי AHA. שיטת ELISA נחשבת מעט פחות רגישה בהשוואה ל-Western blot או לשיטת dot immunoassay בבדיקה שעשתה שימוש בנסיוב מחולי לופוס, אם כי לעיתים ניתן לגלות ב-ELISA מקרים שלא ניתן לגלותם בשיטות האחרות. למרות ששתי השיטות, ELISA ו-Western blot למעשה מגלות פעילות נוגדנים כנגד היסטונים שעברו דה-נטורציה, נמצאו סתירות בין תוצאות שהתבלו בשתי שיטות אלו: לדוגמה, נוגדנים אנטי-H3 התגלו בעיקר בשיטת Western blot בעוד שנוגדנים אנטי-H1 מגיבים עם H1 כפי שמתגלה בעיקר בשיטת ELISA. את הנסיוב הנבדק יש להדגיר קודם לבדיקה עם DNAse על מנת לעכל את ה-DNA בצירקולציה על מנת למנוע קומפלקסים בלתי רצויים של DNA-histone. מספר חלבוני קושרי-היסטון בנסיוב כגון C-reactive protein, אקטין, מיוזין או nucleolin, יכולים להשפיע על הגילוי של AHA.
AHA מתגלים בתדירות משמעותית במספר מחלות סיסטמיות אוטואימוניות ואחרות, כדלהלן: SLE, rheumatoid arthritis, juvenile chronic arthritis, primary biliary cirrhosis, הפטיטיס אוטואימונית, דרמטומיוזיטיס/פולימיוזיטיס וסקלרודרמה. כמו כן AHA יכולים להתגלות בלופוס מושרית על ידי תרופות, במחלות נוירולוגיות כגון subacute sensory neuropathy ובמספר זיהומים כמו HIV ו- infectious mononucleosis. הדעה הרווחת היא ש-AHA כשלעצמם אינם פתוגניים. מספר מחקרים תיארו מודיפיקציות post-translational הספציפיות לאפופטוזיס, שיש להן משמעות בהכרתן על ידי AHA ב-lupus. מודיפיקציות אלו הן לדוגמה אזורי אצטילציה ב-H4 וב-H2B, מתילציה ב-H3, ו-ubiquitination ב-H2A (Dieker ו-Muller ב-Clin Rev All Immunol משנת 2010). Neeli ו-Radic דווחו בשנת 2008 שהיסטון H3 עובר ציטרולינציה בנויטרופילים, וממצא זה זכה לאישור על ידי Liu וחב' ב-Arthritis Res Ter משנת 2012.
מעט מאוד ידוע על הגנטיקה של יצירת AHA. תואר קשר בין יצירת נוגדנים עצמיים ל-H3 לבין ה-haplotype HLA-A2-DR4 בקבוצה של מטופלים אמריקאים עם הפטיטיס אוטואימוני type 1. אזורי V בשרשרות הקלות והכבדות של מספר AHA חד-שבטיים שבודדו מעכברי מודל של לופוס ומאנשים עם SLE, עברו ריצוף (Monestier וחב' ב-J Biol Chem משנת 2000). הממצאים של מחקר זה היו כדלהלן: אין שימוש או מעורבות של משפחות הגנים VH, DH, JH ו-JK בהכרה וזיהוי של היסטון; אזורי V של נוגדנים חד-שבטיים כנגד היסטונים, נוקלאוזומים ו-DNA, הם בעלי דמיון רב, ויש מסלולים משותפים בדרך ליצירת שבטי נוגדנים (clones) על ידי תאי B, המגיבים עם מרכיבי כרומטין אחדים; רוב רצפי V ב-AHA, מראים מוטציות סומטיות נרחבות, מה שתואם את העובדה שהיסטונים במבנים נוקלאוזומיים משחקים תפקיד בררני ביצירת אוטו-נוגדנים בזיקה גבוהה; אזורים ב-AHA חד-שבטיים מכילים מספר גדול של חומצות אמינו טעונות שלילית, שעשויות לשחק תפקיד חשוב בהכרה והקישור להיסטונים קטיוניים.
השימוש בבדיקה זו בתחלואה
תשעים וששה אחוזים מבין הנבדקים עם lupus המושרה על ידי procainamide, יימצאו חיוביים בבדיקת נוגדנים עצמיים להיסטון, ו-100% מבין אלה עם lupus מושרה על ידי פניצילאמין, methyldopa או isoniazid, יתקבלו חיוביים בבדיקת נוגדנים עצמיים להיסטון. ב-70% מהמטופלים עם rheumatoid arthritis, עם תסמונת Felty, עם תסמונת Sjogren, עם סקלרוזיס סיסטמית, או עם צמקת מרתית ראשונית נמצא נוגדני אנטי-היסטון, וכן במספר מחלות נוירולוגיות.
מגבלות השיטה
תוצאות חיוביות בבדיקת נוגדנים עצמיים להיסטון יכולות להימצא במספר מטופלים הנחשפים לתרופות שהוזכרו לעיל, שאין להם בהכרח סימנים או תסמינים של lupus. בדיקת נוגדנים עצמיים להיסטון אינה נחוצה לביסוס האבחון של SLE. תוצאות בדיקה זו אינן שימושיות לקביעת הפרוגנוזה של אלה עם SLE או עם drug-induced antibodies.
ממצאים סותרים או בלתי-הדירים פורסמו לגבי המשמעות הקלינית המדויקת של AHA. נוגדנים אלה אינם מופיעים רק במספר תרחישים אוטו-אימוניים ובאלה שאינם אוטו-אימוניים, אלא גם מראים שוֹנוּת ניכרת בין חולה אחד למשנהו בכל הקשור לריאקטיביות שלהם עם תת-היחידות של היסטון. בממוצע, נוגדני AHA מיוצרים ב-50% של חולי לופוס, והם כרוכים באופן בולט יותר במקרים של לופוס מושרה על ידי תרופות, שם הם עשויים להיות מיוצרים ביותר מ-90% מהמקרים. עם זאת, לא נמצא קשר בין דרגת היצירה של AHA לבין דרגת מחלת לופוס. מחקר אחד, המבוסס על שימוש ב-glomerular proteome arrays, הראה שבמקרה של SLE, נוגדני AHA מהווים חלק מצֶבֶר של נוגדני IgG שאינו כרוך עם חומרת המחלה. זאת בניגוד לצבר של IgG הפועל כאנטי-DNA/כרומטין (Zhen וחב' ב-J Clin Invest משנת 2005). לעומת זאת, מחקר אחר תיאר קשר חזק בין הנוכחות של נוגדנים המזהים H1 (ובאופן מדויק יותר אפיטופ עיקרי ב-H1 ברצף של חומצות אמינו 204–218), לבין חומרת לופוס. מחקר נוסף רמז שנוגדנים המכוונים כנגד היסטוני הליבה (בעיקר H2B) יכולים להיות כרוכים עם מאפיינים קליניים חמורים בסקלרודרמה.
השכיחויות של מטופלים המייצרים AHA שונות באופן ניכר בין חולה אחד למשנהו, והן תלויות בקריטריונים המשמשים להגדת המחלה וכן בשיטות המעבדה בשימוש. שוֹנוּת זו מתוארת בטבלה למטה (על פי Fritzler ו- Rubin ב-Syst Lupus Erythem משנת 2011):
| מחלה/תסמונת | שכיחות AHA |
|---|---|
| SLE | 17-95% |
| Drug-induced lupus | 67-100% |
| Drug-inuced ANA | 22-95% |
| Rheumatoid arthritis | 0-80% |
| Vasculitis | 31-75% |
| תסמונתFelty | 80% |
| Juvenile chronic arthritis | 42-75% |
| Mixed connective tissue disease | 45-90% |
| תסמונת Sjogren | 8-67% |
| Progressive systemic sclerosis | 25-50% |
| Polymyositis/dermatomyositis | 17% |
| Primary biliary cirrhosis | 50-81% |
| Hepatic cirrhosis/autoimmune hepatitis | 13-15% |
| מחלות סרטניות | 14-79% |
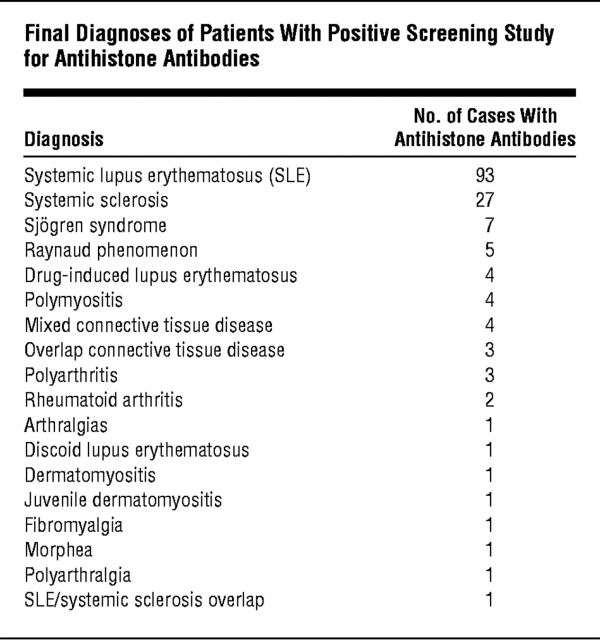
Zirwas ו-Deng דווחו ב-Arch Dermatol משנת 2004 על מחקרם שמדד את יצירת AHA במחלות שונות. במשך 17 שנה התקבלו במעבדתם 2,850 דגימות נסיוב (מתוכן 160 של מקרי SLE קלאסי, ו-6 מקרים של SLE מושרה על ידי תרופות). ב-93 מתוך 160 מקרי SLE זוהו 93 מקרים יוצרי AHA (המהווים 58%), כמו ב-4 מתוך 6 מקרים של מחלה מושרית על ידי תרופות (המהווים 66%).
הוראות לביצוע הבדיקה
יש לדגום את הדם במבחנה כימית (פקק אדום או צהוב) וגם במבחנת ג'ל. יש לפסול דגימות מאוד המוליטיות או ליפמיות, אך ניתן לקבל דגימות המוליטיות או ליפמיות באופן מתון. ניתן לקבל גם דגימות מאוד איקטריות. מועדפות דגימות נסיוב שנשמרו לאחר הפרדתן בסרכוז בקירור (יציבות עד 21 יום) על פני דגימות שהוקפאו, שאף הן יציבות למשך 21 יום. הבדיקה מתבצעת בשיטת ELISA. גילוי של נוגדנים כנגד היסטון יכול להתבצע גם בשיטה בלתי-ישירה של אימונו-פלואורסצנציה.
תערובת של היסטונים או היסטונים אינדיבידואליים, ניתנים לרכישה ממספר חברות פרמצבטיות. היסטונים מסחריים מיוצרים בדרך כלל מתימוס בקר, בשיטת מיצוי בחומצה, או שהם ממקור ריקומביננטי. יש לקחת בחשבון בעת בחינת דרגת הניקיון של מקטעי היסטון, שלכל היסטון יש זיקה שונה לצבעי החלבונים השונים (Coomassie blue או amido black), ולכן הם אינם נצבעים במידה שווה. בשגרה הקלינית היסטונים אינדיבידואלים משמשים רק באופן נדיר לבחינת נוכחות של נוגדנים כנגד היסטון. פרקציות מנוקות של היסטונים יכולות להישמר בצורה של ליופיליזציה למשך שנים תחת תנאי יובש בטמפרטורת החדר. כאשר ממיסים את הפרקציה המיובשת בתמיסה, אין לשמור את ההיסטונים המומסים לפרק זמן של למעלה מ-1–2 שבועות בקירור, כיוון שהם נוטים לעבור בצורה זו לעבור צימות, בפרט בריכוז יוני גבוה ובריכוז היסטון גבוה, מה שגורם לשינויים בתכונות האנטיגניות שלהם. ניתן לבחון את ניקיון הפרקציות השונות על ידי אלקטרופורזה בג'ל אקרילאמיד-SDS, או ב-acid-urea gel, עם או ללא triton.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים
- בדיקות מעבדה - מחלות אוטו-אימוניות
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק