נוגדנים כנגד הקולטן Phospholipsae A2
הופניתם מהדף נוגדנים כנגד הקולטן לפוספולפאז A2 לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| נוגדנים כנגד הקולטן ל-Phospholipase A2 | |
|---|---|
| מעבדה | אימונולוגיה, סרולוגיה |
| תחום | אבחון לתרחיש של נפרופתיה ממברנאלית ראשונית או אידיופתית |
| טווח ערכים תקין | רמת נוגדנים הנמוכה מ-40 U/ml |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הבדלה בין membranous nephropathy ראשונית (אידיופתית) לבין membranous nephropathy שניונית.
בסיס פיזיולוגי
מחלת MN ראשונית מלווה בירידה בתפקוד כלייתי, הבא לביטוי בתסמונת נפרוטית, פרוטאינוריה ניכרת, היפואלבומינמיה, היפרליפידמיה, בצקת וליפידוריה.
MN ראשונית היא סיבה עיקרית לתסמונת נפרוטית במבוגרים. ככל שמתגברת הפרוטאינוריה כך גדל הסיכון לכשל כלייתי, לתחלואה ותמותה, בעיקר כתוצאה מסיבוכים פקקתיים-תסחיפיים ומתחלואה קרדיו-וסקולארית. בערך שליש מהמאובחנים עם MN ראשונית, מגיעים ל-ESKD, בשליש יש פרוטאינוריה עיקשת ללא החמרה למצב של ESKD, ובשליש הנוסף יש רמיסיה עצמונית. MN ראשונית מתרחשת בכל המגזרים האתניים, בשני המינים, כאשר גברים מעל גיל 40 שנה הם בדרך כלל המושפעים ביותר. האבחון של MN ראשונית חיוני לעיתים כאשר יש צורך לעשות אבחנה מבדלת בין מפגע זה לבין MN שניוני. מכל מקרי MN 70-80% מסווגים כמחלה ראשונית, בעוד ש-20-30% כשניונית.
אבחנה מבדלת אמינה בין MN ראשונית לשניונית עשויה להיות קריטית, כיוון שנוקטים בהם טיפולים שונים: MN ראשונית תטופל על ידי immunosuppressants, ואילו התרפיה במקרים של MN שניוני תהיה מכוונת נגד המפגעים הספציפיים שעלולים לגרום ל-MN. זאת ועוד, במספר מטופלים, MN מופיע עוד לפני שניתן היה לזהות את סיבה השניונית להתפתחותו, מה שמגביר את הסיבוך האבחוני, ומקשה על בחירת הטיפול ההולם. MN ראשוני חייב להיות מאובחן באבחנה מבדלת גם ביחס למחלות אוטו-אימוניות אחרות, בהן יש מעורבות של הכליה, לדוגמה lupus nephritis, וסקוליטיס הכרוכה עם נוגדנים כנגד ציטופלזמה של נויטרופילים (ANCA), כמו גם תסמונת Goodpasture. עד סוף המאה ה-20 לא הייתה זמינות למבדקים סרולוגיים אמינים לאבחון של MN ראשונית, בעיקר כיוון שלא היו כל נתונים על אנטיגן המטרה של נוגדנים עצמיים אלה.
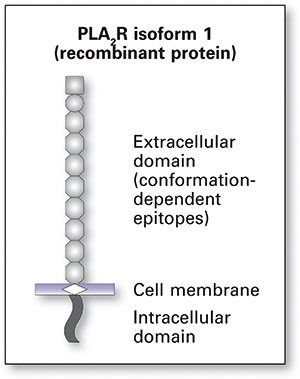
הקולטן ל-PLA2 הוא גליקופרוטאין טרנס ממברנאלי, המתבטא בפקעיות של כליות אדם, על פני הפודוציטים, והוא משחק תפקיד בתהליכים רגולטוריים בתא לאחר התקשרות האנזים פוספוליפאז. כן זוהה type M PLA2R כאנטיגן העיקרי אליו מכוונים הנוגדנים העצמיים. במטופלים עם MN ראשונית, יצירת קופלקסים של נוגדן-אנטיגן, מביאה להופעת משקעים בממברנה הבסיסית של פקעית הכליה, מקום בו הם משרים שפעול מקומי של המשלים, ויצירה מקומית מוגברת של קולאגן IV ושל laminin. כך נגרם נזק לפודוציטים, על ידי הרס של ה-cytoskeleton והרחבה של ה-basement membrane. כתוצאה מכך, יש מעבר של חלבון לשתן, להופעת פרוטאינוריה ותסמינים אחרים.
MN או membranous nephropathy יכולה להתפתח כתוצאה שניונית של לופוס סיסטמי (SLE), סוכרת type 2 או כתוצאה מזיהומים דוגמת הפאטיטיס B, משימוש בתרופות דוגמת NSAIDs וכן כתוצאה ממצבים ממאירים. במצבים אלה, המשקעים התת-אפיתליאליים יכולים לנבוע משקיעה של תצמידים (קומפלקסים) חיסוניים הנעים בדם בדופן הקפילארית, או כתוצאה מקישור נוגדנים לאמטיגנים שמקורם בתאי הסרטן ואשר נטבעים בתוך ממברנת הבסיס, (על פי Glassock ב-N Eng J Med משנת 2009).
Idiopathic membraneous nephropathy
מדי שנה מאובחנים בעולם כולו כ-50 אלף מקרים חדשים של Idiopathic membraneous nephropathy או IMN. נפרופתיה ממברנאלית אידיופתית נחשדה משך שנים כמפגע בעל אופי אוטואימוני, המהווה את הגורם השכיח ביותר לתסמונת נפרוטית בהיותו גורם לדלקת כרונית של פקעיות הכליה במבוגרים ממוצא לבן, כפי שסיכמו Tieboche וחב' ב-Kidney Int בשנת 1987. כבר בשנת 1957 הופיע ב- Am J Pathol מאמרו המקורי של Jones על nephritic glomerulonephritis, ועל ממצאי ביופסיה כלייתית ומיקרוסקופיית-אור לאבחון מפגע זה, ולאחר מכן בשנת 1966 דיווחו McCluskey וחב' ב-N Eng J Med על צביעה אימונופלואוסצנטית של IgG המגלה אימונוגלובולין זה וכן משקעי משלים C3 לאורך הדופן של הקפילארה הגלומרולארית, ובהמשך דווח על משקעים של תוצרי תגובה חיסונית שהם electron-dense, המופיעים בתרחיש זה בתת-ממברנת הבסיס האפיתליאלית בפקעיות הכליה. בשנת 1979 פורסם ב-Lancet על ידי Klouda וחב', שקיים קשר הדוק בין IMN לבין HLA-DRW3, ואילו ב-1989 דווח לראשונה ב-Tissue Antigen על ידי Vaughan וחב', שקשר כזה קיים גם בין IMN לבין האלל DQA1.
בסיס של תגובה חיסונית ב-IMN משתמע גם מהקשר בין תוצרי שפעול משלים כגון C3DG ו-C5b-9 שניתן לזהות בשתן ורמת הפעילות של המחלה (Kon וחב' משנת 1995 ב-Kidney Int). אך רק בעשור הראשון של המאה ה-21 התקבלה הוכחה מוחלטת שתגובה אוטואימונית עלולה להיות מרכיב משמעותי בהופעת IMN. בשנת 2002, זיהו Debiec וחב' ב-N Eng J Med, את האנטיגן CD10 שהוא אנדופפטידאז נויטראלי כאוטו-אנטיגן הראשון הבא לביטוי ומשמש כגורם ל-MN. ב-2011 פרסמו Beck וחב' ב-J Am Soc Nephrol שרמת הנוגדנים ל-PLA2R פוחתת משמעותית על ידי טיפול ב-rituximab הפועל כנגד תאי B, מה שכרוך גם בטווח הקצר בשיפור קליני.
נוגדנים עצמיים ל-PLA2R
נתונים ממודל בחולדות של Heyman nephritis קידמו את ההשערה שבאדם נוגדנים במחלה זו מגיבים ונקשרים למטרה אנטיגנית ראשונית על פני פודוציטים ( Debiec ו-Ronco ב-Ann NY Acad Sci משנת 2007). מחקרים עדכניים יותר, על הפתוגנזה של IMN באדם, הביאו לבידוד אנטיגנים על פני הפודוציטים המשמשים מטרה פוטנציאלית לנוגדנים עצמיים אלה. Prunotto וחב' פרסמו ב-2010 ב-J Am Soc Nephrol, שנוגדנים עצמיים נקשרים לאנזימים aldose reductase ול-SOD2, ואילו Beck וחב' במאמר משנת 2009 ב- N Eng J Med תיארו קישור נוגדנים עצמיים לקולטן טבעי של האנזים M-type phospholipase A2, וכן לגִרסה ריקומביננטית של קולטן זה. במאמר זה הודגם גם מתאם בין כייל הנוגדנים האחרונים לבין דרגת הפעילות של המחלה.
במאמר האחרון נמצא ש-PLA2R בא לביטוי על פודוציטים וכן שנוגדנים כנגד קולטן זה, בעיקר אלה מתת-קבוצה IgG4 היו נוכחים בערך ב-70% של מטופלים עם IMN בצפון-מזרח ארצות הברית, ולמעשה מחקר זה שימש בסיס לעדות על האופי האוטו-אימוני של מחלה זו. חשיבות תפקידו של PLA2R בפתוגנזה של IMN נסמכה גם על מתאם מאוד משמעותי בין SNPs בגן המקודד ל-PLA2R והתפתחות IMN, וכן נמצא ש-HLA-DAQ1 מהווה אף הוא גורם סיכון למחלה זו, כפי שפרסמו Stanescu וחב' ב-N Eng J Med בשנת 2011.
על מנת להיווכח האם נוכחות מוגברת דומה של נוגדנים עצמיים ל-PLA2R ניתנת לגילוי גם באוכלוסייה אירופית, בחנו Hofstra וחב' נושא זה במדגם של חולים מתחום העיר ההולנדית Nijmegen המאובחנים עם IMN על ידי ביופסיה כלייתית. בניסוי שהתפרסם בשנת 2011 ב-Clin J Am Soc Nephrol, השתתפו 18 מטופלים, מהם נלקחו 54 דגימות דם בשלבים שונים של מהלך המחלה. במקביל נמדדו בדגימות נסיוב אלה מדדים נוספים המשמשים להערכת התפקוד הכלייתי כגון רמות קראטינין, אלבומין, כולסטרול, בטא-2-מיקרוגלובולין (β2m), וכן IgG וטרנספרין, כמו גם נמדדה ההפרשה בשתן של קראטינין, β2m אלבומין, IgG, טרנספרין, ו-אלפא-1-מיקרוגלובולין. כל הדגימות הללו נשמרו בהקפאה בטמפרטורה של מינוס 70 מעלות.
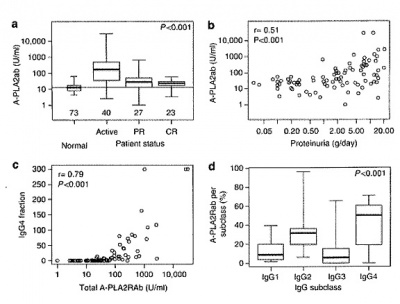
במחקר של Kanigicherla וחב', שהתפרסם בשנת 2013 ב-Kidney Int, נבדקו רטרוספקטיבית רמות הנוגדנים ל-PLA2R ב-90 מטופלים אנגליים מאזור מנצ'סטר עם IMN מאובחן בביופסיה, מהם נלקחו דגימות דם פרוספקטיבית במשך 33 חודשי מעקב מאז מדידה ראשונית של נוגדנים ל-PLA2R בשיטת ELISA כמותית, ותועדו נתונים קליניים כדרגת פרוטאינוריה. נוגדנים אלה זוהו ב-70% מהנבדקים בניסוי זה, אם כי שעור המקרים עם נוכחות הנוגדן הגיע ל-75% בקרב נבדקים עם מחלה פעילה, ורמת הנוגדן הייתה משמעותית גבוהה יותר בנבדקים עם רמיסיה חלקית או מלאה, בהשוואה לנבדקים בריאים: רק ב-37% מבין אלה עם רמיסיה חלקית נמצא הנוגדן, ואילו באלה עם רמיסיה מלאה הוא נמצא רק ב-10% מהמקרים. רק במקרה אחד מתוך 73 נבדקים בריאים נמצא הנוגדן.
בניסוי זה נמצא שהרמה הממוצעת של נוגדים ל-PLA2R בביקורת של בריאים הייתה 10 U/ml, במטופלים עם רמיסיה חלקית היא נקבעה כ-28.2U/ml, באלה עם רמיסיה מלאה-23.7U/ml, זאת בהשוואה לרמת נוגדן של 170.8U/ml באלה עם IMN בשלב פעיל של המחלה.
במחקר באוכלוסייה סינית של Qin וחב' בשיתוף עם Beck מבוסטון שהתפרסם ב-2011 ב-J Am Soc Nephrol, נמצא שבין 60 נבדקים עם IMN, ב-49 מתוכם (82%), היו חיוביים לנוכחות הנוגדן במבדק בשיטת western blotting, באלה בפאזה הפעילה של המחלה, וכן ב-4 מתוך 21 חולים שמחלתם ברמיסיה (19%).
המצבים הקליניים להם הייתה התייחסות בניסוי זה היו תסמונת נפרוטית (רמת אלבומין בנסיוב של פחות מ-3.0 גרם/דציליטר ופרוטאינוריה של מעל 3.5 גרם ליום), רמיסיה ספונטאנית (הפחתת הפרוטאינוריה של מעל 50% ללא טיפול בתרופות מדכאות את התגובה החיסונית), רמיסיה מושרית על ידי טיפול בתרופות מדכאות את מערכת החיסון, פרוטאינוריה עיקשת שמעל 3.5 גרם ליום, או מצב של relapse (פרוטאינוריה של מעל 3.5 גרם חלבון ליום לאחר רמיסיה).
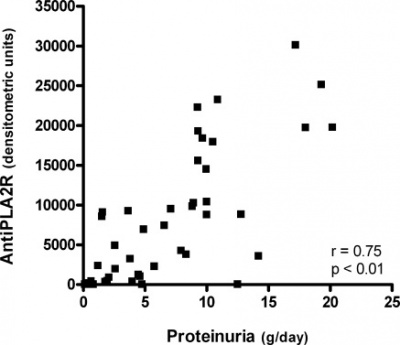
ממצאי ניסוי זה היו כדלקמן: רמות נוגדנים כנגד PLA2R נמדדו בשיטת Western blot בדגימות נסיוב, ונמצא שב-14 מתוך 18 הנבדקים עם IMN או 77.8%), נמצאו נוגדנים אלה בדגימת ה-baseline שלהם שנלקחה בשעת תרחיש של תסמונת נפרוטית. בארבעה מהנבדקים בהם לא נמצאו נוגדני IgG4 כנגד PLA2R. בנבדקים שנמצאו חיוביים לנוכחות נוגדנים אלה בדגימת הבסיס, נמצא מתאם טוב עם מאפיינים קליניים אחדים כמו פרוטאינוריה (r=0.75, p<0.01, ראה תרשים), וכן עם רמת β2m בנסיוב ( r=0.72; p<0.01), עם הפרשת IgG בשתן (r=0.70, p=0.03), עם הפרשת β2m בשתן (r=0.67, p<0.01), ועם רמת קראטינין בנסיוב (r= 0.57, p=0.03). נמצא מתאם שלילי בין רמות נוגדנים ל-PLA2R לבין GFR מוערך (r=-0.53, p=0.049).
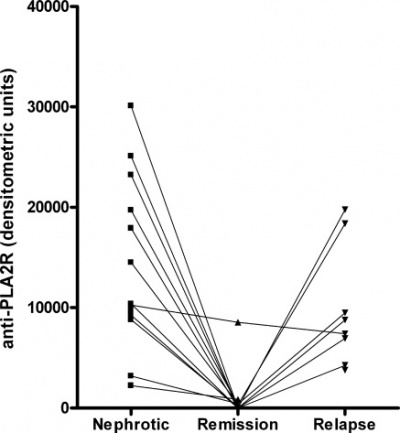
באופן כללי, נמצא בניסוי זה שרמות הנוגדן נגד PLA2R היו גבוהות בתחילת הפאזה של תסמונת נפרוטית, ירדו בהמשך משמעותית בשעת הרמיסיה, ועלו שוב בעת ה-relapse.
התגובה של ארבעת האיזוטיפים של IgG הראתה גרדיאנט מובהק לפיו IgG4>IgG2>IgG3>IgG1 בשלב מוקדם של המחלה (תוך פרק זמן של 6 חודשים מהביופסיה). כפי שמציינים Hofstra ו-Wetzels בשנת 2012 ב-Ned J Med, כיוון שהאיזוטיפ IgG4 הדומיננטי בביופסיות המתקבלות ב-IMN אינו קושר משלים, התעורר ויכוח מה המשמעות הפתוגנית של מקטע נוגדני זה. במאמר עדכני של Ma ו-Beck משנת 2011 ב-J Am Soc Nephrol, מועלית האפשרות שאיזוטיפ IgG4 של הנוגדן כנגד PLA2R עשוי להיקשר ללקטין קושר mannose או MBL, והוא משפעיל את המשלים באופן עקיף על ידי המסלול של MBL.
רמות הנוגדן ל-PLA2R היו כרוכות באופן משמעותי עם ביטוי של DQA1*05:01 ו-DQB1*02:01. ניתוח ההישרדות של מטופלים עם IMN הראה שרמת הנוגדנים ל-PLA2R שהייתה במתאם עם חומרת המחלה הכלייתית, הייתה גם במתאם שלילי עם תוחלת החיים.
בתורמי דם בריאים או במטופלים עם MN משנית, או באלה עם מחלות כליה אחרות כגון לופוס נפריטיס או IgA nephropathy, לא נמצאו נוגדנים ל-PLA2R כמדווח על ידי Ginnarsson וחב' ב-Am J Kidney Dis בשנת 2012. ערך הניבוי הגבוה של נוגדנים אלה, הציג מדד זה כאידיאלי כסמן אבחוני ל-IMN, כפי שמסר בסקירתו Schlumberger ב-Autoimmunity Reviews משנת 2014.
ניטור של הטיפול המחלה
טיפול עם immunosuppressants מפחית את רמת אנטי PLA2R, ואילו בעת relapse טיטר נוגדנים אלה עולה שוב. משמעותית העובדה ששינויים בכייל הנוגדן הזה, מקדימים את השינויים בעוצמת הפרוטאינוריה (Stahl וחב' משנת 2010 ב-N Eng J. Med ו-Hofstra וחב' ב-J Am Soc Nephrol משנת 2012). לפיכך, עליה בטיטר הנוגדן מתגלה לפני הופעת פרוטאינוריה, בעוד שירידה בכייל זה מופיעה לפני הירידה בפרוטאינוריה. במטופלים ברמיסיה מופיעה פרוטאינוריה שארית חודשים אחדים לאחר שכייל הנוגדנים ל-PLA2R הופך בלתי ניתן לגילוי. לכן מדידת רמת נוגדן זה שימושית ביותר להחלטה מוקדמת של טיפול תרופתי, כמו גם לניטור ארוך-טווח של התגובה לטיפולים האימונו-תרפיים. אין כל ראייה לכך ש-anti PLA2R עצמו גורם לפרוטאינוריה.
ב-2014 התפרסם מחקר פרוספקטיבי של Hoxha וחב' ב-J Am Soc Nephrol, שהדגיש ביתר שאת את הערך של מדד הנוגדנים ל-PLA2R לתוצאים הקליניים של MN ראשוני. בניסוי השתתפו 133 חולים עם מפגע זה, שהיו במעקב משך 24 חודשים. בכל המקרים הללו היה מתאם ברור בין פרוטאינוריה לבין רמות הנוגדן. במטופלים עם אימונו-תרפיה בניסוי זה, נמצא פרק זמן משמעותי בין הנפילה המהירה ברמת הנוגדן לבין הירידה ברמת הפרוטאינוריה. יתרה מכך, רמיסיה של פרוטיאנוריה התרחשה מאוחר יותר במטופלים עם רמת נוגדן גבוהה, לעומת אלה עם רמת נוגדן נמוכה. במטופלים שלא קיבלו טיפול לדיכוי התגובה החיסונית, רמיסיה ספונטאנית הייתה כרוכה גם כן עם ירידה בכייל של anti-PLA2R, ואילו במטופלים שלא הגיעו לרמיסיה המשיכה להיות גבוהה רמת הנוגדן.
נוגדנים ל-PLA2R והופעה מחודשת של IMN לאחר השתלת כליה
במטופלים עם IMN המגיעים לשלב של ESRD, השתלת כליה היא אחד הצעדים המועדפים, אם כי על פי Choy וחב' בסקירתם משנת 2006 ב-Am J Transplant, המהלך הבתר-השתלתי מורכב על ידי הופעה מחודשת של המחלה ב-10% עד 45% מהמושתלים. ניתוח רטרוספקטיבי של 15 מושתלי כליה מצא שנוכחות עיקשת של נוגדנים כנגד PLA2R לתקופה של 6 חודשים ומעלה לאחר ההשתלה, היוותה גורם סיכון משמעותי לחזרת המחלה, בעיקר במושתלים שהיו מצויים בטיפול לא מיטבי של immunosuppressors. זאת על פי Seitz-Polski וחב' משנת 2014 ב-Nephrol Dial Transplant.
גילוי הנוגדנים ל-PLA2R, עודד מחקרים לבחינת תפקיד נוגדנים אלה בהתפתחות או בניבוי של IMN recurrence במושתלים אלה. Stahl וחב' פרסמו ב-N Eng J Med בשנת 2010, מקרה של מטופל עם רמות גבוהות של נוגדנים ל-PLA2R בעת השתלת הכליה, בו חזרה המחלה כמעט מייד לאחר ההשתלה. בשנת 2011 דווחו Debiec וחב' ב-Am J Transplant, על 10 מושתלי כליה עם IMN, ומחלה חוזרת ועל 6 מושתלי כליה עם IMN ללא מחלה חוזרת, לאחר ההשתלה.
ב-6 מתוך 10 מושתלי כליה עם מחלה חוזרת ניתן היה למצוא PLA2R במשקעים בביופסיה של הכליה המקורית, כרמז לכך שמדובר במחלה הקשורה לנוגדנים אלה. ב-5 מתוך 6 מקרים אלה, נמצאו נוגדנים אלה גם בנסיוב ו/או בביופסיה בעת חזרת המחלה לאחר ההשתלה. באחד המקרים חזרה המחלה בכליה המושתלת, אך לא נמצאו אצלו נוגדנים אלה. יתרה מכך, בשני מושתלים אחרים גם כן היו ממצאים ייחודיים: באחד מהשניים, נמצאו נוגדנים אלה בנסיוב בעת ההשתלה, אך נעלמו ממנו בעת חזרת המחלה, זאת למרות שבביופסיה נמצאו בכליה משקעים המכילים PLA2R. במושתל השני, בו נמצאו נוגדנים ל-PLA2R בנסיוב, לא ניתן היה לזהות את האנטיגן PLA2R בביופסיה.
לעומת זאת, בשלושה מתוך ששה המושתלים בהם לא חזרה המחלה, נמצאה נוכחות הנוגדנים המדוברים בנסיוב בעת ההשתלה. נראה שנוכחות של נוגדנים כנגד PLA2R לא גרמה לחזרת המחלה במושתלי הכליה, לפחות לאורך תקופה של 4 שנים לאחר ההשתלה, ונזדקק לניסויים רבים מאשרים נוספים, להבהיר את הנקודות הסתומות הללו.
מערכות למדידת anti-PLA2R
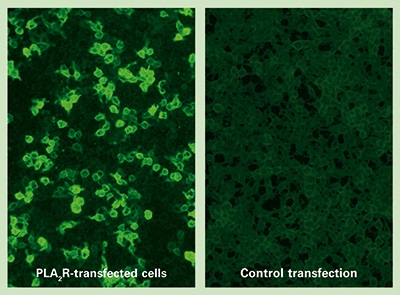
בעבר הלא רחוק נעשה שימוש בשיטת western blot תוך שימוש בתמצית של חומר גלומרולארי שעבר אלקטרופורזה בתנאים לא-מחזרים. נסיוב הנבדק שימש מקור לנוגדן הראשוני, נוגדן ממקור כבש כנגד מקטע IgG אנושי שימש כנוגדן השניוני, ולבסוף נוגדנים מצומדים עם האנזים peroxidase כנגד נוגדנים של כבש משמשים לזיהוי נוכחות של anti-PLA2R. הכימות נעשה בעזרת דנסיטומטריה. בשנת 2011 פיתחו Hoxha וחב' שיטה בלתי-ישירה פלואורסצנטית (IFT), הזמינה כערכה מסחרית (Nephrol Dial Transplant, משנת 2011). מנוגדנים עצמיים ל-PLA2R ניתנים לזיהוי וכימות באופן אמין תוך שימוש ב-IIFT אוindirect immunofluorescence test או בשיטות ELISA. ב-IIFT נעשה שימוש ב-BIOCHIP המכיל תאי-אדם מסוג Hek 293 המבטאים את PLA2R ריקומביננטי, המשמש בתור מצע אנטיגני לגילוי הנוגדן הנקשר אליו. BIOCHIP שני המכיל תאים שעברו טרנספקציה עם "וקטור ריק", משמש כביקורת. שיטת IIFT מתאימה לבדיקות סריקה אבחוניות לאנליזה איכותית או חצי כמותית של הנוגדן בנסיוב. ה-biochips עוברים הדגרה עם הנסיוב הנבדק במיהולים שונים, והנוגדנים הנקשרים מתגלים בעזרת נסיוב תיש כנגד IgG מסומן עם FITC.
שיטת ה-ELISA מבוססת על PLA2R ריקומביננטי מנוקה והיא שימושית במיוחד לאבחון וניטור מהלך המחלה, שכן היא מאפשרת מדידת כמותית של רמת הנוגדן בנסיוב של הנבדקים.
במחקרו של Hoxha אופיינו הביצועים של anti-PLA2R בשיטת IIFT וכן בשיטת ELISA, כאשר במחקר הרטרוספקטיבי האמור התקבלה בשיטת Anti-PLA2R IIFT תוצאה חיובית ב-52% מבין 100 מטופלים עם MN ראשונית מוכחת על ידי ביופסיה, וספציפיות של 100% בנבדקים בריאים, באלה עם MN שניונית או באלה עם נזק גלומרולארי שאינו ממברנאלי. לעומת זאת, בניסוי קליני פרוספקטיבי שפרסם Hoxha ב-Kidney Int ב-2012, נמצא באותה שיטת אבחון שתוצאה חיובית למציאות נוגדן הופיעה ב-82% מבין מטופלים עם MN ראשוני מוכח. ההבדל של 30% בגילוי הנוגדן ב-2 מחקריו של Hoxha נובע כנראה מגורמים כגון רמיסיה והסטאטוס הטיפולי החלים אלה, שיכול להשפיע על נוכחות הנוגדן, בעיקר כאשר מדובר בניסוי רטרוספקטיבי.
תוצאות שהתקבלו בשיטת ELISA הראו מתאם טוב מאוד עם תוצאות בשיטת IIFT. במחקר רטרוספקטיבי עם נסיובים שהתקבלו מ-198 חולים עם MN ראשוני ומ-836 נבדקים בריאים או כאלה עם מחלות לא רלוונטיות, המתאם היה של מעל 94%, כאשר במקרים הבודדים בהם התקבלה תוצאה שלילית ב-ELISA התקבל טיטר נמוך של 1:10 עד 1:100 בשיטת IIFT. לעומת זאת, כל הנסיובים בהם טיטר הנוגדנים נמצא מעל 1:100 בשיטת IIFT התקבלו גם חיוביים בשיטת ELISA. נכון לשנת 2014 החברה הגרמנית Eurolmmun מציעה ערכה מסחרית למדידת נוגדנים ל-PLA2R בשיטה אימונו-פלואורוסצנטית.
במחקר רב-מוסדי בהולנד, צרפת ואנגליה, הִשוו Hofstra וחב' את שיטת IIFT עם שיטת ELISA במדידת נוגדנים עצמיים ל-PLA2R ב-117 מטופלים עם IMN. תוצאות המחקר שהופיעו ב-2012 ב-J Am Soc Nephrol מצאו ש-74% מהמטופלים היו חיוביים לנוגדן בשיטת IIFT, ואילו 72% מהם נמצאו חיוביים בשיטת ELISA.
רמת הנוגדנים כנגד PLA2R ורמיסיה ספוטנית
הקולטן של M type phospholipase A2 (להלן PLA2R), הוא אנטיגן ספציפי ב-IMN, ונוגדנים כנגד PLA2R מופיעים בערך ב-70% מהמאובחנים עם IMN (Kao וחב' ב-J Am Soc Nephrol משנת 2015, Szymanski וחב' ב-Journal of Clinical Aphresis משנת 2017, ו-Prabhu וחב' ב-Nephrology משנת 2016). למרות שהערך האבחוני של נוכחות נוגדנים כנגד PLA2R ב-IMN מקובל (Pang וחב' ב-Medicine משנת 2017, Van De Logt וחב' ב-Kid Int משנת 2015, ו-Seitz-Polski וחב' ב-J Am Soc Nephrol משנת 2016), לא ברורה נוכחות נוגדנים אלה על הפרוגנוזה של המפגע. ניסויים אחדים אף הראו שנוכחות נוגדנים אנטי-PLA2R בעת אבחון המפגע, עשויים לנבא רמיסיה ספונטנית (Radice וחב' ב-Autoimmun Rev משנת 2016, Jullien וחב' ב-Clin Kidney J משנת 2017, Hoxha וחב' ב-Clin J Am Soc Nephrol משנת 2014, ו-Kim וחב' ב-American Journal of Nephrology משנת 2015). Hofstra ו-Timmermans הציעו שרמיסיה ספוטנית שכיחה יותר באלה עם IMN שטיטר הנוגדנים כנגד PLA2R בנסיוב שלהם נמוך יותר (Hofstra וחב' ב-J Am Soc Nephrol משנת 2012, ו-Timmermans וחב' ב-Am J Nephrol משנת 2015). אך כיוון שבניסויים אלה מספר המטופלים היה קטן, קשה להגיע למסקנה באשר לקשר בין טיטר הנוגדנים כנגד PLA2R לבין ההסתברות לרמיסיה בחולים אלה (Oh וחב' ב-PLos One משנת 2012, ו-Pourcine וחב' באותו כתב עת משנת 2017).
Wu וחב' פרסמו ב-Medicine משנת 2018 מטה-אנליזה שהתייחסה לרמת הנוגדנים כנגד PLA2R להסתברות לרמיסיה ספונטנית במטופלים עם IMN. נסקרו חמישה ניסויים שכללו במקובץ 190 משתתפים, ונמצא שאלה ממשתתפי הניסוי שנמצאו חיוביים לנוכחות נוגדנים אלה בעת שאובחן בהם IMN, נמצאו במתאם שלילי לגבי ההסתברות של רמיסיה ספונטנית (RR=0.69, p=0.001). מסקנת מטה-אנליזה זו היא שאי-נוכחות נוגדנים ל-PLA2R מגבירה את הסיכוי לרמיסיה ספונטנית, בהשוואה לאלה בהם נמצאים נוגדנים אלה. לכן, כדי להימנע מאירועים ממאירים שעלולים להתרחש בטיפול עם תכשירים מדכאי-חיסון, כדאי לנקוט בטיפולים שמרניים באלה הנמצאים שליליים לנוכחות בנוגדנים האמורים בעת האבחון של IMN.
בעוד שכּשל כלייתי נמצא מתרחש בשכיחות נמוכה יותר באלה עם רמת anti-PLA2R נמוכה, הרי שרמיסיות ספונטניות פחות שכיחות באלה עם רמות גבוהות של נוגדנים anti-PLA2R. מספר מחקרים דיווחו שמטופלים על ידי תרפיה מדכאת חיסון הראו כצפוי ירידה ברמת הנוגדנים כנגד PLA2R, ושרמת נוגדנים אלה עולה בעת רמיסיה (Beck וחב' ב-J Am Soc Nephro משנת 2011, Hoxha וחב' ב-Nephrol Dial Transplant משנת 2011, Stahl וחב' ב-N Eng J Med משנת 2010, ו-Hofstra וחב' ב-Nat Rev Nephrol משנת 2013). נתונים נוספים מצביעים על כך שבמטופלים חיוביים לנוגדנים כנגד PLA2R, מדידת רמת הנוגדנים בסיום תקופת הטיפול עשויה לנבא את מהלך המחלה בהמשך (Beck וחב' ב-Clin J Am Soc Nephrol משנת 2014). כמו כן, El Zoghby וחב' דיווחו ב-Am J Transplant משנת 2009, ש-IMN מתרחש ב-40% לכל היותר מבין אלה שעברו השתלת כליה. הסיכון להישנות המחלה גדול יותר כאשר נוגדנים עצמיים כנגד PLA2R מתגלים לפני ההשתלה.
MN אחראי בערך ל-20% מהמקרים של תסמונת נפרוטית במבוגרים. בערך שליש מאלה עם MN, יתדרדרו בהמשך לפתח אי-ספיקה כלייתית סופנית תוך 10 שנים (Steinman וחב' ב-Nephrol News Issues משנת משנת 2003). שליש אחר של אלה עם MN יפתחו פרוטאינוריה כרונית ותסמונת נפרוטית, ואילו שליש נוסף ייהנו מרמיסיה ספונטנית. MN יכול להופיע כתולדה של מספר מצבים קליניים כגון זיהומים (הפאטיטיס B ועגבת), לופּוס סיסטמי, סרטן, וטוקסיות של תרופות. כאשר MN מופיע ללא תלות בתמונות ידועות אחרות, ההתייחסות אליו היא כאל primary MN, אשר באופן היסטורי כונה idiopathic MN (או IMN) דהיינו ללא סיבה אטיולוגית ידועה. מדובר במחלה אוטו-אימונית בה נוגדנים מגיבים עם אנטיגן אינטרינסי על פני הפּדוֹציטים הגלומרולריים, ויוצרים משקעים של קומפלקסים אימוניים על דופן הקפילרות הגלומרולריות. ידוע שנוגדנים עצמיים בצירקולציה המכוונים כנגד קולטן M type על פני הפּודוציט המשמש את האנזים המופרש phospholipase A2, מופיעים ב-70-80% מאנשים מאובחנים עם IMN (על פי מחקרו המקורי והמכונן של Beck משנת 2009 שהתפרסם ב-N Eng J Med).
העיקרון של מדידת נוגדנים כנגד PLA2R בשיטת TRFIA (time-resolved fluoroimmunoassay)
נוגדנים רקומביננטיים כנגד PLA2R נוצרו על ידי שיבוט בתאי 293T. נוגדנים ממקור עז כנגד IgG אנושי סומנו עם +Euronium3. הריכוז האופטימלי של האנטיגן PLS2R לציפוי פלטות מיקרו-טיטר היה בערך 5 מיקרוגרם/מ"ל. ההוספה של מגביר פלואוסצנטי הביאה לחיזוק הפלואורסצנציה המקורית פי מיליון, ושיפרה את הרגישות ואת טווח הגילוי בשיטה זו של הנוגדנים מסוג IgG כנגד PLA2R. מכשיר AutoDELFIA1235 של חברת Perkin Elmer, שימש למדידת הפלואורסצנציה +Euronium3 בבארות של פלטת המיקרוטיטר. תחום המדידה של IgG כנגד PLA2R בשיטת TRFIA היה 0.02-340 מיליגרם/ליטר. ה-intra CV נקבע כ-3.2%, וה-inter CV נקבע כ-5.6%.
כימות אולטרה-רגיש של רמת נוגדנים כנגד PLA2R כמדד אבחוני ופרוגנוסטי של idiopathic membranous nephropathy
בסין, אחוז המקרים של MN גדל במהירות בקרב אלה עם גלומרולופתיה ראשונית (או אידיופתית) מ-7.1% בשנת 2000, ל-22.7% בשנים 2009–2011 (Pan וחב' ב-Conrtib Nephrol משנת 2013). מפגע MN שכיח בגברים פי-2 יותר מאשר בנשים והוא מופיע בבני 50 שנה ומעלה ב-30.6% מהמקרים, כאשר באלה בני 60 שנה ומעלה, הוא מהווה את הסיבה העיקרית ל-MN אידיופתי. האבחון המסורתי של MN התבצע בעזרת ביופסיה כלייתית, כאשר 75% מהמקרים היו אידיופתיים (IMN), ושאר המקרים היו משניים לזיהומים (דוגמת הפאטיטיס B), מסיבה אוטו-אימונית (דוגמת לופוס), השפעת תרופות (דוגמת NSAIDs), או משניים לממאירויות (Feng וחב' ב-Oncotarget משנת 2016, Lefaucheur וחב' ב-Kidney Int משנת 2006). המחקרים המקוריים של Hoxha ,Hofstra ,Beck וחבריהם, הראו שנוגדנים עצמיים כנגד PLA2R הופיעו ב-52-82% מהמאובחנים עם IMN. אך לא נמצאו או שהיו מאוד לא שכיחים באלה עם MN משני (Segarra-Medrano וחב' ב-Nefrologia משנת 2014).
גם Dou וחב' ב-Int Urol Nephrol משנת 2016, הדגימו את דרגות הדיוק, הרגישות והספציפיות הגבוהות של בדיקה זו לאבחון IMN. אך מה שלא הובהרה לחלוטין היא מידת המתאם בין טיטר הנוגדנים ל-PLA2R ודרגת המחלה (Kim וחב' ב-Am J Nephrol משנת 2015, Wei וחב' באותו כתב עת משנת 2016, Lin וחב' ב-Zhonghua Nei ke Sa Zhi משנת 2015, ו-Ruggenenti וחב' ב-J Am Soc Nephrol משנת 2015). אי הוודאות הזו יכולה להיות מוסברת חלקית בכך בהבדלים בין שיטות המדידה של טיטר הנוגדנים הללו, וגם בעיתוי השונה של נטילת הדם על ידי החוקרים השונים. לכן בחרו Zhang וחב' ב-Sci Rep משנת 2017, למדוד את הנוגדנים כנגד PLA2R בשיטת TRFIA או Time-resolved fluoroimmunoassay, שהיא שיטה חדשה לאנליזה של המתאם בין רמת הנוגדנים האמורים לבין המדדים הקליניים של מאובחנים עם IMN.
בניסוי האחרון נמדדה בשיטת TRFIA רמת אימונוגלובולין IgG כנגד PLA2R בנסיוב של 172 מטופלים, מהם 69 עם IMN, וכן 9 עם MN משני ו-94 מאובחנים עם גלומרולונפריטיס מסיבות אחרות, וכקבוצת ביקורת נוספת שמשו 286 אנשים בריאים לחלוטין. רמות של נוגדנים אנטי-PLA2R בנסיוב של המתנדבים הבריאים היו בין 0.09-0.91 מיקרוגרם/מיליליטר, וכיוון שכך החליטו בעלי המחקר לקבוע את רף הנורמה העליון על רמת נוגדנים של 0.91 מיקרוגרם/מיליליטר. עם סף נורמה זה רגישות הבדיקה נקבעה כ-84.06% לאבחון של IMN. כאשר הוגבה סף הנורמה העליון לריכוז נוגדנים של 2.025 מיקרוגרם/מיליליטר, הרגישות לאבחון IMN אמנם פחתה ל-71.01%, אך הספציפיות של האבחון הגיעה ל-100%. במאובחנים עם IMN רמת הנוגדנים מסוג IgG כנגד PLA2R, הייתה גבוהה יותר באופן משמעותי בהשוואה לרמתם במאובחנים עם MN משני. היה מתאם שלילי בין רמת נוגדנים אלה לבין תפקוד הכליות (GFR), דהיינו ככל שרמת הנוגדנים הייתה גבוהה יותר, ה-GFR היה נמוך יותר, כמו גם רמת אלבומין בנסיוב שכן אחוז גבוה של חלבון זה הופרש בשתן. כצפוי, ככל שרמת הנוגדנים הייתה גבוהה יותר כך גם נרשמה עלייה ברמת קראטינין בנסיוב, וירידה בשיעור רמיסיה מוחלטת. מובהק לא פחות היה הממצא שככל שרמת הנוגדנים ל-PLA2R הייתה גבוהה יותר, הפרוגנוזה של אלה עם IMN הייתה גרועה יותר.
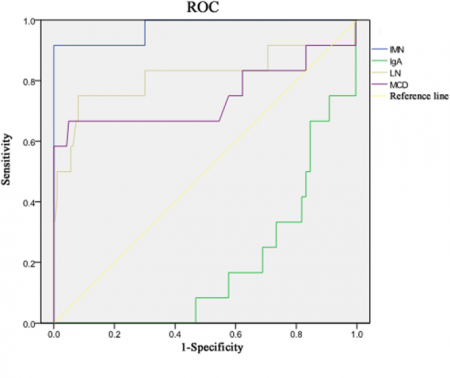
פירוט של תוצאות הניסוי של Zhang וחב': הרמה הממוצעת של נוגדנים מסוג IgG כנגד PLA2R בנסיוב של מתנדבים בריאים הייתה 0.5 מיקרוגרם/מיליליטר. כאמור, בקבוצת ה-IMN רגישות השיטה הייתה של 84.06%, בעוד שרגישותה בקבוצת המאובחנים עם minimal change disease או MCD הייתה 58.33%, בקבוצת ה-lupus nephritis או LN הרגישות הייתה 50%, בקבוצת המאובחנים עם IgA nephropathy הרגישות הייתה 41.82%, ואילו באלה עם נפרופתיות מסיבות אחרות הרגישות הייתה 40%. אנליזה של עקומת ROC או receiver-operating-characteristics של נוגדנים מסוג IgG כנגד PLA2R, הבדילה בין IMN (עם 0.975), לופוס נפריטיס (0.815), מחלת שינוי מינימלי או MCD (עם 0.745), ו-IgA nephropathy (עם 0.191).
המתאם של רמות נוגדנים מסוגIgG כנגד PLA2R עם המאפיינים הקליניים
הרמה הממוצעת של נוגדנים אלה בחולי IMN היא 8.78 מיקרוגרם/מיליליטר במחקרם של Zhang וחב', ואילו באלה עם SMN רמה ממוצעת של 0.99 מיקרוגרם/מיליליטר. לעומת זאת, לא היה הבדל משמעותי בין רמות הנוגדנים האלה בין השלבים II ,I או III של המחלה. דגימות נסיוב וביופסיות כליה היו זמינות מ-63 מתוך 69 משתתפי הניסוי עם IMN, והם נלקחו בעת ובעונה אחת, ממטופלים ללא טיפול בקורטיקו-סטרואידים או בתכשירים מדכאי-חיסון. מבין 63 הנבדקים, ב-47 נמצאו הנוגדנים האמורים הן בנסיוב, כמו גם נמצאה בביופסיות צביעה חיובית כנגד PLA2R. ב-6 מהנבדקים נמצאו נוגדנים בנסיוב, אך הייתה צביעה שלילית של הביופסיות, ו-6 מהמשתתפים נמצאו שליליים לנוגדנים בנסיוב וחיוביים לצביעה בביופסיה, ו-4 נבדקים היו שליליים בשתי הקטגוריות. הרגישויות של מציאת נוגדנים חיוביים בנסיוב או צביעת PLA2R בביופסיות היו 84.13% ו-80.95%, בהתאמה.
הטיטר של נוגדנים ל-PLA2R נמצא בתאום שלילי עם התפקוד הכלייתי (GFR), כאשר מטופלים חיוביים עם רמת נוגדנים מעל 0.91 מיקרוגרם/מיליליטר היו שונים משמעותית מאלה עם ערכים נמוכים של נוגדנים anti-PLA2R, ביחס למפגעים קליניים כגון פרוטאינוריה של 24 שעות (4.56 לעומת 3.03 גרם/24 שעות, p=0.013), ואלבומין בפלזמה (21.45 לעומת 26.21 גרם/ליטר, p=0.025).
בעוד שהגישה הטיפולית באלה עם MN שניוני לתרחישים בולטים מתמקדת באותם תרחישים, הרי שאלה עם IMN בדרך כלל מטופלים עם תכשירים מדכאי חיסון. עם זאת מספר קטן של מטופלים עם מחלת MN משנית לתרחישים ידועים נמצאים גם הם חיוביים לנוגדנים עצמיים כנגד PLA2R, אם כי המשמעות הקלינית של ממצא זה אינה ברורה (Beck ו-Salant ב-J Clin Invest משנת 2014, Gunnarsson וחב' ב-Am J Kidney Dis משנת 2012, Qin וחב' ב-J Am Soc Nephrol משנת 2011, ו-Hofstra וחב' ב-Clin J Am Soc Nephrol משנת 2014). רמות של נוגדנים בצירקולציה כנגד PLA2R מראות מתאם עם פעילות המחלה, כפי שהדבר נמדד עם דרגת הפרוטאינוריה. רמת anti-PLA2R נמצאה בעלת ערך של ניבוי מהלך המחלה ותוצאותיה (Kanigicheria וחב' ב-Kidney Int משנת 2013, ו-Hoxha וחב' ב-J Am Soc Nephrol משנת 2014).
נוגדנים בנסיוב כנגד PLA2R הנמדדים בשיטת TRFIA ופרוגנוזה גרועה בקרב מטופלים עם IMN
כדי להעריך את הקשר בין הטיטר של נוגדן כנגד PLA2R לבין הממצאים הקליניים והתוצאים הקליניים, חולקו משתתפי הניסוי לשתי קבוצות מבחינת טיטר הנוגדנים, כאשר ריכוז נוגדנים של 2.025 מיקרוגרם/מיליליטר שימש כריכוז סף בין רמת נוגדנים גבוהה ונמוכה: קבוצה A (41 נבדקים) עם טיטר נוגדנים גבוה וקבוצה B עם טיטר נוגדנים נמוך. בקבוצה A הייתה רמת אלבומין בנסיוב נמוכה משמעותית מאשר בקבוצה B (3.093 לעומת 3.580 גרם/דציליטר, p=0.048), כתוצאה מתפקוד כליות ירוד יותר (GFR של 77.76 לעומת 107.67 מ"ל/דקה/1.73מ-2, p=0.005), עם פרוטאינוריה גבוהה יותר (2.34 לעומת 1.22 גרם/יום, p=0.031), וריכוז קראטינין בנסיוב גבוה יותר (87.87 לעומת 67.64 מיקרומול/ליטר, p=0.049). מטופלים עם טיטר גבוה של נוגדנים כנגד PLA2R היו בעלי רמיסיה קלינית נמוכה יותר (51.22% לעומת 82.35%, p=0.027).
אחד היתרונות של גילוי נוגדנים כנגד PLA2R הוא בכך שהופעת נוגדנים אלה בנסיוב או היעלמותם, מקדימה את ההופעה או ההתפוגגות של התסמינים הקליניים (Brenchley ב-J Am Soc Nephrol משנת 2015). וכך רמות הנוגדנים הללו פחתו לפני שפחתה דרגת הפרוטאינוריה, כאשר ברוב המטופלים הפכו שליליים בבדיקת הנוגדנים 6–9 חודשים לפני רמיסיה מוחלטת של פרוטאינוריה שהתרחשה רק לאחר 12–24 חודשים. מחקר אירופי על MN הראה קשר בין רמות גבוהות של נוגדנים ל-PLA2R בעת אבחון המחלה, לסיכוי מופחת של רמיסיה ספונטנית (Hofstra וחב' ב-J Am Soc Nephrol משנת 2012). מחקר Manchester הראה שרמות גבוהות של anti-PLA2R היו במתאם עם תוצאים קליניים גרועים 5 שנים מהאבחון (Kanigicheria וחב' ב-Kidney Int משנת 2013). תוך שימוש בפרוטוקול תקני של immunosuppression, נמצא שהכישלון להסב מטופלים לשליליים מבחינת הנוגדנים ל-PLA2R על ידי דיכוי המערכת החיסונית, כרוך בשיעור גבוה של הישנות המחלה (relapse) (על פי Bech וחב' ב-Clin J Am Soc Nephrol משנת 2014). מחקר רב-מוסדי בגרמניה אישר באופן ברור שרמת anti-PLA2R היא גורם סיכון בלתי-תלוי לכך שלא ניתן לקבל רמיסיה בפרוטאינוריה (Hoxha וחב' ב-J Am Soc Nephrol משנת 2014). עיכוב בטיפול להפחתת רמת anti-PLA2R, עלול לסכן פעילות הכליות (Hoxha וחב' ב-Clin J Am Soc Nephrol משנת 2014). ניסויים אלה התבצעו בשיטת ELISA שהתבררה כמדויקת וקלה יותר לביצוע מאשר שיטת Western blotting (על פי Dahnrich וחב' ב-Clin Chim Acta משנת 2013).
החיוניות של מדד נוגדנים כנגד PLA2R להערכת הטיפול המתאים ב-IMN
התרפיה העיקרית ב-30 השנים האחרונות התבססה על דיכוי בלתי-ספציפי של מערכת החיסון, שנקבעה באופן אמפירי בשימוש משולב של ציקלופוספמיד וסטרואידים. כתוצאה מחסר של מדד ביולוגי רלוונטי של אימונו-פתולוגיה, נעשה שימוש ברמיסיה של פרוטאינוריה כמדד של תוצא דומיננטי. למרות שתכשירים לא-ספציפיים אלה יכולים להתברר כיעילים למניעה של התקדמות המחלה ב-60-80% מהמטופלים, טיפול זה גובה תשלום יקר בתחלואה ואף בתמותה כתוצאה מהגברת הסיכון להדבקות בפתוגנים שונים, ממאירות, ואירועים קרדיו-וסקולריים. רוב המטופלים חווים מהלך מחלה מחזורית של רמיסיות ומשברים, בהם מתבקש טיפול של דיכוי של מערכת החיסון, כאשר חלק מהמטופלים מראים עמידות לטיפול האחרון. נתונים אלה מחייבים צורך בטיפול משופר, עם שימוש בתכשירים מכוונים וספציפיים, והתנהלות טיפולית הולמת יותר על בסיס של מדד-ביולוגי רלוונטי.
הנוגדן החד-שבטי rituximab, הספציפי לאנטיגן CD20 על תאי B, הוא התכשיר הראשון המייצג דור חדש של תרפיה מדכאת-חיסון, שהראה תוצאות מבטיחות בניסויים קטנים בכך שהצליח להשרות רמיסיה של תסמונת נפרוטית ב-2/3 של המטופלים עם MN ראשוני או אידיופטי. Ruggenenti וחב' ב-J Am Soc Nephrol משנת 2015, פרסם נתונים חשובים מניסוי עם 101 מטופלים עם MN, בו הוא עשה שימוש ב-rituximab והסתבר שהשפעת תכשיר זה הייתה דומה באלה עם נוגדנים anti-PLA2R כמו גם באלה ללא נוגדנים. מחקרים קודמים הראו שכמעט 50% מהמטופלים עם MN ראשוני-אידיופטי, בהם לא נמצאו נוגדנים ל-PLA2R, ניתן היה לזהות ב-basement membrane הגלומרולרי, משקעי קומפלקסים המכילים PLA2R (על פי Svobodova וחב' ב-Nephrol Dial Transplant משנת 2013). כלומר ייתכן שבמקרים האחרונים, ריבוי של קולטן לפוספוליפאזה A2 במשקעים בממברנת הגלומרולי, גורם לכך שרוב או כל הנוגדנים לקולטן זה נספחים אליו, ולכן אלה נגרעים מהפלזמה.
במטופלים עם רמות נמוכות של נוגדנים כנגד PLA2R בבסיס הטיפול, היעלמות מוחלטת של נוגדנים אלה לאחר 6 חודשים של טיפול ב-rituximab, מנבאת באופן חזק רמיסיה. לעומת זאת, הופעה מחודשת של הנוגדנים בצירקולציה, מצביעה על relapse צפוי. הקשר הגנטי בין PLA2R ו-HLA DQA1 ל-MN אידיופטי מאוד חזק (Stanescu וחב' ב-N Eng J Med משנת 2011). קשר זה הוכח במטופלים סיניים (Lv וחב' ב-J Am Soc Nephrol משנת 2013), וגם במטופלים בארצות הברית (Saeed וחב' ב-Genes Immun משנת 2014), ושני מחקרים אלה מראים קשר חזק בין הסטאטוס של anti-PLA2R לבין SNPs או single-nucleotide polymorphisms בגן האמור.
מגבלות השיטה
בדיקה זו אינה יכולה לשמש בדיקה יחידנית (stand-alone test) אלא כבדיקת עזר למידע קליני נוסף. דהיינו, בדיקה זו כשלעצמה אינה יכולה לשמש כשלעצמה בהבדלה בין (PMNprimary membranous nephropathy) הידועה גם כ-IMN (idiopathic membranous nephropathy) לבין secondary membranous nephropathy. היעדר בצירקולציה של נוגדנים כנגד PLA2R, אינו שולל אבחנה של IMN.
הוראות לביצוע הבדיקה
אין צורך בהכנות מוקדמות כצום. הבדיקה מתבצעת בנסיוב, ולכן יש לקלוט דם למבחנה כימית (פקק אדום או צהוב) או במבחנת ג'ל. הדגימה יציבה בטמפרטורת החדר משך 14 שעות, בהקפאה ובקירור שהיא הצורה המועדפת) למשך 14 יום. יש לפסול דגימות נסיוב מאוד המוליטיות, אך ניתן לקבל דגימות עם המוליזה קלה. דגימות ליפמיות מאוד גם כן קבילות.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק