נוגדנים כנגד אנטמבה היסטוליטיקה - Anti entamoeba histolytica antibodies
הופניתם מהדף נוגדנים כנגד Entamoeba histolytica לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| נוגדנים כנגד אנטמבה היסטוליטיקה | |
|---|---|
| Anti entamoeba histolytica antibodies | |
| מעבדה | כימיה בדם, מיקרוביולוגיה בדם |
| תחום | אבחון של הדבקת אמבה היסטוליטיקה |
| טווח ערכים תקין | בדיקות סרולוגיות בהן טיטר הנוגדנים כנגד E.histolytica נמוך מ-1:2, מצביעות על אי-הדבקה באמבות; כאשר טיטר הנוגדנים גבוה מ-1:128 מדובר בהדבקה פעילה נוכחית או הדבקה לאחרונה; טיטר נוגדנים בין 1:256 לבין 1:2,048 מצביע על הדבקה נוכחית פעילה של אמביאזיס. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
עזר באבחון של אמביאזיס חודרני חוץ-מעי.
רקע
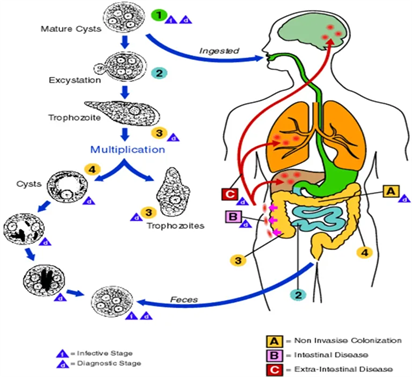
ההדבקה מתרחשת על ידי בליעת ציסטות במזון או במים נגועים בחומר צואתי כאשר אקס-ציסטציה מתרחשת במעי הגס. לאחר האקס-ציסטציה, טרופוזואיטים נצמדים לדופן המעי ומפרישים אנזימים חוץ-תאיים המאפשרים חדירה דרך רירית המעי ומתפשטים לאיברים אחרים כגון הכבד והריאות בהם מתפתחות מורסות. אמביאזיס (או דיזנטריה אמבית) יכולה לגרום לצואה דמית המלווה על ידי חום ותשישות. תאי דם לבנים ואדומים מופיעים בצואה, מורסות בכבד יכולות להתפתח מספר שבועות או חודשים לאחר הופעת כבד מוגדל וחום. בדיקה סרולוגית יעילה במיוחד לאבחון מחלה חודרנית של הטפיל. אין לבצע בדיקה סרולוגית לזיהוי או אבחון של דיזנטריה אמבית בגלל הרגישות הנמוכה של מחלה חריפה אך לא חודרנית.
המין Entamoeba מכיל זנים רבים, אשר שישה מתוכם (Entamoeba histolytica,,Entamoeba dispar Entamoeba mosshkovskii, Entamoeba polecki, Entamoeba hartmanni ו-Entamoeba coli), מופיעים במעי האדם ונחשבים לסיבה הטפילית העיקרית למוות באדם ברחבי העולם. גישות חדשות לזיהוי של E. histolytica מבוססות על הזיהוי של אנטיגן ספציפי של זן זה ועל ה-DNA שלו בצואה ובדגימות ביולוגיות אחרות. מספר טסטים מולקולריים אבחוניים, הכוללים real-time PCR וטסטים קונבנציונליים פותחו לזיהוי ולהבדלה בין E. histolytica, E. dispar ו־E. moshkovskii בדגימות הקליניות. מבין ששת הזנים שהוזכרו, רק E. histolytica גורם לתופעות פתולוגיות באדם, בעוד שהזנים האחרים נחשבים לא פתולוגיים (Garcia ו-Bruckner ב-ASM Press Washington משנת 1997). אף על פי שהתגלו E. dispar ו־E. moshkovskii במטופלים עם תסמינים גסטרו-אינטסטינליים (Fotedar וחב' ב-Australian Journal of Clinical Microbiology משנת 2007), אין עדיין ראייה מוחלטת של קשר סיבתי בין הנוכחות של שני זנים אלה לבין התסמינים של הפונדקאי.
E. Histolytica הוא הגורם הסיבתי לאמביאזיס ונחשב בעולם כגורם הטפילי המוביל לתמותה באדם (Haque וחב' ב־N Eng J Med משנת 2003). המאפיינים הקליניים של אמביאזיס נעים בין התיישבות א-תסמינית עד לדיזנטריה אמבית וחודרנות של הטפיל מחוץ למעיים הבאה לביטוי לרוב במורסות בכבד. כ-50 מיליון אנשים לוקים במחלה חודרנית, המסתכמת ב-100,000 מקרי מוות בשנה בעולם כולו (Haque ו-Petri ב־Arch Med Res משנת 2006). אף על פי שלטפיל יש פיזור גלובלי, שכיחות גבוהה של למעלה מ-10% מהאוכלוסייה דווחה במספר ארצות מתפתחות (Stanley ב-Lancet משנת 2003). מחלה שלשולית הנגרמת מ־E. histolytica דווחה כבעלת השפעה שלילית על גדילת ילדים (Mondal וחב' ב־Trop Med Hyg משנת 2006). כיוון שהאדם מצטייר כפונדקאי היחיד, תוכנית הכחדה מתאימה הייתה מסוגלת להכחיד את תופעת האמביאזיס. הטפיל Entamoeba histolytica תואר לראשונה על ידי Fedor Lösch בשנת 1875 בסט פטרסבורג, בתארו בפרוטרוט אמביאזיס אינטסטינלי, והמושג E. histolytica נטבע לראשונה על ידי Fritz Schaudinn בשנת 1903 (Pinilla וחב' ב־Rev Méd Chile משנת 2008). בנוסף לדיזנטריה נגרמות כתוצאה מהטפיל מחלות חודרניות אחרות כגון מורסות כבד, הדבקה של מערכת הנשימה, ואמביאזיס מוחי וכזה של מערכת השתן/רביה.
אמביאזיס חוץ-מעי
ההתבטאות השכיחה ביותר של תרחיש זה היא הופעת מורסות בכבד. בניגוד למצב במאה ה-20, טיפול קליני וזיהוי מהיר הפחיתו את התמותה ל-1-3% מהמקרים (Shandera וחב' ב-South Med J משנת 1998, ו-Boonyapisit וחב' ב-J Med assoc Thailand משנת 1993). הופעת התרחיש בכבד מתרחשת כאשר טרופוזואיטים חודרניים מגיעים אלין דרך וריד השער, מה שגורם להופעת המורסות בעיקר באונת הכבד הימנית (Rustgi ו-Richter ב-North Am Med Clin משנת 1989). מטופלים יכולים להיות מאובחנים עם מורסות בכבד חודשים עד שנים לאחר ביקור באזורים אנדמיים (Barnes וחב' ב-Medicine משנת 1987). שיעול עלול להופיע, כמו גם אוושות בבסיס הריאה הימנית, אך צהבת אינה רגילה. התסמינים בדרך כלל חריפים ונמשכים פחות מ-10 ימים, אך עלולים להיות גם כרוניים, כולל אנורקסיה ואיבוד משקל. לויקוציטוזיס ללא אאוזינופיליה, אנמיה קלה, רמות מוגברות של alkaline phosphatase ושקיעת דם מהירה, הם ממצאי מעבדה שכיחים. הסיבוך החמור ביותר של מורסות כבד הוא קרע בעיקר בפריקרדיום, והדבקת-על בקטריאלית. קרע בצדר (pleura) יחסית שכיח אך יש לו פרוגנוזה טובה. באבחון מוקדם של מורסות כבד התמותה מתרחיש לא מורכב היא פחות מ-1%. סיבוכים מאמביאזיס חוץ-מעי כוללים אמביאזיס פלאורו-פולמונרית וקרע בסרעפת, מורסות מוחיות, ואמביאזיס גניטואורינרית. דווח על אבחון של אנצפליטיס מ-E.histolytica בשימוש ב-PCR. אבחון של מורסות כבד מקבל אישור בבדיקה סרולוגית חיובית, שהיא בעלת רגישות גבוהה (מעל 94%), ומאוד ספציפית (מעל 95%). בדיקות אולטרה-סאונד בטני או CT אינן משפרות את הספציפיות של הבדיקה למורסות כבד. מחקר מראה שברוב המקרים של מורסות כבד המורסות מתפוגגות מעצמן, אם כי ב-7.1% מהמקרים מתגלים נגעים שנותרו (Blessmann וחב' ב-Trop med Int Health משנת 2006). השימוש המוצלח לגילוי DNA של E.histolytica במטופלים עם מורסות כבד הוא בעל רגישות מרבית של 100% (Tachibana וחב' ב-Int J Parasitol משנת 1992, Zaman וחב' ב-Parasitol Res משנת 2000, ו-Zengzhu וחב' ב-J Clin Microbiol משנת 1999).
באשר ל-E.moshkovskii, אין שוני מורפולוגי בינו לבין E.histolytica או E.dispar. זן זה התגלה לראשונה בביוב של מוסקבה בשנת 1941 (Tshalaia ב-Med Parazit משנת 1941), ולאחר מכן דווח על גילויו במדינות נוספות (Segalia וחב' ב-Ann Parasitol Hum Comp משנת 1983, ו-Clark ו-Diamond ב-Mol Biochem Parasitol משנת 1991). E.moshkovskii נחשב בתחילה כזן סביבתי חופשי, אך בשנת 1961 זן זהה בודד ב-Loredo טקסס, שגרם לשלשולים, איבוד משקל וכאבים אפיגסטריים (Dreyer ב-Texas Rep Biol Med משנת 1961), זן שגדל בטמפרטורת החדר, הוא אוסמו-טולרנטי ואינו רגיש ל-emetine, כאשר בתכונות אלו הוא שונה מזני histolytica ו-dispar (Clark ו-Daimond ב-J Eukaryot Microbiol Rev משנת 1997). דיווחים מסרו ש-E.moshkovskii בודד מצואת אדם (Haque וחב' ב־Parasitol Int משנת 1998, ו-Ali וחב' ב-Bangladesh Emerg Infect Dis משנת 2003). דיווחים על מציאת E.moshkovskii בדגימות אדם הגיעו גם מצפון אמריקה, איטליה, דרום אפריקה, הודו, אירן וטורקיה (Solaymani-Mohammadi וחב' ב-J Clin Microbiol משנת 2006).
האפידמיולוגיה של שלושת הזנים האמורים עדיין לא מבוססת, אך E.dispar נראה שכיח פי-10 יותר מאשר E.histolytica, כאשר רובם של 500 מיליון המודבקים עם E.histolytica מודבקים גם עם E.dispar (Huston וחב' ב-Curr Infect Dis Rep משנת 1999). רוב התחלואה והתמותה מאמביאזיס מתרחשות באזורים מתפתחים של מרכז ודרום-אמריקה, אפריקה ותת היבשת של הודו (Walsh ב-Rev Infect Dis משנת 1986). בבנגלדש, מקום בו מחלות שלשולים הן הסיבה העיקרית לתמותה בקרב ילדים, בערך 50% מהילדים הם בעלי ראייה סרולוגית לחשיפה ל-E.histolytica מתחת לגיל 5 שנים (Haque וחב' ב־Am J Trop Med Hyg משנת 1999). בארצות מתפתחות, קבוצות אנשים בסיכון גבוה הם מהגרים מאזורים אנדמיים והומוסקסואלים (Nozaki וחב' ב-Trans Soc Trop Med Hyg משנת 1989, Ohnishi וחב' ב-Intern Med משנת 1994, ההערכה היא ש-20-30% מההומוסקסואלים מודבקים עם E.dispar בארצות המערב המורגלות ביחסי מין אורליים (Allason-Jones וחב' ב-N Eng J Med משנת 1986) אך גם בטאיוואן ובקוריאה (Oh וחב' ב-AIDS משנת 2000), ובאוסטרליה ((Solaymani-Mohammadi וחב' ב-Med J Austral משנת 2007). העובדה שאין אפשרות מורפולוגית להבדיל בין שלושת הזנים האמורים, הביאה את WHO להמליץ על פיתוח ויישום של שיטות משופרות לאבחון הדבקה ב-E.histolytica.
מעבר א-תסמיני של ציסטות ב-15% מהאנשים עם הדבקה תסמינית קלה או א-תסמינית, הוא הביטוי השכיח ביותר של E.histolytica. אנשים יכולים להתפנות מהטפיל ללא כל תסמינים, הציסטות מתגלות בצואה, וטרופוזואיטים המתגלים לעיתים נדירות, אינם כוללים אריתרוציטים שנבלעו על ידם. נשאים א-תסמיניים של E.histolytica יכולים להשרות יצירת נוגדנים כנגדם גם בהיעדר מחלה חודרנית (Gathiram ו-Jackson ב-S African Med J משנת 1987, ו-Ravdin וחב' ב-J Infect Dis משנת 1990). אי טיפול מתאים עלול לגרום להופעת דיזנטריה (Blessmann וחב' ב-Am J Trop Med Hyg משנת 2002, ו-Haque וחב' ב-J Infect Dis משנת 2001).
דיזנטריה או קוליטיס אמבי
לאחר מעקב של שנה, 4 עד 10% מהמטופלים הא-תסמיניים עם E.histolytica פיתחו קוליטיס עם תסמינים כגון כאבי בטן, רגישות בבטן, או שלשולים מימיים דמיים או מוקוטיים, או מחלה חוץ-מעית. שמונים אחוז מהמודבקים מתלוננים על כאבי בטן ממוקמים, אך חלקם לוקים רק בשלשולים זמניים העלולים להתחלף לעצירות. מיקרוסקופית, טרופוזואיטים מתגלים בקלות ברקמה התת-רירית או בדגימות הצואה על ידי צביעה סטנדרטית. כיוון ש-E.histolytica חודרת לרירית המעי, דגימות הצואה חיוביות כמעט תמיד בבדיקת דם סמוי. בשלב המחלה החריף, גבישי Charcot-Leyden ודם בצואה הם הממצא השולט, בנוסף לאריתרוציטים, גם מקרופאגים ותאים פולי-מורפו-נוקלאריים יכולים להתגלות במיקרוסקופיה בדיזנטריה אמבית. חום גבוה הוא בלתי רגיל, ומופיע בפחות מ-40% מהמטופלים (Adams ו-McLeod ב-Medicine משנת 1977). לעיתים, מודבקים מפתחים קוליטיס אמבי פולמיננטי, עם דם רב בצואה, חום, לויקוציטוזיס בולטת, וכאבי בטן נרחבים לרוב עם סימנים פריטונאליים ומעורבות ניכרת של המעי הגס (Takahashi וחב' ב-Dis Colon Rectum משנת 1997).
Entamoeba dispar
בשנת 1925 יצא Brumpt עם תיאוריה לפיה ההבדל בין ההדבקות השונות הא-תסמיניות האמביות לבין אלו עם מחלה אמבית, יכול להיות כרוך בהבדל בין E. histolytica המסוגל לגרום למחלה חודרנית לבין E. dispar שלעולם לא גורם למחלה. בתחילה הערכה זו לא זכתה לתשומת לב, אך ראיות לאמיתותה החלו להצטבר. בשנת 1993, התקבלה הראייה ששני זנים אלה קרובים זה לזה באנליזות גנטיות, אימונולוגיות וביוכימיות (Stauffer ו-Ravdin ב-Curr Opin Infect משנת 2003, ו-Tanyuksel וחב' ב־Clin Microbiol Rev משנת 2003). אף על פי ש-E. dispar נחשב לא-פתוגני היו מספר דיווחם על תסמיני מעיים באנשים שנדבקו עם זן זה (Jetter וחב' ב־Arch Med Res משנת 1997). במחקר מהודו נבדקו 68 דגימות צואה בהם הודגמו זני Entamoeba במיקרוסקופיה תוך שימוש ב-PCR. ב-11 מהדגימות בהן נמצאו זני E.dispar ו-E.moshkovskii, המטופלים חשו אי-נוחות קלה במעיים (Parija ו-Khairnar ב-J Health Popul Nutr משנת 2005). E.dispar יכול לגרום למפגעים מקומיים משתנים במעי חיות (Chadee וחב' ב-Am J Trop Med Hyg משנת 1985, ו-Espinosa-Cantellano וחב' ב-Arch Med Res משנת 1997), ומסוגל להרוס תאים אפיתליאליים in vitro ( Espinosa-Cantellano וחב' ב-J Eukaryot Microbiol משנת 1998). ישנן גם ראיות לכך שלאחר הדבקה עם E.dispar שינויים פתולוגיים עלולים להתרחש גם במספר אנשים, עם זאת הפוסטולטים של Koch לא באו לביטוי במחקרים גדולים ומבוקרים שנועדו לאשש את הפוטנציאל הפתוגני האמיתי של זן זה.
הפרוגנוזה של אמביאזיס
הדבקות לא מסובכות וטיפול מוקדם הם בעלי שיעור תמותה הנמוך מ-1%. גורמי סיכון להדבקות מסובכות כוללים גיל צעיר, היריון, טיפול בקורטיקוסטרואידים, ממאירות, תזונה לקויה ואלכוהוליזם. לעומת זאת, קוליטיס אמביאלי פולמיננטי כרוך בתמותה של 40% (Kantor וחב' ב-Can J Gastroenterol Hepatol משנת 2018). מורסות כבד אמביאליות עם טיפול רפואי מזורז יעילות ביותר, עם שיעורי תמותה של 1-3%. אמביאזיס פלאורו-פולמונרי כרוך בתמותה של עד 16%, ומעורבות לבבית היא בעלת שיעורי תמותה של עד 30% (Zakaria וחב' ב-Pulmonol משנת 2016). מצבים חוץ-מעיים הנגרמים מ-E.histolytica כוללים: מורסות כבד, מחלה פלאורו-פולמונרית, מורסות מוחיות, פריטוניטיס, פריקרדיטיס, מחלה גניטו-אורינרית, אמביאזיס עורית סב-אנלית, פקקת של וריד הכבד, פקקת של ה-inferior vena cava, אפנדיציטיס, ואמבומה (Martin וחב' ב-Am J Trop Med Hyg משנת 2017, ו-Ito וחב' ב-Int J Surg Case Rep משנת 2014).
מאפיינים של טרופוזואטים וציסטות של E.histolytica, E.dispar ושל E.moshkovskii
הגודל, הגרעין, והתנועתיות של טרופוזואיטים: 15-20 מיקרון, גרעין בודד שקשה לזהות בדגימות לא צבועות, והן נעות באופן פעיל בעזרת פסאודופודיות דמויות אצבע.
הגודל, והגרעין של ציסטות: 10-15 מיקרון, בציסטות בשלות 4 גרעינים שקשה לזהות בדגימות רטובות.
מאפיינים נוספים של טרופוזואיטים: כרומטין היקפי, וקריוזום קטן ודחוס מרכזי, אך יכול להיות גם אקסצנטרי. ציטופלזמה (צבועה): עדינה למראה, גרנולרית, ועלולה להכיל חיידקים, וכן אריתרוציטים (במקרי E.histolytica אך גם במספר מקרים של E.dispar.
לגבי ציסטות: הכרומטין צבוע היקפית, עם גרנולות עדינות היקפיות, המפוזרות באופן אחיד. הקריוזום הצבוע קטן ודחוס, ברובו מרכזי, אך לעיתים גם אקסצנטרי. הציטופלזמה הצבועה יכולה להכיל גופים כרומטואידים לרוב מוארכים עם קצוות מעוגלים וחלקים, הכרומטין יכול להיות יכול להיות דיפוזי, אך גם חסר בציסטות בשלות. כרומטין יכול להיות מקובץ בציסטות צעירות.
כאמור, ההדבקה עלולה להתרחש כאשר צורכים מזון מזוהם עם הפרשה צואתית או מים מזוהמים שמגיעים לדרכי העיכול. זבוב הבית עלול לסייע להדבקה בהיותו דוגר בצואה, מטיל ביצים ונודד למזון לא מוגן. הדבקה נוספת היא בקיום יחסי מין אורליים או אנאליים. במעיים, הטרופוזואיטים בעלי כושר התנועה משלימים את מחזור חיי הטפיל על ידי הפיכתם מחדש לציסטות שתופרשנה בצואה.
האנדופלזמה והאקטופלזמה של E.histolytica מכילות פסאודופודיות שקופות המיועדות לאפשר תנועה, במקרים בהם הטפיל בולע חיידק, נשלפות מספר פסאודופודיות מהציטופלזמה, ללכוד את החיידק. אנטאמבות הן בעלות גרעין שמרכזו והיקפו כהים בתוצאה מה-DND הממוקד בהם, המחולק ל-DNA היקפי על ממברנת התא, ול-DNA מרכזי שהוא הקריוזום. ניתן כמו כן להבחין בגופים כרומטידים של RNA מגובש שמוצאים בציסטה הצעירה, אך נעלמים בציסטה הבשלה המכילה 4 גרעינים. הטרופוזואיט שהוא השלב הפעיל של האמבה, מתרבה וחודר לרקמות, ואז הוא מסוגל להגיע לממדים גדולים של עד 50 מיקרון, כאשר ברוב המקרים קוטרו בין 35–40 מיקרון. הציסטה לעומת זאת, היא השלב הסטטי של האנטאמבה, שגודלה עד 20 מיקרון ובה נוצר RNA גבישי. הציסטה עמידה לתנאים המאתגרים החיצוניים, והיא אף השלב המדביק, זאת בניגוד לטרופוזואיט שאינו מדביק, ואינו מסוגל לעמוד בתנאים החיצוניים כגון הקיבה או בחלקים העליונים של מערכת העיכול, אלא רק במעי הגס. האנטאמבה פוגעת בתאי המעי, ובעיקר בולעת תאי דם אדומים, ועלולה לגרום לקוליטיס. בנוסף, עלול להיווצר גידול שפיר במעי הגס הידוע כאמבומה, שהוא אזור עשיר בגרנולומות המתהווה סביב אזור דלקתי, שעלול לחסום את חלל המעי הגס. בנוסף לצואה מימית בצורת שלשולים דמיים, יש עלייה בתכיפות היציאות (עד 6 יציאות ביום), תרחישים של יצירת מורסות בכבד, וכיבים במעי. כאשר יש התאחות של מספר כיבים קטנים, נוצרים כיבים גדולים העלולים לגרום לנמק (necrosis) שהוא הגורם העיקרי לתמותה מסיבה של אמביאזיס.
מיקרוסקופיה של צואה היא אמנם שיטה זולה ופשוטה לביצוע, אך חסרונותיה ברגישותה הנמוכה מ-60%, וחוסר היכולת להבדיל בין זני אמבה שונים, ובתלות שלה במיומנות של טכנאי המעבדה (Shirley וחב' ב-Open Forum Infect Dis משנת 2018, ו-Saidin וחב' ב-Eur J Clin Microbiol Infect Dis משנת 2009).
גילוי אנטיגן בצואה: מדובר בשיטה פשוטה ומהירה עם היתרון שהיא מאפשרת אבחנה בין E.histolytica לבין E.dispar. ישנן מספר גדול של ערכות מסחריות לזיהוי אנטיגנים תוך שימוש בשיטות ELISA או RIA או בשיטת immunofluorescence, שניתן להגיע בעזרתן עד רגישות של 88% (Spadafora וחב' ב-PLoS Negl Trop Disl משנת 2016).
שיטה סרולוגית היא בעלת רגישות וספציפיות גבוהות, והיא מהירה בביצוע, אך אינה מסייעת באבחנה בין הדבקות עכשוויות לבין קודמות. נוגדנים אינם ניתנים לגילוי בהדבקה פעילה לפחות 7 ימים מתחילתה, ויישארו גבוהים למשך שנים. ניסויים מולקולריים בצואה: נחשבים כסטנדרד הזהב עם רגישות גבוהה של 92%, וספציפיות שבין 89-100%. השיטה זמינה יותר לשימוש, אך היא יקרה יותר, דורשת ציוד מתאים ומחייבת מיומנות של טכנאי המעבדה.
קולונוסקופיה ובחינה היסטולוגית: אינה משמשת לאבחון סטנדרטי, אלא לממצאים מאפיינים של כיבים אמביאליים, או של שחיקת מעי תוך זיהוי של טרופוזואיטים או של ציסטות בדגימות שהוצאו בביופסיה. אבחון דיפרנציאלי של אמביאזיס במעיים מהדבקה עם E.histolytica כוללת: פתוגנים חיידקיים, כגון shigella, E.coli, סלמונלה, קמפילובקטר, ו-C.difficile. כן כולל אבחון זה אבחנה בין אמביאזיס לבין מחלה דלקתית או איסכמית של המעי מסיבה אחרת. האבחון המבדיל של אמביאזיס מסיבה של E.histolytica חוץ-מעית כולל מורסות כבד פיוגניות, ממאירות ומחלה אכינוקוקית.
כיוון שטרופוזואיטים של אנטאמבה מתפוררים במהירות בצואה שלא עברה פיקסציה (Proctor ב-Clin Lab Med משנת 1991), יש לשמר את הדגימה עם fixative המונע את השינוי במורפולוגיה של הטפיל, ומאפשר משטחים לצורך זיהוי. תכשירי פיקסציה אלה כוללים נוזל Schaudin, וכן ,merthiolate iodine-formalin 5-10% פורמלין, ו-sodium acetate-acetic acid-formalin (SAF). תכשירי פיקסציה לצורך משטחים לצביעה קבועה כוללים trichrome ,iron hematoxylin תכשיר Ziehl-Neelsen, פולי-ויניל אלכוהול מכיל כספית וכן SAF. בחינה של ביצים או של אמבות ב-3 דגימות צואה במהלך 10 ימים מומלצת, כיוון שאורגניזם זה מופרש לצואה באופן לא רציף, מה שמשפר את שיעורי הזיהוי ב-85-95%. הנוכחות של אריתרוציטים בציטופלזמה של הטפיל, נחשבת עדיין אבחונית ל-E.histolytica במטופלים עם דיזנטריה, ויכולה להבדיל בין E.histolytica לבין E.dispar. עם זאת, טרופוזואיטים המכילים אריתרוציטים מעוכלים אינם נמצאים ברוב המטופלים (Strachan וחב' ב-Lancet משנת 1988). עם זאת, היו דיווחים שגם ב-E.dispar טרופוזואיטים מכילים אריתרוציטים מעוכלים (Haque וחב' ב-J Clin Microbiol משנת 1995). גם מחקרים in vitro הראו ש-E.dispar עשוי לעכל אריתרוציטים (Trissl וב' ב-J Exp Med משנת 1978).
מחקר שנמשך 3 שנים שנערך בבנגלדש הראה ש-2.2% ממקרי דיזנטריה נגרמו על ידי E.histolytica בילדים בגיל שלפני בית הספר (Aguirre וחב ב-Arch Med Res משנת 1977). באזורים כפריים במקסיקו הבדיקה הסרולוגית הראתה שיעורי הדבקה עד 42% לגבי E.histolytica (Ali וחב' ב-Emerg Infect Dis משנת 2003). במדינות מתקדמות כארצות הברית הדבקות באמביאזיס נדירות ומסתכמות ב-5 מקרי מוות בשנה, בעיקר במהגרים ממדינות אנדמיות. קוליטיס אמביאלי מופיע בגברים ובנשים במידה שווה. גורמים הכרוכים בסיכון מוגבר להדבקות מסובכות ולתמותה, הם הריון, טיפול בקורטיקוסטרואידים, ממאירות, תזונה לקויה ואלכוהוליזם.
האינטרפרטציה של הבדיקה
כאשר תוצאות הבדיקה שליליות, יש לחזור עליה 2-3 שבועות לאחר הופעת חשד קליני. תוצאות לא ברורות מחייבות חזרה על הבדיקה 10–14 יום לאחר הופעת תסמינים קליניים. כאשר תוצאות הבדיקה חיוביות הן מעידות על הדבקה נוכחית או בעבר, עם E.histolytica. ההמלצה היא לקבל זיהוי ישיר של הטפיל בצואה או בדימות גוף אחרות לזיהוי אמביאזיס חריפה. יש לקחת בחשבון אפשרות של הדבקה בעבר שתיתן אף היא תוצאות בדיקה חיוביות. בדיקה סרולוגית משמשת כעזר באבחון, אך אינה אמורה לשמש כבדיקה אבחונית כשלעצמה (Bruckner ב-Clin Microbiol Rev משנת 1992).
מגהקולון או אמבומה (שהיא דלקת אמבית של הכרכשת) (Adams וחב' ב-Medicine משנת 1977), אמביאזיס עורית (Mhalanga וחב' ב-Am J Trop Med Hyg משנת 1992), ופיסטולה רקטו-וגינלית (Lysy וחב' ב-Am J Gastroenterol משנת 1991) עלולים להופיע כסיבוכים של אמביאזיס של המעי.
גידול אנטאמבה בתרבית
טכניקות תרבית לבידוד זני אנטאמבה זמינות למעלה מ-100 שנה, נוזלי תרבית קסניים (xenic) מוגדרים כגידול הטפיל בנוכחות צִמְחִיָּה לא מוגדרת שהוכנסה לראשונה על ידי Boeck ו-Drbohlav בשנת 1925 במדיום ביצה, ומודיפיקציה של מדיום זה (Locke-egg) קיימת עד היום. נוזלי תרבית חד-פזיים שפותחו ל-E.histolytica הם נוזל אינפוזיה מחלמון ביצה (Balamuth ב-Am J Clin Pathol משנת 1946), המדיום של Jones ב-Ann Trop Med Parasitol משנת 1946, ו-TYSGM-9 (Diamond ב-J Parasitol משנת 1982), והמדיום של Robinson ב-Trans R Soc Trop Med Hyg משנת 1968. תרבית axenic פירושה גידול הטפיל בהיעדר תאים העוברים מטבוליזם. נוזל גידול אקסני הוכן לראשונה על ידי Diamond בשנת 1961. המדיום החד-פאזי TP-S-1 פותח והיה בשימוש נרחב לגידול E.histolytica במעבדות מחקר (Diamond ב-J Parasitol משנת 1968). נוזלי המדיום TYI-S-33 (Diamond ב-Trans R Soc Trop Med Hyg משנת 1978), ו־YI-S(Diamond ב-J Eukaryot Microbiol משנת 1995), הם נוזלי המדיום השכיחים ביותר לגידול אקסני של E.histolytica. תרבות של זן זה יכול להיעשות מדגימות צואה, מדגימות ביופסיה רקטלית, או מהפרשות של מורסות כבד. ההצלחה של תרבות של E.histolytica היא בין 50-70% במעבדות רפרנס. כיוון שתרבות של זן זה מדגימות קליניות כגון צואה או מורסות כבד, נותן שיעור משמעותי של false negatives, הוא אינו מתבצע במעבדות שגרה קליניות.
הזן E.dispar יכול לגדול בתרבית קסנית, אך הוא אינו גדל טוב בנוזלי גידול חד-קסניים (Clark ב־J Eukaryot Microbiol משנת 1995, ו-Kobayashi וחב' באותו כתב עת משנת 1998). נראה שמדיום YI-S אינו מתאים לגידול של E.dispar. לזן E.moshkovskii מדיום הגידול המקובל הוא TTY-SB חד-פאזי, וכן TP-S-1-GM חד-פאזי (Diamond ו-Bartgis ב-Exp Parasitol משנת 1970). נוזל מדיום אחר לתרבות של E.moshkovskii הוא המדיום האקסני TYI-S-33 בתוספת 10% נסיוב בקר ב-24 מעלות צלזיוס, או הנוזל הקסני TYSGM-9 בתוספת 5% נסיוב בקר (Diamond וחב' ב-Trans R Soc Trop Med Hyg משנת 1978).
שיטת מיצוי DNA
השיטה הקודמת הייתה מבוססת על תרבות במדיום Robinson של דגימות צואה חיוביות במיקרוסקופיה, ועל מיצוי של DNA מטרופוזואיטים על ידי פנול-כלורופורם (Pinheiro וחב' ב-Am J Trop Med Hyg משנת 2004, ו-Tachibana וחב' ב-Parsitol Int משנת 2000). שיטות מאוחרות יותר כללו מיצוי ישיר של DNA מדגימות צואה חיוביות במיקרוסקופיה (Romero וחב' ב-Arch Med Res משנת 1992).
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק