נוירופתיה מוטורית מולטיפוקאלית - Multifocal motor neuropathy
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| נוירופתיה מוטורית מולטיפוקאלית | ||
|---|---|---|
| Multifocal motor neuropathy | ||
| יוצר הערך | ד"ר אלון אברהם | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – נוירופתיה
נוירופתיה תנועתית רב-מוקדית (Multifocal motor neuropathy) היא מחלה דלקתית אשר מתאפיינת בהתפתחות הדרגתית איטית (או התפתחות בשלבים) של חולשה רחיקנית לא-סימטרית (Asymmetrical distal weakness) בפיזור של עצבים תנועתיים היקפיים, ללא מעורבות סיבים תחושתיים.
החולים הראשונים בנוירופתיה תנועתית רב-מוקדית הוצגו במסגרת הכינוס השנתי של האקדמיה האמריקאית לרפואה אלקטרודיאגנוסטית ב- 1985. החוקרים פארי (Parry) וקלארק (Clark) תיארו שלושה חולים שסבלו מנוירופתיה תנועתית טהורה שפגעה בגפיים העליונות. חולים אלה אובחנו כסובלים ממחלת הנוירון התנועתי (Motor neuron disease), אולם אף אחד מהם לא סבל ממעורבות שרירים בולבריים (Bulbar muscles) או שרירי נשימה. בבדיקה האלקטרופיזיולוגית נצפו בחולים אלו חסמי הולכה קשים בסיבים תנועתיים בלבד, בעוד שמבחני ההולכה התחושתית היו תקינים לחלוטין [1]. ב- 1988, פסטרונק (Pestronk) וחבריו טבעו את המונח Multifocal Motor Neuropathy (MMN) לאבחנה חשובה זו [2].
הערכה קלינית ואלקטרופיזיולוגית שיטתית של קבוצות חולים גדולות אפשרה הבנה טובה יותר של הפתופיזיולוגיה של המחלה ומציאת דרכי טיפול יעילות בה. כיום, על אף ההתקדמות בנושאי אפיון המחלה ואופן הטיפול בה, נותרו מספר שאלות פתוחות, כגון מהי האטיולוגיה של המחלה, מהו הבסיס הביולוגי לחסמי ההולכה, ומהו אופן הטיפול המיטבי במחלה לטווח ארוך [3].
אפידמיולוגיה
נוירופתיה תנועתית רב-מוקדית היא מחלה נדירה ושכיחותה המוערכת היא 2-1 מקרים ל- 100,000.
הגיל הממוצע של החולים במחלה זו הוא 40, כאשר 80% מהחולים מפתחים את התסמינים הראשונים של המחלה בגילאי 50-20. המחלה שכיחה יותר בגברים, ביחס של 1:3 [3].
אטיולוגיה
רק בשלב מאוחר יחסית התגבשה אבחנת נוירופתיה תנועתית רב-מוקדית כהפרעה נפרדת מטרשת אמיוטרופית צידית (ALS ,Amyotrophic Lateral Sclerosis). סיבה אפשרית לכך יכולה להיות כישלון בזיהוי תבנית חולשת השרירים: בנוירופתיה תנועתית רב-מוקדית החולשה הנה בפיזור של עצבים היקפיים נפרדים, בעוד שב- ALS היא בפיזור של מקטעים שדרתיים (Spinal segments). בנוסף, ייתכן כי חסמי ההולכה שנצפו בבדיקה האלקטרודיאגנוסטית בחולי נוירופתיה תנועתית רב-מוקדית יוחסו לגורמים טכניים כגירוי תת-מיטבי של העצבים בנקודות גירוי קריבניות (Proxymal), ונוכחות וריאנטים אנטומיים (Variants) שונים של העצבוב האנטומי [1].
מניחים כי נוירופתיה תנועתית רב-מוקדית הנה מחלה דלקתית, כאשר הן התגובה לטיפול בנוגדנים תוך-ורידיים (IVIG ,Intravenous Immunoglobulin), והן מספר נקודות דמיון לתסמונת גיליאן ברה (Guillain-Barré syndrome) ולווריאנט התנועתי שלה- נוירופתיה אקסונלית-תנועתית חריפה (Acute motor axonal neuropathy), תומכות בהשערה זו. ישנן שתי נקודות דמיון בין נוירופתיה תנועתית רב-מוקדית לנוירופתיה אקסונלית-תנועתית חריפה: הראשונה היא נוכחות נוגדנים כנגד הגליקוליפיד 1GM (glicolipid 1GM), אשר בקרב מספר משמעותי של חולים ניתן למצוא בסרום ביטוי שלו במערכת העצבים ההיקפית, והשנייה היא הימצאות חסמי הולכה ופגיעה אקסונלית המשותפת לשתי המחלות.
הנוגדנים כנגד GM1 קיימים בכמחצית מחולי נוירופתיה תנועתית רב-מוקדית. GM1 הוא גליקוליפיד ממשפחת הגנגליוזידים (Gangliosides), הנמצא בייחוד באזורים פארא-נודליים (Para-nodules) במערכת העצבים ההיקפית. ניתן למצוא נוגדנים כנגד גנגליוזידים במגוון נוירופתיות דלקתיות נוספות, כולל בתסמונת גיליאן ברה. לא ידוע מה הגורם להיווצרות נוגדנים כנגד GM1 בנוירופתיה תנועתית רב-מוקדית. זאת בניגוד לנוירופתיה אקסונלית-תנועתית חריפה, בה זיהום מקדים גורם להיווצרות נוגדנים פתוגנים במנגנון של דמיון מולקולרי [4].
קליניקה
המחלה מתאפיינת בהתפתחות הדרגתית איטית של חולשה רחיקנית לא-סימטרית בפיזור של עצבים היקפיים. בשלבים מאוחרים יותר, בהם ישנה חולשה מפושטת, קשה להבדיל בין דפוס החולשה המתואר לבין חולשה בפיזור של מקטעים שדרתיים, כבמחלות נוירון תנועתי. מנגד, נדיר למצוא דמיון לפולינוירופתיה סימטרית (Symmetrical polyneuropathy), כבמקרים של מונונויריטיס מולטיפלקס (Mononeuritis multiplex) מפושטת [1].
לרוב, המחלה מערבת את הגפיים העליונות, הן בשלב מוקדם יותר והן בצורה קשה יותר. תיתכן חולשה בפיזור קריבני, אך בשכיחות נמוכה יחסית (כ- 10%-5 מהמקרים בלבד) [3].
הביטויים השכיחים ביותר של נוירופתיה תנועתית רב-מוקדית הם צניחת כף יד וחולשה ביכולת הלפיתה. דיווחים מסוימים מצביעים על כך שחולשה ביישור אצבעות היד עם מעורבות לא אחידה של אגדים שונים בתוך העצב מהווה ביטוי שכיח המחשיד למחלה זו [1].
דלדול שרירים מהווה רמז אבחנתי חשוב למחלה זו. במידה וישנו דלדול שרירים, בשלבים ההתחלתיים של המחלה (בהם הפגיעה האקסונלית מזערית) לרוב מדובר בדלדול שרירים קל. בשלבים מאוחרים יותר של המחלה, בהם ישנו נזק אקסונלי משני משמעותי לסיבים התנועתיים, ניתן למצוא דלדול שרירים בולט יותר. בשלב זה, התגובה לטיפול המשפיע על מערכת החיסון (Immunotherapy) פחות טובה. בכמחצית מהחולים קיימים תסמינים נוספים: פסציקולציות (Fasciculations) והתכווצויות שרירים (Muscle cramps), כאשר לעתים ניתן לראות מיוקימיה (Myokymia).
מעצם הגדרתה של המחלה ניתן להסיק כי אין בה תסמינים תחושתיים, אך מיעוט מהחולים מדווח על הפרעות בתחושה- אובדן תחושת רטט תועד בעד 20% מחולי נוירופתיה תנועתית רב-מוקדית. במקרים כאלה ישנה חשיבות רבה להדגמת הולכות תחושתיות תקינות בבדיקה האלקטרודיאגנוסטית.
לרוב ההחזרים הגידיים מופחתים, אך הם יכולים להיות תקינים ואפילו ערים במקרים מסוימים, מה שמקשה על היכולת להבדיל מחלה זו ממחלת הנוירון התנועתי. מעורבות עצבי הגולגולת (Cranial nerves) אינה שכיחה. במידה והיא קיימת, לרוב היא מערבת בעיקר את עצב תת-הלשון (Hypoglossal nerve) וגורמת לדלדול בחצי לשון [3].
החולה האופייני יהיה גבר כבן 40 הסובל מהופעת חולשה ביישור כף רגל ימין ובכפות הידיים, שהתפתחה בהדרגה במשך השנים האחרונות. ממצאי הבדיקה הגופנית בחולה שכזה יהיו דלדול בולט של שרירי כפות הידיים והרגליים, פסציקולציות בזרוע ובאמה מימין, חולשה קשה בכיפוף מרפק ימין, חולשה רחיקנית קשה בכפות הידיים, חולשת יישור כף רגל שמאל וחוסר יכולת מוחלט ליישר את כף רגל ימין. לא ניתן יהיה להפיק החזרים, אך בדיקת התחושה תהיה תקינה על כל מרכיביה. תמונה קלינית זו מכוונת למחלה תנועתית לא-סימטרית מסוג מחלת נוירון תנועתית תחתון (LMN ,Lower Motor Neuron) ללא מעורבות תחושתית. הבדיקה האלקטרודיאגנוסטית בחולה תראה חסמי הולכה תנועתית חלקית ברובם הגדול של העצבים התנועתים בגפיים, בעוד שההולכות התחושתיות יהיו תקינות.
אבחנה
קריטריונים אבחנתיים שנקבעו על ידי אגודות אמריקאיות ואירופאיות למחלה זו, מאפשרים להבדיל בין נוירופתיה תנועתית רב-מוקדית למחלת הנוירון התנועתי ונוירופתיות נוספות, דוגמת נוירופתיה דלקתית דמיאלינטיבית כרונית (CIDP ,Chronic Inflammatory Demyelinating Polyneuropathy) ונוירופתיה דמיאלינטיבית נרכשת רב-מוקדית תחושתית ותנועתית (MADSAM ,Multifocal Acquired Demyelinating Sensory And Motor Neuropathy), המכונה גם תסמונת לואיס-סאמר(Lewis-Sumner syndrome).
|
טבלה 1. קריטריונים אבחנתיים לנוירופתיה תנועתית רב-מוקדית[2] קריטריונים הכרחיים:
קריטריונים תומכים:
קריטריונים שאינם תומכים באבחנה:
|
בדיקות עזר אבחנתיות
בדיקות אלקטרופיזיולוגיות
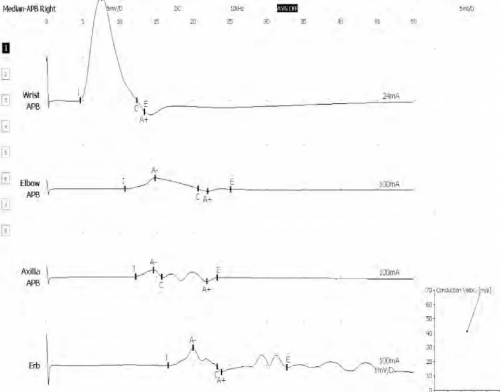
הולכות עצביות: הממצא האופייני ביותר לנוירופתיה תנועתית רב-מוקדית הוא חסמי הולכה תנועתיים באזורים שאינם אופייניים ללכידת עצבים (כתעלה האולנרית או הקרפלית), בשני עצבים או יותר, בנוכחות הולכות תחושתיות תקינות. אבחנת נוירופתיה תנועתית רב-מוקדית ללא נוכחות חסמי הולכה מאתגרת הרבה יותר, ודורשת היכרות יסודית של המיוטומים (Myotomes) והעצבים ההיקפיים השונים, כך שניתן יהיה לאתר את הבסיס האנטומי לחסרים התנועתיים [1].
באופן כללי, חסמי הולכה תנועתיים מוגדרים כירידה במשרעת או בשטח מתחת לעקומת פוטנציאל פעולה שריר מורכב (CMAP ,Compound muscle action potential), בזמן גירוי קריבני, ביחס לגירוי רחיקני. אין הסכמה ביחס לערך הירידה במשרעת או בשטח מתחת לעקומת ה- CMAP, ולרוב מקובל להתייחס לירידה של למעלה מ- 50%.
המחלוקת בנוגע לערך הירידה במשרעת או בשטח שמתחת לעקומת ה- CMAP נובע, בראש וראשונה, מכך שגורמים נוספים עשויים לחקות חסמי הולכה. בפולינוירופתיות דמיאלינטיביות ישנה מהירות הולכה שונה בין סיבי העצב השונים, תופעה הקרויה פיזור בזמן (Temporal dispersion). במצב זה, מופע (Phase) חיובי של פוטנציאל פעולה השייך ליחידה תנועתית אחת, עשוי לחפוף עם מופע שלילי של פוטנציאל פעולה של יחידה תנועתית איטית יותר, ולגרום ל"ביטול מופעי" (Phase cancellation) ולירידה במשרעת. פיזור בזמן מתרחש במחלות דמיאלינטיביות נרכשות של מערכת העצבים ההיקפית, דוגמת CIDP. בנוסף, עצבוב עקיף (Collateral sprouting) המתרחש במחלות דוגמת מחלת הנוירון התנועתי, יכול לגרום ליחידות תנועתיות מרובות-מופע (Polyphasic), ובכך למשרעת נמוכה יותר. לבסוף, מגבלות טכניות, דוגמת גירוי חשמלי שאינו מיטבי באזורים קריבניים (הנגישים פחות לגירוי חשמלי), יכולות אף הן לדמות חסם הולכה [3].
אלקטרומיוגרפיה: MMN היא הפרעה דמילינטיבית בעיקרה, אך תמיד ישנו אובדן של אקסונים מוטוריים המתבטא בנוכחות פעילות ספונטנית, דוגמת פיברילציות וגלים חיוביים חדים, וכן ביחידות מוטוריות גדולות ופוליפזיות בזמן הפעלה רצונית של השריר. אובדן אקסונים מוטוריים מתרחש במידה משמעותית בחולים שאינם מטופלים, אך נראה כי גם בחולים מטופלים היטב ישנו אובדן אקסונים מוטוריים עם הזמן.
בשלבים ראשוניים של המחלה, בשרירים חלשים שטרם עברו אטרופיה ניתן למצוא רק מיעוט פעילות ספונטנית, אך גם גיוס ירוד. בשרירים שבהם התרחשה אטרופיה ניתן למצוא סימני דנרבציה חדה - פעמים רבות ניתן למצוא גם גם פסציקולציות, ובמקרים מסוימים, מיוקימיה. בניגוד למחלת הנוירון המוטורי, בה ניתן למצוא סימני דנרבציה מפושטת אף בשרירים ללא חולשה קלינית, ב-MMN סימני הדנרבציה החדה מוגבלים, לרוב, לשרירים החלשים בלבד[1].
בדיקות מעבדה
הממצא המעבדתי השכיח ביותר הנו נוכחות נוגדנים בסרום מסוג IgM כנגד הגנגליוזיד GM1, הנמצא בטיטרים גבוהים ב-80%-30% מהחולים. הסיבה לערכים שונים בדיווחים שונים נובעת קרוב לוודאי משיטות ELISA שונות במחקרים השונים, וכן להטרוגניות של אוכלוסיות הבקרה .
נוגדנים כנגד GM1 אינם ספציפיים ל-MMN - ניתן למוצאם ב-10%-5% מחולי מחלת הנוירון המוטורי, וכן בנוירופתיות דמילינטיביות נוספות (דוגמת תסמונת גיליאן ברה ו-CIDP), ואף באנשים בריאים.
בשני שליש מהחולים ניתן למצוא ערכי CK גבוהים במקצת, ממצא שאינו ספציפי ואינו עוזר להבדיל בין MMN למחלת נוירון מוטורי או נוירופתיות אחרות. בבדיקת נוזל השדרה ניתן למצוא רמת חלבון מעט גבוהה (עד 80 מ"ג/ד"ל), עם ספירת תאים תקינה[3].
ביופסיית עצב
ביופסיית עצב תחושתי (דוגמת עצב סורלי) אינה תורמת לאבחנת MMN, וצריכה להתבצע רק אם ישנם חסרים תחושתיים משמעותיים או ישנו חשד למחלה אחרת, דוגמת CIDP או וסקוליטיס[3].
MRI
בכמחצית מהחולים ניתן למצוא אות גבוה במקלעת הברכיאלית ברצף T2 או T1 לאחר מתן גדוליניום. ממצא זה אינו ספציפי ולא חושף את הפתופיזיולוגיה בבסיס הנזק, למעט הדגמת בצקת ופגיעה במחסום הדם עצב (Blood-nerve barrier). בעתיד, בדיקת ה-MRI תוכל להוות כלי אלגנטי ולא פולשני להערכת השלמות של סגמנטים עצביים פרוקסימליים[3].
טיפול
אפשרויות הטיפול ב-MMN מוגבלות[2].
הטיפול המוצלח ב-IVIG הווה את אבן הפינה בטיפול במחלה זו ומהווה עד היום את ה-gold standard לטיפול בה[3].
טיפול ב-IVIG הוא הקו הטיפולי הראשון במחלה זו ויעילותו הוכחה במספר מחקרי RCT, כאשר הטיפול מוערך כיעיל ב-86%-70% מהחולים. התועלת הקלינית בטיפול זה לרוב מרשימה, ושיפור הדרגתי בכוח השרירים מתרחש כבר בשבוע הראשון לטיפול. אם לא חל שיפור יש לשקול קיום אבחנה אחרת, אך יש לציין כי חולשת שרירים המלווה בדלדול שלהם, לרוב אינה משתפרת לאחר מתן IVIG.
המינון המקובל בתחילת הטיפול במחלה זו הנו 2 ג'/ק"ג המחולקים ל-5-2 ימים רצופים. בשל נטייה לירידה מהירה ביעילות הטיפול לאחר מספר שבועות, בהמשך יש להתאים את מינון הטיפול באופן פרטני במטרה למקסם את היחס בין העלות לתועלת.
בניגוד ל-CIDP, MMN אינה מגיבה לטיפול בסטרואידים או פלסמפרזיס - יתר על כן, הטיפולים הללו אף עלולים להחמיר את הסימפטומים בכ-20% מהמקרים.
מגוון טיפולים אימונומודולטוריים ואימונוסופרסיביים אחרים, כגון אזטיופרין, מטוטרקסט, ציקלופוספמיד ואחרים, לא הראו ממצאים חד משמעיים[3].
פרוגנוזה
טיפול ב-IVIG יכול לשפר את כוח השריר ולעכב את התפתחות המחלה, אך עדיין חסרים טיפולים יעילים לטווח הארוך, או טיפולים שיביאו להחלמה מהמחלה.
דגלים אדומים
ביבליוגרפיה
קישורים חיצוניים
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 Muley SA, Parry GJ, J. Clin. Neurosci, 2012: 19,1201
- ↑ 2.0 2.1 2.2 European Federation of Neurological Societies/Peripheral Nerve Society guideline on management of multifocal motor neuropathy. Report of a joint task force of the European Federation of Neurological Societies and the Peripheral Nerve Society-first revision. JPNS. 2010, 15,:295
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 3.6 3.7 3.8 3.9 Meuth SG, Kleinschnitz C, Europ Neurology, 2010:63,193
- ↑ Vlam L, van den Berg LH, Cats EA et al., J. Clin. Immunol, 2013 Jan:33 Suppl 1:38
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר אלון אברהם, המחלקה לנוירולוגיה, המרכז הרפואי ת"א


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק