גלוקוזה - Glucose
הופניתם מהדף סוכר בדם לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| גלוקוזה | |
|---|---|
| Glucose | |
| מעבדה | כימיה בדם, כימיה בשתן, וכימיה בנוזל השדרה |
| תחום | מדד מטבולי מרכזי להומאוסטזיס בגוף |
| יחידות מדידה | מיליגרם לדציליטר |
| טווח ערכים תקין | דם טבורי - 45-96; בפגים - 20-60; ביילודים בני יום - 40-60; בתינוקות מעל גיל יום - 50-80; בילדים - 60-100; במבוגרים עד גיל 60 שנה - 74-106; במבוגרים בגיל 60-90 שנה - 82-115; במבוגרים מעל גיל 90 שנה - 75-121. רמות גלוקוזה בבדיקת שתן: פחות מ-500 מיליגרם לנפח איסוף של 24 שעות, או 1-15 מיליגרם לד"ל. על פי ADA רמת גלוקוזה בגברים 1-42 מיליגרם לד"ל, ובנשים 0-33 מיליגרם לד"ל. כאשר ביטוי רמת גלוקוזה בשתן נעשה על בסיס רמת קראטינין, ערכי הנורמה הם כדלקמן: מתחת גיל 40 שנה- גברים-3-181 מיליגרם לגרם קראטינין, ובנשים-5-203 מיליגרם לגרם קראטינין. מעל גיל 40 שנה-גברים - 19-339 מיליגרם לגרם קראטינין, ובנשים - 8-331 מיליגרם לגרם קראטינין. רמת גלוקוזה ב-CSF: בתינוקות וילדים: 60-80 מיליגרם לד"ל; במבוגרים: 40-70 מיליגרם לד"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
רמת גלוקוזה בדם מהווה מאז ומתמיד מדד מרכזי בפרופיל של בדיקות כימיה בדם, שיכולות להיות בדיקות שגרה סדרתיות של סקר בריאות בנבדקים ללא תסמינים, בנבדקים המגיעים לאשפוז בבתי חולים, או בנבדקים עם חשד לסוכרת או באלה שכבר מאובחנים עם סוכרת. מדידת גלוקוזה בחולי סוכרת לרוב היא בדיקה עצמית יומיומית על ידי מכשיר גלוקומטר ביתי, ולעתים אף מספר פעמים ביום, כדי למנוע הגעה למצבי היפרגליקמיה, ואולי אף יותר מכך, להימנע מהגעה למצבים מסוכנים של היפוגליקמיה קיצונית בעקבות מינון יתר של אינסולין.
מדידת רמת גלוקוזה תידרש במקרה של תסמינים המחשידים לסוכרת כגון תחושת צמא מוגברת, מתן מוגבר של שתן, תחושת עייפות וראייה מטושטשת, והשמנה קיצונית שעלולה להוביל לסוכרת type 2 . בה במידה תידרש בדיקת גלוקוזה במצבים של החלמה איטית ממצבי הדבקה הזעה מוגברת, רעב תמידי, רעד, דאגנות ומצבי בלבול המחשידים דווקא לחסר סוכר. מדידת גלוקוזה מתחייבת בתרחישי חרום לקבוע אם רמות קיצון של סוכר אינן אחראיות להתעלפות או אובדן ההכרה.
מדידת גלוקוזה בדם הוא כלי חיוני לאבחון וזיהוי מצבי סוכרת בנבדקים קדם-סוכרתיים, או בנבדקים לא סוכרתיים בעברם, בהם מופיעים תסמינים מחשידים למחלה. מדידה סדירה של סוכרת בדם יעילה לניטור סוכרת המתרחשת בעת הריון, אך גם לעקוב אחר מטופלים עם מפגעים של בלוטת הלבלב האחראית על ייצור הומונים כאינסולין וגלוקגון, המווסתים את רמת הסוכר בדם.
מדידת גלוקוזה בדם יכולה להיות חלק ממגוון בדיקות המיועדות לסייע בהבנת חילוף החומרים של גלוקוזה, כגון רמת אינסולין ו-C-peptide , בדיקות להעמסת גלוקוזה במתווים שונים (העמסה פומית או תוך-ורידית), בדיקות לרמת הסוכר בדגימה אקראית בצום או לאחר ארוחות וכו'. כל הבדיקות הללו מסיעות להבין האם מדובר בחסר יצירת אינסולין או שמא המצב של עמידות להורמון זה (insulin resistance).
בסיס פיזיולוגי
גלוקוזה הוא חד סוכר שש-פחמני (hexose) שמשקלו המולקולארי 180 דלטון, שיכול להיות קשור בקשר גליקוזידי ליצירת דו-סוכר או פולי-סוכרים. פחמימות בדיאטה מורכבות מחד סוכרים כגלוקוזה, פרוקטוזה וגלקטוזה, מדו-סוכרים דוגמת סוכרוזה, לקטוזה ומלטוזה, ורב סוכרים כעמילן, כאשר אנזימים במערכת העיכול מבקעים רב- ודו-סוכרים לחד-סוכרים.
התפקיד הביוכימי העיקרי של גלוקוזה הוא לספק אנרגיה לתהליכי החיים. המקור האוניברסאלי של אנרגיה בגוף היא מולקולת ATP, כאשר חמצון של גלוקוזה במסלול הגליקוליזה, או במסלול החומצות התלת-קרבוקסיליות (מעגל קרבס, או גם מעגל חומצת הלימון) מייצר אנרגיה על ידי יצירת ATP.
המעבר של גלוקוזה אל תוך תאים דרך הממברנה מסתייע על ידי ההורמון אינסולין. קולטנים לאינסולין על פני תאים כמו הפאטוציטים ואדיפוציטים, מורכבים משתי תת יחידות α ושתי תת-יחידות β, הקשורות ביניהן בקשר די-סולפידי. כאשר אינסולין נקשר לתת יחידה α של הקולטן, עובר איתות דרך הממברנה, המשפעל את האנזים טירוזין קינאזה הממוקם על תת-יחידה β של הקולטן. אנזים זה מזרחן שיירים של טירוזין על תת-יחידה β סמוכה, מה שמפעיל רצף של אירועים המאפשרים לגלוקוזה לחדור לתא דרך הממברנה.
מסלולים מטבוליים עיקריים של גלוקוזה
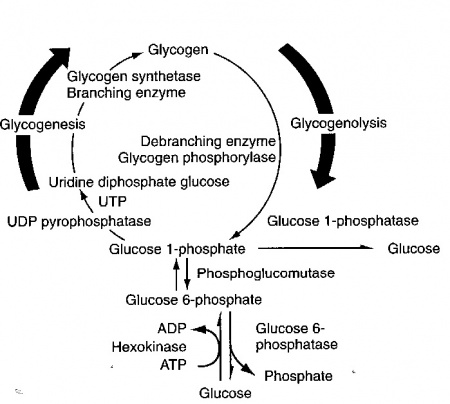
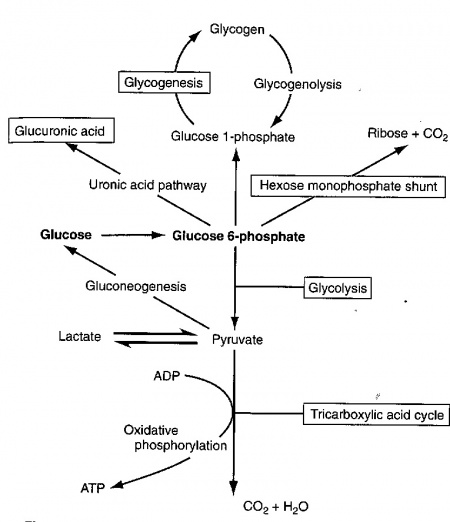
בתוך התא, מולקולת גלוקוזה מוסבת במהירות לגלוקוז-6-פוספאט, שהוא תוצר ביניים מרכזי במטבוליזם של גלוקוזה. האנזים המקטלז את זרחון גלוקוזה על ידי ATP הוא hexokinase (או גלוקוקינאזה בכבד ובתאי β בלבלב). גלוקוקינאזה יכול לשחק תפקיד מפתח בוויסות של ההומאוסטזיס של גלוקוזה על ידי שמירת גרדיאנט של טרנספורט של גלוקוזה אל תוך ההפאטוציט. גלוקוז-6-פוספאט משמש גם כנקודת פתיחה לארבעה מסלולים מטבוליים. תרכובת זו מומרת במסלול הגליקוליזה ליצירת פירובאט, חומר שיכול לעבור בהמשך מטבוליזם במעגל קרבס ליצירת דו-תחמוצת הפחמן ומים. גלוקוז-6-פוספאט יכול גם להתחמצן על ידי מה שידוע כ-hexose monophosphate shunt, ליצירת ribose ודו תחמוצת הפחמן, וכן יכול glucose-6-phosphate להיכנס למסלול ה-uronic acid ליצירת חומצה גלוקורונית, או להיות מוסב ל-glucose-1-phosphate, וכך להשתלב במסלול הגליקוגנזה ליצירת גליקוגן. חמשת המסלולים האלה מופיעים בתרשים הבא:
גליקוליזה אארובית: גלוקוז-6-פוספאט עובר מטבוליזם במסלול היוצר ממולקולה אחת של סוכר שש-פחמני, 2 מולקולות של חומצה פירובית, שלוש-פחמנית. תהליך זה מייצר 2 מולקולות ATP לכל מול גלוקוזה, אך חשיבות התהליך ביצירה של חומצה פירובית שיכולה להשתלב במעגל קרבס, בו היא הופכת בסוף התהליך לדו-תחמוצת הפחמן ולמים. אמנם במעגל קרבס אין יצירה ישירה של אנרגיה בצורת ATP, אך ATP נוצר על ידי חמצון שניים מהתוצרים של מעגל זה, NADH ו-FADH2. יצירת אנרגיה זו מתאפשרת בתהליך המתרחש במיטוכונדריה וידוע כזרחון חמצוני של ADP ליצירת ATP, כאשר האנרגיה לריאקציה זו, נוצרת על ידי שטף של אלקטרונים דרך שרשרת טרנספורט אלקטרונים. וכך, החמצון מחדש של NADH ושל FADH2 שנוצרו במהלך מעגל קרבס, מביאים בעקיפין ליצירת אנרגיה. בניגוד לגליקוליזה בה מיוצרות רק 2 מולקולות ATP לכל מולקולת גלוקוזה, שני המעגלים המשולבים של קרבס וזרחון חמצוני מייצרים 36 מולקולות ATP לכל מולקולת גלוקוזה.
גליקוליזה אנארובית: בשריר העייף, במצב של חסר חמצן, המסלולים המתוארים למעלה אינם יכולים להביא להשתלבות החומצה הפירובית בתהליכים של זרחון חמצוני, ובמקום זאת הפירובאט הופך ללקטאט על ידי האנזים LDH. חומצה לקטית הנוצרת ברקמה האנוקסית, ממשיכה עם זרם הדם לכבד, שם היא הופכת בחזרה לגלוקוזה בתהליך הידוע כ-gluconeogenesis.
גליקוגן: עודף גלוקוזה יכול להיאגר בתאים בצורת הפולימר גליקוגן, כמקור אנרגיה עתידי. גליקוגן, הממוקם בציטופלזמה של תאי הכבד ושריר בתוך גרנולות המכילות את האנזימים הדרושים ליצירתו (גליקוגנזה) או פרוקו (גליקוגנוליזה). גליקוגן הוא פולימר פוליסכרידי גבה-מולקולארי, המורכב באופן בלעדי מיחידות גלוקוזה הקשורות ביניהן בקשרי α1-4 גליקוזידיים.
תהליך נוסף הידוע כ-gluconeogenesis, מייצר מחדש גלוקוז-6-פוספאט מרוב חומצות האמינו, וכן מחומצות שומן, מגליצרול ומלקטאט. פירובאט מהווה תוצר ביניים חשוב בתהליך הגלוקונאוגנזה, כיוון שהוא נוצר באופן ישיר מחמצון של לקטאט ע"י LDH, או מחומצת האמינו אלנין על ידי פעולת האנזים הטרנסאמינאזה SGPT. גליצרול, הנובע מהידרוליזה ליפוליטית של טריגליצרידים, נכנס גם הוא למסלול הגלוקונאוגנזה כ-glycerol-3-phosphate. שלושת תרכובות אלו, לקטאט, אלנין וגליצרול, הם הקודמנים (precursors) העיקריים לסינתזה של גלוקוזה, המתרחשת רק בכבד ובכליות, שמכילים את האנזים glucose-6-phosphatase הנחוץ להפיכת G6P לגלוקוזה. למעשה, הכבד הוא המקור הלא-דיאטתי העיקרי ליצירת גלוקוזה בדם, ולכן מהוא קריטי לשמירה על רמות גלוקוזה בדם.
פיקוח הורמונאלי על המטבוליזם של גלוקוזה: המערכת לוויסות רמת סוכר בדם מתוכננת להשיג 2 מטרות: הראשונה, היא לאגור עודף של גלוקוזה בצורת מאגר קומפקטי וזמין דוגמת גליקוגן. השנייה, היא לגייס בשעת הצורך גלוקוזה על ידי הידרוליזה של גליקוגן. הוויסות של רמת גלוקוזה בדם חיוני להגנה על המוח, שגלוקוזה מהווה מקור אנרגיה ראשי שלו, באופן שדורש אספקה שוטפת של גלוקוזה למוח. התפקיד של אינסולין הוא אכן לכוון עודף של גלוקוזה חוץ-תאית אל תוך התאים שם הסוכר מתפלמר לגליקוגן. לעומת זאת, בתגובה להיפוגליקמיה כמו במצבי צום, יפעלו הורמונים דוגמת גלוקגון, הורמון גדילה (GH), קורטיזול, ומספר הורמוני מעי כגורמים היפרגליקמיים, הפועלים ליצירת גלוקוזה על ידי שחרורו ממאגריו כגליקוגן.
לאינסולין ולגלוקגון השפעות מנוגדות: אינסולין מעכב פרוטאוליזה, ליפוליזה גלוקונאוגנזה וגליקוגנוליזה, מעודד סינתזת ליפידים וגליקוגנזה בכבד, ומגביר סינתזה של חלבון בשריר וסינתזה של טריגליצרידים בתאי השומן. אינסולין המופרש מתאי β בלבלב הוא הגורם ההיפוגליקמי היחיד בגוף. בניגוד לאינסולין, גלוקגון מעודד ליפוליזה, קטוגנזה, גלוקונאוגנזה וגליקונוליזה, שכולן תורמות להגברת רמת הסוכר בדם. ארוחה עשירה בפחמימות משרה הפרשת אינסולין ומדכאת את הפרשת גלוקגון. לעומת זאת, היפוגליקמיה מעודדת הפרשת גלוקגון מתאי α בלבלב. כך שאינסולין וגלוקגון הם למעשה הורמונים מנוגדים זה לזה, כאשר אינסולין מעודד אגירת אנרגיה וגלוקגון תומך בשחרור אנרגיה, והתוצאה נטו של שתי פעולות מנוגדות אלו מביאה להומאוסטאזיס של גלוקוזה.
לעומת זאת, קורטיזול וקורטיקוסטרואידים אחרים מגבירים את קצב הגלוקונאוגנזה מחלבונים ומחומצות אמינו, בעיקר בכבד. גם אפינפרין מגביר רמות גלוקוזה על ידי עידוד של הפרשת גלוקגון, כמו גם עידוד גליקוגנוליזה, גלוקונאוגנזה ועל ידי עיכוב הפרשת אינסולין.
ה-incretins הם הורמונים המופרשים מרירית המעי בשעת צריכת פחמימות המתפרקות לגלוקוזה. שני האינקרטינים העיקריים הם א.GIP או glucose-dependent insulinotropic polypeptide (הידוע גם כ-gastric inhibitory peptide), ב. GLP-1 או glucagon-like peptide-1. שני הורמונים אלה פועלים באיי לנגרהנס בלבלב על קולטני ביתא, מה שמעודד הפרשת אינסולין. באנשים בריאים האינקרטינים אחראיים ל-50-70% מהפרשת אינסולין בשעת ארוחה עתירת פחמימות.
הורמונים נוספים כגון הורמון הגדילה (GH) ותירוקסין, אף הם פועלים להגברת רמת גלוקוזה בדם. סומטוסטאטין הוא הורמון פוליפפטידי המסונתז בעיקר בתאי δ בבלוטת הלבלב, ומעכב את הפרשת אינסולין וגלוקגון כאחד. פפטידים נוספים הידועים כ-insulin-like growth factors, הם בעלי מבנה אנלוגי לזה של פרואינסולין ושל somatomedin C. גם לגורמים אלה תפקיד בבקרה על רמת גלוקוזה.
מטבוליזם של גלוקוזה בבריאות מלאה
באנשים בריאים הנמצאים בצום היחס בין רמת אינסולין לגלוקגון נמוך, מה שגורם לגליקוגן בכבד ובשריר לעבור הידרוליזה כמקור לגלוקוזה בדם. יודגש שהכבד הוא המקור העיקרי של גלוקוזה בדם במצב צום שבין ארוחות. במצבים של צום מתמשך, או בתת-תזונה מובהקת, יש שבירה של חלבונים לחומצות אמינו בשריר השלד, ויש ליפוליזה של טריגליצרידים לחומצות שומן, כדי שאלה ישמשו לסינתזה של גלוקוזה בתהליך של גלוקונאוגנזה המושרה על די גלוקגון. בנוסף, חומצות שומן חופשיות יכולות לשמש כ"דלק" בלב, בשרירי השלד ובכבד.
דקות אחדות אחר בליעת המזון, רמות אינסולין בדם עולות באופן מהיר גם בהשפעת GIP ו-GLP-1 המופרשים במעי. גלוקוזה וחומצות אמינו דוגמת לאוצין, איזולאוצין וליזין, הם גריינים משמעותיים של תאי β בלבלב, ומגבירים הפרשת אינסולין. רוב התאים ההיקפיים מגיבים לעליה ברמת הסוכר בדם על ידי הגברה מהירה של קליטתו. לכן, לאחר ארוחה, רמות גלוקוזה בדם עולות רק ב-20 עד 40 אחוז באנשים בריאים. יחד עם זאת, בערך 80% מקליטת הסוכר בתאים אינה קשורה לאינסולין, כיוון שהמוח, כדוריות הדם האדומות, הכבד והמעי אינם נזקקים לאינסולין כדי להגביר את קליטת גלוקוזה במצבים של רמת סוכר מוגברת בדם. לעומת זאת השריר היא הרקמה התלויה ביותר בפעילות אינסולין לקליטת גלוקוזה אל תוך התאים. הגברה ברמות גלוקוזה בדם ובדיעבד עלייה ברמת אינסולין, אינם מעכבים את תהליך הליפוליזה, ואינם משפיעים על כ-60% מכלל ההפרשה הנורמאלית של גלוקוזה על ידי הכבד.
מטבוליזם של גלוקוזה בסוכרת
במאובחנים עם סוכרת, יצירת גלוקוזה והמטבוליזם שלו אינם תקינים. וכך במצב של צום, מוגבר ביותר שחרור גלוקוזה מהכבד, מה שגורם לעליה משמעותית ברמות הסוכר בחולי סוכרת. בנוסף, שחרור של אינסולין נמוך בסוכרת type 1, כאשר תגובת התאים להורמון זה פגומה בסוכרת type 2, כך שבשני סוגי הסוכרת השפעת האינסולין נמוכה באופן יחסי לרמות הסוכר הנתונות. כתוצאה מירידה בפיקוח של אינסולין על רמות גלוקוזה, נמצא שחולי סוכרת נמצאים במצב של צום למחצה, עם תלות מוגברת בטריגליצרידים כמקור של דלק, ותלות בחלבונים כמקור לחומצות אמינו המשמשות כקודמנים ליצירת גלוקוזה. לכן, במצב של צום, החולה הסוכרתי יכול להיות עם רמה מוגברת של חומצות שומן חופשיות או של קטונים בדם.
לאחר ארוחה, קטן בהרבה העיכוב של הפרשת גלוקוזה מהכבד בחולי סוכרת. שילוב של עובדה זו עם הפרשה מועטת של אינסולין או מצב של עמידות לאינסולין, מוליכים לרמה מוגברת משמעותית של סוכר לאורך זמן בדם של סוכרתיים.
אי-תקינוּת של רמת גלוקוזה ביילודים
מצבי היפוגליקמיה של היילוד הם שכיחים ומהווים כ-10% מכלל היילודים, ועלולים באי-טיפול נאות לגרום לחסכים נוירולוגיים לטווח הקצר והארוך. היפוגליקמיה בגיל הרך היא לרוב א-תסמינית, וניתן לזהותה על ידי בדיקת סקר של יילודים בסיכון גבוה. לעומת זאת היפוגלימיה תסמינית צפויה להיות כרוכה יותר עם תופעות לוואי נוירולוגיות. הסיבות למצבי היפוגליקמיה ביילוד מגוונות: א. צריכה מוגברת של הסוכר שיכולה לנבוע ממצבי עקה קטבולית, במצבי הלם או ספסיס, וכן ב-cold-induced thermogenesis. ב. אספקה ירודה של גלוקוזה שיכולה לנבוע מהזנה לא מספקת, או ממאגרים דלים של גליקוגן בכבד בדרך כלל בפגים או ביילודים הנולדים קטנים מהמקובל למשך ההיריון (SGA). ג. מפגעים אנדוקריניים כחסר בהורמון גדילה, או באי-ספיקה של האדרנל. ד. מפגעים גנטיים כגון ייצור בלתי מווסת ומוגבר של אינסולין, או מפגע בתהליכי החמצון של חומצות שומן. סיבות אחרות להיפוגליקמיה ביילוד הם היפוקסיה וסוכרת של האם.
היפוגליקמיה עיקשת ביילוד המחייבת מתן עירוי ורידי של הסוכר, עלולה לרמוז לאי-סדירות הורמונאלית או מטבולית. כאשר מתרחש מצב כזה, יש לנטר ביילוד את רמות גלוקוזה, לקטאט, קטונים, אינסולין, קורטיזול, והורמון הגדילה. בדיקות נוספות לרמת TSH, חומצות אמינו, פרופיל אציל קרניטין וחומצות אורגניות בשתן עשויות לסייע.
האבחון של היפוגליקמיה ביילוד מבוסס על רמות גלוקוזה בפלזמה יחסית לשבוע הלידה של ההיריון, גיל התינוק, וסטאטוס הצום. ערכי סף להתערבות טיפולית נקבעו כרמת סוכר של 40 מיליגרם לד"ל ליילודים מתחת גיל 24 שעות, או כ-50 מיליגרם לד"ל ליילודים מעל גיל 24 שעות. יילודים בסיכון להיפוגליקמיה צריכים להיבדק לרמת גלוקוזה 1-2 שעות לפני ההזנה. אם רמת הסוכר נמוכה מ-40 מיליגרם לד"ל, יש להאכילו ולבדוק שוב לאחר ההזנה.הבדיקה יכולה להתבצע בעזרת גלוקומטרים, אך תוצאות נמוכות במיוחד חייבות להיות מאוששות בעזרת מכשיר מדידה תקני.
היפרגליקמיה ביילודים היא ממצא נדיר באלה שנולדו בעיתם, וממצא זה מרמז למצב של תגובת עקה והפרשת יתר של קורטיזול, או למצב נדיר מאוד של תסמונת סוכרת מולדת שמופיע ב-1 ל-500,000 לידות. יש לקחת בחשבון גם תרחיש של היפרגליקמיה יאטרוגנית, בטיפול בעירוי גלוקוזה תוך ורידי. בעיקר בפגים בהם מוגבלת היכולת לווסת גלוקונאוגנזה בכבד או יצירת אינסולין בתאי ביתא בבלוטת הלבלב. רמות סוכר הגבוהות מ-180 מיליגרם לד"ל בפגים חייבות להיות מטופלות או בהפחת מינון הסוכר בעירוי או בהזלפת אינסולין, בהתאם לצרכים הקאלוריים של היילוד. רמות הסוכר חייבות להיות מנוטרות לכל היילודים הנמצאים תחת עירוי גלוקוזה, עד להתייצבות רמת הסוכר.
שיטות המדידה של גלוקוזה
על חשיבות המדידה של גלוקוזה תעיד העובדה שלא פחות מ-12 שיטות מדידה שונות פותחו והיו בשימוש מעבדתי במהלך 100 הנשים האחרונות. בעיקרן, מתחלקות שיטות המדידה ל-2: שיטות כימיות המתבססות על יכולת החיזור של גלוקוזה בריאקציה עם חומרים שונים המשנים צבעם לאחר שהם עוברים חיזור, ושיטות אנזימטיות בהן מוסב הסוכר לחומרים כרומוגנים. מטבע הדברים השיטות הכימיות פחות ספציפיות שכן חומרים אחרים בדם הם בעלי כושר חיזור כמו urea, סוכרים אחרים הדם, קראטינין, חומצה אסקורבית (ויטמין C) ועוד, מה שעלול לתת תוצאות חיוביות כזובות בסדר גודל של 5-15 מיליגרם לד"ל.
- בין השיטות הכימיות יש לציין אחדות
- שיטת Folin-Wu בה מלח נחושת (++Cu) מגיב עם גלוקוזה בסביבה בסיסית בחימום ליצירת תחמוצת נחושת שצבעה כחול.
- שיטת Somoggi-Nelson בה נמדדת רמת גלוקוזה בשני שלבים: בשלב הראשון גלוקוזה מחזרת יון נחושת דו-ערכי לקבלת יון חד-ערכי, כאשר בשלב השני נחושת חד ערכית מגיבה עם חומצה ארסנו-מוליבדית המתחזרת ליצירת תרכבובת מוליבדניום כחולה.
- שיטת Benedict-שהיא שיטת איכותית (או כמותית למחצה), בה נחושת דו-ערכית מגיבה עם גלוקוזה בסביבה בסיסית בחימום ליצירת תחמוצת נחושת ו-CuOH בגווני אדום-צהוב.
- שיטת neocuproine הכמותית, בה נחושת חד ערכית הנוצרת לאחר הגבת גלוקוזה עם נחושת דו-ערכית, מגיבה עם neocuproine ליצירת תוצר צבע.
- שיטה נוספת של קביעה כמותית של גלוקוזה (Hagedorn-Jensen) היא בחיזור ferricyanide (שצבעו צהוב) על ידי הסוכר בסביבה בסיסית בחימום, ליצירת ferrocyanide חסר צבע.
- שיטת Orthotoluidine הכמותית בה מגיב הסוכר גלוקוזה עם האמין הארומטי אורתו-טולואידין בחימום בנוכחות חומצה אצטית, ליצירת בסיס Schiffו-glycosamine בגוון אמרלד-ירוק שעוצמתו נמדדת באורך גל 630 ננומטר. שיטה זו מוגבלת לשימוש כיוון שאורתו-טולואידין נחשב קרצינוגן, ועוד יותר כיוון שסוכרים אחרים בנסיוב יגיבו באופן דומה לתת תוצאה מוגברת כזובה של גלוקוזה.
- השיטות היותר מקובלות כיום למדידת רמת גלוקוזה הן השיטות האנזימטיות, תוך שימוש באנזימים המגיבים ספציפית עם גלוקוזה
- שיטת hexokinase הכמותית המשמשת כיום ברוב מכשירי המדידה האוטומטיים במעבדות קליניות. בשיטה דו-שלבית זו, מגיב הסוכר עם ATP לריאציית זרחון בנוכחות האנזים הקסוקינאזה ויוני מגנזיום, ליצירת גלוקוז-6-פופאט ו-ADP. בשלב השני מגיב תוצר הביניים G6P עם NADP לריאקציית חמצון בה התוצרים הם -phosphogluconate וכן NADPH ויוני מימן. מדידה באורך גל 340 ננומטר של בליעת NADPH עומדת ביחס ישר לריכוז גלוקוזה. שיטה זו נחשבת ספציפית יותר משיטת Glucose oxidase, כיוון שתוצר הביניים גלוקוז-6-פוספאט מעכב השפעת חומרים שונים בדם.
- שיטת Glucose oxidase המשולבת ידועה כשיטת Trinder, בה מגיב הסוכר עם חמצן בנוכחות האנזים גלוקוז אוקסידאזה ליצירת תוצרי הביניים חומצה גלוקונית ומי חמצן. בשלב השני יגיבו מי החמצן עם חומר צבע מחוזר (4aminoantipyrine מצומד עם פנול ) בנוכחות האנזים horseradish peroxidase להופעת חומר צבע מסוג quinone בגוון אדום-סגול שעוצמתו נמדדת באורך גל 540 ננומטר. שיטה זו עלולה להיות מושפעת מרמה מוגברת של קראטינין, חומצת שתן או המוגלובין בפלזמה. כן עלול להיות עיכוב על ידי האנזים catalase. שיטה זו מקובלת בשיטות המקלונים למדידה עצמית בגלוקומטרים ביתיים.
- שיטות נוספות למדידת גלוקוזה שאינן מקובלות בשגרת המעבדה הקלינית הן: שיטת Glucose dehydrogenase, שיטת radiation energy attenuation ושיטת isotope dilution mass-fragmentography, שדיוקן טוב אך עלותן גבוהה או שתהליך המדידה מורכב מדי.
- תכשירים ותרופות המעלים רמת גלוקוזה בדם באופן פיזיולוגי: ACTH, אספרגינאזה, אגוניסטים ביתא אדרנרגיים (כגון albuterol ,isoproterenol ו-terbutaline), קפאין, קלציטונין, קורטיקוסטרואידים, אפינפרין, diazoxide, תכשירים דיורטיים (acetazolamide ,ethacrynic acid ,furosemideגלוקגון, indomethacin, ליתיום קרבונאט, isoniazid, מורפין, חומצה ניקוטינית (ניאצין) במינון גבוה, סומאטוסטטין, פנותיאזינים, phenytoin, תאופילין, rifampin ,strptozotocin ,D-thyroxine ,thiabendazole, חוסמי ביתא כמו propranolol, נוגדי דיכאון טריציקליים דוגמת amitriptyline ,imipramine ,triamterene. צריכה התחלתית של אלכוהול יכולה להעלות באופן זמני רמת גלוקוזה בדם.
- תכשירים ותרופות המעלים את הערך הנמדד של גלוקוזה כתוצאה מהתערבות בבדיקה האנליטית במכשירי Beckman בשיטת Glucose oxidase (כימיה יבשה): 2deoxy glucose, hydroxyethyl starch.
- תכשירים או תרופות המורידים רמת גלוקוזה בדם באופן פיזיולוגי: אצטאמינופן (ברמות רעלניות), חוסמי ביתא אדרנרגיים, סטרואידים אנבוליים בייחוד בחולי סוכרת, פיבראטים (benzafibrate ,clofibrate ו-gemfibrozil), סליצילאטים (מינון יתר של אספירין), indomethacin, צריכת יתר של אתנול, captopril, אנטי-היסטאמינים, cyproterone, מריחואנה, nifedipine (באופן לא מוחלט), מעכבי מונו-אמין-אוקסידאזה, pentamidine (לאחר מספר ימים של טיפול), tromethamine, ספירונולקטון, חוממצה אסקורבית, pivampicillin, תכשירים נגד שחפת, protionamide ,disopyramide, מנת יתר של אינסולין, fenfluramine (בחולי סוכרת), אנלוגים של guanethidine.
- תכשירים ותרופות המורידים רמת גלוקוזה בדם הנמדדת כתוצאה מהשפעה אנליטית: אצטאמינופן, levodopa, ויטמין C (השפעה על ריאקצית Trinder), גלוטתיון (השפעה על ריאצית hexokinase).
- מצבים פיזיולוגיים ומפגעים הכרוכים ברמה מוגברת של גלוקוזה בדם: מצב ראשוני כסוכרת נעורים או סוכרת type 2. גלוקוזה יכולה להיות מוגברת במצבי אכילת-יתר, עקה חריפה (בעקבות טראומה גופנית או נפשית או בעקבות שבץ מוחי, התקף-לב או ניתוח), התכווצויות, לאחר פעילות גופנית נמרצת ומאומצת, במשבר רגשי קשה, במצבי הלם, כוויות חמורות, השמנה קיצונית, כתוצאה מעלייה בהפרשת אפינפרין. רמת הסוכר עולה במפגעים אנדוקריניים כגון פיאוכרומוציטומה, פעילות יתר של בלוטת התריס ו-thyrotoxicosis, ב-acromegaly ובענקוּת (gigantism), בתסמונת Cushing, בשאתות כמו גלוקגונומה וסומטוסטטינומה.
רמת גלוקוזה מוגברת במחלות בלוטת הלבלב כגון פנקראטיטיס חריפה או כרונית, בלייפת כיסתית (cystic fibrosis), בממאירות של בלוטת הלבלב, או בפגיעה בלבלב כתוצאה מהמוכרומאטוזיס. רמת גלוקוזה בדם תוגבר בהקשר של אירוע צרברו-וסקולארי (CVA), אוטם שריר הלב, או תעוקת חזה חמורה, במחלות כבד או כליה כרוניות. מוגברות של רמת סוכר בדם תימצא בתרחישים של יצירת נוגדנים כנגד הקולטנים לאינסולין או במצב של עמידות לאינסולין כמו ב-acanthosis nigricans, וגם בתסמונת Wernicke בחסר של ויטמין B1.
- תכשירים או תרופות המעלים רמת גלוקוזה בשתן: כלורל הידראט, carbamezapine, קורטיקוסטרואידים, D-thyroxine, תכשירים דיורטיים (כגון תיאזידים, acetazolamide ,chlorthalidone ,ethacrynic acid ,furesamide), ליתיום קרבונאט, ניאצין.
- תכשירים המשפיעים באופן אנליטי בהגדלת התוצאה של רמת גלוקוזה בשתן: מי חמצן, היפוכלוריט או דטרגנטים המשמשים לשטיפת מיכלים למתן שתן.
- תכשירים המשפיעים באופן אנליטי בהפחתת התוצאה של גלוקוזה בשתן: ויטמין C, אספירין, levodopa, טטרציקלין, dipyrone, 5-הידרוקסי אינדול חומצה אצטית.
- מצבים פיזיולוגיים ומפגעים הכרוכים ברמה מופחתת של גלוקוזה בדם: מטבע הדברים תיתכן הפחתת גלוקוזה בדם במצבי צום או תזונה לקויה וכמובן בתרחיש קיצון כאנורקסיה. מפגעי בלוטת הלבלב המפחיתים את רמת הסוכר בדם הם ממאירות של תאים מייצרי אינסולין (islet cells) הידועה כאינסולינומה, או חסר ביצירת גלוקגון. רמה מופחתת של סוכר צפויה בממאירויות מסוג פיברוסרקומה, וקרצינומה של הקיבה או של בלוטת האדרנל. חסר ברמת גלוקוזה נמצא במפגעים אנדוקריניים כאי-ספיקה כרונית של האדרנל כמו מחלת אדיסון, פעילות חסר של יותרת המוח (לעתים כתוצאה מגידול בבלוטה זו), ובהיפותירטאידיזם. רמת גלוקוזה נמוכה גם בכשל של הכליות, במפגעי כבד חמורים כמו צמקת הכבד, או מפגעים כתוצאה מהרעלת ארסן, פחמן טטרכלורי, cinchophen, כלורופורם, אלכוהול, סליצילאטים, phenformin, ואנטי-היסטאמינים.
רמה נמוכה של גלוקוזה בדם עלולה לנבוע ממפגעי מערכת העצבים האוטונומית, לאחר ניתוחי כריתת קיבה, ו-gastroenterostomy. במפגעים פדיאטריים כאי-בשלוּת, במקרים של תינוקות לאמהות סוכרתיות, במצבי היפוגליקמיה קטוטית, בתרחיש של רגישות אידיופטית ללאוצין, ובתסמונת Zetterstrom. רמה מופחתת של גלוקוזה נמצא במפגעי חסר אנזימטי כגון תסמונת von Gierke, בגלקטוזמיה, בתמונת Maple syrup, ובעמידות תורשתית לפרוקטוזה.
מצבים פיזיולוגיים ומפגעים הכרוכים ברמה מוגברת של גלוקוזה בשתן
כל תרחיש או מפגע המגביר רמת גלוקוזה בדם יביא להגברת סוכר זה בשתן. בעיקר יש להזכיר מצבים בהם יש ספיגה מהירה של גלוקוזה במעי כגון לאחר ניתוח gastrectomy, או מפגעים אנדוקריניים כסוכרת, תירוטוקסיקוזיס, ענקוּת, אקרומגליה, תסמונת Cushing, או adrenocortical hyperplasia, תרחיש טראומה משמעותי, שבץ מוחי, התקף-לב נטילה פומית של סטרואידים, כוויות, הדבקה בפתוגנים, מפגעי כליה, פאוכרומוציטומה, ירידה בסף הספיגה בכליות כגון במחלה טובולו-אינטרסטיציאלית, הרעלת עופרת בתינוקות ובילדים.
- תרחישים פיזיולוגיים וקליניים המעלים רמת גלוקוזה ב-CSF: היפרגליקמיה סוכרתית, אנצפאליטיס מגפתית, עגבת במערכת העצבים המרכזית, במצבי היפרגליקמיה מסיבות כלשהן.
- תרחישים פיזיולוגיים וקליניים המפחיתים באופן מתון רמת גלוקוזה ב-CSF: שטף דם תת-עכבישי, מנינגו-אנצפליטיס לא-חיידקית.
מצבים קליניים המביאים לירידה ניכרת ברמת גלוקוזה ב-CSF: מנינגיטיס פּיוגנית חריפה, מנינגיטיס שחפתית, מנינגיטיס קריפטוקוקאלית, מנינגואנצפאליטיס אמבית ראשונית, אנצפאליטיס על רקע נגיף חזרת, גידול ראשוני או גרורתי של קרומי המוח (meninges), סרקואידוזיס. במנינגיטיס פּיוגני, רמת גלוקוזה עשויה לחזור במהירות לרמה הנורמאלית לאחר מתן טיפול אנטיביוטי. מדידת גלוקוזה בנוזל השדרה מסייעת באבחנה בין מנינגיטיס נגיפי וחיידקי. בעוד רמת גלוקוזה נורמאלית במנינגיטיס נגיפית, היא נמוכה ב-40-45% מרמת הנורמה במנינגיטיס חיידקית.
רמות גלוקוזה בנוזל הצדר (פלאורה)
רמות גלוקוזה בנוזל הפלאורלי, דומות לאלה שבפלזמת הדם, בנוזל פלאורה תקין, ובתפליטי transudate. לעומת זאת רמת גלוקוזה נמוכה יותר בתפליט exudate. כאשר רמת גלוקוזה בנוזל הפלאורה נמוכה מ-60 מיליגרם לד"ל, או כאשר ההפרש בין רמת גלוקוזה בין זו שבפלזמה לזו בנוזל הפלאורה עולה על 30 מיליגרם לד"ל, זהו נתון משמעותי. רמות גלוקוזה נמוכות בנוזל הפלאורלי, נמצא במצבים של הדבקות חיידקיות, שחפת, ממאירות, ומחלות ראומטיות. שני מנגנונים אחראיים לרמה נמוכה של הסוכר בנוזל הפלאורה, כאשר הראשון נובע מצריכה מוגברת של גלוקוזה על ידי מיקרואורגניזמים בנוזל עצמו. המנגנון השני נובע מחסימה יחסית בטרנספורט של גלוקוזה מהדם לנוזל הפלאורלי, מה שבולט במיוחד במפגעים ראומטיים. הפירוש של רמות נמוכות של גלוקוזה בנוזלים הפריטונאלי והפריקרדיאלי, דומה לזה במקרים של רמות גלוקוזה נמוכות בנוזל הפלאורלי.
רמות גלוקוזה בבדיקות למערכת סוכרת הריונית (Gestational Diabetes)
סוכרת הריונית היא סוכרת המופיעה באופן זמני ב-1-3% מכלל הנשים ההרות. מטה אנליזה של Kim וחב' שסרקה מאמרים בשנים 1965-2001 העלתה שחלק משמעותי של מקרים של סוכרת הריונית, היו מלווים לאחר ההיריון בהתפתחות סוכרת type 2 בעיקר ב-5 השנים הראשונות לאחר ההיריון. מקובל שסוכרת הריונית נובעת מאי היכולת של האישה ההרה להפריש רמה מספקת של אינסולין הנדרש לפצות על הדרישות הגוברות להורמון זה בשלב מתקדם של ההיריון, כתוצאה מהגדלה במספר האדיפוציטים בהיריון, וכן כתוצאה מהפרשה מוגברת של הורמוןנים היפרגליקמיים, כולל לקטוגן שלייתי, קורטיזול, פרוגסטרון ופרולקטין. כל אלה מביאים לעלייה פי-4 בהזדקקות להפרשת אינסולין, וכאשר זו לא מסתייעת מתפתחת היפר-גליקמיה הריונית.
בנשים הרות המצויות בסיכון מוגבר לסוכרת הריונית (כגון השמנה ניכרת, גליקוזוריה, סיפור משפחתי של סוכרת או סוכרת הריונית בעבר) נהוג לבצע העמסת סוכר כבדיקה אבחנתית ראשונה, בדרך כלל בשבועות 24-28 להיריון. בעבר היו נוהגים לערוך בדיקת סקר לכלל הנשים בהיריון, אם כי כיום נמנעים מביצועה לנשים הרות מתחת גיל 25 שנה, עם משקל גוף תקין, שאין להן היסטוריה של סוכרת קדם-הריונית, הריון קודם עם אבחנה של סוכרת הריונית, או היסטוריה משפחתית של סוכרת. בדיקת סקר מקדימה מתבצעת לנשים הרות בסיכון נמוך בהעמסה של 50 גרם גלוקוזה ומדידת הרמה בדם לאחר שעה אחת. במקרה זה ערך סף הגבוה מ-140 מיליגרם לד"ל מביא לאיתור כ-80% ממקרי סוכרת ההריונית. אם רמת הסוכר הנמדדת שעה לאחר ההעמסה נמצאת מוגברת, מתבצעת העמסה ממושכת יותר, בדרך כלל לשעתיים או 3 שעות. בשנת 2011 איגוד הסוכרת האמריקני (ADA) אימץ הנחיות חדשות הממליצות על מבחן העמסת סוכר פומי (OGTT) של 75 גרם גלוקוזה למשך שעתיים במקום זה של 3 שעות לגילוי סוכרת הריונית, בעוד שקונגרס המיילדים והגינקולוגים שם (OCOG) עדיין תומך במבחן העמסה של 100 גרם למשך 3 שעות.
בשתי צורות ההעמסה המתוארות, ערכי הסף המירביים המותרים של גלוקוזה בדם ורידי לאחר שעה אחת הם 180 מיליגרם לד"ל, לאחר שעתיים 195 מיליגרם לד"ל, ובמבחן ההעמסה של 100 גרם גלוקוזה ל-3 שעות, ערך הסף המירבי המותר הוא 140 מיליגרם לד"ל.
הפרעה בסבילות לגלוקוזה (IGT או Impaired Glucose Tolerance)
IGT מאובחן כאשר רמת הסוכר הנמדדת שעתיים לאחר שתיית 75 גרם גלוקוזה נמצאת גבוהה מ-140 מיליגרם לד"ל, אך נמוכה מרמה של 200 מיליגרם לד"ל. רמת גלוקוזה הנמדדת בנבדקים אלה בצום נמוכה מ-126 מיליגרם לד"ל, שהיא אמנם גבוהה מרמת הסוכר הנמדד בתנאי צום בבריאות מלאה, אך עדיין נמוכה מזו המתקבלת לצורך אבחון של סוכרת. כ-30% מאלה עם IGT יחזרו לסטאטוס נורמאלי, ואחוז אחר יישאר לאורך זמן בסטאטוס של IGT, אך בערך ב- 40-50% מאלה עם IGT תלך ותדעך הפרשת אינסולין והרגישות לאינסולין, באופן שעלול להתדרדר לקראת הופעת סוכרת type 2 תוך 10 שנים.
פרטים עם IGT עלולים לא להיות מטופלים ברוב המקרים כיוון שמצב זה מאובחן רק לעתים מעטות. ניתן להפחית את הסיכון להופעת IGT על ידי הגדלת הפעילות הגופנית, שמירה על משקל ונתוני BMI תקינים, תוך הקפדה על מזון בריא ודיאטה מאוזנת. אלה המאובחנים עם IGT חייבים להיות מנוטרים על ידי בדיקות לאבחון סוכרת באופן מחזורי.
בשנת 2003 נעשתה הערכה ש-314 מיליוני איש ברחבי העולם (שהיוו אז 8.2% מאוכלוסיית המבוגרים) לוקים ב-IGT, והתחזית היא שבשנת 2025 מספר הפרטים עם IGT יעלה ל-472 מיליון שיהוו אז כ-9% מהאוכלוסייה הבוגרת. האזור של דרום מזרח אסיה הוא כיום מאכלס את המספר הגבוה ביותר של אלה עם IGT, ומספרם שם מגיע ל-93 מיליון המהווים של 13.2% מהאוכלוסייה הבוגרת. באזור מערב האוקיינוס השקט (אוסטרליה וניו-זילנד) והאיים הסמוכים, ישנם 78 מיליון פרטים מתוכם רק 5.7% עם IGT. ההערכה היא שבשנת 2025 יגיע מספר הלוקים ב-IGT בדרום מזרח אסיה ל-13.5% כאשר באירופה יהיו 10.9% מהאוכלוסייה הבוגרת עם מפגע זה.
סקר הבריאות והתזונה הלאומי (NHANES) השלישי שנערך בארה"ב בין השנים 1988-94, בחן 2,844 מבוגרים ללא היסטוריה של סוכרת, לאפשרות שהם לוקים ב-IGT. התברר בסקר זה ש-15.5% מהנסקרים אכן לקו ב-IGT, כאשר לא היה הבדל משמעותי בין גברים ונשים מבחינת אחוז הלוקים בתסמונת זו. סקר בעל אופי דומה (DECODE) שנערך באירופה בקרב כ-25 אלף משתתפים, הראה שרמה מוגברת של גלוקוזה הנמדדת שעתיים לאחר העמסה פומית של 75 גרם סוכר, הייתה גורם סיכון בלתי תלוי למוות טרם-עת. עוד מצא סקר זה שאנשים עם IGT הם בסיכון הגדול ב-50% למות מסיבוכים קרדיו-וסקולאריים במהלך תקופת המעקב של סקר זה, בהשוואה עם בעלי תוצאות תקינות של רמת סוכר.
הכמות המעשית של גלוקוזה בדם היא מאוד קטנה באופן יחסי. לדוגמה, בגבר בריא במשקל של 75 ק"ג עם נפח דם של 5 ליטר, ריכוז גלוקוזה של 100 מיליגרם לד"ל, מייצג כמות כוללת של 5 גרם גלוקוזה בדם. אחת מהסיבות מדוע כמות גלוקוזה היא כה נמוכה, נובעת מכך שעל מנת לאפשר מעבר גלוקוזה אל תוך התאים, סוכר זה עובר שינוי אנזימטי כמו על ידי ריאקציה הקושרת לו שייר פוספאט, או שיירים אחרים המקלים על חדירתו לתאים. מדידת רמת גלוקוזה בשתן פחות שימושית מזו של מדידת הרמה בדם. בתפקוד תקין של כליות אין לגלות סוכר זה בשתן, אלא אם כן נחצה סף הספיגה מחדש של הסוכר בכליות. מדובר ברמות סוכר שהן באופן משמעותי גבוהות יותר מרמות גלוקוזה התקינות בדם, בתרחישים היפרגליקמיים חמורים. יחד עם זאת, כיוון שהשתן מצטבר בשלפוחית השתן, סוכר הנוצר בשלפוחית זו יוסיף לרמת הסוכר בשתן, סוכר שלא בהכרח מבטא את הרמה בדם. לכן ניטור רמות גלוקוזה בדם מועדפת בהרבה, גם מהבחינה הקלינית וגם מבחינת פשטות הניטור.
מדידת גלוקוזה בשתן מהווה אם כך מדד לא מומלץ להערכת סוכרת. סף הכליות התקין לגלוקוזה הוא בריכוז של 180 מיליגרם לד"ל. כאשר רמות גלוקוזה בדם צריכות לעבור סף זה כדי שעודף הסוכר יופרש בשתן. סיבוך נוסף של התמונה נעוץ בעובדה שסף הכליות לגלוקוזה בנבדקים עם סוכרת עולה לעתים ומגיע ל-300 מיליגרם לד"ל. יש מספר מחלות או תרחישים בהם נוצרים מצבים של היפרגליקמיה וגלוקוזוריה כגון ספטיסמיה, עודף קורטיזול, ממאירות בלבלב, גלוקגונומה, פנקראטיטיס חריפה, סומטוסטטינומה, פאוכרומוציטומה, אלדוסטרוניזם ראשוני, היפרתירואידיזם, אוטם חריף של שריר הלב, אקרומגליה או שטף דם במוח. אך יש גם תרחישים בהם יש גלוקוזוריה למרות רמה תקינה של גלוקוזה בדם, כגון הריון (בה יורד סף הכליות לאצירת גלוקוזה), ברככת עמידה לוויטמין D, באוסטאומלציה בה משתבש תפקוד האבוביות הפרוקסימליות, ובמחלת וילסון.
כיוון שמדד של רמת גלוקוזה בשתן הוא אחד מ-11 מדדים הנמדדים באופן שגרתי בבדיקת מקלונים או בדיקת שתן כללית (urinalysis), ניתן לקבל מידע חצי כמותי על רמת הסוכר בשתן, שחשיבותה באלה החשודים לסוכרת, בנבדקים עם אבחנה מוחלטת של סוכרת, או לשלילת חשד לסוכרת באנשים בריאים, או באלה העוברים בדיקות כלליות בקבלה לאשפוז.
מבדק המוגלובין A1C
מבדק זה נועד לקבלת מידע על רמת הסוגר הממוצעת בדם משך תקופת 6-8 השבועות האחרונים. HbA1C הוא למעשה המוגלובין אליו קשור הסוכר גלוקוזה, באופן שרמה מוגברת של גלוקוזה בדם תגדיל מטבע הדברים את אחוז מולקולות החלבון המוגלובין אליו קשור הסוכר. מדובר ברמה ממוצעת של רמת הסוכר בדם לאורך פרק זמן זה, באופן שעלייה חדה לאורך פרק זמן קצר של שעות אחדות או אפילו יום-יומיים ברמת הסוכר אינה בהכרח אמורה להשפיע על רמת HbA1C הנמדדת כידוע אחת לחודשיים-שלושה. לעומת זאת, אי-הקפדה מתמשכת על שמירת רמת גלוקוזה בתחומי הנורמה תעלה את % HbA1C.
רמת HbA1C תקינה באלה ללא סוכרת היא 6% מכלל המוגלובין, והיעד של חולי סוכרת הוא לשמור על רמת HbA1C מתחת ל-6.5% במידת האפשר, אם כי גם שמירה על רף עליון שלא יעלה על 7% נחשבת סבירה. תוצאה של 7.5% מצביעה על הקפדה לא מושלמת של רמת הסוכר בדם, כאשר תוצאות של מעל 8.5% מעידות על הזנחה מוחלטת בנושא. קבוצת המחקר הבריטית בנושא סוכרת הידועה כ-UKPDS ערכה מעקב בן 20 שנה אחר תוצאות המוגלובין A1C בחולי סוכרת type 2, ומסקנתה שעל כל עליה של 1% ברמת HbA1C גדל הסיכון ב-30% לפתח סיבוכים בשלב מאוחר הנובעים מהנזק לכלי-דם קטנים. מעקב דומה בארה"ב אחר אלה עם סוכרת נעורים, הראה יחס ישר בין עלייה ברמת HbA1C והסיכון להופעת סיבוכים מאוחרים.
מצב של קדם-סוכרת (pre-diabetes) מוגדר גם השלב של סבילות פגומה לסוכר (Impaired Glucose Tolerance - IGT). זהו שלב בו רמות גלוקוזה בדם גבוהות מהרמה התקינה, אך עדיין נמוכות מאלה שמוצאים בחולה סוכרת מאובחן. מצב של IGT יכול לנבוע הפרשה לא אופטימאלית של אינסולין, מעמידות או תגובה אופטימאלית להורמון, או משילוב של השניים. באלה עם IGT העלייה ברמת הסוכר בדם לאחר העמסה של 75 גרם, גבוה יותר מזו המתקבלת באנשים בריאים, אם כי אינה כה גבוהה כפי שמוצאים בסוכרת type 2. רמת הסוכר הנלקח בתנאי צום באלה עם IGT עשויה להיות תקינה או מוגברת אך באופן מתון. מצב של IGT עלול להתפתח לסוכרת type 2, ולכן ההתייחסות אליו של ה-ADA היא כאל מצב "קדם-סוכרתי".
הליקוי בכושר ההפרשה של אינסולין באלה עם IGT או בשלבים מוקדמים של סוכרת type 2, נובע מתפקוד לקוי של תאי ביתא בלוטת הלבלב, מה שגורם בטווח הארוך לנזק טוקסי לתאים מפרישי אינסולין אלה, של רמות הסוכר הגבוהות בדם, שעלול לגרום לפגיעה חמורה יותר בתאי ביתא, ולהחמרת סטאטוס הסוכר בדם. יש הכורכים IGT עם שילוב של מספר גורמי סיכון קרדיו-וסקולאריים הידוע כתסמונת מטבולית הכוללת גם יתר לחץ-דם, רמה נמוכה של HDL, רמה גבוהה של טריגליצרידים, רמה שמעל 100 מיליגרם לד"ל גלוקוזה בצום, והשמנה בטנית.
פענוח תוצאות הבדיקה
קריטריונים מעבדתיים לאבחנה של סוכרת
מעבר לתסמינים הקליניים מוגדר מצב של סוכרת כאשר מתקיימים שלושה תנאים:
- מדידת גלוקוזה אקראית עם ערך שמעל 200 מיליגרם לד"ל (בלי קשר למועד הארוחה שלפני דיגום הדם);
- ערך גלוקוזה בצום של 8-10 שעות של 126 מיליגרם לד"ל, לפחות;
- לאחר העמסה פומית של 75 גרם גלוקוזה מומסת במים, ערך גלוקוזה של 200 מיליגרם לד"ל, לפחות. פורמאלית, אבחנת סוכרת תיעשה אם אחד משלושת הקריטריונים האלה חוזר על עצמו פעמיים בשני מועדים שונים, ומדובר בסוגי הסוכרת השונים.
האגודה האמריקנית לסוכרת (ADA) והאגודה האירופית המקבילה (EASD) חלוקות בהמלצותיהן באשר לערכי גלוקוזה תקינים. על פי נתוני ה-ADA משנת 2003 רמות תקינות של גלוקוזה בצום 70-99 מיליגרם לד"ל, בעוד שרמת הסוכר הנלקח בצום בנבדקים קדם-סוכרתיים (pre-diabetes) היא 100-125 מיליגרם לד"ל, ובחולי סוכרת רמת גלוקוזה בדם הנלקח בצום היא מעל 126 מיליגרם לד"ל ביותר ממדידה אחת. על פי המלצת EASD משנת 2006 ערך הסף העליון של גלוקוזה בצום צריך להישאר 110 מיליגרם לד"ל, בעוד שתחום ערכי גלוקוזה של 110-125 מיליגרם לד"ל צריך להגדיר את אלה עם הפרעה ברמת הסוכר בצום (IGF).
מדד אחר הוא של רמת גלוקוזה הנמדדת בדם הנלקח 2 שעות לאחר ארוחה (post prandial): רמה תקינה נחשבת רמת גלוקוזה הנמוכה מ-140 מיליגרם לד"ל באנשים בגיל 50 שנה ומטה, רמה הנמוכה מ-150 מיליגרם לד"ל באנשים בגיל 50-60 שנה, ורמה הנמוכה מ-160 מיליגרם לד"ל באנשים בגיל 60 שנה ומעלה.
רמות סוכר במבדק העמסת סוכר
דגימת דם נלקחת 2 שעות לאחר שתייה של 75 גרם גלוקוזה (לא בהיריון) - תוצאה של פחות מ-140 מיליגרם לד"ל מעידה על רמה תקינה של עמידות (tolerance) לסוכר; תוצאה של 140-199 מיליגרם לד"ל אופיינית לנבדק קדם-סוכרתי עם עמידות פגומה לגלוקוזה (IGT); תוצאה של מעל 200 מיליגרם לד"ל אופיינית לנבדק עם סוכרת. רמה אקראית של גלוקוזה בדם תלויה בסוג הארוחה ובזמן שחלף מהארוחה האחרונה ועד דגימת הדם, ובדרך כלל במצב תקין היא תימצא בתחום שבין 80-120 מיליגרם לד"ל לפני ארוחה או בהשכמה, ובדרך כלל רמה זו תימצא בתחום של 100-140 מיליגרם לד"ל בשעות הערב לפני השינה.
רמות סוכר במבדק העמסת סוכר בו דגימת הדם נלקחה שעה אחת לאחר שתיית 50 גרם גלוקוזה: פחות מ-140 מיליגרם לד"ל מעידה על מצב תקין, כאשר רמת גלוקוזה של מעל 140 מיליגרם לד"ל אינה תקינה. יש הגורסים שסף הרמה העליונה (cutoff) צ"ל 130 מיליגרם לד"ל, כיוון שהוא מזהה 90% מהנשים עם סוכרת הריון, בהשוואה ל-80% המתגלות עם סף עליון של 140 מיליגרם לד"ל.
מבחן העמסת סוכר תוך-ורידי
מבחן זה מתבצע הדרך כלל בנבדקים עם מפגעי ספיגה או באלה שעברו ניתוחי קיבה או מעי קודמים. עירוי גלוקוזה בתמיסת 20% נמשך 30 דקות, כאשר מינון הסוכר הוא 0.5 גרם לק"ג משקל גוף. אנשים לא סוכרתיים יגיבו לעירוי זה ברמות גלוקוזה שבין 200-250 מיליגרם לד"ל, כאשר רמת הסוכר חוזרת לנורמה תוך 90 דקות מהפסקת העירוי. בחולי סוכרת יביא עירוי כזה לעלייה ברמת גלוקוזה בדם לרמות שמעל 250 מיליגרם לד"ל, וגם בסוכרתיים תחזורנה רמות גלוקוזה לרמותיהן בצום כ-90 דקות מהפסקת העירוי. קיימת שיטה חלופית הידועה כשיטת Soskin, בה נעשה עירוי של תמיסת 50% גלוקוזה, למשך 3-5 דקות, במינון סוכר של 0.3 גרם לק"ג משקל גוף.
הוראות לביצוע הבדיקה
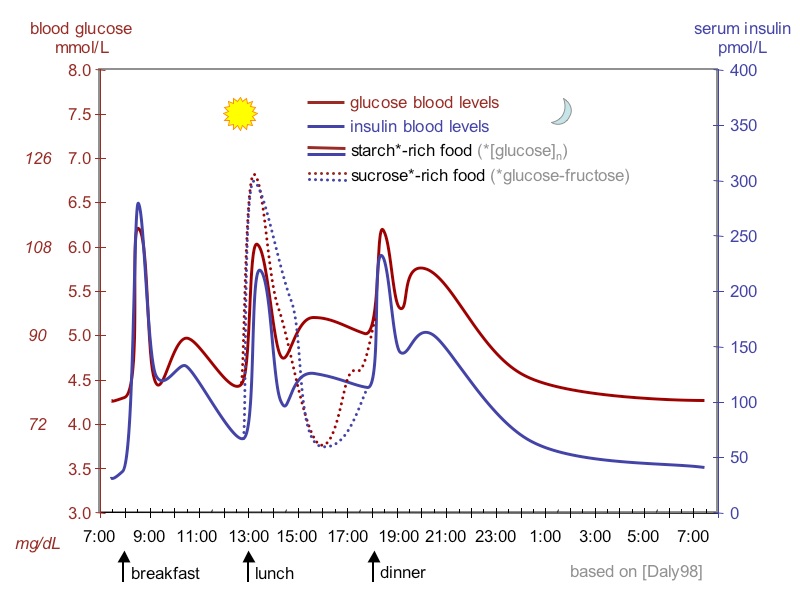
בדיקת רמת גלוקוזה יכולה להתבצע בגישות שונות כגון מדידת סוכר בצום (מקובל צום של 8 שעות ומעלה), מדידת גלוקוזה בשתן, או בנוזל השדרה, מדידת גלוקוזה שעתיים לאחר הארוחה (postprandial), מבחן העמסת סוכר פומי, מבחן העמסת סוכר תוך-ורידי, מבחן ההמוגלובין המסוכר (המוגלובין A1C), מדידה אקראית של סוכר בדם בכל זמן נתון, או מדידה עצמית של רמת סוכר דם בעזרת גלוקומטרים ביתיים. התנאים הסטנדרטיים המומלצים הם צריכה מינימאלית של 150 גרם פחמימות ביום, משך 3 ימים לפני הבדיקה. יש להימנע מפעילות גופנית נמרצת או מעקה נפשית בולטת במידת האפשר ביום שלפני הבדיקה. רצוי שנטילת הדם לצורך בדיקה שגרתית של רמת גלוקוזה תיעשה בשעת בוקר באופן אחיד שכן רמות הסוכר עוברות תמורות משמעותיות לאורך היום כפי שנראה בתמונה
גלוקוזה נמדדת או בדם מלא, וכן בפלזמה או בנסיוב. באופן היסטורי, נמדדו רמות הסוכר בדם מלא, אם כי רוב המעבדות הקליניות מודדות כיום את רמת הסוכר בנסיוב. כיוון שרמת תכולת המים בנסיוב גבוהה זו שבכדוריות האדומות, בהתאם כמות גלוקוזה המומסת בנסיוב גבוהה מזו שניתן למדוד בדם מלא. כדי להעריך בקירוב סביר את כמות הגלוקוזה בנסיוב מנתונים של מדידת סוכר זה בדם מלא, יש להכפיל את התוצאה של רמת גלוקוזה בדם מלא בפקטור של 1.15 כדי לקבל את רמת הסוכר בפלזמה/נסיוב. זו גם הסיבה לתחום ערכי גלוקוזה של 65-95 מיליגרם לד"ל במדידת רמתו בדם מלא, הנמוכה ב-10-20% מרמת הסוכר הנמדדת בנסיוב של אותו נבדק.
איסוף דם במחנה כימית (פקק אדום או צהוב) מותנה בסרכוז ללא שיהוי והפרדה מהירה בין נוזל הנסיוב מהכדוריות השונות, שכן המטבוליזם של גלוקוזה נמשך בכדוריות הדם הלבנות והדומות בטמפרטורת החדר וכך רמתו תרד, באופן שכל עיכוב בפרדת הנוזל מהתאים עלולה לתת תוצאות נמוכות כזובות של רמת הסוכר. בהתאם, גם בנטילת דם במחנת הפארין (פקק ירוק) מתבקשת הפרדה מהירה של הפלזמה מכדוריות הדם. כדוריות דם אדומות אינן זקוקות לאינסולין כדי לקלוט גלוקוזה מהדם ולפרק את הסוכר במסלול הגליקוליזה, ואילו בדגימות דם עם ספירה מוגברת של לויקוציטים, גם תאים אלה ימשיכו לקלוט ולפרק את הסוכר גלוקוזה, ובכך יתרמו לירידה מתמשכת ברמת הסוכר, אם לא יופרד נוזל הדם מהתאים בסרכוז סמוך ככל האפשר לנטילת הדם.
רמת גלוקוזה בנסיוב נותרת יציבה לאחר ההפרדה מהתאים למשך 8 שעות בטמפרטורת החדר, ולמשך 72 שעות במקרר. אם הדם נלקח במבחנת הפארין וההפרדה נעשית מייד, הסוכר יציב בפלזמה למשך 24 שעות בטמפרטורת החדר, שכן מניעת יצירת קריש הדם מפחיתה את הפגיעה במבנה כדוריות הדם, מה שמקטין את המגע עם אנזימים גליקוליטיים בכדוריות עם הסוכר, וכך פוחתת התפרקותו. ניתן להימנע מירידה ברמת גלוקוזה אם נוטלים את הדם ב"מבחנת סוכר" ייעודית, עם פקק אפור, מבחנה המכילה sodium fluoride, חומר המעכב את תהליך הגליקוליזה ומונע פירוק הסוכר. ניתן אף להשתמש ב-iodoacetate לאותה מטרה של מניעת פירוק הסוכר.
חיוני להקפיד על כך שנטילת דם ורידי למדידת רמת גלוקוזה ממטופל המקבל עירוי ורידי תמיסת גלוקוזה, תיעשה מהיד הנגדית לזו בה מתבצע העירוי. אי-הקפדה עלולה לתת תוצאות מוגברות כזובות משמעותית, שכן זיהום של 10% של דגימת דם ורידי שנלקח לא כשורה בעת עירוי תמיסת 5% של סוכר זה, עלולה לתת תוצאה המוגברת ב-500 מיליגרם לד"ל מרמת הסוכר האמיתית של הנבדק. נטילה לא נכונה של דגימת דם ורידי ממי שמקבל בו זמנית עירוי של 5% גלוקוזה, עלולה לתת תוצאה הגבוהה ב-500 מיליגרם לד"ל (!!) מהתוצאה האמיתית של אותו נבדק. נטילת דם ורידי או עורקי, וכן דם נימי (קפילארי) הנלקח בעזרת דוקרן, נותנת ערכים ברי השוואה של רמת גלוקוזה, אם כי מקובל שבדם ורידי רמת גלוקוזה נמוכה ב-10% לערך מזו הנקבעת בדם עורקי או נימי.
לצורך בדיקת רמת גלוקוזה בשתן, ניתן להשתמש בשתן מדגמי-נקודתי, או לבצע איסוף 24 שעות. בכל מקרה חיוני לשמור את השתן מקורר. במקרים של איסוף 24 שעות מומלץ להוסיף למיכל האיסוף חומר משמר (5 מ"ל של חומצה אצטית גלציאלית, או 5 גרם של סודיום בנזואט או סודיום פלואוריד.
לבדיקת גלוקוזה בנוזל השדרה יש לטפל ב-CSF הצלול במידת האפשר ללא השהיה, לאחר סרכוז להרחקת כדוריות דם, באם יש כאלה. עיכוב ביצוע הבדיקה עלול לתת תוצאות נמוכות כזובות. אם מדידת סוכר אינה מתבצעת מייד, יש להקפיא את הנוזל.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק