סומטוסטטין - Somatostatin
| מדריך בדיקות מעבדה | |
| סומטוסטטין | |
|---|---|
| Somatostatin | |
| שמות אחרים | GHIH או Growth hormone-inhibiting hormone, וכן SRIF או Somatotropin release-inhibiting factor או גם SRIH או Somatotropin release-inhibiting hormone |
| מעבדה | אנדוקרינולוגיה בדם |
| תחום | הערכת גידולים נוירואנדוקריניים, תפקוד בלוטות הלבלב ויותרת המוח |
| טווח ערכים תקין | 10-22 פיקוגרם/מ"ל, או בערכי SI-4.26-9.37 פיקומול/לליטר |
| יוצר הערך | פרופ' בן-עמי סלע |
בסיס פיזיולוגי
סומטוסטטין הוא פוליפפטיד בעל תפקיד משמעותי במערך האנדוקריני של מערכת העיכול. השם סומטוסטטין שתרגומו "עיכוב הגוף" נקבע כאשר התגלה סומטוסטטין בתמצית של ההיפותלאמוס במוח, וזוהה בהמשך כהורמון המעכב הפרשת הורמון גדילה (growth hormone) מההיפופיזה. בדיעבד, נמצא שסומטוסטטין מופרש ממספר רקמות כולל בעיקר מבלוטת הלבלב וצינור העיכול, ואף ממספר אזורים במערכת העצבים המרכזית שמחוץ להיפותלמוס. כיום ההתייחסות היא בעיקר לפעילות המעכבת של תהליכים במערכת העיכול. ניתן לסכם פעילות הורמון זה כ"הורמון המעכב הפרשתם של הורמונים רבים אחרים".
סומטוסטטין מיוצר על ידי רקמות אחדות בגוף. הוא נוצר על ידי ההיפותלמוס לשם עיכוב והפרשה לסירוגין של הורמון גדילה (GH) ולחילופין את ההורמון שמעורר את בלוטת התריס (TSH), הורמונים המיוצרים בעצמם על ידי בלוטת יותרת המוח (היפופיזה) וכך משפיע על גדילה וחילוף חומרים. סומטוסטטין מיוצר על ידי הלבלב כדי לעכב ולשחרר לסירוגין את האינסולין והגלוקגון לשם שמירה על רמת סוכר מאוזנת בדם. כמו כן משמש סומטוסטטין כמעכב חזק מאוד של חומרים נוספים במערכת העיכול כולל עיכוב הפרשת חומצה הידרוכלורית בקיבה, ועיכוב תהליכי ספיגת מזון במעיים ושולט כך על תחושת הרעב והשובע.
סומטוסטטין מיוצר ע"י תאים פאראקריניים המפוזרים ברחבי מערכת העיכול, ומעכב הפרשות אנדוקריניות במערכת זו. סומטוסטטין נמצא גם באזורים שונים במערכת העצבים, ומפגין פיקוח עצבי על פעילויות פיזיולוגיות רבות. פיתוחם של אנאלוגים סינתטיים אחדים, הוביל לטיפולים קליניים של מפגעים רבים כמו ענקוּת (acromegaly), גידולים מפרישי-הורמון במערכת העיכול, ודימום שערי (portal) כתוצאה מיתר לחץ-דם.
צורות מולקולאריות
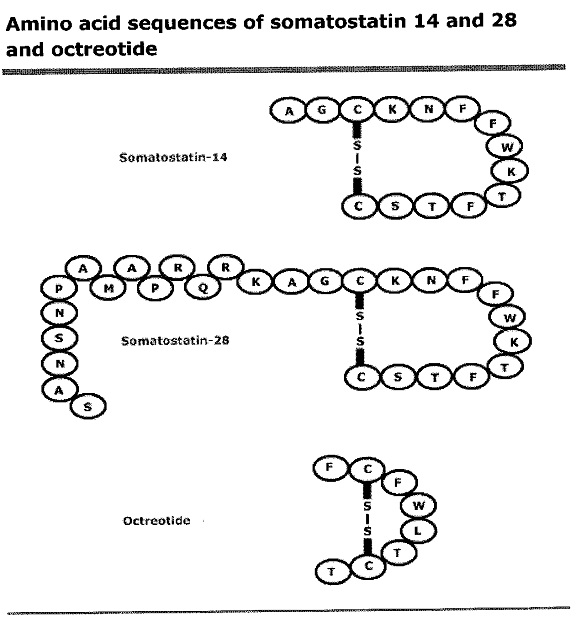
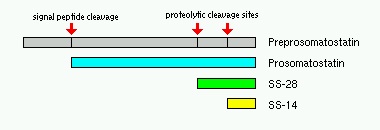
סומטוסטטין פעיל ביולוגית מופיע ב-2 צורות מולקולאריות: סומטוסטטין-14, וסומטוסטטין-28, על פי מספר חומצות האמינו המרכיבות אותו. שתי הצורות הללו, נובעות מתהליכי ביקוע שחלים במולקולת האם, הידועה כ-preprosomatostatin הנחתכת אנזימטית להסרת signal peptide ליצירת prosomatostatin, כאשר האחרון עובר ביקוע פרוטאוליטי נוסף ליצירת SS-28 ו-S-14. סומטוסטטין הוא הורמון ציקלי, כאשר 2 שיירי ציסטאין בעמדות 3 ו-14 ב-SS-14, יוצרים ביניהם קשר די-סולפידי, ליצירת המבנה הציקלי.
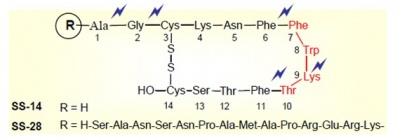
מבנה הורמון זה נשמר היטב במהלך האבולוציה, כאשר SS-14 זהה לחלוטין ל-14 החומצות האמיניות בקצה הקרבוקסילי של SS-28. משקלו המולקולארי של סומטוסטטין-14 הוא 1,638 דלטון ורצף חומצות האמינו שלו הוא:
H-Ala-Gly-Cys- Lys-Asn-Phe-Phe-Trp-Lys-Thr-Phe-Thr-Ser-Cys - OH
הפעילות הביולוגית של סומטוסטטין ממוקמת החלק הטבעתי של ההורמון, כאשר רצף חומצות האמינו פנילאלנין-טריפטופאן-ליזין-תראונין בעמדות 7-10בחלק הטבעתי של הפפטיד חיוני להתקשרות ההורמון לקולטן שלו.
על פי ממצא זה אפשר היה לסנתז פפטידים סינטתיים פעילים אנלוגים של סוממטוסטטין כגון octreotide acetate (הידוע כ-Sandostatin). יצוין שקיים נוירופפטיד בשם קורטיסטטין, הדומה במבנהו לסומטוסטטין, ונקשר לכל סוגי הקולטנים אליהם נקשר האחרון. קורטיסטטין מסוגל להיקשר גם לקולטן של gherlin הידוע גם כ-GHS-R או growth hormone secretagogue receptor, אך עד כה לא התברר התפקיד הפיזיולוגי של נוירופפטיד זה.
הפיזור הרקמתי של סומטוסטטין
סוממטוסטטין נפוץ ברחבי הגוף כולו, ואף נפוץ ברקמה העצבית של ה-cortex, בהיפותלאמוס, בגזע המוח, ובעמוד השדרה. סומטוסטטין מוקם גם בעצבי הלב, בבלוטת התריס, בעור, בעיניים, ובבלוטת ההרת (תימוס). אך מבחינה קלינית משמעותית ביותר נפיצותו במערכת העיכול. 28 SS- דומיננטי יותר במערכת עצבים, ולדוגמה הוא פעיל יותר בערך פי-10 מ-SS-14 בעיכוב הפרשת GH. לעומת זאת, SS-14 הוא דומיננטי בהפרשות הלבלב ובאופן כללי SS-14 נפוץ יותר בצינור העיכול, בה הוא מיוצר בתאים פאראקריניים ואנדוקריניים דמויי-תאי Delta, ובתאי עצב לאורך המעי.
תאים מפרישי סומטוסטטין מגוונים מבחינה מורפולוגית. ברירית המעי, תאי Delta הם דמויי בקבוק ומכילים שלוחות ציטופלזמיות דמיות שלוחות של תאי עצב, דרכן מופרש ההורמון או באופן אנדוקריני לצירקולציה, או על ידי שחרור מקומי ומגע ישיר עם תאים סמוכים. במערכת העצבים המרכזית וההיקפית, עצבים מפרישים סומטוסטטין ושם הוא פועל כפפטיד דמוי נוירו-טרנסמיטור.
בבלוטת הלבלב, סומטוסטטין מיוצר בתאי delta שבאיי לנגרהנס, ותפקידו לחסום את הפרשתם של אינסולין כמו גם של גלוקגון על ידי השפעתו הפאראקרינית על תאים סמוכים. שלושת ההורמונים הללו פועלים בתיאום לפקח על חדירת מרכיבי המזון אל תוך ומחוץ לצירקולציה. הריכוזים היחסיים של שלושת ההורמונים האלה, מווסתים את קצב הספיגה, הניצול והאגירה של גלוקוזה, חומצות אמינו וחומצות שומן. סומטוסטטין אף מדכא את פעולת ההפרשה האקסוקרינית של בלוטת הלבלב, זאת על ידי עיכוב הפרשת אנזימים בתיווך cholecystokinin, וכן על ידי עיכוב הפרשת ביקרבונאט בהשראת secretin.
בנוסף, חיות שטופלו עם נוגדנים לסומטוסטטין הראו רמות מוגברות של הורמון גדילה בפלזמה. יצוין שהפרשת הורמון גדילה מבוקרת על ידי אינטראקציה בין סומטוסטטין לבין ההורמון GHRH המפקח על הפרשת הורמון הגדילה, כאשר סומטוסטטין ו-GHRH מופרשים כאמור על ידי נוירונים בהיפותלאמוס.
מערכת העיכול
סומטוסטטין מופרש על ידי תאים המפוזרים באפיתל הגסטרו-אינטסטינאלי, וכן על ידי נוירונים במערכת העצבים של המעיים. סומטוסטטין ינדוד דרך מערכת הדם השערית (portal) ללב, משם לצירקולציה הסיסטמית, וכך ישפיע על מערכת העיכול. בקיבה, סומטוסטטין פועל על התאים הפארייטאליים (parietal cells) מייצרי החומצה, דרך קישורו לקולטן המזווג עם G-protein להפחית ישירות הפרשת חומצת קיבה. סומטוסטטין מפחית גם באופן בלתי-ישיר הפרשת פפסין חומצת קיבה, על ידי מניעת הפרשתם של הורמונים אחרים כולל gastrin, היסטמין, ,secretin, ו-cholecystokinin, מה שמאט ביעילות את תהליך העיכול.
סומטוסטטין מדכא הפרשה מתאי בתא בבלוטת הלבלב של GIP או gastric inhibitory polypeptide ההורמון המעודד הפרשת אינסולין. סומטוסטטין מפחית את קצב התרוקנות הקיבה,מפחית את התכווצויות השירי החלק במעי ואת תנועת המעיים, מפחית את שפיעת הדם במעיים, כמו גם את התכווצות כיס המרה. במקובץ, חלק גדול מהפעילויות האלו של סומטוסטטין במערכת העיכול, השפעה המקטינה את קצב ספיגת המזון.
המוח
סומטוסטטין מיוצר על ידי נוירונים נוירואנדוקריניים בגרעין הוונטרו-מדיאלי של ההיפותלאמוס. נוירונים אלה מקרינים ל-median eminence, האזור בהיפותלאמוס האחראי להפרשת הורמונים רגולטוריים, ומשם מופרש סומטוסטטין מקצות הנוירונים אל תוך מערכת ה-hypothalamo-hypophysial המעבירה את ההורמון הזה לחלק הקדמי של ההיפופיזה (anterior pituitary gland),שם הוא מעכב הפרשת הורמון גדילה (GH) מהתאים הסומטוטרופים.
הנוירונים מפרישי-סומטוסטטין בגרעין הסב-ונטריקולארי, מתווכים בעצמם השפעות משוב-שלילי של הורמון הגדילה על הפרשת הורמון זה: הנוירונים מפרישי סומטוסטטין מגיבים לריכוזים גבוהים של הורמון גדילה בצירקולציה, על ידי שהם מגבירים הפרשה של סומטוסטין, ובכך מפחיתים את קצב הפרשת הורמון הגדילה.
סומטוסטטין מיוצר כמו כן על ידי אוכלוסיות תאים מוחיים המקרינים לאזורי מוח רבים אחרים. ישנם נוירונים מייצרי סומטוסטטין ב-arcuate nucleus שהוא מִקבץ הנוירונים (ביניהם נוירואנדוקריניים) בחלק המדיו-בזלי של ההיפותלאמוס הסמוך ל-median eminence. נוירונים מייצרי סומטוסטטין מופיעים גם בהיפוקמפוס וב-nucleus of the solitary tract במוח המוארך (medulla oblongata).
בקדמת בלוטת יותרת המוח (היפופיזה) השפעות סומטוסטטין הן: עיכוב הפרשה של הורמון הגדילה, ובכך למעשה פעולה הפוכה לזו של ה-GHRH, וכן עיכוב הפרשה של TSH ושל פרולקטין.
קולטנים לסומטוסטטין
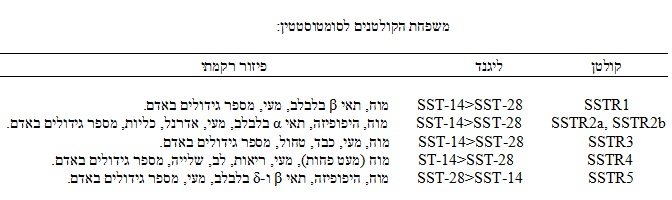
הקולטן להורמון זה הוא קולטן טיפוסי הקשור לחלבון G. עד כה זוהו 5 תת-סוגים של קולטנים (שסימונם 1 עד 5). קולטנים אלה אינם שונים ביניהם באופן בולט בזיקת הקשור אליהם של SS-14 ו-SS-28, אך קיימת שונות ניכרת באופן שנקשרים אליהם פפטידים סינטתיים של ההורמון. כל סוגי הקולטנים הללו נמצאו במוח, ולעומת זאת, רקמות היקפיות שונות ביניהן בסוג קולטן אותו מהם מבטאים.
כל התת-סוגים של הקולטנים לסומטוסטטין, קשורים לעיכוב האנזים adenylate cyclase, דרך חלבון G, ובעקבות קישור זה חל שפעול של הקולטן והפחתה של הצטברות של cAMP. בכמה מתת הסוגים של קולטני סומטוסטטין, אגוניסטים של קולטנים אלה משפעלים תעלות יונים כגון תעלות אשלגן בהיקשרם, ומונעים יציאת סידן מהתאים. הקולטנים 1-4 מראים זיקה גבוהה יותר ל-SS-14, ואילו הקולטן 5 קושר ביתר שאת את SS-28 (ראו טבלה).
קולטנים לסומטוסטטין מסוגלים להגיב ביניהם ליצירת דימרים. באותה מידה יכולים גם קולטנים אחרים להגיב עם הקולטנים של סומטוסטטין ליצירה של heterodimers. לדוגמה, הקולטן ל-dopamine (סוג 2) הקולטן לסומטוסטטין (סוג 5) יכולים להיקשר פיזית ולגוון על ידי כך את האיתות ההורמונלי בתא. היכולת לתקשר בין קולטנים לסומטוסטטין לבין קולטנים לפקטורי גדילה ממשפחת הקולטנים של tyrosine kinase יכולה להיות משמעותית בתהליך הסרטני.
הפרשת סומטוסטטין
סומטוסטטין הוא פפטיד מווסת מרכזי הפועל בראש ובראשונה כמתווך פאראקריני. לאחר שהוא מופרש מתאי עצב, מתאים אנדוקריניים או מתאים אנטרו-אנדוקריניים, יש לו זמן מחצית חיים קצר מאוד (1-4 דקות) ברקמות ובדם. ריכוזו בדם בדרך כלל נמוך מאוד, בסדרי גודל של פחות מפיקומול' בליטר. לאחר הזרקה תוך ורידית שלו לגוף, 50% מכמות הפפטיד המוזרק מתפנה מהצירקולציה תוך פחות מ-3 דקות. הפרשת סומטוסטטין מתרחשת בתגובה למגוון של גירויים. לאחר ארוחה לדוגמה, והפרשת חומצת קיבה, גדלה הפרשת סומטוסטטין מתאי Delta בקיבה. יצירת סומטוסטטין במעי מבוקרת על ידי מערכת העצבים האוטונומית כאשר קטכולאמינים מעכבים אותה, ואילו חומרים כולינרגיים מעודדים את הפרשתו.
הפיזיולוגיה של סומטוסטטין
ההשפעה הפיזיולוגית של סומטוסטטין בגוף היא בעיקרה השפעה מעכבת (ראה טבלה):
באיברים היקפיים, סומטוסטטין מפחית הפרשה אנדוקרינית ואקסוקרינית של הורמונים רבים המצוינים בטבלה הבאה - טבלת הורמונים המעוכבים על ידי סומטוסטטין:
סטומטוסטטין מעכב כמו כן פעילות נוירוטרנסמיטורים במוח, אך בתלות במסלולים המוחיים המושפעים, סומטוסטטין במערכת העצבים המרכזית עשוי דווקא לעודד הפרשה אנדוקרינית. לדוגמה, סומטוסטטין מעכב הפרשת ghrelin מתאים דמויי-X/A ברירית הקיבה, אך במוח שפעול של הקולטן לסומטוסטטין מגביר את רמת ה-ghrelin בפלזמה.
הפרשה מוגברת של סומטוסטטין נדירה יחסית, ואופיינית למקרים של somatostatinoma. מפגע קליני אחרון זה מתאפיין בסוכרת, שלשולים תכופים, steatorrhea, איבוד משקל, היפוכלורידיה וא-כלורידיה, על רקע ספיגה לקויה, ואבני מרה. שלושת תסמינים אלה הם תוצאה ישירה של ההשפעה המעכבת של סומטוסטטין על הפרשת אינסולין, על הפרשה לבלבית אקסוקרינית ועל יכולת הכיווץ של כיס המרה.
האנלוגים של סומטוסטטין
2 אנלוגים עיקריים נמצאים כיום בשימוש:
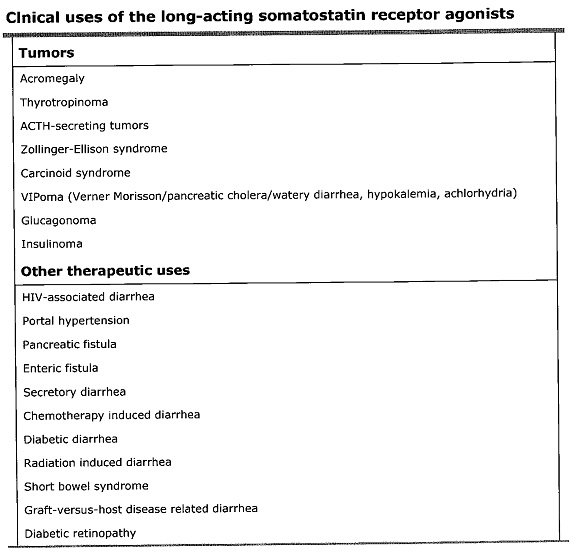
א) octerotide (שם מותג Sandostatin תוצרת Novartis), שסונתז לראשונה על ידי Bauer כבר בשנת 1979, הוא octapeptide הדומה בפעילותו הביולוגית לסומטוסטטין, אך נחשב מעכב יותר יעיל של הורמון הגדילה, גלוקגון, ואינסולין מאשר ההורמון הטבעי, כנראה בעיקר בגלל תקופת מחצית החיים היחסית ארוכה שלו (90 דקות). יחד עם זאת, כיוון שיכולת הספיגה שלו במעי מוגבלת, הוא ניתן בהזרקה תוך-ורידית, או תוך שרירית או תת-עורית. הטיפולים עם octreotide שכיחים בעיקר במקרים של acromegaly ושל תסמונת קרצינואידית. לאחרונה יש שימוש גובר בו במחלות פוליציסטיות של הכבד והכליות.
ב) lanreotide (שם מותג Somatuline תוצרת Ipsen), אושר על ידי ה-FDA לשימוש באוגוסט 2007 בעיקר כתכשיר במקרים של acromegaly ותסמינים הנגרמים מגידולים נוירואנדוקריניים, בעיקר תסמונת קרצינואידית.
המשמעות הטיפולית עם סומטוסטטין
השימוש הקליני בסומטוסטטין כתרופה, לוקה במגבלה קשה: להורמון זה תקופת מחצית חיים מאוד קצרה בצירקולציה (פחות מ-3 דקות). כתוצאה מכך נעשה שימוש ב-octreotide acetate, פפטיד סינטתי המחקה את פעילותו הביולוגית של סומטוסטטין אלא שהוא הרבה יותר יציב שפעילותו בדם שורדת משך 90 דקות. בטבלה הבאה מופיעים תרחישים קליניים שונים בהם נעשה שימוש ב-octreotide:
אנאלוגים של סומטוסטטין (Sandostatin LAR ו-lanreotide-PR) מייצגים פורמולציות של שחרור איטי של האנאלוג המאפשרות טיפול בהזרקה אחת לחודש, והם מאפשרים רמה גבוהה ויציבה של octreotide ו-lanreotide:
סומטוסטטין בטיפול בשלשול הפרשתי (secretory diarrhea):
שלשול הפרשתי הוא ביטוי למגוון של מפגעים, ולדוגמה הדבקה ב-HIV עלולה לגרום לשלשולים מסיביים שעשויים להגיב ל-octerotide על פי מחקרו של Cello ןחב' שהתפרסם ב-Ann Intern Med בשנת 1991. תכשיר זה נוסה במספר מחלות עם שלשול כרוני הפרשתי עם תוצאות בלתי פסקניות.
אחת האינדיקציות המוכחות היא לטיפול באלה עם גידול מסוג VIPoma המפריש vasoactive intestinal polypeptide, תרחיש הידוע גם כ-pancreatic cholera וכן כ-WDHA או watery diarrhea/hypokalemic/achlorhydria. מטופלים אלה עם רמת VIP גבוהה בנסיוב, מגיבים לטיפול עם octreotide. גם מטופלים עם תסמונת קרצינואידית מגיבים היטב ל-octreotide, בכך שהוא מפחית אצלם את תופעת ההסמקה ואת השלשולים האופייניים, זאת על פי Kvols וחב' במאמר ב-N Eng J Med משנת 1986.
תרחישים המשפיעים על רמת סומטוסטטין בדם
הגברה של רמת סומטוסטטין בסוכרת לא מאוזנת, כאשר רמת סומטוסטטין בדם יכולה להיות פי-1,000 יותר גבוהה מהנורמה, מתקבלת בגידול סרטני המייצר פפטיד זה (somatostatinoma), כמו גם ב-ADUPoma (כולל VIPoma,insulinoma, glucagonoma ו-gastrinoma), בקרצינומה מדולארית של התירואיד, pheochromocytoma, כיב בתריסריון, קוליטיס כיבית פעילה, תסמונת המעי הרגיז (IBS), מחלת כבד אלכוהולית. לעומת זאת, הפחתה ברמת סומטוסטטין בדם תתרחש לאחר כריתת עצב תועה (vagotomy), המבוצעת כדי להפחית הפרשת חומצה ופפסין על-ידי הקיבה לריפוי כיב עיכולי. כמו כן הפחתה בסומטוסטטין מתרחשת בהדבקות עיקשות של Helicobacter pylori במצבים של גסטריטיס כרונית.
דימום במערכת העיכול
לסומטוסטטין יש תפקיד חשוב בוויסות שפיעת הדם במעיים. אכן התכשיר octerotide מפחית את שפיעת הדם בקיבה, במעי הדק, במעי הגס, בכבד ובטחול (מה שנהוג לכלול במושג splanchnic circulation), ולכן משתמשים בו לטיפול בדימום גסטרו-אינטסטינאלי.
מפגעי לבלב
מכיוון שסומטוסטטין מעכב הפרשה פארארינית ואנדוקרינית מבלוטה זו, הוצע בשנת 2000 על ידי Andriulli וחב' ב-Gastrointest Endosc לטפל בהורמון זה כדי למנוע פנקראטיטיס בעקבות ביצוע הליך של ERCP. אגוניסטים של הקולטן של סומטוסטטין נחקרו במספר מפגעים של הלבלב, כולל פנקראטיטיס חריפה ומקרי נצור (פיסטולה) לבלבי. אך מחקרים אחדים בנושא של פנקראטיטיס חריפה, לא מצאו יתרון מובהק בשימוש בסומטוסטטין או ב-octreotide לשיפור מצבים של תיעול (drainage) של פיסטולה לבלבית. טיפול זה גם לא הוכח יעיל במקרים של פיסטולה של המעי לעור הבטני (enterocutaneous fistula) כפי שדיווחו Stevens וחב' ב-2011 ב-Europ J Gasroenterol Hepatol. גם Connor וחב' דיווחו ב-2005 ב-Brit J Surg, על מטה-אנליזה לפיה אנאלוגים של סומטוסטטין עשויים אולי להפחית סיבוכים בעקבות ניתוחי לבלב, אך לא להפחית את סך מקרי התמותה במקרים אלה.
שימוש ב-octreotide לדימות אבחוני
רוב הגידולים הנוירו-אנדוקריניים מבטאים על פני התאים קולטנים לסומטוסטטין, מה שמאפשר שימוש ב-octreotide רדיואקטיבי המוזרק לווריד ונקשר לתאים הסרטניים הללו, באופן המאפשר דימות של הגידול. שיטות דימות קונבנציונאליות הכוללות CT, אולטרה-סאונד, אנגיוגרפיה ו-MRI, לעתים אינן יעילות בגילוי גידולים נוירו-אנדוקריניים שהם לעתים קרובות קטנים בממדיהם.
מאז מאמרם החלוצי של Gibril וחב' משנת 1996 על הרגישות הגבוהה יותר של שיטת ה-somatostatin receptor scintigraphy לגילוי שאתות נוירואנדוקריניות, היה פופולארי במיוחד השימוש ב-DTPA-octreotide מסומן באיזוטופ indium-111, או שיטת DOTATOC PET/CT בה נעשה שימוש ב-octreotide מסומן באיזוטופ Galium-68, הנחשבת מדויקת ביותר לזיהוי מיקומם של תאים סרטניים נוירואנדוקריניים בגוף. שיטה נוספת לטיפול בשאת נוירואנדוקריניות ידועה כ-Y90 DOTA, עושה שימוש בהזרקה של octreotide מסומן באיזוטופ Yttrium-90, וכן בהזרקת אנאלוג זה קשור לאיזוטופ lutetium-177.
כ-85% מכלל הגידולים הללו, פרט ל-insulinoma, מכילים קולטנים לסומטוסטטין. בסקירה משנת 2011 של Teunissen וחב' ב-Endocr Relate Cancer, הם עומדים על התנופה הרבה בפיתוח של אנאלוגים נוספים של סומטוסטטין עם זיקה גבוהה יותר לקולטני הורמון זה, וספציפיות שונה לגבי תת קבוצות של קולטני סומטוסטטין ההופכים שימושיים בתחום הרפואה הגרעינית בדימות של גידולים נוירואנדו-קריניים.
עיכוב התפתחות גידולים על ידי סומטוסטטין
סומטוסטטין והאנאלוגים שלו, יכולים להאט את קצב הגידול של מספר גידולים גסטרו-אינטסטינאליים, בעיקר מהסוג הנוירואנדוקריני. ההשפעה האנטי-סרטנית יכולה להיות ישירה ובלתי-ישירה: ההשפעה הישירה על ידי שפעול של קולטנים לסומטוסטטין, גורמת בתאים הסרטניים לבלימת תהליך האפופטוזה באופן ישיר על ידי וויסות של האנזים MAP kinase, ופעילות האנזימים ממשפחת ה-phosphotyrosine phosphatase. ההשפעה הבלתי-ישירה היא על ידי כך שסומטוסטטין מפחית את גידול התאים הסרטניים על ידי עיכוב של התהליך האנגיוגניות והפרשת גורמי גדילה המסייעים לשגשוג הגידול כפי שתיארו Fiorio וחב' בשנת 2008 ב-Front Biosci.
גידולים סולידיים שאינם אנדוקריניים, יכולים לבטא מגוון גדול של תת-סוגים של קולטנים לסומטוסטטין, ואמנם הוצע שאנאלוגים אחרים של הורמון זה, עם מגוון רחב יותר של פעילות של קישור לקולטניו, עשויים להיות יעילים יותר מאשר octreotide או מ-lanneotide בעיכוב תאי סרטן, כפי שמתנבאים Hasskart וחב' ב-2011 ב-Future Oncol.
אנאלוגים של סומטוסטטין מסומנים באיזוטופ רדיואקטיבי, יכולים לשמש להעברת איזוטופים לגידולים סרטניים המכילים קולטנים להורמון. כתוצאה מכך, התקיימו ניסויים קליניים במגוון של ממאירויות. כך לדוגמה Tomassetti וחב' דיווחו בשנת 2000 ב-N Eng J Med על טיפול בקרצינואיד של הקיבה באנאלוג רדיואקטיבי של סומטוסטטין, ובדומה טופל סרטן הכבד באנאלוגים רדיו-אקטיביים של ההורמון על ידי Kouroumalis וחב' (Gut, 1998) ועל ידי Raderer וחב' (Int J Oncol, 2000).
שימושים טיפוליים נוספים של סומטוסטטין
כיוון שלהורמון זה ישנן השפעות אנטי-אנגיוגניות, כמו גם יכול להשרות אפופטוזה בתאי אנדותל, נעשו ניסויים של שימוש באנלוגים של סומטוסטטין לטיפול ברטינופתיה סוכרתית. תוצאות ניסויים בכיוון זה של Lang ב-Ophthalmologe בשנת 2004, כמו גם של Grant ו-Caballero משנת 2005 ב-Treat Endocrinol וכן של Boehm בשנת 2007 ב- Dev Ophthalmol, היו בעלות הצלחה חלקית, אך לא שללו המשך ניסויים בכיוון זה.
היבט אחר הוא של שימוש בסומטוטטין או באנלוגים שלו כחומרים נוגדי-כאב (antinociceptive), במצבים של allodynia (תחושת כאב בתגובה למגע) או של hyperalgesia (תגובת כאב קיצונית לגירוי). ידוע שכאב נוירופתי כתוצאה מפגיעה עצבית, מלווה על ידי הגברה בחשיפת קולטנים שדרתיים המצומדים ל-G-protein, כמו גם פעילות של תעלות יונים המתווכות בהעברת חישות כאב. יחד עם זאת, יש לעתים קרובות פיצוי על ידי הגברת פעילות קולטנים על תאי עצב הכוללים את אלה לסומטוסטטין, המסייעים לשיכוך הכאב. היבט זה של פעילות סומטוסטטין בא לביטוי בסקירותיהם של Taylor משנת 2009 ב-Curr Pain Headache Rep, ושל Pan וחב' משנת 2008 ב-Pharmacol Ther.
הוראות לביצוע הבדיקה
מדידת סומטוסטטין מתבצעת בדרך כלל בשיטת RIA או Direct radioimmunoassay. את הדם יש ליטול בצום של 10-12 שעות, מנבדק שאינו נוטל תרופות מסוג antacid המשפיעות על הפרשת אינסולין, או תכשירים המשפיעים על תנועות המעי (רצוי לפחות 48 שעות לפני הבדיקה). הדם נלקח במבחנה ספירת דם (EDTA, פקק סגלגל), שקוררה קודם לכן, ומכילה מעכב פעילות פרוטאוליטית כגון Trasylol. הסרכוב חייב להתבצע מייד בצנטריפוגה מקוררת, ואת הפלזמה המתקבלת יש להקפיא מייד בטמפרטורה של מינוס 20 מעלות. הפלזמה יציבה לצורך בדיקה זו 6 חודשים בהקפאה.
אין להשתמש במבחנות המכילות נוגדי קרישה אחרים, בדגימות פלזמה שהופאו והופשרו יותר מפעם אחת. אין להשתמש בנסיוב המתקבל משימוש במבחנה כימית (פקק אדום או צהוב). פלזמה המוליטית, ליפמית או איקטרית בדרגות נמוכות (++), אינה פוגעת באיכות הבדיקה.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - מפגעי בלוטת הלבלב
- בדיקות מעבדה - תפקוד בלוטת יותרת המוח
- בדיקות מעבדה - סמנים סרטניים


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק