סונר תוך ניתוחי בניתוחי שד - Ultrasound in breast surgery
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| אולטרסאונד תוך ניתוחי בניתוחי שד | ||
|---|---|---|
| Ultrasound in breast surgery | ||
| יוצר הערך | ד"ר עודד אולשה וד"ר איתמר אשכנזי | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן השד
בשנת 1954, תואר לראשונה בספרות המקצועית, השימוש הקליני באולטרסאונד ככלי עזר לאבחון מחלות שד[1]. בד בבד עם התפתחויות טכניות (מתמרים עם זרוע גמישה, שיפור ברזולוציה ,Grey Scale Real Time !imaging, ועוד), יחד עם מזעור המכשור[2], הפך השימוש באולטרסאונד לכלי חשוב, בו משתמשים אנשי מקצוע רבים: רדיולוגים, גניקולוגים, מיילדים, קרדיולוגים, כירורגים, גםטרואנטרולוגים, רופאי עיניים, אורתופדים ורופאים מרדימים.
כיום משתמשים המנתחים בטכנולוגיה זו להשלמת הבדיקה הקלינית, וככלי עזר בהנחיית ניתוחים לכריתת גידולים בשד. שימוש זה, של ביצוע אולטרסאונד במהלך ניתוח שד, פורסם לראשונה בשנת 1988[3]. בעשור האחרון נערכו בעולם, מספר קורסים בנושא אולטרסאונד שד, המיועדים לא רק לרנטגנולוגים אלא גם למנתחי שד. בנובמבר 2012, נערך קורם בנושא זה גם בישראל, והועבר על ידי בית הספר הבינלאומי לאולטרסאונד של השד (www.ibus.org).
ניתוחים משמרי שד
משנת 1988 ועד היום, פורסמו מאמרים רבים המתארים את השימוש באולטרסאונד תוך ניתוחי, כדי להבטיח כריתת גידולים עם שוליים חופשיים. אנו יודעים כיום, כי אין הבדל בהישרדות לאחר כריתה שלמה של השד, לעומת ניתוח משמר שד[4]. יחד עם זאת, אחד החסרונות הבולטים בניתוח משמר שד, הנו הסיכון לניתוח חוזר, בשל שולי כריתה שאינם חופשיים מגידול. שיעור הניתוחים החוזרים אחרי ניתוח משמר שד יכול להגיע עד ל־41% [5], [6] , [7], [8], [9], [10], [11], [12], [13], [14], [15], [16], [17]. במטרה לצמצם את מספרם של הניתוחים החוזרים, וכדי להפחית את שיעור השוליים הנגועים, הוצעו מספר שיטות ליישום במהלך הניתוח, כגון, בדיקה ידנית של התכשיר, חתך קפוא של השוליים, הערכה פתולוגית של השוליים הניתוחיים, צילום התכשיר, ביצוע אולטרסאונד, וכן שימוש בכלים חדשים וניסויים [18], כולל פיתוח ישראלי[19], שהוכח כיעיל בצמצום היקף הניתוחים החוזרים[20].
השימוש באולטרסאונד
השימוש באולטרסאונד תוך ניתוחי ככלי להבטחת שוליים תקינים, תואר במספר תחומים בנוסף לכירורגיה של השד: כירורגיה הפטוביליארית, ניתוחי לבלב, אורולוגיה, נוירוכירורגיה ועוד [21], [22], [23], [24], [25]. בנוסף, כיום נעשה שימוש באולטרסאונד לצורך אלחוש היחס האנטומי של הגידול לגבעת הפטמה אזורי, המתבצע לא רק על ידי רדיולוגים, אלא גם בהנחיית רופאים מרדימים [26].
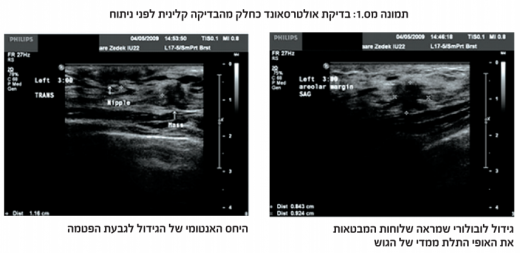
כאשר מדובר כמטופלות עם גוש בשד, מהווה בדיקה זו מימד נוסף, בין אם מדובר בסרטן השד ובין אם מדובר בגידול שפיר[27]. הבדיקה הקלינית מוגבלת פעמים רבות, ותוצאותיה עלולות להיות שגויות, כתוצאה מסמיכות של רקמת השד. הוספת בדיקת אולטרסאונד בהמשך לבדיקה קלינית, נותנת לבודק מידע מדויק על גודל הגוש, צורתו, מיקומו, עומקו ועוד (תמונה 1). בבדיקה זו ניתן ללמוד על האופי התלת ממדי של הגידול -מידע חיוני למנתח.
תפקיד האולטרסאונד בניתוחים משמרי שד
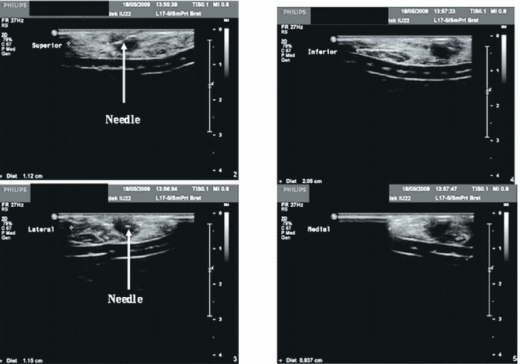
במצב בו מאובחן גידול בשד שאינו ניתן למישוש, יש צורך בהכוונת המנתח לאזור הגידול. עד לאחרונה בוצעה הכוונה כזו, באמצעות מימון הממצא בתיל שמוחדר לגוש בהנחיית אולטרסאונד. במקרה כזה, המנתח מתכנן את החתך ואת הניתוח על פי צילומי רנטגן, לפי המקום המשוער של הגידול, אך הוא אינו יכול לזהות את הגידול עצמו, או לראות אותו. כאשר ניתן לזהות את הגידול בקלות בעזרת אולטרסאונד, השימוש בטכנולוגיה זו במהלך הניתוח, יכול לסייע בתכנון החתך והניתוח, הן כאשר מדובר בגידולים נמושים, והן כאשר ישנם גידולים שאינם ניתנים למישוש.
שימוש באולטרסאונד מאפשר הערכה של רוחב השוליים מיד לאחר הכריתה על שולחן הניתוחים (תמונה 2). לאחרונה פורסמה עבודה לפיה המנתח יכול לרכוש בקלות את הכישורים הדרושים להפעלת אולטרסאונד תוך ניתוחי, בכריתת גידולים הניתנים למישוש, לפיכך ניתן להגיע לתוצאה אופטימלית לאחר עקומת למידה של שני ניתוחים בלבד[28].
השפעת השימוש באולטדםאונד תוך ניתוחי לפי הספרות המקצועית
קיימים כיום שני מחקרים פרוםפקטיבים רנדומלים שהשוו בין שימוש באולטרסאונד ושימוש במישוש בלבד, שהצביעו על יתרון משמעותי לשימוש באולטרסאונד: טכנולוגיה זו מצמצמת את שיעור השוליים המעורבים בגידול, ולכן הצורך בניתוחים חוזרים, פוחת, ובנוסף נפח הכריתה קטן יותר [29] , [30]. המחקרים הללו מתווספים למחקרים רטרוספקטיביים אחרים, שהראו תוצאות דומות [31], [32], [33], [34].
לגבי גידולים שאינם ניתנים למישוש, קיים מחקר פרוםפקטיבי רנדומלי אחד[35] בלבד, שהראה יתרון מובהק לטובת השימוש באולטרסאונד. במאמר אחר, פורסמה מטאנליזה שבדקה את כל המחקרים הרטרוםפקטיביים ההשוואתיים. נמצא הבדל משמעותי בשימוש באולטרסאונד תוך ניתוחי, בשיעור השוליים המעורבים, עם סיכון יחסי של 0.52%, לעומת כריתה שבוצעה בהנחיית תיל בלבד [36]. ישנה גם עדות שהשימוש באולטרסאונד במהלך הניתוח יעיל יותר משימוש בזירעונים רדיואקטיביים לסימון גושים שלא ניתן למשש [37] - שיטה בעייתית בשל הצורך במציאת הזירעון ברקמה שהוצאה, ולאחר מכן טיהור וסילוק הזירעון הרדיואקטיבי. בנוסף ליעילות האולטרסאונד התוך ניתוחי, קיימים מספר יתרונות נוספים על פני סימון עם תיל: היעדר תלות ברדיולוג וצורך לתאם ולתזמן פרוצדורות, הפחתת עלויות של הסימון כולל הציוד הנדרש לפרוצדורה, וכן מניעת אי הנוחות הכרוכה בקיומו של התיל בשד, עד למועד הניתוח וכן הקרינה הנוספת הדרושה בצילום לאחר הסימון[38].
שימוש באולטרסאונד בשערי צדק
במרכז הרפואי שערי צדק נעשה שימוש באולטרסאונד תוך ניתוחי מאז 2008. שיעור הניתוחים החוזרים במהלכן מתבצעות כריתות בגין קרצינומות של השד(למעט בגידולים מסוג Ductal Carcinoma in Situ טהור), ירד מ-% 11 לפני השימוש באולטרסאונד תוך ניתוחי, ל-7% בלבד, לאחר השימוש בשיטה זו(השוואה רטרוספקטיבית) [32]. בבדיקת ביצוע הניתוחים בהם נעשה שימוש באולטרסאונד תוך ניתוחי, הגדרנו את הצורך ברווח של שוליים םונוגרפיים בגודל של 0.5 סנטימטר כדי להשיג שוליים היםטולוגיים של 0.2 סנטימטר, ב-95% מהבריתות כאשר מדידת השוליים נעשתה ע״י המנתח על שולחן הניתוחים, לאחר כריתת הגוש [32]. הממצאים שלנו לא אומתו במחקר עם אוכלוסייה של מטופלות עם נתונים דומים למטופלות שלנו על ידי קבוצה אחרת, אבל במחקר ההוא נעשה שימוש באולטרסאונד, על מנת למדוד את השוליים רק לאחר הוצאת הגוש, ולא במהלך הניתוח; נוסף על כך, בדיקת השוליים נעשתה על ידי רדיולוג ולא על ידי המנתח על שולחן הניתוחים [39].
קריטריונים להצלחת השימוש באולטדסאונד תוך ניתוחי ופרטים טכניים
תנאי בסיסי לשימוש באולטרסאונד תוך ניתוחי, הוא היכרות עם הציוד והדרכה נכונה על אופן השימוש בו. במידה ואין מכשיר אולטרסאונד ייעודי לניתוחי שד, נחוץ שיתוף פעולה עם רדיולוגים, מרדימים ומנתחי כלי דם שלהם מכונות אולטרסאונד.
תנאי טכני נוסף, הנו זמינות המכשיר לשימוש בחדר הניתוחים. כמו כן קיים תנאי הכרחי נוסף, הדרוש על מנת להסתמך על אולטרסאונד תוך ניתוחי, ללא שימוש במחטי סימון: הדמייה של הגוש על ידי המנתח מראש
^ט^וגיח£שד-^רר נזתוי)ינמס. דגימות ;65*9-201201»»201201
Sentinel Node 500/1 4991/10 Blue 4־ Sentinel Node 300/1 2843/10 Blue *5 Sentinel Node 200/1 1695/10 Blue-4 Sentinel Node 190/1 1SB0/10 Blue ■7 פתו&וני KSOC 59»1 בדיקה טאקחוסקופית |
דוח פתולוגי 0ופי שמכיל את נתוני המדידה באולטרסאונד (מומלץ לבדוק את החולה במרפאה), ותיעוד הממצאים בתמונות שהתקבלו מבדיקת האולטרסאונד. חשוב לזכור שבדיקת אולטרסאונד על ידי המנתח איננה בדיקה אבחנתית, אלא היא בגדר בדיקה ממוקדת לזיהוי התהליך הפתולוגי בו צריך לטפל (אבחון הוא תפקידו של הרדיולוג). אחת הבעיות המוכרות במהלך הניתוח היא בעיית הסימון, בין אם מדובר בציור על העור, ובין אם מדובר במחט סימון: ברגע שהעור נפתח, נפתחים גם הליגמנטים ע״ש קופר (סיבי התמיכה המעניקים לשד את צורתו הזקופה) והקשר בין החלקים השונים של
■nil WNS Avnu. 1u1 ^״
הרקמה, נעלם. חשיבות האולטרסאונד התוך ניתוחי הנו הדמיית הגידול בחדר הניתוח המאפשרת למנתח לתכנן את החתך הניתוחי. זהו כלי עזר המסייע למנתח בתכנון המשך מהלך הניתוח [תמונה 3] [35].
בתום הכריתה, עם הוצאת הגוש ורקמת השד שנכרתה סביבו, יכול המנתח להעריך (תוך כדי ניתוח), את מרחק החתך הכירורגי מהגוש הגידול׳, ולהחליט האם יש צורך בכריתה נוספת של שוליים. כריתת השולים נעשית באותו ניתוח, דבר שלדעתנו, הרופאים המטפלים, מדויק יותר מניתוח חוזר, בשל שוליים נגועים המתגלים בהערכה סופית
תמונה מ4.0: המתנזר התוך ניתוחי
בפתולוגיה. על פי ניסיוננו הנממך על המחקר, על מנת לקבל תוצאה אופטימלית, יש לוודא כי המרחק הנמדד באולטרסאונד, יהיה מעל 0.5 0״מ [32]. בבדיקה לאחר הוצאת התכשיר, ניתן להרחיב את הכריתה בכיוונים הרצויים, לפי בדיקת האולטרסאונד החוץ גופית, באופן מדויק יותר מאשר בניתוח חוזר, כאמור, בגלל שוליים נגועים. ניתן לתעד את המדידות בהפנייה לבדיקה פתולוגית, המחייבת התייחמות מצד הפתולוגים לשולי הכריתה, בדו׳׳ח הפתולוגי המופי [תמונה 4]. בשלבי הלימוד הראשונים, אנו ממליצים למנתח להשתמש באולטרסאונד תוך ניתוחי, בשילוב עם תיל מימון, עד לצבירת ניסיון המאפשר לזנוח את תיל המימון בגידולים לא נמושים, שנראים בבירור באולטרסאונד. ניתן ואף רצוי להשתמש בטכנולוגיה זו במהלך הניתוח, גם כאשר מדובר בגידולים שניתנים למישוש, שכן לא תמיד אנו מדייקים בשאלת מיקום השוליים.
תמונה מ3.0: השימוש במתמר ייעודי(intraoperative probe) בתוך פצע הניתוח יחד עט התמונה שנראית על מ0ך מכונת האולטרטאונד
סיכום האולטרסאונד התוך ניתוחי נותן למנתח מימד נוסף בטיפול הכירורגי בסרטן שד. לפי כל העדויות, הן במחקרים פרוםפקטיביים והן במחקרים רטרוספקטיביים, השימוש באולטרסאונד במהלך הניתוח, משפר את היכולת להשיג שולי כריתה תקינים, שאינם מעורבים בגידול. נוסף על כך השימוש בהדמייה זו, יעיל גם במקרים של גידולים שאינם נמששים, ויכול להחליף את הסימון המקובל בתיל. נוסף על יתרונות אלה, המכשור נמצא בהישג יד, והטכנולוגיה קלה ללמידה.
39. Londero V, Zuiani C, Panozzo M, Linda A, Girometti R, Bazzocchi M. Surgical specimen ultrasound: is it able to predict the status of resection margins after breast-conserving surgery? Breast. 2010;19:532-537.
ביבליוגרפיה
- ↑ Wild JJ, Reid JM. Echographic visualization of lesions of the living intact human breast. Cancer Res. 1954;14:[4] 277-82.
- ↑ Woo J. A short History of the development of Ultrasound in Obstetrics and Gynecology. http://www.ob-ultrasound.net/history1.html
- ↑ Schwartz GF, Goldberg BB, Rifkin MD, D'Orazio SE. Ultrasonography: an alternative to x-ray-guided needle localization of nonpalpable breast masses. Surgery 1988;104:870-873.
- ↑ Yang SH, Yang KH, Li YP, et al. Breast conservation therapy for stage I or stage II breast cancer: a meta-analysis of randomized controlled trials. Ann Oncol. 2008;19:1039-1044.
- ↑ Smitt MC, Nowels K, Carlson RW, Jeffrey SS. Predictors of reexcision findings and recurrence after breast conservation. Int J Radiation Biol Phys 2003; 57(4):979-985.
- ↑ Freedman G, Fowble B, Hanlon A, Nicolaou N, Fein D, Hoffman J, Sigurdson E, Boraas M, Goldstein L. Patients with early stage invasive cancer with close or positive margins treated with conservative surgery and radiation have an increased risk of breast recurrence that is delayed by adjuvant systemic therapy. Int J Radiation Oncology Biol Phys 1999; 44:1005-1015.
- ↑ Leong C, Boyages J, Jayasinghe UW, Bilous M, Ung 0, Chua B, Salisbury E, Wong AY. Effect of margins on ipsilateral breast tumor recurrence after breast conservation therapy for lymph node-negative breast carcinoma. Cancer. 2004; 100:1823-1832.
- ↑ Anscher MS, Jones P, Prosnitz LR, Blackstock W, Hebert M, Reddick R, Tucker A, Dodge R, Leight G Jr, Iglehart JD, Rosenman J. Local failure and margin status in early-stage breast carcinoma treated with conservation surgery and radiation therapy. Ann Surg. 1993; 218:22-28.
- ↑ Ghossein NA, Alpert S, Barba J, Pressman P, Stacey P, Lorenz E, Shulman M, Sadarangani GJ. Breast cancer. Importance of adequate surgical excision prior to radiotherapy in the local control of breast cancer in patients treated conservatively. Arch Surg. 1992;127:411-415.
- ↑ Ooi CW, Serpell JW, Rodger A. Tumour involvement of the re-excision specimen following clear local excision of breast cancer with positive margins. ANZ J Surg. 2003;73:973-974.
- ↑ Jenkinson AD, Al-Mufti RA, Mohsen Y, Berry MJ, Wells C, Carpenter R. Does intraductal breast cancer spread in a segmental distribution? An analysis of residual tumour burden following segmental mastectomy using tumour bed biopsies. Eur J Surg Oncol. 2001; 27:21-25.
- ↑ Heimann R, Powers C, Halpem HJ, Michel AG, Ewing CA, Wyman B, Recant W, Weichselbaum RR. Breast preservation in stage I and II carcinoma of the breast. The University of Chicago experience. Cancer. 1996; 78:1722-1730.
- ↑ Solin LJ, Fowble BL, Schultz DJ, Goodman RL. The significance of the pathology margins of the tumor excision on the outcome of patients treated with definitive irradiation for early stage breast cancer. Int J Radiat Oncol Biol Phys. 1991; 21:521-522.
- ↑ Park CC, Mitsumori M, Nixon A, Recht A, Connoly J, Gelman R, Silver B, Hetelekidis S, Abner A, Harris JR, Schnitt SJ. Outcome at 8 years after breast conserving surgery and radiation therapy for invasive breast cancer: influence of margin status and systemic therapy on local recurrence. J Clin Oncol 2000; 18:1668-1675.
- ↑ Dooley WC, Parker J. Understanding the mechanisms creating false positive lumpectomy margins. Am J Surg 2005; 190:606-608.
- ↑ Ohsumi S, Sakamoto G, Takashima S, Koyama H, Shin E, Suemasu K, Nishi T, Nakamura S, lino Y, Iwase T, Ikeda T, Teramoto S, Fukutomi T, Komaki K, Sano M, Sugiyama K, Miyoshi K, Kamio T, Ogita M. Long-term results of breast-conserving treatment of early-stage breast cancer in Japanese Women from multicenter invastigation. Jpn J Clin Oncol 2003; 33:61-67.
- ↑ Renton SC, Gazet JC, Ford HT, Corbishley C, Sutcliffe R. The importance of the resection margin in conservative surgery for breast cancer. Eur J Surg Oncol 1996; 22:17-22.
- ↑ Pleijhuis RG, Graafland M, de Vries J, Bart J, de Jong JS, van Dam GM. Obtaining adequate surgical margins in breast-conserving therapy for patients with early-stage breast cancer: current modalities and future directions. Ann Surg Oncol. 2009;16:2717-2730.
- ↑ Kami T, Pappo I, Sandbank J, Lavon O, Kent V, Spector R, Morgenstern S, Lelcuk S. A device for real-time, intraoperative margin assessment in breast-conservation surgery. Am J Surg. 2007;194:467-473.
- ↑ Allweis TM, Kaufman Z, Lelcuk S, Pappo I, Kami T, Schneebaum S, Spector R, Schindel A, Hershko D, Zilberman M, Sayfan J, Berlin Y, Hadary A, Olsha 0, Paran H, Gutman M, Carmon M. A prospective, randomized, controlled, multicenter study of a real-time, intraoperative probe for positive margin detection in breast-conserving surgery. Am J Surg. 2008;196:483-489.
- ↑ Zacherl J, Scheuba C, Inhof M, Zacherl M, Langle F, Pokieser P, et al. Current value of intraoperative sonography during surgery for hepatic neoplasms. World J Surg 2002;26:550-554.
- ↑ Falconi M, Bettini R, Boninsegna L, Crippa S, Butturini G, Pederzoli P. Surgical strategy in the treatment of pancreatic neuroendocrine tumors. JOP 2006;7:150-156.
- ↑ Doerfler A, Cerantola Y, Meuwly JY, Lhermitte B, Bensadoun H, Jichlinski P . Ex vivo ultrasound control of resection margins during partial nephrectomy. J Urol. 2011;186:2188-2193.
- ↑ Shinoura N, Takahashi M, Yamada R. Delineation of brain tumor margins using intraoperative sononavigation: implications for tumor resection. J Clin Ultrasound. 2006;34:177-183.
- ↑ Kodama M, Khanal A, Habu M, Iwanaga K, Yoshioka 1, Tanaka T Morimoto Y, Tominaga K. Ultrasonography for intraoperative determination of tumor thickness and resection margin in tongue carcinomas. J Oral Maxillofac Surg. 2010;68:1746-1752.
- ↑ Marhofer P, Harrop-Griffiths W, Kettner SC, Kirchmair L. Fifteen years of ultrasound guidance in regional anaesthesia: part 1. Br J Anaesth. 2010;104:538-546.
- ↑ Whitehouse PA, Baber Y, Brown G, Moskovic E, King DM, Gui GP. The use of ultrasound by breast surgeons in outpatients: an accurate extension of clinical diagnosis. Eur J Surg Oncol. 2001 ;27:611616.
- ↑ Krekel NM, Lopes Cardozo AM, Muller S, Bergers E, Meijer S, van den Tol MP. Optimising surgical accuracy in palpable breast cancer with intra-operative breast ultrasound-feasibility and surgeons' learning curve. Eur J Surg Oncol. 2011;37:1044-50.
- ↑ Moore MM, Whitney LA, Cerilli L, Imbrie JZ, Bunch M, Simpson VB, Hanks JB. Intraoperative ultrasound is associated with clear lumpectomy margins for palpable infiltrating ductal carcinoma. Ann Surg 2001; 233:761-768.
- ↑ Krekel NM, Haloua MH, Lopes Cardozo AM, de Wit RH, Bosch AM, de Widt-Levert LM, Muller S, van der Veen H, Bergers E, de Lange de Klerk ES, Meijer S, van den Tol MP. Intraoperative ultrasound guidance for palpable breast cancer excision (COBALT trial): a multicentre, randomised controlled trial. Lancet Oncol. 2013;14:48-54.
- ↑ Eichler C, Hubbel A, Zarghooni V, Thomas A, Gluz O, Stoff-Khalili M, Warm M. Intraoperative ultrasound: improved resection rates in breast-conserving surgery. Anticancer Res 2012; 32: 1051-56.
- ↑ Olsha O, Shemesh D, Carmon M, Sibirsky O, Abu Dalo R, Rivkin L, Ashkenazi I. Resection margins in ultrasound guided breast conserving surgery. Ann Surg Oncol, 2011; 18:447-452.
- ↑ Fisher CS, Mushawah FA, Cyr AE, Gao F, Margenthaler JA. Ultrasound-guided lumpectomy for palpable breast cancers. Ann Surg Oncol 2011; 18: 3198-203.
- ↑ Davis KM, Hsu CH, Bouton ME, Wilhelmson KL, Komenaka IK. Intraoperative ultrasound can decrease the re-excision lumpectomy rate in patients with palpable breast cancers. Am Surg 2011 ;77:720-725.
- ↑ Rahusen FD, Bremers AJ, Fabry HF, van Amerongen AH, Boom RP, Meijer S. Ultrasound-guided lumpectomy of nonpalpable breast cancer versus wire-guided resection: a randomized clinical trial. Ann Surg Oncol. 2002;9:994-998.
- ↑ Ahmed M, Douek M. Intra-operative ultrasound versus wire-guided localization in the surgical management of non-palpable breast cancers: systematic review and meta-analysis. Breast Cancer Res Treat. 2013;140:435-446.
- ↑ Krekel NM, Zonderhuis BM, Stockmann HB, et al. A comparison of three methods for nonpalpable breast cancer excision. Eur J Surg Oncol 2011 ;37:109-115.
- ↑ Thompson M, Klimberg VS. Use of Ultrasound in Breast Surgery. Surg Clin N Am 2007;87: 469-484.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר עודד אולשה - המרכז הרפואי שערי צדק, ירושלים, וד"ר איתמר אשכנזי - המרכז הרפואי הלל יפה, חדרה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק