הבדלים בין גרסאות בדף "סרטן הכליה - טיפול במחלה גרורתית - Renal cancer - treatment of metastatic disease"
יאיר שוורץ (שיחה | תרומות) |
יאיר שוורץ (שיחה | תרומות) |
||
| שורה 24: | שורה 24: | ||
*'''[[השמנת יתר]]''' {{הערה|שם=הערה6| van Dijk BA, Schouten LJ, Kiemeney LA, et al. Relation of height, body mass, energy intake, and physical activity to risk of renal cell carcinoma: results from the Netherlands Cohort Study. Am J Epidemiol 2004;160:1159-1167}} {{הערה|שם=הערה7| Bjørge T, Tretli S, Engeland A. Relation of height and body mass index to renal cell carcinoma in two million Norwegian men and women. Am J Epidemiol 2004;160:1168-1176}} | *'''[[השמנת יתר]]''' {{הערה|שם=הערה6| van Dijk BA, Schouten LJ, Kiemeney LA, et al. Relation of height, body mass, energy intake, and physical activity to risk of renal cell carcinoma: results from the Netherlands Cohort Study. Am J Epidemiol 2004;160:1159-1167}} {{הערה|שם=הערה7| Bjørge T, Tretli S, Engeland A. Relation of height and body mass index to renal cell carcinoma in two million Norwegian men and women. Am J Epidemiol 2004;160:1168-1176}} | ||
*'''[[יתר לחץ דם]]''': לאחרונה מדברים על קושי להבחין בין סיכון של לחץ דם גבוה לשימוש בתרופות נוגדות לחץ דם, כגון משתנים{{הערה|שם=הערה8| Corrao G, Scotti L, Bagnardi V, et al. Hypertension, antihypertensive therapy and renal-cell cancer: a meta-analysis. Curr Drug Saf 2007;2:125-133}}{{הערה|שם=הערה9| McCredie M, Pommer W, McLaughlin JK, et al. International renal-cell cancer study. II. Analgesics. Int J Cancer 1995;60:345-349 }} | *'''[[יתר לחץ דם]]''': לאחרונה מדברים על קושי להבחין בין סיכון של לחץ דם גבוה לשימוש בתרופות נוגדות לחץ דם, כגון משתנים{{הערה|שם=הערה8| Corrao G, Scotti L, Bagnardi V, et al. Hypertension, antihypertensive therapy and renal-cell cancer: a meta-analysis. Curr Drug Saf 2007;2:125-133}}{{הערה|שם=הערה9| McCredie M, Pommer W, McLaughlin JK, et al. International renal-cell cancer study. II. Analgesics. Int J Cancer 1995;60:345-349 }} | ||
| − | *'''[[מחלות כליה]]''', כגון: מחלת כליות סופנית (End stage renal disease) ומחלה ציסטית נרכשת של הכליה (Aquired renal cystic disease). | + | *'''[[מחלות כליה]]''', כגון: [[מחלת כליות סופנית]] (End stage renal disease) ומחלה ציסטית נרכשת של הכליה (Aquired renal cystic disease). {{כ}}{{הערה|שם=הערה10| Ishikawa I, Saito Y, Asaka M, et al. Twenty-year follow-up of acquired renal cystic disease. Clin Nephrol 2003;59:153-159}} וטוברוס סקלרוזיס (Tuberous sclerosis) {{כ}}{{הערה|שם=הערה11| Farivar-Mohseni H, Perlmutter AE, Wilson S, et al. Renal cell carcinoma and end stage renal disease. J Urol 2006;175:2018-2020}}{{הערה|שם=הערה12| Rakowski SK, Winterkorn EB, Paul E, et al. Renal manifestations of tuberous sclerosis complex: Incidence, prognosis, and predictive factors. Kidney Int 2006;70:1777-1782}} |
| − | 3 | + | 2-3% מהמקרים הם על רקע גנטי משפחתי. תוארו כמה תסמונות אוטוזומליות דומיננטיות, כל אחד על בסיס גנטי ופנוטיפי שונה. זוהו ארבעה סוגים של RCC תורשתי אשר קשורים למוטציות גנטיות{{הערה|שם=הערה13| Linehan WM, Walther MM, Zbar B. The genetic basis of cancer of the kidney. J Urol 2003;170:2163–2172 }}{{הערה|שם=הערה14| Vira MA, et al. Genetic basis of kidney cancer: a model for developing molecular-targeted therapies. BJU Int 2007;99:1223–1229 }}: תסמונת וון היפל-לינדאו (Von hippel-lindau - VHL){{כ}}{{הערה|שם=הערה15| Maher ER. Inherited renal cell carcinoma. Br J Urol 1996;78:542-545 }}{{הערה|שם=הערה16| Latif F, Tory K, Gnarra J, et al. Identification of the von Hippel-Lindau disease tumor suppressor gene. Science 1993;260:1317-1320}}{{הערה|שם=הערה17| Gudbjartsson T, Jónasdóttir TJ, Thoroddsen A, et al. A population-based familial aggregation analysis indicates genetic contribution in a majority of renal cell carcinomas. Int J Cancer 2002;100:476-479}} הינה הבולטת ביותר (1 ל- 36,000 לידות). המחלה מאופיינת בהתפתחות גידולים וסקולריים, כולל RCC, [[פאוכרומוציטומה]], [[המנגיובלסטומה]] של מערכת העצבים המרכזית. ביותר מ- 70% מחולי RCC מסוג תאים בהירים(Clear cell) שלא על רקע תורשתי נמצא פגם בגן VHL. |
זוהו ארבעה דפוסי מחלה בעלי אפיון גנטי שונה. | זוהו ארבעה דפוסי מחלה בעלי אפיון גנטי שונה. | ||
גרסה מ־12:52, 28 ביולי 2013
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| סרטן הכליה - טיפול במחלה גרורתית | ||
|---|---|---|
| Renal cancer - treatment of metastatic disease | ||
| יוצר הערך | ד"ר ויקטוריה ניימן 
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – סרטן הכליה, סרטן במערכת השתן
בטיפול בסרטן כליה חלו תמורות שונות. חידושים בכירורגיה האורולוגית הביאו להפחתה ניכרת בשיעורי התחלואה. הגישה פחות פולשנית מבעבר, ולכן היעילות הטיפולית השתפרה. נוסף על כך, הבנת המנגנונים הביולוגיים העומדים בבסיס הפתולוגיה, הביאה לשינוי דרמטי בדפוסי הטיפול האונקולוגי. טיפולים ביולוגיים המכוונים לגורם הגדילה של אנדותל כלי הדם (Vascular endothelial growth factor - VEGF) והמסלולים הביולוגיים שבהם הוא מעורב, הביאו להגברת היעילות הטיפולית ולשינוי התפיסה הטיפולית. בהתבסס על מחקרים אקראיים רבים, תרופות ממשפחת ה- Anti-VEGF, כגון: Avastin (Bevacizumab), Nexavar (Sorafenib)ו- Sutent (Sunitinib) ותרופות ממוקדות ל- mTOR (Mammalian target of rapamycin), כגון: Torisel (Temsirolimus) ו- Certican (Everolimus) הוכיחו שיפור משמעותי בזמן התקדמות המחלה וחלקם גם בהישרדות כללית. למרות המנגנון הממוקד קיים פרופיל רעילות רחב. דבר זה דורש אבחון מוקדם וטיפול מהיר כדי לאפשר לחולה לקבל טיפול מיטבי עם מינימום פגיעה באיכות החיים.
מבוא
סרטן הכליה (Renal cell carcinoma - RCC) מהווה כ- 3-5% מכלל הגידולים במבוגרים, השביעי בשכיחות בקרב גברים ושמיני בקרב הנשים[1]. בשנת 2009 אובחנו בארה"ב 57,760 מקרים חדשים של RCC, כ- 12,980 מתוכם צפויים למות מהמחלה. הגיל החציוני לאבחנה הינו 65, שכיחות RCC גדלה עם הזמן. שיעור ההישרדות ל- 5 שנים עומד על 69.4%.
גורמי סיכון
- מין: בעבר דווח RCC כבעל שכיחות של כפליים לפחות אצל גברים לעומת נשים. עם זאת, הנתונים האחרונים מראים כי הפער הזה הצטמצם [2] [3]
- עישון: סיכון יחסי של עד פי 2 לעומת לא מעשנים [4][5]
- השמנת יתר [6] [7]
- יתר לחץ דם: לאחרונה מדברים על קושי להבחין בין סיכון של לחץ דם גבוה לשימוש בתרופות נוגדות לחץ דם, כגון משתנים[8][9]
- מחלות כליה, כגון: מחלת כליות סופנית (End stage renal disease) ומחלה ציסטית נרכשת של הכליה (Aquired renal cystic disease). [10] וטוברוס סקלרוזיס (Tuberous sclerosis) [11][12]
2-3% מהמקרים הם על רקע גנטי משפחתי. תוארו כמה תסמונות אוטוזומליות דומיננטיות, כל אחד על בסיס גנטי ופנוטיפי שונה. זוהו ארבעה סוגים של RCC תורשתי אשר קשורים למוטציות גנטיות[13][14]: תסמונת וון היפל-לינדאו (Von hippel-lindau - VHL)[15][16][17] הינה הבולטת ביותר (1 ל- 36,000 לידות). המחלה מאופיינת בהתפתחות גידולים וסקולריים, כולל RCC, פאוכרומוציטומה, המנגיובלסטומה של מערכת העצבים המרכזית. ביותר מ- 70% מחולי RCC מסוג תאים בהירים(Clear cell) שלא על רקע תורשתי נמצא פגם בגן VHL.
זוהו ארבעה דפוסי מחלה בעלי אפיון גנטי שונה.
סוגים היסטולוגיים[18][19][20][21]
קיימים ארבעה סוגים הסטולוגיים של RCC. כ-75% מכלל גידולי הכליה הינם מסוג Clear Cell Carcinoma, בעלי תאים המכילים כמות שומן גבוהה בציטופלזמה, המשווה להם מראה של תא לבנבן. הסוג ההיסטולוגי השני בשכיחותו הוא ה-Papillary Carcinoma המופיע בשתי צורות, מבניהן סוג 2 בעל מופע אגרסיבי יותר.
Oncocytoma לא נחשבת יותר כגידול ממאיר. גידולים מסוג Chromophobe, Collecting Duct Unclassified, Medullary נדירים יותר, מתרחשים אצל חולים עם Sickle Cell Trait [22]. מרכיב Sarcomatoid יכול להתרחש בכל תת-סוגים היסטולוגיים של RCC, ומצביע על גידול אגרסיבי[23] [24].
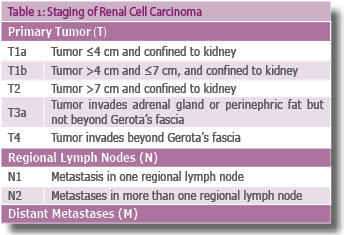
קביעת שלב המחלה נקבע על פי קריטריונים לפי TNM (AJCC Cancer Staging Manual and Handbook, 2002) (טבלה 1).
מה המטרה?
הפרדיגמה הבסיסית של האונקולוגיה המודרנית היא זיהוי מסלול ביולוגי החיוני להישרדות התא. תרופות המעכבות אחד או יותר ממדורי המסלול, מובילות בהמשך למות תאי הסרטן. הפרדיגמה תלויה בגורמים מרובים. RCC הינו סרטן המאופיין מבחינה ביולוגית באופן ניכר ביחס לגידולים מוצקים אחרים, וזוהו בו מסלולים תאיים הרלוונטיים לטיפול בתרופות חדשניות. שני מסלולים חיוניים שאופיינו ב-RCC הינם VEGF ו-mTOR.
גורמים ניבויים בסרטן כליה גרורתי
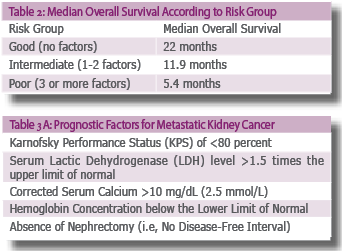
הגורמים המנבאים את הפרוגנוזה בסרטן כליה נחלקים לשלוש קטגוריות: מצד אחד, הרמה האנטומית - גודל, גרורות, מעורבות כלי דם גדולים ובלוטות לימפה. מצד שני, הסוג ההיסטולוגי הכולל Fuhrman Grade, מורפולוגיה, חדירה מיקרו-וסקולרית ונמק בגידול. ברמה הקלינית מצב תפקודי, סימפטומים קשורים ל-Cachexia, מספר טסיות מוגבר נמצאו במנבאים את הפרוגנוזה. מחקרים רבים קשרו בין שיעורי ההישרדות למאפיינים קליניים ספציפיים של המחלה[25] [26][27][28], כגון: מרווח זמן בין כריתת כליה לבין הופעת גרורות מרחוקות, אתר אחד של מחלה גרורתית, היעדר הגדלת בלוטות רטרופריטונליות. חמישה גורמים נוספים זוהו כמנבאים הישרדות פחותה בחולים שטופלו באינטרפרון אלפא, שנחשב לפני עידן הטיפול הביולוגי לטיפול הסטנדרטי (טבלה 2). הגורמים זוהו על ידי ניתוח רב משתני בסדרה של 670 חולים עם סרטן כליה מתקדם מקבוצת Memorial Sloan Kettering [27](טבלה 3א).
בעידן של טיפולים חדשים נשאלת השאלה: האם אותם גורמי סיכון עדיין תקפים גם בטיפול המודרני? מחקרים בחולים אשר טופלו במעכבי טירוזין קינז, כגון Sunitinib, גם ניסו להגדיר גורמים מנבאים [29] לדוגמה, במחקר פאזה שלישית, רמות גבוהות יותר של לקטט דהידרוגנז בסרום, סידן בסרום, מספר של אתרי גרורות, וזמן קצר יותר מן האבחון לתחילת הטיפול היו קשורים כולם עם פרוגנוזה גרועה[30]. במחקר אחר, טסיות ונויטרופילים גבוהים בדם בנקודת ההתחלה היו קשורים פרוגנוזה פחות טובה[31].
טיפול במחלה מתקדמת/גרורתית
מכלל החולים כבר בשלב האבחנה כ-30%-20% גרורתיים וכ-40%-20% יפתחו גרורות בהמשך לאחר כריתת כליה. חולים עם מחלה גרורתית או מקומית מתקדמת שאינה נתיחה, וחולים שיפתחו גרורות לאחר ניתוח ראשוני נחשבים לבעלי פרוגנוזה גרועה. מגוון של אופציות טיפוליות נבדק בחולים אלו.
הבנת הפתוגנזה של RCC ברמה המולקולרית אפשרה לאפיין את מסלולי VGEF (Vascular Endothelial Growth Factor) ו- mTOR (Mammalian Target of Rapamycin) כמטרות להתערבות טיפולית. מטרת הטיפול במחלה הגרורתית היא לדחות ככל האפשר את התפתחות המחלה במקביל להענקת איכות חיים מקסימלית לחולה בזמן הטיפול.
מה הם מאפייני המחלה המשפיעים על בחירת הטיפול?
- וריאנט היסטולוגי:
- Clear Cell/Clear-Cell Component
- Non-Clear-Cell Carcinoma
- Sarcomatoid Differentiation
- היסטוריית טיפולים קודמים:
- מספר טיפולים קודמים, סוגי הטיפולים שהחולה עבר
- תגובה/תופעות לוואי לטיפולים הקודמים
- קבוצת סיכון MSKCC:
- טובה/בינונית
- גרועה
- מאפיינים הקשורים לחולה (לא לשכוח שאנחנו בראש ובראשונה מטפלים בחולה ולא במחלה):
- גיל
- מצב תפקודי (Performance Status)
- מחלות רקע (מחלת לב, ריאות וכיו"ב)
מה התפקיד של Debulking Nephrectomy בעידן המודרני?
Debulking Nephrectomy הפך לטיפול סטנדרטי בחולים סלקטיבים על בסיס שני מחקרים פרוספקטיבים, רנדומליים. חולים עם סרטן כליה גרורתי RCC חולקו לשתי זרועות: כריתת כליה למול טיפול לא כירורגי ולאחריו אינטרפרון אלפא בשתי זרועות הניסוי. אנליזה משולבת של ניסויים אלו הוכיחה יתרון הישרדות כללית (OS) עבור קבוצת - Nephrectomy 13.6 מול 7.8 חודשים עבור אינטרפרון לבד [32] [33] [34]. אולם, המנגנון ליתרון הישרדותי לטובת Debulking Nephrectomy איננו ברור וקיימות מספר השערות: האחת היא הפחתה פשוטה של העול הגידולי. השערה אחרת הינה אימונומודולציה של מערכת החיסון לאחר Nephrectomy המשפרת את יעילות מערכת החיסון למול תאי הגידול. השערה אחרת היא כי ניתוח גורם לחמצת מטבולית קלה, אשר מעכבת חודרנות הגידול[35][36][37][38].
כריתת כליה ראשונית ולאחריה טיפול סיסטמי הינה גישה טיפולית מקובלת המתאימה לחולים עם (ECOG) 0 או 1; גידול רזקטבילי עיקרי המייצג את רוב הנטל של הגידול; שליטה על מחלה חוץ-כלייתית, ללא מחלות נלוות קשות. ראוי לציין כי הקריטריונים לבחירת החולים שצוינו לעיל הם בעיקר סובייקטיביים, מבוססים על חולים שטופלו בעידן הציטוקינים. גישה טיפולית נוספת הינה טיפול סיסטמי קדם-ניתוחי ולאחריו Nephrectomy. גישה זו מאפשרת הערכה של תגובה לטיפול סיסטמי ואת קצב התקדמות המחלה הכללית. בהתאם לכך ניתן לבחור את הטיפול האופטימלי לחולה.
שני מחקרים קליניים המתנהלים כעת בוחנים את יעילות הגישות שצוינו: המחקר הראשון מייעד חולים עם RCC גרורתי ל- Sunitinib - זרוע אחת הינה חולים לאחר כריתת כליה והשנייה ללא ניתוח. במחקר השני חלוקת החולים דומה, אולם בזרוע הטיפול התרופתי מוצעת כריתת כליה בהמשך.
אילו אמצעים תרופתיים עומדים לרשותנו היום לטיפול במחלה?
- ציטוקינים
עד לאחרונה היו Interleukin-2 ואינטרפרון אלפא הטיפול הסטנדרטי עבור חולים עם סרטן כליות גרורתי. שיעור התגובה בטיפול עם אינטרפרון - כ-15% שיפור בהישרדות לעומת היעדר טיפול [39] [40]. שיעורי תגובה ל-2IL במינון גבוה כ-25%-20%, אך יש עד 7% הפוגה מלאה לתקופה ארוכה. החולים שמפיקים את מרב התועלת מהטיפול בציטוקינים הם לרוב צעירים[41][42][43][44], PS-0, לא מטופלים לפני כן, עם היסטולוגיה של תאים בהירים, נפח המחלה הגרורתית מוגבל לריאות/בלוטות. חסרונות הטיפול בציטוקינים כוללים: תחלואה גבוהה והגבלת טיפול לאוכלוסיית חולים מצומצמת, ולפיכך הטיפול ב-IL2 במינון גבוה הפך שכיח פחות.
Targeted Therapy במחלה גרורתית
כפי שצוין לעיל, הבנת תהליכים ברמה ביולוגית אפשרה לזהות מטרות טיפוליות בסרטן כליה - VEGF ו-mTOR. נכון להיום נבדקו שש תרופות במחקרי פאזה שלישית שלהן תוצאות חיוביות.
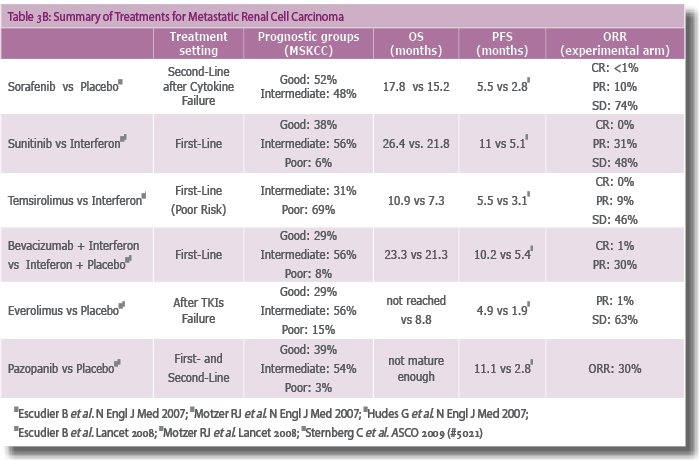
תרופה פומית שלה פעילות מעכבת כנגד כמה קולטני טירוזין קינאז, כגון: (PDGFR)-ß , KIT (Stem Cell Factor Receptor)[45] ו-Fms-like Tyrosine Kinase-3, Receptors 1, 2 and 3 (VEGF) [46]. נערכו שני ניסויים בפאזה שנייה שכללו 169 חולים הסובלים מסרטן כליה גרורתי. חולים אלה נכשלו בטיפול בציטוקינים, קיבלו Sunitinib והפגינו שיעור תגובה אובייקטיבי של 45%, משך חציוני של התגובה 11.9 חודשים, והישרדות ללא התקדמות המחלה (PFS) של 8.4 חודשים[47][48]. ניסוי בפאזה שלישית כלל 750 חולים הסובלים מסרטן כליה גרורתי מסוג תאים בהירים בעיקר, ונחלקו לשלוש קבוצות סיכון (רובם טוב או בינוני) שלא קיבלו טיפול קודם[49] .?המטופלים חולקו אקראית לקבל מחזורים של Sunitinib 50 מ"ג ליום במשך ארבעה שבועות, ולאחריהם - שבועיים ללא טיפול או אינטרפרון אלפא9 (IFNa) מיליון יחידות שלוש פעמים בשבוע. התצפיות העיקריות כוללות את התוצאות האלה:שיעור התגובה האובייקטיבית היה פי ארבעה בקבוצת Sunitinib לעומת IFN: 47% לעומת 12%, P<0.001. PFS: 11 חודשים לעומת 5 חודשים (:Interval Confidence HR 0.54 ,(0.45-0.64 P<0.001 יתרון זה נשמר בכל קבוצות הסיכון (הישרדות ללא התקדמות המחלה 14.5 חודשים לעומת 7.9 חודשים, 10.6 חודשים לעומת 3.8 חודשים, ו-3.7 חודשים לעומת 1.2 חודשים בהתאמה). לאחרונה פורסם הניתוח הסופי של הניסוי, שהראה שיפור בהישרדות הכללית עם Sunitinib חציון 26.4 חודשים לעומת 21.8 חודשים[50],(HR) (0.82, 95% CI 0.67-1.00, p = 0.051)?.
ניתוח ההישרדות הכוללת היה מסובך נוכח העובדה שיותר מחצי מהחולים בשתי הזרועות טופלו במעכבי VEGF לאחר סיום הטיפול.?בסך הכול 33% מן החולים שטופלו ב-IFN טופלו לאחר מכן גם ב-Sunitinib, וכשליש מהחולים בשתי הזרועות קיבלו טיפול עם מעכב VEGF TK אחר לאחר שסיימו את הפרוטוקול. תרופה זו נחשבת כעת כטיפול קו ראשון בזכות אחוזי התגובה הגבוהים יחסית לתכשירים אחרים ושיפור ב-OS.
תופעות הלוואי השכיחות הן: שלשול, עלייה בלחץ דם, עייפות, היפותירואידיזם, אי ספיקת לב (באחוז קטן) ובעיות עור.
תרופה פומית שלה פעילות מעכבת כנגד כמה קולטני טירוזין קינאז, כולל:(VEGF) Receptors 1-3, Platelet-Derived Growth Factor Receptor (PDGFR)-ß ו-The Serine Threonine Kinase Raf-1 [51][52].
כקו ראשון: במסגרת Phase 2 ניתן טיפול פומי ב-400 מ"ג פעמיים ביום, בהשוואה לאינטרפרון אלפא. במחקר שכלל 189 חולים לא הוכח הבדל ב- PFS (Progression Free Survival) בין שתי הקבוצות (5.7 חודשים לעומת 5.6 חודשים), אולם אחוז גבוה יותר של חולים השיג הצטמקות משמעותית של המסה הגידולית בקבוצה של Sorafenib (75% לעומת 25%) [53].
כקו שני: במחקר Target (Phase 3) ניתן טיפול פומי ב-400 מ"ג פעמיים ביום ל-900 חולים הסובלים ממחלה גרורתית רפרקטורית לציטוקינים. נצפה שיפור ב-PFS שהיה משמעותי סטטיסטית (5.5 חודשים לעומת 2.8 חודשים בקבוצת פלצבו, P<0.0001). באנליזה ראשונית לא היה רושם לשיפור בהישרדות, אולם באנליזה חוזרת של קבוצת החולים שטופלה מלכתחילה (לאחר שהושמטו החולים שהועברו ל-Sorafenib מאחר שמחלתם התקדמה תחת טיפול בפלצבו), נצפה גם שיפור בהישרדות הכוללת (OS) HR=0.78; P=0.029 v 14.3 months; 17.8 [54]. יתרה מזאת, בקבוצת חולים שגילם היה יותר מ-70 שנה, הושג PFS טוב יותר (26 שבועות לעומת 14 שבועות ללא טיפול) ללא תוספת רעילות[55].
היום מדורגת Sorafenib כתרופת קו שני נוכח רמזים שהתקבלו ליעילות מופחתת לעומת Sunitinib. ייתכן שבעתיד תזוהה קבוצת חולים שעשויה ליהנות ממנה כתרופת קו ראשון (במיוחד נוכח רעילות מופחתת), אולם בשלב זה אין די קריטריונים מזהים לקבוצת חולים כזו.
תופעות לוואי שכיחות הן: שלשול, עלייה בלחץ דם, אי ספיקת לב (באחוז קטן) ותופעות לוואי עוריות (Hand-Foot Syndrome).
נוגדן מונוקלונלי שקושר ומנטרל VEGF. נוסה בשתי עבודות גדולות רנדומליות (Phase 3) בארה"ב/קנדה ובאירופה (כ-1,400 חולים סה"כ) שבדקו שילוב של Bevacizumab ו-IFN-Alpha כנגד אינטרפרון לבדו. במחקר Avoren נבדקו 650 חולים לאחר כריתת כליה, והושג בו שיפור בתגובה האובייקטיבית (31% לעומת 13%) וב-PFS (10.2 חודשים לעומת 5.4 חודשים) [56] ללא שיפור בהישרדות כללית.
במחקר CALGB נבדקו 732 חולים ללא טיפול מקדים כלשהוא, ובו הודגמו תוצאות דומות (25% תגובה לעומת 13% תגובה, עם PFS של 8.4 חודשים לעומת 4.9 חודשים לטובת קבוצת השילוב)[57], והתקבל הרושם כי חלה הטבה גם בהישרדות הכוללת (18.3 חודשים לעומת 17.4 חודשים, P=0.07). תופעות לוואי הן: יתר לחץ דם, פרוטאינוריה ונטייה לדימומים.
מעכב פומי של כמה סוגי טירוזין קינאזות (,C-Kit PDGF-R, VEGF-R). נבדק במסגרת Phase 3 Trial לעומת פלצבו במחקר שכלל 435 חולים, ובו הושג שיפור ב-PFS (9.2 חודשים לעומת 4.2 חודשים בקבוצת הפלצבו) ונצפה אחוז תגובה משמעותי של 30% לעומת 3% בהתאמה. המינון המקובל הוא 800 מ"ג פעם ביום, שעה לפני האוכל. יש לציין כי במחקר הנ"ל נבדקה תרופה זו גם כקו ראשון וגם כקו שני בחולים שנכשלו בטיפול בציטוקינים. תרופה זו הוכיחה יעילות דומה בשתי הקבוצות.
תופעות לוואי שכיחות הן: עלייה בלחץ דם, שלשול, הפרעה באנזימי כבד, הקאות וחוסר תיאבון. יש להימנע מלתת אותו לחולים הסובלים מבעיה כבדית מוכחת[58].
- מעכבי mTOR
עד כה נכנסו לשימוש שתי תרופות מקבוצה זו: Temsirolimus ו-Everolimus.
תכשיר IV הניתן פעם בשבוע (25 מ"ג). במחקר Phase 3 שבוצע ב-626 חולים בקבוצת סיכון גבוה (כתכשיר קו ראשון) נצפה שיפור ב-OS, לעומת קבוצת חולים שטופלה באינטרפרון (10.9 חודשים לעומת 7.3 חודשים) וב-PFS (3.8 חודשים לעומת 1.9 חודשים). בקבוצת חולים שבהם נבדק טיפול משולב לא הוכח יתרון בהשוואה ל-Temsirolimus לבד[59].
תופעות לוואי הן: אנמיה, חולשה, היפוגליקמיה, דיסליפידמיה ופנאומוניטיס (בחלק קטן מהחולים).
תכשיר פומי, לעומת פלצבו. בעבודה שבדקה את פעילות התרופה ב-410 חולים הושג שיפור ב-PFS (4 חודשים לעומת 1.9 בקבוצת פלצבו, P)<0.001))[60]. תופעות לוואי בולטות הן: סטומטיטיס, פנאומוניטיס, היפוגליקמיה, ולימפופניה (טבלה 3ב).
אסטרטגיות טיפוליות לחולים הסובלים מסרטן כליה גרורתי
בחירת הטיפול מבוססת על כמה גורמים הקשורים גם לחולה וגם למאפייני המחלה. החולים חולקו לשלוש קבוצות סיכון לפי מודל שפותח בMSKCC.
Poor Risk: רוב התרופות החדשות נבדקו בחולים מקבוצות סיכון טוב/בינוני. לפיכך נשאלת השאלה מהו הטיפול היעיל בחולים שלהם יותר גורמי סיכון. המידע העיקרי מתקבל ממחקר שבדק Temsirolimus [61], ושהראה שיפור בהישרדות בקבוצה זו. תת-אנליזה של מחקרים אחרים מעלה את האפשרות שגם Sunitinib פעיל בקבוצת סיכון גבוה[52], אך לא Bevacizumab [59].
Non Clear: סוגיה אחרת היא בחירת הטיפול בחולים שלהם היסטולוגיה של Non Clear Cell. חולים אלה הם פלח קטן במחקרים שבדקו מעכבי טירוזין קינאזות ו-mTOR. עם זאת, ישנם נתונים ממחקרים גדולים אחרים שהראו פעילות של Temsirolimus, Sorafenib ו- Sunitinib בחולים שלהם היסטולוגיות שונות [61][62] [63].
איך לטפל בחולה באופן מיטבי?
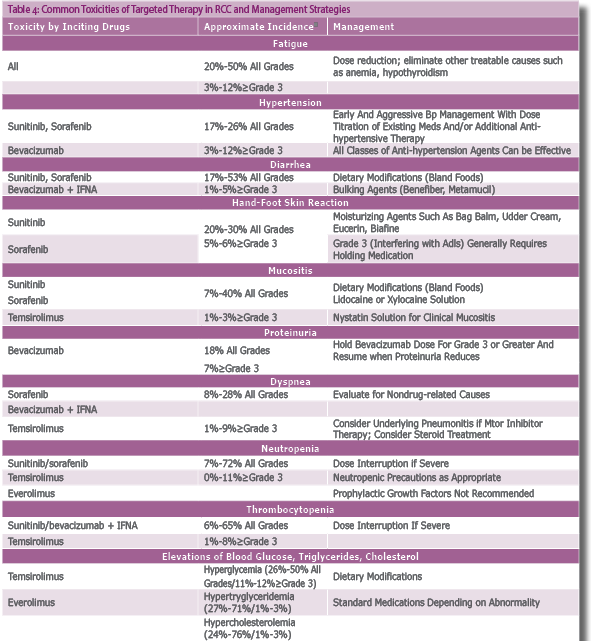
האתגר הטיפולי משלב בין ניטור תופעות הלוואי וטיפול בהן לבין טיפול במינונים אפקטיביים [64] (טבלה 4).
סוגיות במחלוקת
- עיתוי המעבר ממעכב טירוזין קינאז אחד לאחר, או מתכשיר מקבוצה אחת לאחרת
- שילוב של תרופות מקבוצות שונות
- יעילות Debulking ועיתויה במקביל לטיפול סיסטמי
- מתן טיפול אדג'ובנטי לאחר ניתוח, ללא מחלה גרורתית מוכחת ועיתויה (בשלב מחקרי)
- טיפול במחלה רפרקטורית
- תרופות חדשות במחקר
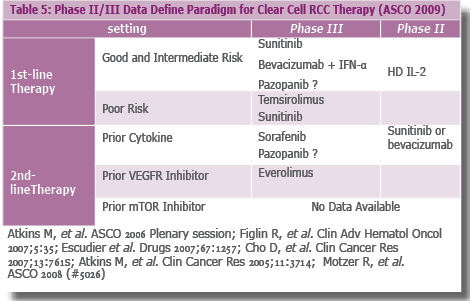
- המלצות לטיפול לאחר 2009 ASCO בגידולים מסוג Clear Cell (טבלה 5)
- קבוצת חולים שלהם סיכון טוב/בינוני
- קבוצת חולים שלהם סיכון גרוע
- קו ראשון
- קו שני
- בגידולים שאינם מסוג Clear Cell מומלצות האופציות הטיפוליות האלה
- טיפול במסגרת מחקר
- Temsirolimus
- Sunitinib
- Sorafenib
- Chemotherapy (Bellini Ducts, >50% Sarcomatoid Features)
סיכום
הטיפול המכוון נגד VEGF ו-mTOR הוכיח יתרון טיפולי משמעותי במחלה גרורתית, המוביל לשליטה טובה יותר בנטל הגידולי הכולל. בעידן האונקולוגיה המודרנית לכל מטופל צרכים ייחודיים ומאתגרים, המחייבים להגדיר את מטרות הטיפול, את יישום הטיפול המתאים וכן לזהות את תופעות הלוואי ולטפל בהן באופן מהיר. ככל שתועמק הבנת המנגנון הביולוגי של RCC ישתלבו הגדלת היעילות הטיפולית וניטור פרופיל הרעילות באופן יעיל יותר במסגרת מחקרים קליניים.
דגלים אדומים
ביבליוגרפיה
- ↑ Jemal A, Siegel R, Ward E, et al. Cancer statistics 2009. Cancer J Clin 2009;59(4):225-249
- ↑ Stafford HS, Saltzstein SL, Shimasaki S, et al. J Urol 2008;179(5):1704-1708
- ↑ Woldrich JM, Mallin K, Ritchey J, et al. Sex differences in renal cell cancer presentation and survival: an analysis of the National Cancer Database, 1993-2004. J Urol 2008;179(5):1709-1713
- ↑ Hunt JD, van der Hel OL, McMillan GP, et al. Renal cell carcinoma in relation to cigarette smoking: meta-analysis of 24 studies. Int J Cancer 2005;114:101-108
- ↑ Yuan JM, Castelao JE, Gago-Dominguez M, et al. Tobacco use in relation to renal cell carcinoma. Cancer Epidemiol Biomarkers Prev 1998;7:429-433
- ↑ van Dijk BA, Schouten LJ, Kiemeney LA, et al. Relation of height, body mass, energy intake, and physical activity to risk of renal cell carcinoma: results from the Netherlands Cohort Study. Am J Epidemiol 2004;160:1159-1167
- ↑ Bjørge T, Tretli S, Engeland A. Relation of height and body mass index to renal cell carcinoma in two million Norwegian men and women. Am J Epidemiol 2004;160:1168-1176
- ↑ Corrao G, Scotti L, Bagnardi V, et al. Hypertension, antihypertensive therapy and renal-cell cancer: a meta-analysis. Curr Drug Saf 2007;2:125-133
- ↑ McCredie M, Pommer W, McLaughlin JK, et al. International renal-cell cancer study. II. Analgesics. Int J Cancer 1995;60:345-349
- ↑ Ishikawa I, Saito Y, Asaka M, et al. Twenty-year follow-up of acquired renal cystic disease. Clin Nephrol 2003;59:153-159
- ↑ Farivar-Mohseni H, Perlmutter AE, Wilson S, et al. Renal cell carcinoma and end stage renal disease. J Urol 2006;175:2018-2020
- ↑ Rakowski SK, Winterkorn EB, Paul E, et al. Renal manifestations of tuberous sclerosis complex: Incidence, prognosis, and predictive factors. Kidney Int 2006;70:1777-1782
- ↑ Linehan WM, Walther MM, Zbar B. The genetic basis of cancer of the kidney. J Urol 2003;170:2163–2172
- ↑ Vira MA, et al. Genetic basis of kidney cancer: a model for developing molecular-targeted therapies. BJU Int 2007;99:1223–1229
- ↑ Maher ER. Inherited renal cell carcinoma. Br J Urol 1996;78:542-545
- ↑ Latif F, Tory K, Gnarra J, et al. Identification of the von Hippel-Lindau disease tumor suppressor gene. Science 1993;260:1317-1320
- ↑ Gudbjartsson T, Jónasdóttir TJ, Thoroddsen A, et al. A population-based familial aggregation analysis indicates genetic contribution in a majority of renal cell carcinomas. Int J Cancer 2002;100:476-479
- ↑ Linehan WM, Walther MM, Zbar B. The genetic basis of cancer of the kidney. J Urol 2003;170:2163-2172
- ↑ Renshaw AA. Subclassification of renal cell neoplasms: an update for the practising pathologist. Histopathology 2002;41:283-300
- ↑ Störkel S, Eble JN, Adlakha K, et al. Classification of renal cell carcinoma: Workgroup No. 1. Union Internationale Contre le Cancer (UICC) and the American Joint Committee on Cancer (AJCC). Cancer 1997;80:987-989
- ↑ Zambrano NR, Lubensky IA, Merino MJ, et al. Histopathology and molecular genetics of renal tumors toward unification of a classification system. J Urol 1999;162:1246-1258
- ↑ Davis CJ, Mostofi FK, Sesterhenn IA. Renal medullary carcinoma. The seventh sickle cell nephropathy. Am J Surg Pathol 1995;19:1-11
- ↑ Cheville JC, Lohse CM, Zincke H, et al. Sarcomatoid renal cell carcinoma: an examination of underlying histologic subtype and an analysis of associations with patient outcome. Am J Surg Pathol 2004;28:435-441
- ↑ Farrow GM, Harrison EG Jr, Utz DC. Sarcomas and sarcomatoid and mixed malignant tumors of the kidney in adults. Cancer 1968;22:556-563
- ↑ Mickisch GH, Garin A, van Poppel H, et al. Radical nephrectomy plus interferon-alfa-based immunotherapy compared with interferon alfa alone in metastatic renal-cell carcinoma: a randomised trial..Lancet 2001;358:966-970
- ↑ Motzer RJ, Mazumdar M, Bacik J, et al. Survival and prognostic stratification of 670 patients with advanced renal cell carcinoma. J Clin Oncol 1999;17:2530-2540
- ↑ 27.0 27.1 Vasselli JR, Yang JC, Linehan WM, et al. Lack of retroperitoneal lymphadenopathy predicts survival of patients with metastatic renal cell carcinoma. J Urol 2001;166:68-72
- ↑ Elson PJ, Witte RS, Trump DL. Prognostic factors for survival in patients with recurrent or metastatic renal cell carcinoma. Cancer Res 1988;48:7310-7313
- ↑ Motzer RJ, Bukowski RM, Figlin RA, et al. Prognostic nomogram for sunitinib in patients with metastatic renal cell carcinoma. Cancer 2008;113(7):1552-1558
- ↑ Heng DY, Chi KN, Murray N, et al. A population-based study evaluating the impact of sunitinib on overall survival in the treatment of patients with metastatic renal cell cancer. Cancer 2009;115(4):776-783
- ↑ Heng DY, Xie W, Regan MM, et al. Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: Results from a large multicenter study (abstract #5041). J Clin Oncol 2009;27:5794-5799
- ↑ Flanigan RC, Salmon SE, Blumenstein BA, et al. Nephrectomy followed by interferon alfa-2b compared with interferon alfa-2b alone for metastatic renal-cell cancer. NEJM 2001;345:1655–1659
- ↑ Mickisch GH, Garin A, van Poppel H, et al. Radical nephrectomy plus interferon-alfa-based immunotherapy compared with interferon alfa alone in metastatic renal-cell carcinoma: A randomised trial. Lancet 2001;358:966–970
- ↑ Flanigan RC, Mickisch G, Sylvester R, et al. Cytoreductive nephrectomy in patients with metastatic renal cancer: A combined analysis. J Urol 2004;171:1071–1076
- ↑ Tatsumi T, Herrem CJ, Olson WC, et al. Disease stage variation in CD4+ and CD8+ T-cell reactivity to the receptor tyrosine kinase EphA2 in patients with renal cell carcinoma. Cancer Res 2003;63:4481–4489
- ↑ Tatsumi T, Kierstead LS, Ranieri E, et al. Disease-associated bias in T helper type 1 (Th1)/Th2 CD4(+) T cell responses against MAGE-6 in HLA-DRB10401(+) patients with renal cell carcinoma or melanoma. J Exp Med 2002;196:619–628
- ↑ Dadian G, Riches PG, Henderson DC, et al. Immunological parameters in peripheral blood of patients with renal cell carcinoma before and after nephrectomy. Br J Urol 1994;74:15–22
- ↑ Gatenby RA, Gawlinski ET, Tangen CM, et al. The possible role of postoperative azotemia in enhanced survival of patients with metastatic renal cancer after cytoreductive nephrectomy. Cancer Res 2002;62:5218–5222
- ↑ Coppin C, Porzsolt F, Awa A, et al. Immunotherapy for advanced renal cell cancer. Cochrane Database Syst Rev 2005;CD001425
- ↑ Interferon-alpha and survival in metastatic renal carcinoma. Early results of a randomised controlled trial: Medical Research Council Renal Cancer Collaborators. Lancet 1999;353:14–17
- ↑ Klapper JA, Downey SG, Smith FO, et al. High-dose interleukin-2 for the treatment of metastatic renal cell carcinoma: A retrospective analysis of response and survival in patients treated in the surgery branch at the National Cancer Institute between 1986 and 2006. Cancer 2008;113:293–301
- ↑ Fyfe G, Fisher RI, Rosenberg SA, et al. Results of treatment of 255 patients with metastatic renal cell carcinoma who received high-dose recombinant interleukin-2 therapy. J Clin Oncol 1995;13:688–696
- ↑ McDermott DF, Regan MM, Clark JI, et al. Randomized phase III trial of high-dose interleukin-2 versus subcutaneous interleukin-2 and interferon in patients with metastatic renal cell carcinoma. J Clin Oncol 2005;23:133–141
- ↑ Yang JC, Sherry RM, Steinberg SM, et al. Randomized study of high-dose and low-dose interleukin-2 in patients with metastatic renal cancer. J Clin Oncol 2003;21:3127–3132
- ↑ Mendel DB, Laird AD, Xin X, et al. In vivo antitumor activity of SU11248, a novel tyrosine kinase inhibitor targeting vascular endothelial growth factor and platelet-derived growth factor receptors: determination of a pharmacokinetic/pharmacodynamic relationship. Clin Cancer Res 2003;9:327-337
- ↑ Abrams TJ, Lee LB, Murray LJ, et al. SU11248 inhibits KIT and platelet-derived growth factor receptor beta in preclinical models of human small cell lung cancer. Mol Cancer Ther 2003;2:471-478
- ↑ Motzer RJ, Rini BI, Bukowski RM, et al. Sunitinib in patients with metastatic renal cell carcinoma. JAMA 2006;295:2516-2524
- ↑ Motzer RJ, Michaelson MD, Redman BG, et al. Activity of SU11248, a multitargeted inhibitor of vascular endothelial growth factor receptor and platelet-derived growth factor receptor, in patients with metastatic renal cell carcinoma. J Clin Oncol 2006;24:16-24
- ↑ Motzer RJ, Hutson TE, Tomczak P, et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med 2007;356(2):115-124
- ↑ Motzer RJ, Hutson TE, Tomczak P, et al. Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma. J Clin Oncol 2009;27:3584-3590
- ↑ Lyons JF, Wilhelm S, Hibner B, et al. Discovery of a novel Raf kinase inhibitor. Endocr Relat Cancer 2001;8:219-225
- ↑ 52.0 52.1 Wilhelm SM, Carter C, Tang L, et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis. Cancer Res 2004;64:7099-7109
- ↑ Escudier B, Szczylik C, Hutson TE, et al. Randomized phase II trial of first-line treatment with sorafenib versus interferon Alfa-2a in patients with metastatic renal cell carcinoma. J Clin Oncol 2009;27:1280-1289
- ↑ Escudier B, Eisen T, Stadler WM, et al. Sorafenib for treatment of renal cell carcinoma: final efficacy and safety results of the phase iii treatment approaches in renal cancer global evaluation trial. J Clin Oncol 2009;27:3312-3318
- ↑ Eisen T, Oudard S, Szczylik C, et al. Sorafenib for older patients with renal cell carcinoma: subset analysis from a randomized trial. J Natl Cancer Inst 2008;100:1454-1463
- ↑ Escudier, BJ, Bellmunt, J, Negrier, S, et al. Final results of the phase III, randomized, double-blind AVOREN trial of first-line bevacizumab (BEV) + interferon- 945;2a (IFN) in metastatic renal cell carcinoma (mRCC) (abstract #5020). J Clin Oncol 2009; 27:239
- ↑ Rini, BI, Halabi, S, Rosenberg, J, et al. Bevacizumab plus interferon-alpha versus interferon-alpha monotherapy in patients with metastatic renal cell carcinoma: Results of overall survival for CALGB 90206 (abstract #LBA5019). J Clin Oncol 2009;27:798s. (Abstract available on line at: http://www.abstract.asco.org/index2.html, accessed on June 4, 2009)
- ↑ Sternberg, CN, Szczylik, C, Lee, ES, et al. A randomized, double-blind phase III study of pazopanib in treatment-naive and cytokine-pretreated patients with advanced renal cell carcinoma (RCC) (abstract #5021). J Clin Oncol 2009;27:240s. (Abstract available on line at: http://www.abstract.asco.org/index2.html, accessed on June 4, 2009)
- ↑ 59.0 59.1 Hudes G, Carducci M, Tomczak P, et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med 2007;356:2271-2281
- ↑ Motzer RJ, Escudier B, Oudard S, et al. Efficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomised, placebo-controlled phase III trial. Lancet. 2008;372:449-456
- ↑ 61.0 61.1 Stadler WM, Figlin RA, Ernstoff MS, et al. The Advanced Renal Cell Carcinoma Sorafenib (ARCCS) expanded access trial: Safety and efficacy in patients (pts) with non-clear cell (NCC) renal cell carcinoma (RCC). J Clin Oncol 2007;25:243s
- ↑ Dutcher, JP, Szczylik, C, Tannir, R, et al. Correlation of survival with tumor histology, age, and prognostic risk group for previously untreated patients with advanced renal cell carcinoma (adv RCC) receiving temsirolimus (TEMSR) or interferon-alpha (IFN). (Abstract). J Clin Oncol 2007;25:243
- ↑ Choueiri TK, Plantade A, Elson P, et al. Efficacy of sunitinib and sorafenib in metastatic papillary and chromophobe renal cell carcinoma. J Clin Oncol 2008;26:127-131
- ↑ Brian I. Rini. metastatic renal cell carcinoma: many treatment options, one patient. J Clin Oncol 2009:3225-3234
קישורים חיצוניים
- חידושים בטיפול בסרטן כליה גרורתי, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר ויקטוריה ניימן


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק