סרטן הכליה - טיפול במחלה גרורתית - Renal cancer - treatment of metastatic disease
| סרטן הכליה - טיפול במחלה גרורתית | ||
|---|---|---|
| Renal cancer - treatment of metastatic disease | ||
| יוצר הערך | ד"ר ויקטוריה ניימן 
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן במערכת השתן
בטיפול בסרטן הכליה חלו תמורות שונות. חידושים בכירורגיה האורולוגית הביאו להפחתה ניכרת בשיעורי התחלואה. הגישה פחות פולשנית מבעבר, ולכן היעילות הטיפולית השתפרה. נוסף על כך, הבנת המנגנונים הביולוגיים העומדים בבסיס הפתולוגיה, הביאה לשינוי דרמטי בדפוסי הטיפול האונקולוגי. טיפולים ביולוגיים המכוונים לגורם הגדילה של אנדותל כלי הדם (Vascular endothelial growth factor - VEGF) והמסלולים הביולוגיים שבהם הוא מעורב, הביאו להגברת היעילות הטיפולית ולשינוי התפיסה הטיפולית. בהתבסס על מחקרים אקראיים רבים, תרופות ממשפחת נוגדי ה- VEGF, כגון: Avastin (Bevacizumab), Nexavar (Sorafenib) ו- Sutent (Sunitinib) ותרופות ממוקדות ל- mTOR (Mammalian target of rapamycin), כגון: Torisel (Temsirolimus) ו- Certican (Everolimus) הוכיחו שיפור משמעותי בזמן התקדמות המחלה וחלקם גם בשרידות הכוללת. למרות המנגנון הממוקד קיים פרופיל רעילות רחב. דבר זה דורש אבחון מוקדם וטיפול מהיר כדי לאפשר לחולה לקבל טיפול מיטבי עם מינימום פגיעה באיכות החיים.
אפידמיולוגיה
סרטן הכליה (Renal cell carcinoma - RCC) מהווה כ- 3-5% מכלל הגידולים במבוגרים, והוא השביעי בשכיחות בקרב גברים ושמיני בקרב הנשים[1]. בשנת 2009 אובחנו בארה"ב 57,760 מקרים חדשים של RCC, כ- 12,980 מתוכם צפויים למות מהמחלה. הגיל החציוני לאבחנה הינו 65, שכיחות RCC גדלה עם הזמן. שיעור השרידות ל- 5 שנים עומד על 69.4%.
גורמי סיכון
- מין: בעבר דווח RCC כבעל שכיחות של כפליים לפחות אצל גברים לעומת נשים. עם זאת, הנתונים האחרונים מראים כי הפער הזה הצטמצם [2] [3]
- עישון: סיכון יחסי של עד פי 2 לעומת לא מעשנים [4][5]
- השמנת יתר [6] [7]
- יתר לחץ דם: לאחרונה מדברים על קושי להבחין בין סיכון של לחץ דם גבוה לשימוש בתרופות נוגדות לחץ דם, כגון משתנים[8][9]
- מחלות כליה, כגון: מחלת כליות סופנית (End stage renal disease) ומחלה ציסטית נרכשת של הכליה (Aquired renal cystic disease). [10] וטוברוס סקלרוזיס (Tuberous sclerosis) [11][12]
2-3% מהמקרים הם על רקע גנטי משפחתי. תוארו כמה תסמונות אוטוזומליות דומיננטיות, כל אחד על בסיס גנטי ופנוטיפי שונה. זוהו ארבעה סוגים של RCC תורשתי אשר קשורים למוטציות גנטיות[13][14]: תסמונת וון היפל-לינדאו (Von hippel-lindau - VHL)[15][16][17] הינה הבולטת ביותר (1 ל- 36,000 לידות). המחלה מאופיינת בהתפתחות גידולים וסקולריים, כולל RCC, פאוכרומוציטומה, המנגיובלסטומה של מערכת העצבים המרכזית. ביותר מ- 70% מחולי RCC מסוג תאים בהירים (Clear cell) שלא על רקע תורשתי נמצא פגם בגן VHL.
זוהו ארבעה דפוסי מחלה בעלי אפיון גנטי שונה.
היסטולוגיה של סרטן הכליה[18][19][20][21]
קיימים ארבעה סוגים הסטולוגיים של RCC. כ- 75% מכלל גידולי הכליה הינם מסוג קרצינומה של תאים בהירים (Clear cell carcinoma), בעלי תאים המכילים כמות שומן גבוהה בציטופלזמה, המשווה להם מראה של תא לבנבן. הסוג ההיסטולוגי השני בשכיחותו הוא קרצינומה פפילרית (Papillary carcinoma) המופיעה בשתי צורות, מביניהן סוג 2 בעל מופע אגרסיבי יותר.
אונקוציטומה (Oncocytoma) לא נחשבת יותר כגידול ממאיר. גידולים מסוג מדולרי (Medullary), גידול לא מסווג של צינור האיסוף (Collecting duct unclassified) וכרומופובי (Chromophobe), נדירים יותר, מתרחשים אצל חולים עם נטייה לתאים חרמשיים (Sickle cell trait) [22]. מרכיב סרקומטואידי (Sarcomatoid) יכול להתרחש בכל תת-סוגים היסטולוגיים של RCC, ומצביע על גידול אגרסיבי[23] [24].
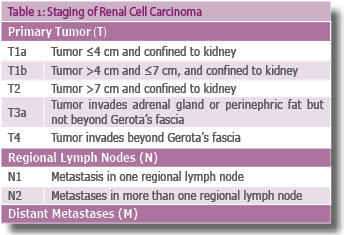
קביעת שלב המחלה נקבע על פי קריטריונים לפי TNM (AJCC Cancer staging manual and handbook, 2002) (טבלה 1).
מטרת הטיפול
הפרדיגמה הבסיסית של האונקולוגיה המודרנית היא זיהוי מסלול ביולוגי החיוני להישרדות התא. תרופות המעכבות אחד או יותר ממדורי המסלול, מובילות בהמשך למות תאי הסרטן. הפרדיגמה תלויה בגורמים מרובים. RCC הינו סרטן המאופיין מבחינה ביולוגית באופן ניכר ביחס לגידולים מוצקים אחרים, וזוהו בו מסלולים תאיים הרלוונטיים לטיפול בתרופות חדשניות. שני מסלולים חיוניים שאופיינו ב- RCC הינם VEGF ו- mTOR.
גורמים פרוגנוסטיים בסרטן כליה גרורתי
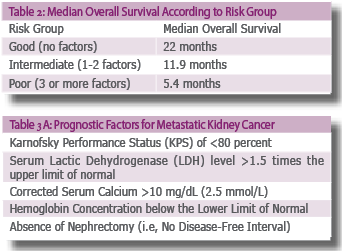
הגורמים המנבאים את הפרוגנוזה בסרטן כליה נחלקים לשלוש קטגוריות: מצד אחד, הרמה האנטומית - גודל, גרורות, מעורבות כלי דם גדולים ובלוטות לימפה. מצד שני, הסוג ההיסטולוגי הכולל את דירוג פורמן (Fuhrman grade), מורפולוגיה, חדירה מיקרו-וסקולרית ונמק בגידול. ברמה הקלינית מצב תפקודי, ,תסמינים קשורים לככקציה (Cachexia), מספר טסיות מוגבר נמצאו במנבאים את הפרוגנוזה. מחקרים רבים קשרו בין שיעורי השרידות למאפיינים קליניים ספציפיים של המחלה[25] [26][27][28], כגון: מרווח זמן בין כריתת כליה לבין הופעת גרורות מרחוקות, אתר אחד של מחלה גרורתית, היעדר הגדלת בלוטות רטרופריטונאליות. חמישה גורמים נוספים זוהו כמנבאים שרידות פחותה בחולים שטופלו בInterferon alfa, שנחשב לפני עידן הטיפול הביולוגי לטיפול הסטנדרטי (טבלה 2). הגורמים זוהו על ידי ניתוח רב משתני בסדרה של 670 חולים עם סרטן כליה מתקדם מקבוצת Memorial sloan kettering cancer center (MSKCC)[27](טבלה 3א).
בעידן של טיפולים חדשים נשאלת השאלה: האם אותם גורמי סיכון עדיין תקפים גם בטיפול המודרני? מחקרים בחולים אשר טופלו במעכבי טירוזין קינז, כגון Sutent, גם ניסו להגדיר גורמים מנבאים [29]. לדוגמה, במחקר שלב 3, רמות גבוהות יותר של לקטאט דהידרוגנאזה בסרום, סידן בסרום, מספר אתרי הגרורות, וזמן קצר יותר מן האבחון לתחילת הטיפול היו קשורים כולם עם פרוגנוזה גרועה[30]. במחקר אחר, טסיות ונויטרופילים גבוהים בדם בנקודת ההתחלה היו קשורים בפרוגנוזה פחות טובה[31].
עקרונות טיפוליים במחלה מתקדמת/גרורתית
מכלל החולים, כבר בשלב האבחנה כ- 20-30% גרורתיים וכ- 20-40% יפתחו גרורות בהמשך לאחר כריתת כליה. חולים עם מחלה גרורתית או מקומית מתקדמת שאינה נתיחה, וחולים שיפתחו גרורות לאחר ניתוח ראשוני נחשבים לבעלי פרוגנוזה גרועה. מגוון של אפשרויות טיפוליות נבדק בחולים אלו.
הבנת הפתוגנזה של RCC ברמה המולקולרית אפשרה לאפיין את מסלולי VEGF ו- mTOR כמטרות להתערבות טיפולית. מטרת הטיפול במחלה הגרורתית היא לדחות ככל האפשר את התפתחות המחלה במקביל להענקת איכות חיים מירבית לחולה בזמן הטיפול.
מה הם מאפייני המחלה המשפיעים על בחירת הטיפול?
- סוג היסטולוגי:
- תאים בהירים\מרכיב של תאים בהירים (Clear cell/clear-cell component)
- קרצינומה שאינה של תאים בהירים (Non-clear-cell carcinoma)
- התמיינות סרקומטואידית (Sarcomatoid differentiation)
- היסטוריית טיפולים קודמים:
- מספר טיפולים קודמים, סוגי הטיפולים שהחולה עבר
- תגובה/תופעות לוואי לטיפולים הקודמים
- קבוצת סיכון MSKCC:
- טובה/בינונית
- גרועה
- מאפיינים הקשורים לחולה (בראש ובראשונה מטפלים בחולה ולא במחלה):
- גיל
- מצב תפקודי (Performance status)
- מחלות רקע (מחלת לב, ריאות וכיוצא בזה)
אסטרטגיות טיפוליות לחולים הסובלים מסרטן כליה גרורתי
בחירת הטיפול מבוססת על כמה גורמים הקשורים גם לחולה וגם למאפייני המחלה. החולים חולקו לשלוש קבוצות סיכון לפי מודל שפותח ב- MSKCC.
סיכון גרוע (Poor risk): רוב התרופות החדשות נבדקו בחולים מקבוצות סיכון טוב/בינוני. לפיכך נשאלת השאלה מהו הטיפול היעיל בחולים שלהם יותר גורמי סיכון. המידע העיקרי מתקבל ממחקר שבדק Torisel [32], ושהראה שיפור בשרידות בקבוצה זו. תת-אנליזה של מחקרים אחרים מעלה את האפשרות שגם Sutent פעילה בקבוצת סיכון גבוה[33], אך לא Avastin[34].
סרטן שאינו סרטן של תאים בהירים: סוגיה אחרת היא בחירת הטיפול בחולים שלהם היסטולוגיה של תאים שאינם בהירים (Non clear cell). חולים אלה הם פלח קטן במחקרים שבדקו מעכבי טירוזין קינאזות ו- mTOR. עם זאת, ישנם נתונים ממחקרים גדולים אחרים שהראו פעילות של Torisel, Nexavarו- Sutent בחולים שלהם היסטולוגיות שונות [32][35] [36].
טיפול מיטבי בחולה
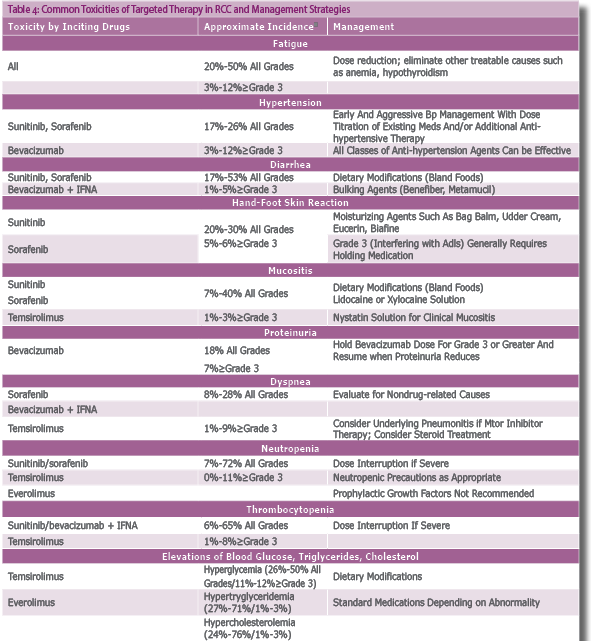
האתגר הטיפולי משלב בין ניטור תופעות הלוואי וטיפול בהן לבין טיפול במינונים בעלי השפעה[37] (טבלה 4).
סוגיות במחלוקת:
- עיתוי המעבר ממעכב טירוזין קינאז אחד לאחר, או מתכשיר מקבוצה אחת לאחרת
- שילוב של תרופות מקבוצות שונות
- יעילות ניתוח להקטנת נפח ועיתויה במקביל לטיפול מערכתי
- מתן טיפול משלים (Adjuvant) לאחר ניתוח, ללא מחלה גרורתית מוכחת ועיתויה (בשלב מחקרי)
- טיפול במחלה עמידה (רפרקטורית)
- תרופות חדשות במחקר
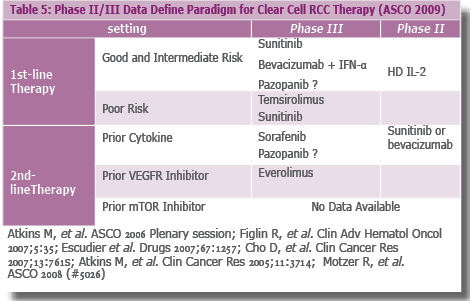
- המלצות לטיפול לאחר 2009 ASCO בגידולים מסוג Clear Cell (טבלה 5)
- קבוצת חולים שלהם סיכון טוב/בינוני
- קבוצת חולים שלהם סיכון גרוע
- קו ראשון
- קו שני
- בגידולים שאינם מסוג תאים בהירים (Clear cell) מומלצות האופציות הטיפוליות האלה
טיפול ניתוחי
ניתוח להקטנת נפח הגידול (Debulking nephrectomy) הפך לטיפול סטנדרטי בחולים נבחרים על בסיס שני מחקרים פרוספקטיבים, אקראיים. חולים עם סרטן כליה גרורתי RCC חולקו לשתי זרועות: כריתת כליה אל מול טיפול לא כירורגי ולאחריו Interferon alfa בשתי זרועות הניסוי. ניתוח משולב של ניסויים אלו הוכיחה יתרון בשרידות הכוללת (Overall survival - OS) - עבור קבוצת כריתת הכליה (Nephrectomy) 13.6 מול 7.8 חודשים עבור אינטרפרון לבד [38] [39] [40]. אולם, המנגנון ליתרון הישרדותי לטובת ניתוח להקטנת נפח איננו ברור וקיימות מספר השערות: האחת היא הפחתה פשוטה של העול הגידולי. השערה אחרת הינה התאמה חיסונית (אימונומודולציה) של מערכת החיסון לאחר כריתת כליה המשפרת את יעילות מערכת החיסון אל מול תאי הגידול. השערה אחרת היא כי ניתוח גורם לחמצת מטבולית קלה, אשר מעכבת את חודרנות הגידול[41][42][43][44].
כריתת כליה ראשונית ולאחריה טיפול מערכתי הינה גישה טיפולית מקובלת המתאימה לחולים עם Eastern cooperative oncology group (ECOG) 0 או 1, גידול הניתן לכריתה עיקרי המייצג את רוב הנטל של הגידול, שליטה על מחלה חוץ-כלייתית, ללא מחלות נלוות קשות. ראוי לציין כי הקריטריונים לבחירת החולים שצוינו לעיל הם בעיקר סובייקטיביים, מבוססים על חולים שטופלו בעידן הציטוקינים. גישה טיפולית נוספת הינה טיפול מערכתי קדם-ניתוחי ולאחריו כריתת כליה. גישה זו מאפשרת הערכה של תגובה לטיפול מערכתי ואת קצב התקדמות המחלה הכללית. בהתאם לכך ניתן לבחור את הטיפול המיטבי לחולה.
שני מחקרים קליניים המתנהלים כעת בוחנים את יעילות הגישות שצוינו: המחקר הראשון מייעד חולים עם RCC גרורתי ל- Sutent - זרוע אחת הינה חולים לאחר כריתת כליה והשנייה ללא ניתוח. במחקר השני חלוקת החולים דומה, אולם בזרוע הטיפול התרופתי מוצעת כריתת כליה בהמשך.
טיפול תרופתי
ציטוקינים
Interleukin-2 וInterferon alfa היו הטיפול הסטנדרטי עבור חולים עם סרטן כליות גרורתי. שיעור התגובה בטיפול עם Interferon alfa - כ- 15% שיפור בשרידות לעומת היעדר טיפול [45] [46]. שיעורי תגובה לInterleukin-2 במינון גבוה הם כ- 20-25%, אך יש עד 7% הפוגה מלאה לתקופה ארוכה. החולים שמפיקים את מרב התועלת מהטיפול בציטוקינים הם לרוב צעירים[47][48][49][50], מצב תפקודי (Performance status) 0, לא מטופלים לפני כן, עם היסטולוגיה של תאים בהירים, נפח מחלה הגרורתית מוגבל לריאות/בלוטות. חסרונות הטיפול בציטוקינים כוללים: תחלואה גבוהה והגבלת טיפול לאוכלוסיית חולים מצומצמת, ולפיכך הטיפול בInterleukin-2 במינון גבוה הפך שכיח פחות.
טיפול מוכוון מטרה במחלה גרורתית
כפי שצוין לעיל, הבנת תהליכים ברמה ביולוגית אפשרה לזהות מטרות טיפוליות בסרטן כליה - VEGF ו- mTOR. נבדקו שש תרופות במחקרי שלב 3 שלהן תוצאות חיוביות.
תרופה פומית שלה פעילות מעכבת כנגד כמה קולטני טירוזין קינאז, כגון: PDGFRB (Beta type platelet derived growth factor receptor) , KIT (Stem cell factor receptor)[51] , קולטני VEGF 1, 2, 3 ו- Fms-like tyrosine kinase3 [52]. נערכו שני ניסויים שלב 2 שכללו 169 חולים הסובלים מסרטן כליה גרורתי. חולים אלה נכשלו בטיפול בציטוקינים, קיבלו Sutent והפגינו שיעור תגובה אובייקטיבי של 45%, משך תגובה חציוני של 11.9 חודשים, ושרידות חופשיה מהתקדמות מחלה (Progression free survival - PFS) של 8.4 חודשים[53][54]. ניסוי שלב 3 כלל 750 חולים הסובלים מסרטן כליה גרורתי מסוג תאים בהירים בעיקר, ונחלקו לשלוש קבוצות סיכון (רובם טוב או בינוני) שלא קיבלו טיפול קודם[55] . המטופלים חולקו אקראית לקבל מחזורים של Sutent 50 מ"ג ליום במשך ארבעה שבועות, ולאחריהם - שבועיים ללא טיפול או Interferon alfa 9 מיליון יחידות שלוש פעמים בשבוע.
התצפיות העיקריות כוללות את התוצאות הבאות:
שיעור התגובה האובייקטיבית היה פי ארבעה בקבוצת Sutent לעומת Interferon alfa: 47% לעומת 12%, P<0.001.
שרידות חופשיה מהתקדמות מחלה: 11 חודשים לעומת 5 חודשים: יחס סיכון (Hazard ratio - HR) 0.54, רווח סמך 0.45-0.64, P>0.001. יתרון זה נשמר בכל קבוצות הסיכון (שרידות חופשיה מהתקדמות מחלה 14.5 חודשים לעומת 7.9 חודשים, 10.6 חודשים לעומת 3.8 חודשים, ו- 3.7 חודשים לעומת 1.2 חודשים בהתאמה). לאחרונה פורסם הניתוח הסופי של הניסוי, שהראה שיפור בשרידות הכוללת עם Sutent עם חציון של 26.4 חודשים לעומת 21.8 חודשים[56], (יחס סיכון 0.82, עם רווח סמך של 95% 0.67-1.00, P=0.051).
ניתוח השרידות הכוללת היה מסובך נוכח העובדה שיותר מחצי מהחולים בשתי הזרועות טופלו במעכבי VEGF לאחר סיום הטיפול. בסך הכול 33% מן החולים שטופלו בInterferon alfa טופלו לאחר מכן גם ב- Sutent, וכשליש מהחולים בשתי הזרועות קיבלו טיפול עם מעכב אחר של VEGF טירוזין קינאז לאחר שסיימו את הפרוטוקול. תרופה זו נחשבת כעת כטיפול קו ראשון בזכות אחוזי התגובה הגבוהים יחסית לתכשירים אחרים ושיפור בשרידות הכוללת.
תופעות הלוואי השכיחות הן: שלשול, עלייה בלחץ דם, עייפות, תת פעילות של בלוטת התריס, אי ספיקת לב (באחוז קטן) ובעיות עור.
תרופה פומית שלה פעילות מעכבת כנגד כמה קולטני טירוזין קינאז, כולל: קולטני VEGF 1-3, PDGFRB ו- The Serine Threonine Kinase Raf-1 [57][33].
כקו ראשון: במסגרת שלב 2 ניתן טיפול פומי ב- 400 מ"ג פעמיים ביום, בהשוואה לInterferon alfa. במחקר שכלל 189 חולים לא הוכח הבדל בשרידות חופשיה ממחלה בין שתי הקבוצות (5.7 חודשים לעומת 5.6 חודשים), אולם אחוז גבוה יותר של חולים השיג הצטמקות משמעותית של המסה הגידולית בקבוצה של Nexavar (75% לעומת 25%) [58].
כקו שני: במחקר Target (שלב 3) ניתן טיפול פומי ב- 400 מ"ג פעמיים ביום ל- 900 חולים הסובלים ממחלה גרורתית עמידה (רפרקטורית) לציטוקינים. נצפה שיפור בשרידות חופשיה ממחלה שהיה משמעותי סטטיסטית (5.5 חודשים לעומת 2.8 חודשים בקבוצת אינבו, P<0.0001). בניתוח ראשוני לא היה רושם לשיפור בשרידות, אולם בניתוח חוזר של קבוצת החולים שטופלה מלכתחילה (לאחר שהושמטו החולים שהועברו ל- Nexavar מאחר שמחלתם התקדמה תחת טיפול אינבו), נצפה גם שיפור בשרידות הכוללת (שרידות כוללת 17.8 חודשים לעומת 14.3, יחס סיכון 0.78, P=0.029)[59]. יתרה מזאת, בקבוצת חולים שגילם היה יותר מ- 70 שנה, הושגה שרידות חופשיה ממחלה טובה יותר (26 שבועות לעומת 14 שבועות ללא טיפול) ללא תוספת רעילות[60].
Nexavar מדורגת כתרופת קו שני נוכח רמזים שהתקבלו ליעילות מופחתת לעומת Sutent. ייתכן שתזוהה קבוצת חולים שעשויה ליהנות ממנה כתרופת קו ראשון (במיוחד נוכח רעילות מופחתת), אולם אין די קריטריונים מזהים לקבוצת חולים כזו.
תופעות לוואי שכיחות הן: שלשול, עלייה בלחץ דם, אי ספיקת לב (באחוז קטן) ותופעות לוואי עוריות (תסמונת יד רגל - Hand-foot syndrome).
נוגדן חד שבטי (מונוקלונלי) שקושר ומנטרל VEGF. נוסה בשתי עבודות אקראיות גדולות (שלב 3) בארה"ב/קנדה ובאירופה (כ- 1,400 חולים סך הכל) שבדקו שילוב של Avastin וInterferon alfa כנגד אינטרפרון לבדו. במחקר Avoren נבדקו 650 חולים לאחר כריתת כליה, והושג בו שיפור בתגובה האובייקטיבית (31% לעומת 13%) ובשרידות חופשיה ממחלה (10.2 חודשים לעומת 5.4 חודשים) [61] ללא שיפור בשרידות הכוללת.
במחקר CALGB נבדקו 732 חולים ללא טיפול מקדים כלשהוא, ובו הודגמו תוצאות דומות (25% תגובה לעומת 13% תגובה, עם שרידות חופשיה ממחלה של 8.4 חודשים לעומת 4.9 חודשים לטובת קבוצת השילוב)[62], והתקבל הרושם כי חלה הטבה גם בשרידות הכוללת (18.3 חודשים לעומת 17.4 חודשים, P=0.07). תופעות לוואי הן: יתר לחץ דם, הפרשת חלבון בשתן (פרוטאינוריה) ונטייה לדימומים.
מעכב פומי של כמה סוגי טירוזין קינאזות (VEGF-R, PDGF-R ו- C-Kit). נבדק במסגרת מחקר שלב 3 לעומת אינבו במחקר שכלל 435 חולים, ובו הושג שיפור בשרידות חופשיה ממחלה (9.2 חודשים לעומת 4.2 חודשים בקבוצת האינבו) ונצפה אחוז תגובה משמעותי של 30% לעומת 3% בהתאמה. המינון המקובל הוא 800 מ"ג פעם ביום, שעה לפני האוכל. יש לציין כי במחקר לעיל נבדקה תרופה זו גם כקו ראשון וגם כקו שני בחולים שנכשלו בטיפול בציטוקינים. תרופה זו הוכיחה יעילות דומה בשתי הקבוצות.
תופעות לוואי שכיחות הן: עלייה בלחץ דם, שלשול, הפרעה באנזימי כבד, הקאות וחוסר תיאבון. יש להימנע מלתת אותו לחולים הסובלים מבעיה כבדית מוכחת[63].
- מעכבי mTOR
עד כה נכנסו לשימוש שתי תרופות מקבוצה זו: Torisel ו- Certican.
תכשיר IV הניתן פעם בשבוע (25 מ"ג). במחקר שלב 3 שבוצע ב- 626 חולים בקבוצת סיכון גבוה (כתכשיר קו ראשון) נצפה שיפור בשרידות הכוללת, לעומת קבוצת חולים שטופלה בInterferon alfa (10.9 חודשים לעומת 7.3 חודשים) ובשרידות חופשיה ממחלה (3.8 חודשים לעומת 1.9 חודשים). בקבוצת חולים שבהם נבדק טיפול משולב לא הוכח יתרון בהשוואה ל- Torisel לבד[34].
תופעות לוואי הן: אנמיה, חולשה, היפוגליקמיה, דיסליפידמיה ופנאומוניטיס (בחלק קטן מהחולים).
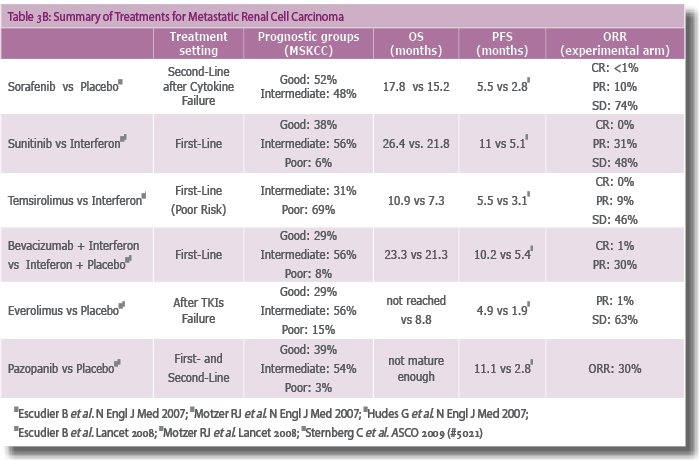
תכשיר פומי. בעבודה שבדקה את פעילות התרופה לעומת אינבו ב- 410 חולים הושג שיפור בשרידות חופשיה ממחלה (4 חודשים לעומת 1.9 בקבוצת אינבו, P<0.001)[64]. תופעות לוואי בולטות הן: סטומטיטיס, פנאומוניטיס, היפוגליקמיה, ולימפופניה (טבלה 3ב).
הטיפול המכוון נגד VEGF ו- mTOR הוכיח יתרון טיפולי משמעותי במחלה גרורתית, המוביל לשליטה טובה יותר בנטל הגידולי הכולל. בעידן האונקולוגיה המודרנית לכל מטופל צרכים ייחודיים ומאתגרים, המחייבים להגדיר את מטרות הטיפול, את יישום הטיפול המתאים וכן לזהות את תופעות הלוואי ולטפל בהן באופן מהיר. ככל שתועמק הבנת המנגנון הביולוגי של RCC ישתלבו הגדלת היעילות הטיפולית וניטור פרופיל הרעילות באופן יעיל יותר במסגרת מחקרים קליניים.
ביבליוגרפיה
- ↑ Jemal A, Siegel R, Ward E, et al. Cancer statistics 2009. Cancer J Clin 2009;59(4):225-249
- ↑ Stafford HS, Saltzstein SL, Shimasaki S, et al. J Urol 2008;179(5):1704-1708
- ↑ Woldrich JM, Mallin K, Ritchey J, et al. Sex differences in renal cell cancer presentation and survival: an analysis of the National Cancer Database, 1993-2004. J Urol 2008;179(5):1709-1713
- ↑ Hunt JD, van der Hel OL, McMillan GP, et al. Renal cell carcinoma in relation to cigarette smoking: meta-analysis of 24 studies. Int J Cancer 2005;114:101-108
- ↑ Yuan JM, Castelao JE, Gago-Dominguez M, et al. Tobacco use in relation to renal cell carcinoma. Cancer Epidemiol Biomarkers Prev 1998;7:429-433
- ↑ van Dijk BA, Schouten LJ, Kiemeney LA, et al. Relation of height, body mass, energy intake, and physical activity to risk of renal cell carcinoma: results from the Netherlands Cohort Study. Am J Epidemiol 2004;160:1159-1167
- ↑ Bjørge T, Tretli S, Engeland A. Relation of height and body mass index to renal cell carcinoma in two million Norwegian men and women. Am J Epidemiol 2004;160:1168-1176
- ↑ Corrao G, Scotti L, Bagnardi V, et al. Hypertension, antihypertensive therapy and renal-cell cancer: a meta-analysis. Curr Drug Saf 2007;2:125-133
- ↑ McCredie M, Pommer W, McLaughlin JK, et al. International renal-cell cancer study. II. Analgesics. Int J Cancer 1995;60:345-349
- ↑ Ishikawa I, Saito Y, Asaka M, et al. Twenty-year follow-up of acquired renal cystic disease. Clin Nephrol 2003;59:153-159
- ↑ Farivar-Mohseni H, Perlmutter AE, Wilson S, et al. Renal cell carcinoma and end stage renal disease. J Urol 2006;175:2018-2020
- ↑ Rakowski SK, Winterkorn EB, Paul E, et al. Renal manifestations of tuberous sclerosis complex: Incidence, prognosis, and predictive factors. Kidney Int 2006;70:1777-1782
- ↑ Linehan WM, Walther MM, Zbar B. The genetic basis of cancer of the kidney. J Urol 2003;170:2163–2172
- ↑ Vira MA, et al. Genetic basis of kidney cancer: a model for developing molecular-targeted therapies. BJU Int 2007;99:1223–1229
- ↑ Maher ER. Inherited renal cell carcinoma. Br J Urol 1996;78:542-545
- ↑ Latif F, Tory K, Gnarra J, et al. Identification of the von Hippel-Lindau disease tumor suppressor gene. Science 1993;260:1317-1320
- ↑ Gudbjartsson T, Jónasdóttir TJ, Thoroddsen A, et al. A population-based familial aggregation analysis indicates genetic contribution in a majority of renal cell carcinomas. Int J Cancer 2002;100:476-479
- ↑ Linehan WM, Walther MM, Zbar B. The genetic basis of cancer of the kidney. J Urol 2003;170:2163-2172
- ↑ Renshaw AA. Subclassification of renal cell neoplasms: an update for the practising pathologist. Histopathology 2002;41:283-300
- ↑ Störkel S, Eble JN, Adlakha K, et al. Classification of renal cell carcinoma: Workgroup No. 1. Union Internationale Contre le Cancer (UICC) and the American Joint Committee on Cancer (AJCC). Cancer 1997;80:987-989
- ↑ Zambrano NR, Lubensky IA, Merino MJ, et al. Histopathology and molecular genetics of renal tumors toward unification of a classification system. J Urol 1999;162:1246-1258
- ↑ Davis CJ, Mostofi FK, Sesterhenn IA. Renal medullary carcinoma. The seventh sickle cell nephropathy. Am J Surg Pathol 1995;19:1-11
- ↑ Cheville JC, Lohse CM, Zincke H, et al. Sarcomatoid renal cell carcinoma: an examination of underlying histologic subtype and an analysis of associations with patient outcome. Am J Surg Pathol 2004;28:435-441
- ↑ Farrow GM, Harrison EG Jr, Utz DC. Sarcomas and sarcomatoid and mixed malignant tumors of the kidney in adults. Cancer 1968;22:556-563
- ↑ Mickisch GH, Garin A, van Poppel H, et al. Radical nephrectomy plus interferon-alfa-based immunotherapy compared with Interferon alfa alone in metastatic renal-cell carcinoma: a randomised trial..Lancet 2001;358:966-970
- ↑ Motzer RJ, Mazumdar M, Bacik J, et al. Survival and prognostic stratification of 670 patients with advanced renal cell carcinoma. J Clin Oncol 1999;17:2530-2540
- ↑ 27.0 27.1 Vasselli JR, Yang JC, Linehan WM, et al. Lack of retroperitoneal lymphadenopathy predicts survival of patients with metastatic renal cell carcinoma. J Urol 2001;166:68-72
- ↑ Elson PJ, Witte RS, Trump DL. Prognostic factors for survival in patients with recurrent or metastatic renal cell carcinoma. Cancer Res 1988;48:7310-7313
- ↑ Motzer RJ, Bukowski RM, Figlin RA, et al. Prognostic nomogram for Sunitinib in patients with metastatic renal cell carcinoma. Cancer 2008;113(7):1552-1558
- ↑ Heng DY, Chi KN, Murray N, et al. A population-based study evaluating the impact of Sunitinib on overall survival in the treatment of patients with metastatic renal cell cancer. Cancer 2009;115(4):776-783
- ↑ Heng DY, Xie W, Regan MM, et al. Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: Results from a large multicenter study (abstract #5041). J Clin Oncol 2009;27:5794-5799
- ↑ 32.0 32.1 Stadler WM, Figlin RA, Ernstoff MS, et al. The Advanced Renal Cell Carcinoma Sorafenib (ARCCS) expanded access trial: Safety and efficacy in patients (pts) with non-clear cell (NCC) renal cell carcinoma (RCC). J Clin Oncol 2007;25:243s
- ↑ 33.0 33.1 Wilhelm SM, Carter C, Tang L, et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis. Cancer Res 2004;64:7099-7109
- ↑ 34.0 34.1 Hudes G, Carducci M, Tomczak P, et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med 2007;356:2271-2281
- ↑ Dutcher, JP, Szczylik, C, Tannir, R, et al. Correlation of survival with tumor histology, age, and prognostic risk group for previously untreated patients with advanced renal cell carcinoma (adv RCC) receiving Temsirolimus (TEMSR) or interferon-alpha (IFN). (Abstract). J Clin Oncol 2007;25:243
- ↑ Choueiri TK, Plantade A, Elson P, et al. Efficacy of Sunitinib and Sorafenib in metastatic papillary and chromophobe renal cell carcinoma. J Clin Oncol 2008;26:127-131
- ↑ Brian I. Rini. metastatic renal cell carcinoma: many treatment options, one patient. J Clin Oncol 2009:3225-3234
- ↑ Flanigan RC, Salmon SE, Blumenstein BA, et al. Nephrectomy followed by interferon alfa-2b compared with interferon alfa-2b alone for metastatic renal-cell cancer. NEJM 2001;345:1655–1659
- ↑ Mickisch GH, Garin A, van Poppel H, et al. Radical nephrectomy plus interferon-alfa-based immunotherapy compared with Interferon alfa alone in metastatic renal-cell carcinoma: A randomised trial. Lancet 2001;358:966–970
- ↑ Flanigan RC, Mickisch G, Sylvester R, et al. Cytoreductive nephrectomy in patients with metastatic renal cancer: A combined analysis. J Urol 2004;171:1071–1076
- ↑ Tatsumi T, Herrem CJ, Olson WC, et al. Disease stage variation in CD4+ and CD8+ T-cell reactivity to the receptor tyrosine kinase EphA2 in patients with renal cell carcinoma. Cancer Res 2003;63:4481–4489
- ↑ Tatsumi T, Kierstead LS, Ranieri E, et al. Disease-associated bias in T helper type 1 (Th1)/Th2 CD4(+) T cell responses against MAGE-6 in HLA-DRB10401(+) patients with renal cell carcinoma or melanoma. J Exp Med 2002;196:619–628
- ↑ Dadian G, Riches PG, Henderson DC, et al. Immunological parameters in peripheral blood of patients with renal cell carcinoma before and after nephrectomy. Br J Urol 1994;74:15–22
- ↑ Gatenby RA, Gawlinski ET, Tangen CM, et al. The possible role of postoperative azotemia in enhanced survival of patients with metastatic renal cancer after cytoreductive nephrectomy. Cancer Res 2002;62:5218–5222
- ↑ Coppin C, Porzsolt F, Awa A, et al. Immunotherapy for advanced renal cell cancer. Cochrane Database Syst Rev 2005;CD001425
- ↑ Interferon-alpha and survival in metastatic renal carcinoma. Early results of a randomised controlled trial: Medical Research Council Renal Cancer Collaborators. Lancet 1999;353:14–17
- ↑ Klapper JA, Downey SG, Smith FO, et al. High-dose interleukin-2 for the treatment of metastatic renal cell carcinoma: A retrospective analysis of response and survival in patients treated in the surgery branch at the National Cancer Institute between 1986 and 2006. Cancer 2008;113:293–301
- ↑ Fyfe G, Fisher RI, Rosenberg SA, et al. Results of treatment of 255 patients with metastatic renal cell carcinoma who received high-dose recombinant interleukin-2 therapy. J Clin Oncol 1995;13:688–696
- ↑ McDermott DF, Regan MM, Clark JI, et al. Randomized phase III trial of high-dose interleukin-2 versus subcutaneous interleukin-2 and interferon in patients with metastatic renal cell carcinoma. J Clin Oncol 2005;23:133–141
- ↑ Yang JC, Sherry RM, Steinberg SM, et al. Randomized study of high-dose and low-dose interleukin-2 in patients with metastatic renal cancer. J Clin Oncol 2003;21:3127–3132
- ↑ Mendel DB, Laird AD, Xin X, et al. In vivo antitumor activity of SU11248, a novel tyrosine kinase inhibitor targeting vascular endothelial growth factor and platelet-derived growth factor receptors: determination of a pharmacokinetic/pharmacodynamic relationship. Clin Cancer Res 2003;9:327-337
- ↑ Abrams TJ, Lee LB, Murray LJ, et al. SU11248 inhibits KIT and platelet-derived growth factor receptor beta in preclinical models of human small cell lung cancer. Mol Cancer Ther 2003;2:471-478
- ↑ Motzer RJ, Rini BI, Bukowski RM, et al. Sunitinib in patients with metastatic renal cell carcinoma. JAMA 2006;295:2516-2524
- ↑ Motzer RJ, Michaelson MD, Redman BG, et al. Activity of SU11248, a multitargeted inhibitor of vascular endothelial growth factor receptor and platelet-derived growth factor receptor, in patients with metastatic renal cell carcinoma. J Clin Oncol 2006;24:16-24
- ↑ Motzer RJ, Hutson TE, Tomczak P, et al. Sunitinib versus Interferon alfa in metastatic renal-cell carcinoma. N Engl J Med 2007;356(2):115-124
- ↑ Motzer RJ, Hutson TE, Tomczak P, et al. Overall survival and updated results for Sunitinib compared with Interferon alfa in patients with metastatic renal cell carcinoma. J Clin Oncol 2009;27:3584-3590
- ↑ Lyons JF, Wilhelm S, Hibner B, et al. Discovery of a novel Raf kinase inhibitor. Endocr Relat Cancer 2001;8:219-225
- ↑ Escudier B, Szczylik C, Hutson TE, et al. Randomized phase II trial of first-line treatment with Sorafenib versus interferon Alfa-2a in patients with metastatic renal cell carcinoma. J Clin Oncol 2009;27:1280-1289
- ↑ Escudier B, Eisen T, Stadler WM, et al. Sorafenib for treatment of renal cell carcinoma: final efficacy and safety results of the phase iii treatment approaches in renal cancer global evaluation trial. J Clin Oncol 2009;27:3312-3318
- ↑ Eisen T, Oudard S, Szczylik C, et al. Sorafenib for older patients with renal cell carcinoma: subset analysis from a randomized trial. J Natl Cancer Inst 2008;100:1454-1463
- ↑ Escudier, BJ, Bellmunt, J, Negrier, S, et al. Final results of the phase III, randomized, double-blind AVOREN trial of first-line Bevacizumab (BEV) + interferon- 945;2a (IFN) in metastatic renal cell carcinoma (mRCC) (abstract #5020). J Clin Oncol 2009; 27:239
- ↑ Rini, BI, Halabi, S, Rosenberg, J, et al. Bevacizumab plus interferon-alpha versus interferon-alpha monotherapy in patients with metastatic renal cell carcinoma: Results of overall survival for CALGB 90206 (abstract #LBA5019). J Clin Oncol 2009;27:798s. (Abstract available on line at: http://www.abstract.asco.org/index2.html, accessed on June 4, 2009)
- ↑ Sternberg, CN, Szczylik, C, Lee, ES, et al. A randomized, double-blind phase III study of Pazopanib in treatment-naive and cytokine-pretreated patients with advanced renal cell carcinoma (RCC) (abstract #5021). J Clin Oncol 2009;27:240s. (Abstract available on line at: http://www.abstract.asco.org/index2.html, accessed on June 4, 2009)
- ↑ Motzer RJ, Escudier B, Oudard S, et al. Efficacy of Everolimus in advanced renal cell carcinoma: a double-blind, randomised, placebo-controlled phase III trial. Lancet. 2008;372:449-456
קישורים חיצוניים
- חידושים בטיפול בסרטן כליה גרורתי, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר ויקטוריה ניימן


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק