הבדלים בין גרסאות בדף "סרטן הריאה - טיפול - Lung cancer - treatment"
| שורה 8: | שורה 8: | ||
|ICD-9= 162 | |ICD-9= 162 | ||
|MeSH= D002283 | |MeSH= D002283 | ||
| − | |יוצר הערך=ד"ר תמי בירנבוים גל וד"ר אליזבטה דודניק | + | |יוצר הערך=ד"ר תמי בירנבוים גל וד"ר אליזבטה דודניק |
|אחראי הערך= | |אחראי הערך= | ||
}} | }} | ||
{{הרחבה|סרטן ריאה}} | {{הרחבה|סרטן ריאה}} | ||
| − | שיעור התחלואה ב'''[[סרטן הריאה]]''' מצוי בעלייה מתמדת, וממאירות זו מהווה | + | שיעור התחלואה ב'''[[סרטן הריאה]]''' מצוי בעלייה מתמדת, וממאירות זו מהווה את גורם התמותה המוביל מסרטן בקרב גברים ונשים כאחד. בישראל מאובחנים מדי שנה יותר מ-2,000 חולי סרטן ריאה חדשים. |
גורם הסיכון העיקרי לסרטן ריאה הוא [[עישון]], אשר מעלה את הסיכון לכל סוגי סרטן הריאה. כ-85 אחוזים מהחולים הם מעשנים או שעישנו בעברם. גורמי סיכון נוספים כוללים עישון סביל (Passive) וחשיפה לאסבסט ([[Asbestos]]), גז רדון ([[Radon]]) וזיהום אוויר. | גורם הסיכון העיקרי לסרטן ריאה הוא [[עישון]], אשר מעלה את הסיכון לכל סוגי סרטן הריאה. כ-85 אחוזים מהחולים הם מעשנים או שעישנו בעברם. גורמי סיכון נוספים כוללים עישון סביל (Passive) וחשיפה לאסבסט ([[Asbestos]]), גז רדון ([[Radon]]) וזיהום אוויר. | ||
| − | התסמינים השכיחים של סרטן ריאה כוללים [[שיעול]], [[קוצר נשימה]], [[כיח דמי]], [[כאבים בחזה]] ו[[דלקות ריאה]] נשנות. האבחנה מבוצעת בדרך כלל על ידי נטילת ביופסיה באמצעות בדיקת [[ברונכוסקופיה|שקיפת סימפונות]] (Bronchoscopy) או דיקור מונחה [[תהודה מגנטית]] (Computed Tomography guided lung biopsy), אשר באמצעותם ניתן לקבוע גם את סוג הגידול המסוים {{הערה|שם=הערה1|http://www.seer.cancer.gov/statfacts/html/lungb.html.}}. | + | התסמינים השכיחים של סרטן ריאה כוללים [[שיעול]], [[קוצר נשימה]], [[כיח דמי]], [[כאבים בחזה]] ו[[דלקות ריאה]] נשנות. האבחנה מבוצעת בדרך כלל על ידי נטילת ביופסיה באמצעות בדיקת [[ברונכוסקופיה|שקיפת סימפונות]] (Bronchoscopy) או דיקור מונחה [[תהודה מגנטית]] (Computed Tomography guided lung biopsy), אשר באמצעותם ניתן לקבוע גם את סוג הגידול המסוים{{הערה|שם=הערה1|http://www.seer.cancer.gov/statfacts/html/lungb.html.}}. |
| − | + | מאז תחילת המאה ה-21 חלה התקדמות בשטח הטיפול בסרטן הריאות, כאשר הדגש מושם על טיפולים הממוקדים לפגיעה בתאים הסרטניים המותאמים לכל מטופל על פי מאפיינים גידוליים ייחודיים. | |
==סוגי סרטן הריאה== | ==סוגי סרטן הריאה== | ||
| שורה 23: | שורה 23: | ||
[[קובץ:סוגי סרטן ריאה.png|מרכז|520 פיקסלים]] | [[קובץ:סוגי סרטן ריאה.png|מרכז|520 פיקסלים]] | ||
| − | בנוסף לקביעת הסוג ההיסטולוגי (Histological) של הגידול, נערכת | + | בנוסף לקביעת הסוג ההיסטולוגי (Histological) של הגידול, נערכת בדיקה לתאי הגידול לנוכחות מוטציה (Mutation) בקולטן לגורם גדילה אפידרמלי (EGFR {{כ}},Epidermal Growth Factor Receptor), אשר קיימת בכ-15 אחוזים מחולי [[סרטן ריאה - Lung Cancer#אפידמיולוגיה|סרטן ריאה של תאים שאינם קטנים]] (NSCLC {{כ}},Non-Small-Cell Lung Carcinoma). נוכחות תשנית זו חשובה לצורך בחירת הטיפול המערכתי המתאים ביותר לחולים בשלב מחלה מתקדם. |
המוטציה מביאה לפעילות יתר של הקולטן אליו נקשר גורם הגדילה, ובעקבות כך מופעלת שרשרת של תהליכים אשר מעודדים את גדילת והתרבות התאים הממאירים והתפתחות גרורות. | המוטציה מביאה לפעילות יתר של הקולטן אליו נקשר גורם הגדילה, ובעקבות כך מופעלת שרשרת של תהליכים אשר מעודדים את גדילת והתרבות התאים הממאירים והתפתחות גרורות. | ||
| − | קבוצת החולים בעלי השתנית ב-[[EGFR]]{{כ}} (Epidermal Growth Factor Receptor) מפיקה תועלת קלינית ייחודית מטיפול התחלתי עם תרופות מקבוצת מעכבי Tyrosine-Kinase{{כ}} ([[TKI]] {{כ}},Tyrosine-Kinase Inhibitors), המהווים | + | קבוצת החולים בעלי השתנית ב-[[EGFR]]{{כ}} (Epidermal Growth Factor Receptor) מפיקה תועלת קלינית ייחודית מטיפול התחלתי עם תרופות מקבוצת מעכבי Tyrosine-Kinase{{כ}} ([[TKI]] {{כ}},Tyrosine-Kinase Inhibitors), המהווים את טיפול הבחירה בקו ראשון בחולים אלו. |
==שלבי המחלה== | ==שלבי המחלה== | ||
| − | דירוג התפשטות המחלה (Staging) נקבע על סך שלושה מאפיינים {{הערה|שם=הערה2|NCCN guidelines version I 2011 Tarceva.}}: | + | דירוג התפשטות המחלה (Staging) נקבע על סך שלושה מאפיינים{{הערה|שם=הערה2|NCCN guidelines version I 2011 Tarceva.}}: |
*'''T:''' מידת החדירה של הגידול הראשוני. | *'''T:''' מידת החדירה של הגידול הראשוני. | ||
*'''N:''' מיקום בלוטות הלימפה המעורבות. | *'''N:''' מיקום בלוטות הלימפה המעורבות. | ||
| שורה 36: | שורה 36: | ||
==עקרונות הטיפול ופרוגנוזה== | ==עקרונות הטיפול ופרוגנוזה== | ||
| − | הטיפול נקבע בהתאם לשלב המחלה ומשלב ניתוח''',''' קרינה, [[כימותרפיה]] (Chemotherapy), אימונותרפיה (Immunotherapy), טיפול ביולוגי (Biological) מכוון מטרה וטיפול תומך (Palliative care) לפי הצורך. במרבית המקרים (מלבד השלבים המוקדמים של המחלה בהם עיקר הטיפול הוא ניתוחי או קרינתי הניתן לבדו), הטיפול בסרטן ריאה משלב שיטות טיפול שונות (Multi-modality treatment){{כ}}{{הערה|שם=הערה3|Postmus PE, Kerr KM, Oudkerk M, et al. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28 Suppl 4:iv1-iv21. doi:10.1093/annonc/mdx222}}. | + | הטיפול נקבע בהתאם לשלב המחלה ומשלב ניתוח''',''' קרינה, [[כימותרפיה]] (Chemotherapy), אימונותרפיה (Immunotherapy), טיפול ביולוגי (Biological) מכוון מטרה וטיפול תומך (Palliative care) לפי הצורך. במרבית המקרים (מלבד השלבים המוקדמים של המחלה בהם עיקר הטיפול הוא ניתוחי או קרינתי הניתן לבדו), הטיפול בסרטן ריאה משלב שיטות טיפול שונות (Multi-modality treatment){{כ}}{{הערה|שם=הערה3|Postmus PE, Kerr KM, Oudkerk M, et al. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28 Suppl 4:iv1-iv21. doi:10.1093/annonc/mdx222}}. |
=== טיפול כימותרפי === | === טיפול כימותרפי === | ||
| − | משלבים מבוססי-פלטינום (Platinum-based antineoplastic) הכוללים [[Cisplatin]]{{כ}} ([[Abiplatin]]) | + | משלבים מבוססי-פלטינום (Platinum-based antineoplastic) הכוללים [[Cisplatin]]{{כ}} ([[Abiplatin]])} או{{כ}} [[Carboplatin]] הניתנים עם אחת מבין התרופות הבאות: [[Vinblastine]],{{כ}} ([[Blastovin]]){{כ}}, [[Vinorelbine]], ({{כ}}[[Navelbine]]){{כ}}, [[Pemetrexed]], {{כ}}([[Alimta]]),{{כ}} [[Etoposide]],{{כ}} [[Paclitaxel]],{{כ}} [[Gemcitabine]] או [[Docetaxel]]. |
| − | ([[Blastovin]]) | ||
| − | בטיפול בקו ראשון בחולים עם מחלה מתקדמת, ניתן להוסיף למשלב גם [[Bevacizumab]]{{כ}} ([[Avastin]] | + | בטיפול בקו ראשון בחולים עם מחלה מתקדמת, ניתן להוסיף למשלב גם [[Bevacizumab]]{{כ}} ([[Avastin]]). |
| − | לאחר התקדמות המחלה ניתן בדרך כלל טיפול עם תרופה כימותרפית בודדת או TKI | + | לאחר התקדמות המחלה ניתן בדרך כלל טיפול עם תרופה כימותרפית בודדת או TKI. |
=== חידושים בטיפול בשלב מתקדם === | === חידושים בטיפול בשלב מתקדם === | ||
| − | יותר ממחצית מחולי סרטן ריאה מאובחנים בשלב שבו המחלה התפשטה לאיברים מרוחקים, כגון שלד, ריאה, כבד, בלוטות יותרת הכליה ומוח .עד לפני כעשור, הגישה הטיפולית בשלב זה התבססה על טיפול כימותרפי. שינוי מהפכני שחל בעשור השני של המאה ה-21 הביא לשיפור משמעותי בתחזית כלל התפחות שיטות הטיפול בשני כיוונים עיקריים: | + | יותר ממחצית מחולי סרטן ריאה מאובחנים בשלב שבו המחלה התפשטה לאיברים מרוחקים, כגון שלד, ריאה, כבד, בלוטות יותרת הכליה ומוח .עד לפני כעשור, הגישה הטיפולית בשלב זה התבססה על טיפול כימותרפי. שינוי מהפכני שחל בעשור השני של המאה ה-21 הביא לשיפור משמעותי בתחזית כלל התפחות שיטות הטיפול בשני כיוונים עיקריים: |
| − | #'''טיפולים ביולוגים מכווני מטרה''' – השיטה כאן מבוססת על זיהוי של המנגנון המולקולרי (Molecular) שאחראי על התפתחות הסרטן (Driver mutation) ושימוש בטיפול ביולוגי מכוון כנגד מנגנון משפעל | + | #'''טיפולים ביולוגים מכווני מטרה''' – השיטה כאן מבוססת על זיהוי של המנגנון המולקולרי (Molecular) שאחראי על התפתחות הסרטן (Driver mutation) ושימוש בטיפול ביולוגי מכוון כנגד מנגנון משפעל |
#'''טיפולים אימונותרפיים''' על ידי מעכבי נקודות בקרה חיסונית (Immune check-point inhibitors) - השיטה שמורידה את השפעתם של הגורמים המעכבים ממערכת החיסון של הגוף ועל ידי כך מאפשרת לה תקוף את הגידול הסרטני | #'''טיפולים אימונותרפיים''' על ידי מעכבי נקודות בקרה חיסונית (Immune check-point inhibitors) - השיטה שמורידה את השפעתם של הגורמים המעכבים ממערכת החיסון של הגוף ועל ידי כך מאפשרת לה תקוף את הגידול הסרטני | ||
==== טיפולים ביולוגים מכווני מטרה ==== | ==== טיפולים ביולוגים מכווני מטרה ==== | ||
| − | מדובר בטיפול ביולוגי מותאם אישית, שהתאפשר בזכות זיהוי של מוטציות (Mutations) משפעלות בתאי הגידול (כגון מוטציות בגנים (Genes){{כ}} EGFR{{כ}}{{כ}}, [[ROS-1]]{{כ}}, [[ALK]]{{כ}} (Anaplastic Lymphoma Kinase){{כ}}, [[NTRK]]{{כ}} (Neurotrophin Tyrosine Kinases){{כ}}, [[BRAF]]{{כ}}, [[c-MET]]{{כ}}, [[RET]]{{כ}} (REarranged during Transfection) ו-[[HER-2|HER-2{{כ}}]] (Human Epidermal Growth factor Receptor 2) ופיתוח תרופות הפועלות נגד המוטציות הללו. כך, כ- | + | מדובר בטיפול ביולוגי מותאם אישית, שהתאפשר בזכות זיהוי של מוטציות (Mutations) משפעלות בתאי הגידול (כגון מוטציות בגנים (Genes){{כ}} EGFR{{כ}}{{כ}}, [[ROS-1]]{{כ}}, [[ALK]]{{כ}} (Anaplastic Lymphoma Kinase){{כ}}, [[NTRK]]{{כ}} (Neurotrophin Tyrosine Kinases){{כ}}, [[BRAF]]{{כ}}, [[c-MET]]{{כ}}, [[RET]]{{כ}} (REarranged during Transfection) ו-[[HER-2|HER-2{{כ}}]] (Human Epidermal Growth factor Receptor 2) ופיתוח תרופות הפועלות נגד המוטציות הללו. כך, כ-30–40 אחוזים מגידולי ריאה גרורתיים מסוג Adenocarcinoma עשויים להיות גידולים נושאי מוטציה הפעלתית, שכנגדה קיימים טיפולים ממוקדי מטרה הניתנים בצורת פומית. לאורך השנים, פותחו דורות חדשים של תכשירים ביולוגיים עבור המוטציות הללו, לרבות תכשירים שמסוגלים להתמודד עם מנגנוני העמידות הנרכשת (עמידות שמפתחים תאי סרטניים במהלך הטיפול) ומאפשרים מתן מספר טיפולים ביולוגיים ברצף אחד לאחר השני. כך לדוגמה, פותחו כבר מספר דורות מעכבי EGFR (כגון [[T:Gefitinib|Gefitinib]]{{כ}}, [[Erlotinib]]{{כ}}, [[T:Afatinib|Afatinib]]{{כ}}, [[Osimertinib]]), מעכבי ALK{{כ}} ([[Crizotinib]]{{כ}}, [[Alectinib]]{{כ}}, [[T:Ceritinib|Ceritinib]]{{כ}}, [[Brigatinib) Alunbrig) - מעכב ALK מהדור החדש - ALK inhibitor of the new generation|Brigatinib]]{{כ}}, [[T:Lorlatinib|Lorlatinib]]) מעכבי ROS-1{{כ}} (Crizotinib{{כ}}, [[T:Entrectinib|Entrectinib]]{{כ}}, [[T:Repotrectinib|Repotrectinib]]{{כ}}, [[T:Lorlatinib|Lorlatinib]]) ומעכבי c-MET{{כ}} (Crizotinib{{כ}}, [[T:Capmatinib|Capmatinib]]{{כ}}, [[T:Tepotinib|Tepotinib]]{{כ}}, [[T:Savolitinib|Savolitinib]]). טיפולים אלה שינו לטובה את מהלך המחלה בחולים שגידולם נושא מוטציה משפעלת, איפשרו לחלק מהחולים לשרוד 5 שנים ואף יותר{{הערה|שם=הערה4|Mok T, Camidge DR, Gadgeel SM, et al. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study. Ann Oncol. 2020;31(8):1056-1064. doi:10.1016/j.annonc.2020.04.478}}, וכן שיפרו משמעותית את איכות חייהם. |
'''בחירת החולים''' | '''בחירת החולים''' | ||
| − | בחירת חולים שמתאימים לטיפולים מכווני מטרה היא קריטית, וכדי למצוא את המוטציה ההפעלתית בגידול מסוים מומלץ לבצע אבחון מולקולרי מעמיק עם תיעדוף לשיטות שמבוססות על ריצוף גנומי (Genomic sequencing) מהדור החדש - | + | בחירת חולים שמתאימים לטיפולים מכווני מטרה היא קריטית, וכדי למצוא את המוטציה ההפעלתית בגידול מסוים מומלץ לבצע אבחון מולקולרי מעמיק עם תיעדוף לשיטות שמבוססות על ריצוף גנומי (Genomic sequencing) מהדור החדש - Next Generation Sequencing) NGS) . בדיקות אלה, המכונות בדיקות גנומיות מקיפות, מאבחנות את הפרופיל המולקולרי (Molecular profile) של הגידול, ובאמצעות ריצוף של מאות גנים במקביל הן מתאימות בצורה מדויקת יותר אפשרויות טיפול ממוקד המכוונות כנגד המוטציות ההפעלתיות. |
==== טיפולים אימונותרפיים ==== | ==== טיפולים אימונותרפיים ==== | ||
| − | אחד מהמאפיינים של סוגי סרטן רבים הוא שהתאים הסרטניים מוצאים דרך להתחמק מתגובת מערכת החיסון. {{ש}}אימונותרפיה חדישה ״מורידה את הבלמים״ ממערכת החיסון וכך מגבירה את יכולת מערכת החיסון להילחם בסרטן. אימונתרפיה היוותה פריצת דרך משמעותית בטיפול בסרטן ריאה מתקדם. כך לדוגמה, בסרטן ריאה מתקדם מסוג NSCLC, מחקרים רבים הוכיחו כי מתן אימונותרפיה בהשוואה למתן כימותרפיה מביא להישרדות ארוכה יותר {{הערה|שם=הערה5|Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016;375(19):1823-1833. doi:10.1056/NEJMoa1606774}}, רעילות קלה יותר ואיכות חיים טובה יותר {{הערה|שם=הערה6|Brahmer JR, Rodríguez-Abreu D, Robinson AG, et al. Health-related quality-of-life results for pembrolizumab versus chemotherapy in advanced, PD-L1-positive NSCLC (KEYNOTE-024): a multicentre, international, randomised, open-label phase 3 trial. Lancet Oncol. 2017;18(12):1600-1609. doi:10.1016/S1470-2045(17)30690-3}} | + | אחד מהמאפיינים של סוגי סרטן רבים הוא שהתאים הסרטניים מוצאים דרך להתחמק מתגובת מערכת החיסון. {{ש}}אימונותרפיה חדישה ״מורידה את הבלמים״ ממערכת החיסון וכך מגבירה את יכולת מערכת החיסון להילחם בסרטן. אימונתרפיה היוותה פריצת דרך משמעותית בטיפול בסרטן ריאה מתקדם. כך לדוגמה, בסרטן ריאה מתקדם מסוג NSCLC, מחקרים רבים הוכיחו כי מתן אימונותרפיה בהשוואה למתן כימותרפיה מביא להישרדות ארוכה יותר{{הערה|שם=הערה5|Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016;375(19):1823-1833. doi:10.1056/NEJMoa1606774}}, רעילות קלה יותר ואיכות חיים טובה יותר {{הערה|שם=הערה6|Brahmer JR, Rodríguez-Abreu D, Robinson AG, et al. Health-related quality-of-life results for pembrolizumab versus chemotherapy in advanced, PD-L1-positive NSCLC (KEYNOTE-024): a multicentre, international, randomised, open-label phase 3 trial. Lancet Oncol. 2017;18(12):1600-1609. doi:10.1016/S1470-2045(17)30690-3}}{{הערה|שם=הערה7|Reck M, Schenker M, Lee KH, et al. Nivolumab plus ipilimumab versus chemotherapy as first-line treatment in advanced non-small-cell lung cancer with high tumour mutational burden: patient-reported outcomes results from the randomised, open-label, phase III CheckMate 227 trial. Eur J Cancer. 2019;116:137-147. doi:10.1016/j.ejca.2019.05.008}}, היתרון הבולט של אימונותרפיה הוא בעובדה כי המטופלים שמגיבים לטיפול עשויים לשרוד שנים ארוכות. כך לדוגמה, 25-14 אחוזים, בהתאם לדרגת הביטוי של PD-L1 {{כ}}(Programmed Death Ligand-1) בתאי הגידול מהחולים עם NSCLC בשלב מתקדם עשויים לשרוד 4 שנים ויותר ממועד תחילת אימונותרפיה{{הערה|שם=הערה8|Antonia SJ, Borghaei H, Ramalingam SS, et al. Four-year survival with nivolumab in patients with previously treated advanced non-small-cell lung cancer: a pooled analysis. Lancet Oncol. 2019;20(10):1395-1408. doi:10.1016/S1470-2045(19)30407-3}}{{הערה|שם=הערה9|Garon EB, Hellmann MD, Rizvi NA, et al. Five-Year Overall Survival for Patients With Advanced Non‒Small-Cell Lung Cancer Treated With Pembrolizumab: Results From the Phase I KEYNOTE-001 Study. J Clin Oncol. 2019;37(28):2518-2527. doi:10.1200/JCO.19.00934}}, |
==ביבליוגרפיה== | ==ביבליוגרפיה== | ||
גרסה מ־19:13, 28 בספטמבר 2020
| סרטן הריאה - טיפול | ||
|---|---|---|
| Lung cancer - treatment | ||
| ICD-10 | C33-C34 | |
| ICD-9 | 162 | |
| MeSH | D002283 | |
| יוצר הערך | ד"ר תמי בירנבוים גל וד"ר אליזבטה דודניק | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן ריאה
שיעור התחלואה בסרטן הריאה מצוי בעלייה מתמדת, וממאירות זו מהווה את גורם התמותה המוביל מסרטן בקרב גברים ונשים כאחד. בישראל מאובחנים מדי שנה יותר מ-2,000 חולי סרטן ריאה חדשים.
גורם הסיכון העיקרי לסרטן ריאה הוא עישון, אשר מעלה את הסיכון לכל סוגי סרטן הריאה. כ-85 אחוזים מהחולים הם מעשנים או שעישנו בעברם. גורמי סיכון נוספים כוללים עישון סביל (Passive) וחשיפה לאסבסט (Asbestos), גז רדון (Radon) וזיהום אוויר. התסמינים השכיחים של סרטן ריאה כוללים שיעול, קוצר נשימה, כיח דמי, כאבים בחזה ודלקות ריאה נשנות. האבחנה מבוצעת בדרך כלל על ידי נטילת ביופסיה באמצעות בדיקת שקיפת סימפונות (Bronchoscopy) או דיקור מונחה תהודה מגנטית (Computed Tomography guided lung biopsy), אשר באמצעותם ניתן לקבוע גם את סוג הגידול המסוים[1].
מאז תחילת המאה ה-21 חלה התקדמות בשטח הטיפול בסרטן הריאות, כאשר הדגש מושם על טיפולים הממוקדים לפגיעה בתאים הסרטניים המותאמים לכל מטופל על פי מאפיינים גידוליים ייחודיים.
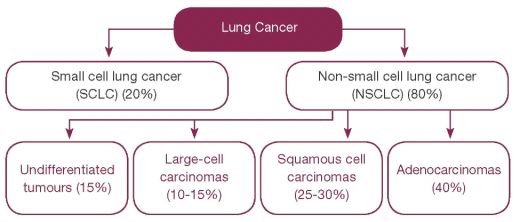
סוגי סרטן הריאה
ניתן לסווג את הגידולים הממאירים בריאה על סמך מאפיינים היסטולוגיים:
בנוסף לקביעת הסוג ההיסטולוגי (Histological) של הגידול, נערכת בדיקה לתאי הגידול לנוכחות מוטציה (Mutation) בקולטן לגורם גדילה אפידרמלי (EGFR ,Epidermal Growth Factor Receptor), אשר קיימת בכ-15 אחוזים מחולי סרטן ריאה של תאים שאינם קטנים (NSCLC ,Non-Small-Cell Lung Carcinoma). נוכחות תשנית זו חשובה לצורך בחירת הטיפול המערכתי המתאים ביותר לחולים בשלב מחלה מתקדם.
המוטציה מביאה לפעילות יתר של הקולטן אליו נקשר גורם הגדילה, ובעקבות כך מופעלת שרשרת של תהליכים אשר מעודדים את גדילת והתרבות התאים הממאירים והתפתחות גרורות.
קבוצת החולים בעלי השתנית ב-EGFR (Epidermal Growth Factor Receptor) מפיקה תועלת קלינית ייחודית מטיפול התחלתי עם תרופות מקבוצת מעכבי Tyrosine-Kinase (TKI ,Tyrosine-Kinase Inhibitors), המהווים את טיפול הבחירה בקו ראשון בחולים אלו.
שלבי המחלה
דירוג התפשטות המחלה (Staging) נקבע על סך שלושה מאפיינים[2]:
- T: מידת החדירה של הגידול הראשוני.
- N: מיקום בלוטות הלימפה המעורבות.
- M: הימצאות גרורות מרוחקות.
עקרונות הטיפול ופרוגנוזה
הטיפול נקבע בהתאם לשלב המחלה ומשלב ניתוח, קרינה, כימותרפיה (Chemotherapy), אימונותרפיה (Immunotherapy), טיפול ביולוגי (Biological) מכוון מטרה וטיפול תומך (Palliative care) לפי הצורך. במרבית המקרים (מלבד השלבים המוקדמים של המחלה בהם עיקר הטיפול הוא ניתוחי או קרינתי הניתן לבדו), הטיפול בסרטן ריאה משלב שיטות טיפול שונות (Multi-modality treatment)[3].
טיפול כימותרפי
משלבים מבוססי-פלטינום (Platinum-based antineoplastic) הכוללים Cisplatin (Abiplatin)} או Carboplatin הניתנים עם אחת מבין התרופות הבאות: Vinblastine, (Blastovin), Vinorelbine, (Navelbine), Pemetrexed, (Alimta), Etoposide, Paclitaxel, Gemcitabine או Docetaxel.
בטיפול בקו ראשון בחולים עם מחלה מתקדמת, ניתן להוסיף למשלב גם Bevacizumab (Avastin).
לאחר התקדמות המחלה ניתן בדרך כלל טיפול עם תרופה כימותרפית בודדת או TKI.
חידושים בטיפול בשלב מתקדם
יותר ממחצית מחולי סרטן ריאה מאובחנים בשלב שבו המחלה התפשטה לאיברים מרוחקים, כגון שלד, ריאה, כבד, בלוטות יותרת הכליה ומוח .עד לפני כעשור, הגישה הטיפולית בשלב זה התבססה על טיפול כימותרפי. שינוי מהפכני שחל בעשור השני של המאה ה-21 הביא לשיפור משמעותי בתחזית כלל התפחות שיטות הטיפול בשני כיוונים עיקריים:
- טיפולים ביולוגים מכווני מטרה – השיטה כאן מבוססת על זיהוי של המנגנון המולקולרי (Molecular) שאחראי על התפתחות הסרטן (Driver mutation) ושימוש בטיפול ביולוגי מכוון כנגד מנגנון משפעל
- טיפולים אימונותרפיים על ידי מעכבי נקודות בקרה חיסונית (Immune check-point inhibitors) - השיטה שמורידה את השפעתם של הגורמים המעכבים ממערכת החיסון של הגוף ועל ידי כך מאפשרת לה תקוף את הגידול הסרטני
טיפולים ביולוגים מכווני מטרה
מדובר בטיפול ביולוגי מותאם אישית, שהתאפשר בזכות זיהוי של מוטציות (Mutations) משפעלות בתאי הגידול (כגון מוטציות בגנים (Genes) EGFR, ROS-1, ALK (Anaplastic Lymphoma Kinase), NTRK (Neurotrophin Tyrosine Kinases), BRAF, c-MET, RET (REarranged during Transfection) ו-HER-2 (Human Epidermal Growth factor Receptor 2) ופיתוח תרופות הפועלות נגד המוטציות הללו. כך, כ-30–40 אחוזים מגידולי ריאה גרורתיים מסוג Adenocarcinoma עשויים להיות גידולים נושאי מוטציה הפעלתית, שכנגדה קיימים טיפולים ממוקדי מטרה הניתנים בצורת פומית. לאורך השנים, פותחו דורות חדשים של תכשירים ביולוגיים עבור המוטציות הללו, לרבות תכשירים שמסוגלים להתמודד עם מנגנוני העמידות הנרכשת (עמידות שמפתחים תאי סרטניים במהלך הטיפול) ומאפשרים מתן מספר טיפולים ביולוגיים ברצף אחד לאחר השני. כך לדוגמה, פותחו כבר מספר דורות מעכבי EGFR (כגון Gefitinib, Erlotinib, Afatinib, Osimertinib), מעכבי ALK (Crizotinib, Alectinib, Ceritinib, Brigatinib, Lorlatinib) מעכבי ROS-1 (Crizotinib, Entrectinib, Repotrectinib, Lorlatinib) ומעכבי c-MET (Crizotinib, Capmatinib, Tepotinib, Savolitinib). טיפולים אלה שינו לטובה את מהלך המחלה בחולים שגידולם נושא מוטציה משפעלת, איפשרו לחלק מהחולים לשרוד 5 שנים ואף יותר[4], וכן שיפרו משמעותית את איכות חייהם.
בחירת החולים
בחירת חולים שמתאימים לטיפולים מכווני מטרה היא קריטית, וכדי למצוא את המוטציה ההפעלתית בגידול מסוים מומלץ לבצע אבחון מולקולרי מעמיק עם תיעדוף לשיטות שמבוססות על ריצוף גנומי (Genomic sequencing) מהדור החדש - Next Generation Sequencing) NGS) . בדיקות אלה, המכונות בדיקות גנומיות מקיפות, מאבחנות את הפרופיל המולקולרי (Molecular profile) של הגידול, ובאמצעות ריצוף של מאות גנים במקביל הן מתאימות בצורה מדויקת יותר אפשרויות טיפול ממוקד המכוונות כנגד המוטציות ההפעלתיות.
טיפולים אימונותרפיים
אחד מהמאפיינים של סוגי סרטן רבים הוא שהתאים הסרטניים מוצאים דרך להתחמק מתגובת מערכת החיסון.
אימונותרפיה חדישה ״מורידה את הבלמים״ ממערכת החיסון וכך מגבירה את יכולת מערכת החיסון להילחם בסרטן. אימונתרפיה היוותה פריצת דרך משמעותית בטיפול בסרטן ריאה מתקדם. כך לדוגמה, בסרטן ריאה מתקדם מסוג NSCLC, מחקרים רבים הוכיחו כי מתן אימונותרפיה בהשוואה למתן כימותרפיה מביא להישרדות ארוכה יותר[5], רעילות קלה יותר ואיכות חיים טובה יותר [6][7], היתרון הבולט של אימונותרפיה הוא בעובדה כי המטופלים שמגיבים לטיפול עשויים לשרוד שנים ארוכות. כך לדוגמה, 25-14 אחוזים, בהתאם לדרגת הביטוי של PD-L1 (Programmed Death Ligand-1) בתאי הגידול מהחולים עם NSCLC בשלב מתקדם עשויים לשרוד 4 שנים ויותר ממועד תחילת אימונותרפיה[8][9],
ביבליוגרפיה
- ↑ http://www.seer.cancer.gov/statfacts/html/lungb.html.
- ↑ NCCN guidelines version I 2011 Tarceva.
- ↑ Postmus PE, Kerr KM, Oudkerk M, et al. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28 Suppl 4:iv1-iv21. doi:10.1093/annonc/mdx222
- ↑ Mok T, Camidge DR, Gadgeel SM, et al. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study. Ann Oncol. 2020;31(8):1056-1064. doi:10.1016/j.annonc.2020.04.478
- ↑ Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016;375(19):1823-1833. doi:10.1056/NEJMoa1606774
- ↑ Brahmer JR, Rodríguez-Abreu D, Robinson AG, et al. Health-related quality-of-life results for pembrolizumab versus chemotherapy in advanced, PD-L1-positive NSCLC (KEYNOTE-024): a multicentre, international, randomised, open-label phase 3 trial. Lancet Oncol. 2017;18(12):1600-1609. doi:10.1016/S1470-2045(17)30690-3
- ↑ Reck M, Schenker M, Lee KH, et al. Nivolumab plus ipilimumab versus chemotherapy as first-line treatment in advanced non-small-cell lung cancer with high tumour mutational burden: patient-reported outcomes results from the randomised, open-label, phase III CheckMate 227 trial. Eur J Cancer. 2019;116:137-147. doi:10.1016/j.ejca.2019.05.008
- ↑ Antonia SJ, Borghaei H, Ramalingam SS, et al. Four-year survival with nivolumab in patients with previously treated advanced non-small-cell lung cancer: a pooled analysis. Lancet Oncol. 2019;20(10):1395-1408. doi:10.1016/S1470-2045(19)30407-3
- ↑ Garon EB, Hellmann MD, Rizvi NA, et al. Five-Year Overall Survival for Patients With Advanced Non‒Small-Cell Lung Cancer Treated With Pembrolizumab: Results From the Phase I KEYNOTE-001 Study. J Clin Oncol. 2019;37(28):2518-2527. doi:10.1200/JCO.19.00934


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק