הבדלים בין גרסאות בדף "סרטן הריאות - בדיקות סקר וטיפולים חדשניים - Lung cancer - screening and new treatments"
| שורה 1: | שורה 1: | ||
{{מחלה | {{מחלה | ||
| − | |תמונה= | + | |תמונה=Lung cancer.jpg |
|כיתוב תמונה= | |כיתוב תמונה= | ||
|שם עברי= סרטן הריאות - בדיקות סקר וטיפולים חדשניים | |שם עברי= סרטן הריאות - בדיקות סקר וטיפולים חדשניים | ||
| שורה 12: | שורה 12: | ||
}} | }} | ||
{{הרחבה|סרטן ריאה}} | {{הרחבה|סרטן ריאה}} | ||
| − | '''[[סרטן הריאה]]''' מהווה את אחד הגידולים הנפוצים ביותר בעולם, והוא בעל שיעור התמותה הגבוה ביותר מביניהם. בשנת 2013 אובחנו 228,190 מקרים חדשים בארצות הברית, ו- 159,480 חולים נפטרו כתוצאה מהמחלה{{הערה|שם=הערה1|[http://seer.cancer.gov/statfacts/html/lungb.html SEER Stat Fact Sheets: Lung and Bronchus Cancer]}}. בישראל מאובחנים | + | '''[[סרטן הריאה]]''' מהווה את אחד הגידולים הנפוצים ביותר בעולם, והוא בעל שיעור התמותה הגבוה ביותר מביניהם. בשנת 2013 אובחנו 228,190 מקרים חדשים בארצות הברית, ו- 159,480 חולים נפטרו כתוצאה מהמחלה{{הערה|שם=הערה1|[http://seer.cancer.gov/statfacts/html/lungb.html SEER Stat Fact Sheets: Lung and Bronchus Cancer]}}. בישראל מאובחנים כ־1,500 איש מדי שנה. |
| − | קיימים מספר גורמי סיכון להתפתחות סרטן ריאות. העיקרי מביניהם הוא [[עישון]], כתלות במספר שנות העישון ובכמות הסיגריות ליום. גורמי סיכון נוספים הם חשיפה תעסוקתית (כגון | + | קיימים מספר גורמי סיכון להתפתחות סרטן ריאות. העיקרי מביניהם הוא [[עישון]], כתלות במספר שנות העישון ובכמות הסיגריות ליום. גורמי סיכון נוספים הם חשיפה תעסוקתית (כגון לאזבסט, סיליקה ורדון) וחשיפה לקרינה מייננת. |
==סיווג הגידולים== | ==סיווג הגידולים== | ||
| + | כ־85 אחוזים ממקרי סרטן ריאה הם מסוג '''תאים שאינם קטנים''' (NSCLC {{כ}},Non-Small-Cell Lung Carcinoma). סוג זה מורכב ממספר תתי-סוגים היסטולוגיים: | ||
| + | *'''סרטן ריאה מסוג אדנוקרצינומה (Adenocarcinoma):''' שכיחותו נמצאת במגמת עלייה, והוא מהווה כ-40 אחוזים מכלל סרטני הריאה של תאים שאינם קטנים. מקור הגידול הוא בדרכי האוויר הקטנות, ולפיכך מדובר בגידולים היקפיים (Peripheral) יחסית. מבחינה אימונוהיסטוכימית (Immunohistochemistry), גידולים אלו חיוביים לגורם השעתוק של בלוטת התריס 1 (1{{כ}}TTF {{כ}},Thyroid Transcription Factor 1), חיוביים לציטוקרטין 7 (7{{כ}}Ck {{כ}},7 {{כ}}Cytokeratin) ושליליים לציטוקרטין 20 (20{{כ}}Ck {{כ}},20 {{כ}}Cytokeratin). | ||
| + | *'''סרטן ריאה קשקשי (Squamous):''' שכיחותו היחסית נמצאת במגמת ירידה, והוא מהווה כ־20 עד 30 אחוזים מכלל סרטני הריאה של תאים שאינם קטנים. מקור הגידול בסימפונות הגדולים, ולרוב מיקומם מרכזי וקרוב למיצר. מבחינה אימונוהיסטוכימית, הגידולים בדרך כלל שליליים ל־1{{כ}}TTF,{{כ}} 7{{כ}}Ck ו- {{כ}}20{{כ}}Ck, וחיוביים לציטוקרטין 5 (5{{כ}}Ck {{כ}},5 {{כ}}Cytokeratin), ציטוקרטין 6 (6{{כ}}Ck {{כ}},6 {{כ}}Cytokeratin) ול־63{{כ}}P. | ||
| + | *'''אחרים:''' קרצינומה של תאים גדולים (Large cell carcinoma){{כ}}- מהווה 15 אחוזים מכלל גידולי הריאה של תאים שאינם קטנים, אדנוקרצינומה נחה (Adenocarcinoma in situ) - או בשמה הקודם - קרצינומה של הסימפונות ובועיות האוויר (Bronchioloalveolar carcinoma), {{כ}}קרצינומה אדנו-קשקשית (Adenosquamous) וסוגים נוספים. | ||
| − | + | שאר המקרים (כ-15 אחוזים) כוללים '''סרטן ריאה מסוג תאים קטנים''' (SCLC {{כ}},Small Cell Lung Cancer). | |
| − | |||
| − | |||
| − | |||
| − | + | סוגים אחרים של סרטן ראשוני של הריאה הם נדירים וכוללים [[גידולים נוירואנדוקריניים]] (Neuroendocrine tumors) של הריאה{{הערה|שם=הערה2|Travis WD, Brambilla E, Muller-Hermelink HK. Patholoy and genetics: Tumors of the lung, Pleura, Thymus and Heart. IARC, Lyon, France, 2004}}. | |
| − | |||
| − | סוגים אחרים של סרטן ראשוני של הריאה הם נדירים וכוללים [[גידולים נוירואנדוקריניים]] (Neuroendocrine tumors) של הריאה {{הערה|שם=הערה2|Travis WD, Brambilla E, Muller-Hermelink HK. Patholoy and genetics: Tumors of the lung, Pleura, Thymus and Heart. IARC, Lyon, France, 2004}}. | ||
==שלב המחלה בעת האבחון== | ==שלב המחלה בעת האבחון== | ||
| − | |||
שלב המחלה מוגדר לפי סיווג ה- TNM ומבוסס על גודל הגידול הראשוני, חדירה לאיברים סמוכים, עירוב בלוטות לימפה בשער הריאה, במיצר או נוכחות בלוטות על-בריחיות, וכן פיזור משני מרוחק. | שלב המחלה מוגדר לפי סיווג ה- TNM ומבוסס על גודל הגידול הראשוני, חדירה לאיברים סמוכים, עירוב בלוטות לימפה בשער הריאה, במיצר או נוכחות בלוטות על-בריחיות, וכן פיזור משני מרוחק. | ||
| − | + | כ־70 אחוזים מהחולים החדשים מאובחנים בשלב מאוחר, בין אם בשלב גרורתי (שלב 4), או בשלב מתקדם מקומית (שלב 3). כ־30 אחוזים בלבד יתייצגו עם מחלה מוקדמת יחסית (שלבים 1-2). | |
הטיפול בשלבים השונים מורכב משילוב של כירורגיה, [[קרינה]], [[כימותרפיה]] וטיפול תומך הכולל [[טיפול מקל]] (Palliative care) לפי הצורך. | הטיפול בשלבים השונים מורכב משילוב של כירורגיה, [[קרינה]], [[כימותרפיה]] וטיפול תומך הכולל [[טיפול מקל]] (Palliative care) לפי הצורך. | ||
| − | + | חלו התפתחויות משמעותיות בהבנת הביולוגיה המולקולרית שעומדת בבסיס ההתמרה הממארת, ההתקדמות והתוקפנות של תאי סרטן הריאה. ההתקדמות המחקרית והטכנולוגית שינתה את הגישה הטיפולית במחלה. | |
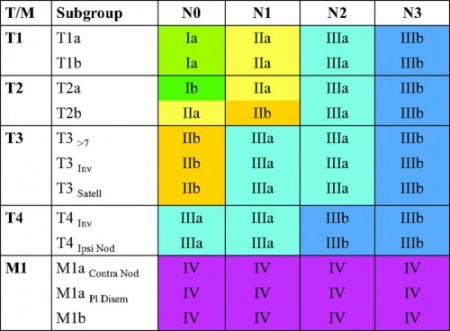
[[קובץ:Lung cancer1.jpg|ממוזער|מרכז|450 פיקסלים|תמונה 1. (stage groups according to TNM 7<sup>th</sup> edition (Chest. 2009;136 (1): 260-271]] | [[קובץ:Lung cancer1.jpg|ממוזער|מרכז|450 פיקסלים|תמונה 1. (stage groups according to TNM 7<sup>th</sup> edition (Chest. 2009;136 (1): 260-271]] | ||
==בדיקות סקר לסרטן הריאות - התפתחויות חדשות== | ==בדיקות סקר לסרטן הריאות - התפתחויות חדשות== | ||
| + | שכיחות סרטן הריאות, אופייה החמור של המחלה וההתייצגות בשלב מתקדם יחסית הובילו למחקר ענף בנושא [[בדיקות סקר]] ואבחון מוקדם. בעבר, מספר מחקרים אשר בדקו שימוש ב[[צילומי רנטגן]] (X-ray) כבדיקת סקר, לא הצליחו להוכיח יתרון בגילוי מוקדם או השפעה על הישרדות. | ||
| − | + | בשלוש השנים האחרונות התפרסמו תוצאות מחקרי סקירה לאומיים בנושא סרטן הריאות (National lung screening trials), בהם 53,454 נבדקים עברו חלוקה אקראית לסקירה באמצעות בדיקת [[טומוגרפיה ממוחשבת]] (CT {{כ}},Computed Tomography) של בית החזה במינון קרינה נמוך או באמצעות צילום רנטגן, בתדירות שנתית למשך שלוש שנים{{הערה|שם=הערה3|National lung screening trial research team. Aberle DR, Adams AM, Berg CD et al. Reduced lung cancer mortality with low-dose computed tomographic screening. NEJM. 2011; 365(5):395}}. כל הנבדקים היו בדרגת סיכון גבוהה לסרטן ריאות: גילאי 55-75 המעשנים מעל 30 שנות קופסה, או גילאי 50 ומעלה המעשנים מעל 20 שנות קופסה ובעלי גורם סיכון נוסף, כגון חשיפה תעסוקתית או רקע משפחתי. | |
| − | + | תוצאות המחקר הראו כי בדיקת טומוגרפיה ממוחשבת הובילה לגילוי סרטן ריאה ב־24 אחוזים, לעומת 7 אחוזים בלבד עם צילום חזה. חשוב מכך, שימוש בבדיקת טומוגרפיה ממוחשבת כבדיקת סקר גרם באופן יחסי להורדת תמותה מסרטן ריאה ב־20 אחוזים ולהורדת תמותה כללית (All-cause mortality) ב־6.7 אחוזים. | |
| − | |||
| − | תוצאות המחקר הראו כי בדיקת טומוגרפיה ממוחשבת הובילה לגילוי סרטן ריאה | ||
| − | + | בדיקת טומוגרפיה ממוחשבת במינון קרינה מופחת היא הבדיקה המומלצת כבדיקת סקר שגרתית לאוכלוסייה בסיכון גבוה. | |
==חידושים בטיפול בסרטן הריאות בשלב 1== | ==חידושים בטיפול בסרטן הריאות בשלב 1== | ||
| − | |||
סרטן ריאות בשלב 1 מוגדר כגידול ממוקם, ללא עירוב בלוטות לימפה או איברים סמוכים, ובגודל של עד חמישה סנטימטרים. הטיפול מורכב מניתוח הכולל כריתת אונה ודגימת בלוטות לימפה סמוכות. | סרטן ריאות בשלב 1 מוגדר כגידול ממוקם, ללא עירוב בלוטות לימפה או איברים סמוכים, ובגודל של עד חמישה סנטימטרים. הטיפול מורכב מניתוח הכולל כריתת אונה ודגימת בלוטות לימפה סמוכות. | ||
| − | בעבר, מטופלים עם מחלות רקע קשות שהיוו סיכון הרדמתי גבוה (Medically inoperable), טופלו בקרינה חיצונית (External beam radiotherapy), במינון 44-66 גריי (Gy) במקטעים שגרתיים, לאורך כשישה שבועות. התוצאות היו הישרדות כוללת לחמש שנים של 10 | + | בעבר, מטופלים עם מחלות רקע קשות שהיוו סיכון הרדמתי גבוה (Medically inoperable), טופלו בקרינה חיצונית (External beam radiotherapy), במינון 44-66 גריי (Gy) במקטעים שגרתיים, לאורך כשישה שבועות. התוצאות היו הישרדות כוללת לחמש שנים של 10 עד 30 אחוזים בלבד, בהשוואה ליותר מ־60 אחוזים בחולים שנותחו. |
| − | התקדמות טכנולוגית ומחקרית מאפשרת | + | התקדמות טכנולוגית ומחקרית מאפשרת מתן טיפול קרינתי במנות גבוהות ובמקטעים בודדים ישירות לגידול, ללא פגיעה באיברים סמוכים. הטיפול, הנקרא טיפול קרינה סטראוטקטי (SBRT {{כ}},Stereotactic Body Radiation Therapy), נבדק במחקר 0236{{כ}} RTOG, שם ניתן מינון של 54 גריי בשלושה מקטעים בלבד. התוצאות הראו שליטה מקומית של מעל 90 אחוזים והישרדות תלוית-סרטן בשיעור דומה לחולים שנותחו{{הערה|שם=הערה4|Timmerman R, Paulus R, Galvin J et al. Stereotactic body radiation therapy for inoperable early stage lung cancer. JAMA 2010; 303(11):1070}}. |
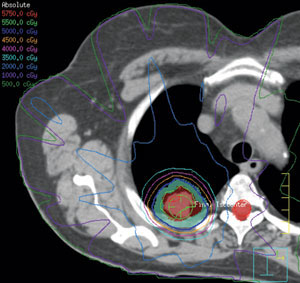
[[קובץ:Lung cancer2.jpg|ממוזער|מרכז|450 פיקסלים|תמונה 2. (SBRT planning for lung cancer (Oncolog, September 2012, vol 57, No 9]] | [[קובץ:Lung cancer2.jpg|ממוזער|מרכז|450 פיקסלים|תמונה 2. (SBRT planning for lung cancer (Oncolog, September 2012, vol 57, No 9]] | ||
==חידושים בטיפול בגידולים ריאתיים של תאים שאינם קטנים בשלב 4== | ==חידושים בטיפול בגידולים ריאתיים של תאים שאינם קטנים בשלב 4== | ||
| − | |||
יותר ממחצית מהחולים החדשים מאובחנים בשלב שבו המחלה התפשטה לאיברים מרוחקים, כגון שלד, ריאה בצד הנגדי לגידול, כבד, בלוטות יותרת הכליה ומוח. | יותר ממחצית מהחולים החדשים מאובחנים בשלב שבו המחלה התפשטה לאיברים מרוחקים, כגון שלד, ריאה בצד הנגדי לגידול, כבד, בלוטות יותרת הכליה ומוח. | ||
| − | מטרת הטיפולים בשלב זה אינה ריפוי, אלא הארכת חיים והקלה על תסמינים כגון [[כאבים]], הצטברות [[תפליט פלוארלי]] (Pleural Effusion) ו[[קוצר נשימה]]. מחקרים היסטוריים הדגימו יתרון הישרדותי לטיפולים כימותרפיים על פני טיפול תומך בלבד, וכן יתרון למשלב שתי תרופות כימותרפיות (Doublet combination) על פני תרופה יחידה. | + | מטרת הטיפולים בשלב זה אינה ריפוי, אלא הארכת חיים והקלה על תסמינים כגון [[כאבים]], הצטברות [[תפליט פלוארלי]] (Pleural Effusion) ו[[קוצר נשימה]]. מחקרים היסטוריים הדגימו יתרון הישרדותי לטיפולים כימותרפיים על פני טיפול תומך בלבד, וכן יתרון למשלב שתי תרופות כימותרפיות (Doublet combination) על פני תרופה יחידה. חלה התקדמות רבה בתחום הטיפול בגידולים ריאתיים של תאים שאינם קטנים בשלבים מתקדמים. |
| − | ===התאמת טיפול לתת ההיסטולוגיות=== | + | ===התאמת טיפול לתת ההיסטולוגיות=== |
| + | עד סוף שנות ה-2000, מטופלים קיבלו משלב על בסיס [[Platinum]], ללא הבדל ביחס לסוג ההיסטולוגי של הגידול. לדוגמה, מחקר של הקבוצה המזרחית המאוגדת לאונקולוגיה (Eastern cooperative oncology group) השווה ב־1,200 מטופלים עם גידולים ריאתיים של תאים שאינם קטנים ארבעה משלבים שונים: [[Cisplatin]]{{כ}} (Abiplatin) ו- [[Paclitaxel]]{{כ}} (Taxol),{{כ}} [[Carboplatin]] ו- Paclitaxel,{{כ}} Cisplatin ו- [[Gemcitabine]]{{כ}} (Gemzar),{{כ}} Cisplatin ו- [[Docetaxel]]{{כ}} (Taxotere). כולם נתנו תוצאה זהה, עם תגובה לטיפול של 20 אחוזים והישרדות חציונית של שמונה חודשים{{הערה|שם=הערה5|Schiller J, Harrington D, Bellani CP et al. Comparison of four chemotherapy regimens for advanced non small cell lung cancer. NEJM 2002; 346:92-98}}. | ||
| − | + | ב־2008 פורסם לראשונה מחקר שהראה הבדל הישרדותי תחת טיפול שונה על פי תת-סוגים היסטולוגיים שונים{{הערה|שם=הערה6| Scagliotti GV, Parikh P, von Pawel J et al. Phase III study comparing Cisplatin plus Gemcitabine with Cispatin plus Pemetrexed in chemotherapy naïve patients with advanced stage non small cell lung cancer. JCO 2008 (26):21, 3543-3551}}. המחקר כלל 1,725 חולים עם גידולי ריאה של תאים שאינם קטנים בשלב מתקדם, שעברו הקצאה אקראית לטיפול במשלב Cisplatin ו- Gemcitabine לעומת משלב Cisplatin ו- [[Pemetrexed]]{{כ}} (Alimta). התוצאות הראו יתרון הישרדותי לטובת משלב Cisplatin ו- Gemcitabine בקרב חולים עם קרצינומה קשקשית (הישרדות חציונית של 9.4 לעומת 10.8 חודשים), ומנגד יתרון הישרדותי לטובת משלב Cisplatin ו- Pemetrexed בקרב חולים עם קרצינומה שאינה קשקשית (הישרדות חציונית של 10.9 לעומת 12.6 חודשים). | |
| − | + | ===תוספת תרופות ביולוגיות לכימותרפיה=== | |
| − | + | אחד המאפיינים הבולטים בהתפתחות סרטן הוא התהוות כלי דם חדשים (Angiogenesis), ומחקר נרחב בתחום הוביל לפיתוח תרופות חדשניות המעכבות תהליך זה. | |
| − | ===תוספת תרופות ביולוגיות לכימותרפיה=== | ||
| − | |||
[[Bevacizumab]]{{כ}} (Avastin) הוא נוגדן חד-שבטי שפותח כנגד גורם גדילה אנדותליאלי של כלי דם (VEGF {{כ}},Vascular Endothelial Growth Factor) המאושר על ידי מנהל המזון והתרופות (FDA {{כ}},Food and Drug Administration) האמריקאי לטיפול במספר סוגי סרטן, כולל [[סרטן המעי הגס]], [[סרטן השחלות]] ו[[סרטן הכליה]]. | [[Bevacizumab]]{{כ}} (Avastin) הוא נוגדן חד-שבטי שפותח כנגד גורם גדילה אנדותליאלי של כלי דם (VEGF {{כ}},Vascular Endothelial Growth Factor) המאושר על ידי מנהל המזון והתרופות (FDA {{כ}},Food and Drug Administration) האמריקאי לטיפול במספר סוגי סרטן, כולל [[סרטן המעי הגס]], [[סרטן השחלות]] ו[[סרטן הכליה]]. | ||
שני מחקרים בעלי הקצאה אקראית בשלב 3 בדקו את יעילות תוספת Bevacizumab לכימותרפיה בגידולי ריאות מתאים שאינם קטנים. המחקרים כללו נבדקים עם היסטולוגיה שאינה קשקשית בלבד, וזאת על סמך מחקרים מוקדמים שהראו נטייה מוגברת לדמם תחת הטיפול בנוגדן בגידולים קשקשיים: | שני מחקרים בעלי הקצאה אקראית בשלב 3 בדקו את יעילות תוספת Bevacizumab לכימותרפיה בגידולי ריאות מתאים שאינם קטנים. המחקרים כללו נבדקים עם היסטולוגיה שאינה קשקשית בלבד, וזאת על סמך מחקרים מוקדמים שהראו נטייה מוגברת לדמם תחת הטיפול בנוגדן בגידולים קשקשיים: | ||
| − | #מחקר 4599{{כ}} ECOG בדק | + | #מחקר 4599{{כ}} ECOG בדק ב־880 חולים, כקו ראשון, משלב Carboplatin ו- Paclitaxel, מול אותו המשלב בתוספת Bevacizumab, והמשך הנוגדן בלבד כטיפול משמר (Maintenance) לשנה. התוצאות הראו יתרון הישרדותי מובהק לשילוב התרופה הביולוגית, עם הארכת ההישרדות החציונית בשנתיים והורדת 20 אחוזים בסיכון היחסי לתמותה. בנוסף, נצפה שיפור באחוז התגובה האובייקטיבית ובזמן עד התקדמות או תמותה{{הערה|שם=הערה7|Sandler A, Gray R, Perry MC. Paclitaxel-Carboplatin alone or with Bevacizumab for non small cell lung cancer. NEJM 2006; 355: 2542-50}} |
| − | #מחקר AVAIL בדק באופן דומה תוספת Bevacizumab למשלב הכולל Cisplatin ו- Gemcitabine, בהשוואה לכימותרפיה בלבד. בעוד במחקר זה לא נצפה יתרון הישרדותי, תוספת Bevacizumab שיפרה את התגובה לטיפול {{הערה|שם=הערה8|Rack M, von Pawel J, Zatloukal P. Phase III trial of Cisplatin plus Gemcitabine with either placebo or Bevacizumab as first line therapy for nonsquamous no-small cell lung cancer: Avail. JCO 2009; 27(8): 1227-34}} | + | #מחקר AVAIL בדק באופן דומה תוספת Bevacizumab למשלב הכולל Cisplatin ו- Gemcitabine, בהשוואה לכימותרפיה בלבד. בעוד במחקר זה לא נצפה יתרון הישרדותי, תוספת Bevacizumab שיפרה את התגובה לטיפול{{הערה|שם=הערה8|Rack M, von Pawel J, Zatloukal P. Phase III trial of Cisplatin plus Gemcitabine with either placebo or Bevacizumab as first line therapy for nonsquamous no-small cell lung cancer: Avail. JCO 2009; 27(8): 1227-34}} |
התייחסויות נוספות לטיפול הביולוגי ניתנו בפרסומים נוספים: | התייחסויות נוספות לטיפול הביולוגי ניתנו בפרסומים נוספים: | ||
| − | #מטה-אנליזה | + | #מטה-אנליזה מ־2013 הראתה שתוספת של Bevacizumab לכימותרפיה שיפרה את ההישרדות הכללית וההישרדות ללא התקדמות (Progression-free survival), בהשוואה לכימותרפיה בלבד. |
#מחקר נוסף, Pointbreak, השווה באמצעות הקצאה אקראית שני משלבים כימותרפיים שונים יחד עם Bevacizumab:{{כ}} Carboplatin ו- Paclitaxel לעומת Carboplatin ו- Pemetrexed. התוצאות שללו יתרון הישרדותי לאחד מהמשלבים, והדגימו יתרון קל בהישרדות ללא התקדמות למשלב הכולל Pemetrexed {{כ}}{{הערה|שם=הערה9| Patel JD, Socinski M, Gradon EB. Pointbreak: a randomized phase III study of Pemetrexed plus Carboplatin and Bevacizumab followed by maintenance Pemetrexed and Bevacizumab versus Paclitaxel plus Carboplatin and Bevacizumab followed by maintenance Bevacizumab in patients with stage IIIb or IV nonsquamous non small cell lung cancer. JCO 2013}}. | #מחקר נוסף, Pointbreak, השווה באמצעות הקצאה אקראית שני משלבים כימותרפיים שונים יחד עם Bevacizumab:{{כ}} Carboplatin ו- Paclitaxel לעומת Carboplatin ו- Pemetrexed. התוצאות שללו יתרון הישרדותי לאחד מהמשלבים, והדגימו יתרון קל בהישרדות ללא התקדמות למשלב הכולל Pemetrexed {{כ}}{{הערה|שם=הערה9| Patel JD, Socinski M, Gradon EB. Pointbreak: a randomized phase III study of Pemetrexed plus Carboplatin and Bevacizumab followed by maintenance Pemetrexed and Bevacizumab versus Paclitaxel plus Carboplatin and Bevacizumab followed by maintenance Bevacizumab in patients with stage IIIb or IV nonsquamous non small cell lung cancer. JCO 2013}}. | ||
[[קובץ:Lung cancer3.jpg|ממוזער|מרכז|450 פיקסלים|תמונה 3. Bevacizumab (pictured as green and purple y-shaped molecules) binds VEGF' blocking signals that can help sustain tumor survival and growth (NCI cancer bulletin, February 8 2011; volume 8 (3). Image from Genentech)]] | [[קובץ:Lung cancer3.jpg|ממוזער|מרכז|450 פיקסלים|תמונה 3. Bevacizumab (pictured as green and purple y-shaped molecules) binds VEGF' blocking signals that can help sustain tumor survival and growth (NCI cancer bulletin, February 8 2011; volume 8 (3). Image from Genentech)]] | ||
| − | ===התאמת טיפול מכוון מטרה (Targeted therapy) לתשניות (Mutations) ייחודיות=== | + | ===התאמת טיפול מכוון מטרה (Targeted therapy) לתשניות (Mutations) ייחודיות=== |
| − | + | טיפולים אונקולוגיים בכלל והטיפול בסרטן הריאות בפרט מתקדמים לכיוון טיפול מכוון מטרה. | |
| − | טיפולים אונקולוגיים בכלל והטיפול בסרטן הריאות בפרט מתקדמים לכיוון טיפול מכוון מטרה. | ||
| − | בעוד בעבר מחלה גרורתית טופלה בכימותרפיה ללא אבחנה, כעת מכירים בסרטן הריאה כקבוצה לא-אחידה ומורכבת, עם תשניות ייחודיות המכתיבות את ההתמרה וההתנהגות של הגידול. שינויים בגנים האחראים על חלוקה, התהוות כלי דם או עמידות וחדירות של התא, יכולים להוביל ליצירת תשנית מתניעה (Driver mutation) - תשנית מובילה בתהליך הסרטני. | + | בעוד בעבר מחלה גרורתית טופלה בכימותרפיה ללא אבחנה, כעת מכירים בסרטן הריאה כקבוצה לא-אחידה ומורכבת, עם תשניות ייחודיות המכתיבות את ההתמרה וההתנהגות של הגידול. שינויים בגנים האחראים על חלוקה, התהוות כלי דם או עמידות וחדירות של התא, יכולים להוביל ליצירת תשנית מתניעה (Driver mutation) - תשנית מובילה בתהליך הסרטני. מוכרים מספר שינויים גנטיים ותשניות, המשמשים מטרה לטיפול. העיקריים שבהם הם תשנית בקולטן לגורם גדילה אפידרמלי (EGFR {{כ}},Epidermal Growth Factor Receptor) ואיחוי של גן אחינודרם קשור למיקרוטובולי דמוי-חלבון 4{{כ}} (4{{כ}}EML {{כ}},4{{כ}}Echinoderm Microtubule-Associated Protein Like) עם הגן אנפלאסטיק לימפומה קינאז (ALK {{כ}},Anaplastic Lymphoma Kinase). |
[[קובץ:Lung cancer4.jpg|ממוזער|מרכז|450 פיקסלים|תמונה 4. (driver mutations in lung cancer (Kris MG, Jons on BE, Kwiatkowski DJet al. JCO 2011; 29,june 20 suppl]] | [[קובץ:Lung cancer4.jpg|ממוזער|מרכז|450 פיקסלים|תמונה 4. (driver mutations in lung cancer (Kris MG, Jons on BE, Kwiatkowski DJet al. JCO 2011; 29,june 20 suppl]] | ||
====טיפולים בנוכחות תשנית ב- EGFR==== | ====טיפולים בנוכחות תשנית ב- EGFR==== | ||
| + | תשנית ב- EGFR מתרחשת בכ־15 אחוזים מהגידולים שאינם קשקשיים בקרב חולים ממדינות מערביות, ובשכיחות גבוהה של כ־50 אחוזים בקרב חולים ממוצא אסיאתי. | ||
| − | + | פותחו תרופות מעכבות טירוזין קינאז (TKI {{כ}},Tyrosine Kinase Inhibitors), הנקשרות ומעכבות את אתר הטירוזין קינאז התוך תאי של ה- EGFR. הדור הראשון של התרופות עיכב את האתר באופן הפיך וכלל שתי מולקולות קטנות (Small molecules):{{כ}} [[Erlotinib]]{{כ}} (Tarceva) ו- [[Gefitinib]] {{כ}}(Iressa). | |
| − | + | במחקר בשלב 3, IPASS, {{כ}}1,200 חולים ממוצא מזרח-אסיאתי עם אדנוקרצינומה מתקדמת, לא מעשנים, הוקצו אקראית לטיפול קו ראשון ב- Gefitinib לעומת כימותרפיה במשלב Carboplatin ו- Paclitaxel{{כ}}{{הערה|שם=הערה10| Mok TS, Wu YL, Thongprasert S. Gefitinib or Carboplatin- Paclitaxel in pulmonary adenocarcinoma. NEJM 2009; 361: 947-957}}. מטרת המחקר הייתה לבחון האם קיים הבדל בהישרדות ללא התקדמות בין הטיפולים. | |
| − | + | התוצאות הראו שיפור משמעותי בהישרדות ללא התקדמות תחת טיפול ב- Gefitinib: הורדה יחסית של 25 אחוזים בסיכון להתקדמות (1 אחוז לעומת 25 אחוזים בהישרדות ללא התקדמות למשך שנה). כ־430 חולים נבדקו לתשנית ב- EGFR, מתוכם 60 אחוזים היו חיוביים. | |
| − | התוצאות | + | התוצאות החיוביות חזרו על עצמן במספר מחקרים, כולל מחקר בחולים מקרב מדינות מערביות (EURTAC), שבו מטופלים חיוביים לתשנית ב-EGFR שטופלו ב- Erlotinib הדגימו שיפור של 4.5 חודשים בהישרדות ללא התקדמות לעומת חולים שטופלו במשלב על בסיס Platinum{{כ}}{{הערה|שם=הערה11|Rosell R, Carcereny E, Gervaise R. Erlotinib versus standard chemotherapy as first line treatment for European patients with advanced EGFR mutation positive non small cell lung cancer (EURTAC): a mulicentre open label randomized phase III trial. Lancet Oncol. 2012 Mar 13 (3): 239-46}}. |
| − | + | חולים עם מוטציה ב-EGFR שמטופלים במעכב ביולוגי מראים שיעורי תגובה של 70 אחוזים לתרופה, לעומת 30 עד 40 אחוזים בלבד של תגובה לכימותרפיה. בנוסף להארכת ההישרדות ללא התקדמות, מתאר תופעות הלוואי עדיף על זה של כימותרפיה וכולל בעיקר [[שלשול]], תגובות עוריות ועייפות. | |
| − | + | פותח דור חדש של TKI-{{כ}}EGFR, שמעכב את אתר הטירוזין קינאז באופן בלתי הפיך. המעכב, [[Afatinib]]{{כ}} (Gilotrif), אושר על ידי מנהל התרופות האמריקאי לטיפול קו ראשון בחולים עם סרטן ריאות גרורתי ותשנית ב- EGFR, על סמך מחקר{{כ}} 3{{כ}}LUNG{{כ}}-LUX, שהשווה במטופלים אלה טיפול ב- Afatinib לכימותרפיה במשלב Cispatin ו- Pemetrexed{{כ}}{{הערה|שם=הערה12|Sequist LV, Yang JCH, Yamamoto N. Phase III study of Afatinib or Cispatin plus Pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. JCO 2013 (31) 27: 3327-3334}}. | |
| − | |||
| − | |||
תוצאות המחקר הראו שיפור של ארבעה חודשים בהישרדות ללא התקדמות בטיפול ב- Afatinib לעומת כימותרפיה, הכפלה של שיעור התגובה לטיפול ומתאר תופעות לוואי עדיף. | תוצאות המחקר הראו שיפור של ארבעה חודשים בהישרדות ללא התקדמות בטיפול ב- Afatinib לעומת כימותרפיה, הכפלה של שיעור התגובה לטיפול ומתאר תופעות לוואי עדיף. | ||
====טיפול בנוכחות האיחוי הגנטי ALK{{כ}}-4{{כ}}EML==== | ====טיפול בנוכחות האיחוי הגנטי ALK{{כ}}-4{{כ}}EML==== | ||
| + | היפוך מקטע (Inversion) בכרומוזום 2 גורם לאיחוי של הגן 4{{כ}}EML עם הגן ALK, ויצירת גן אונקוגני חדש, ALK{{כ}}-4{{כ}}EML. האונקוגן מביע פעילות קינאז תמידית, ללא תלות בליגנד. | ||
| − | + | שכיחות השינוי הגנטי היא כ־5 עד 7 אחוזים מכלל החולים עם אדנוקרצינומה של הריאה. המאפיינים הקליניים הנפוצים של המטופלים בהם קיים השינוי הגנטי: גיל צעיר (גיל חציוני 52 לעומת 66), לא מעשנים ותתי הסוג טבעת חותם (Signet ring){{כ}} או אצינר. כמו כן, המטופלים בדרך כלל שליליים לתשניות ב- EGFR או [[KRAS]]{{כ}}. | |
| − | + | מחקר בשלב 3 בדק 350 חולים חיוביים לשחלוף {{כ}}(Rearrangement) ב-ALK, לאחר התקדמות על טיפול מבוסס Platinum, שהוקצו אקראית לטיפול ב- [[Crizotinib]] או כימותרפיה (Pemetrexed או Docetaxel). התוצאות היו משמעותיות לטובת Crizotinib: הורדה יחסית של 50 אחוזים בסיכון להתקדמות, שיפור של 4.5 חודשים בהישרדות ללא התקדמות ואחוז תגובה של 60 אחוזים לעומת 20 אחוזים בלבד עם כימותרפיה{{הערה|שם=הערה13|Shaw AT, Kim DW, Nakagawa K et al. Crizotinib versus chemotherapy in dvanced alk-positive lung cancer. NEJM 2013; 368: 2385-2394}}. | |
| − | |||
| − | מחקר בשלב 3 בדק 350 חולים חיוביים לשחלוף {{כ}}(Rearrangement) ב-ALK, לאחר התקדמות על טיפול מבוסס Platinum, שהוקצו אקראית לטיפול ב- [[Crizotinib]] או כימותרפיה (Pemetrexed או Docetaxel). התוצאות היו משמעותיות לטובת Crizotinib: הורדה יחסית של 50 | ||
===כיווני מחקר עתידיים=== | ===כיווני מחקר עתידיים=== | ||
| שורה 126: | שורה 117: | ||
==ביבליוגרפיה== | ==ביבליוגרפיה== | ||
| − | <blockquote> | + | <blockquote> |
| − | + | {{הערות שוליים|יישור=שמאל}} | |
| − | |||
| − | {{הערות שוליים}} | ||
| − | |||
| − | |||
</blockquote> | </blockquote> | ||
==קישורים חיצוניים== | ==קישורים חיצוניים== | ||
| − | |||
* [http://www.medic-digital.com/oncology-digital/#page-3 סרטן ריאות – שלבי המחלה, אבחון וחידושים בטיפול בה], Medic | * [http://www.medic-digital.com/oncology-digital/#page-3 סרטן ריאות – שלבי המחלה, אבחון וחידושים בטיפול בה], Medic | ||
| − | + | {{שש}} | |
| − | |||
{{ייחוס|ד"ר סיון שמאי מחלקה אונקולוגית, המרכז הרפואי תל אביב ע"ש סוראסקי}} | {{ייחוס|ד"ר סיון שמאי מחלקה אונקולוגית, המרכז הרפואי תל אביב ע"ש סוראסקי}} | ||
| − | + | {{שש}} | |
<center>'''פורסם במגזין הדיגיטלי oncology-digital, אפריל 2014, Medic'''</center> | <center>'''פורסם במגזין הדיגיטלי oncology-digital, אפריל 2014, Medic'''</center> | ||
גרסה מ־08:51, 27 בפברואר 2021
| סרטן הריאות - בדיקות סקר וטיפולים חדשניים | ||
|---|---|---|
| Lung cancer - screening and new treatments | ||

| ||
| שמות נוספים | סרטן ריאות - שלבי המחלה, אבחון וחידושים בטיפול בה | |
| יוצר הערך | ד"ר סיון שמאי | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן ריאה
סרטן הריאה מהווה את אחד הגידולים הנפוצים ביותר בעולם, והוא בעל שיעור התמותה הגבוה ביותר מביניהם. בשנת 2013 אובחנו 228,190 מקרים חדשים בארצות הברית, ו- 159,480 חולים נפטרו כתוצאה מהמחלה[1]. בישראל מאובחנים כ־1,500 איש מדי שנה.
קיימים מספר גורמי סיכון להתפתחות סרטן ריאות. העיקרי מביניהם הוא עישון, כתלות במספר שנות העישון ובכמות הסיגריות ליום. גורמי סיכון נוספים הם חשיפה תעסוקתית (כגון לאזבסט, סיליקה ורדון) וחשיפה לקרינה מייננת.
סיווג הגידולים
כ־85 אחוזים ממקרי סרטן ריאה הם מסוג תאים שאינם קטנים (NSCLC ,Non-Small-Cell Lung Carcinoma). סוג זה מורכב ממספר תתי-סוגים היסטולוגיים:
- סרטן ריאה מסוג אדנוקרצינומה (Adenocarcinoma): שכיחותו נמצאת במגמת עלייה, והוא מהווה כ-40 אחוזים מכלל סרטני הריאה של תאים שאינם קטנים. מקור הגידול הוא בדרכי האוויר הקטנות, ולפיכך מדובר בגידולים היקפיים (Peripheral) יחסית. מבחינה אימונוהיסטוכימית (Immunohistochemistry), גידולים אלו חיוביים לגורם השעתוק של בלוטת התריס 1 (1TTF ,Thyroid Transcription Factor 1), חיוביים לציטוקרטין 7 (7Ck ,7 Cytokeratin) ושליליים לציטוקרטין 20 (20Ck ,20 Cytokeratin).
- סרטן ריאה קשקשי (Squamous): שכיחותו היחסית נמצאת במגמת ירידה, והוא מהווה כ־20 עד 30 אחוזים מכלל סרטני הריאה של תאים שאינם קטנים. מקור הגידול בסימפונות הגדולים, ולרוב מיקומם מרכזי וקרוב למיצר. מבחינה אימונוהיסטוכימית, הגידולים בדרך כלל שליליים ל־1TTF, 7Ck ו- 20Ck, וחיוביים לציטוקרטין 5 (5Ck ,5 Cytokeratin), ציטוקרטין 6 (6Ck ,6 Cytokeratin) ול־63P.
- אחרים: קרצינומה של תאים גדולים (Large cell carcinoma)- מהווה 15 אחוזים מכלל גידולי הריאה של תאים שאינם קטנים, אדנוקרצינומה נחה (Adenocarcinoma in situ) - או בשמה הקודם - קרצינומה של הסימפונות ובועיות האוויר (Bronchioloalveolar carcinoma), קרצינומה אדנו-קשקשית (Adenosquamous) וסוגים נוספים.
שאר המקרים (כ-15 אחוזים) כוללים סרטן ריאה מסוג תאים קטנים (SCLC ,Small Cell Lung Cancer).
סוגים אחרים של סרטן ראשוני של הריאה הם נדירים וכוללים גידולים נוירואנדוקריניים (Neuroendocrine tumors) של הריאה[2].
שלב המחלה בעת האבחון
שלב המחלה מוגדר לפי סיווג ה- TNM ומבוסס על גודל הגידול הראשוני, חדירה לאיברים סמוכים, עירוב בלוטות לימפה בשער הריאה, במיצר או נוכחות בלוטות על-בריחיות, וכן פיזור משני מרוחק.
כ־70 אחוזים מהחולים החדשים מאובחנים בשלב מאוחר, בין אם בשלב גרורתי (שלב 4), או בשלב מתקדם מקומית (שלב 3). כ־30 אחוזים בלבד יתייצגו עם מחלה מוקדמת יחסית (שלבים 1-2).
הטיפול בשלבים השונים מורכב משילוב של כירורגיה, קרינה, כימותרפיה וטיפול תומך הכולל טיפול מקל (Palliative care) לפי הצורך.
חלו התפתחויות משמעותיות בהבנת הביולוגיה המולקולרית שעומדת בבסיס ההתמרה הממארת, ההתקדמות והתוקפנות של תאי סרטן הריאה. ההתקדמות המחקרית והטכנולוגית שינתה את הגישה הטיפולית במחלה.
בדיקות סקר לסרטן הריאות - התפתחויות חדשות
שכיחות סרטן הריאות, אופייה החמור של המחלה וההתייצגות בשלב מתקדם יחסית הובילו למחקר ענף בנושא בדיקות סקר ואבחון מוקדם. בעבר, מספר מחקרים אשר בדקו שימוש בצילומי רנטגן (X-ray) כבדיקת סקר, לא הצליחו להוכיח יתרון בגילוי מוקדם או השפעה על הישרדות.
בשלוש השנים האחרונות התפרסמו תוצאות מחקרי סקירה לאומיים בנושא סרטן הריאות (National lung screening trials), בהם 53,454 נבדקים עברו חלוקה אקראית לסקירה באמצעות בדיקת טומוגרפיה ממוחשבת (CT ,Computed Tomography) של בית החזה במינון קרינה נמוך או באמצעות צילום רנטגן, בתדירות שנתית למשך שלוש שנים[3]. כל הנבדקים היו בדרגת סיכון גבוהה לסרטן ריאות: גילאי 55-75 המעשנים מעל 30 שנות קופסה, או גילאי 50 ומעלה המעשנים מעל 20 שנות קופסה ובעלי גורם סיכון נוסף, כגון חשיפה תעסוקתית או רקע משפחתי.
תוצאות המחקר הראו כי בדיקת טומוגרפיה ממוחשבת הובילה לגילוי סרטן ריאה ב־24 אחוזים, לעומת 7 אחוזים בלבד עם צילום חזה. חשוב מכך, שימוש בבדיקת טומוגרפיה ממוחשבת כבדיקת סקר גרם באופן יחסי להורדת תמותה מסרטן ריאה ב־20 אחוזים ולהורדת תמותה כללית (All-cause mortality) ב־6.7 אחוזים.
בדיקת טומוגרפיה ממוחשבת במינון קרינה מופחת היא הבדיקה המומלצת כבדיקת סקר שגרתית לאוכלוסייה בסיכון גבוה.
חידושים בטיפול בסרטן הריאות בשלב 1
סרטן ריאות בשלב 1 מוגדר כגידול ממוקם, ללא עירוב בלוטות לימפה או איברים סמוכים, ובגודל של עד חמישה סנטימטרים. הטיפול מורכב מניתוח הכולל כריתת אונה ודגימת בלוטות לימפה סמוכות.
בעבר, מטופלים עם מחלות רקע קשות שהיוו סיכון הרדמתי גבוה (Medically inoperable), טופלו בקרינה חיצונית (External beam radiotherapy), במינון 44-66 גריי (Gy) במקטעים שגרתיים, לאורך כשישה שבועות. התוצאות היו הישרדות כוללת לחמש שנים של 10 עד 30 אחוזים בלבד, בהשוואה ליותר מ־60 אחוזים בחולים שנותחו.
התקדמות טכנולוגית ומחקרית מאפשרת מתן טיפול קרינתי במנות גבוהות ובמקטעים בודדים ישירות לגידול, ללא פגיעה באיברים סמוכים. הטיפול, הנקרא טיפול קרינה סטראוטקטי (SBRT ,Stereotactic Body Radiation Therapy), נבדק במחקר 0236 RTOG, שם ניתן מינון של 54 גריי בשלושה מקטעים בלבד. התוצאות הראו שליטה מקומית של מעל 90 אחוזים והישרדות תלוית-סרטן בשיעור דומה לחולים שנותחו[4].
חידושים בטיפול בגידולים ריאתיים של תאים שאינם קטנים בשלב 4
יותר ממחצית מהחולים החדשים מאובחנים בשלב שבו המחלה התפשטה לאיברים מרוחקים, כגון שלד, ריאה בצד הנגדי לגידול, כבד, בלוטות יותרת הכליה ומוח.
מטרת הטיפולים בשלב זה אינה ריפוי, אלא הארכת חיים והקלה על תסמינים כגון כאבים, הצטברות תפליט פלוארלי (Pleural Effusion) וקוצר נשימה. מחקרים היסטוריים הדגימו יתרון הישרדותי לטיפולים כימותרפיים על פני טיפול תומך בלבד, וכן יתרון למשלב שתי תרופות כימותרפיות (Doublet combination) על פני תרופה יחידה. חלה התקדמות רבה בתחום הטיפול בגידולים ריאתיים של תאים שאינם קטנים בשלבים מתקדמים.
התאמת טיפול לתת ההיסטולוגיות
עד סוף שנות ה-2000, מטופלים קיבלו משלב על בסיס Platinum, ללא הבדל ביחס לסוג ההיסטולוגי של הגידול. לדוגמה, מחקר של הקבוצה המזרחית המאוגדת לאונקולוגיה (Eastern cooperative oncology group) השווה ב־1,200 מטופלים עם גידולים ריאתיים של תאים שאינם קטנים ארבעה משלבים שונים: Cisplatin (Abiplatin) ו- Paclitaxel (Taxol), Carboplatin ו- Paclitaxel, Cisplatin ו- Gemcitabine (Gemzar), Cisplatin ו- Docetaxel (Taxotere). כולם נתנו תוצאה זהה, עם תגובה לטיפול של 20 אחוזים והישרדות חציונית של שמונה חודשים[5].
ב־2008 פורסם לראשונה מחקר שהראה הבדל הישרדותי תחת טיפול שונה על פי תת-סוגים היסטולוגיים שונים[6]. המחקר כלל 1,725 חולים עם גידולי ריאה של תאים שאינם קטנים בשלב מתקדם, שעברו הקצאה אקראית לטיפול במשלב Cisplatin ו- Gemcitabine לעומת משלב Cisplatin ו- Pemetrexed (Alimta). התוצאות הראו יתרון הישרדותי לטובת משלב Cisplatin ו- Gemcitabine בקרב חולים עם קרצינומה קשקשית (הישרדות חציונית של 9.4 לעומת 10.8 חודשים), ומנגד יתרון הישרדותי לטובת משלב Cisplatin ו- Pemetrexed בקרב חולים עם קרצינומה שאינה קשקשית (הישרדות חציונית של 10.9 לעומת 12.6 חודשים).
תוספת תרופות ביולוגיות לכימותרפיה
אחד המאפיינים הבולטים בהתפתחות סרטן הוא התהוות כלי דם חדשים (Angiogenesis), ומחקר נרחב בתחום הוביל לפיתוח תרופות חדשניות המעכבות תהליך זה.
Bevacizumab (Avastin) הוא נוגדן חד-שבטי שפותח כנגד גורם גדילה אנדותליאלי של כלי דם (VEGF ,Vascular Endothelial Growth Factor) המאושר על ידי מנהל המזון והתרופות (FDA ,Food and Drug Administration) האמריקאי לטיפול במספר סוגי סרטן, כולל סרטן המעי הגס, סרטן השחלות וסרטן הכליה.
שני מחקרים בעלי הקצאה אקראית בשלב 3 בדקו את יעילות תוספת Bevacizumab לכימותרפיה בגידולי ריאות מתאים שאינם קטנים. המחקרים כללו נבדקים עם היסטולוגיה שאינה קשקשית בלבד, וזאת על סמך מחקרים מוקדמים שהראו נטייה מוגברת לדמם תחת הטיפול בנוגדן בגידולים קשקשיים:
- מחקר 4599 ECOG בדק ב־880 חולים, כקו ראשון, משלב Carboplatin ו- Paclitaxel, מול אותו המשלב בתוספת Bevacizumab, והמשך הנוגדן בלבד כטיפול משמר (Maintenance) לשנה. התוצאות הראו יתרון הישרדותי מובהק לשילוב התרופה הביולוגית, עם הארכת ההישרדות החציונית בשנתיים והורדת 20 אחוזים בסיכון היחסי לתמותה. בנוסף, נצפה שיפור באחוז התגובה האובייקטיבית ובזמן עד התקדמות או תמותה[7]
- מחקר AVAIL בדק באופן דומה תוספת Bevacizumab למשלב הכולל Cisplatin ו- Gemcitabine, בהשוואה לכימותרפיה בלבד. בעוד במחקר זה לא נצפה יתרון הישרדותי, תוספת Bevacizumab שיפרה את התגובה לטיפול[8]
התייחסויות נוספות לטיפול הביולוגי ניתנו בפרסומים נוספים:
- מטה-אנליזה מ־2013 הראתה שתוספת של Bevacizumab לכימותרפיה שיפרה את ההישרדות הכללית וההישרדות ללא התקדמות (Progression-free survival), בהשוואה לכימותרפיה בלבד.
- מחקר נוסף, Pointbreak, השווה באמצעות הקצאה אקראית שני משלבים כימותרפיים שונים יחד עם Bevacizumab: Carboplatin ו- Paclitaxel לעומת Carboplatin ו- Pemetrexed. התוצאות שללו יתרון הישרדותי לאחד מהמשלבים, והדגימו יתרון קל בהישרדות ללא התקדמות למשלב הכולל Pemetrexed [9].
התאמת טיפול מכוון מטרה (Targeted therapy) לתשניות (Mutations) ייחודיות
טיפולים אונקולוגיים בכלל והטיפול בסרטן הריאות בפרט מתקדמים לכיוון טיפול מכוון מטרה.
בעוד בעבר מחלה גרורתית טופלה בכימותרפיה ללא אבחנה, כעת מכירים בסרטן הריאה כקבוצה לא-אחידה ומורכבת, עם תשניות ייחודיות המכתיבות את ההתמרה וההתנהגות של הגידול. שינויים בגנים האחראים על חלוקה, התהוות כלי דם או עמידות וחדירות של התא, יכולים להוביל ליצירת תשנית מתניעה (Driver mutation) - תשנית מובילה בתהליך הסרטני. מוכרים מספר שינויים גנטיים ותשניות, המשמשים מטרה לטיפול. העיקריים שבהם הם תשנית בקולטן לגורם גדילה אפידרמלי (EGFR ,Epidermal Growth Factor Receptor) ואיחוי של גן אחינודרם קשור למיקרוטובולי דמוי-חלבון 4 (4EML ,4Echinoderm Microtubule-Associated Protein Like) עם הגן אנפלאסטיק לימפומה קינאז (ALK ,Anaplastic Lymphoma Kinase).
טיפולים בנוכחות תשנית ב- EGFR
תשנית ב- EGFR מתרחשת בכ־15 אחוזים מהגידולים שאינם קשקשיים בקרב חולים ממדינות מערביות, ובשכיחות גבוהה של כ־50 אחוזים בקרב חולים ממוצא אסיאתי.
פותחו תרופות מעכבות טירוזין קינאז (TKI ,Tyrosine Kinase Inhibitors), הנקשרות ומעכבות את אתר הטירוזין קינאז התוך תאי של ה- EGFR. הדור הראשון של התרופות עיכב את האתר באופן הפיך וכלל שתי מולקולות קטנות (Small molecules): Erlotinib (Tarceva) ו- Gefitinib (Iressa).
במחקר בשלב 3, IPASS, 1,200 חולים ממוצא מזרח-אסיאתי עם אדנוקרצינומה מתקדמת, לא מעשנים, הוקצו אקראית לטיפול קו ראשון ב- Gefitinib לעומת כימותרפיה במשלב Carboplatin ו- Paclitaxel[10]. מטרת המחקר הייתה לבחון האם קיים הבדל בהישרדות ללא התקדמות בין הטיפולים.
התוצאות הראו שיפור משמעותי בהישרדות ללא התקדמות תחת טיפול ב- Gefitinib: הורדה יחסית של 25 אחוזים בסיכון להתקדמות (1 אחוז לעומת 25 אחוזים בהישרדות ללא התקדמות למשך שנה). כ־430 חולים נבדקו לתשנית ב- EGFR, מתוכם 60 אחוזים היו חיוביים.
התוצאות החיוביות חזרו על עצמן במספר מחקרים, כולל מחקר בחולים מקרב מדינות מערביות (EURTAC), שבו מטופלים חיוביים לתשנית ב-EGFR שטופלו ב- Erlotinib הדגימו שיפור של 4.5 חודשים בהישרדות ללא התקדמות לעומת חולים שטופלו במשלב על בסיס Platinum[11].
חולים עם מוטציה ב-EGFR שמטופלים במעכב ביולוגי מראים שיעורי תגובה של 70 אחוזים לתרופה, לעומת 30 עד 40 אחוזים בלבד של תגובה לכימותרפיה. בנוסף להארכת ההישרדות ללא התקדמות, מתאר תופעות הלוואי עדיף על זה של כימותרפיה וכולל בעיקר שלשול, תגובות עוריות ועייפות.
פותח דור חדש של TKI-EGFR, שמעכב את אתר הטירוזין קינאז באופן בלתי הפיך. המעכב, Afatinib (Gilotrif), אושר על ידי מנהל התרופות האמריקאי לטיפול קו ראשון בחולים עם סרטן ריאות גרורתי ותשנית ב- EGFR, על סמך מחקר 3LUNG-LUX, שהשווה במטופלים אלה טיפול ב- Afatinib לכימותרפיה במשלב Cispatin ו- Pemetrexed[12].
תוצאות המחקר הראו שיפור של ארבעה חודשים בהישרדות ללא התקדמות בטיפול ב- Afatinib לעומת כימותרפיה, הכפלה של שיעור התגובה לטיפול ומתאר תופעות לוואי עדיף.
טיפול בנוכחות האיחוי הגנטי ALK-4EML
היפוך מקטע (Inversion) בכרומוזום 2 גורם לאיחוי של הגן 4EML עם הגן ALK, ויצירת גן אונקוגני חדש, ALK-4EML. האונקוגן מביע פעילות קינאז תמידית, ללא תלות בליגנד.
שכיחות השינוי הגנטי היא כ־5 עד 7 אחוזים מכלל החולים עם אדנוקרצינומה של הריאה. המאפיינים הקליניים הנפוצים של המטופלים בהם קיים השינוי הגנטי: גיל צעיר (גיל חציוני 52 לעומת 66), לא מעשנים ותתי הסוג טבעת חותם (Signet ring) או אצינר. כמו כן, המטופלים בדרך כלל שליליים לתשניות ב- EGFR או KRAS.
מחקר בשלב 3 בדק 350 חולים חיוביים לשחלוף (Rearrangement) ב-ALK, לאחר התקדמות על טיפול מבוסס Platinum, שהוקצו אקראית לטיפול ב- Crizotinib או כימותרפיה (Pemetrexed או Docetaxel). התוצאות היו משמעותיות לטובת Crizotinib: הורדה יחסית של 50 אחוזים בסיכון להתקדמות, שיפור של 4.5 חודשים בהישרדות ללא התקדמות ואחוז תגובה של 60 אחוזים לעומת 20 אחוזים בלבד עם כימותרפיה[13].
כיווני מחקר עתידיים
ההבנה המעמיקה בביולוגיה מולקולרית של סרטן הריאות מובילה לפיתוח תרופות חדשות. מחקרים חדשים בודקים יעילות מספר טיפולים, כולל טיפול חיסוני (Immunotherapy), שימוש כמעכבי MET-c, עיכוב התהוות כלי דם במנגנונים שונים (כגון Endostatin) ועוד.
על פי מכון הבריאות הלאומי (National health instituted) האמריקאי, יש כעת מעל 1,100 מחקרים פתוחים לגיוס חולים, הבודקים טיפולים חדשניים בגידולים ריאתיים.
ביבליוגרפיה
- ↑ SEER Stat Fact Sheets: Lung and Bronchus Cancer
- ↑ Travis WD, Brambilla E, Muller-Hermelink HK. Patholoy and genetics: Tumors of the lung, Pleura, Thymus and Heart. IARC, Lyon, France, 2004
- ↑ National lung screening trial research team. Aberle DR, Adams AM, Berg CD et al. Reduced lung cancer mortality with low-dose computed tomographic screening. NEJM. 2011; 365(5):395
- ↑ Timmerman R, Paulus R, Galvin J et al. Stereotactic body radiation therapy for inoperable early stage lung cancer. JAMA 2010; 303(11):1070
- ↑ Schiller J, Harrington D, Bellani CP et al. Comparison of four chemotherapy regimens for advanced non small cell lung cancer. NEJM 2002; 346:92-98
- ↑ Scagliotti GV, Parikh P, von Pawel J et al. Phase III study comparing Cisplatin plus Gemcitabine with Cispatin plus Pemetrexed in chemotherapy naïve patients with advanced stage non small cell lung cancer. JCO 2008 (26):21, 3543-3551
- ↑ Sandler A, Gray R, Perry MC. Paclitaxel-Carboplatin alone or with Bevacizumab for non small cell lung cancer. NEJM 2006; 355: 2542-50
- ↑ Rack M, von Pawel J, Zatloukal P. Phase III trial of Cisplatin plus Gemcitabine with either placebo or Bevacizumab as first line therapy for nonsquamous no-small cell lung cancer: Avail. JCO 2009; 27(8): 1227-34
- ↑ Patel JD, Socinski M, Gradon EB. Pointbreak: a randomized phase III study of Pemetrexed plus Carboplatin and Bevacizumab followed by maintenance Pemetrexed and Bevacizumab versus Paclitaxel plus Carboplatin and Bevacizumab followed by maintenance Bevacizumab in patients with stage IIIb or IV nonsquamous non small cell lung cancer. JCO 2013
- ↑ Mok TS, Wu YL, Thongprasert S. Gefitinib or Carboplatin- Paclitaxel in pulmonary adenocarcinoma. NEJM 2009; 361: 947-957
- ↑ Rosell R, Carcereny E, Gervaise R. Erlotinib versus standard chemotherapy as first line treatment for European patients with advanced EGFR mutation positive non small cell lung cancer (EURTAC): a mulicentre open label randomized phase III trial. Lancet Oncol. 2012 Mar 13 (3): 239-46
- ↑ Sequist LV, Yang JCH, Yamamoto N. Phase III study of Afatinib or Cispatin plus Pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. JCO 2013 (31) 27: 3327-3334
- ↑ Shaw AT, Kim DW, Nakagawa K et al. Crizotinib versus chemotherapy in dvanced alk-positive lung cancer. NEJM 2013; 368: 2385-2394
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר סיון שמאי מחלקה אונקולוגית, המרכז הרפואי תל אביב ע"ש סוראסקי


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק