סרטן השד - היבטים כירורגיים - Breast cancer - surgical aspects
| עקרונות בכירורגיה | ||
|---|---|---|
| ||
| שם המחבר | ד"ר צבי קויפמן | |
| שם הפרק | כירורגיה של השד | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן השד
אפידמיולוגיה
שכיחות והיארעות
- סרטן השד הוא השכיח ביותר מבין השאתות הממאירות בנשים. בארה"ב הסקרים מדווחים על 72 נשים הלוקות בסרטן השד לכל 100,000 נשים מדי שנה (כ-190,000 נשים בשנה), ואילו 22 נשים לכל 100,000 נפטרות מדי שנה עקב סרטן השד (כ-50,000 נשים בשנה). 3.5% מהנשים הנפטרות מדי שנה - נפטרו מסרטן השד. בארץ מתגלים כ-4,000 מקרים חדשים מדי שנה. שיעור ההיארעות של סרטן השד עלה מדי שנה ב-1%-0.5% בעולם המערבי. עד 2005, מאז נרשמת ירידה קלה בהיארעות, המיוחסת בחלקה לירידה בשימוש בתרופות המשמשות כטיפול ההורמונלי החליפי (HRT), וירידה בשיעור הנשים המבצעות ממוגרפיה שגרתית עקב מגבלות חברות הביטוח בארה"ב.
- ממאירות בשד היא הסיבה השכיחה ביותר לפטירת נשים בנות 45 שנים ומטה.
- השכיחות עולה עם הגיל. מגיעה לשיאה בגיל 70 ומנקודה זו היא נשארת באותה רמה (Plateau). העלייה בשכיחות מתחילה בנשים בנות 30 שנה ומעלה, למרות שבאופן נדיר ניתן לגלות שאתות ממאירות בנשים צעירות יותר.
- שאתות ממאירות בשד שכיחות פי 100 בנשים מאשר בגברים (1:100).
סיפור משפחתי וסרטן השד
ערך מורחב – גנטיקה וסרטן שד
שכיחות השאתות הממאירות של השד גבוהה יותר בנשים עם סיפור משפחתי של סרטן השד. כאשר האם היתה חולה, וגילה פחות מ-60 שנה, שכיחות הסרטן בבנותיה גדולה פי 2 מאשר בנשים ללא סיפור משפחתי. כאשר גם האם וגם האחות נגועות - הרי שכיחות המחלה בבת נוספת גדולה פי 6-4 מאשר בנשים ללא סיפור משפחתי. כאשר אחות חלתה בגיל צעיר מ-40 שנה, ומחלתה דו-צדדית, קיימת הסתברות של 50% שאחותה תחלה. 30% מהנשים שלהן אמא או אחות שלקו בסרטן שד דו-צדדי בגיל צעיר, או שלהן מספר קרובות מדרגה ראשונה, שחלו בסרטן השד, יחלו בסרטן השד.
גיל החולה וסרטן השד
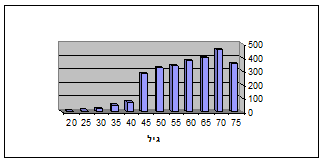
נשים ללא גורם סיכון כלשהו, עלולות לחלות בסרטן השד עד גיל 80 בהסתברות של 6% (גרף 1.12). יותר מ- 95% מהשאתות הממאירות נמצאו בחולות בנות 30 שנה ומעלה. שאתות המופיעות בגילאים נמוכים יותר הן שפירות ברובן.
| שכיחות סרטן השד בקבוצות גיל שונות | |
|---|---|
| גיל | סיכון לשנה |
| 30 | 1 ל-5,900 |
| 35 | 1 ל-2,300 |
| 40 | 1 ל-1,200 |
| 50 | 1 ל-590 |
| 60 | 1 ל-420 |
| 70 | 1 ל-330 |
| 80 | 1 ל-290 |
היריון, מחזור וסרטן השד
ערך מורחב – היריון וסרטן השד
שכיחות סרטן השד עולה פי 1.9 בנשים שלא הרו עד גיל 30, פי 1.3 בנשים שבהן החל המחזור מוקדם, ופי 1.5 בנשים שבהן הסתיים המחזור מאוחר. שכיחות נמוכה של סרטן השד נמצאה בנשים אשר הרו לפני גיל 18 (קטנה פי 0.7), בנשים שעברו עיקור לפני גיל 40 (קטנה פי 0.7) ובנשים שהניקו, בתנאי שהאישה היתה בת 25 שנים ומטה בעת ההנקה הראשונה.
שאתות בשד השני
בנשים בעלות קרצינומה שטופלה בשד אחד - ההסתברות להופעת קרצינומה בשד השני היא 0.7% לכל שנה, כאשר אחוז זה מצטבר. ב-25% מהנשים הצעירות החולות, ניתן למצוא ממאירות בו-זמנית בשני השדיים.
מיקום סרטן השד
השכיחות הינה פונקציה של מיקום השאת בשד. רוב הקרצינומות ממוקמות ברביע החיצוני העליון. לאחריו - הרביע הפנימי העליון, הרביע החיצוני התחתון והרביע הפנימי התחתון. השאתות שכיחות יותר בצד שמאל. מחצית מהשאתות הנמושות גדולות מ-2 ס"מ ורק 5% מהשאתות קטנות מ-1 ס"מ. במקומות שבהם קיים סיקור ממוגרפי עלה שיעור החולות בעלות שאתות הקטנות מ-1 ס"מ ל- 25%-20%.
ממאירות נוספת וסרטן השד
בנשים בעלות שאתות ממאירות באיברים אחרים נמצאה שכיחות גבוהה יותר של שאתות ממאירות בשד. מאמרים אחרים מדווחים על שכיחות יתר של מחלות ממאירות באיברים אחרים של חולות סרטן השד. האיברים הנגועים ביותר הם: בלוטות הרוק, הרחם, השחלות, בלוטת התריס וכרכשת. רוב העבודות מציינות שסרטן השד מתגלה בדרך כלל לאחר האבחון של הסרטן בבלוטות הרוק. לעומת זאת אין שוני מהותי מבחינת עיתוי גילוי מחלת הסרטן באיברים אחרים או בשד.
מוצא וסרטן השד
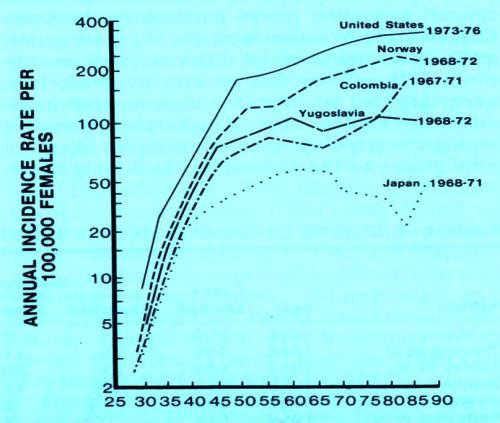
ידוע, כי שכיחות סרטן השד שונה בארצות שונות ובקרב גזעים שונים. השכיחות גבוהה יותר בקרב נשים אמריקניות לבנות ונמוכה יחסית ביפן. השכיחות גבוהה מאוד בצפון אמריקה ובצפון אירופה, ופחות גבוהה בדרום אירופה ובארצות הלטיניות, ונמוכה בארצות אפריקה ואסיה. בישראל, למשל, נשים יהודיות אשכנזיות ממזרח אירופה נוטות יותר לחלות בסרטן השד, מאשר נשים מעדות אחרות. המחלה שכיחה יותר אצל נשים משכבות חברתיות-כלכליות גבוהות מאשר אצל נשים משכבות נמוכות, אצל נשים שלא נישאו מאשר אצל נשים נשואות ואצל נשים מישובים עירוניים מאשר אצל נשים מאזורים כפריים.
השכיחות ביפן היא 1/5 מאשר בארה"ב. אולם שיעור ההיארעות של סרטן השד בנשים העוברות מאזור בעל שכיחות מחלה נמוכה לאזור בעל שכיחות מחלה גבוהה, עולה עם השנים (גרף 2.12).
שינויים פיברוציסטיים וסרטן השד
קיים קשר בין שינויים דיספלסטיים ברקמת השד לבין מציאת שאתות ממאירות. המקור המשותף לשתי מחלות אלה הוא כנראה ההשפעה האסטרוגנית. באחת העבודות עקבו אחר 10,000 נשים שעברו ביופסיה של נגע בשד. המעקב החציוני ב-3,300 נשים היה 17 שנים. ב-7,200 מהנשים לא נמצאו בביופסיות הוכחות לשינויים פרוליפרטיבים, ב-2,800 נמצאו שינויים פרוליפרטיבים ללא אטיפיה, וב-377 נמצאו שינויים פרוליפרטיבים עם אטיפיה. בחולות בעלות שינויים פרוליפרטיבים ללא אטיפיה הסיכון לפתח סרטן השד דומה או מעט יותר גבוה מזה של האוכלוסייה הכללית. בחולות בעלות שינויים פרוליפרטיביים עם אטיפיה הסיכון היה גדול פי 5.3. סיפור משפחתי היה חסר משמעות סטטיסטית בחולות ללא מחלות פרוליפרטיביות של השד, אולם בחולות בעלות שינויים פרוליפרטיביים ואטיפיה הסיכון גדל פי 11. בחולות בעלות שינויים פרוליפרטיבים והסתיידויות שיעור הופעת סרטן השד גדול פי 2.4 מזה של האוכלוסייה הכללית. מסקנת המחברים בעבודה זו היא שרוב הנשים העוברות ביופסיות עקב מחלה שפירה של השד לא נמצאות בקבוצת הסיכון לפתח סרטן שד. חולות עם אטיפיה וסיפור משפחתי של סרטן השד מהוות קבוצה בעלת סיכון גבוה לפתח סרטן השד.
גלולות וסרטן השד
ערך מורחב – הגלולה וסרטן השד
מסקירת הספרות על הקשר שבין השימוש בגלולות למניעת הריון ובאסטרוגנים לבין שאתות השד, אפשר להסיק, שאין כיום הוכחה ברורה לקשר שכזה. לעומת זאת במספר סקרים שפורסמו לאחרונה נמצאה עלייה בשכיחות סרטן השד בגיל צעיר בנשים שהשתמשו בגלולות באופן ממושך. למרות שההבדלים הם בלתי משמעותיים מבחינה סטטיסטית מחייב הממצא בדיקות מעקב בנשים אלה. באשר לשימוש באסטרוגנים בגיל הבלות (HRT - Hormone replacement therapy) נמצא קשר רופף להתפתחות סרטן השד (פי 1.3-פי 1.5), לאחר שנים מרובות (10-8) של שימוש (ראה סיכום בסוף הפרק).
השמנה וסרטן השד
נשים שמנות נוטות לפתח סרטן שד יותר מנשים מכלל האוכלוסייה. בנשים בעלות שד גדול שכיחות סרטן השד גדול פי 1.2 מזו של כלל האוכלוסייה. התמותה בנשים אלה מסרטן השד היא גבוהה יותר. ישנן עבודות המצביעות על התזונה כגורם סיכון, בעיקר תזונה עשירה בשומנים מהחי. אצל נשים לאחר הבלות השמנת יתר מגדילה את הסיכון לחלות בסרטן השד. זאת משום ההמרה הרבה יותר של Androstendione ל- Estrone ברקמת השומן אצל נשים שמנות והרמה הנמוכה של ערכי ה-Sex hornome binding globulin לעומת נשים רזות.
צריכת אלכוהול
צריכת אלכוהול מעלה את שכיחות סרטן השד בקרב הצורכות. בקרב הצורכות עד 14 גר' אלכוהול נמצא סיכון יחסי ללקות בסרטן השד של 1.3. בצריכה של מעל 15 גר' הסיכון היה של 1.7. בנשים מתחת לגיל 50 שצרכו 15 גר' ויותר הסיכון היחסי היה 2.5. שילוב של טיפול הורמונלי חלופי בנשים עם חידלון אורח וצריכת אלכוהול מעל 20 גר', שיעור סרטן השד שדווח היה פי 2 מהאוכלוסיה שלא צרכה אלכוהול.
קרינה וסרטן השד
חשיפה לקרינה בגיל הילדות מעלה את שכיחות השאתות הממאירות בשד (פי 3).
סמיכות גבוהה של רקמת השד בממוגרפיה
סמיכות שד גבוהה מבטאת הפרעה בחדירת קרן הרנטגן דרך רקמת השד עקב המרכיב הבלוטי הרב בשד זה. נמצא, שבנשים שלהן רקמת שד סמיכה והן מעל גיל 50, הסיכון לחלות בסרטן השד הוא עד פי 4 ביחס לנשים שלהן רקמת שד שומנית בעיקרה.
טיפולי הפריה
נשים שעוברות טיפולי הפריה שמשמעותם חשיפה לגירוי מוגבר ביתר של השחלות לביוץ על ידי מתן טיפולים הורמונים במינון גבוה, מעלה לפי חלק מהמחקרים את הסיכון לחלות בסרטן שד לאחר שנים, אולם חסרים עבודות טובות לאמת עובדות אלה.
ביולוגיה של סרטן השד
תא שאת צריך לעבור לפחות 30 חלוקות כדי שיגיע לגודל של 1 ס"מ, ויהיה ניתן לזיהוי באופן קליני. 10 חלוקות נוספות - והשאת תכיל כמיליארד תאים. זהו המצב שבו מוכרעת החולה על-ידי המחלה. דהיינו, כשיש ביטוי קליני ראשוני של המחלה, השאת, מבחינת המהלך הטבעי שלה, היא בשלב מתקדם מאוד.
קצב הגדילה של סרטן השד או זמן הכפלת הנפח (Volume doubling time) נבדקים בשיטות שונות:
- מדידת קוטר השאת הראשונית בבדיקות ממוגרפיות למיניהן.
- מדידת קוטרן של גרורות ריאתיות בסדרה של צילומי בית החזה.
- מדידת קוטר ההישנות המקומית בצלקת הניתוחית לאחר כריתת שד.
- מדידת קצב יצירת ה-DNA בתימידין מסומן ברקמת שאת.
זמן ההכפלה של תא סרטן השד נע בין 40 ל-380 יום. גרורות יכולות להופיע בין שנתיים ל-20 שנה. כשמאבחנים סרטן בשלב ראשוני, ייתכן שקיים כבר פיזור גרורתי מיקרוסקופי תת-קליני.
גדילת השאתות בשד היא פונקציה של היחס בין המאכסן לגידול, כלומר היכולת של המאכסן להגיב מבחינה אימונולוגית במטרה להגביל את מהירות גדילת השאת. אם יכולת זו מועטה הרי השאת יכולה לגדול מהר מאוד כאשר זמן הכפלת המסה שלה הוא 28 ימים, או לגדול לאט כאשר זמן ההכפלה הינו 300 ימים ויותר, בחולים בעלי תגובה אימונולוגית טובה. ברור מכאן, שיכולות לחלוף אף 8 שנים עד אשר מסה כזו תגיע לממדים אשר ניתן למששם בבדיקה קלינית. יש לציין ששאתות הגדלות מהר הן שאתות השולחות גרורות בשלבים מוקדמים יותר. ההיוותרות בחיים של חולות ללא טיפול היא בממוצע 3 שנים, ויכולה להגיע גם ל-5 ועד 30 שנה בשאתות הגדלות לאט.
סיקור אוכלוסיית הנשים לגילוי מוקדם של סרטן השד
מטרת הסיקור היא לזהות את המחלה באוכלוסייה א-תסמינית בשלב מוקדם על מנת לאפשר טיפול מוקדם וריפוי מהמחלה. התנאים הנדרשים ממערכת סיקור הם:
- המחלה שכיחה מאוד באוכלוסייה הנסקרת.
- קיום בדיקת סקירה טובה.
- הוכחה שסיקור עוזר.
שכיחות המחלה: סרטן השד היא השאת השכיחה ביותר בנשים, והמחלה מאובחנת באישה אחת עד שבע נשים לכל אלף נשים מדי שנה. הערכה היא שכ-6% מהנשים יפתחו את המחלה במשך חייהן. בישראל מתגלים כ-2000 מקרים חדשים מדי שנה. השכיחות עולה בקצב של 1% מדי שנה. משנת 2000 כ-2 מיליון נשים ברחבי העולם חלו בסרטן השד מדי שנה. שכיחות המחלה עולה עם הגיל: בגיל 40 ומטה - 0.7 נשים לכל 100 נשים מאובחנות מדי שנה; בין גיל 40 ל-55 - אישה אחת עד שתי נשים לכל 1,000 נשים מאובחנות מדי שנה; מגיל 55 ומעלה - שלוש עד ארבע נשים לכל 1,000 נשים מאובחנות מדי שנה. בישראל השכיחות של המחלה בקרב עדות המזרח והאוכלוסייה הערבית נמוכה יחסית, למרות שניכרת נטייה לעלייה בשכיחות המחלה באוכלוסיות אלה בשנים האחרונות. בארה"ב נפטרות מדי שנה כ-50,000 נשים מסרטן השד. בישראל נפטרות כ-1000 נשים בשנה. סרטן השד הינה מחלה שכיחה הממלאת אחר התנאי הראשון לסיקור.
בדיקת סקירה: בדיקת הסקירה היחידה הקיימת כיום לסרטן השד היא הממוגרפיה. בהערכת הממוגרפיה כבדיקת סקירה יש לברר האם הממוגרפיה היא בדיקה אמינה, בטוחה, מה עלותה ועד כמה קשורות תוצאותיה למפענח.
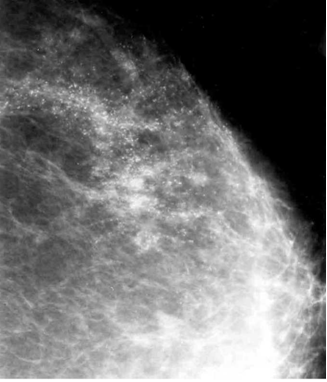
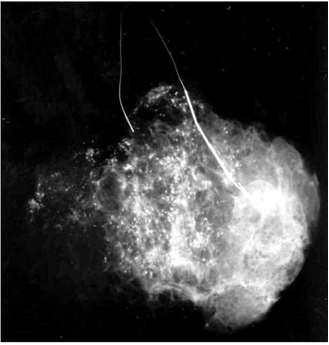
אמינות: סגוליות הממוגרפית המדווחת היא 96% ואילו הרגישות 80%-75%. Positive predictive value הוא 50%-10%. אין ספק שהממוגרפיה היא מכשיר בינוני לסיקור אוכלוסייה לגילוי מוקדם של סרטן השד. אולם זה המכשיר היחיד כיום (תמונה 19.12).
בטיחות: הסיכון לפתח שאת ממארת בשד עקב ממוגרפיה הוא 6 למיליון ראד/שנה. סיקור אוכלוסייה בגיל 50-40 יגרום ל-18 מקרי סרטן שד למיליון ראד/שנה, ול-24 מקרים למיליון ראד/שנה באוכלוסייה של בני 40 שנה ומטה. באופן תיאורטי סיקור של מיליון נשים יגרום בכל שנה לשני מקרי סרטן השד שמקורם בקרינת הממוגרפיה. הערכה היא שאחת מתוך 170 ועד 300 שאתות ממאירות שיתגלו בסיקור, מקורה הוא בקרינת הממוגרפיה. עלות הממוגרפיה גבוהה יחסית. עלות האבחנה של 54 מקרי סרטן היתה 7 מיליון דולר. כלומר, כ-130,000 דולר לכל אבחנה של מקרה סרטן. בשנת 2000 בעלות של 402 מיליון דולר ניתן יהיה להציל 373 נשים ממוות. בתור פרויקט לאומי מדובר בהוצאה גדולה מאוד מהכיס הציבורי.
פיענוח הממוגרפיה תלוי לגמרי ביכולתו של המפענח. ב-30% מהמקרים אין הסכמה בין מפענחי הממוגרפיה. ממוגרפיה דיגיטלית אפשרה פיתוח תוכנות לקריאה אוטומטית של הממוגרפיה. אולם מלבד היות תוכנות אלה יקרות, הן עדיין דורשות בקרה והחלטה של רדיולוג, ולכן שיפרו אך במעט את יכולת הפענוח ביחס לקריאה של שני רדיולוגים. בחלק מהמרכזים בעולם כל ממצא עובר ביופסיה ולכן היחס בין ממצאים ממאירים לשפירים הוא אחד לעשרה, שמשמעותו הרבה ביופסיות מיותרות.
מכל האמור לעיל הממוגרפיה היא כלי בינוני לסיקור, יקר לשימוש, בעל בטיחות גבוהה יחסית באוכלוסיות מגיל 50 שנה ומעלה, ותלוי לחלוטין במפענח. לאור זאת ברור ששימוש במכשיר כזה מחייב הוכחה ברורה שהוא מקטין את התמותה מסרטן השד באוכלוסייה נסקרת.
הוכחת סיוע: בעולם נערכו מספר מחקרים קלינים שבהם השוו אוכלוסיית סיקור לאוכלוסייה ללא סיקור. תוצאות המחקרים שנתפרסמו מראים יתרון לאוכלוסייה הנסקרת (ראה טבלה 2.12).
| טבלה 2.12: מחקרים על יעילות סיקור האוכלוסייה לגילוי מוקדם של סרטן השד | ||||
|---|---|---|---|---|
| שם המחקר | מספר המשתתפים | צורת הסיקור | אורך המעקב שנים | שנת פרסום |
| H.I.P | 60,000 | קליני ממוגרפיה | 14 | 1989 |
| BDDDP | 280,000 | קליני ממוגרפיה | 18 | 1985 |
| שבדי | 140,000 | ממוגרפיה | 8 | 1989 |
| אדינבורג | 45,000 | ממוגרפיה | 7 | 1989 |
| Nijmegen | 43,000 | ממוגרפיה | 7 | 1988 |
| Malno | 30,000 | ממוגרפיה | 8 | 1988 |
| U.K | 60,000 | קליני ממוגרפיה | 5 | 1989 |
| Utrich | 21,000 | ממוגרפיה קליני | 1989 | |
| NBSS | 90,000 | קליני לעומת ממוגרפיה | ||
בהערכה של מחקרים מסוג זה חשוב לזכור שיש מספר הטיות (Bias) שצריך לקחת בחשבון בזמן שמסכמים את תוצאות העבודות הללו. ה- Lead time bias נובע מגילוי מוקדם של השאת בעקבות הסיקור, אולם לא היתה לכך כל השפעה על משך ההיוותרות בחיים של החולה. לכן, אם נבדוק את אורך החיים של החולות בשתי הקבוצות נמצא שבקבוצת הסיקור הוא ארוך יותר, אבל זאת עקב גילוי מוקדם ולא עקב שינוי במהלך הטבעי של המחלה. אם נמדוד את משך החיים עד המוות נראה שוב אותם ממצאים שאין להם משמעות מבחינת בריאות החולות. מכיוון שישנן שאתות הגדלות מהר וכאלה הגדלות לאט, הרי ייתכן שבממוגרפיה נגלה דווקא את אלה הגדלות לאט, ולכן שאתות שנמצאו בממוגרפיה יהיו בעלות היוותרות בחיים ארוכה יותר לעומת אלה שלא נתגלו בממוגרפיה; כלומר אנו עוסקים בשני סוגים שונים של שאתות - Length time bias. מקור אחר לטעות הוא ה-Selection bias, כלומר אוכלוסיות נשים שונות, שבהן שכיחות המחלה שונה. כדי להתגבר על ההטיות הללו יש לבצע עבודות אקראיות, עם מעקב לטווח ארוך וכאשר המדד הוא תמותה מסרטן השד באוכלוסייה. עבודות מסוג זה הן מעטות.
העבודה של איגוד חברות הביטוח לבריאות בארה"ב (HIP) היא העבודה הראשונה מסוג זה שהראתה שה- Odd mortality ratio באוכלוסיית הסיקור היה ב-30% קטן יותר מאשר באוכלוסיית הביקורת לאחר 14 שנות מעקב, וזאת למרות היענות של 50% באוכלוסיית הסיקור. עבודה אחרת שעונה לקריטריונים שהצבנו היא העבודה השבדית שנמשכה 7 שנים ושיעור ההיענות של האוכלוסייה היה 90%. שיעור האבחון באוכלוסייה זו היה 7/1000, שהוא משמעותי בין הקבוצות. כאשר הקבוצות חולקו לפי קריטריון גיל נמצא שבאוכלוסיות השונות נשמר ההבדל המשמעותי בתמותה בין קבוצת הסקר לבין קבוצת הביקורת. העבודה מאדינבורג לא מצאה הבדלים משמעותיים בין הקבוצות אולם חסרונה הוא במעקב קצר יחסית ובהיענות נמוכה. המחקר מ-MALNO מראה שוב שההבדלים בין אוכלוסיות הסיקור והביקורת הם רק באוכלוסיות של גילאי 55 שנה ומעלה. מעניין שבעבודה של HIP, במעקב ארוך נמצאה יעילות בסיקור גם אצל אוכלוסייה של גילאי 50 שנה ומטה ועיקר ההבדל נוצר כעבור 9-8 שנים כאשר הנשים היו בגיל ה-50 ומעלה. משמעות הממצאים היא שאם היינו סורקים את האוכלוסייה מגיל 50 ולא מגיל 40, ייתכן שהתוצאות היו זהות.
מכאן נובעות ההנחיות השונות של האיגודים השונים בארה"ב. אלה הגורסים שאין הבדל בתמותה בין אוכלוסיית הסקר לאוכלוסיית ביקורת בגילאי 50 ומטה, ממליצים על סיקור אוכלוסייה רק בגילאי 50 ומעלה. לעומתם אלה הגורסים שקיים הבדל כפי שהוכח בסקר ה-HIP, ויש לבצע את הסיקור גם באוכלוסיות של גילאי 40 ומעלה. אין ספק כיום שסיקור של גילאי 50 ומעלה מביא להקטנת התמותה בקרב נשים בקבוצת הסקר. ולכן קיימת הסכמה להמליץ על ממוגרפיה שגרתית לבנות גיל זה ומעלה. לגבי הגילים 50-40 יש ויכוח כאשר חלק ממליצים לבצע ממוגרפיה וחלק אינם ממליצים. הנושא נמצא עתה בבדיקה. מהתוצאות הראשוניות נראה שהכף נוטה לטובת השוללים.
לסיקור האוכלוסייה יש מחיר! 10% מהנשים הנסקרות ייקראו חזרה עקב ממצאים לא ברורים בממוגרפיה. 20%-10% מהנשים הללו יוזמנו לביופסיה של הנגע שנמצא, כאשר רק ל-2-1 מכל 10 נשים יש שאת ממארת. עבודות שעקבו אחר נשים שעברו סיקור במשך 10 שנים מצאו שב-30% מהן נמצאו ממצאים המצריכים בירור נוסף, אם על-ידי ממוגרפיה או על-ידי ביופסיות מחטיות או על-ידי ביופסיות פתוחות. המחיר לכך היה הכפלת ההוצאות הכספיות של מערכת הסיקור, והחרדה שאליה נחשפו אותן נשים בתקופת הבירור. מכאן, נשים רבות תעבורנה ביופסיות מיותרות בגלל הסיקור. לביופסיות אלה יש מחיר נפשי וגופני. העלות הכספית של סיקור מסוג זה המאורגן על-ידי רשויות הבריאות היא אדירה. הקטנת התמותה באוכלוסיית הסיקור אינה באה לידי ביטוי בתמותה הכללית של אוכלוסיית הנשים. גילוי מוקדם - כך אנו מבטיחים לנשים - יאפשר גילוי שאתות בשלב שבו ניתן לבצע טיפול משמר שד לנשים. המציאות מראה שכ- 30%-20% מהחולות, שהתגלתה בהן שאת בסיקור, יעברו כריתת שד שלמה. מחד גיסא, המחיר לאוכלוסייה הוא גבוה הן כלכלית, והן גופנית ונפשית, ומאידך גיסא, הפחתת התמותה באוכלוסייה היא שולית. לפני שנכנסים לפרויקט כזה יש להתכונן היטב, להגדיר את אוכלוסיות הסיכון שבהן יחס העלות-יעילות הוא נמוך ביותר, ורק אותן לסקור.
בסקר גדול של התמותה מסרטן שד, הכולל בתוכו את רוב מדינות אירופה המערבית בהן מופעלים תוכניות סיקור ממוגרפיות, ניתן להדגים הפחתה בתמותה מסרטן שד בקרב אוכלוסיות שעברו סריקה ביחס לאלה שלא עברו סריקה. ההפחתה נעה בין 4% ל-10% ונמצאה בעלת מובהקות סטטיסטית. ההבדלים בין מדינות שונות נמצאו תלויים ברמת ההיענות לתוכניות הסיקור באותן מדינות. נתון זה שם קץ לוויכוח על יעילות תוכניות הסיקור (גרף 3.12).
בדיקה עצמית לאבחון מוקדם של סרטן השד
נבדקה ההשפעה של החדרת מודעות גבוהה לסרטן השד באוכלוסיית San Diego (2,000,000) בעזרת אמצעי התקשורת, הדרכת נשים לבדיקה עצמית, דרישה מרופאי משפחה לבדוק בצורה סדירה נשים הפונות לטיפולם וכו', על השכיחות הצפויה של גילוי סרטן השד באוכלוסייה זו, גודל השאת ומעורבות בלוטות הלימפה בתהליך. המעקב נמשך 5 שנים. בתום הסקר דווח שלא נמצאה עלייה משמעותית בשכיחות סרטן השד שנתגלתה באותם שנים ביחס לצפוי, וגם לא נמצא כל הבדל בגודל השאת או במעורבות של בלוטות הלימפה באוכלוסייה שחלתה בסרטן השד. בפרק הסיכום נקבע שהבדיקה הקלינית אינה מהימנה מספיק על מנת לגלות שאתות ממאירות בשלבים מוקדמים, ויש צורך בבדיקות סקירה אחרות. עבודה זו נתמכת בעבודות אחרות המראות שלבדיקה העצמית אין השפעה על שלב המחלה, וחשיבותה העיקרית היא במודעות לבריאות השד המוחדרת באישה.
התמונה הקלינית
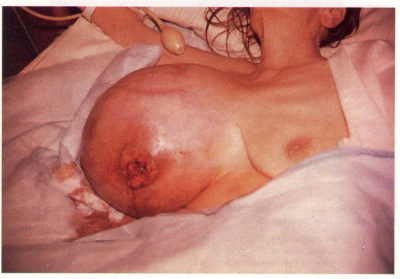
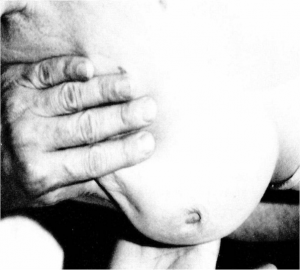
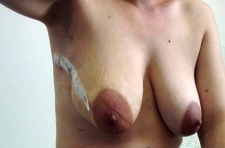
- גוש בשד: רוב הנשים מופיעות עם גוש בשד. לרוב הן היו הראשונות ששמו לב אליו. לעתים יותר רחוקות הגוש, שנשים ממששות, הוא מחוץ לשד ומבטא גרורות מהשד אל בית השחי.
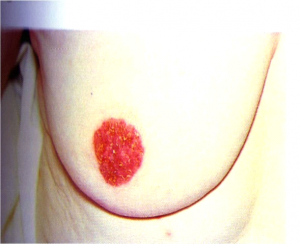
- הפרשה מהפטמה דמית במיוחד (תמונה 20.12).
- בחלק קטן מהחולות הגוש בשד מלווה בכאבים באותו האזור או באזור אחר.
- תופעות סיסטמיות כמו כאבי עצמות, ירידה במשקל ואחרות הן נדירות יותר.
- בחלק מהחולות הגוש נמצא במסגרת בדיקה שגרתית.
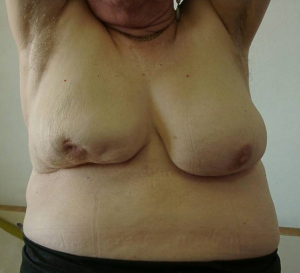
- שינוי בגודל השד (תמונה 21.12).
- שינויים בצורת השד עם רטרקציות (שקיעה) של העור (תמונה 22.12).
|
|
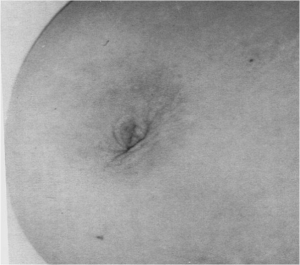
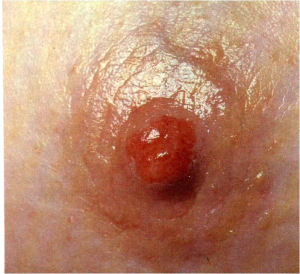
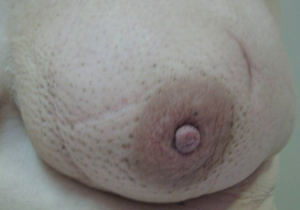
- שינויים בפטמה כולל שקיעת הפטמה או שינוים דלקתיים–אקזמטוטיים של העור (תמונה 23.12 ותמונה 24.12).
|
|
|
|
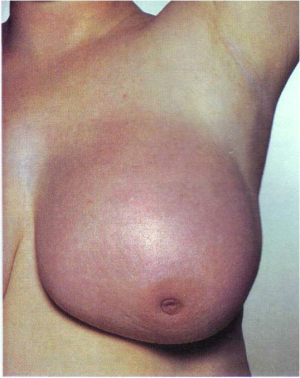
- שינוי בעור השד כמו שינויים דלקתיים או מראה עור תפוז (תמונה 25.12).
|
|
בקבלת חולה יש לקבל אנמנזה טובה הכוללת גיל, סיפור של כאבים בשד, מיקומם והקשר שלהם למחזור. מחזור - תחילתו, סיומו והפרעות בו. הפרשה מהפטמה, שקיעת הפטמה. מחלות קודמות כמו שאתות בשד שני, שאתות מערכת המין, ניתוחים גניקולוגיים ועוד. ההיסטוריה המשפחתית חשובה. לידות - מתי, כמה ומתי היתה הלידה הראשונה. משך ההנקה. שימוש בגלולות או בתרופות הורמונליות אחרות. יש לשאול על קיום גרד וארוזיות סביב הפטמה או גדילת שד באופן פתאומי.
הבדיקה מתבצעת כאשר החולה יושבת ושוכבת. בהסתכלות צריך לשים לב לגודל השד, לצורה, לצבע, לתבנית כלי הדם, לתופעות אקזמתיות, לרטרקציות או לתבנית של עור תפוז. את המישוש מבצעים בשכיבה ובישיבה כאשר הידיים על המותניים. בבדיקה יש לזכור את זנב השד, המתארך לעבר בית השחי, וגם אותו יש לבדוק בקפדנות. במישוש מחפשים גוש, ואם קיים - יש לברר את גודלו, סמיכותו וגבולותיו. יש לבדוק האם הגוש נייד או מקובע. יש לבדוק האם קיימת הפרשה מהפטמה. בפטמה עצמה צריך לחפש קרעים, תופעות אקזמתיות, שקיעת הפטמה או הפרשה. לאחר מכן יש לבדוק את בלוטות הלימפה בבית השחי. בדיקה זו תעשה כאשר החולה בישיבה והיד בצד הנבדק מונחת בצורה חופשית על יד הבודק בזוית של כ-45%. יש לבדוק גם את הבלוטות הסופראקלויקולריות.
בלוטות הלימפה המוגדלות יכולות להיות בודדות, קטנות מ-0.5 ס"מ, ולרוב הן אינן חשודות מבחינה קלינית. בלוטות גדולות יותר, הדבוקות זו לזו, או דבוקות לעור או לבית השחי, הן חשודות ולרוב מבשרות על מצב מתקדם של המחלה. ב-30% מהחולות שבהן לא נמושו בלוטות לימפה, נמצאו גרורות בבדיקה היסטולוגית. לעומת זאת רק ב-85% מהחולות שנחשדו בבלוטות נגועות אכן נמצאו גרורות.
בדיקות עזר
בדיקות מעבדה
בדיקות העזר המעבדתיות הן מעטות וקשורות להתפשטות המחלה. עלייה ברמת הפוספטאזה הבסיסית מרמזת על פגיעה גרורתית בכבד ובעצמות. הסידן יכול להיות מוגבר בגלל גרורות בעצמות, או בצורה ראשונית ללא קשר לגרורות. בשתי קבוצות אלה הפרוגנוזה היא פחות טובה. עלייה בערכי האנטיגן הקרצינואמבריוני (Carcinoembryonic antigen, CEA) מצביעה על תהליך גרורתי, לעתים תת-קליני. עלייה ב- CA 15-3 יכולה להצביע על הישנות מקומית או גרורות. סמן זה הוא יותר ספציפי לשאתות השד.
סמנים
האנטיגן CA 15-3 הוא סמן המאופיין בסגוליות רבה לתאים ממאירים שמקורם בסרטן השד. אנטיגן זה הוא התמזגות של שני אנטיגנים: 115D8 ו-FD3. אנטיגן 115D8 מצוי בקרצינומות שונות של השד, אך אין ניתן למוצאו בלימפומות, במלנומות, בסמינומות, או בשאתות אחרות ממקור לא-אפיתלי. אנטיגן FD3 תואר כאנטיגן המאפיין התמיינות והוא ייחודי לתאי אפיתל השד. נגד שני האנטיגנים הללו פותחו נוגדנים חד-שבטיים. 15-3 CA יעיל במעקב אחר חולי סרטן והטיפול שניתן להם, ונותן מידע לגבי תגובתם לסוגי הטיפול השונים. כמו-כן ניתן להפיק ממנו מידע מוקדם לגבי התפתחות גרורות כ-4-9 חודשים לפני הופעת סימנים קליניים. כיום ניתן לערוך בדיקת 15-3 CA גם ברקמות, וזאת על-ידי בדיקת צביעת הרקמה בנוגדן של האנטיגן 15-3 CA הנקשר לאותם חלקים ברקמה המפרישים אותו. אנטיגן נוסף המאפיין קרצינומות של השד הוא MCA (Mucine-like carcinoma associated antigen). רמתו בנסיוב עולה עם התפשטות המחלה. בהשוואה של רמת MCA לערכי CA 15-3 ניתן למצוא מתאם בערכים.
צילום חזה
צילומי חזה מבוצעים לשלילת גרורות בריאות.
מיפויים
מיפוי כבד ועצמות מבוצע במטרה לגלות גרורות באיברים אלה.
כיום אולטרה-סאונד של הכבד היא בדיקת הבחירה לבירור ליקויים בכבד בחולות א-תסמיניות, שלהן בדיקות מעבדה תקינות והן בשלב I או II. בפחות מ-3% מהחולות ניתן למצוא ממצאים חיוביים באולטרה-סאונד או במיפויים. בהרבה מרכזים חדלו לבצע בדיקות אולטרה-סאונד של הכבד ומיפוי עצמות בחולות מדרגה II- I עקב יחס העלות/תועלת הגבוה של בדיקות אלה.
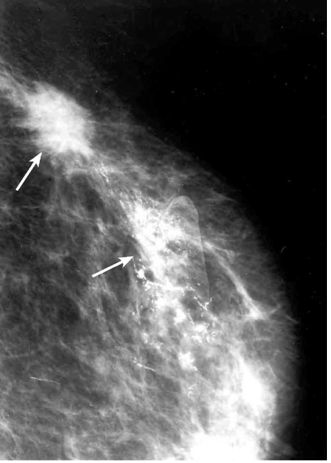
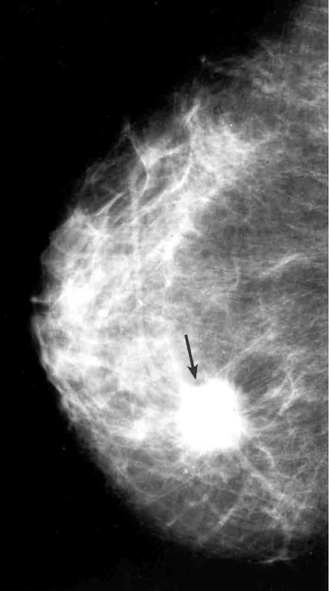
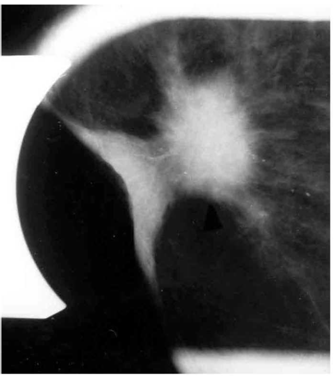
ממוגרפיה
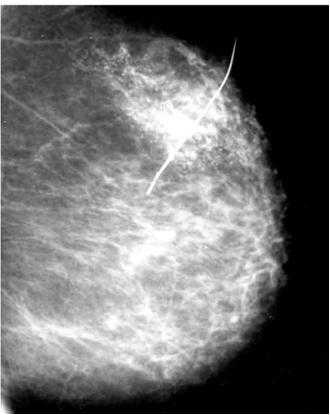
הבדיקה החשובה ביותר לגילוי מוקדם של שאתות השד היא הממוגרפיה. בבדיקה זו ניתן להדגים את רקמת השד, סמיכות הרקמה, הסתיידויות, עובי העור, צורתו וצל כלי הדם. צל בעל סמיכות יתר המכיל בתוכו מיקרוקלסיפיקציות במספר רב, בעל גבולות בלתי סדירים, כמו קרניים, עם זנב של רקמה סמיכה היוצאת ממנו, ריבוי והדגשה של כלי הדם או התעבות העור ושקיעת הפטמה, כולם מהווים סימנים מחשידים לקיום שאת ממארת בשד (תצלומים 22.12, 23.12). בהגדלה ניתן לראות את הסימנים לממאירות בצורה ברורה יותר (תצלום 24.12).
היעד העיקרי של הממוגרפיה הוא אבחון ממאירות בשד בשלב מוקדם ככל האפשר, כאשר השאת עודנה קטנה. תודות ליכולת זו של הממוגרפיה ובמקביל למודעות הגוברת והולכת לגילוי סרטן שד על-ידי ממוגרפיה בשלב מוקדם, כשעדיין לא ניתן למשש את השאת, גדל והולך השימוש בסימון השאת שלא ניתנת למישוש על-ידי חוט מתכת המוחדר לשד בהכוונה של הממוגרפיה.
בד בבד עם גילוי נגעים שאינם ניתנים למישוש, עולה הדרישה מצד המנתחים לגבש שיטה לסימון נגעים אלה. השיטה המקובלת מתבססת על סימון בתיל מתכתי. קיימים סוגים שונים של הרכבי מחט-חוט וכולם מבוססים על אותו העיקרון (ראה פרק מיקום נגעים סמויים).
הסיבות אשר בעטיין נגע מסוים איננו ניתן למישוש הן: שאת קטנה, שאת המתבטאת רק בהסתיידויות זעירות ללא גוש (תצלום 25.12), שד גדול או מגורגר המקשה על הבדיקה הקלינית. הממוגרפיה, למרות יכולתה לגלות נגעים בלתי ניתנים למישוש, איננה בדיקה חד-משמעית וסגוליותה נמוכה. מחד גיסא, גוש סמיך בעל שוליים בלתי סדירים, עם הקרנת קוריות לסביבה מעיד בביטחון על תהליך ממאיר. מאידך גיסא, הסתיידויות גסות, הסתיידויות כיסתיות או הסתיידויות פסיות סדירות וכן נגעים בעלי סמיכות דומה לזו של שומן, מצביעים על תהליך שפיר.
מצויה שורה של ממצאים רנטגניים הנוגעים לפי הספרות לקבוצה שבה קיימת חפיפה בין סימני ממאירות לבין סימני שפירות. אלה כוללים: הסתיידויות זעירות, בלתי סדירות, המסודרות בקבוצות, או שמספרן הוא גדול מ-20, גוש שאיננו מוגדר דיו, שינוי מקומי במהלך קוריות השד, א-סימטריה בהופעת רקמת השד וממצא שנתגלה בין ביצוע ממוגרפיה אחת לזו שאחריה.
לפי הספרות, שיעור הביופסיות, שבהן מאובחנת ממאירות בנגעים שאינם ניתנים למישוש, נע בין 10% ל-30%, דבר המצביע על הקושי האבחנתי. אחוז זה איננו שונה מתוצאות הביופסיות המבוצעות בנגעים נמושים.
השאיפה היא שאחוז הביופסיות החיוביות יהיה גדול יותר, הווה אומר, להעלות את דיוק האבחון הטרום-ניתוחי בין נגע ממאיר לשפיר גם בנגעים שאינם ניתנים למישוש, וזאת כדי למנוע סבל מיותר מהחולות, ולהקטין את העומס וההוצאות במערכת הבריאות.
מתוך שאיפה זו דווח על סגוליותם של הסימנים הרנטגניים, המחשידים לממאירות. הסימנים הפחות סגוליים הם א-סימטריה ברקמת השד ושינוי במהלך קוריות השד. ייתכן שגילוי סימנים אלה, ללא סימנים אחרים, מצדיק רק מעקב זהיר וצמוד. הסתייגות אחת קיימת לגבי סוג נדיר של סרטן השד - Intralobular carcinoma - אשר די בשילוב שני סימנים אלה בלבד בכדי להעלות חשד לקיומו.
מיקום נגעים סמויים בשד באמצעות מחט עדינה (FNLB - Fine needle localization biopsy)
השימוש הנפוץ בממוגרפיה כחלק משגרת המעקב מאפשר גילוי מקרים סמויים של סרטן השד שאינם ניתנים למישוש. אין ספק, שהממוגרפיה המודרנית היא השיטה היעילה ביותר לגילוי מוקדם של סרטן השד. איתור מחלה זו בשלביה המוקדמים ובממדים תת- קליניים הפחית את התמותה ממחלה זו.
ממליצים על ביצוע ממוגרפיה אחת לשנה או שנתיים החל מגיל 50 שנה ואילך; ובנשים עם גורם סיכון להתפתחות סרטן השד, כמו תולדות משפחה, שאת ממאירה בשד שני, שד דחוס (פיברוכיסתי), וכן נגע הטעון מעקב - יש לבצע ממוגרפיה אחת לשנה. במקרים של ספק, דרוש ביצוע ממוגרפיה לעתים תכופות יותר (אחת לחצי שנה).
מרבית השאתות הממאירות המתגלות באמצעות ה-Screening mammography, הן מדרגה I, לעומת הבדיקה הקלינית, המאבחנת לרוב שאתות בשלבים מתקדמים יותר. הישג זה ראוי לציון, מאחר שניתוח בשלב ראשוני, משפר את תוחלת החיים. מקובל כיום, שממצאים ממוגרפיים החשודים לשאת ממאירה, מהווים הוריה לביופסיה. ואמנם כ-30%-20% מהם מוכחים כממאירים בבדיקה הפתולוגית.
ההוריות לביצוע ביופסיית נגעים בשד השתנו בשנים האחרונות בעקבות הגילוי המוקדם של ממצאים תת-קליניים בממוגרפיה. במקרים אלה ההוריות לביופסיה הן: מיקרו-הסתיידויות ב-42% מהחולות, נוכחות גוש בשד - ב-23% מהחולות, ושילוב שתי הסיבות גם יחד - ב-19% מהחולות. העלמות המרקם התקין של השד והרחבת צינור חלב בודד, היוו הוריה לביופסיה ב-16% מהחולות.
מאחר שמרבית השאתות הממאירות המתגלות בממוגרפיה בשלביהן הראשונים אינן ניתנות למישוש, קיים צורך במיקום מדויק של הנגע כדי להדריך את המנתח בביצוע הביופסיה. שיתוף פעולה בין רדיולוג, מנתח ופתולוג, מאפשר כריתת הנגע בשלמותו עם שוליים בריאים ונזק אסתטי מיזערי. מיקום טרום-ניתוחי של הנגע ברקמת השד מונע לרוב את הצורך בניתוחים נוספים.
בעבר, נהוג היה במרכזים רבים לטפל בנגע שאינו ניתן למישוש בביופסיה של רקמת השד בשיטה העיוורת. הניתוח כולל כריתה מורחבת של האזור החשוד (Lumpectomy), עד כדי כריתת רבע מרקמת השד (Quadrantectomy). מאחר שלעתים קרובות אין הביופסיה כוללת את הממצא החשוד בממוגרפיה, קיים צורך בניתוחים חוזרים. כדי לוודא, שאמנם רקמת הביופסיה כוללת את הנגע החשוד, יש לצלמו בממוגרף בזמן הניתוח.
הדרך היעילה ביותר למיקום טרום-ניתוחי של נגע סמוי בשד היא באמצעות מחט (Needle localization). תוארו שיטות שונות, שלכולן עיקרון זהה ויעילותן דומה. השיטה נבחרת בהתאם למיקום הנגע, למכשור ולנוחות הרופא המנתח.
שיטות המיקום באמצעות המחט
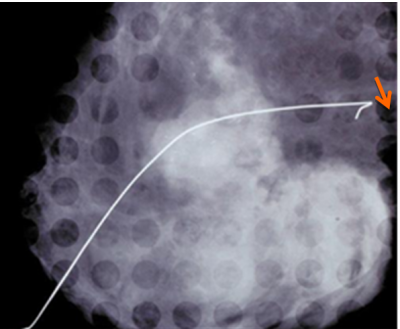
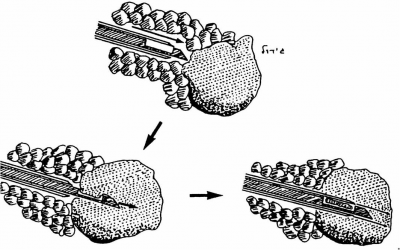
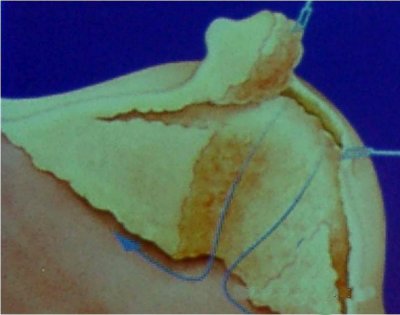
לאחר ביצוע צילומי ממוגרפיה בתנוחות קרניו-קאודלית וצדדית אמיתית, ממקמים את הנגע החשוד באמצעות פלטה עם חורים מרובים, שדרכם ניתן לראות את הנגע (תצלום 26.12).
לאחר החדרת המחט לחור שבו נראה הנגע, מבצעים צילומי ממוגרפיה חוזרים כדי לוודא את מיקום המחט (תצלום 27.12).
לתוך המחט מכניסים חוט מתכתי בעל וו בקצהו, וזה נתפס ברקמת השד. מוציאים את המחט ומקבעים את חוט המתכת אל דופן בית החזה עד למועד הניתוח (תמונה 26.12).
כיום מקובל להכניס מספר סימונים על ידי תיל לסימון מרחב הנגע בשד ולא רק את מרכזו, ובכך להגדיל את הסיכוי להוציאו בשלמותו. לאחר הביופסיה מבצעים צילומי ממוגרפיה של רקמת השד שהוצאה, ומוודאים שהנגע אכן הוצא בשלמותו (תצלום 28.12).
כריתה בלתי שלמה מחייבת כריתת שוליים רחבים יותר של רקמת השד להשלמת הניתוח. רצוי לבצע צילום רנטגני של התכשיר כשהחולה עדיין בחדר הניתוחים, כדי להימנע מניתוח חוזר במועד מאוחר יותר.
שיטה שיטה אחרת לסימון הנגע היא Stereotactic needle localization, שפותחה על-ידי Bolmgren וחבריו בשטוקהולם ב-1977. שיטה זו מאפשרת החדרה מדויקת יותר של המחט, ואם יש צורך גם ביצוע שאיבת קטע מרקמת השאת לבדיקה ציטולוגית.
העיקרון הסטראוטקטי הוא לצלם את השד בשני מישורים, הקבועים בזווית של 30 מעלות זה מזה, מה שמאפשר מיקום תלת-ממדי של הנגע בשד (תצלום 29.12). משתדלים למקם את השפופרת כך, שהמרחק עור-מטרה יהיה הקצר ביותר להחדרת המחט. מטרת מכשיר זה היא להשיג דיוק של עד 1 מ"מ במיקום הנגע.
הסיבוכים והשפעות הלוואי של מיקום נגע בשד באמצעות מחט הם נדירים וכוללים:
- תגובה ואזו-ואגלית, לעתים עד כדי עילפון.
- היארעות דמומות (המטומות) שטחיות ועמוקות.
- הרגשת חולשה, כאבי ראש קלים וסחרחורת.
- זיהום שטחי והתפתחות מורסה בשד.
- צלקת קטנה בולטת היפרטרופית.
ממצאים פתולוגיים
שיעור הנגעים שמוקמו ונמצאו ממאירים הוא 50%-20% בסדרות שונות. 80%-50% מהנגעים - היו שפירים, 0.5% - הראו ממצא פתולוגי בלתי ברור. מתוך הנגעים הממאירים - היוו 66% Carcinoma in situ ו-34% - Invasive carcinoma. הסיכוי לכלול בביופסיה נגע שקוטרו קטן מ- 1 ס"מ גדול יותר, אם המיקום הטרום-ניתוחי נעשה באמצעות מחט.
מיקום
שיעור ההצלחה במיקום טרום-ניתוחי של הנגע החשוד באמצעות מחט קרוב ל-100%. בשיטה הסטראוטקטית ניתן למקם את המחט במרחק של עד 2 מ"מ מהנגע החשוד ב-96% מהחולות ועד 1 מ"מ ב-76% מהחולות.
הצורך בביופסיות חוזרות עקב כריתה בלתי שלמה של הנגע נע בעבודות שונות בין 1.6% ל-8.8% מהחולות.
בעבר רק 5% מהביופסיות נעשו עקב ממצאים ממוגרפיים, שאינם באים לידי ביטוי קליני. כיום 30% ויותר מהביופסיות נעשות בעקבות ממצא רנטגני, המחייב מיקום באמצעות מחט. הבדל זה נובע מביצוע תדיר של ממוגרפיה כחלק ממעקב שגרתי, תוך שימוש במכשור משוכלל ובעל רזולוציה טובה יותר.
יחס השאתות השפירות לשאתות ממאירות לפי צילומי הממוגרפיה הוא 2.4 ל-1, בעוד שבבדיקה הקלינית הוא 5 ל-1. כלומר, על כל שאת ממאירה מבצעים 5 ביופסיות של שאתות שפירות. לכן, שימוש מוגבר בממוגרפיה יכול להפחית למחצית את מספר הביופסיות.
ממוגרפיה אבחנתית
ההוראות לביצוע ממוגרפיה אבחנתית הן:
- ביסוס חשד לקיום שאת ממארת בשד הנבדק, או לשלול את קיומה.
- גילוי מוקדים נוספים שלא מוששו ידנית.
- אבחון שאת בשד השני.
- בדיקת שדיים שממדיהם גדולים.
- הערכה של התקשויות (Thickening) בנשים בנות 53 שנים ומעלה.
- ביצוע ממוגרפיה אצל נשים בעלות קשריות לימפה מוגדלות בבית השחי, או לשם חיפוש אחר השאת הראשונית במקרים של גרורות משאת באזור אחר בגוף.
- כל אישה מבת 35 שנה ומעלה העוברת ניתוח בשד, חייבת לעבור קודם כל ממוגרפיה. בנשים צעירות יותר בעלות שאת שפירה, כמו פיברואדנומה, אין לערוך צילום.
מטרת הממוגרפיה האבחנתית היא לזהות בצורה מדויקת יותר את הנגע הקיים. אם לאחר ביצוע הממוגרפיה מתגלה ממצא חריג יש לברר את טבעו. ניתן לעשות בירור זה בדרכים שונות: הגדלה של האזור הנגוע על מנת לראות בצורה מדויקת יותר את הנגע, ביצוע צילומי דחיסה (קומפרסיה), "פתיחת" סמיכויות רקמתיות על-ידי לחץ או ביצוע צילומים בזוויות אחרות, כמו צילום לטרלי אמיתי ולא אלכסוני וכו'. אם לאחר בירור זה עדיין נשאר ספק לגבי שפירות הנגע יש לבצע ביופסיה של הנגע.
שיטה אחרת לבירור נגע כזה, שאינו ניתן למישוש, היא ביצוע ביופסיה מחטית (FNA או Core biopsy) המכוון על-ידי ממוגרפיה. בעזרת מכשיר סטראוטקטי המחשב את מיקום הנגע בשד מחדירים מחט לנגע ודרכה שואבים חומר לבדיקה ציטולוגית פתולוגית.
בממוגרפיה שיעור False negative הוא 4.7%. 30% מהחולות, שבהן נמצאו שאתות ממאירות בממוגרפיה, לא אובחנו קלינית.
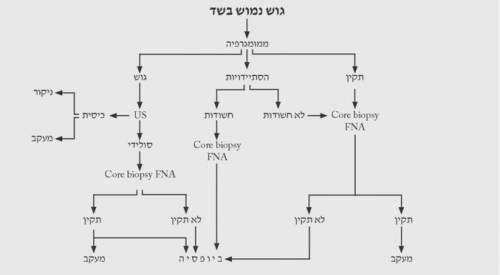
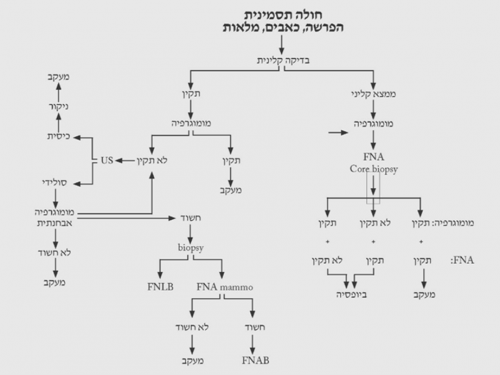
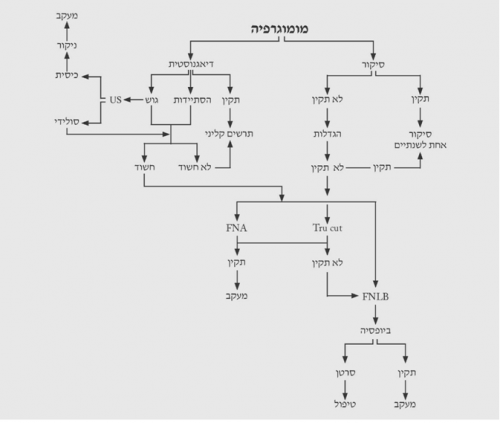
הגישה לבירור גוש בשד
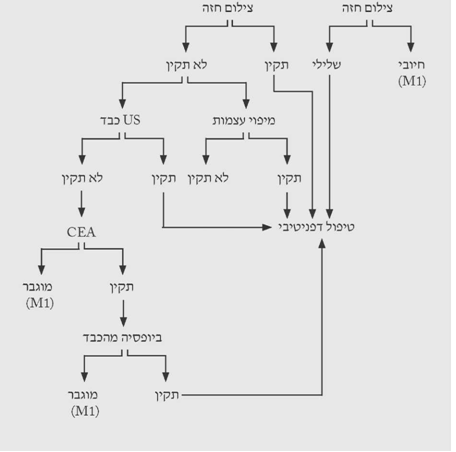
הגישה לבירור ממצאים בשד מסוכמת בתרשימים 2.12 – 5.12.
ביופסיית שד
ההוראות לביצוע ביופסיה בשד הן:
- גוש קבוע בשד.
- הפרשה דמית מהפטמה.
- תופעות אקזמתיות בפטמה.
- נגע חשוד בממוגרפיה.
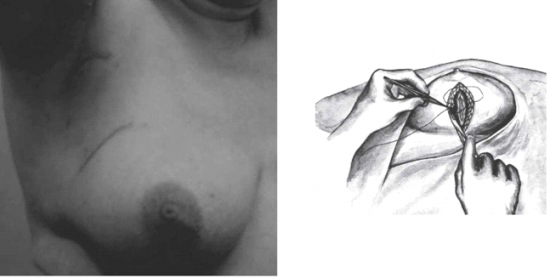
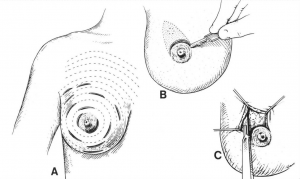
האבחנה הסופית נקבעת על-ידי ביופסיה של הגוש. הביופסיה יכולה להיות:
- פתוחה (בניתוח), בהרדמה כללית או מקומית (איור 15.12).
|
|
- ביופסיה עם מחט עבה, על-ידי Tru-cut needle (Core needle) – (איור 16.12). החומר הנלקח הוא רקמת שד על מרכיביה ולכן התשובה היא פתולוגיה של הרקמה (תמונה 27.12).
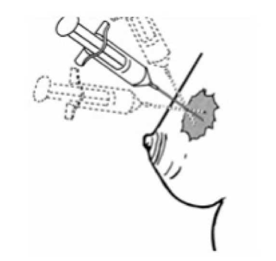
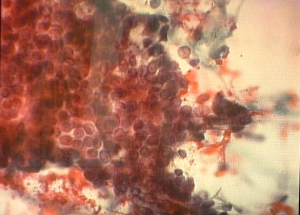
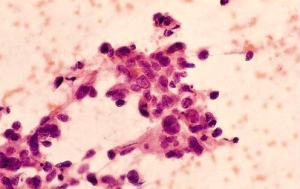
- שאיבה במחט עדינה (FNA, Fine-needle aspiration biopsy) - היא בדיקה שבה מבצעים שאיבה של תאים מהגוש בעזרת מחט עדינה (איור 17.12) ובודקים בציטולוגיה את סוג התאים שנשאבו (תמונה 30.12).
|
|
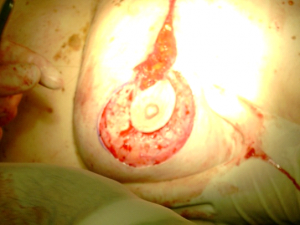
ביופסיה במחט עבה: בביופסיה זו משתמשים במחט מיוחדת (איור 16.12) המורכבת משתי מחטים, האחת בתוך השנייה. המחט הפנימית היא מחט בעלת חוד שבהמשכה קיימת מגרעת, והמחט החיצונית הנעה על המחט הפנימית מסתיימת בקצה בחלק מושחז כסכין. המחט על שתי מרכיביה מוחדרת עד הנגע. בשלב זה, המחט הפנימית נדחפת לתוך הנגע ומכיוון שרקמות הן בדרך כלל אלסטיות, קטע מרקמת הנגע ממלא את המגרעת במחט הפנימית. בשלב הבא המחט החיצונית נדחפת וחותכת אל הרקמה אשר מילאה את המגרעת במחט הפנימית. המחט כולה מוצאת כאשר בתוכה גליל רקמה שנשלח לבדיקה פתולוגית. כיום, כל סדר הפעולות הזה אינו מבוצע ידנית אלא באמצעות מכשיר מיוחד הנקרא "אקדח" ביופסיות, המבצע את פעולת החדרה המחט לנגע והחיתוך באופן אוטומטי. ככל שקוטר המחט גדול יותר, ומספר הגלילים הנלקח גדול יותר, אמינות הבדיקה גבוהה יותר. מספר עבודות הראו התאמה של 80% ל-97% בין הבדיקות של הגלילים לביופסיה הכירורגית. האמינות הגבוה יותר מדווחת כאשר בהכוונת מחט הביופסיה נעזרו ב- US או בממוגרפיה. במידה ולא ניתן למשש את הנגע, אפשר להיעזר בהכוונת ה-US או הממוגרפיה (ממוטומיה או ביופסיה סטריאוטקטית) כדי להביא את מחט הביופסיה לנגע. פרטי הטכניקה מתוארים בפרק הקודם. את החומר המוצא בממוטומיה מצלמים כדי להוכיח שאכן הוא מכיל את ההסתיידויות שרצינו לדגום (תצלום 31.12).
FNA (Fine needle aspiration): Martin & Ellis היו הראשונים ב-1934 שדיווחו על ה-FNA כשיטה לאבחון סרטן השד. בעבודתם הם מדווחים על 1,405 חולים שאובחנו בשיטה זו. מאז עברו כ-50 שנה עד ששיטה זו הפכה למקובלת באבחון הציטולוגי של סרטן השד (איור 12.7A).
Zajicek ב-1979 סיכם מספר עבודות הכוללות 8,641 אספירציות בחולות הלוקות בסרטן השד. התוצאות היו False positive ב-0.9% מהבדיקות, ו- False negative - ב-11.2%.
Wanebo ב-1984 מדווח על 398 אספירציות שביצע בחולות בעלות גוש בשד. הוא מדווח שב-93 חולות עם ציטולוגיה חיובית נמצאה קרצינומה בחתך בפרפין. בחולה אחת שבה האבחנה היתה של שאת שפירה נמצאה שאת ממארת. בקבוצה שנחשדה בממאירות נמצאה שאת ממארת במחצית מהחולות. מסקנתם היא שכאשר הממצא הוא של שאת ממארת ניתן לקבל את התשובה כסופית, אך לעומת זאת כאשר התשובה היא שלילית ויש גוש בשד יש צורך בביופסיה מחטית או פתוחה.
Eisenberger ב-1983 סוקר 1942 בדיקות FNA ומסקנתו החד-משמעית היא, שבדיקה זו היא בעלת אמינות גבוהה, כאשר התשובה היא חיובית. אין לקבל תשובה שלילית כתשובה סופית, ויש לבצע בחולות אלה ביופסיה מחטית או פתוחה בהתאם לשיקול הקליני.
Azzarelli ב-1983 מדווח על הניסיון של Milan tumor institute ב-1138 נשים. הבדיקה הקלינית היתה בעלת רגישות באבחון גוש בשד ב-96% מהנשים, הממוגרפיה ב-84% מהנשים, אולם שתי הבדיקות היו קשורות בסגוליות נמוכה (FP קליני - 20%, ממוגרפי - 18%). הרגישות של ה-FNA בעבודה זו היתה 97% אולם הספציפיות היתה ירודה - 65%. מסקנתם היא ששילוב של שלוש השיטות הללו הוא בעל הרגישות והסגוליות הגבוהה ביותר.
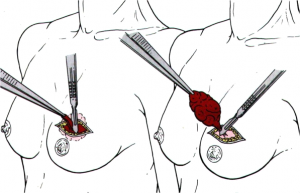
ביופסיה פתוחה: יש לבצע את הביופסיה הפתוחה תוך הקפדה על הוצאת הגוש בשלמותו - Excisional biopsy. רק במקרים שבהם משמעות הוצאת הגוש בשלמותו היא הוצאת מרבית רקמת השד, יש לבצע Incisional biopsy (הוצאת חלק מהרקמה הקשה בשד) במקום החשוד. את החתך בעור יש לעשות בסמוך לקו שבו העטרה מתחברת לעור, שם הצלקת כמעט אינה נראית ואינה מורגשת, או בקווים היקפיים (צירקולטורים) סביב השד - Langer's lines (איור 15.12). האבחנה של התכשיר מביופסיה של השד יכולה להתבצע על-ידי חתך קפוא וקבלת תשובה מיידית, או על-ידי חתך בפרפין וקבלת תשובה תוך 48-24 שעות. האמינות של החתך בפרפין היא גבוהה מאוד. האמינות של החתך הקפוא היא גבוהה. שכיחות של False negative בחתך קפוא היא 2% ואילו False positive היא נדירה ביותר.
הגישה המקובלת כיום היא לבצע ביופסיה מחטית לקבלת האבחנה. רק בחולות שבהן האבחנה אינה חד משמעית, או שהממצא נמצא חשוד בבדיקה קלינית או בממוגרפיה והביופסיה המחטית אבחנה ממצא שפיר, צריך לבצע ביופסיה כירורגית. הדיווחים בספרות מראים ירידה של 80%-75% במספר הביופסיות הפתוחות במרכזי שד שונים בעולם.
אבחנה מבדלת
האבחנה המבדלת העיקרית היא בין שאתות ממאירות של השד לבין שאתות שפירות, אשר נסקרו בתחילת הערך.
קביעת שלב השאתות הממאירות בשד
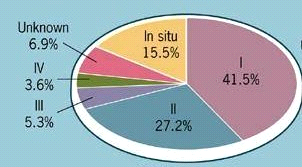
קביעת שלב הקרצינומה של השד (Stage)
מקובל לקבוע את שלב שאתות השד לפי שיטת ה-TMN :
ה-T מבטאת את גודל השאת, וסימוניה השונים הם:
- T1 - כאשר השאת קטנה מ-2 ס"מ. תת חלוקה היא ל:
- T1a - עד 0.5 ס"מ.
- T1b - 1-0.5 ס"מ.
- T1c - 2-1 ס"מ.
- T2 - גודל השאת 5-2 ס"מ עם תת חלוקה זהה לקודמת.
- T3 - גודל השאת 5 ס"מ ויותר.
- T4 - שאת מגודל כלשהו, אך מתפשטת לעור. תת החלוקה היא ל:
- a - כאשר השאת דבוקה גם לשריר החזה (פקטורליס).
- b - כאשר יש בצקת בעור.
- c - כאשר תופעות b- a קיימות.
- d - קרצינומה דלקתית (Inflammatory carcinoma).
- T0 - כאשר לא נמצאה השאת הראשונית בשד.
- Tx - כאשר אין הערכה של גודל השאת.
- Tis - במחלת פאג'ט של השד, Carcinoma in situ.
ה-N מבטאת נוכחות בלוטות לימפה בבית השחי.
- N0 - אין בלוטות נגועות.
- (-i)N0 - אין גרורות בצביעות רגילות ולא ב- IHC (אימונוהיסטוכימיה)
- (+i)N0 - אין גרורות בצביעות רגילות ויש ב- IHC
- N1 - הבלוטות שנמושו מוגדלות, ניידות באותו הצד.
- N1mic - גרורות בין 2-0.2 מ"מ
- N2 - הבלוטות שנמושו דבוקות זו לזו.
- N3 - גרורות בבלוטות לאורך ה-Internal mammary lymph node.
- Nx - לא נעשתה בדיקה של הבלוטות.
ה- M מבטאת נוכחות של גרורות.
- M0 - אין גרורות.
- M1 - גרורות מרוחקות.
- Mx - לא נעשתה הערכה.
השילוב בין המשתנים השונים הוא קביעת השלב המוצגת בטבלה 3.12.
קביעת שלב השאת יכולה להיות קלינית או פתולוגית. קביעת השלב הקלינית היא הערכת גודל השאת, נגיעות הבלוטות באופן קליני וסיווג השאת לפי ה-TMN. קביעת השלב הפתולוגית של ה-TMN נקבעת לפי הממצאים הפתולוגיים והיא קביעת השלב המדויקת. ההתאמה בין שני הדירוגים הללו אינה טובה ולא ניתן להסתמך על קביעת השלב הקלינית אלא לשם הערכה ראשונית של סוג הטיפול האפשרי.
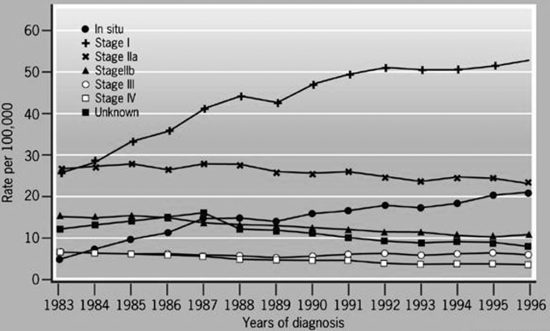
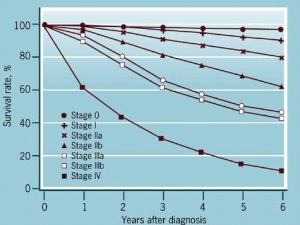
יש לציין שכתוצאה מהכנסת תוכניות הסיקור לסל שרותי הבריאות במדינות המערב, עלה שיעור החולות המאובחנות בשלבים מוקדמים עם השנים (גרף 4.12)
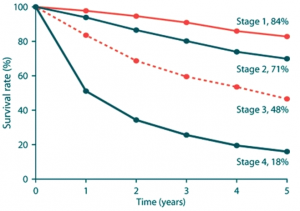
היוותרות בחיים
שיעור ההיוותרות בחיים הוא בהתאם לשלב המחלה. בשלב 1 שיעור היוותרות בחיים ל-5 שנים הוא 85% (94%-82%), בשלב 2 - 66% (74%-47%), בשלב 3 - 41% ובשלב 4 - 10%. כאשר בלוטות הלימפה אינן מעורבות בתהליך (שליליות) שיעור ההיוותרות בחיים ל-10 שנים הוא 65% וכאשר הבלוטות נגועות (חיוביות) הוא 25%. כאשר 3-1 בלוטות נגועות - שיעור ההיוותרות בחיים הוא 37% וכאשר יותר מ-4 בלוטות נגועות - 13% (גרף 5.12).
|
|
גרורות בבלוטות הלימפה
עיקר הגרורות מתפשטות לבית-השחי (אקסילה). גרורות לבלוטות מרוחקות יותר נשלחות רק לאחר שהבלוטות האקסילריות נגועות. נגיעות בבלוטות הסופראקלויקולריות מצביעה על מחלה סיסטמית, ולכן אין טעם בטיפול מקומי. כאשר הבלוטות נגועות הפרוגנוזה גרועה יותר.
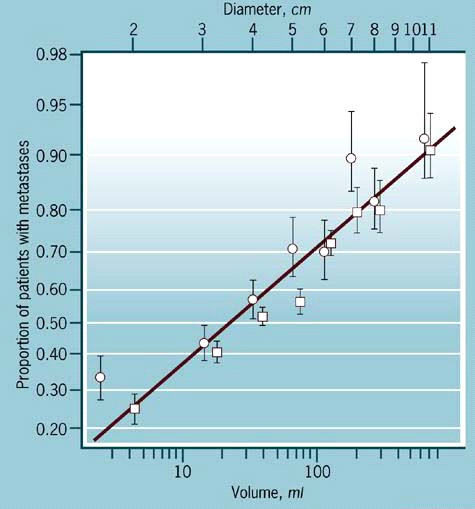
קיום גרורות בבלוטות האקסילריות אינו קשור לקיום גרורות בבלוטות של שרשרת ה-Internal mammary. שאתות מכל הרביעים שולחות גרורות לבלוטות האקסילריות, ואילו שאתות בחלק המדיאלי שולחות גרורות גם ל-Internal mammary. בלוטות קשות וגדולות יותר מ-5 מ"מ לרוב מכילות גרורות. יש לזכור כי אצל 30% מהחולות שעברו בדיקה קלינית של הבלוטות ולא נמצאו בלוטות מוגדלות -נמצאו אחר כך גרורות במיקרוסקופיה. מאידך, אצל 15% מהחולות שעברו בדיקה זו ונמצאו בלוטות מוגדלות - לא נמצאו אחר כך גרורות. כאשר גודל השאתות היה קטן מ-1 ס"מ נמצאו גרורות ב-22% מהחולות, ואילו כאשר היו שאתות גדולות מ-5 ס"מ, נמצאו בלוטות נגועות ב-60% מהחולות.
יש גם התאמה בין מספר הבלוטות הנגועות לבין גודל השאת. חשיבות רבה יש גם למיקום הבלוטות. התחזית משתנה אם הבלוטות הנגועות מוגבלות רק לשרשרת של Internal mammery ולבית השחי, או שנמצאו גם בלוטות סובקלויקולריות נגועות. שיעור ההיוותרות בחיים ל-5 שנים יורד מ-65% ל-28% בהתאמה. ככל שהשאת גדולה יותר, כך אחוז החולות בעלות גרורות שהתפשטו ל- Internal mammary הוא גדול יותר. כאשר אין גרורות בבלוטות האקסילריות ניתן למצוא גרורות ב- Internal mammary אצל 22%-0% מהחולות, תלוי במיקום השאת, ואילו כאשר הבלוטות האקסילריות נגועות והשאת היא פנימית, ניתן למצוא גרורות ב-Internal mammary אצל 67%-33% מהחולות. ב-27% מהחולות בעלות שאתות פולשניות (Invasive), שנתגלו בממוגרפיה סוקרת ולא נמושו קלינית, נמצאו גרורות בבלוטות הלימפה.
נמצא קשר ישיר בין גודל השאת עם או ללא נוכחות של בלוטות מעורבות (טבלה 6.12).
ה-National survey of cancer of the breast in the U.S.A דיווח על סקר שנכללו בו 27,000 נשים שהיו במעקב ארוך ו-20,000 נשים שהיו במעקב קצר, ובו נמצא כי שיעור ההיוותרות בחיים ל-5 שנים של חולות סרטן השד ללא בלוטות נגועות היה 92%, כאשר בלוטה אחת היתה נגועה - 82%, 3 בלוטות נגועות - 77%, 5 בלוטות נגועות ויותר - 60%, ואילו בחולות בעלות 20 בלוטות נגועות ויותר - 39%. תוצאות דומות נתקבלו גם בסקר של ה- NSABP (National surgery adjuvant brease project).
בבדיקת השכיחות של נגיעות בלוטות הלימפה באזורים השונים של בית השחי, נמצא כי 95% מהבלוטות הנגועות היו שייכות לאזור 1 (Level I), כלומר מתחת לגבול הלטרלי של הפקטורליס הקטן (איור 7.12). רק 5% מהבלוטות הנגועות היו שייכות לאזורים 2-3 (מתחת לשריר הפקטורליס הקטן או פנימית לו) ללא מעורבות של אזור 1, ולכן, אפשר להסתפק בסילוק הבלוטות מאזור זה על מנת להעריך את שלב המחלה.
נבדקה הרגישות של הבדיקה הידנית (בניתוח), בחיפוש אחר בלוטות נגועות ביחס לממצאים שהתקבלו לאחר המסת השומן ובדיקת כל הבלוטות שבפרפרט. נמצא שכאשר הבלוטות שנבדקו ידנית היו שליליות, אזי בכל החולות שנבדקו, הבלוטות שנמצאו לאחר מכן היו שליליות. לעומת זאת, כאשר הבלוטות שנבדקו במישוש ידני היו חיוביות, נמצאו אחר כך בכ-50% מהחולות בלוטות נוספות נגועות לאחר המסת השומן. לדעת המחברים ניקוי כל בית השחי משומן לאחר שהוצאו כל הבלוטות שניתן למששן אינו מוסיף מידע פרוגנוסטי.
הסיווג הפתולוגי (Grade)
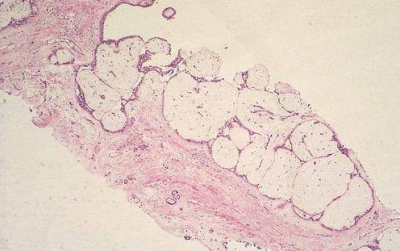
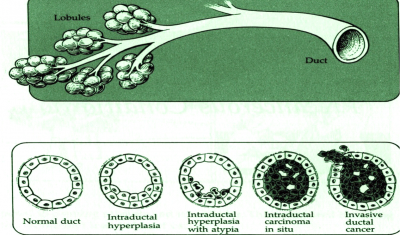
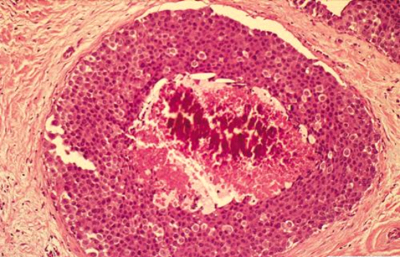
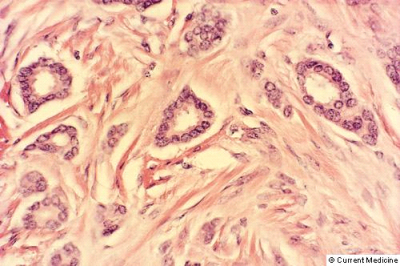
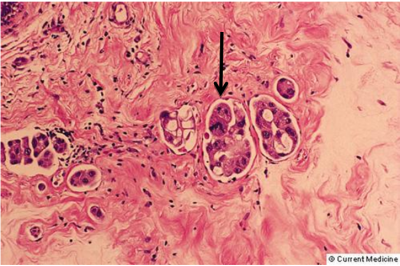
רוב השאתות הממאירות בשד מקורם בצינורות החלב ולכן הן נקראות (75%) Ductal carcinoma. מקור אחר לנגעים ממאירים בשד הן בועיות החלב הנקראות Lobular carcinoma (כ-20%-15%). שאר הנגעים מקורם ברקמת החיבור של השד וברקמה הלימפתית (סרקומות, לימפומות, לויקמיות ועוד). חלק ניכר מהשאתות האפיתליאליות בשד מתפתחות ב-Terminal ductal lobular unit (TDLU) (איור 18.12). צינוריות ובועיות החלב מכוסות באפיתל קובואידלי חד שכבתי היושב על ממברנה בזלית. בין הממברנה הבזלית לתאי האפיתל, נמצא את התאים המיואפיתליאלים המכווצים את צינורית החלב ובועית החלב ומאפשרים לחלב לזרום לכוון הפטמה. שכבת התאים הזו היא דינמית, כלומר התאים בה מתחלפים כל הזמן. תאים ישנים עוברים תהליך של מוות (אפופטוזיס) ואחרים מחליפים אותם, כך שבכל רגע נתון נמצא שכבה אחת של תאים. כאשר חל שיבוש בתהליך, עקב שינויים גנטיים כנראה, תהליך האפופטוזיס מעוכב או תהליך צמיחת התאים מזורז, יופיעו בחתך הסטולוגי של ה-TDLU יותר משכבת אחת של תאים אפיתליאליים - Ductal hyperplasia. התאים בתהליך היפרפלסטי זה תקינים. במידה והתהליך הזה מתקדם, נמצא גם שינוי בתאי האפיתל עם שינוי בגודל ויותר חלוקות, שלב הנקרא Atypical ductal hyperplasia (ADH). שלב זה הוא קדם סרטני ושכיחות הופעת סרטן השד בקבוצה עם ADH היא עד פי 4 מהאוכלוסיה הכללית (תמונה 28.12).
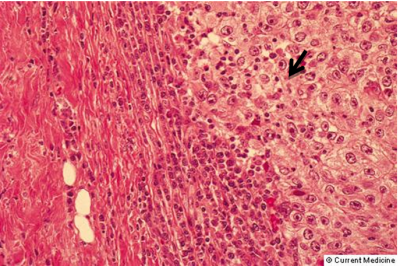
תהליך זה המתקדם וממלא את כל צינורית החלב ובו זמנית מאבד את התאים המיואפיתליאלים שלו, הופך להיות Ductal carcinoma in situ (DCIS) (תמונה 29.12) או בבועית החלב Lobular carcinoma in situ (LCIS)(תמונה 30.12).
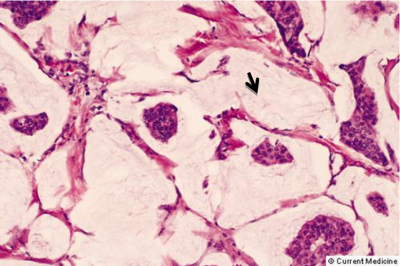
ה- DCIS היא השאת הממארת הכי מוקדמת שניתן לגלות כיום. היא מתאפיינת בהיותה מחלה מקומית של השד אשר נדיר כי מערבת בלוטות או שולחת גרורות. לכן הטיפול במחלה זו הוא מקומי. במידה והנגע הזה נשאר, כ-30% יפתחו את הצורה התוקפנית יותר של סרטן השד והיא ה- Invasive carcinoma (IC). בנגעים אלה, מתפתחות קבוצות (קלון) של תאים בעלי יכולת לפרוץ מחוץ לצינורית החלב אל השומן מסביב ולשרוד שם (תמונה 31.12 -33.12).
תאים אלה יכולים לנדוד גם לבלוטות הלימפה או להיהפך לגרורות באיברים אחרים. למעשה, המעבר מ-DCIS ל-IC הוא מעבר ממחלה מקומית למחלה אזורית-מערכתית. ב-70% מהחולות המאובחנות בשלבים מוקדמים (Stage I, II) המחלה היא מקומית-איזורית, ואילו ל-30% יש מחלה מערכתית. החלוקה של סוגי השאתות השונות לפולשנית/ לא פולשנית והדרגה מוצגת בגרף 7.12:
קבוצת ה-IC היא הטרוגנית ומכילה סוגים שונים של גידולים שמקורם אפיתליאלי . הקבוצות השכיחות הן:
- Infiltrating ductal carcinoma (IDC): השכיח מבין שאתות השד (75%) (איור 29.12). מאופיין במבנים דוקטלים מלאים בתאי אפיתל גדולים יחסית ברמות מיון (דיפרנציאציה) שונות. גרעינים גדולים לעיתים מרובים. 90% מהמרכיב הוא דוקטלי. בדך כלל נמוש כגוש קשה ולכן נקרא לפעמים "Scirrhous carcinoma". נוטה להתפשט לעצמות ריאות וכבד.
- Tubular carcinoma: שכיחה בכ- 5% מכלל סרטני השד. מורכב ממבנים דוקטלים סדורים היטב מצופים בתאים בשכבה אחת גרעינים עם שינויים קלים. מוגדר כטובולר קרצינומה במידה ו- 75% מהמרכיב הוא טובולרי. במידה ופחות מדובר ב-IDC עם מרכיב טובולרי. מתגלה בעיקר בממוגרפיה ואינו נוטה לשלוח גרורות (תמונה 34.12).
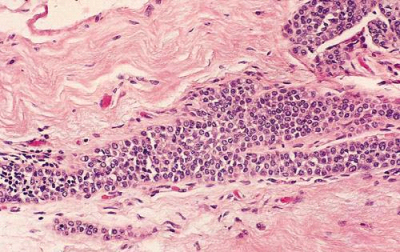
- Medullary carcinoma: שכיחה בכ-5% מכלל סרטני השד. שכיחה יותר בקרב חולות צעירות. מאופיינת ע"י שדות של תאי גידול עם גרעינים בעלי דיפרנציאציה נמוכה, תסנין לימפוציטרי, תאי פלסמה, מוגבל היטב ולרוב לא רואים בסמיכות DCIS. לרוב הקולטנים שליליים והיא מצויה אצל נשאיות BRCA1. היא נוטה פחות להתפשט מה-IDC ובעלת פרוגנוזה טובה יותר (תמונה 35.12).
- Mucinous carcinoma: שכיחה ב- 3% מחולות סרטן השד. מאופינת בצבירה של מוצין בכמות מחוץ לתאים סביב קבוצות תאים. השאת גדלה לאט והפרוגנוזה טובה (תמונה 36.12).
- שאת פפילרית (Papillary carcinoma): מהווה 1-2% מכלל השאתות הממאירות בשד. שכיחה יותר בנשים מבוגרות . בפתולוגיה נראה מבנה של אצבעות הבולטות לתוך נהור הצינורית עם חסר של תאי המיואפיתל. לרוב רב מוקדי והפרוגנוזה טובה.
- שאת לובולרית פולשנית (ILC): מהווה כ- 10% משאתות השד. מתחלקת לתת קבוצות - 1-Solid, 2- Alveolar, 3- Pleomorphic. האחרונה היא בעלת פרוגנוזה לא טובה. קשה קלינית לאבחן שאתות אלה. הן מופיעות יותר כמלאות בשד ללא גוש מוגדר. גם בממוגרפיה קשה לראותן ולכן במקרים אלה ה- MRI יכול אף הוא לעזור. השאת נוטה להיות רב מוקדית באותו השד ושכיחה אף בשד השני. 90% מופיעים עם לובולר נאופזיה דרגה 3 (LCIS). השאת נוטת יותר לשלוח גרורות למעטפות המוח ולמערכת העיכול.
- קיימים עוד סוגים נדירים מאוד של שאתות בשד כמו Apocrine carcinoma, Squamous cell carcinoma., Spindle cell carcinoma., Carcinosarcoma, Merkel-cell carcinoma., Adenoid cystic carcinoma.
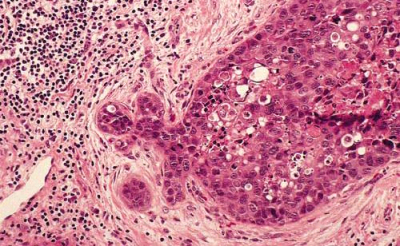
- מחלת פאג'ט (Paget disease): זו היא שאת תוך עורית מסוג אדנוקרצינומה. נראה כמו אקזמה של העור של הפטמה והעטרה. לעיתים קרובות נמצא DCIS מתחת לעור ברקמת השד. המאפיין של שאת זו הם מציאת תאי פאג'ט - תאים גדולים עגולים או אובליים המצויים בין תאי אפיתל תקינים.
- שאת דלקתית של השד (Inflammatory breast cancer): שאת מאוד אגרסיבית מאופיינת לעיתים קרובות במעורבות של העור היוצרת גודש כולל לימפתי ואודם בעור. שכיחה ב- 1%-3% מכלל החולות בסרטן השד. השאת מתקדמת מהר מאוד ונוטה לשלוח גרורות. השאת מוגדרת כשאת מתקדמת מקומית (Local advanced IIIb) ויש הממליצים בכל מקרה להתחיל טיפול כימותרפי לפני כירורגיה.
- לימפומה של השד שכיחה ב- 1.7% מכלל הלימפומות האקסטרא נודלריות או 0.01% מכלל הממאירויות בשד. רובן מאובחנות כגוש בשד בבדיקה או בממוגרפיה. הטיפול בחולות אלה הוא כמו בחולות לימפמה על ידי פרוטוקולים של כימותרפיה.
קיים קשר בין הסוג ההיסטולוגי לבין פוטנציאל הממאירות של השאתות. בקבוצה 1 נמצאות כל השאתות אשר אינן פולשניות: דוקטל קרצינומה מוגבלת לדאקט (In situ) ולובולר קרצינומה In situ (פאג'ט ללא נוכחות של גוש). בקבוצה 2 נמצאות השאתות שהן פולשניות, אולם שולחות גרורות לעתים נדירות, והן אדנוקרצינומה בעלת התמיינות טובה, מדולרי קרצינומה, קולואיד מוצינוס קרצינומה ופפילרי קרצינומה. בקבוצה 3 נמצאות כל השאתות השולחות גרורות במידה בינונית, כולן פולשניות (אינבזיביות) כמו ה- Infiltrating adenocarcinoma, דוקטל קרצינומה עם חדירה לסטרומה, Infiltrating lobular carcinoma וכל השאתות שאינן בקבוצות הקודמות. קבוצה 4 כוללת את כל השאתות השולחות גרורות בשכיחות גבוהה, כל השאתות שהן Undifferentiated ואת כל השאתות שחודרות מקומית לכלי הדם והלימפה (LVI - Lymphovascular invation) (תמונה 37.12).
טבלה 7.12: מסכמת את הקשר בין הפתולוגיה לפרוגנוזה. Grade 1 הוא בעל היוותרות בחיים טובה מ- 4 Grade וההיוותרות בחיים בקבוצה A ארוכה יותר מזו של קבוצה D.
| טבלה 7.12: חלוקה היסטופתולוגית של סרטן השד | ||
|---|---|---|
| Histopathologic Grade (G) | ||
| Gx | Grade cannot be assessed | |
| G1 | Well differentiated | |
| G2 | Moderately differentiated | |
| G3 | Poorly differentiated | |
| G4 | Undifferentiated | |
| Cancer of breast | ||
| A | Not metastizing | |
| Ductal carcinoma in situ, | ||
| Lobular carcinoma in situ, | ||
| Paget's disease (no mass) | ||
| B | Rarely metastizing | |
| Well differentiated IDC | ||
| Medullary carcinoma | ||
| Mucinous carcinoma | ||
| Papillary carcinoma | ||
| C | Moderately metastizing | |
| Infiltrating ductal carcinoma | ||
| Infiltrating lobular carcinoma | ||
| D | Highly metastizing | |
| Undifferentiated carcinoma | ||
| Lympho-vascular invasion (LVI) | ||
| Inflamatory carcinoma | ||
השכיחות של שליחת גרורות בקבוצה 1 היא נדירה. בקבוצה 2 - 15%, בקבוצה 3 - 35%, ובקבוצה 4 - 58%. שיעור ההיוותרות בחיים ל-5 שנים יורד מ-98% בקבוצה 1 ל- 55% בקבוצה 4. אצל חולים בעלי שאת שאינה פולשנית (In situ), נמצא ב- 30%-20% מהחולות שאתות גם בשד השני שהן סינכרוניות, ו-10% הן מטאכרוניות בעיקר בצורה של LCIS, בעוד שבשאתות שהן פולשניות 12% מהשאתות בשד השני הן סינכרוניות ו-8% הן מטאכרוניות.
בהשוואה בין צורות היסטולוגיות של חולות עם היוותרות בחיים ארוכה, לבין אלה של חולות שנפטרו לאחר תקופה קצרה, כאשר שתי הקבוצות היו באותה דרגה, נמצא כי לחולות עם ההיוותרות בחיים הארוכה (15 שנה ויותר), היו צורות היסטולוגיות שפירות יותר כמו קרצינומה טובולרית, מדולרית, פפילרית וכו'. בנוסף - עבודות שונות מצביעות על כך שנוכחות של קולטנים לאסטרוגן ולפרוגסטרון משפיעה לטובה על הפרוגנוזה.
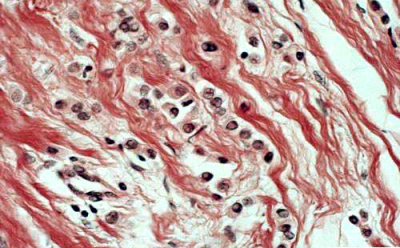
ב- 4% עד 40% מהשאתות שהוצאו במסטקטומיה (תלוי בסוג השאת) אפשר למצוא חדירה לכלי הדם או לכלי הלימפה (תמונה 34.12). הפרוגנוזה של החולים הללו היא פחות טובה מזו של החולים ללא חדירה כזו. בסקר על 20,000 נשים, נמצא שקיים קשר ישיר בין היוותרות בחיים לבין חדירת השאת לכלי הלימפה. כמו-כן נמצא קשר ישיר בעל אופי אקספוננציאלי בין מספר בלוטות הלימפה הנגועות לבין ההיוותרות בחיים וחזרת המחלה. המרכיבים הפתולוגיים המשפיעים על הפרוגנוזה מסוכמים בטבלה 8.12.
טבלה 8.12: המרכיבים הפתולוגיים המשפיעים לרעה על הפרוגנוזה
- בלוטות לימפה נגועות.
- נמק של השאת.
- היפרפלזיה של מרכזי הנבט בבלוטות הלימפה.
- Scar cancers
- חדירה לעצבים.
- חדירה לכלי דם (שכיחות 40%-4%).
- חדירה לכלי לימפה.
- אי-נוכחות קולטנים לאסטרוגן ולפרוגסטרון.
- רמות CEA גבוהות ונוכחות CEA בצביעת הרקמות. רמות CA 15-3 גבוהות.
- מעורבות הפטמה.
- אנפלואידיות של השאת.
- שאתות חיוביות HER2
בחולות בעלות שאת ממארת של השד שאינה ממוקמת בסמוך לפטמה, נמצאה נגיעות של הפטמה בתאי שאת ב-44 מתוך 141 חולות. ככל שהשאת גדולה יותר או אנפלסטית יותר, כך צפויה שכיחות גדולה יותר של נגיעות הפטמה, ופרוגנוזה גרועה יותר בחולות אלה.
קולטנים הורמונליים
ערך מורחב – קולטנים לאסטרוגן ולפרוגסטרון בסרטן השד
חלק מהתאים הממאירים מגיבים לאסטרוגנים וחלקם אינם מגיבים. ככל שההתמיינות שלהם טובה יותר, כך הם מכילים יותר קולטנים הורמונליים. לאור זאת היה צפוי שכל החולות בעלות קולטנים חיוביים לאסטרוגן יגיבו לסילוק המקורות לאסטרוגן, כמו כריתת השחלות, כריתת האדרנל או כריתת ההיפופיזה, אולם נמצא שרק 60% מהחולות הגיבו. בעקבות זאת נערכו חיפושים אחר קולטנים נוספים, ונמצאו קולטנים הורמונליים נוספים, כמו קולטנים לפרוגסטרון. כאשר הקולטנים הללו היו גם הם חיוביים נמצאה תגובה ב-80% מהחולות (הנושא יידון בהרחבה בסוף הפרק). התגובה בהתאם לנוכחות הקולטנים מסוכמת בטבלאות 9.12 ו- 10.12.
| טבלה 9.12: השפעת נוכחות קולטנים על תגובה למניפולציה הורמונלית ומאפיינים | |
|---|---|
| נוכחות קולטנים | תגובה למניפולציה הורמונלית |
| קולטן חיובי לאסטרוגן | 60% מהחולות מגיבות למניפולציה הורמונלית |
| קולטן שלילי לאסטרוגן | 15% מהחולות מגיבות למניפולציה הורמונלית |
| קולטן חיובי לאסטרוגן ולפרוגסטון | 85% מהחולות מגיבות למניפולציה הורמונלית |
| קולטן שלילי לאסטרוגן ולפרוגסטון | 15% מהחולות מגיבות למניפולציה הורמונלית |
| קולטן חיובי לאסטרוגן | מעיד על צורה היסטולוגית שפירה יותר |
| קולטן שלילי לאסטרוגן | מעיד על צורה היסטולוגית אנפלסטית |
| טבלה 10.12: השפעת נוכחות קולטנים על שיעור חזרת השאת | ||
|---|---|---|
| נוכחות קולטנים | בלוטות (+) | בלוטות (-) |
| קולטן חיובי לאסטרוגן | שיעור חזרה 25% | שיעור חזרה 7% |
| קולטן שלילי לאסטרוגן | שיעור חזרה 50% | שיעור חזרה 27% |
שיעור ההיוותרות בחיים של נשים בעלות קולטנים חיוביים לאסטרוגן הוא 70% לעומת 52% בחולות ללא קולטנים לאסטרוגן.
Nikson בנה מודל פרוגנוסטי הכולל את המשתנים ההיסטולוגיים, ההורמונליים ובלוטות הלימפה, ובעזרת תוכנית מחשב ערך סימולציה של שיעור החזרות הצפוי ב-3,100 חולות סרטן השד. הוא מצא התאמה טובה בין השיעורים הצפויים שנמצאו בסימולציה לאלה שנמצאו במציאות. לאור נתונים אלה נעשים ניסיונות לבנות מערכת דירוג אשר תהיה בעלת ערך פרוגנוסטי רב יותר מזו שמשתמשים בה כיום (TMN או הקלסיפיקציה של קולומביה).
עיבוד חולות סרטן השד
שאתות שגודלן קטן מ-5 ס"מ אצל נשים ללא בלוטות נגועות בבית השחי שולחות גרורות שקוטרן יותר מ- 1 ס"מ רק לעתים נדירות, ולכן הסיכוי לגלות אצלן גרורות בשיטות המקובלות כיום הוא קטן ביותר. לכן מומלץ על ביצוע שגרתי של צילום חזה בכל חולה הלוקה בסרטן השד. לא מומלץ לבצע צילומים אלכסוניים או טומוגרפיה ממוחשבת, אלא אם כן יש חשד לממצא גרורתי בריאות. בנוסף יש לבצע בדיקת פוספטזה בסיסית, שהינה אינדיקטור בלתי ספציפי, אולם אמינותה דומה לזו של המיפויים. רוב העבודות מציינות שניתן להוכיח גרורות בכבד ב-80% מהחולות שלהן שאת מתקדמת בשד, אולם רובן לא עוסקות בשאתות קטנות הנתונות לכריתה מרפאית. רק בחולה אחת מכל 100 חולות ניתן להוכיח גרורות בכבד על-ידי מיפוי. לכן לא מומלץ לבצע מיפוי שגרתי לחולות בעלות שאתות קטנות, במיוחד אם רמת הפוספטזה הבסיסית שלהן תקינה.
השילוב של מיפוי פתולוגי עם רמות CEA גבוהות (יותר מ-9) הוא בעל ספציפיות גבוהה, כלומר חולים שנמצאו בהם ממצאים אלה נחשבים כסובלים מגרורות בכבד, למרות שלא ניתן לומר את אותו הכלל בצורה הפוכה.
הטומוגרפיה הממוחשבת היא בדיקה רגישה לגילוי גרורות בכבד, אולם היא אינה מומלצת כשיטת סקירה שגרתית, אלא אם לחולה רמה מוגברת של פוספטזה בסיסית, CEA, או CA 15-3 או בשאת הנמצאת בשלב 3, מכיוון שההוצאה הכספית על חולות הנמצאות בשלבים מוקדמים יותר היא גבוהה ואילו שיעור האבחנות החיוביות נמוך ביותר.
Baker ממליץ על צילום חזה ובדיקת פוספטזה בסיסית כבדיקות שגרה. אם הפוספטזה הבסיסית גבוהה, בנוכחות תפקודי כבד תקינים, יש לבצע טומוגרפיה ממוחשבת (תרשים 6.12). אם אין טומוגרף ממוחשב יש לבצע מיפוי כבד ומדידת CEA.
העצמות הן המקום השכיח ביותר למציאת גרורות בחולות הנפטרות מסרטן השד. כ-50% מהגרורות הנמצאות בנתיחה שלאחר המוות אינן מודגמות לפני המוות. צילומי הרנטגן של העצמות הם בעלי רגישות נמוכה ביותר לזיהוי גרורות בעצמות של חולות מדרגות 1 ו-2. הרגישות הנמוכה נובעת מכך שחלק מהגרורות הן תוך טרבקולריות, ומכיוון ש-50% מהמינרלים בעצם צריכים להיהרס לפני שניתן להדגים את הגרורה. רק ב-2% מחולות סרטן השד מדרגה 1 ו-2 נמצאו גרורות א- תסמיניות במיפוי עצמות. ממצא זה מדווח בעבודות רבות שנתפרסמו. תוצאות אלה מצביעות על כך שאין ערך רב בביצוע בדיקות סקירה של מיפוי עצמות בחולות מדרגה 1 ו-2. לעומת הגישה הזו Gerber ממליץ לבצע מיפוי עצמות כמקור להשוואה במסגרת מעקב. כיוון שרק 20% מהחולות מדרגה 1 ו-2 יפתחו במשך המעקב גרורות בעצמות הרי רק בקבוצה קטנה יחסית יהיה ערך לביצוע בדיקה שגרתית זו.
בסיכום של 12 עבודות גדולות העוסקות במיפוי עצמות וכבד בחולות סרטן השד, נמצא מיפוי עצמות חיובי ב-3% מהחולות מדרגה 1, ב-7% מדרגה 2 וב-25% מדרגה 3. זאת לעומת 2% בממוצע במיפוי הכבד. ב-90% מהחולות שבהן מיפוי הכבד הפך מחיובי לשלילי היו ממצאים נלווים קודמים שהעידו על מעורבות הכבד. מסקנתו היא שבמסגרת המעקב יש לבצע מיפוי עצמות לחולות, אולם אין צורך במיפוי כבד.
בחיפוש אחר גרורות יש לזכור שברוב החולות לא ניתן להדגים שאתות גרורתיות שקוטרן הוא פחות מ-2 ס"מ.
בחולות א-תסמיניות מדרגה 1 ו-2 השכיחות של מציאת נגעים בכבד ובעצמות נמוכה מאוד ולכן אין צורך בביצוע שגרתי של חיפוש גרורות במקומות אלה. בעבודה שבדקה את משמעות המעקב בין קבוצה שעברה מעקב יזום קבוע לבין קבוצה שעברה מעקב לפי תסמינים נמצא שלא היה הבדל בהיוותרות בחיים בין שתי הקבוצות.
בחולים הסובלים מהפרעה בתפקודי הכבד ומכבד מוגדל, יש לבצע טומוגרפיה ממוחשבת של הבטן. בחולים הלוקים במחלה מתקדמת (T3-4), מעורבות של בלוטות (N2-3) וגרורות מרוחקות יש לבצע מיפוי עצמות.
טיפול מרפא
טיפול מרפא ניתן להעניק לחולות מדרגה 1 ו-2. הטיפול בחולות מדרגה 3 ו-4 הוא מקל (פליאטיבי).
מועד הטיפול הכירורגי
בתחילת שנות ה-90 התגבשה הגישה של כירורגיה בשני שלבים (ביופסיה בשלב ראשון וטיפול כירורגי בשלב שני), דהיינו, שלב האבחנה מופרד משלב הטיפול. יתרונות השיטה הזו הם אנושיים, רפואיים וכלכליים. העדיפות היא לביופסיה מחטית ורק במידה וזו אינה מספקת יש לבצע ביופסיה פתוחה (ראה הגישה לברור גוש בשד).
- את הביופסיה ניתן לבצע באלחוש מקומי, דבר החוסך ימי אשפוז ומקטין את העומס על חדרי הניתוח.
- ניתן למנוע את הסבל והסיכונים שבאלחוש כללי מ-2/3 הנשים המגיעות לביופסיות (ולא נמצאה בהן שאת ממארת).
- החולה יכולה לקבל אינפורמציה מדויקת על מהות מחלתה ולהחליט בשיתוף רופאיה ובני משפחתה על סוג הטיפול שהיא תקבל (כריתה מקומית והקרנות או כריתה רדיקאלית).
- גישה זו מאפשרת לבצע בדיקות עזר באופן סלקטיבי על מנת לקבוע את דירוג המחלה לפני הניתוח ולקבוע בהתאם את סוג הטיפול.
החסרונות המצוינים בספרות לגישה זו הם: אפשרות של פיזור גרורתי בעקבות הביופסיה וזמן ההמתנה. דעה זו נשמעה על-ידי מספר מחברים שהראו שדחייה של שבועיים בטיפול מקטינה את סיכויי ההיוותרות בחיים. אולם בעבודות של השנים האחרונות ממצאים אלה לא הוכחו. מהספרות שהתפרסמה עד היום נראה שאין סיכון יתר בגישה הדו-שלבית.
בסקרים רטרוספקטיבים ארוכי טווח נמצא שעיכוב בטיפול למעלה מ-3 חודשים לאחר האבחנה היה כרוך בפרוגנוזה גרועה יותר. הסיבה העיקרית לכך היתה דירוג מתקדם יותר של המחלה בחולות אלה. הפרוגנוזה של חולות מאותה דרגה היתה דומה.
טיפול ניתוחי
Halsted, הנחשב לאבי כירורגיית השד המודרנית, חי בסוף המאה ה-19 ובתחילת המאה העשרים. הוא טען שהשאת הממארת בשד מתחילה כשאת מקומית המתפשטת מהשד בצורה צנטריפוגלית לבלוטות הלימפה המהוות מחסום בפני התפשטות השאת. העקרונות אותם תיאר היו:
- התפשטות השאת היא בצורה מסודרת ובהתאם לעקרונות מכניים.
- תאי השאת מגיעים לבלוטות הלימפה דרך כלי הלימפה.
- בלוטות לימפה נגועות הינן עדות להתפשטות השאת.
- בלוטות הלימפה משמשות כמחסום להתפשטות השאת.
- התפשטות דרך כלי הדם היא מיקטנית (מינימלית).
- השאת היא אוטונומית במאכסן.
- מכאן נובע העיקרון הכירורגי ששאת הניתנת לכריתה היא שאת מקומית או זו שהתפשטה לבלוטות הלימפה בלבד.
- מכיוון שהשאת הממארת היא מחלה מקומית הרי ככל שהניתוח הוא נרחב יותר סיכויי הריפוי טובים יותר.
העקרונות הכירורגיים אותם קבע Halsted היו:
- כריתה רחבה של עור השד, וכיסוי הפגם על-ידי שתל עור.
- כריתת שרירי החזה (פקטורליס), כחלק מכל טיפול ניתוחי בסרטן השד.
- כריתת בלוטות הלימפה בבתי השחי.
- כריתה נרחבת של כל רקמת השד כחטיבה אחת.
עקרונות אלה שימשו בסיס לניתוחי כריתת השד השונים.
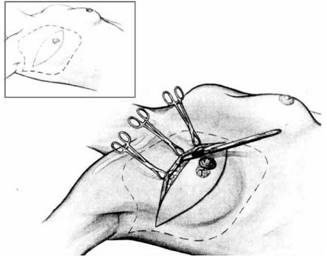
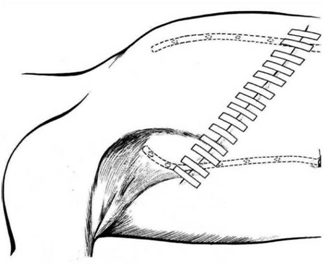
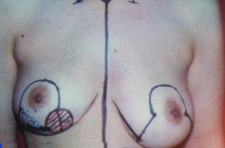
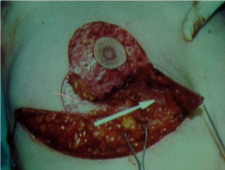
כריתה נרחבת של השד - Radical mastactomy
ניתוח זה תואר על-ידי Halsted כפתרון כירורגי לסרטן השד. בניתוח זה מבצעים חתך אליפטי רוחבי או אלכסוני סביב השד (איור 22.12),
כורתים את השד תוך הכנת שני מתלי עור (איור 23.12), עליון ותחתון, בעובי של כ-0.5 ס"מ, המיועדים לסגירת הפצע בגמר הניתוח. עובי המתלה נקבע על ידי קו ההפרדה שבין העור לשד. קו הפרדה זה הוא הפסציה השטחית של השד המפרידה בין העור לשד. למעשה, זוהי רקמת חיבור דקה עם מעט כלי דם העוברים בה ולכן הפרדה במישור זה יוצרת הפרדה אנטומית ומעט דימום.
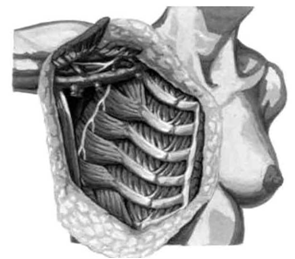
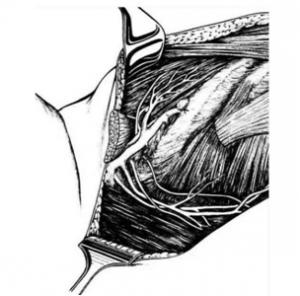
לאחר מכן כורתים את שריר החזה הגדול והקטן (Minor and major pectoralis). פותחים את בית השחי וכורתים את בלוטות הלימפה בשלושת האזורים של בית השחי (איור 24.12).
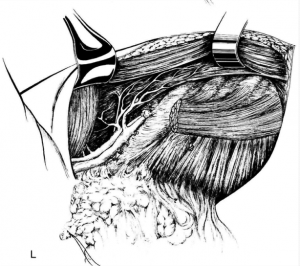
|
|
הגבולות האנטומיים של בית השחי, לצורך ניתוח זה, הם: מאחור - שריר הגב הרחיב (Latissimus dorsi) והשריר התת-שכמי (Subscapularis); מדיאלית - שריר המשור הקדמי (Serratus anterior) וצלעות בית החזה; מלפנים - שרירי הפקטורליס; ומעל - הווריד האקסילרי ממקום כניסתו לזרוע ועד האפקס של האקסילה שהוא אזור המעבר של הווריד האקסילרי מעל צלע 1 ומתחת לעצם הבריח. כל הבלוטות הנמצאות בתחום זה, כולל כלי הדם היוצאים מהווריד האקסילרי, נכרתות. בסיום כריתה זו מכסים את אזור הדיסקציה בשני מתלי העור, שהוכנו בזמן כריתת רקמת השד, ונתפרים ראשונית (איור 25.16 ותמונה 38.12).
אם חסר עור אפשר לבצע השתלת עור במקום. בחולות בעלות גרורות רחוקות, או גרורות שלא ניתן להוציאן בשלמות, אין לבצע ניתוח זה.
באמצע שנות החמישים קמו מנתחים שטענו שהניתוח שהוצע על-ידי Halsted אינו מספיק רדיקאלי, מכיוון שאינו כולל את הניקוז הלימפתי שלאורך ה-Internal mammary. הם הציעו לבצע את הניתוח שתואר על-ידי Urben ואחרים – ה-Extended radical mastectomy.
Extended Radical Mastectomy
בניתוח זה, בנוסף לכריתה המבוצעת ב-Radical mastectomy, מבצעים בנוסף פתיחת בית החזה דרך סחוסי הצלעות ומבצעים כריתה של בלוטות לאורך ה-Internal Mammary (איור 26.12). ניתוח זה אינו מקובל, מכיוון שניתן להקרין את הבלוטות האלה, ולקבל תוצאות דומות מבחינת ההיוותרות בחיים.
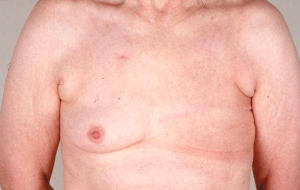
בשנות ה-60 של המאה ה-20 קמו מנתחים שערערו על הצורך בניתוחים רדיקאלים אלו. הם טענו שאין צורך בכריתת שריר הפקטורליס הגדול במסגרת הטיפול הכירורגי בסרטן השד. הם הציעו לאמץ את הניתוחים שתוארו על-ידי Patey- Madden, שנקראו ה-Modified radical mastectomy. לניתוח זה יתרונות קוסמטיים ותפקודיים. השארת הפקטורליס הגדול מאפשרת טווח תנועה תקין של היד בצד המנותח, ועיוות קטן יותר של דופן בית החזה.
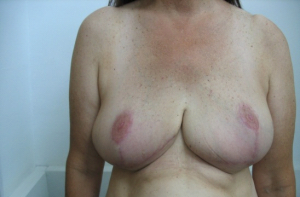
כריתת נרחבת מותאמת של השד - Modified Radical Mastectomy
בניתוח זה, בניגוד ל-Radical mastectomy, לא כורתים את שריר הפקטורליס הגדול. הפקטורליס הקטן מנותק לפי שיטה אחת מהקורקואיד פרוסס, על מנת לאפשר גישה לאפקס של האקסילה - ניתוח על-שם Madden. בשיטה שנייה הפקטורליס הקטן נכרת לגמרי, יחד עם בלוטות הלימפה שבין שרירי החזה (אינטרפקטורליות) - ניתוח על-שם Patey. בנוסף כורתים גם את בלוטות הלימפה של בית השחי, כפי שתואר ב- Radical mastectomy (תמונה 38.12א').
בעבודות רבות הוכח שהתחלואה, התמותה, שכיחות החזרות המקומיות וההיוותרות בחיים, דומות בניתוח זה לאלה המושגות בשיטות היותר רדיקאליות. לכן ניתוח זה הפך למקובל בקרב מנתחים רבים.
|
|
כריתת שד פשוטה- Simple mastectomy
כריתת שד פשוטה היא כריתת רקמת השד בלבד, ללא כריתת השרירים של דופן בית החזה, וללא כריתת בלוטות בית השחי. ניתוח זה הוא בעל שיעור גבוה של חזרות בבית השחי מאשר בניתוחים הרדיקאליים יותר. כריתת שד פשוטה של חולות מדרגה 1 ו-2, המלווה בהקרנות לאחר הניתוח, משיגה תוצאות דומות לאלה של ניתוחים נרחבים יותר.
כריתות מוגבלות של השד
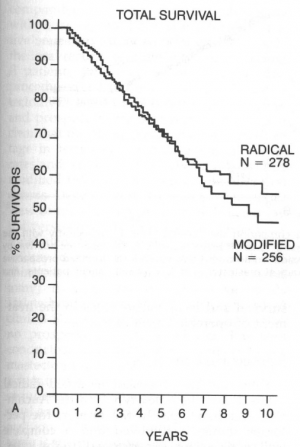
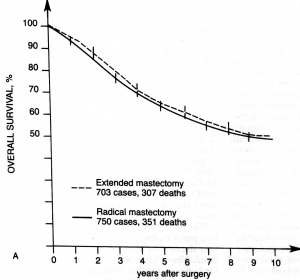
לאור העובדה שלא נמצא כל הבדל בהיוותרות בחיים בין הניתוחים הרדיקאלים יותר לרדיקאלים פחות (גרף 8.12), הועלתה השאלה מה הסיבה לכך שלא נתקבל כל הבדל בין הניתוחים הללו?
|
|
העובדה שב-25% מהחולות מדרגה 1, וב-75% מהחולות שלהן בלוטות לימפה חיוביות נמצאה עדות לגרורות בתום 10 שנות מעקב, מלמדת שכבר בשלב האבחנה המוקדם (שלב 1) קיים פיזור גרורתי שלא אובחן בהתחלה בשיטות המקובלות. עבודות בנושא הקינטיקה וזמן הכפלת המסה של שאתות, מלמדות שזמן רב לפני שהשאת ניתנת למישוש היא בעלת יכולת לשלוח גרורות. תא שאת בודד זקוק ל-30 הכפלות (106 תאים) על מנת להגיע לגודל של 1 ס"מ. בשלב זה אפשר למצוא ב-20% מהחולות גרורות נסתרות בבלוטות הלימפה.
השאת בשלב זה זקוקה ל-10 הכפלות נוספות על מנת להגיע לגודל קריטי שאינו ניתן לריפוי. זמן ההכפלה של השאת שונה משאת אחת לחברתה, והוא נע בין 40 ל-380 ימים. משמעות הדבר היא ששאת המתגלה בבדיקה קלינית נמצאת בגוף החולה בין שנתיים ל-17 שנים. מסתבר שהשאתות אינן גדלות ליניארית, אלא יש להן תקופות של גדילה מואצת ותקופות של רגיעה יחסית בגדילה. וזה מסביר את התצפיות של שאתות שלעתים מתחילות לצמוח במהירות יחסית. זמן הכפלת המסה של שאתות בחולות בעלות גרורות בבית השחי הוא קצר יותר מאלה שאין להן גרורות.
המסקנה הנובעת מהנתונים הללו היא שבזמן האבחנה התפשטה השאת של רוב החולות מעבר לשד, כלומר, מדובר במחלה סיסטמית. מכאן שאין טעם בניתוחים רדיקאלים מאוד כדי לטפל במחלה, שהיא באופן מעשי או פוטנציאלי מפושטת. גישה זו היתה מקובלת על Hirsch כבר בתחילת המאה, כאשר ב-1927 פרסם בגרמניה עבודה מדעית ראשונה על התוצאות הטובות יחסית שהשיג בטיפול מוגבל בסרטן השד. Vera Peters מטורונטו התחילה ב-1939 בטיפול מקומי בסרטן השד על-ידי כריתה חלקית של השד והקרנות. ב-1983 היא פרסמה את תוצאותיה, לאחר מעקב שנמשך עד 30 שנה אחר 800 חולות. היא לא מצאה כל הבדל בין הניתוחים הללו לניתוחים הרדיקאלים יותר בהשפעה על שיעור ההיוותרות בחיים.
לאור הממצאים האלה קבע פישר עקרונות חדשים להבנת סרטן השד:
- אין סדר קבוע להתפשטות תאי השאת.
- תאי השאת חודרים לבלוטות הלימפה על-ידי אמבוליזציה.
- נגיעות בלוטות הלימפה היא עדות ליחס שבין המאכסן לשאת המאפשרת התפתחות גרורות, ולאו דווקא הסיבה לגרורות מרוחקות.
- בלוטות הלימפה האזוריות אינן משמשות כחסימות להתפשטות השאת.
- בלוטות הלימפה הן בעלות חשיבות ביולוגית ולא אנטומית.
- מכאן נובע שכל שאת הניתנת לכריתה כירורגית היא מחלה סיסטמית.
- היקף הטיפול המקומי בסרטן השד אינו משפיע על ההיוותרות בחיים.
- נוכחות של שאתות רב מוקדיות אינה בהכרח עדות למחלה ממארת יותר.
כריתת בלוטות הלימפה משמשת בעיקר להערכה של השאת, ולא כחלק מהטיפול בסרטן השד. לאחרונה פורסמו מספר עבודות המראות שסילוק בלוטות הלימפה חשוב לטיפול בחולות הללו. חולות שהוצאו מהן בלוטות הלימפה פיתחו פחות גרורות מרוחקות יחסית לאלה שהושארו בהן הבלוטות, ולכן גם היוותרות בחיים שלהן היתה טובה יותר. עבודות אלה הן בודדות ומספר החולים בהן קטן, לכן אינן מאפשרות להסיק מסקנות לגבי הערך של כריתת בלוטות לימפה לריפוי חולות סרטן השד.
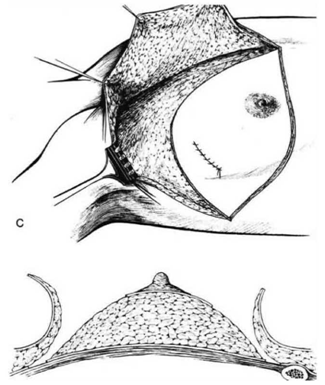
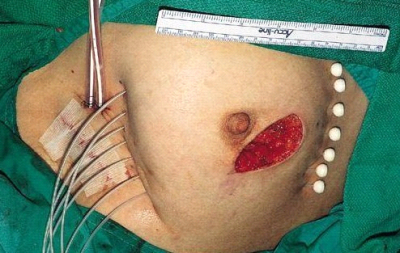
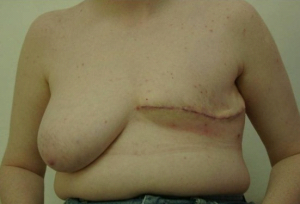
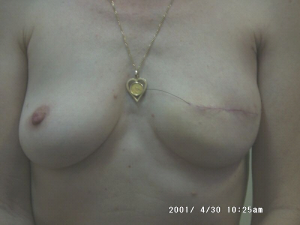
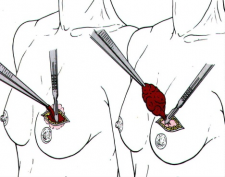
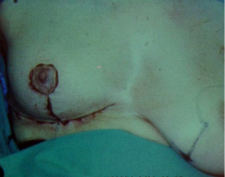
כריתה משמרת שד
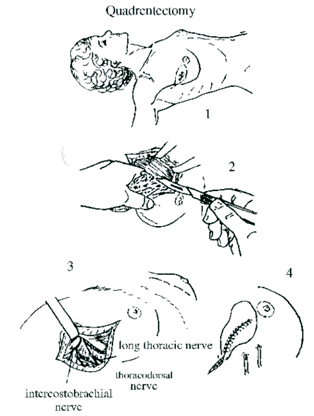
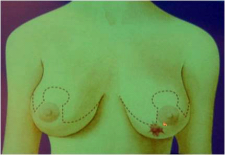
כריתה משמרת שד היא כריתה של חלק מרקמת השד בה נמצאת השאת הממארת עם רקמת שד בריאה סביבה (שוליים חופשיים). מרחב הכריתה הוא שנותן לפעולות אלה את שמם. כריתת גוש בשד (Lumpectomy) היא כריתה של השאת עם שולים יחסית צרים של מספר מילימטרים (איור 27.12 תמונה 39.12), ואילו כריתת רביע (Quadrentectomy) היא כריתה רחבה שאינה מתייחסת לגודל השאת והשולים אלא מסלקת כרבע שד סביב השאת (איור 28.12).
מבחינה טכנית יש לשלב שמירה על מראה ללא ויתור על מרחב הכריתה האונקולוגית. הכריתה הרחבה הנדרשת יוצרת חסר רקמה רצינית בשד וכל ניסיון לסגור את החסר יצור עיוות ניכר בשד. לכן, אין לנסות ולקרב את שולי הלמפקטומיה ואין לנקז אותה. יש להשאיר בסיס טוב לעור מעל החסר ולסגור אותו. נוזל המופרש על ידי הרקמות ממלא את החוסר ושומר על הצורה של השד. נוזל זה מוחלף תוך מספר שבועות ועד חודשים (תלוי בגודל החלל) על-ידי רקמת חיבור שבהתחלה היא נוקשה, אולם עם חלוף הזמן הולכת ומתעדנת. את החתך בעור יש לבצע בהתאם לקווי העור - בחלק העליון והתחתון קווים רוחביים ובצדדים קוים אורכיים. תפר בעור צריך להיות אסתטי רצוי תפר תת עורי ממושך במטרה למנוע את הפגיעה בעור כפי שיכול לקרות בתפרי Mattress בודדים או סיכות. לאחר מכן, דרך חתך נפרד בבית השחי בקו השערות נכנסים לשומן בית השחי לביצוע של כריתת בלוטת הזקיף או כריתת מכלול בלוטות בית השחי. חולות עם שאת מאחורי הפטמה או בסמוך לה או חולות עם מחלת פאג'ט של הפטמה יעברו כריתת גוש מרכזית (Central lumpectomy) (תמונה 70.12) הכוללת כריתת הפיטמה, השאת והרקמות סביבה.
|

|
הכנסת הלמפקטומיה כניתוח שגרתי לטיפול בסרטן השד מעוררת מספר שאלות:
- האם ההיוותרות בחיים של החולות שעברו ניתוחים מוגבלים שונה מזו של החולות שעברו ניתוחים נרחבים יותר (כריתת שד)?
- האם החזרה המקומית בניתוחים אלה גבוהה יותר מאשר בניתוחים הנרחבים יותר?
- האם לרב-מוקדיות של סרטן השד יש השפעה על שיעור ההישנות המקומית?
- האם התוצאות, מבחינה קוסמטית, מצדיקות את הניתוח?
- האם יש להוסיף כריתת בלוטות הלימפה בבית השחי?
- מה מקום הטיפול הקרינתי בהמשך לכריתה השמרנית?
היוותרות בחיים לאחר למפקטומיה
ביחס לשאלה הראשונה, בדבר ההישרדות בחיים של חולות עם סרטן השד לאחר טיפולים משמרים ורדיקאליים, התפרסמו עד 1985 כ-40 עבודות בספרות המערבית. בעבודות אלו מדווחים המחברים על כ-10,000 חולות שעברו כריתה מקומית. בכל העבודות, שרובן אינן מבוקרות, התוצאות דומות - אין הבדל בין תוצאות הכריתה הרדיקאלית לבין תוצאות הכריתה המקומית של השאת הממארת בשד.
חסרונן של כל העבודות הללו, על אף המעקב הארוך שלהן, היה בכך שהעבודות לא היו אקראיות ופרוספקטיביות, ולכן נטען נגדן שלא ניתן להשוות בין האוכלוסיות השונות ומכאן שאין להסיק מהן מסקנות.
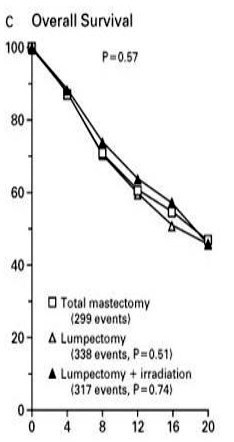
Veronesi ממילאנו מדווח ב-1985 על תוצאות סקר מתוכנן פרוספקטיבי ואקראי שהחל ב-1973. החולות חולקו לשתי קבוצות, האחת עברה כריתת שד רדיקאלית והשנייה Quadrentectomy. עבודה זו כללה 701 חולות בעלות שאת הקטנה מ-2 ס"מ וללא בלוטות לימפה נגועות-קלינית. המעקב הממוצע היה 8 שנים. בסיכום המעקב נמצאו חופשיות מהמחלה 79% מהחולות לאחר כריתת השד, ו-80% מהחולות לאחר למפקטומיה. שיעור החזרות המקומיות היה זהה בשתי הקבוצות - 4%. מסקנתו היא שהתוצאות המושגות בכריתה חלקית של השד ובכריתה רדיקאלית הן זהות.
Fisher ב-1985 פירסם תוצאות מחקר דומה שהיווה חלק מהסקר של ה-NSABP. בסקר זה נכללו 1,843 חולות סרטן השד מדרגה 1 ו-2, ושגודל השאת שלהן היה עד 4 ס"מ. הנשים חולקו בצורה פרוספקטיבית אקראית ל-3 קבוצות. קבוצה אחת עברה כריתת שד שלמה (TM), קבוצה שנייה עברה למפקטומיה (SM) וקבוצה שלישית עברה למפקטומיה והקרנות (SM + RAD). בכל שלושת הקבוצות בוצעה כריתה של בלוטות הלימפה בבית השחי, והן קיבלו טיפול כימי כמקובל (התוצאות מופיעות בטבלה 11.12).
| טבלה 11.12: היוותרות בחיים ל-5 שנים ללא מחלה | ||
|---|---|---|
| חולות ללא בלוטות לימפה נגועות | חולות בעלות בלוטות לימפה נגועות | |
| TM | 82% | 63% |
| SM | 70% | 63% |
| SM + RAD | 90% | 67% |
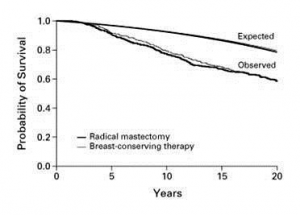
עבודה זו ורבות אחרות כמותה מראות שאין הבדל בתוצאות לטווח של 5 שנים, לפחות, בין הכריתה הרדיקאלית של השד לכריתה הסגמנטרית של השד בתוספת הקרנות. מעבודות אחרות בספרות אפשר ללמוד שגם לטווח יותר ארוך של 20 שנה מגמה זו אינה משתנית (גרף 9.12).
|
|
85% מכישלונות הטיפול המתרחשים ב-10 השנים הראשונות מתרחשים כבר ב-5 השנים הראשונות, ולכן מסקנות אלה תקפות גם לטווח ארוך יותר.
Bluming (1986) מדווח על תוצאות הסקר שנערך בלוס אנג'לס, שכלל כריתת השאת בשד, כריתת בלוטות הלימפה, הקרנה מקומית והשתלת מחטי אירידיום 192 באזור שבו נמצאה השאת בשד. התוצאות שנתקבלו היו דומות לאלה של הסדרות האחרות עם כריתה מקומית או רדיקאלית.
קיים כיום מספיק חומר עובדתי התומך בגרסה שההיוותרות בחיים של חולות שטופלו בכריתה מוגבלת ובהקרנות שווה לזו של החולות שטופלו בכריתה רדיקאלית של סרטן השד מדרגות 1 ו-2. ולכן, הפכה הכריתה המשמר שד לניתוח מקובל בטיפול בסרטן השד.
תוצאות קוסמטיות
לגבי התוצאות הקוסמטיות, רוב המחברים טוענים שב-90% מהחולות התוצאות הן טובות, מותנות כמובן בכריתה נכונה של השאת. הקרנות במינון של 6500R-5000R גורמות, במידה מסוימת, לפיברוזיס, אולם ברוב הנשים השד נשאר רך וטבעי. יש לציין שהתוצאות הקוסמטיות נשארות זהות במעקב ל-5 שנים. לעומת עבודות אלה קיימות מספר עבודות המציינות תוצאות לא טובות בכריתה שמרנית עם עיוות השד ב-30% מהמטופלות. העיוות הנוצר הוא על רקע כירורגי או קרינתי. כנראה יש כאן השפעה לגישתו של המנתח לביצוע שמרני של היקף הניתוח ולשיטת ההקרנה. במרכזים שבהם נושא השד מרוכז ביחידות, שיעור הלמפקטומיות מכלל ניתוחי השד הוא גבוה והתוצאות הקוסמטיות טובות יותר.
הישנות מקומית
שיעור ההישנות המקומית, בחולים לאחר למפקטומיה או כריתה רדיקאלית, תלוי באם נמצאו בלוטות לימפה נגועות. שיעור ההישנות המקומית ל-20 שנה כפי שדווח בעבודות אקראיות נע בין 7% בעבודה של Veronesi וחבריו ל-14% בעבודה של פישר וחבריו. כאשר הבלוטות נגועות שיעור ההישנות המקומית הוא כ-20%, וכאשר הבלוטות אינן נגועות שיעור ההישנות הוא כ-4%. כאשר מוסיפים טיפול בהקרנות לחולות בעלות בלוטות נגועות השיעור של ההישנות המקומית יורד לכ-7% (תמונה 40.12).
חזרה מקומית לאחר כריתה משמרת שד שונה מזו שלאחר כריתת שד. השוני הוא בכך שהמחלה היא מחלה מקומית ברוב החולות שעברו כריתה משמרת שד. בכריתת שד שלמה, חזרה מקומית היא למעשה ביטוי לחזרה מערכתית ברוב החולות. הבדל זה מסביר מדוע למרות השיעור הגבוה יחסית של חזרות מקומיות בכריתה משמרת שד לעומת כריתה שד שלמה, אין הבדל בהישרדות לטווח ארוך, ובשיעור ההיוותרות בחיים ללא מחלה מרוחקת (גרורות) בין שתי השיטות.
רב מוקדיות של סרטן השד
שאתות השד לסוגיהן נוטות להיות רב מוקדיות. עבודות שונות, שפורסמו בנושא זה, הראו שעד 60% מהשאתות הן רב מוקדיות. Haggensen הראה שבמרחק של 4 ס"מ מהשאת המקורית עדיין ניתן למצוא מוקדי גידול נוספים ב-40% מהחולות, כש-80% מהן הם DCIS, שכשבודקים את כל השד הנכרת אפשר למצוא ב-60% שאתות נוספות, בעבודה קפדנית מאוד שכללה פריסת השד הנכרת לפרוסות דקות, ממוגרפיה של הרקמה ובדיקה היסטולוגית של האזורים החשודים, וכ-8% מהמוקדים מצויים מחוץ לרביע המנותח. Urban מדווח כי ל-10.5% מהשאתות הרב-מוקדיות יש מוקדים גם בשד השני. Chaudary מדווח כי 3% מהשאתות הן סינכרוניות ו-7.6% מהשאתות הן מטכרוניות. בנשים בנות 40 שנה ומטה שיעור השאתות המטכרוניות בשד השני גדול פי 3. שיעור הופעת שאת בשד שני, בחולות שבהן נמצאה שאת ממארת בשד אחד גדול פי 5.9 מהאוכלוסייה הכללית. עיקר החזרות המקומיות מתרחשות בחולות עם מעורבות של בלוטות הלימפה או בחולות צעירות.
הוכח בעבודות שונות שניתן להשיג נסיגה והיעלמות של סרטן השד על-ידי קרינה בלבד, במיוחד כשמדובר במוקדים קטנים מאוד או נידוסים של תאים בודדים. כנראה הקרינה אחראית להקטנת החזרות המקומיות לאחר כריתה מקומית של השד.
מעבודות (Level II) שעקבו אחר חולות שעברו כריתה משמרת שד או כריתת שד מלאה, ניתן להסיק, שלרב מוקדיות אין השפעה על ההישרדות לטווח ארוך, אולם יש לה השפעה על שיעורי החזרות המקומיות.
טיפול בהקרנות לאחר למפקטומיה
Fisher ב- 1985 ואחרים מדווחים, ש-92% מהחולות שקיבלו הקרנות היו חופשיות מהמחלה במעקב של 5 שנים, לעומת 72% מאלה שלא קיבלו הקרנות. במיוחד בולט ההבדל בחולות בעלות בלוטות לימפה נגועות.
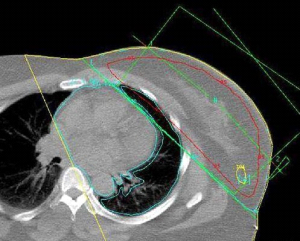
רוב המטפלים בסרטן השד על-ידי למפקטומיה משלבים טיפול קרינתי במנות של 6500R-5000R ויותר, כאשר חלק מהם (2000R) ניתן במרוכז על איזור (בוסט). עבודות שלא כללו קרינה כלל, הראו תוצאות פחות טובות מאשר הניתוחים הרדיקאליים, ולכן נראה שתנאי להצלחת הניתוחים המשמרים, הוא הוספת טיפול קרינתי לפרוטוקול. עבודות חדשות הראו שהקטנת מנת הקרינה ומשכה לא השפיעו לרעה על התוצאות לטווח ארוך ולכן בחולות שניתן להגדיל את המנה ולהקטין את מספר ההקרנות יקבלו אותו מינון מחולק ל-16 פעמים. גישה חדשנית לטיפול הקרינתי היא קרינה תוך ניתוחית. הרעיון מבוסס על כך שרוב החזרות המקומיות היו בסביבת הלמפקטומיה, ולכן יש להקרין את אותו איזור ולא את כל השד. בשיטה זו לאחר סיום הלמפקטומיה ולפני סגירת העור החולה מקבלת מנת קרינה בחדר ניתוח למיטת הלמפקטומיה, תהליך שנמשך כ- 45 דקות, ובסיומו העור נסגר מעל החלל. דווחים ראשוניים מראים שאין הבדל משמעותי בין החזרות המקומיות בחולות שקבלו קרינה על כל השד לבין אלה שקבלו קרינה רק למקום הלמפקטומיה.
כדי למנוע נזקי קרינה מידיים כמו כוויות על העור ונזקים מאוחרים כמו פגיעה בריאות ובלב יש לתכן את הקרינה בצורה כזו שהאיברים החיוניים יוצאו עד כמה שאפשר משדה הקרינה וכניסת הקרינה דרך העור תהיה כל פעם דרך מקום אחר (תמונה 41.12 ו-38.12).
|

|
שיטה אחרת למתן קרינה מקומית היא על ידי בריכתרפיה שבה מוחדרות מחטים מיוחדות המכילות חומר רדיואקטיבי – מחטי אירידיום - לאיזור הלמפקטומיה ומושארות שם עד קבלת מנת הקרינה הרצויה (איור 42.12).
גישה אחרת להקרין את השד היא דרך הכנסת צינורית שבקצה בלון הניתן לניפוח לחלל הלמפקטומיה ותפירת העור מעליו. כעבור 7-10 ימים מחברים את הצינורית לגנרטור שמפעיל אלמנט בבלון וכתוצאה מכך מופקים גלי קרינה לחלל הלמפקטומיה והרקמה סביבו. התהליך מבוצע מספר פעמים ביום במשך שבוע ימים ואז הבלון מרוקן ונשלף מהחלל הלמפקטומיה.
שולי הכריתה
הלמפקטומיה הוגדרה ככריתה של רקמת השאת בשוליים בריאים. השאלה הנשאלת היא מהו רוחב השוליים הנקיים (ברקמה בריאה) הנדרשים על מנת להבטיח תוצאות מיטביות. בעבודות המשוות כריתה משמרת שד עם שוליים צרים וכריתת שד שלמה עם השוליים הכי רחבים שניתן להשיג, לא נמצא הבדל בהישרדות לטווח של 20 שנה בין הקבוצות. מכאן ברור שלרוחב השולים אין השפעה על ההישרדות. מאידך גיסא, לשוליים השפעה על החזרה המקומית. נמצא בעבודות רבות שבחולות עם שוליים המעורבים בתאי שאת ממארת, שיעורי החזרה המקומית הם גבוהים מאוד ומגיעים לכדי 60%. לכן קיימת הסכמה גורפת ששוליים נגועים מחייבים כריתה חוזרת במטרה להשיג שולים נקיים. לעומת זאת לא הוכח ששוליים של מילימטר הם פחות טובים משוליים של 2 מ"מ או 1 ס"מ כשמשווים את ההיוותרות בחיים ושיעור החזרות המקומיות לאחר קרינה. נמצא שבחולות עם שוליים קרובים שאינן מקבלות הקרנות שיעור החזרות יכול להגיע עד 30% ל-10 שנים, אולם שיעור זה פוחת לכדי 10%-7% לאחר קרינה. בחולות עם שוליים ברוחב שמעל סנטימטר סביב השאת, הקרינה תורמת רק מעט להקטנת החזרות המקומיות.
אונקופלסטיקה – Oncoplasty
האונקופלסטיקה היא טכניקה חדשה יחסית בכירורגיה של השד. טכניקה זו מאפשרת לבצע כריתות נרחבות מקומיות בשד, ללא צורך להתפשר על האסתטיקה של השד. התוצאה הקוסמטית האופטימאלית היא פשרה מאוזנת בין נפח הרקמה הנכרתת לבין שיעור החזרה מקומית. הבעיה בכריתות רחבות היא שהחלל הגדול שנוצר גורם לשקיעה של העור לתוכו ולעיוות קשה של השד (איור 29.12).
|
|
|
קיימים מספר גורמים המשפיעים לרעה על התוצאה הקוסמטית:
- ניסיון להשיג שולים רחבים מאוד.
- הערכה לא נכונה של גודל השאת לעומת נפח השד.
- טכניקה כירורגית.
- קרינה.
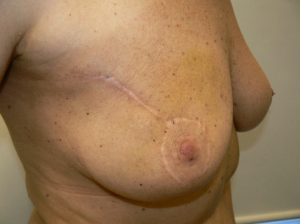
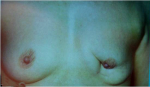
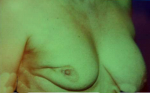
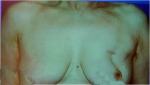
עד כמה הבעיה שכיחה? עבודות שבדקו את התוצאות הקוסמטיות של הלמפקטומיות דווחו על:
- 80% תוצאה טובה, כלומר האישה מרוצה והמראה ללא עוות ניכר (תמונה 43.12)
- 15% תוצאה בינונית, כלומר קיים עיוות מסויים אולם האישה מרוצה או חיה בשלום עם המראה (תמונה 44.12).
- 5% תוצאה גרועה, כלומר המראה אינו אסתטי והאישה אינה מרוצה עד כדי העדפה לעבור כריתת שד (45.12).
|

|
|
|
מעניין לציין שנשים שנותחו מדרגות את התוצאות הקוסמטיות כטובות יותר ביחס להערכות של המנתחים, שכן הללו ביקורתיים יותר.
האם ניתן להקטין את שעור התוצאות הבינוניות וגרועות?
התשובה היא חיובית. כדי למנוע תוצאות בינוניות או גרועות, מנתח השד צריך להשתמש בטכניקות לשימור אסתטיקה המקובלות בכירורגיה הפלסטית - אונקופלסטיקה. הצלחת הגישה האונקופלסטית דורשת תכנון פרטני של הטכניקה הניתוחית. על המנתח בזמן הניתוח להיות ער לאפשרות של היווצרות העיוות כאשר החלל גדול ובסיס העור דק, מצב שיגרום בסופו של דבר לעיוות השד. במקרים כאלה הוא צריך להיות מסוגל להשתמש באחת מהשיטות של אונקופלסטיקה על מנת לסגור את החלל ולמנוע את שקיעת העור. בהרבה מקרים הבעיה צפויה מראש, ואז יש לתכן את הניתוח מראש, כולל הזזת הפטמה אם יש בכך צורך. יש לסמן על העור נקודות חשובות על מנת לשמור על סימטריה. קיימות מספר שיטות למניעת העיוות. אלה מחולקות לרמה 1 ו-2. טכניקות רמה 1 הם טכניקות שכל מנתח שד חייב להכיר ולדעת להשתמש בהם. טכניקות ברמה 2 דורשות לרוב מיומנות בטכניקות של פלסטיקה או התערבות של פלסטיקאי מיומן על מנת לבצע את הניתוח.
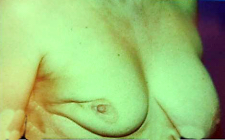
עיצוב מחדש (Reshaping) של השד היא שיטה הנחשבת לרמה אחת, בה לאחר כריתת השאת בשוליים רחבים מבצעים הפרדה בין רקמת השד והעור שמעליו והפרדה בין רקמת השד לפאציה של שריר בית החזה (איור 29.12).
שחרור זה מאפשר לנייד את רקמת השד שבשולי החלל אל תוך החלל ובכך לסגור את החלל ללא גרימה של עיוות חיצוני בשד (איור 30.12). לעור יש בסיס לשבת עליו, לכן הוא אינו שוקע והתוצאה היא מראה אסתטי טוב של השד.
התוצאות המידיות והמאוחרות שלאחר ניתוח מוצגות בתמונה 46.12.
|
|

|
לעיתים יש כדי לשמור על הסימטריה יש להזיז את הפטמה בהתאם. איור 30.12 מראה את כיווני הזזת הפטמה בהתאם למקום השאת.
הטכניקה להזזת הפטמה דורשת, לאחר ההחלטה על מיקום הפטמה, לבצע דה-אפיתליזציה של העור לשם מתוכנן להעביר את הפטמה, וקיבועה במקום על ידי תפרים לשולים החדשים (תמונה 47.12).
טכניקה אחרת שייכת לקבוצה 2, כלומר דורשת מיומנות גבוהה בטכניקות של פלסטיקה או שיתוף פלסטיקאי. היא טובה בחולות עם שד גדול יחסית ובה מנצלים את הטכניקת להקטנת השד (Reduction mammoplasty) לצורך כריתת קטעים גדולים מהשד, בנייתו מחדש תוך הקטנתו והקטנה מקבילה של השד השני במטרה להשיג סימטריה ואסטטיקה טובה של שני השדיים (תמונות 48.12, 49.12 ו- 50.12).
|
|

|

|
|
טיפול על-ידי הקרנות בלבד
ערך מורחב – טיפול קרינתי בסרטן השד
הקרנות הן שיטת טיפול לא מקובלת בשלבים מוקדמים של המחלה. לחולות מדרגה 1 ו-2 ההקרנות ניתנות במנות של 6000R-4500R, במשך 4-6 שבועות, ולאחר מכן השתלה של מחטי 192-Iridium, במינון של 3000R-1500R. שיעור הישנות המחלה, לאחר הקרנות, בחולות מדרגה 3 הוא גבוה ביותר ולכן שיטה זו לא מומלצת בעבורן. בכל החולות האלה יש לברר קיום נגיעות בבלוטות המידאקסילריות, על- ידי מישוש והוצאת דגימה, על מנת לקבוע את דירוג המחלה.
הקרנות, כטיפול בבלוטות לימפה נגועות ב-Internal mammary, משיגות תוצאות הדומות לאלה שמתקבלות לאחר ניתוחים שבהם נכרתות בלוטות אלה.
מחקרים חדשים מראים שקרינה לבית השחי של רמה 1 ו-2 מקנה אותם תוצאות כמו ביצוע דיסקציה אקסילרית של רמה 1 ו-2, ולכן בחולות שעברו כריתת בלוטת זקיף שנמצאה נגועה ולא עברו השלמה לכריתת בלוטות ברמה 1 ו-2 יקבלו במקום קרינה עם תוצאות דומות.
כימותרפיה טרום ניתוחית
ערך מורחב – הטיפול הכימי בסרטן השד
הטיפול בסרטן שד מתקדם מקומי הוא רב-תחומי ודורש שיתוף פעולה ותיאום בין גורמים רפואיים רבים וביניהם: רופאי הדמיה, כירורגים ואונקולוגים. מטרת הטיפול בסרטן שד מתקדם מקומית היא כפולה: 1. הקטנת השאת בשד ובבלוטות הלימפה האזוריות עד כדי יכולת לבצע ניתוח משמר שד וכריתת בלוטות. 2. חיסול גרורות או בחולות שבהן השאת דבוקה לשרירי הפקטורליס ומומלץ ללא טיפול טרום ניתוחי לבצע Radical mastectomy לגרום להקטנת השאת ודבקותה בשריר ולאפשר כריתה פחות רדיקאלית.
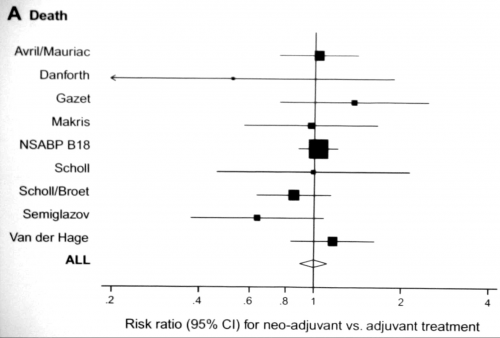
בדרגה 3, ללא טיפול כימי טרום ניתוחי, טיפול הבחירה הוא Modified radical mastectomy וכריתת בלוטות הלימפה האקסילריות. בחולות שבהן השאת אינה ניתנת לכריתה בשלמות אפשר לבצע רק כריתת שד שלמה (Toilet mastectomy) ולטפל בהמשך בהקרנות. טיפול כימי מסייע מומלץ בחולות שעברו כריתה מרפאת של השד. דרך נוספת לטיפול בחולות סרטן שד מתקדם מקומי (Local advanced) הוא מתן טיפול כימותרפי טרום ניתוחי (Neoajuvant chemotherapy). מטרת טיפול זה היא להקטין את נפח השאת לממדים אשר יאפשרו כריתה משמרת שד. ב-60% מחולות אלה, המועמדות לכריתת שד שלמה לפני הטיפול, אפשר לבצע כריתה משמרת שד לאחר טיפול כימותרפי טרום ניתוחי.
הרצף הטיפולי המוצע הוא טיפול כימי ראשוני למספר קורסים משתנה, בדרך כלל 4-6 קורסים, עם מעקב קליני והדמייתי צמוד. לאחר השגת תגובה קלינית מירבית, החולה מופנית לטיפול ניתוחי ובהתאם לתוצאות הפתולוגיות תמשיך את הטיפול האונקולוגי התרופתי והקרנתי. התשלובות לטיפול טרום ניתוחי הן תשלובות המכילות אנטרציקלינים (Anthracyclines) ו- Cyclophosphamide (AC) בארבעה מחזורים, שלאחריהם ניתנים טקסנים (Taxanes) במנה שבועית למשך כ-12 שבועות. טיפולים אלה הביאו לשיעורי תגובה קליניים גבוהים של 92% ושיעורי היעלמות קלינית של השאת בשד ב-60% וכן העלמות שלמה של השאת בפתולוגיה ב-25% (מחקר ה-NSABP B27). לחולות אלו אחוזי הישרדות גבוהים יותר בהשוואה לחולות שהגיבו חלקית. עבודות הראו שבחולות שלא הגיבו ל-AC, כ-55% מהן הגיבו לטקסנים. בחולות שהשאת שלהן מוגדרת Her2+3 תוספת של Trastuzumab (Herceptin) מעלה בצורה משמעותי את שיעורי התגובה.
רוב העבודות לא הצליחו להראות שיפור בהישרדות של חולות שקבלו טיפול כימי טרום ניתוחי, אולם 60% מהם עברו כריתה משמרת שד מוצלחת (גרף 10.12). יתרון נוסף לשימוש בטיפול הכימי הטרום ניתוחי הוא היכולת ללמוד על הביולוגיה של השאת - האם היא מגיבה או לא לטיפול. בחולות שאינן מגיבות, ניתן לשנות את התרופות. עבודות ראשוניות הראו שאכן ניתן להשיג שיעורי תגובה גבוהים יותר בשיטה זו. יתרון נוסף הוא בחולות שהגיבו ואחר כך חזרה המחלה אפשר להשתמש באותן תרופות כדי להשיג הפוגה (רמיסיה). חולות שמתחילות לקבל טיפול כימי טרום ניתוחי צריכות לעבור סימון של מרחב הגידול על ידי קליפסים המוחדרים בהכוונת US או ממוגרפיה. המטרה בהחדרת קליפים אלה היא לסמן עבור המנתח את מרחב הכריתה הרצוי, בחולות שבהן השאת קטנה או נעלמה לגמרי.
בחירת הטיפול
טיפול הבחירה בחולות בעלות שאתות ממאירות בשד הוא: בדרגות 1 ו-2 כריתת שד שמרנית, כמו Lumpectomy וכריתת בלוטת הזקיף בתוספת קרינה לאחר הניתוח. אפשרות אחרת היא כריתת שד שלמה (Simple mastectomy) והוצאת בלוטת זקיף, או כריתת שד שלמה עם קטע משריר בית החזה כאשר השאת דבוקה לשריר. בחולות שבהן השאת חודרת לשריר הפקטורליס מומלץ לבצע Radical mastectomy. בדרגה 3 טיפול הבחירה הוא Modified radical mastectomy וכריתת בלוטות הלימפה האקסילריות. גם כאן, אם השאת דבוקה לפקטורליס, יש לבצע Radical mastectomy. דרך נוספת לטיפול בחולות סרטן שד מתקדם מקומי (Local advanced) הוא מתן טיפול כימותרפי טרום ניתוחי (Neoajuvant chemotherapy). מטרת טיפול זה היא להקטין את נפח השאת לממדים אשר יאפשרו כריתה משמרת שד. ב-60% מחולות אלה, המועמדות לכריתת שד שלמה לפני הטיפול, אפשר לבצע כריתה משמרת שד לאחר טיפול כימותרפי טרום ניתוחי. בחולות שבהן השאת אינה ניתנת לכריתה בשלמות יש לבצע רק כריתת שד שלמה (Toilet mastectomy) ולטפל בהמשך בהקרנות. טיפול כימי מסייע מומלץ בחולות שעברו כריתה מרפאת של השד.
| Stage 1 | |||
|---|---|---|---|
| 1. | Simple mastectomy + Sentinel node biopsy | ||
| a. | E.R. (+) - Observation, Tamoxifen, Aromatase inhibitors | ||
| b. | E.R. (-) - Chemotherapy (+Trastuzumab if Her2+3) | ||
| c. | Undifferentiated - Chemotherapy | ||
| 2. | Lumpectomy + Sentinel node biopsy + Radiation | ||
| a. | Radiation always | ||
| b. | Chemotherapy (?), Hormonal therapy | ||
| 3. | Radiation 5000-6500R + Iridium 1500R localy + Chemotherapy | ||
| Stage 2 | |||
| 1. | Simple mastectomy + Sentinel node biopsy + Chemotherapy or Hormonal therapy. Postoperative radiation if: | ||
| a. | Lymph nodes (+) | ||
| b. | Medial lesion | ||
| c. | Pectoralis muscle involvement | ||
| Hormonal therapy | |||
| a. | Postmenopausal E.R. (+ or -) - Tamoxifen, aromatase inhibitors | ||
| b. | Premenopausal | ||
| 1. Surgical or medical castration (?) | |||
| 2. E.R. (+) - Tamoxifen + Chemotherapy | |||
| 2. | Lumpectomy or Quadrentectomy + Sentinel node biopsy + Radiation | ||
| a. | Premenopausal - Chemotherapy | ||
| b. | Postmenopausal - Tamoxifen | ||
| Stage 3 | |||
| 1. | Simple mastectomy + Sentinel node biopsy or Axillary dissection + Chemotherapy + Radiation | ||
| 2. | Preoperative chemotherapy (stage IIIb) | ||
| 3. | High dose chemotherapy + Bone marrow transplantation (stage IIIb) | ||
| 4. | Premenopausal - Surgical or medical castration (?) |
ראו גם
- לנושא הקודם: מחלות השד בילדות ומתבגרות - היבטים כירורגיים - Breast disorders in children and adolescents - surgical aspects
- לנושא הבא: כריתת בלוטות הלימפה
- לתוכן העניינים של הפרק
- לתוכן העניינים של הספר
- לפרק הקודם: כירורגיה של הטחול
- לפרק הבא: בקעים
המידע שבדף זה נכתב על ידי ד"ר צבי קויפמן, מומחה בכירורגיה, מנהל היחידה לבריאות השד, מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק