סרטן השחלה - Ovarian cancer
| סרטן השחלה | ||
|---|---|---|
| Ovarian cancer | ||
| ICD-10 | Chapter C 56. | |
| ICD-9 | 183
, 220 |
|
| MeSH | D010051 | |
| יוצר הערך | ||
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן השחלות
סרטן השחלה מהווה כרבע מכלל הממאירויות הגניקולוגיות ושיעור ההיארעות שלו הנו כ-1.5% מאוכלוסית הנשים. נשים נשאיות תשניות (Mutations) בגן BRCA נמצאות בסיכון מוגבר לחלות בסרטן השחלה. בשלבים ההתחלתיים של המחלה, סרטן השחלה מתאפיין בהיעדר תסמינים קליניים ייחודיים, ולכן קרוב לשני שליש מהחולות מתגלות רק בשלבים מתקדמים של המחלה (שלב III/IV) כאשר קיימת מעורבות משמעותית של איברים מחוץ לחלל האגן והבטן התחתונה. הטיפול בסרטן השחלה כולל שילוב של טיפול ניתוחי אגרסיבי, טיפול כימותרפי (Chemotherapy) וטיפול ביולוגי.
אפידמיולוגיה
שיעור היארעות סרטן השחלה הנו כ-1.5% מאוכלוסיית הנשים (אחת לשבעים נשים)[1] והוא מהווה כרבע מכלל הממאירויות הגינקולוגיות. על פי רישום הסרטן הלאומי[2], מאובחנות במדינת ישראל מידי שנה כ-320 חולות חדשות בסרטן השחלה.
סרטן החצוצרות וסרטן הצפק (Omentum) הראשוני הם נדירים יחסית ונחשבים כחלק מסרטן השחלה הן בהיבט הניתוחי והן בהיבט הטיפולי והפרוגנוסטי.
אטיולוגיה
גורמי הסיכון הקשורים בסיכון מוגבר לחלות בסרטן השחלה כוללים תשניות בגן BRCA (המעלות גם את הסיכון לחלות בסרטן השד ונפוצות בקרב יוצאות אשכנז) וכניסה מאוחרת לגיל המעבר (Menopause). לעומת זאת ריבוי היריונות, הנקה ונטילת גלולות למניעת היריון נמצאו כמפחיתים את הסיכון לחלות בסרטן השחלה.
קליניקה
בשלבים ההתחלתיים של המחלה, סרטן השחלה מתאפיין בהיעדר תסמינים קליניים ייחודיים. עם זאת תסמינים אפשריים כוללים כאבי בטן, דימומים, ירידה במשקל, עצירות, בחילות והקאות, מיימת ועוד.
אבחנה
שלב התפשטות המחלה נקבע בהתאם למיקום המחלה בעת האבחון. על פי האיחוד הבינלאומי לגינקולוגיה (International federation of gynecology), קרוב לשני שליש מהחולות מתגלות בשלבים מתקדמים של המחלה (שלב III/IV) כאשר קיימת מעורבות משמעותית של איברים מחוץ לחלל האגן והבטן התחתונה. הגילוי המאוחר נובע ככל הנראה כתוצאה מהיעדר תסמינים ספציפיים בשלבי המחלה המוקדמים[3].
כ-80% מגידולי השחלה הם ממקור אפיתליאלי, היתר ממקור תאי הנבט (Germ cells) או סרקומות.
טיפול
הטיפול בסרטן השחלה כולל שילוב של טיפול ניתוחי אגרסיבי וטיפול כימותרפי המשלב מספר תרופות ציטוטוקסיות (Cytotoxic) [3].
טיפול ניתוחי
מטרת הטיפול הניתוחי היא להסיר כמות גידול מרבית על מנת להגיע לשארית גידולית מינימאלית (Optimal debulking), המוגדרת כהיעדר שארית גידולית מאקרוסקופית לאחר הניתוח. זאת לאור העובדה שחולות אשר נותרות עם שארית גידולית לאחר הניתוח, בפרט אם גודלה מעל סנטימטר אחד, הן בעלות סיכון מוגבר לחזרת המחלה ופרוגנוזה גרועה יותר. לצורך השגת מטרה זו משלבים בניתוחים אלו כריתת רחם, שחלות ואומנטום כאיברים בעלי הסיכון המרבי למעורבות במחלה, ובמידת הצורך גם כריתת מקטעי מעי, טחול או כל איבר אחר המעורב במחלה[3].
טיפול כימותרפי
לאחר הטיפול הניתוחי מקובל, בשלבי מחלה מתקדמים אך גם בשלבי מחלה מוקדמים יותר, לתת טיפול כימותרפי משלים (Adjuvant)[4] לצורך השמדת שארית גידולית מיקרוסקופית או מאקרוסקופית במידה ונותרה. קיימות מספר קבוצות של תרופות כימותרפיות המשמשות לטיפול בסרטן השחלה. הטיפול הראשוני המקובל הנו משלב של תרופות מקבוצות Platinum ו-Taxanes לרוב Carboplatin ו-Paclitaxel[4].
במצבים בהם בעת האבחון קיימת מחלה מפושטת המערבת את חלל הצפק או מחוצה לו, ומקשה על השגת הסרה מלאה של רקמת הגידול בניתוח, ניתן לתת טיפול כימותרפי מקדים (Neoadjuvant) שהוכח כמסייע בהפחתת התחלואה הניתוחית של חולות אלו[5].
בהישנות או התקדמות המחלה מקובל להבחין בין מחלה חוזרת רגישה ל-Platinum, כאשר החזרה מתרחשת לאחר יותר משישה חודשים מסיום הטיפול הכימי הקודם, לבין מחלה חוזרת עמידה ל-Platinum, כאשר החזרה מתרחשת תוך פחות משישה חודשים מסיום הטיפול הכימי הקודם. במחלה חוזרת רגישה ל-Platinum מטפלים על ידי שילוב של Carboplatin עם Paclitaxel או Gemcitabine. במחלה חוזרת עמידה ל-Platinum מקובל לרוב לטפל בתרופה ציטוטוקסית בודדת כדוגמת Topotecan, Paclitaxel, Gemcitabine או Doxorubicin[6].
טיפול ביולוגי
ערך מורחב – סרטן השחלה - טיפול - Ovarian cancer - treatment
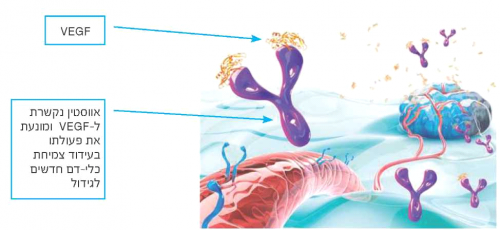
היווצרות כלי דם חדשים (Angiogenesis) הוא תהליך המאפשר לגידולים ממאירים לקבל אספקת חמצן וחומרי מזון, ולפיכך חיוני לצמיחתם ולשליחת גרורות לאיברים מרוחקים. תהליך זה משופעל על ידי הגידול באמצעות הפרשת החלבון גורם הגדילה של אנדותל כלי הדם (VEGF, Vascular Endothelial Growth Factor). כלי הדם החדשים שנוצרים נבדלים במבנם ובתכונותיהם מכלי דם פיזיולוגים, והישרדותם תלויה בהמשך נוכחות חלבון זה. רמות מוגברות של גורם הגדילה הודגמו בממאירויות שונות, בהן סרטן השחלה, ונמצא מתאם בין רמתן לפרוגנוזה רעה.
Avastin (Bevacizumab) הוא הטיפול הביולוגי הראשון שהדגים יעילות משמעותית בסרטן השחלה. זהו נוגדן חד-שבטי (Monoclonal) הנקשר ספציפית לגורם הגדילה של אנדותל כלי הדם ומונע ממנו להיקשר לקולטנים על פני תאי האנדותל ולשפעלם, וכך מעכב היווצרות כלי דם חדשים. בנוסף, Avastin נמצאה כמשפרת את הגעת הכימותרפיה לגידול על ידי הפחתת החדירות הגבוהה המאפיינת את דופן כלי-הדם שנוצרו. הפגיעה באספקת הדם לגידול ושיפור הגעת הכימותרפיה אליו גורמים לנסיגתו ולעיכוב התפשטותו בגוף.
יעילות הוספת Avastin למשלב הכימותרפי המקובל כטיפול ראשוני במחלה נבדקה בשני מחקרי פאזה (GOG128 ו-ICON7) שכללו למעלה מ-3,300 חולות עם ממאירות שחלתית[7][8]. תוצאות המחקרים הדגימו כי בקרב חולות בשלב מחלה מתקדם המצויות בסיכון מוגבר להתקדמות המחלה הוספת Avastin ל-Carboplatin ו-Paclitaxel הביאה להארכת הזמן החציוני עד להתקדמות המחלה (Progression-free survival) בכ-6 חודשים בהשוואה לטיפול כימותרפי בלבד, תוך הפחתה של כ-30% בסיכון להתקדמות המחלה או מוות (0.001>p). במחקר ה-7 ICON אף הודגם כי Avastin הביאה להארכת ההישרדות הכוללת החציונית ב-9.4 חודשים (0.03=P). פרופיל תופעות הלוואי בחולות היה עקבי למוכר עם Avastin בהתוויות אחרות.
יעילות הוספת Avastin לטיפול כימותרפי כטיפול לאחר הישנות/התקדמות מחלה רגישה ל-Platinum[7] הודגמה במחקר הפאזה ה-OCEANS Ill[9]. המחקר כלל 484 חולות סרטן השחלה שמחלתן חזרה תוך יותר מ-6 חודשים מסיום טיפול מבוסס Platinum בקו הראשון, והשווה בין מטופלות שקיבלו Avastin בשילוב עם Carboplatin ו-Gemcitabine למטופלות שקיבלו טיפול כימותרפי בלבד. תוצאות המחקר הדגימו כי הוספת Avastin לטיפול הכימותרפי הביאה להארכה של 4 חודשים במשך הזמן החציוני עד להתקדמות המחלה בהשוואה לטיפול כימותרפי בלבד (12.4 לעומת 8.4 חודשים בהתאמה), תוך הפחתה של 52% בסיכון להתקדמות המחלה או למוות 0.48=(p<0.0001) ,Hazard ratio (HR). פרופיל הבטיחות של Avastin שנצפה במחקר היה עקבי למוכר מהתוויות אחרות, ללא תופעות לוואי חדשות או בלתי-צפויות.
פרוגנוזה
הפרוגנוזה תלויה בגורמים נוספים, מלבד שלב המחלה, כדוגמת קיום וכמות שארית גידולית לאחר הניתוח ומחלות רקע.
| שלב בעת האבחנה | אחוז מכלל המקרים[10] | אופן הטיפול | משטר טיפולי מקובל | שרידות לחמש שנים[10] |
| I | 30% | ניתוח (+-) כימותרפיה | Paclitaxel + Carboplatin | 86% |
| II | 8% | ניתוח + כימותרפיה | Paclitaxel + Carboplatin | 77% |
| III | 50% | ניתוח + כימותרפיה | Paclitaxel + Carboplatin (+ Avastin - רק לשלבים IIIb ו-IIIc ) | 39% |
| IV | 12% | ניתוח + כימותרפיה | Paclitaxel + Carboplatin + Avastin | 18% |
דגלים אדומים
ביבליוגרפיה
- ↑ Jemal.A, et al. Cancer statistics 2006 .CA Cancer J.Clin 2006;56:106-130.
- ↑ Israeli MoH cancer registry. Available at: http://www.health.gov.il.
- ↑ 3.0 3.1 3.2 Berek.JS, et al. Practical Gynecologic Oncology 4th Edition Ed. Philadelphia, PA: Lippincott Wiliams &Wilkins 2005:443-541.
- ↑ 4.0 4.1 Polverino.G, et al. Survival and prognostic factors of women with advanced ovarian cancer and complete response after a carboplatin- paclitaxel chemotherapy. Gynecol Oncol 2005 ;99:343-347.
- ↑ National Comprehensive Cancer Network (NCCN): Clinical practice guidelines in oncology: Ovarian Cancer 2/2014.
- ↑ Vergote.l, et al. Neoadjuvant chemotherapy or primarysurgery in stage IIIC or IV ovarian cancer. NEJM 2010 Sept 2 pp 943-53.
- ↑ 7.0 7.1 Burger.RA, Brady MF, et al. Incorporation of Bevacizumab in the Primary Treatment of Ovarian Cancer . NEJM 2011; 365 : 2473-83.
- ↑ Perren.J, et al. A Phase 3 Trial of Bevacizumab in Ovarian Cancer; NEJM 2011 ; 365 : 2484-96.
- ↑ Aghajanian.C, et al. OCEANS: A Randomized, Double-Blind, Placebo-Controlled Phase Ill Trial of Chemotherapy With or Without Bevacizumab in Patients With Platinum-Sensitive Recurrent Epithelial Ovarian, Primary Peritoneal, or Fallopian Tube Cancer, J Clin Oncol. 2012 Jun 10;30(17):2039-45.
- ↑ 10.0 10.1 Heintz.APM, et al. Carcinoma of the ovary. 26th Annual Report on the results of treatment in gynecological cancer. IJGO 2006;95(1):S161-S192.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק