סרטן חלל הפה - Oral cancer
| סרטן חלל הפה | ||
|---|---|---|
| Oral cancer | ||
| 250px | ||
| יוצר הערך | ד"ר מרילנה ורד
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – סרטן, בריאות השן וחלל הפה
סרטן חלל הפה (Oral cancer) וסרטן לוע תחתון (Oropharynx) מהווים יחד את הממאירות השמינית הנפוצה ביותר בעולם. למרות מגמה עולמית כללית של ירידה קלה בשכיחותו של סרטן הפה והלוע התחתון, שכיחות סרטן הלשון הניידת (שני השלישים הקדמיים) ושכיחות סרטן השקד (Tonsil) נמצאות בעלייה. שיעורי ההישרדות ל-5 שנים של חולים בעלי סרטן חלל הפה נמוכים – כ-50% במשך 4 העשורים האחרונים. לנוכח זאת מובן הצורך במחקר בסיסי נוסף לשם מציאת דרכי טיפול חדשות בסרטן הפה.
אפידמיולוגיה
עולמית, מבין כל הגידולים המוצקים – סרטן הפה והלוע התחתון הוא הממאירות השמינית בנפיצותה, המונה כ-400,000 מקרים חדשים המאובחנים מדי שנה. סרטן הפה והלוע התחתון מהווה כ-3% מהגידולים הממאירים בקרב הגברים וכ-2% מהם בקרב הנשים [1]. בארצות הברית אובחנו בשנת 2010 כ-25,000 מקרים חדשים של סרטן הפה והלוע התחתון. מעניין שלפי נתונים אלה היה מספר המקרים של סרטן הפה והלוע התחתון גבוה במעט ממספר מקרי הלוקמיות (Leukemias) בקרב גברים בארצות הברית [1]. באותה שנה מתו מהמחלה כ-4,000 מהחולים בעלי סרטן הפה וכ-2,500 מהחולים בעלי גידולים בלוע התחתון. אף שקצב ההיארעות (Incidence Rate, IR) של סרטן הפה והלוע התחתון נמצא במגמת ירידה קלה, קצב ההיארעות של סרטן הלשון הניידת והשקדים נמצא בעלייה מתמדת [2]. זאת ועוד, שכיחות סרטן הלשון הניידת, הנפוץ ביותר בחלל הפה וגם האלים ביותר מבחינת ההתנהגות הביולוגית, נמצאת בעלייה מתמדת בקרב חולים צעירים (בעשור החמישי ומטה לחייהם). מגמות אלה נצפות גם בארץ.
בהודו ובכמה מדינות אחרות באסיה מתגלה מצב ייחודי: סרטן הפה והלוע התחתון הוא הגידול הממאיר הנפוץ ביותר במדינות אלה ומהווה כ-50% מכלל הממאירויות. הדבר נובע מהרגלי עישון אופייניים למקומות אלה [3].
אחוזי ההישרדות בקרב החולים בעלי סרטן הפה והלוע התחתון לא השתנו במהלך ארבעת העשורים האחרונים ונאמדים ב-50% ל-5 שנים, למרות ההתקדמות בשיטות הטיפול ולמרות השיפור שהושג בהישרדותם של החולים בעלי סרטנים באתרים אחרים בגוף. ראוי לציין שחולים בעלי סרטן תאי הקשקש (SCC, Squamous Cell Carcinoma) של הלשון הניידת הם בעלי אחוזי ההישרדות הנמוכים ביותר ביחס לחולים בעלי SCC באתרים אחרים של הפה, זאת בגלל התנהגות ביולוגית אלימה יותר של הגידול ובגלל חוסר יעילותם של הטיפולים הקיימים בהשתלטות על המחלה הראשונית ו/או הגרורתית [4].
היחס המספרי בין גברים לנשים הלוקים במחלה עומד בתקופה הנוכחית על שני גברים חולים לכל אישה חולה אחת. לפני כמה עשורים היה הפער גדול יותר: 3 גברים חולים לכל אישה חולה אחת. יש להניח שלשינוי תרמו שינויים בהרגלי העישון ותוחלת החיים הארוכה יותר של הנשים[5].
השכיחות הגבוהה ביותר לסרטן הפה והלוע התחתון בקרב גברים נצפתה בצרפת, שמקדימה את ארצות מרכז אירופה ומזרחה (בעיקר הונגריה) וחלק מארצות דרום אמריקה. הגיל הממוצע של החולים הוא כ-60 שנה, אם כי בעשורים האחרונים דווח בכמה ארצות מערביות על עלייה מדאיגה בשכיחות המחלה בקרב אנשים צעירים (בעשור החמישי לחייהם ואף צעירים יותר) , בעיקר סרטן הלשון בגברים[6].
לאחרונה פורסם מחקר אשר ריכז את הנתונים של המרשם הלאומי לסרטן בישראל בשנים 2006-1970 ואשר בדק היבטים אפידמיולוגיים, מגמות, ממצאים היסטופתולוגיים והישרדות החולים לפי אתרים [7]. המחברים דיווחו שה-SCC הייתה הגידול הממאיר הנפוץ ביותר (מעט יותר מ-4,000 מקרים מסך 6,577 מקרים של גידולים ממאירים מכל הסוגים). שכיחותו נמצאה בעלייה מתמדת עד לשיא בשנת 2000 ולאחר מכן החלה מגמה קלה של ירידה. הבעיה העיקרית במחקר זה היא שקבוצת המחקר כללה גם חולים בעלי סרטנים של השפה או של העור מסוג תאי בסיס, ששונים מה-SCC של חלל הפה ברמת האטיולוגיה [קרני על-סגול (Ultra-violet)], בטיפול ובסיכויי ההישרדות של החולים.
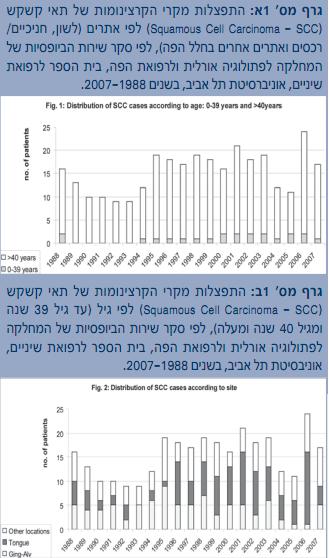
בסקירה שנעשתה בארכיון המחלקה לפתולוגיה אורלית בבית הספר לרפואת שיניים באוניברסיטת תל אביב ושכלל את כל הביופסיות שהתקבלו בשנים 2007-1988 (לרוב מהמחלקה לכירורגית פה ולסתות, המרכז הרפואי שיבא, תל השומר), אובחנו 310 (1.4%) מקרים של SCC בחלל הפה מתוך סך של 21,889 ביופסיות (טבלה מס' 1). הלשון הניידת הייתה האתר הנפוץ ביותר (111 מקרים, 36%) ואחריה החניכיים/הרכסים מחוסרי השיניים (86 מקרים, 27%). בסך הכול נמצאו 22 מקרים (7%) של חולים צעירים מגיל 45 שנה. בעשור שבין 1997-1988 שכיחות ה-SCC בלשון הניידת הייתה 24%, ובעשור 2007-1998 – 45% (גרף מס' 1א'). מלבד זאת, נמצאה עלייה בשכיחות מקרי ה-SCC בקרב חולים בני 45 ומטה, מ-4.4% ב 1997-1988 ל-9% ב-2007-1998 (גרף מס' 1ב'). מגמות אלה תואמות למגמה העולמית של עלייה בשכיחות ה-SCC בחלל הפה, בעיקר בלשון ובחולים צעירים.
במקביל למגמה העולמית, סרטן חלל הפה בכלל וסרטן של הלשון הניידת בפרט הולכים ותופסים מקום גדול יותר ויותר במציאות האונקולוגית בישראל. יש להיות ערים למגמה הזאת, בעיקר לנוכח העובדה שגיל המתרפאים הולך ויורד באופן מדאיג, מ-60 שנה בממוצע לעשור החמישי, לעשור הרביעי ואף פחות.
אטיולוגיה
סרטן חלל הפה והלוע התחתון כולל גידולים:
- אפיתליאליים-הגידולים האפיתליאליים יכולים לנבוע ממקור של אפיתל הציפוי של חלל הפה והלוע התחתון וכן ממקור של בלוטות רוק. יותר מ-90% מהגידולים באתרים אלה הם ממקור של אפיתל הציפוי והגידול שמתפתח ממנו נקרא סרטן של תאי קשקש (SCC , Squamous Cell Carcinoma) [3].
- מזנכימליים (Mesenchymal)
- המטולימפואידיים (Hematolymphoid)
מקובל שהמונח סרטן חלל הפה כולל גידולים מסוג SCC המתפתחים באזור הכלול בתחום האנטומי של חלל הפה.
הגורמים האטיולוגיים העיקריים הם עישון טבק וצריכת אלכוהול מוגברת, אשר למעשה פועלים באגבור (Synergism). הם אחראים לכ-75% ממקרי ה-SCC של חלל הפה והלוע התחתון באירופה, ביבשת אמריקה וביפן [3][2][8]. עישון הוא הגורם החשוב ביותר והשפעתו תלויה במינון ובזמן. עד לאחרונה נחשבה צריכת אלכוהול לגורם מסייע בעיקרו, מכיוון שהיה קשה להוכיח את יכולתו המסרטנת, היות ורוב המעשנים גם נהגו לשתות באופן מוגבר. אולם, מחקרים אפידמיולוגיים מעודכנים יותר הצליחו להראות שהאלכוהול עצמו יכול להעלות את הסיכון לסרטן הפה והלוע התחתון[3]. השימוש בטבק ללא עישון (Smokeless tobacco), בין שבלעיסה ובין שבהרחה הוא בעל יכולת להעלות את הסיכון לסרטן הפה, אולם הסיכון לכך אינו גבוה. לנוכח זאת, יש אנשים אשר מוצאים בטבק ללא עישון תחליף לעישון, אולם יש לזכור שיש דרכים בטוחות להפסקת העישון.
כמה גורמים ביולוגיים נקשרים לסיכון לסרטן הפה והלוע התחתון:
- הקנדידה אלביקנס (Candida albicans) – תושב קבע בחלל הפה של מרבית האוכלוסייה, המפריש חומר מסרטן מסוג ניטרוזובנזילמתילאמין (N-nitrozobenzylmethylamine). יש להניח שאין די בהשפעתו של חומר זה בלבד כדי להשרות התפתחותו של גידול ממאיר, אלא כתוספת להשפעתם של גורמים מסרטנים חזקים, כמו עישון ואלכוהול [3][5].
- נגיף האפשטיין-בר (EBV, Epstein–Barr Virus) קשור ללימפומה על שם ברקיט ( Burkitt's Lymphoma) ולסרטן של לוע האף (Nasopharynx), אך לא לסרטן הפה והלוע התחתון[5]. לעומת זאת, הוכח שזנים 16 ו-18 של נגיף הפפילומה האנושי (HPV ,Human Papilloma Virus) הם גורם אטיולוגי ב-SCC של הלוע התחתון ואילו לגבי חלל הפה הקשר ברור פחות[3]. חשיבותו של ממצא זה טמונה בכך שחולים בעלי SCC של הלוע התחתון (בעיקר של הלשון הלא ניידת, בסיס הלשון, ושל השקד) על רקע HPV צפויים להגיב טוב יותר לטיפול וצפויים לפרוגנוזה טובה יותר בהשוואה לחולים בעלי SCC של חלל הפה עם אטיולוגיה של עישון ואלכוהול [3][2]. בהקשר זה יש לשים לב ללשון, שהיא איבר ש"חי בשני העולמות": שני השלישים הקדמיים שלו, חלקו הנייד, נמצאים בתחום חלל הפה, ואילו השליש האחורי (בסיס הלשון) נמצא בתחום הלוע התחתון. מכאן חשיבותו של המיקום האנטומי המדויק של הגידול בלשון. עד לאחרונה, כאשר התברר ההבדל בין סרטן הפה ללוע התחתון ברמת האטיולוגיה והפרוגנוזה במחקרים אפידמיולוגים וקליניים, דיברו רבים בנשימה אחת על הגידולים בלשון הניידת ובבסיס הלשון, דבר שמקשה היום על הסקת מסקנות מדויקות.
- חוסר בוויטמינים ובמינרלים לא הוכח באופן חד-משמעי כפקטור אטיולוגי לסרטן הפה והלוע התחתון. יוצא מהכלל הוא חוסר ברזל בהקשר של תסמונת על שם פלאמר-וינסון, שבו נמצא קשר כלשהו ל-SCC של הלוע התחתון.
- מצב של דיכוי חיסוני, כמו במושתלי מח עצם ובחולי איידס, מעלה את הסיכון לפיתוח סרטן הפה והלוע התחתון לעומת שאר האוכלוסייה [5].
- גירוי ממושך של חבלה מכנית אינו נחשב לגורם שמסוגל להשרות SCC, אלא יותר כגורם מחזק. הוא הדין גם לגבי מצבים של גהות (Hygiene) פה ירודה. יש להניח ששני המצבים האחרונים נפוצים יותר בקרב אנשים שאצלם קיימים גורמים אטיולוגיים "אמיתיים", כמו עישון ושתיית אלכוהול.
קליניקה
מבחינה אנטומית חלל הפה כולל את החך הקשה, רצפת הפה, החניכיים ו/או הרכסים מחוסרי השיניים, ריריות הלחיים וכן את החלק הדיבורי, הנייד, של הלשון [שני השלישים הקדמיים מקצה הלשון ועד למענית הסופית (Sulcus terminalis)]. הלוע התחתון נמצא בחלקו האחורי של חלל הפה, והוא כולל את השליש האחורי (או הבסיס) של הלשון הלא נייד, את שקד האף (Pharyngeal tonsil), החך הרך והשקדים.
חולים בעלי גידולים קטנים יכולים להציג סימנים ותסמינים קלים בלבד, אם בכלל, ומכאן החשיבות של בדיקה גופנית יסודית של חלל הפה, בייחוד על רקע של עישון ושל צריכת אלכוהול. סרטן הפה עלול להופיע – במקרים מסוימים ובשלבים המוקדמים – ככתם אדום (אריטרופלקיה, Erythroplakia), ככתם אדום-לבן (אריטרולאוקופלקיה, Erythroleukoplakia) ואפילו ככתם לבן (לאוקופלקיה, Leukoplakia). אולם ברוב החולים יופיעו, בשלבים מתקדמים יותר של המחלה, צורה של נגע בולט מעל פני השטח או נגע מכויב. בשלבים אלה ילווה הגידול בכאב, בריח לא טוב מהפה, ובמקרים החמורים יותר ייתכנו אף קושי בדיבור וקושי בבליעה, דימום, ירידה במשקל ואפילו תפיחות בצוואר כעדות לגידול משני שמתנקז לבלוטות הלימפה האזוריות.
נמק, התפשטות לרקמות הסמוכות (רכות ועצמות), נצורות (Fistulae), אנמיה וכיחשון (Cachexia) יופיעו במצבים הסופניים.
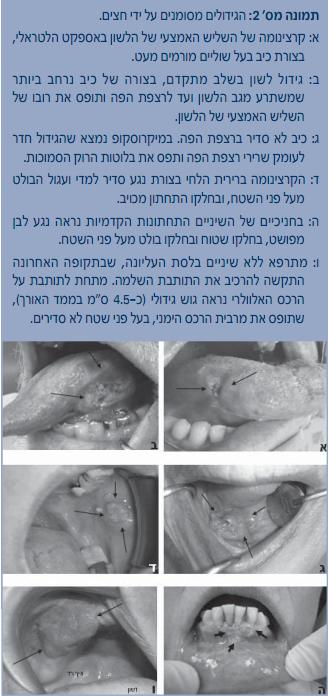
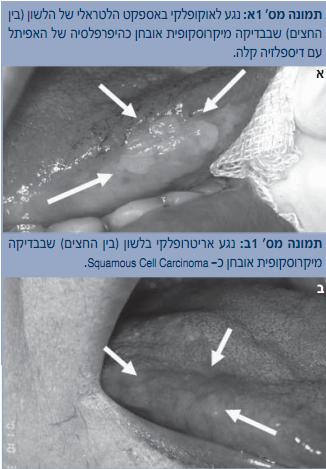
הלשון הניידת היא המקום הנפוץ ביותר להופעת סרטן הפה, ולפי רוב הסקרים כרבע עד מחצית מהמקרים מופיעים באספקט הצידי, בשליש האמצעי של הלשון[5][8]. יש לזכור שהתנהגותם של הגידולים בלשון הניידת היא אלימה מאוד ושלמרות מראה קליני "תמים" לכאורה והיעדר תלונות מצד המתרפאים – במיקרוסקופ עלולה כבר להימצא חדירה משמעותית לתוך הרקמות הסמוכות. המופע הקליני מגוון וכולל אריטרופלקיה, אריטרולאוקופלקיה, נגע בולט וכיב שלא מתרפא בעל שוליים מורמים ונוקשים (Indurative) (תמונות א ו-2ב). נדיר למצוא SCC בקצה הלשון. בגב הלשון לא יתפתח SCC, אלא אם כן קיימת מחלת רקע מערכתית, כמו עגבת (Syphilis) בשלב השלישוני. הגידול נפוץ יותר בגברים מאשר בנשים, רוב החולים הם בעשורים שישי-שמיני לחייהם, אולם חייבים להיות ערים למגמה העולמית, הקיימת גם בארץ, שגם חולים צעירים (אפילו בעשור השני לחייהם) עלולים לחלות ב-SCC של הלשון הניידת [6].
השליש האחורי של הלשון (בסיס הלשון) שייך ללוע התחתון ובו, כאמור, גידולי ה-SCC קשורים בדרך כלל לאטיולוגיה של HPV. אתר זה אינו נגיש לבדיקת ראייה באותה קלות כמו הלשון הניידת, ולכן הגידולים שמתפתחים כאן "בשקט" עלולים להתגלות רק בשלב מתקדם מאוד.
רצפת הפה היא האתר השני בנפיצותו בחלל הפה להתפתחות SCC (20%-15%) (תמונה 2ג) [5]. החולים הם בדרך כלל גברים מבוגרים. הגידול בעל מופע קליני של נגע לבן או של נגע אדום, כיב א-תסמיני שלא מתרפא, ולעתים רחוקות אף ייראה כנגע בולט פטמתי/ וורוקוזי (Papillary/verrucous). בשלבים מתקדמים יותר יתלוננו החולים על חוסר נוחות, ואם הנגע מפושט וחודר לתוך הלשון עלולה להיפגע תנועתיות הלשון.
מקרי ה-SCC ברירית הלחיים, בחניכיים וברכסים מחוסרי השיניים מהווים, בכל אחד מהאתרים הללו, כ-10% מכלל המקרים ואופייניים לגברים בעשור השביעי לחייהם [5]. המופע הקליני כולל נגע לבן, כיב שאינו מתרפא בעל שוליים מורמים ונוקשים, או נגע בולט בעל חזות וורוקוזית (תמונות 2ד-2ו). בחניכיים הגידול יכול לחקות קלינית נגעים תגובתיים, בעיקר אם הוא מופיע ליד שיניים בעלות בעיות חניכיים או בעלות שחזורים (סתימות, כתרים) לא תקינים. ברכסים מחוסרי שיניים הגידול עלול להפריע להרכבת שיניים תותבות. בבדיקה פיזיקלית של מתרפא המרכיב תותבות, יש לבדוק כשגרה את מצב הריריות תחתיהן.
גידולי SCC של החך מופיעים בחך הקשה, השייך אנטומית לחלל הפה, ובחך הרך, ששייך ללוע תחתון. בחך הקשה ה-SCC נדירה יחסית בעולם המערבי, אך נפוצה בהודו, שבה יש הרגל של עישון הפוך (Reverse smoking) בעיקר בקרב נשים, כך שהעשן והחום של הסיגריה באים במגע מסיבי עם רירית החך הקשה[3][5][8]. גידולי SCC נפוצים יחסית בחך הרך ומהווים למעשה חטיבה אחת עם ה-SCC של קשתות החיך-לוע (Palatopharyngeal arches) ושל השקדים.
אבחנה
בדיקה של חלל הפה למציאת נגעים חשודים צריכה להפוך לשגרה, כחלק מהבדיקה הגופנית של המתרפאים הפוקדים את המרפאות של רופאי המשפחה. חולים בעלי גידולים קטנים יכולים להציג סימנים ותסמינים קלים בלבד, אם בכלל, ומכאן החשיבות של בדיקה גופנית יסודית של חלל הפה, בייחוד על רקע של עישון ושל צריכת אלכוהול. עלות ההסתכלות נמוכה לאין שיעור מאשר עלות כל בדיקות האבחנה המוקדמת הנהוגות היום, כגון ממוגרפיות וקולונוסקופיות, שבהן משקיעים משאבים כספיים עצומים – לא רק לשם עצם ביצוען, אלא גם לשם פרסום עצום בכל אמצעי התקשורת. עם הימצאותו של נגע חשוד יש להפנות מיד את המתרפאים למומחים ברפואת הפה ו/או בכירורגיית פה ולסתות, לביצוע אבחנה בהקדם האפשרי.
הנגעים העיקריים שיכולים להיחשב כבעלי יכולת להתמרה ממאירה הם כתמים לבנים מסוג לאוקופלקיה, כתמים אדומים מסוג אריתרופלקיה וכתמים מעורבים לבנים ואדומים מסוג אריתרולאוקופלקיה. כמו כן, מחלת העור ילפת שטוחה (Lichen planus) – מחלה עור וריריות כרונית על רקע אוטואימוני (Autoimmune), אשר יכולה להתבטא רק בריריות חלל הפה, ילפת שטוחה של הפה (OLP, Oral Lichen Planus) קשורה במידה מסוימת לסרטן חלל הפה.
לאוקופלקיה היא אבחנה קלינית בלבד והיא מוגדרת ככתם לבן ברירית הפה, שאינו מתקלף ואינו מתאים קלינית לשום מצב ולשום מחלה אחרים (תמונה מס' 1א'). הגורמים האטיולוגיים ללאוקופלקיה הם הגורמים לסרטן הפה, אך יש לציין שבמקרים לא מעטים מדובר בלאוקופלקיה עלומה (Idiopathic). המראה הקליני אינו משקף את הממצאים המיקרוסקופיים של הלאוקופלקיה, אשר יכולים להיות בטווח שבין שגשוג שפיר ובין SCC. לכן ביופסיה של נגע לאוקופלקי הכרחית לאבחנה מדויקת של טיב הנגע. ההערכה היא שכ-90% מהלאוקופלקיות הן שפירות ולא יעברו התמרה, 5% יאובחנו כ-SCC כבר בעת הביופסיה הראשונה, וב-5% הנותרים, שברמת המיקרוסקופ מאובחנים שינויים דיספלסטיים (Dysplastic) בדרגה זו או אחרת, קיים סיכוי קטן להתמרה ממאירה במשך הזמן. חלל הפה אינו אחיד מבחינת הסיכון של הלאוקופלקיות לעבור התמרה ורצפת הפה היא האתר בעל הסיכון הגבוה ביותר לכך מכל אתרי הפה, בעיקר בנשים ללא עבר של עישון[5]. הטיפול בלאוקופלקיות כולל בראש ובראשונה הרחקת הגורם האטיולוגי (אם יש) ותלוי באבחנה מיקרוסקופית: אם הנגע שפיר אך קלינית לא הוצא בשלמותו (ייתכן בשל גודלו או בשל מיקומו הבעייתי), יש לעקוב אחריו מקרוב ולשקול ביופסיה נוספת כשחל שינוי מחשיד. אם חלים שינויים דיספלסטיים קלים יש להמליץ על הוצאת הנגע כולו; אם חלים שינויים דיספלסטיים בינוניים עד קשים, הוצאת הנגע הכרחית; אם תתגלה מיקרוסקופית SCC בנגע לאוקופלקי, יטופל החולה לפי הנוהל האונקולוגי המקובל.
יש לזכור שלמרות הטיפול הכירורגי, הלאוקופלקיה עלולה לחזור ואין בידינו כרגע סמנים מולקולריים או סמנים אחרים אשר ינבאו איזה נגע יחזור ואיזה יעבור התמרה ממאירה.
האריטרופלקיה היא "בן הזוג" האדום של הלאוקופלקיה. היא נגע קליני שנראה ככתם אדום על פני הריריות (תמונה מס' 1ב). לרוב, בבדיקה מיקרוסקופית, בכמחצית מהנגעים תימצא דיספלזיה בינונית או חמורה ובמחצית האחרת תימצא SCC. הגורמים האטיולוגיים דומים לאלה שהוזכרו ל-SCC. אריטרופלקיות שכיחות פחות מלאוקופלקיות. רצפת הפה, צדי הלשון ורירית הרכסים שמאחורי שיני הבינה הם האתרים בעלי הסיכון הגבוה ביותר בפה להתמרה. הטיפול מחייב הוצאה ניתוחית ומעקב צמוד, אם כי הדבר אינו ימנע חזרה של הנגעים[5][8].
ילפת שטוחה של הפה יכולה להתבטא בחלל הפה בצורה של קפלים או רובדים או לחלופין בצורת נגעים חשופים (Erosive)/ מכויבים [5][8]. הנגעים בילפת שטוחה של הפה הם דו-צדדיים, מרובים או מפושטים. יש מחקרים קליניקו-פתולוגיים אשר מעריכים את הסיכון להתמרה בנגעי ילפת שטוחה של הפה בטווח של 5%-0%, אם כי בספרות הדבר עדיין נתון במחלוקת[3][5][8]. עד שתושג הסכמה כללית לגבי סוגיה זו, מוסכם שיש לעקוב קלינית אחרי חולים בעלי ילפת שטוחה של הפה כל שישה חודשים, או מוקדם יותר אם חל שינוי בתמונה הקלינית של הנגעים.
הלשון הניידת היא המקום הנפוץ ביותר להופעת סרטן הפה. לפי רוב הסקרים כרבע עד מחצית מהמקרים מופיעים באספקט הצידי, בשליש האמצעי של הלשון[5][8]. אזור זה ניתן לבדיקה גופנית בכל מתרפא ברמת ההסתכלות הפשוטה. מומלץ לבצע זאת כשגרה. ברגע שמתעורר חשד כלשהו יש להפנות במהרה את המתרפא למומחים המתאימים, ברפואת הפה ו/או בכירורגיה פה ולסתות.
לעתים חל עיכוב מצער באבחנה של סרטן הלשון בגלל אבחנה מוטעית של "אפטה". יש לזכור שכיב בלשון ולמעשה בכל אתר אחר בריריות חלל הפה, שלא מתרפא מעבר לתקופה סבירה של שבועיים (לאחר שהורחקה אפשרות של גורם מגרה מקומי) יש להפנות בהקדם לביופסיה אבחנתית.
טיפול
הטיפול הניתוחי בגידולי SCC של חלל הפה מבוסס על מיקומו של הגידול הראשוני ועל השלב הקליני של החולה, שמבוצע על פי שיטת TNM (Tumor, Nodes, Metastasis), שנהוגה במרבית הגידולים הממאירים המוצקים בגופנו (תוך התאמות הדרושות לכל גידול ולכל אתר) [5][8].
כריתה של הגידול הראשוני בחלל הפה וכן הוצאה של קשריות הלימפה האזוריות בצוואר המנקזות את הגידול [פרוצדורה הנקראת בתירה צווארית (Neck dissection)] מותאמות אישית לכל חולה. הכריתה של הגידול הראשוני כוללת שולי ביטחון של רקמה "בריאה" של 1.0 ס"מ עד 1.5 ס"מ מעבר לגבולות הקליניים של הגידול (במאמר מוסגר ייאמר שממדיו הקטנים של חלל הפה ו/או הקרבה למבנים חיוניים לא יאפשרו תמיד להשיג שולי ביטחון כאלה ומכאן עלול למעשה לנבוע כישלון בטיפול, שמוכתב על ידי האנטומיה של המקום). גידולי SCC בלשון מטופלים בכריתה נרחבת, הנקראת כריתת לשון חלקית (Partial/hemi-glossectomy).
השימוש בטיפול קרינתי חיצוני משלים לאחר הכריתה תלוי במידה רבה בממצאים המיקרוסקופיים של עומק החדירה, במעורבות של שולי הכריתה, בנוכחות גידול גרורתי, בחדירה לתוך עצמות הלסתות, בחדירה לסביבת סיבי העצבים, בנוכחות מצבים של תחלואה נילווית-למשל דיכוי חיסוני אצל חולי איידס ומושתלי מח עצם או איברים אחרים.
שיטות ההקרנה היום השתכללו ובחלק מהמרכזים הרפואיים, כולל בארץ, נהוג לתת את ההקרנה בשיטה של חלוקת מנת הקרינה למקטעים לפי לוח זמנים (Fractionation schedules), שהעיקרון בה הוא מתן קרינה במינון נמוך בכל מקטע, כך שאפשר להעלות את סך מנת הקרינה ללא החמרה בתופעות הלוואי המאוחרות [5]. כדי לא להאריך את משך טיפול הקרינה נוהגים לתת כמה מקטעים בכל יום. שיפור נוסף הוא מתן הקרינה בצורת האצה (Acceleration), זאת אומרת מתן מנות קרינה מרובות כמעט במינון של מקטע רגיל, אבל במשך זמן קצר יותר לעומת משך הטיפול המקובל, זאת במטרה למנוע את יכולת השתקמותם של תאי הסרטן השאריים. במחקרים שבוצעו בשנים האחרונות נראה שבעזרת מתן הקרינה בשיטות המשוכללות, הישרדות החולים עלתה בכ-3% לעומת מתן הקרינה בשיטות הרגילות [5]. כמו כן, יש להזכיר שהטיפול במקטעים עשוי להקטין את תופעת הלוואי המיידית של ההקרנות – דלקת ריריות מושרית קרינה (Radiation-induced mucositis) [5][8].
נושא חשוב שיש להתייחס אליו בחולים אלה, הוא תופעות הלוואי המאוחרות של הקרינה, כמו יובש פה בעקבות פגיעה לא הפיכה בבלוטות הרוק, זיהומים תכופים בקנדידה, עששת נרחבת ופגיעה בעצמות הלסת –נמק עצם מושרה קרינה (Osteoradionecrosis)[9], מאמר סקירה בנושא תופעות הלוואי המאוחרות של טיפול קרינתי וכימי).
טיפול כימי אינו טיפול בחירה ב-SCC של חלל הפה. במקרים של גידולים בשלבים מתקדמים מאוד, כאשר הטיפול הניתוחי אינו אפשרי, אפשר לתת טיפול קרינתי ו/או כימי להקלה על תסמינים (Paliation) ולא למטרות ריפוי [5][8].
טיפולים עתידיים
כאמור, שיעורי ההישרדות ל-5 שנים של חולים בעלי סרטן חלל הפה נמוכים, כ-50% במשך 4 העשורים האחרונים, אף שבמהלך התקופה האמורה חל שיפור ניכר בהישרדותם של חולים בעלי גידולים ממאירים מוצקים באזורים אחרים בגוף, כתוצאה מהתקדמות בשיטות אבחנה ובדרכי הטיפול. לנוכח זאת, מובן הצורך במחקר בסיסי נוסף לשם מציאת דרכי טיפול חדשות בסרטן הפה. צעדים מחקריים ראשוניים נעשים בכיוון זה ונראה שהטיפול בסרטן הפה ישלב פעולות נגד תאי הגידול ונגד מרכיבים ברקמה התומכת שבסביבת הגידול (מיקרו-סביבה). שילוב זה עשוי להוביל לעלייה בשיעורי ההישרדות של חולים במחלות אלה.
לפני כ-20 שנה חל שינוי במחקר על גידולים ממאירים מוצקים, ובמקביל לאפיון תאי הגידול הוסבה תשומת לב החוקרים לרקמה הסובבת את הגידול. רקמה זאת נקראת המיקרו-סביבה של הגידול (TME, Tumor Microenvironment). היא כוללת מרכיבים תאיים ומרכיבים שאינם תאיים. המרכיבים התאיים הם תאי רקמת החיבור, תאי הציפוי של כלי הדם (תאי אנדותל), תאי דלקת למיניהם ותאי גזע. המרכיבים שאינם תאיים הם סיבי הקולגן של רקמת החיבור התומכת וכן גורמים אנזימטים, גורמי גדילה ומתווכי דלקת רבים ומגוונים.
תחילה סברו כי יצירתה של רקמת חיבור עשירה בסיבי קולגן היא תגובת מגננה של הגוף, שמיועדת ליצור מעין קופסית סביב הגידול כדי לעצור את התקדמותו. אולם, בהמשך הוכח ההפך והיום ידוע שהגידול נעזר בסיבי הקולגן המשמשים לו כמעין מסילות שלאורכן הוא מתקדם. עוד התברר כי בהשפעת מולקולות ממקור של הגידול, תאי רקמת החיבור שמייצרים את סיבי הקולגן ומכונים תאי סיב הקשורים לסרטן (CAFs, Cancer Associated Fibroblasts), מייצרים ומפרישים לסביבה גורמים רבים שהגידול מנצל להתרבות, לחדירה ולהתפשטות.
התברר שדבר דומה קורה בתאי התסנין הדלקתי: תחילה רווחה ההנחה שהתסנין הדלקתי משקף את תגובת מערכת החיסון נגד הגידול. אולם, מאוחר יותר הובהר שבאמצעות דו-שיח של מולקולות המתווכות בין הגידול לתסנין הדלקתי, חלק מתאי התסנין הדלקתי, כולל גורמי הגדילה שלו, מגויסים "לטובת" שגשוג הגידול והתקדמותו.
לנוכח האמור לעיל, הוחלט במסגרת המחקר שנערך במחלקה לפתולוגיה אוראלית ולרפואת הפה בבית הספר לרפואת שיניים באוניברסיטת תל אביב לבדוק אם יש מקום ליישם את הממצאים הכללים לגבי המיקרו-סביבה של הגידול גם בסרטן חלל הפה. ראשית נבדקה נוכחותם של תאים מסוג CAFs במערכת של חיות מעבדה (חולדות). החיות נחשפו לחומר מסרטן במי השתייה. החומר ניתן בריכוז נמוך מאוד לתקופות זמן הולכות ומתארכות, כהדמיה למה שקורה אצל בני האדם בתהליך היווצרות הגידול הממאיר בחלל הפה. בחתכים מיקרוסקופיים שהוכנו מהלשונות של חיות המעבדה נמצאו תאים מסוג CAFs רק סביב גידולי ה-SCC, אך לא בנגעים שלא עברו התמרה ממאירה [10]. מהמערכת הניסויית בחיות הוסק שיש קשר ברור בין הופעת הגידול הממאיר בלשון לבין הופעת ה-CAFs ומכאן ואילך, המחקר התרכז ב-SCC של הלשון הניידת בחולים. בדומה לחיות, גם בחולים נמצא שה-CAFs אופייניים למיקרו-סביבה של הגידול הממאיר והם אינם חלק מרקמת החיבור המלווה נגעים טרום-ממאירים, אפילו לא נגעים בעלי דיספלזיה קשה [11]. בשלב הבא נבדק הקשר בין צפיפות ה-CAFs לבין חזרת המחלה והישרדות החולים בעלי סרטן הלשון ונמצא שכאשר המיקרו-סביבה של הגידולים עשירה ב-CAFs, יש סיכוי גבוה פי 4 לחזרת המחלה והסיכוי היחודי למות מהמחלה עולה אף הוא פי 4 [12].
ממצא נפוץ במיקרו-סביבה של גידולי הלשון הוא תאי הדלקת. כאשר אופיינו תאי הדלקת שבמיקרו-סביבה של גידולי הלשון, נמצא שכמות התאים שתפקידם לתקוף את תאי הגידול ,למשל לימפוציטים ציטוטוקסיים (Cytotoxic lymphocyte), הייתה זעומה, אך מספרם של תאי דלקת מסוגים מסוימים שידוע שהם מנוּוטים על ידי הגידול ופועליו למענו, היה גבוה באופן ניכר. כמו כן נמצא שנוכחותם של תאים אלה מעלה את הסיכוי לחזרת הגידול פי 3 (החומר בשלבי הכנה לפרסום). לנוכח הממצאים במחלקה הנ"ל ומעבודות נוספות מהספרות העכשווית [13][14] החלה להתברר התמונה האמיתית של הדו-שיח המגוון שבין הגידול לבין מרכיבי המיקרו-סביבה של הגידול ועל התמיכה שהמיקרו-סביבה מעניקה לגידול. המסקנה היא בלתי נמנעת: אין די בטיפול שניתן היום לחולים בעלי סרטן חלל הפה בכלל ובעלי סרטן הלשון בפרט, כי הוא מכוון אך ורק נגד הגידול עצמו. בעתיד יוגדרו גורמי המפתח בדו-שיח שבין הגידול למיקרו-סביבה שלו ויתוכננו טיפולים כדי לקטוע אותו. שילוב של טיפול נגד תאי הגידול ונגד מרכיבי מפתח מהמיקרו-סביבה של הגידול יוביל לשיפור בפרוגנוזה של החולים בעלי סרטן הפה.
פרוגנוזה
בדומה לגידולים ממאירים מוצקים אחרים, גם הפרוגנוזה של SCC בחלל הפה תלויה בשלב הקליני ובממצאים המיקרוסקופיים. הנטייה היום היא לתת משקל גבוה יותר לקליניקה. נתונים נוספים כמו גיל החולה, מצב בריאותו הכללי, מצב הפעילות של מערכת החיסון שלו וחוסנו הנפשי – כל אלה עשויים להשפיע על הפרוגנוזה.
אף שבמהלך עשרות השנים האחרונות הושקע מאמץ אינסופי במחקר המולקולרי, עדיין לא זוהו סמנים בתוך תאי הגידול עצמם שביכולתם לנבא את ההתנהגות של SCC של חלל הפה, או את הפרוגנוזה של החולים.
מבחינת הקליניקה, הסמן הפרוגנוסטי החשוב ביותר היום הוא הימצאות גידול גרורתי: שיעורי ההישרדות של SCC של חלל הפה עומדים על כ-50% ל-5 שנים. במקרה של גידול קטן ומקומי שיעורי ההישרדות יכולים לנוע סביב 70%-60%, אך נוכחותו של גידול גרורתי בקשריות הלימפה הצוואריות מורידה את שיעורי ההישרדות באופן חד ל-25% [3][5][8].
לסיכום, יש להדגיש את העובדה שלמרות טיפול ניתוחי מטיל מום וטיפול קרינתי על סיבוכיו הקשים, שיעורי ההישרדות ל-5 שנים של חולים עם סרטן חלל הפה נמוכים. הם עומדים על כ-50% ולא השתנו בארבעת העשורים האחרונים. היום ידוע שאין די בטיפול המקובל, המכוון נגד הגידול בלבד, ויש לשלבו עם טיפולים נגד מרכיבים מסביבת הגידול כדי לשפר את אחוזי ההישרדות של החולים.
ביבליוגרפיה
- Bello IO, Vered M, Dayan D, et al. Cancer-associated fibroblasts, a parameter of the tumor microenvironment, overcomes carcinoma-associated parameters in the prognosis of patients with mobile tongue cancer. Oral Oncol 2011; 47: 33-38
- ↑ 1.0 1.1 Jemal A, Siegel R, Xu J, et al. Cancer Statistics, 2010. CA Cancer J Clin 2010; 60: 277–300
- ↑ 2.0 2.1 2.2 Rethman MP, Carpenter W, Cohen EE, et al. Evidence-based clinical recommendations regarding screening for oral squamous cell carcinoma. J Am Dent Assoc 2010; 141; 509-520
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 3.6 3.7 3.8 3.9 World Health Organization Classification of Tumours. Pathology and Genetics. Head and Neck Tumours. Barnes L, Eveson JW, Reichart P, Sidransky D (eds). IARC Press, Lyon, 2005
- ↑ Bello IO, Soini Y, Salo T. Prognostic evaluation of oral tongue cancer: means, markers and perspectives (II). Oral Oncol 2010;46:636-643.
- ↑ 5.00 5.01 5.02 5.03 5.04 5.05 5.06 5.07 5.08 5.09 5.10 5.11 5.12 5.13 5.14 5.15 5.16 5.17 5.18 Regezi JA, Sciubba JJ, Jordan RC. Oral Pathology. Clinical Pathologic Correlations. Saunders-Elsevier, China, 2008
- ↑ 6.0 6.1 Müller S, Pan Y, Li R, et al. Changing trends in oral squamous cell carcinoma with particular reference to young patients: 1971–2006. The Emory University experience. Head Neck Pathol 2008; 2 :60-66
- ↑ Zini A, Czerninski R, Sgan-Cohen HD. Oral cancer over four decades: epidemiology, trends, histology, and survival by anatomical sites. J. Oral Pathol Med 2010;39:299-305
- ↑ 8.00 8.01 8.02 8.03 8.04 8.05 8.06 8.07 8.08 8.09 8.10 Neville B, Damm DD, Allen CM, et al. Oral and Maxillofacial Pathology. Saunders-Elsevier, China, 2008
- ↑ National Cancer Institute. Oral complications of chemotherapy and head/neck radiation. Available at: http://www.cancer.gov/cancertopics/pdq/supportivecare/oralcomplications/HealthProfessional/AllPages (Last Modified on March 24, 2011)
- ↑ Vered M, Allon I, Buchner A, Dayan D. Stromal myofibroblasts and malignant transformation in a 4NQO rat tongue carcinogenesis model. Oral Oncol 2007; 43:999-1006
- ↑ Vered M, Allon I, Buchner A, Dayan D. Stromal myofibroblasts accompany modifications in the epithelial phenotype of tongue dysplastic and malignant lesions. Cancer Microenv 2009; 2: 49-57
- ↑ Vered M, Dobriyan A, Dayan D, et al. Tumor-host histopathologic variables, stromal myofibroblasts and risk score, are significantly associated with recurrent disease in tongue cancer. Cancer Sci 2010; 101: 274-80
- ↑ Marsh D, Suchak K, Moutasim KA, et al. Stromal features are predictive of disease mortality in oral cancer patients. J Pathol 2011; 223: 470-481
- ↑ Mantovani A, Allavena P, Sica A, Balkwill F. Cancer-related inflammation. Nature 2008; 454: 436-444
קישורים חיצוניים
- סרטן חלל הפה – Oral cancer: כאן ועכשיו, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר מרילנה ורד, מרצה בכירה בפתולוגיה אורלית המחלקה לפתולוגיה אורלית ולרפואת הפה, בית הספר לרפואת שיניים, אוניברסיטת תל אביב
תודות
לפרופ' עמוס בוכנר, שניהל את המחלקה לפתולוגיה אורלית ולרפואת הפה, בית הספר לרפואת שיניים, אוניברסיטת תל אביב במשך כ-3 עשורים, ושהארגון המופתי שלו אפשר את איסוף החומר ההיסטופתולוגי הייחודי שקיים במחלקה.
לפרופ' דן דיין, המחלקה לפתולוגיה אורלית ולרפואת הפה, בית הספר לרפואת שיניים, אוניברסיטת תל אביב, שעם פרופ' בוכנר היה מעמודי הטווח של המחלקה, וכן יזם ומוביל את המחקר על ה-tumor microenvironment בסרטן חלל הפה.
לפרופ' שלמה טייכר, מנהל המחלקה לכירורגיה פה ולסתות, המרכז הרפואי שיבא, תל השומר, על שיתוף הפעולה שלו ושל צוות מחלקתו, מתוך הבנת החשיבות של תחום הפתולוגיה האורלית כחלק בלתי נפרד מהכירורגיה של ראש צוואר.
לד"ר רן יהלום, סגן מנהל המחלקה לכירורגיה פה ולסתות, המרכז הרפואי שיבא, תל השומר, על החומר הקליני והתמונות.
לד"ר אנה שניידרמן-שפירו, המחלקה לפתולוגיה אורלית ולרפואת הפה, בית הספר לרפואת שיניים, אוניברסיטת תל אביב, על סקירת המקרים שבארכיון המחלקה.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק