סרטן שד גרורתי - טיפולים חדשניים - Metastatic breast cancer - new treatments
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| סרטן שד גרורתי - טיפולים חדשניים | ||
|---|---|---|
| Metastatic breast cancer - new treatments | ||
| שמות נוספים | סרטן שד גרורתי - טיפולים ביולוגיים וכימיים חדשניים לטיפול | |
| יוצר הערך | ד"ר לריסה ריבו | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן השד
סרטו השד היא המחלה הממארת השכיחה ביותר בישראל ובעולם המערבי. כ-4,000 נשים מאובחנות מדי שנה כחולות בסרטן השד בישראל. אחת מכל שמונה נשים בישראל עלולה לחלות בסרטן השד וככל שהמחלה מאובחנת בשלבים המוקדמים, הסיכויים לריפוי גבוהים. מסתמן כי מספר הנשים אשר מחלימות מסרטן השד עולה בהתמדה בזכות הגילוי המוקדם ובזכות שיפור דרכי הטיפול והגברת המודעות הנרחבת בארץ. במדינות מפותחות, רוב מקרי סרטן השד מתגלים בשלבים מוקדמים. בכ-5% מהנשים מופיעה בגילוי הראשוני מחלה מפושטת (פיזור מרוחק של מחלה).
קיימים סוגים שונים של סרטן השד. במאמר זה נתרכז בסרטן שד גרורתי עם ביטוי יתר של HER2.
אחת מחמש נשים החולות בסרטן שד, תחלנה בסוג מסוים הנקרא סרטן שד מסוג HER2 חיובי. המדובר בסרטן מסוג אגרסיבי. אבחון HER2 נעשה בשלב הביופסיה הנלקחת מהגידול. לאבחון השפעה מכרעת על סוג הטיפול שיינתן, על איכות חיי החולות ועל הסיכוי להארכת חיים.
HER2 -Human Epidermal Growth Factor Receptor הוא קולטן המצוי באופן נורמלי בתא. ל-HER2 תפקיד חשוב בבקרה על גדילתם וחלוקתם של תאים תקינים. בתא נורמלי ניתן למצוא כמויות קטנות יחסית של קולטן HER2. נמצא כי בגידולים סרטניים מסוימים יש ביטוי יתר, כלומר רמות גבוהות מהתקין של HER2 בתאים (מוגדר בבדיקה כ- HER2 חיובי), שגורמות לגדילה בלתי מבוקרת של התאים ולהתפתחות מואצת של תאים סרטניים. כאמור, נשים חולות בסרטן שד המאובחנות עם רמות גבוהות של HER2, סובלות ממחלה אלימה במיוחד של סרטן שד עם פרוגנוזה גרועה וסיכוי גדול לפיתוח גרורות מרוחקות. בשנים האחרונות פותחו טיפולים חדשים (targeted therapy, טיפול מכוון מטרה) הקשורים לביטוי יתר של HER2.
Herceptin=Trastuzumab - הרספטין הנו נוגדן חד שבטי מואנש, אשר מכוון באופן ספציפי נגד הקולטן HER2 ומהווה את בסיס הטיפול לנשים עם סרטן שד מסוג HER2 חיובי. התרופה ניתנת בהזרקה תוך ורידית. הרםפטין פועל בארבעה מנגנוני פעולה שונים:
- עיכוב שגשוג התא דרך קולטן HER2.
- עיכוב יצירת כלי דם חדשים (אנגיוגנזה), המוביל להפחתה קוטר ונפח כלי-הדם של הגידול, ירידה בצפיפות כלי-הדם סביב הגידול והפחתה במיגרציית תאי האנדותל.
- אקטיבציה של המערכת האוטואימונית והפעלתה כנגד התאים הסרטניים (מגביר גיוס תאי מערכת החיסון להרג התא הסרטני).
- מניעת נשירת החלק החוץ-תאי של קולטן HER2 והיווצרות היחידה הפוטנטית p95.
השימוש בהרספטין בסרטן שד גרורתי מקובל מזה שנים רבות. טיפול בהרספטין בשילוב כימותרפיה יארד את חיי המטופלות ויעניק להן כ-9 חודשי חיים נוספים ביחס לטיפול המקובל בכימותרפיה בלבד. בסרטן שד משלב מוקדם - לאחר ניתוח כריתת הגידול - נהוג להוסיף טיפול מונע (אדג׳ובנטי). במחקר שפורסם בכתב העת The New England journal of Medicine ב-2011 נבדקה תוספת מתן הרספטין למשך שנה לאחר סיום הטיפול הכימי המונע. במחקר השתתפו 3,222 נשים עם סרטן שד משלב מוקדם מסוג HER2 חיובי אשר עברו ניתוח לכריתת הגדול הראשוני. החולות טופלו בכימותרפיה או בכימותרפיה בתוספת הרספטין. הוכח כי מתן הרספטין לשנה משפר את ההישרדות הכללית והזמן עד לחזרת המחלה לעומת טיפול כימותרפי בלבד. הטיפול האדגובנטי בהרספטין לשנה הפך לסטנדרט גם לחולות עם סרטן שד HER2 חיובי משלב מוקדם.
לאחרונה נמצאת בפיתוח ובתהליכי רישום גם צורת מתן חדשה להרספטין -הרספטין תת-עורי. מדובר באותה תרופה (trastuzumab) אם כי שילובו עם אנזים היאלורונידז רקומביננטי מאפשר מתן התרופה בזריקה תת-עורית. אנזים זה מחקה את הפעילות של אנזים ההיאלורונידז הפועל באופן טבעי בגוף, ומפרק באופן זמני והפיך את החומצה ההיאלורונית, המהווה חלק מהשכבה התת-עורית (ביחד עם סיבי הקולגן). טכנולוגיה זו מאפשרת מתן נפח גדול יותר של נוזלים - ובמקרה של ההרספטין מתן של 5 מ"ל - בזריקה תת עורית. ההרספטין התת-עורי ניתן במינון קבוע של 600 מ"ג, ללא צורך במנת העמסה, ללא צורך בהכנה רוקחית, ומשך הזרקה הינו ב-5 דקות. התרופה נבדקה במחקר פאזה שלישית בשילוב עם טיפול כימי והראתה יעילות דומה לטיפול תוך ורידי.
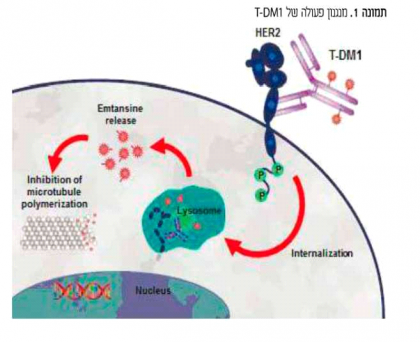
T-DM1
T-DM1 היא מולקולה חדשה מסוג "נוגדן מצומד כימותרפיה" ADC -(antibody drug conjugate), המיועדת לטיפול בחולות עם סרטן שד חיובי ל-HER2. ה-ADCs שייכים לקבוצה תרפויטית חדשה המשלבת תרופה ציטוטוקסית הקשורה בקשר קוולנטי לנוגדן מכוון מטרה. בזכות מבנה זה, ה- ADCs מפחיתים חשיפה מערכתית לציטוטוקסיקה ומשפרים את האינדקס התרפויטי של התרופה.
T-DM1 מורכבת מטרסטוזומאב (Trastuzumab), מקשר יציב ייחודי (MCC) וציטוטוקסיקה פוטנטיה בשם DM1. כהוצאה ממנגנון פעולתה הייחודי, T-DM1 מאפשרת שחרור תוך תאי סלקטיבי של כימותרפיה פוטנטית בתאים סרטניים עם ביטוי יתר של חלבון HER2. היקשרות T-DM1 לקולטן HER2 על פני שטח תא הגידול (בעזרת המרכיב טרםטוזומאב) מובילה לבליעה תאית (אנדוציטוזה) של הקומפלקס T-DM1-HER2 receptor אל תוך תא הגידול. עם השלמת תהליך זה הקומפלקס עובר פירוק בליזוזום תוך שחרור תוך תאי של המטבוליט הציטוטקסי (תמונה 1).
התרופה נבדקה במחקר (EMILIA) אשר כלל 980 נשים עם מחלה גרורתית וביטוי יתר של HER2. החולות נחשפו קודם לטיפול בהרספטין ומחלתן התקדמה. החולות חולקו באופן אקראי ל-2 קבוצות:
- קבוצה אחת קיבלה טיפול ב-T-DM1
- הקבוצה השנייה קיבלה טיפול LAPATINIB+XELODA (טיפול כימותרפי מקובל).
תוצאות המחקר הוכיחו הבדל משמעותי סטטיסטית משך הזמן עד התקדמות המחלה בקבוצה שקיבלה טיפול T-DMI היה ארוך יותר לעומת קבוצת הביקורת (9.6 חד' לעומת 6.4 חד' בהתאמה). כמו כן יותר חולות בקבוצה של T-DMI השיגו רמיסיה של המחלה (43.6% לעומת 30.8%). ההישרדות החציונית הכללית בקבוצת T-DMI הייתה 30.9 חודשים לעומת קבוצת הביקורת: 25.1 חודשים.
(Perjeta (Pertuzumab
התרופה (Perjeta (pertuzumab הינה נוגדן חד שיבטי מואנש הנקשר לקולטן HER2, והיא הראשונה מקבוצה חדשה של תרופות: HER2 Dimerisation inhibitors. באופן כללי, כאשר שני קולטנים ממשפחה HER-H עוברים דימריזציה, מופעלים מסלולים הוך-תאיים המובילים לפרוליפרציה של התאים הסרטניים. משפחת חלבוני HER-n מורכבת מ-4 רצפטודם טרנס-ממברנלים (מסוג Tyrosinekinase). חלבוני 1,3,4 HER הם קולטנים תלויי ליגנד: כאשר הליגנד נקשר אליהם המבנה המרחבי של הקולטן משתנה וכך מתאפשרת הדימריזציה לקולטן אחר ממשפחה n־HER. לעומת זאת, קולטן HER2-H אינו תלוי ליגנד, הוא נמצא במבנה מרחבי פתוח ותמיד זמין לעבור דימריזציה, ולכן הוא הפרטנר המועדף ליצירת דמדם עם קולטני HER האחרים(תמונה 2). Perjeta נקשרת לאתר אחר על-גבי אותו קולטן HER2, אתר ספציפי שאחראי לדמריזציה, ומונעת את היצמדותו לקולטנים אחרים ממשפחת HER-H. במנגנון זה, Perjeta מונעת, בץ היתר, אה יצירת הצמד HER2-HER3, שנמצא כצמד האונקוגני הפוטנטי ביותר בסרטן שד וכך מונעת הפעלת שני מסלולים תוך תאיים האחראים לשגשוג הגדול ולהישרדותו. עיכוב שני מסלולים אלה מביא לפגיעה בפעילותו של התא הסרטני. כמו-ק, Perjeta מגבירה גיוס תאי מערכת החיסון להרג התא הסרטני (ADCC). ^Perjeta יש מנגנון פעולה משלים להרספטץ ולמעשה טיפול משולב של שנדם מאפשר חסימה מקיפה יוהד של מסלולי האיתות התוך תאיים של משפחת HER-n ובכך דיכוי יעל יותר של הגדול הסרטני(ציור 3). Perjeta נבדקה במחקר (CLEOPATRA), המחקר כלל 808 נשים עם מחלה גרורתית וטטוי יהד של HER2, החולות לא קיבלו טיפול קודם בהרספטץ. החולות חולקו באופן אקראי ל־2 קבוצות. קטצה אחת קיבלה טיפול בהרספטין + פרטוזומב + טקםוטר וקבוצה שנייה קיבלה טיפול בהרספטין + טקסוטר. תוצאות המחקר הראו כי הזמן עד התקדמות המחלה בקבוצה שקיבלה טיפול בהרספטין + פרטהומב + טקסוטר היה ארוך יותר לעומת קבוצת הביקורת (18.5 חד לעומת 12.4 חדי). כמו כן יותר חולות בקטצה הרספטץ + פרטוזומב + טקסוטר הגיבו לטיפול (80% לעומת 70%). לגט ההישרדות הכללית עדין אין נתונים. לסיכום: הנתונים בספתת מצטעים על התקדמות בטיפולים טולוגיים נוגדי HER2 בחולות סרטן שד משלב גרורתי ומשלב מוקדם: מהן הסרפטין אדג׳ובנטי משפר שיעורי ריפוי של חלות בסרטן שד מוקדם, לגבי מחלה גרורהית - הטיפולים הביולוגיים מעלים את יעלות הטיפלים הכימותרפיים האת מבלי להוסיף רעלות
בסרטן שד גרורתי שטופלו בעבר בשני משטרי טיפול קודמים. הנשים חולקו לקבלת Haiaven או טיפול כימותרפי אחר(תרופה בודדת). תוצאות המחקר הראו כי Haiaven האריכה באופן מובהק את חייהן של המטופלות בה בהשוואה לאורך חייהן של המטופלות בקבוצה הביקורת. הטיפול ניתן רק פעמיים בלבד, ביום הראשח והשמיני, במהלך מחזור טיפול של 21 עם. מתן העירוי נמשך כ-15 דקות בלבד ואינו דורש שימוש באנטי-היסטמינים או סטרואידים. הטיפול נסבל היטב ונמצא יעיל בקוים מתקדמים של טיפול בסרטן שד גרורתי.
1. Tzahar E, Waterman H, Chen X, Levkowltz G, Karunagaran D, Lavi S, et al. A hierarchical network of interreceptor interac¬tions determines signal transduction by Neu differentiation factor/neuregulin and epidermal growth factor. Mol Cell Biol 1996;16:5276-5287.
2. Citri A, Skaria KB, Yarden Y.The deaf and the dumb: the biol-0gyofErbB-2and ErbB-3. Exp Cell Res 2003;284:54-65.
3. Clynes RA, Towers TL, Presta LG, Ravetch JV. Inhibitory Fc re¬ceptors modu late in vivo cytotoxicity against tumor targets. Nat Med 2000; 6:443-446.
4. Gennari R, Menard S, Fagnoni F, Ponchio L, Scelsi M, Tagli-abue E, Castiglioni F, Villani L, Magalotti C, Gibelli N, Oliviero B, Ballardini B, Da Prada G, Zambelli A, Costa A. Pilot study of the mechanism of action of preoperative trastuzumab in patients
IIICIMOIIIMII u■ aiiiun "i ^cuyeianvt uaiiuiuiוIOU 111 |JCHICII"
with primary operable breast tumors overexpressing HER2. Clin Cancer Res 2004; 10:5650-5655.
5. Arnould L, Gelly M, Penault-Llorca F, Benoit L, Bonnetain F, Migeon C, Cabaret V, Fermeaux V, Bertheau P, Gamier J, Jeannin JF, Coudert B. Trastuzumab-based treat¬ment of HER2-positive breast cancer: an antibody-dependent cellular cytotoxicity mechanism? J Cancer 2006; 94; 259-267.
6. Chari RV. Targeted cancer therapy: conferring specificity to cytotoxic drugs. Acc Chem Res. 2008;41:98-107.
7. Lewis Phillips GD, Li G, Dugger DL, et al. Targeting HER2-positive breast can¬cer with trastuzumab-DM1, an antibody-cytotoxic drug conjugate. Cancer Res. 2008;68:9280-9290.
8. Junttila TT, Li G, Parsons K, Phillips GL, Sliwkowski MX.Trastuzumab-DM1 (T-DMI) retains all the mechanisms of action of trastuzumab and efficiently inhibits growth of lapatinib insensitive breast cancer. Breast Cancer Res Treat. 2011;128:347-356.
9. Slamon DJ, Leyland-Jones B, Shak S, Fuchs H, Paton V, Bajamonde A, Fleming T, Eiermann W, Wolter J, Pegram M, Baselga J, Norton L, Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med. 2001 Mar 15;344(11):783-92.
1. Slamon D, Eiermann W, Robert N, Pienkowski T, Martin M, Press M, Mackey J, Glaspy J, Chan A, Pawlicki M, Pinter T, Valero V, Liu MC, Sauter G, von Minckwitz G, Visco F, See V, Buyse M, Bendahmane B, Tabah-Fisch I, Lindsay MA, Riva A, Crown J; Breast Cancer International Research Group. Adjuvant trastuzumab in HER2-positive breast cancer. N Engl J Med. 2011 Oct6;365(14]:1273-83
באופן משמעותי. טיפלים בילוגיים בשלוב עם טיפולים כימותרפיים מאריכים זדים ומשפדם איכות חיים, בחלות עם םרטץ שד &־ורתי עם ביטוי יתר של HER2.
(Haiaven (eribulin
Haiaven מבוססת על סנתוז של חומר פעל שנמצא לפני שנים בספוג ים שחור
יפני.
פיתוח התרופה מחדר לבמה תהליכים שחלקם נזנחו על יד חברות התרופות, במסגרתם נמצאו חומרים פעילים שמקורם בצמחים והפכו לתרופות. במקרה הנוכחי קיים בספוגים חומר פעל שהראה פעילות אנטי סרטניה באמצעות פעילות המונעת אה התחלקות ההא. מכיוח שכמות החומר בספוגים הייתה קטנה, החוקרים עבדו במשך שנים על מנת לייצר מולקלה סינתטית זהה למקוריח והיא זו הנמצאת כיום בתרופה.
- (Haiaven (Eribuim הינה כימותרפיה המשמשת לטיפל בסרטן שד מתקדם או גרורתי לאחר טיפול בשר משטרי טיפל אחרים שאיבדו אה האפקטיביות שלהם. יעילותה ובטיחוהה של Haiaven הודגמו במחקר בו השתתפו 762 נשים חלות
ביבליוגרפיה
קישורים חיצוניים
- הטיפול ההורמונלי בסרטן השד, TheMEDICAL
המידע שבדף זה נכתב על ידי ד"ר לריסה ריבו, רופאה בכירה, המערך האונקולוגי, המרכז הרפואי ת"א


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק