הבדלים בין גרסאות בדף "עדכונים בטיפול בסרטן שד גרורתי בישראל - 2017 - Metastatic breast cancer - treatment - updates"
| שורה 69: | שורה 69: | ||
קינאזות אלו מהוות חלק ממערך אנזימים (Enzymes), החיוניים להתקדמות חלוקת התא בין שלביו השונים (G2 ,S ,G1 ו-S). עיכוב פעילותן של קינאזות אלו, יכול להביא להיעצרות מעגל חלוקת התא ולדיכוי חלוקת תאי גידול ממאיר. קינאזות 4 ו-6 חיוניות למעבר מ-G1 ל-S; עיכוב CDK4/6 יביא לעצירת מעגל התא ב-G1, וימנע התקדמות לשלב S. פעילותן של תרופות מדכאות CDK4/6 מהווה הוכחת עיקרון זה (Proof of concept). | קינאזות אלו מהוות חלק ממערך אנזימים (Enzymes), החיוניים להתקדמות חלוקת התא בין שלביו השונים (G2 ,S ,G1 ו-S). עיכוב פעילותן של קינאזות אלו, יכול להביא להיעצרות מעגל חלוקת התא ולדיכוי חלוקת תאי גידול ממאיר. קינאזות 4 ו-6 חיוניות למעבר מ-G1 ל-S; עיכוב CDK4/6 יביא לעצירת מעגל התא ב-G1, וימנע התקדמות לשלב S. פעילותן של תרופות מדכאות CDK4/6 מהווה הוכחת עיקרון זה (Proof of concept). | ||
| − | שלוש תרופות המעכבות CDK4/6 נמצאות בשלבי מחקר מתקדמים:{{כ}} [http://www.wikitrufot.org.il/index.php?button=&search=Palbociclib&title=%D7%9E%D7%99%D7%95%D7%97%D7%93%3A%D7%97%D7%99%D7%A4%D7%95%D7%A9 Palbociclib] {{כ}}([[t:Ibrance|Ibrance]]),{{כ}} [[ריבוציקליב|Ribociclib]] {{כ}}([[Kisqali]]) ו-{{כ}} [[Abemaciclib|Abemaciclib{{כ}}{{הערה|שם=הערה6|Bilgin, B., et al., A current and comprehensive review of cyclin-dependent kinase inhibitors for the treatment of metastatic breast cancer. Curr Med Res Opin, 2017.: 33(9): p. 1559-1569.}}]][[עדכונים בטיפול בסרטן שד גרורתי בישראל - 2017 - Metastatic breast cancer - treatment - updates#cite note-.D7.94.D7.A2.D7.A8.D7.946-6|<span class="mw-reflink-text">[6]</span>]][עדכונים_בטיפול_בסרטן_שד_גרורתי_בישראל_-_2017_-_Metastatic_breast_cancer_-_treatment_-_updates#cite_note-.D7.94.D7.A2.D7.A8.D7.946-6 <span class="mw-reflink-text"><nowiki>[6]</nowiki></span>], {{הערה|שם=הערה7|Griggs, J.J. and A.C. Wolff, Cyclin-Dependent Kinase 4/6 Inhibitors in the Treatment of Breast Cancer: More Breakthroughs and an Embarrassment of Riches. J Clin Oncol, 2017. 35(25): p. 2857-2859.}}, {{הערה|שם=הערה8|Kwapisz, D., Cyclin-dependent kinase 4/6 inhibitors in breast cancer: palbociclib, ribociclib, and abemaciclib. Breast Cancer Res Treat, 2017.}}, {{הערה|שם=הערה9|I Wander, S.A., E.L. Mayer, and H.J. Burstein, Blocking the Cycle: Cyclin-Dependent Kinase 4/6 Inhibitors in Metastatic, Hormone Receptor-Positive Breast Cancer. J Clin Oncol, 2017. 35(25): p. 2866-2870.}}. שתי הראשונות רשומות FDA והשלישית תירשם בזמן הקרוב. | + | שלוש תרופות המעכבות CDK4/6 נמצאות בשלבי מחקר מתקדמים:{{כ}} [http://www.wikitrufot.org.il/index.php?button=&search=Palbociclib&title=%D7%9E%D7%99%D7%95%D7%97%D7%93%3A%D7%97%D7%99%D7%A4%D7%95%D7%A9 Palbociclib] {{כ}}([[t:Ibrance|Ibrance]]),{{כ}} [[ריבוציקליב|Ribociclib]] {{כ}}([[Kisqali]]) ו-{{כ}} [[Abemaciclib|Abemaciclib{{כ}}{{הערה|שם=הערה6|Bilgin, B., et al., A current and comprehensive review of cyclin-dependent kinase inhibitors for the treatment of metastatic breast cancer. Curr Med Res Opin, 2017.: 33(9): p. 1559-1569.}}]][[עדכונים בטיפול בסרטן שד גרורתי בישראל - 2017 - Metastatic breast cancer - treatment - updates#cite note-.D7.94.D7.A2.D7.A8.D7.946-6|<span class="mw-reflink-text">[6]</span>]][[עדכונים בטיפול בסרטן שד גרורתי בישראל - 2017 - Metastatic breast cancer - treatment - updates#cite note-.D7.94.D7.A2.D7.A8.D7.946-6|<span class="mw-reflink-text">[6]</span>]][עדכונים_בטיפול_בסרטן_שד_גרורתי_בישראל_-_2017_-_Metastatic_breast_cancer_-_treatment_-_updates#cite_note-.D7.94.D7.A2.D7.A8.D7.946-6 <span class="mw-reflink-text"><nowiki>[6]</nowiki></span>], {{הערה|שם=הערה7|Griggs, J.J. and A.C. Wolff, Cyclin-Dependent Kinase 4/6 Inhibitors in the Treatment of Breast Cancer: More Breakthroughs and an Embarrassment of Riches. J Clin Oncol, 2017. 35(25): p. 2857-2859.}}, {{הערה|שם=הערה8|Kwapisz, D., Cyclin-dependent kinase 4/6 inhibitors in breast cancer: palbociclib, ribociclib, and abemaciclib. Breast Cancer Res Treat, 2017.}}, {{הערה|שם=הערה9|I Wander, S.A., E.L. Mayer, and H.J. Burstein, Blocking the Cycle: Cyclin-Dependent Kinase 4/6 Inhibitors in Metastatic, Hormone Receptor-Positive Breast Cancer. J Clin Oncol, 2017. 35(25): p. 2866-2870.}}. שתי הראשונות רשומות FDA והשלישית תירשם בזמן הקרוב. |
====Palbociclib==== | ====Palbociclib==== | ||
Palbociclib נרשמה ב-FDA בשנת 2015 כטיפול, בשילוב עם [[לטרוזול|Letrozole]], כקו טיפולי ראשון בחולות עם סרטן שד גרורתי ורצפטורים חיוביים וב-2016, בשילוב עם Faslodex, כטיפול בקווים מתקדמים יותר. Palbociclib ניתנת דרך הפה במינון של 125 מ״ג ליום, בתזמון יומי, למשך 3 שבועות עם שבוע הפסקה. התרופה נסבלת היטב עם רעילות מינימלית, הכוללת [[נויטרופניה - Neutropenia|Neutropenia]] ותשישות. לא נצפו מאורעות של זיהומים הקשורים ל-Neutropenia במחקרים קליניים. האישור לטיפול בקו ראשון ניתן על סמך מחקר פאזה 2 פלומה 1{{כ}}{{הערה|שם=הערה10| Finn, R.S., et al., The cyclin-dependent kinase 4/6inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1WRIO-18): a randomised phase 2 study. Lancet Oncol, 2015. 16(1): p. 25-35.}}, ואושר במחקר פאזה 3, פלומה 2{{כ}}{{הערה|שם=הערה11| Finn, R.S., et al., Palbociclib and Letrozole in Advanced Breast Cancer. N Engl J Med, 2016. 375(20): p. 1925¬1936.}}. | Palbociclib נרשמה ב-FDA בשנת 2015 כטיפול, בשילוב עם [[לטרוזול|Letrozole]], כקו טיפולי ראשון בחולות עם סרטן שד גרורתי ורצפטורים חיוביים וב-2016, בשילוב עם Faslodex, כטיפול בקווים מתקדמים יותר. Palbociclib ניתנת דרך הפה במינון של 125 מ״ג ליום, בתזמון יומי, למשך 3 שבועות עם שבוע הפסקה. התרופה נסבלת היטב עם רעילות מינימלית, הכוללת [[נויטרופניה - Neutropenia|Neutropenia]] ותשישות. לא נצפו מאורעות של זיהומים הקשורים ל-Neutropenia במחקרים קליניים. האישור לטיפול בקו ראשון ניתן על סמך מחקר פאזה 2 פלומה 1{{כ}}{{הערה|שם=הערה10| Finn, R.S., et al., The cyclin-dependent kinase 4/6inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1WRIO-18): a randomised phase 2 study. Lancet Oncol, 2015. 16(1): p. 25-35.}}, ואושר במחקר פאזה 3, פלומה 2{{כ}}{{הערה|שם=הערה11| Finn, R.S., et al., Palbociclib and Letrozole in Advanced Breast Cancer. N Engl J Med, 2016. 375(20): p. 1925¬1936.}}. | ||
| − | במחקר פלומה 1 טופלו 165 נשים עם סרטן שד גרורתי, ללא טיפול קודם למחלה גרורתית ולפחות שנה לאחר סיום של טיפול הורמונלי משלים לסרטן שד מוקדם. החולות עברו באופן אקראי בין טיפול על ידי Letrozole במינון של 2.5 מ״ג ליום לבין Letrozole+{{כ}} Palbociclib (במינון ובתזמון כמפורט מעלה). ה-Primary end point של המחקר היתה PFS{{כ}} | + | במחקר פלומה 1 טופלו 165 נשים עם סרטן שד גרורתי, ללא טיפול קודם למחלה גרורתית ולפחות שנה לאחר סיום של טיפול הורמונלי משלים לסרטן שד מוקדם. החולות עברו באופן אקראי בין טיפול על ידי Letrozole במינון של 2.5 מ״ג ליום לבין Letrozole+{{כ}} Palbociclib (במינון ובתזמון כמפורט מעלה). ה-Primary end point של המחקר היתה PFS{{כ}} עם נקודות משניות של OS{{כ}}, משך תגובה ואחוזי תגובה לטיפול. המחקר כלל שתי קבוצות: בקבוצה הראשונה נכללו חולות ללא אפיון של סמנים ביולוגיים (Biomarkers) ובקבוצה השנייה נכללו חולות עם מאפיינים ביולוגיים שנחשבו למנבאי יעילות של Palbociclib{{כ}} (CCND1 |
amplification and/or loss of p16). לא נצפה כל הבדל בין הקבוצות ולכן בניתוח המחקר בוצע איחוד של שתי הקבוצות. | amplification and/or loss of p16). לא נצפה כל הבדל בין הקבוצות ולכן בניתוח המחקר בוצע איחוד של שתי הקבוצות. | ||
גרסה מ־15:56, 29 בינואר 2019
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| עדכונים בטיפול בסרטן שד גרורתי בישראל 2017 | ||
|---|---|---|
| Metastatic breast cancer – treatment – updates - 2017 | ||
| ICD-10 | Chapter C 50. | |
| ICD-9 | 174
-175 |
|
| MeSH | D001943 | |
| יוצר הערך | ד"ר נעה אפרת (בן ברוך) | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן שד
סרטן שד גרורתי היא מחלה רבת פנים. מהלך המחלה יכול להיות אטי, עד כדי הפיכתה למחלה כרונית עם יכולת טיפולית ממושכת, ולחלופין- מהלך מהיר, עם תגובה מזערית לטיפולים כימיים וביולוגיים.
סל התרופות לסרטן שד ככלל, ולסרטן שד גרורתי בפרט, מבטא את המגוון הרב של טיפולים הקיימים למחלה זו, והוא עשיר ומקיף את מרבית התרופות הרשומות ב-FDA וב-EMEA.
בסקירה זו אפרט בקצרה את המהפכה השקטה שעובר הטיפול בסרטן שד גרורתי, את התרופות העיקריות שנכנסו לסל בשנים האחרונות ואת התרופות המועמדות לסל התרופות ב-2018.
אפיון סרטן שד וחשיבותו בקביעת מסכת טיפולית
הטיפול בסרטן שד גרורתי מסתמך על מאפיינים ביולוגיים של הגידול ובנוסף גם על משתנים רבים נוספים, בהם: מידת הפיזור הגרורתי, מידת ההפרעה לתפקודם של איברים חיוניים, תפקוד החולה, מחלות נוספות והעדפות החולה. קיימים קווים מנחים מקובלים לטיפול בסרטן שד גרורתי שפורסמו על ידי ASCO, ESMO ו-NCCN [1].
בזמן אבחון סרטן שד, נמדדים מספר מאפיינים ביולוגיים על ביופסיית הגידול, וכן נבדקים גם מאפיינים מולקולריים בשיטות חדישות. בעזרת מאפיינים אלה ניתן להעריך מהי יעילות הטיפולים השונים ולקבוע את מסכת הטיפול עם הסיכוי המרבי להשגת שליטה על המחלה הגרורתית.
שני מאפיינים עיקריים מהווים אבן בסיס בהחלטות טיפוליות:
- קיום ביטוי של קולטנים לאסטרוגן או פרוגסטרון (Estrogen Receptor ,Progeterone Receptor): לחולות עם קולטנים חיוביים להורמונים, ניתן טיפולים אנטי הורמונליים כגון Tamoxifen, Aromatase inhibitors או Fulvestrant (Faslodex). החידושים העיקריים בטיפול בחולות אלו הם שילוב של תרופות ביולוגיות ספציפיות יחד עם הטיפול ההורמונלי. שילובים אלה יכולים להביא להיפוך עמידות לטיפול הורמונלי (לדוגמה, טיפולים הורמונליים בשילוב עם מעכבי mTor) או לשיפור משך התגובה לטיפול הורמונלי (לדוגמה, שילוב עם מעכבי CDK4/6).
- קיום ביטוי ביתר של הקולטן HER2: לחולות עם ביטוי יתר של HER2, ניתן טיפול ספציפי כנגד HER2 כגון: נוגדנים [[[t:Trastuzumab|Trastuzumab]] (Herceptin, Kadcyla), Pertuzumab (Perjeta)] או מעכבי Tyrosine kinase ספציפיים (Lapatinib). החידושים העיקריים בטיפול בחולות אלו הם שילוב של שני אופני דיכוי של HER2, כגון: שני נוגדנים או נוגדן ומעכב Kinase, וכניסתו לשימוש של נוגדן צמוד כימותרפיה (Antibody drug conjugates), בעל יעילות רבה ומיעוט תופעות לוואי.
אצל חולות עם גידולים ללא ביטוי של קולטנים להורמונים או HER2 (Triple negative), אפשרות הטיפול העיקרית היא טיפול כימותרפי. ניסיון לשלב טיפול ביולוגי שאינו מכוון מטרה ספציפית לסרטן שד, כגון טיפול Anti angiogenic, הביא לתוצאות לא חד משמעיות.
מאפיין נוסף, החוצה את כל סוגי סרטן השד, הוא נשאות גנטית של מוטציות בגנים BRCA1 ו-BRCA2. מוטציות אלו יכולות להיות מולדות או נרכשות, הנמצאות רק בגידול עצמו. מוטציות אלו פוגעות ביכולת התא הממאיר לתקן נזקי DNA דו גדילי. לגידולים בעלי מוטציות ב-BRCA רגישות רבה ביותר לטיפולים הפוגעים במנגנון של תיקון DNA כגון: Platinum compounds (Cisplatin ו-Carboplatin) וכן לקבוצה של טיפולים ביולוגיים של מעכבי PARP (Poly ADP-Ribose Polymerase), הפוגעים ביכולת התא לתקן נזקי DNA חד גדילי.
כאשר התא אינו מסוגל לתקן נזקי DNA חד ודו גדילי, הוא עובר מוות תאי מתוכנן (Apoptosis) במנגנון שנקרא Synthetic lethality. לתרופות אלו יעילות בגידולים שונים הנושאים מוטציות ב-BRCA, ובשלב זה נמצאות בסל לטיפול אחזקתי בסרטן שחלה אצל נשים עם מוטציה ב-BRCA.
הודגם כי טיפול במעכבי PARP שונים הוא בעל משמעות גם אצל נשים עם סרטן שד גרורתי. תרופות אלו עדיין אינן מועמדות לכניסה לסל ב-2018, אך אנו תקווה כי התוצאות יבשילו לכדי רישום ומעמדות לסל בשנת 2019.
חידושים בטיפולים הורמונליים
החידושים העיקריים בטיפולים הורמונליים הם בפיתוח שילובים של טיפול הורמונלי מוכר עם טיפולים ביולוגיים, שמטרתם להפוך עמידות לטיפול או לשפר את יעילות הטיפול.
Afinitor
אחת הבעיות המשמעותיות ביותר בטיפול בסרטן היא הופעת עמידות לתרופות. אחד המנגנונים העיקריים המעורבים בפיתוח עמידות היא הפעלת האנזים mTor עם כל מסלול העברת האותות הנלווה אליו. בתאי סרטן שד, שפיתחו עמידות לטיפול הורמונלי, נראה שפעול יתר של המסלול PI3K/AKT/mTOR.
Afinitor מוכר שנים רבות כחלק ממסכת טיפול נוגד דחיית איברים מושתלים, ומנגנון הפעולה של תרופה זו כולל דיכוי של mTor. מחקר בולרו 2[2] בדק את היכולת של תוספת Afinitor לטיפול הורמונלי לשפר PFS (Progression-Free Survival) ו-OS (Overall Survival) לעומת טיפול הורמונלי בלבד. 724 נשים עם סרטן שד גרורתי, שמחלתן התקדמה תוך כדי טיפול הורמונלי על ידי Non steroidal aromatase inhibitors, עברו באופן אקראי בין Exemestane (Aromasin, שהינו Steroidal aromatase inhibitor) + Afinitor [10 מיליגרם (מ"ג) ליום] לעומת Aromasin + אינבו. הודגם שיפור משמעותי ביותר ב-PFS מ-4.1 חודשים ל-Aromasin בלבד ל-10.6 חודשים לשילוב של Aromasin + Afinitor. לא נצפה שיפור משמעותי סטטיסטי ב-OS, אך כן הודגם שיפור מספרי של חיות חציונית של 26.6 חודשים ל-Aromasin לעומת 31 חודשים לשילוב.
לשילוב יש תופעות לוואי הדורשות מעקב צמוד וניהול קפדני. מרביתן מופיעות בחודשים הראשונים לטיפול. תופעות הלוואי כוללות Stomatitis, Pneumonitis, שינויים מטבוליים (Metabolic) ברמות סוכר ושומני הדם, נטייה לזיהומים ובעיות עוריות.
על סמך נתוני בולרו 2 ונתוני מחקרים נוספים, Afinitor נמצא בסל הבריאות משנת 2014 בהתוויה של טיפול בסרטן שד גרורתי עמיד לטיפולים הורמונליים, בשילוב עם ארומזין.
Faslodex
Faslodex הוא מעכב של הקולטן לאסטרוגן (ER), בעל פעילות ייחודית. מנגנון הפעולה של Faslodex גורם להרס הקולטן על ידי Downregulation. כך, לאחר מתן Faslodex לתאי סרטן שד עם ביטוי של ER, נראה היעלמות של ביטוי ER בצביעות Immunohistochemistry.
פיתוח Faslodex כטיפול בסרטן שד גרורתי נמשך שנים רבות; הודגם כי יש לתת מנה כפולה, כולל מנת העמסה, לצורך השגת השפעה מרבית במחקר פאזה 3 CONFIRM[3]. Faslodex ניתן במינון של 500 מ"ג בזריקה לתוך השריר, כל 28 ימים. בחודש הראשון ניתנת גם מנה נוספת של 500 מ"ג, שבועיים לאחר המתן הראשון. על סמך מחקר זה ומחקרים נוספים, Faslodex נמצא בסל הבריאות כטיפול הורמונלי לסרטן שד גרורתי, במינון של 500 מ"ג עם מנת העמסה, לאחר כישלון של טיפול הורמונלי קודם לסרטן שד גרורתי וכן, לנשים שמחלתן נשנתה יותר משנה לאחר סיום טיפול הורמונלי משלים לסרטן שד מוקדם.
ב-2018 הוגשה בקשה להרחבת הסימן לשימוש ב-Faslodex כטיפול הורמונלי כקו טיפולי ראשון בסרטן שד גרורתי, לנשים שקיבלו טיפול הורמונלי משלים לסרטן שד מוקדם, ללא תלות בזמן וכן לנשים שאובחנו בשלב הגרורתי ולא קיבלו כל טיפול קודם. הבקשה להרחבת הסימן לשימוש מבוססת על שני מחקרים: FIRST[4] ו-Falcon [5].
במחקר פאזה שנייה FIRST[4], 205 נשים עם סרטן שד גרורתי עם קולטנים חיוביים ו-HER2 שלילי טופלו באופן אקראי בין Faslodex 500 מ"ג לחודש, עם מנת העמסה, ל-Anastrozole (Arimidex) 1 מ"ג ליום כקו טיפולי ראשון; מרביתן לא קיבלו כל טיפול הורמונלי קודם. נצפה הבדל משמעותי ביותר ב-TTP (Time To Progression, משך זמן להתקדמות המחלה) בין Arimidex (13 חודשים) ל-Faslodex (23 חודשים), כמו כן נמצא הבדל משמעותי בחיות חציונית בין Arimidex (48 חודשים) לבין Faslodex (54 חודשים). אוכלוסיית החולות במחקר זה אינה מייצגת את אוכלוסיית החולות בישראל, היות שמרבית החולות עם סרטן שד גרורתי נחשפו לטיפול הורמונלי קודם, במסגרת טיפול משלים לסרטן שד מוקדם.
כדי לאמת את תוצאות מחקר FIRST, תוכנן מחקר FALCON- שהוא מחקר פאזה 3, הבודק אוכלוסיה דומה למחקר FIRST, כלומר: נשים עם סרטן שד גרורתי שלא קיבלו כל טיפול קודם[5]. 462 נשים עברו באופן אקראי בין טיפול ב-Faslodex ל-Arimidex. הזמן להתקדמות המחלה היה ארוך יותר בקבוצת החולות שקיבלו Faslodex (16.6 חודשים) לבין זה של אלו שקבלו Arimidex (13.8 חודשים). טרם פורסמו תוצאות של חיות (Overall survival).
מעכבי CDK4/6 (Cyclin-dependent kinase 4/6)
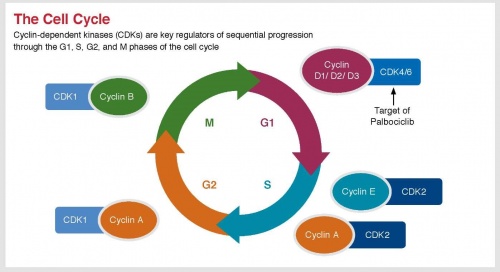
במסגרת מעגל חלוקת התא (תמונה מספר 1), יש חשיבות עליונה לתפקודן של CDKs) Cyclin-dependent kinases).
קינאזות אלו מהוות חלק ממערך אנזימים (Enzymes), החיוניים להתקדמות חלוקת התא בין שלביו השונים (G2 ,S ,G1 ו-S). עיכוב פעילותן של קינאזות אלו, יכול להביא להיעצרות מעגל חלוקת התא ולדיכוי חלוקת תאי גידול ממאיר. קינאזות 4 ו-6 חיוניות למעבר מ-G1 ל-S; עיכוב CDK4/6 יביא לעצירת מעגל התא ב-G1, וימנע התקדמות לשלב S. פעילותן של תרופות מדכאות CDK4/6 מהווה הוכחת עיקרון זה (Proof of concept).
שלוש תרופות המעכבות CDK4/6 נמצאות בשלבי מחקר מתקדמים: Palbociclib (Ibrance), Ribociclib (Kisqali) ו- Abemaciclib[6][6][6][עדכונים_בטיפול_בסרטן_שד_גרורתי_בישראל_-_2017_-_Metastatic_breast_cancer_-_treatment_-_updates#cite_note-.D7.94.D7.A2.D7.A8.D7.946-6 [6]], [7], [8], [9]. שתי הראשונות רשומות FDA והשלישית תירשם בזמן הקרוב.
Palbociclib
Palbociclib נרשמה ב-FDA בשנת 2015 כטיפול, בשילוב עם Letrozole, כקו טיפולי ראשון בחולות עם סרטן שד גרורתי ורצפטורים חיוביים וב-2016, בשילוב עם Faslodex, כטיפול בקווים מתקדמים יותר. Palbociclib ניתנת דרך הפה במינון של 125 מ״ג ליום, בתזמון יומי, למשך 3 שבועות עם שבוע הפסקה. התרופה נסבלת היטב עם רעילות מינימלית, הכוללת Neutropenia ותשישות. לא נצפו מאורעות של זיהומים הקשורים ל-Neutropenia במחקרים קליניים. האישור לטיפול בקו ראשון ניתן על סמך מחקר פאזה 2 פלומה 1[10], ואושר במחקר פאזה 3, פלומה 2[11].
במחקר פלומה 1 טופלו 165 נשים עם סרטן שד גרורתי, ללא טיפול קודם למחלה גרורתית ולפחות שנה לאחר סיום של טיפול הורמונלי משלים לסרטן שד מוקדם. החולות עברו באופן אקראי בין טיפול על ידי Letrozole במינון של 2.5 מ״ג ליום לבין Letrozole+ Palbociclib (במינון ובתזמון כמפורט מעלה). ה-Primary end point של המחקר היתה PFS עם נקודות משניות של OS, משך תגובה ואחוזי תגובה לטיפול. המחקר כלל שתי קבוצות: בקבוצה הראשונה נכללו חולות ללא אפיון של סמנים ביולוגיים (Biomarkers) ובקבוצה השנייה נכללו חולות עם מאפיינים ביולוגיים שנחשבו למנבאי יעילות של Palbociclib (CCND1 amplification and/or loss of p16). לא נצפה כל הבדל בין הקבוצות ולכן בניתוח המחקר בוצע איחוד של שתי הקבוצות.
פלומה 1 אישר את הנחת היסוד ששילוב של פלבוציקליב עם לטרוזול האריך באופן משמעותי את הזמן להתקדמות המחלה PFS מ־10 חודשים ל־20 חודש. לא נצפה הבדל משמעותי בחיות חציונית אם כי נצפה הבדל מספרי של 34 לעומת 30 חודש.
מחקר פלומה 2 הוא מחקר פאזה 3 זהה לפלומה 1. במחקר זה טופלו 666 נשים ברנדומיזציה של 2:1 על ידי לטרוזול + פאלבוציקליב (444 נשים) לעומת לטרוזול + פלצבו (222 נשים). גם במחקר פלומה 2 הודגם הבדל משמעותי ביותר בזמן להתקדמות המחלה בין החולות שקיבלו את השילוב לבין החולות שקבלו לטרוזול בלבד, מ־14.5 חודש ל־24.8 חודש (HR - 0.58, 0.46-0.72 CI). נתוני חיות - OS - לא הוצגו עדיין עקב חוסר זמן.
פלבוציקליב נבדק במחקר פלומה 3[12], אצל 521 נשים עם סרטן שד בעל רצפטורים חיוביים ו-HER2 שלילי שמחלתן התקדמה על טיפול הורמונלי קודם.
טיפול הורמונלי קודם הוגדר כטיפול הורמונלי למחלה גרורתית (עד שני קווי טיפול) או טיפול הורמונלי משלים, עם התקדמות המחלה תוך כדי קבלת טיפול משלים. הטיפול שניתן במחקר פלומה 3 היה Faslodex 500 מ״ג כל 4 שבועות, עם מנת העמסה ביום ה־14, בשילוב עם פלבוציקליב לעומת Faslodex באותו מינון בשילוב עם פלצבו.
347 נשים קבלו Faslodex עם פלבוציקליב ו־174 נשים קבלו Faslodex עם פלצבו. גם במחקר זה הושגה המטרה הראשונית עם יותר מהכפלת PFS מ־4.6 חודשים לFaslodex לבד ל־11.2 חודשים לשילוב. בנוסף, הודגמה במחקר שיפור באיכות חיי המטופלות שקיבלו את השילוב לעומת Faslodex כתרופה בודדת.
על סמך מחקרים אלה ורישומו של פלבוציקליב על ידי ה-FDA, פלבוציקליב נרשם בארץ לשתי האינדיקציות בחודשים אלה ומוגש להכללה בסל הבריאות של 2018 באינדיקציה של קו טיפולי ראשון אצל נשים עם סרטן שד גרורתי בשילוב עם לטרוזול, וקו טיפולי מתקדם בשילוב עם פסלודקס.
ריבוציקליב
ריבוציקליב נרשם ב-FDA בשנת 2017, כטיפול בשילוב עם לטרוזול כקו טיפולי ראשון בחולות עם סרטן שד גרורתי ורצפטורים חיוביים.
ריבוציקליב ניתן דרך הפה במינון של 600 מ״ג ליום בתזמון יומי למשך 3 שבועות עם שבוע הפסקה. בדומה לפלבוציקליב, התרופה נסבלת היטב עם רעילות מינימלית הכוללת נויטרופניה ותשישות, ללא מאורעות של זיהומים הקשורים לנויטרופניה. באחוז קטן של החולות נצפתה הארכה של מקטע QT, ונדרש ניטור אק״ג בחודשים הראשונים לטיפול.
ריבוציקליב נרשם ב-FDA על סמך מחקר פאזה 3, מונה ליזה 2[13]. במחקר זה השתתפו 668 נשים שקיבלו ריבוציקליב עם לטרוזול (334 נשים) או עם פלצבו (334 נשים), כקו טיפולי ראשון למחלה גרורתית. גם כאן הושגה מטרת המחקר, כאשר השילוב הדגים הארכה משמעותית ב-PFS של 25.3 חודשים לעומת 16 חודש ללטרוזול בלבד. מחקר הבודק של יעילות ריבוציקליב בשילוב עם Faslodex כקו טיפול מתקדם סיים גיוס ותוצאותיו יפורסמו בעתיד.
על סמך מחקר זה ורישומו על ידי ה-FDA, ריבוציקליב מועמד לרישום בארץ לאינדיקציה של קו טיפולי ראשון אצל נשים עם סרטן שד גרורתי בשילוב עם לטרוזול, ומוגש להכללה בסל הבריאות של 2018 לאינדיקציה זו.
אבמציקליב
אבמציקליב - השלישי ממשפחת מעכבי CDK4/6 שעדיין אינו רשום ב-FDA. גם הוא ניתן דרך הפה אך בשונה לפלבוציקליב וריבוציקליב, הוא ניתן בתזמון יומי רציף במינון של 300 מ״ג ליום. פרופיל תופעות הלוואי של אבמציקליב שונה במקצת, יש פחות נויטרופניה ויותר רעילות למערכת העיכול המתבטאת בשלשולים.
מחקר מונרך 3 הוצג בספטמבר 2017 בכינוס ESMO ועדיין לא פורסם, והוא מקביל באוכלוסיית החולות לפלומה 2 ומונה ליזה 2, כלומר קו טיפול ראשון בשילוב עם לטרוזול לעומת פלצבו אצל חולות עם סרטן שד גרורתי. גם כאן הושגה מטרת המחקר. PFS אצל חולות שקיבלו את השילוב עדיין לא נמדד, לעומת 14.7 חודש אצל החולות שקיבלו לטרוזול בלבד. הצפי הוא ל-PFS של כ־25 חודש לפחות עם השילוב, משך זמן התואם את התוצאות שהושגו בשני המחקרים המקבילים.
אבמציקליב נבדק במחקר מונרך 2 כקו טיפול מתקדם בשילוב עם Faslodex בדומה למחקר פלומה 3. גם כאן הושגה מטרת המחקר עם PFS לשילוב של 16.4 חודשים לעומת 9.3 חודשים לFaslodex לבד.
על סמך מחקרים אלה, אבמציקליב מוגש להכללה בסל הבריאות של 2018 באינדיקציה של קו טיפולי ראשון אצל נשים עם סרטן שד גרורתי בשילוב עם לטרוזול, וקו טיפולי מתקדם בשילוב עם פסלודקס. זאת לאחר רישומו ב-FDA ובארץ לאינדיקציות אלו.
לשילוב של מעכבי CDK4/6 עם לטרוזול משמעות רבה ביותר במסכת הטיפול אצל חולות עם סרטן שד גרורתי בעל רצפטורים חיוביים. אלו הן מרבית החולות עם סרטן שד גרורתי, ומתן השילוב מאפשר משך חיים ממושך יותר עם שליטה טובה ומיעוט תופעות לוואי לפני החמרה וצורך לעבור לקו טיפולי נוסף. כמו כן, בנוסף למשך תגובה ארוך יותר, לשילוב יש גם אחוז תגובה גבוה יותר מלטרוזול כתרופה בודדת וכן מהירות תגובה גבוהה יותר. לא אחת נראה תגובות לשילוב תוך 6-4 שבועות מתחילת הטיפול, בעוד שעם לטרוזול בלבד התגובה תיראה לאחר 3 חודשים ויותר.
חידושים בטיפולים כימיים
מרבית התרופות המפותחות היום הן תרופות ביולוגיות בעלות מנגנון פעילות מולקולרי ייחודי, אך לצערנו, רק למקצת הגידולים הממאירים אנו יכולים לזהות מטרות מולקולריות ולפתח תרופות ייעודיות. עקב כך קיים צורך ברור בהמשך פיתוח תרופות כימותרפיות.
- אריבולין
אריבולין היא תרופה ייחודית, אנלוג סינתטי של halichondrin B שבודד מספוג ימי marine sponge Halichondria okadai. אריבולין נקשר לאתר ייחודי על טובולין, מדכא את הפולימריזציה של המיקרוטובולים וגורם לחסם מיטוטי לא הפיך. מנגנון הפעולה של אריבולין שונה מזה של טקסנים, ובתרביות רקמה מראה יעילות בתאים העמידים לטקסול.
אריבולין ניתן במינון של 1.4 מ"ג/מ2 בימים 1, 8 כל 3 שבועות. הטיפול ניתן בעירוי מהיר של 5-2 דקות. תופעות הלוואי השכיחות הן נוירופטיה פריפרית (כמו כל התרופות הכימותרפיות הפוגעות במיקרוטובולים), נויטרופניה וחולשה.
שני מחקרים עיקריים מדגימים את פעילותו של אריבולין בחולות עם סרטן שד גרורתי, ובאנליזה של אחד מהם מודגמת פעילות ספציפית אצל חולות עם סרטן שד מסוג טריפל נגטיב. במחקר הראשון, EMBRACE[14], טופלו 762 נשים עם סרטן שד גרורתי שקבלו לפחות 2 קווי טיפול קודמים למחלה גרורתית (טווח 5-2 קווי טיפול קודמים). 508 נשים קיבלו אריבולין ו-254 קיבלו טיפול לפי בחירת הרופא המטפל, ללא מגבלה על סוג הטיפול. המטרה הראשונית של המחקר היתה OS ואכן מטרה זו הושגה כאשר אצל חולות שקיבלו אריבולין חיות חציונית היתה 13.1 חודש לעומת 10.6 חודשים אצל חולות שטופלו לפי בחירת הרופא המטפל. הבדל זה היה משמעותי סטיסטי עם HR של 0.81 ו-p value = 0.041.
מחקר נוסף[15] בדק אוכלוסיית חולות דומה עם מעט פחות קווי טיפול קודמים. הפעם היתה מגבלה של עד 2 קווי טיפול לסרטן שד גרורתי, כאשר הרנדומיזציה היתה בין אריבולין לקסלודה. אריבולין במינון שנכתב מעלה וקסלודה במינון של 2,500 מ"ג/מ2 ליום, ימים 14-1 כל 3 שבועות.
1,102 חולות עברו רנדומיזציה בין אריבולין לקסלודה. במחקר זה לא נצפה כל הבדל במדדי PFS ו-OS בין אריבולין לקסלודהMedian OS was 15.9 and 14.5 months (hazard ratio [HR] 0.879; 95% confidence intervals [CI] 0.770–1.003; p = 0.056), and PFS (independent review) was 4.1 and 4.2 months (HR 1.079; 95% CI 0.932–1.250; p = 0.305) for eribulin and capecitabine. במחקר זה בוצעה סטרטיפיקציה מראש לפי מצב הקולטנים.
במאמר שכלל את שני המחקרים בוצעה מטה-אנליזה לגבי יעילות אריבולין בתת אוכלוסיות שונות לפי מצב קולטנים ו-HER2 [16]. 1,062 חולות קיבלו אריבולין, 802 טיפול בקבוצת הבקרה. חיות חציונית היתה 15.8 חודש עם אריבולין ו-12.8 חודש בקבוצת הבקרה (HR 0.85, p=0.003), ובייחוד אצל נשים עם סרטן שד מסוג טריפל נגטיב עם חיות חציונית של 12.9 חודשים למטופלות על ידי אריבולין לעומת 8.2 בקבוצת הבקרה (HR 0.74, p=0.006).
על סמך נתונים אלה, אריבולין רשום במשרד הבריאות לטיפול בנשים עם סרטן שד גרורתי לאחר טיפול קודם באנטרציקלינים וטקסנים. אריבולין הוכנס לסל ב-2016 לחולות עם סרטן שד מסוג טאיפל נגטיב, ומוגש לסל 2018 לטיפול בנשים עם סרטן שד גרורתי עם HER2 שלילי ורצפטורים, כקו טיפולי שני ומעלה.
ביבליוגרפיה
- ↑ Cardoso, F., et al., ESO-ESMO 2nd international consensus guidelines for advanced breast cancer (ABC2)dagger. Ann Oncol, 2014. 25(10): p. 1871-88.
- ↑ Baselga, J., et al., Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. N Engl J Med, 2012. 366(6): p. 520-9.
- ↑ Di Leo, A., et al., Final overall survival: fulvestrant 500 mg vs 250 mg in the randomized CONFIRM trial. J Natl Cancer Inst, 2014. 106(1): p. djt337.
- ↑ 4.0 4.1 Ellis, M.J., et al., Fulvestrant 500 mg Versus Anastrozole 1 mg for the First-Line Treatment of Advanced Breast Cancer: Overall Survival Analysis From the Phase II FIRST Study. J Clin Oncol, 2015.
- ↑ 5.0 5.1 Robertson, J.F.R., et al., Fulvestrant 500 mg versus anastrozole 1 mg for hormone receptor-positive advanced breast cancer (FALCON): an international, randomised, double-blind, phase 3 trial. Lancet, 2016. 388(10063): p. 2997-3005
- ↑ Bilgin, B., et al., A current and comprehensive review of cyclin-dependent kinase inhibitors for the treatment of metastatic breast cancer. Curr Med Res Opin, 2017.: 33(9): p. 1559-1569.
- ↑ Griggs, J.J. and A.C. Wolff, Cyclin-Dependent Kinase 4/6 Inhibitors in the Treatment of Breast Cancer: More Breakthroughs and an Embarrassment of Riches. J Clin Oncol, 2017. 35(25): p. 2857-2859.
- ↑ Kwapisz, D., Cyclin-dependent kinase 4/6 inhibitors in breast cancer: palbociclib, ribociclib, and abemaciclib. Breast Cancer Res Treat, 2017.
- ↑ I Wander, S.A., E.L. Mayer, and H.J. Burstein, Blocking the Cycle: Cyclin-Dependent Kinase 4/6 Inhibitors in Metastatic, Hormone Receptor-Positive Breast Cancer. J Clin Oncol, 2017. 35(25): p. 2866-2870.
- ↑ Finn, R.S., et al., The cyclin-dependent kinase 4/6inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1WRIO-18): a randomised phase 2 study. Lancet Oncol, 2015. 16(1): p. 25-35.
- ↑ Finn, R.S., et al., Palbociclib and Letrozole in Advanced Breast Cancer. N Engl J Med, 2016. 375(20): p. 1925¬1936.
- ↑ Turner, N.C., et al., Palbociclib in Hormone-Receptor- Positive Advanced Breast Cancer. N Engl J Med, 2015. 373(3): p. 209-19.
- ↑ Hortobagyi, G.N., et al., Ribociclib as First-Line Therapy for HR-Positive, Advanced Breast Cancer. N Engl J Med, 2016. 375(18): p. 1738-1748.
- ↑ Cortes, J., et al., Eribulin monotherapy versus treatment of physician's choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open-label randomised study. The Lancet, 2011. 377(9769): p. 914-923.
- ↑ Kaufman, P.A., et al., Phase III open-label randomized study of eribulin mesylate versus capecitabine in patients with locally advanced or metastatic breast cancer previously treated with an anthracycline and a taxane. J Clin Oncol, 2015. 33(6): p. 594-601.
- ↑ Twelves, C., et al., Efficacy of eribulin in women with metastatic breast cancer: a pooled analysis of two phase 3 studies. Breast Cancer Res Treat, 2014. 148(3): p. 553-61.
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר נעה אפרת (בן ברוך) - מנהלת המכון האונקולוגי, המרכז רפואי קפלן, רחובות


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק