עדכונים וחידושים באי ספיקת לב כרונית נכון ל-2016 - Updates in the treatment of chronic heart failure
הופניתם מהדף עדכונים וחידושים באי ספיקת לב כרונית נכון ל-2016 לדף הנוכחי.
| עדכונים וחידושים באי ספיקת לב כרונית 2016 | ||
|---|---|---|
| Updates in the treatment of chronic heart failure | ||
| 250px | ||
| יוצר הערך | ד"ר ז'אן מרק וויינשטיין | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – אי ספיקת לב
אי ספיקת לב (אס"ל) היא מחלה שכיחה מאוד, ממנה סובלים כ-1.5 אחוזים מהאוכלוסיה הכללית. שכיחות המחלה עולה במקביל לעלייה בגיל המטופל, כך שכ-10 אחוזים מהאנשים מעל גיל 80 שנים סובלים מאס"ל.
השיפור בתוחלת החיים של האוכלוסיה הכללית והירידה בתמותה ובתחלואה מאירועים לבביים חריפים בעשרות השנים האחרונות הם מהגורמים העיקריים לעלייה במספר החולים הסובלים מאס"ל. על פי הערכות, צפוי מספר חולי אס"ל בארצות הברית לעלות מחמישה מיליון חולים בשנת 2012 לכשמונה מיליון חולים בשנת 2030 (עלייה של 46 אחוזים)[1].
אס"ל מהווה נטל כלכלי כבד על כלל מערכת הבריאות בעולם המערבי. בארצות הברית, עלות הטיפול באס"ל צפויה לעלות מ-31 מיליארד דולר בשנת 2012 ל-70 מיליארד דולר בשנת 2030. ההערכה המקובלת בארצות הברית היתה שבין אחוז אחד לשני אחוזים מכלל תקציב הבריאות מכוון לטיפול באס"ל. לאחרונה פורסם כי העלות האמיתית בארצות הברית (ישירה ובלתי ישירה) היא למעשה בין 3.2 אחוזים ל-5.8 אחוזים מתקציב הבריאות. עלות האשפוזים של חולי אס"ל מהווה את החלק המשמעותי ביותר מכלל עלות הטיפול בהם. לכן, מושקעים מאמצים ניכרים לצמצם אשפוזים אלה באמצעות פיתוח דרכים לאיזון מיטבי של המחלה ולמניעת התלקחויות.
במהלך שנת 2014 פורסמו שני מחקרים אשר יכולים להוביל לשינוי מהותי בתוצאים בקרב חולי אס"ל. המחקר הראשון בדק תרופה חדשה - LCZ696 - Entresto והשני תרופה לא חדשה: ferric carboxymaltose תוך ורידי.
LCZ696 - Entresto
במהלך שנות ה-90 של המאה הקודמת הופיעו מספר פריצות דרך בטיפול בחולי אס"ל Systolic, כולל Angiotensin Converting Enzyme Inhibitors (ACEI), חוסמי בטא (Beta Blockers, BB), השתלת מכשירים, כולל Implantable Cardioverter Defibrillators (ICD) ו-Cardiac Resynchronization Therapy (CRT). טיפולים אלה הורידו תמותה ותחלואה באופן משמעותי. מאז, לא הופיעו טיפולים חדשים עם הישגים באותה קנה מידה בטיפול במחלה כמו בטיפולים אלה, עד שבשנת 2014 פורסם מחקר של ה-PARADIGM-HF[2].
Natriuretic Peptides (NPs) נתגלו כגורם פיזיולוגי (Physiological) מרכזי בחולים עם אס"ל. מדובר בקבוצה של Peptides הכוללת Atrial Natriuretic Peptide (ANP) אשר מופרש מעליות הלב, B-type Natriuretic Peptide (BNP) אשר מופרש מעליות וחדרי הלב, ו-C-type Natriuretic Peptide (CNP), אשר מופרש מתאי Endothelium בכלי הדם וממערכת העצבים המרכזית. ה-NPs גורמים להרחבה של כלי דם, וברמות שונות, שיתון, מגבירים הפרשת נתרן בשתן, מפחיתים את הפעלת מערכת ה-RAAS) Renin-Angiotensin-Aldosterone System), מפחיתים את ה-Tonus של מערכת העצבוב ה-Sympathetic, מגבירים את זרימת הדם לכליות ומשפרים את קצב הסינון של תאי הפקעית בכליות (Glomerular Filtration Rate, GFR), מפחיתים התרבות תאים, Hypertrophy והיווצרות רקמת חיבור, ומורידים את ה-Preload ללב. המשמעות היא כי ה-NPs מובילים לשיפור במצבם הפיזיולוגי של חולי אס"ל באמצעות השפעה על מנגנונים רבים בגוף.
ה-NPs מפורקים על ידי אנזים (Enzyme) ה-Neprilysin. בלימת האנזים מונעת פירוק ה-NPs ומעלה את רמתם בדם ואת השפעתם החשובה. Nepriliysin מפרק גם Angiotensin I ו-II ולכן חסימת הפעילות של Neprilysin בלבד תעלה גם את רמת ה-Angiotensin II, אשר מנוגדת להשפעה הטובה של ה-NPs. לאור זאת, בלימת Neprilysin מחייבת בלימה בו-זמנית של ה-RAAS, למשל על ידי Angiotensin Receptor Blocker (ARB).
לייעוד זה נולדה התרופה LCZ696) Entresto), אשר כוללת שני מרכיבים: Sacubitril, Molecule שהיא Pro-drug שעוברת Metabolism לתרופה פעילה שבולמת את פעילות ה-Neprilysin, ומרכיב נוסף - Valsartan, תרופה מקבוצת ה-ARB. השילוב של שני המרכיבים נקרא ARNI) Angiotensin Receptor Neprilysin Inhibitor).
מחקר ה-PARADIGM-HF בדק את יעילות LCZ696 לעומת Enalapril, תרופה אשר נחשבת ל-Gold standard בטיפול לאס"ל Systolic (שנקרא גם Heart Failure with reduced Ejection Fraction: HFrEF). במחקר נכללו חולים בדרגה תפקודית II–IV לפי New York Heart Association) NYHA), עם מקטע פליטה של חדר שמאל (Left Ventricular Ejection Fraction, LVEF) פחות מ-40 אחוזים, (בהמשך המחקר הסף הורד ל-LVEF אשר פחותה מ-35 אחוזים), רמה גבוהה בדם של BNP או NT-pro BNP (סמנים של פעילות אס"ל) ועם לפחות ארבעה שבועות על טיפול יציב ב-ACEI או ARB, BB וכל הטיפול השגרתי המקובל לחולי HFrEF.
בשלב הראשון של המחקר (Run-in period), החולים קיבלו קודם Enalapril במינון גבוה (10 מיליגרם פעמיים ביום), שהוחלף כעבור שבועיים ל-LCZ696 במינון התחלתי. מינון זה הועלה כעבור 2-1 שבועות למינון מלא. תהליך זה בוצע על מנת לבחון האם החולים סובלים את המינונים הגבוהים של שתי התרופות. לאחר תקופה זו, החולים חולקו באופן אקראי לקבל אחת מהתרופות במינון מלא, יחד עם טיפול מוקבל ל-HFrEF (כמובן למעט ACEI או ARB). 8,442 חולים נכנסו למחקר, מספר שמגדיר אותו כמחקר הגדול שבוצע מעולם על תמותה ותחלואה בחולי HFrEF.
התוצא העיקרי היה שילוב של תמותה Cardiovascular ואשפוז בשל אס"ל. נקבעו גם תוצאים משניים של מוות מכל סיבה, שינוי בשאלון ה-Kansas City Cardiomyopathy Questionnaire (KCCQ) כעבור 8 חודשים, הופעה חדשה של פרפור פרוזדורים (Atrial Fibrillation, AF) והחמרה בתפקוד הכלייתי.
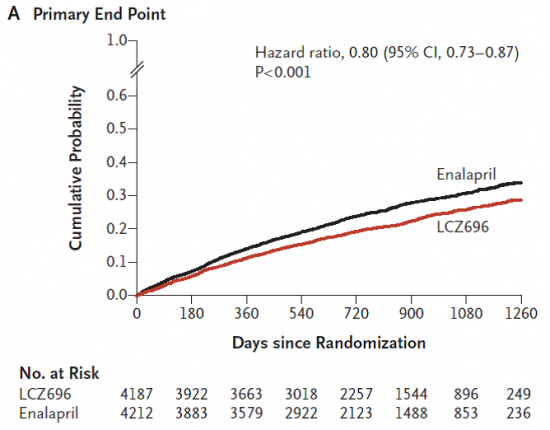
התוצאות הדגימו ירידה בתוצא העיקרי המשולב של 20 אחוזים (יחס צולב - Hazard ratio 0.8, רווח סמך 95 אחוזים 0.87-0.73, p<0.001) (תמונה מספר 1). הודגמה ירידה גם בכל אחד משני התוצאים העיקריים בנפרד: תמותה מסיבה Cardiovascular ירדה ב-20 אחוזים (יחס צולב 0.8, רווח סמך 95 אחוזים 0.89-0.71, p<0.001) ואשפוז ראשון בשל אס"ל ירד ב-21 אחוזים (יחס צולב 0.79, רווח סמך 95 אחוזים 0.89-0.71, p<0.001).
מתוך התוצאים המשניים, מוות מכל סיבה ירד ב-16 אחוזים (p<0.001) וה-KCCQ גם השתפר (p<0.001). לא הודגם הבדל בין שתי התרופות בהקשר להופעת פרפור פרוזדורים או החמרה בתפקוד הכלייתי.
נקודה חשובה נוספת היא בטיחות התרופה החדשה. בקבוצת ה-LCZ696, יותר אנשים סבלו מירידה בערכי לחץ הדם לעומת אלה שקיבלו Enalapril, אך פחות אנשים בקבוצת ה-LCZ696 העלו את רמת ה-Creatinine בדם לרמה גבוהה מ-2.5 מיליגרם לדציליטר, פחות העלו את רמת האשלגן למעל 6 מילימול לליטר ופחות פיתחו שיעול (כל התוצאות האלו היו בעלות מובהקות סטטיסטית). לא הודגם הבדל סטטיסטי בין הקבוצות בהתפתחות Angioedema משמעותית. בסך הכל, פחות חולים בקבוצת ה-LCZ696 הפסיקו את התרופה עקב תופעות לוואי (10.7 אחוזים כנגד 12.3 אחוזים, p=0.03).
לאור התוצאות הנזכרות לעיל, מדובר ככל הנראה במהפכה לטיפול בחולי HFrEF. התוצאות היו כה מרשימות, שרשויות התרופות האמריקאית והאירופאית (ה-FDA - Food and Drug Administration, וה-EMA - European Medicines Agency) אישרו בהליך מזורז את התרופה לשימוש.
כמו כן פורסמו בחודש מאי 2016 בו-זמנית קווים מנחים של טיפול באס"ל של ה-Heart Failure Association, של ה-European Society of Cardiology (ESC) [3] ושל הגופים האמריקאיים: American Heart Association (AHA), American College of Cardiology (ACC), וה-Heart Failure Society of America (HFSA)[4]. ההמלצות בשתי התכניות היו בדרגה "1B" לשימוש בתרופה החדשה לחולים עם HFrEF.
Ferric carboxymaltose
פורסמו מחקרים אשר הדגימו את השכיחות הגבוהה של Anemia וחוסר ברזל (עם או בלי Anemia) בקרב חולי אס"ל. יחד עם זאת, Anemia מורידה את הרמה התפקודית של החולים, את איכות חייהם ומהווה גורם בלתי תלוי לאשפוזים ותמותה [4], [5], [6], [7]. בשנת 2008 קבוצה קטנה של חולי אס"ל עם רמת ברזל נמוכה הדגימה שיפור ביכולת התפקודית ותסמינים לאחר טיפול עם Iron sucrose תוך ורידי. השיפור היה בולט יותר בחולים ה-Anemic [8]. בשנת 2009 הדגים מחקר ה-FAIR-HF [9] ממצאים דומים בקרב חולי אס"ל עם חוסר ברזל (עם או בלי Anemia), לאחר טיפול ב-Ferric carboxymaltose (FCM) תוך ורידי במהלך 6 חודשי מעקב.
בשנת 2014 פורסם מחקר ה-CONFIRM-HF[10] , שכלל חולי אס"ל תסמיניים עם LVEF קטן או שווה ל-45 אחוזים, רמה גבוהה של NPs וחוסר ברזל. החולים חולקו בצורה אקראית לטיפול עם FCM תוך ורידי או אינבו, במשך שנה. התוצא העיקר הוגדר כשינוי במרחק ההליכה במשך שש דקות (Six Minute Walk Test, 6MWT) מתחילת המחקר ועד 24 שבועות. התוצאים המשניים כללו שינוי ברמת ה-NYHA, מרחק ה-6MWT, Patient Global Assessment (PGA), איכות החיים בהקשר לבריאות, והערכת עייפות כעבור 6, 12, 24, 36 ו-52 שבועות והשפעת FCM על אשפוזים בשל החמרה באס"ל.
התוצא העיקרי הדגים הארכה משמעותית ב-6MWT במדידה שהתבצעה כעבור 24 שבועות, בקרב החולים שקיבלו FCM (הבדל בין FCM לאינבו 33±11 מטרים, p=0.002). השפעה זו נמשכה עד שבוע 52 (הבדל בין FCM לאינבו 36±11 מטרים, p<0.001). בנוסף, במהלך כל המחקר, חל שיפור ברמת NYHA, PGA, איכות החיים, והערכת עייפות בקרב חולים שטופלו על ידי FCM משבוע 24 ואילך. כמו כן, FCM גם הוריד באופן משמעותי את הסיכוי לאשפוזים בשל החמרה באס"ל (יחס צולב 0.39, רווח סמך 95 אחוזים 0.82-0.19, p=0.009). השיפור בתוצאות הודגם כמעט בכל תתי הקבוצות, כולל בחולים עם ובלי Anemia. לא היה הבדל בין הקבוצות מבחינת תמותה ושיעור אירועים חריגים.
בקווי מנחה משנת 2016 של טיפול באס"ל של ה-Heart Failure Assocation של ה-ESC [3], טיפול ב-FCM בחולי אס"ל עם חוסר ברזל קיבל המלצה ברמה "IIa, A".
לסיכום, לשני טיפולים אלה קיימת יכולת משמעותית לשיפור במצבם של החולים, שיפור משמעותי בתחלואה, בדרגה תפקודית ובתסמינים, במקביל לירידה באשפוזים בשל החמרה באס"ל, ובמקרה של LCZ696 גם ירידה משמעותית בתמותה.
ביבליוגרפיה
- Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal doi:10.1093/eurheartj/ehw128.
- ↑ Heidenreich PA, et al, on behalf of the American Heart Association Advocacy Coordinating Committee, Council on Arteriosclerosis, Thrombosis and Vascular Biology, Council on Cardiovascular Radiology and Intervention, Council on Clinical Cardiology, Council on Epidemiology and Prevention, and Stroke Council. Forecasting the impact of heart failure in the United States: a policy statement from the American Heart Association. Circ Heart Fail. 2013;6:606–619.
- ↑ McMurray J.J.V., et al for the PARADIGM-HF Investigators and Committees. Angiotensin–Neprilysin Inhibition versus Enalapril in Heart Failure. N Engl J Med 2014; 371:993-1004
- ↑ 3.0 3.1 Yancy CW, Jessup M, Bozkurt B, et al. 2016 ACC/AHA/HFSA focused update on new pharmacological therapy for heart failure: an update of the 2013 ACCF/AHA guideline for the management of heart failure. J Am College Cardiol 2016; DOI:10.1016/j.jacc.2016.05.011.
- ↑ 4.0 4.1 Klip IT, et al. Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J 2013;165:575–582.
- ↑ Okonko DO, et al. Disordered iron homeostasis in chronic heart failure: prevalence, predictors, and relations to anemia, exercise capacity, and survival. J Am Coll Cardiol 2011;58:1241–1251.
- ↑ Jankowska EA, et al. Iron deficiency defined as depleted iron stores accompanied by unmet cellular iron requirements identifies patients at the highest risk of death after an episode of acute heart failure. Eur Heart J 2014 Sep 21;35(36):2468-76
- ↑ Jankowska EA, et al. Iron deficiency predicts impaired exercise capacity in patients with systolic chronic heart failure. J Card Fail 2011;17:899–906.
- ↑ Okonko DO et al. Effect of intravenous iron sucrose on exercise tolerance in anemic and nonanemic patients with symptomatic chronic heart failure and iron deficiency FERRIC-HF: a randomized, controlled, observer-blinded trial. J Am Coll Cardiol. 2008 Jan 15;51(2):103-12.
- ↑ Anker SD et al for the FAIR-HF Trial Investigators. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med 2009;361:2436–2434.
- ↑ Ponikowski P, et al for the CONFIRM-HF Investigators. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J. Advance Access published August 31, 2014. doi:10.1093/eurheartj/ehu385
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר ז'אן מרק וויינשטיין - מרפאת אי ספיקת לב, מרכז רפואי אוניברסיטאי סורוקה, באר שבע; היחידה לאי ספיקת לב, שירותי בריאות כללית, מחוז הדרום


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק