פוליציטמיה ורה - Polycythemia Vera
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| פוליציטמיה ראשונית – טיפול | ||
|---|---|---|
| Primary polycythemia– Treatment | ||
| שמות נוספים | פוליציטמיה ורה – טיפול - Polycytemia vera – Treatment | |
| יוצר הערך | ד"ר נועה לביא | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – פוליציטמיה
פוליציטמיה ראשונית או פוליציטמיה ורה (Polycythemia Vera, PV) שייכת לקבוצת המחלות המיילופרוליפרטיביות המתאפיינות בשגשוג חריג (Anomalous proliferation) של תאים מיילואידים (Myeloid) שמקורם בתאי אב (Stem cells). בפוליציטמיה ורה נוצרים במח העצם יותר מדי תאים אדומים (Erythrocytes), כדוריות דם לבנות (Leukocytes) ומגהקריוציטים (Megakaryocytes). תאים אלו מצטברים בדם וגורמים לו להיות צמיגי יותר מהרגיל. כמעט כל החולים עם PV נושאים מוטציה ב-JAK2 (2 JAnus Kinase) הגורמת לשפעולו. 96 אחוזים מהחולים נושאים את המוטציה באקסון (Exon) 14, (JAK2(V617F ו-3 אחוזים באקסון 12. עומס המוטציה (Allele burden) ב-(JAK2(V617F לא משפיע על הישרדות או התמרה (Transformation) ללוקמיה (Leukemia). עומס גבוה של המוטציה קשור עם גרד וסיכוי מוגבר יותר למעבר למיילופיברוזיס (Myelofibrosis). לחולים עם מוטציה באקסון 12 יש נטייה לייצור מוגבר בעיקר של השורה האדומה וגיל מוקדם יותר באבחנה, אך הפרוגנוזה דומה לאלו עם המוטציה השכיחה (JAK2(V617F.
אבחנה - האבחנה של PV נעשית על פי קריטריונים קליניים ומעבדתיים של ארגון הבריאות העולמי ודורשת את קיומם של שני קריטריונים מג'וריים (Major) וקריטריון מינורי (Minor) אחד או קריטריון מג'ורי אחד ושני קריטריונים מינוריים (טבלה 1)[1]. זיהוי מוטציה ב- (JAK2(V617F מאוד רגישה וספציפית על מנת להבדיל בין PV לסיבות אחרות לעליית ההמטוקריט. רמת האריתרופויטין (Erythropoietin) היא מתחת לערכי הנורמה במעל ל־85 אחוזים מהחולים עם PV. רמת אריתרופויטין נמוכה בהעדר מוטציה ב-(JAK2(V617F מצריכה בדיקה של JAK2 exon12 mutation.

המוגלובין מעל לאחוזון 99; או מעל 17 גרם(גר')/דציליטר(דל') בגברים, ו-15 גר'/דל' בנשים אם מלווה בעלייה קבועה בלפחות 2 גר'/דל' מערך הבסיס ולא משני לתיקון של חסר ברזל; או עלייה בנפח כדוריות דם אדומות מעל 25 אחוזים מהערך הממוצע המצופה
המונח "Masked PV" מתייחס לחולים עם מוטציה ב-JAK2 ומאפיינים במח העצם המתאימים ל-PV, למרות ערך המוגלובין נמוך יותר. ערך המוגלובין 16.5 גר'/דל' לגברים ו-16.5-15 גר'/דל' לנשים נקבע כערך הסף להבחנה בין חולים עם מוטצית a־JAK2 ואבחנה של תרומבוציטמיה ראשונית (Essential Thrombocytosis) לעומת Masked PV[2].
- גורמי סיכון המשפיעים על הישרדות וטרנספורמציה ללוקמיה או מיילופיברוזיס
מחקר שפורסם הדגים חציון הישרדות של 14 שנים בחולים עם PV, ובחולים צעירים מתחת לגיל 60, חציון ההישרדות הוא 24 שנים. הסיכוי לטרנספורמציה ללוקמיה חריפה במעקב של 20 שנים הוא פחות מ-10 אחוזים, הסיכוי לטרנספורמציה למיילופיברוזיס מעט גבוה יותר[3]. גורמי הסיכון המשפיעים על ההישרדות כוללים גיל מבוגר, ספירה לבנה גבוהה (Lekokocytosis) ואירוע טרומבוטי (פקקת, Thrombosis) קודם[4]. גורמי הסיכון המשפיעים על הסיכון לטרנספורמציה ללוקמיה כוללים גיל מבוגר, ספירה לבנה גבוהה וקריוטיפ (Karyotype) לא תקין[4].
גורמי סיכון לטרומבוזיס ודימום: חולים בסיכון גבוה לטרומבוזיס הם חולים בגיל 60 ומעלה או חולים שחוו אירוע טרומבוטי (עורקי או ורידי) בעברם. טסיות דם מעל מיליון הם סיכון מוגבר לדמם.
טיפול
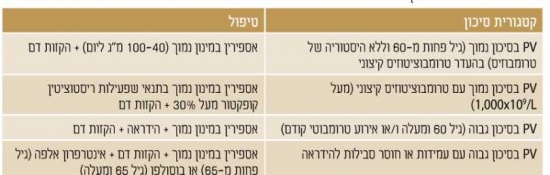
מאחר ושיעורי ההישרדות גבוהים והסכנה לטרנספורמציה ללוקמיה או למיילופיברוזיס נמוכים מאד. כיום לא מומלץ לטפל (בכל טיפול) באופן שגרתי על מנת להשפיע על המהלך הטבעי של המחלה. מאידך, הסכנה לאירוע טרומבוטי עולה על 20 אחוזים וחלק לא מבוטל מהחולים סובל מהפרעות וזומוטוריות (Vasomotor); כאבי ראש, סחרחורת, עקצוצים בקצות האצבעות, Erythromelalgia - התקפי כאב ואודם בקצות האצבעות, כאבים לא טיפוסיים בחזה וגרד. בחולים עם מספר טסיות מעל מיליון עשויה להיות נטייה לדמם. לכן, מטרת הטיפול העיקרית היא למנוע סיבוכים טרומבוטיים או דמם, ומטרת הטיפול השניונית היא לווסת את התסמינים המיקרווסקולריים (טבלה 2)[5].
טיפול בחולים בסיכון נמוך, בהעדר רמת טסיות קיצונית
במחקר המבוקר ה-ECLAP study (European Collaboration study on Low-dose Aspirin in Polycythemia) הוכחה יעילות הטיפול באספירין במינון נמוך למניעה אירועים טרומבוטים בחולי PV בכל דרגות הסיכון[6]. מחקרים הראו גם את היעילות של הקזות דם (Phlebotomy) בכל חולי ה- PV, כאשר מחקר CYTO-PV (CYTOreductive therapy in Polycythemia Vera)[7] הראה כי חולים ששמרו על המטוקריט מטרה של פחות מ-45 אחוזים היו פחות אירועים טרומבוטים ותמותה קרדיווסקולרית נמוכה יותר לעומת חולים עם המטוקריט 50-45 אחוזים ולכן המטרה הטיפולית היא לשמור על המטוקריט של פחות מ-45 אחוזים.
גם אספירין במינון נמוך מפחית סימפטומים וזומוטורים. אם אין השפעה תחת טיפול באספירין במינון נמוך ניתן להעלות את מינון האספירין לפעמיים ביום או לטפל ב-Plavix (Clopidogrel) או בשילוב של שתי התרופות יחד. במקרים מסויימים אספירין הניתן פעמיים ביום יעיל יותר מאשר פעם ביום ולכן, שוקלים לעיתים גישה טיפולית זו בחולים עמידים לטיפול באספירין פעם ביום או לאלו עם יותר גורמי סיכון לטרומבוזיס עורקי.
גרד מופיע ברוב החולים עם PV ולרוב מוחמר על ידי מים חמים. יש להתחיל טיפול באמצעים לא תרופתיים כגון הימנעות מגורמים מחמירים (הימנעות מעור יבש, טמפרטורות קיצוניות ורחצה במים חמים). תיתכן תגובה לאנטי-היסטמינים (Antihistamines). תוארה תגובה של מעל 50 אחוזים לגרד על ידי שימוש ב-Paroxetine (Seroxat, Paxxet) תרופה נוגדת דיכאון ממשפחת SSRI (Selective Serotonin Reuptake Inhibitors). טיפולים אחרים יעילים לגרד כוללים טיפול ב-Interferon, מעכבי JAK ופוטותרפיה (Phototherapy).
טיפול בחולים בסיכון נמוך עם רמת טסיות קיצונית או נטייה לדמם
תסמונת וון-וילברנד נרכשת (Acquired Von Willebrand Syndrome, AvWS), שכיחה בחולי PV ומתאפיינת באיבוד מולטימרים (Multimers) גדולים של פקטור Von-Willebrand, בשל פירוק מוגבר על ידי ADAMTS13 התלוי בחומרת הטרומבוציטוזיס (Thrombocytosis). AvWS מביאה להפרעה תפקודית משמעותית יותר מאשר נראה כאשר בודקים את אנטיגן Von-Willebrand ורמות פקטור VIII ולכן יש צורך בתבחינים המעריכים את תפקוד פקטור Von-Willebrand כגון פעילות Ristocetin Cofactor (RCo). כשרמת הטסיות מעל.1000x109/l יש למדוד את פעילות RCo ולשקול הימנעות מאספירין אם הפעילות פחות מ-30 אחוזים, מחשש לדמם. מצד שני, טרומבוציטוזיס קיצונית לא מגבירה סיכון לטרומבוזיס ואינה מהווה התוויה לטיפול ציטורדוקטיבי (Cytoreductive).
טיפול בחולי PV בסיכון גבוה
בנוסף לאספירין והקזות דם, חולים בסיכון גבוה (גיל 60 ומעלה או אירוע טרומבוטי קודם) צריכים לקבל גם טיפול ציטורדוקטיבי ב- Hydroxyurea (Hydrea) על מנת להפחית סכנה לטרומבוזיס, בחולים עם אירוע טרומבוטי ורידי מומלץ לטפל בנוגדי קרישה ולשקול טיפול באספירין. טרנספורמציה לוקמית הוכחה כקשורה לטיפול ב- Pipobroman ו-P32 שאינם בשימוש כיום, אך אינה קשורה לטיפול ב-Hydrea.
- עמידות או חוסר סבילות לטיפול ב-Hydrea
עמידות או חוסר סבילות ל-Hydrea (טבלה 3) [8] יכולה להתפתח ב-25-20 אחוזים מהחולים עם PV[9]. עמידות קשורה לסיכון מוגבר לטרנספורמציה ללוקמיה ומיילופיברוזיס וירידה בהישרדות. ההישרדות הממוצעת בחולים עמידים ל-Hydrea היא 1.2 שנים בלבד. חוסר סבילות ל-Hydrea לא משפיע על הפרוגנוזה (Prognosis).
טיפול בחולי PV בסיכון גבוה עם עמידות או חוסר סבילות ל-Hydrea
חולים עם עמידות או חוסר סבילות ל-Hydrea יכולים להיות מטופלים בצורה יעילה על ידי Interferon או Busulphan. מחקרים קליניים הדגימו שיעור גבוה של הפוגה המטולוגית עם טיפול ב-Peginterferon ואף ירידה ב-JAK2(V617F) Allele burden. אולם, הטיפול ב- Interferon כרוך בתופעות לוואי קשות ורבים מהחולים לא סובלים טיפול זה. מנגד, קיים חשש שטיפול ב-Busulfan מגביר סיכוי לטרנספורמציה ללוקמיה ולכן מעדיפים להימנע מהשימוש בו בחולים צעירים.
קבוצת החולים עם PV עם חוסר סבילות או עמידות לטיפול ב-Hydrea ואלו הממשיכים להיות סימפטומטיים למרות טיפול ב-Hydrea מהווים קבוצה של חולים עם צרכים שלרוב אין להם פיתרון עם הטיפולים הקיימים. חשוב לזכור גם שטרנספורמציה ללוקמיה מ-PV בדרך כלל מופיע בתאים שהם שליליים למוטציה (JAK2(V617F ולכן ירידה ב-Allele burden של (JAK2(V617F על ידי תרופות לא בהכרח מתורגמת ליתרון ארוך טווח.
מחקרים קליניים ב-PV שמים כעת דגש על קבוצות חולים אלו. מבין התרופות הנחקרות, מעכבי JAK עשויים להיות בעלי ערך טיפולי בחולים עם עמידות/חוסר סבילות ל-Hydrea.
ביבליוגרפיה
- ↑ Tefferl A, Vardiman JW: Classification and diagnosis of myeloproliferative neoplasms; the 2008 World 2. Health Organization criteria and point-of-care diag¬nostic algorithms. Leukemia 2008
- ↑ Barbui T,Thiele J, Carobbio A, etal. Discriminating between essential thrombocythemia and masked polycythemia vera in JAK2 mutated patients. Am J Hematol 2014
- ↑ Tefferi A, Guglielmelli P, Larson DR, et al. Long-term survival and blast transformation in molecularlyanno-tated essential thrombocythemia, polycythemia vera, and myelofibrosis. Blood 2014
- ↑ 4.0 4.1 Tefferi A, Rumi E, Finazzi G, etal. Survival and prognosis among 1545 patients with contemporary polycythemia vera: An international study. Leukemia 2013
- ↑ Tefferi A, Barbui T. Polycythemia vera and essential thrombocythemia: 2015 update on diagnosis, risk stratification and management American Journal of Hematology, 2015
- ↑ Landolfi R, Marchioli R, Kutti J, et al. Efficacy and safety of low-dose aspirin in polycythemia vera. N Engl J Med. 2004
- ↑ 7Marchioli R, Finazzi G, Specchia G, etal. Cardiovas¬cular events and intensity of treatment in polycythe-mia vera. N EnglJ Med 2013
- ↑ Barosi G,Birgegard G, Finazzi G, et al. A unified definition of clinical resistance and intolerance to hydroxycarbamide in polycythaemia vera and primary myelofibrosis; results of a European LeukemiaNet (ELN) consensus process. BrJHaematol 2010
- ↑ Sever M, Newberry K, Verstovsek S.Therapeutic options for patients with polycythemia vera and essential thrombocythemia refractory/resistant to hydroxyurea. Leukemia & Lymphoma Dec 2014
קישורים חיצוניים
המידע שבדף זה נכתב על ידי ד"ר נועה לביא. המכון ההמטולוגי, הקריה הרפואית רמב"ם, חיפה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק