תת פעילות ראשונית של בלוטות יותרת התריס - טיפול בנטפרה - Primary hypoparathyrodism - treatment with natpara
הופניתם מהדף פעילות יתר ראשונית של בלוטות יותרת-התריס - טיפול בנטפרה - Primary hyperparathyroidism - treatment with natpara לדף הנוכחי.
| פעילות יתר ראשונית של בלוטות יותרת-התריס - טיפול בנטפרה | ||
|---|---|---|
| Primary hyperparathyroidism - treatment with natpara | ||
| יוצר הערך | פרופ׳ צופיה איש-שלום | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – רמת סידן בדם ובלוטת יותרת התריס#הפרעות בפעילות יותרת התריס
מחלות אנדוקריניות משתייכות לשלוש קבוצות עיקריות:
- מצבי חסר הורמונלי
- מצבי עודף
- עמידות להורמון
הטיפול המתאים ביותר למצב חסר הורמונלי הוא מתן ההורמון החסר, באופן שמחקה את הפרשתו הפיזיולוגית. הדבר מתאפשר בדרך כלל באופן חלקי, אך בכל מצבי החסר המוכרים ניתן טיפול הורמונלי, מלבד בטיפול בתת פעילות ראשונית של בלוטות יותרת התריס (Primary hypoparathyrodism).
תת פעילות ראשונית של בלוטות יותרת התריס היא "מחלה יתומה", כלומר מחלה שהחולים בה מעטים. בארצות הברית דווח על כ-70,000 חולים[1]. לא נעשה מחקר אפידמיולוגי בנושא זה בישראל, אך ניתן להעריך שיש כמה מאות חולים בארץ. המחלה נובעת מחסר הורמון PTH (Parathyroid hormone). היות ומדובר בהורמון חיוני לבקרת משק הסידן והזרחן בגופנו, החסר יתבטא בהיפוקלצמיה (Hypocalcemia), היפרפוספטמיה (Hyperphosphatemia), רמה נמוכה של 0H)2D)1,25 ורמה נמוכה או נמוכה יחסית לריכוז הסידן בדם של ההורמון PTH בבדיקת מעבדה.
ברוב המקרים מדובר במחלה נרכשת והסיבה השכיחה ביותר היא כריתה של בלוטות יותרת התריס בניתוחי צוואר[1],[2],[3],[4],[5]. ייתכן גם הרס עקב תהליך אוטואימוני, הקרנות, שקיעת ברזל או נחושת בתוך הבלוטה[4],[5],[6]. לעתים נדירות מדובר במחלה גנטית כגון תסמונת DiGeorge syndrome ואחרות.
הביטוי הקליני של המחלה הנובע מהיפוקלצמיה, נע בין התייצגות מתונה יחסית של נימול, התכווצויות שרירים, "הרדמות" גפיים, עייפות וקשיי חשיבה וריכוז; לביטוי חמור של גירוי נוירומוסקולרי כגון טטניה, לרינגו-ברונכוספאזם (Laryngo-bronchospasm) ומעורבות מערכת העצבים המרכזית: מצב בלבולי, פרכוסים ואבדן הכרה. תיתכן מעורבות לבבית כגון הארכת מקטע QT ואי ספיקת לב[2],[4].
הטיפול בביטוי חמור וחריף של המחלה הוא מתן תוך ורידי של מלחי סידן ומטבוליט פעיל של ויטמין D, באשפוז ותחת בקרה[2],[7].
הטיפול הכרוני כולל מתן פומי של תוסף סידן ומטבוליט פעיל של ויטמין D. יעדי הטיפול הם השגת הקלה בתסמיני ההיפוקלצמיה ומניעת סיבוכים ארוכי טווח. מבחינה מעבדתית, השאיפה היא לשמור את ריכוז הסידן המתוקנן לאלבומין בין 8 ל-8.5 מיליגרם לדציליטר (מ"ג/ד"ל), ריכוז הזרחן מתחת ל-6 מ"ג/ד"ל, מכפלת ריכוזי סידן זרחן בסרום מתחת ל-55 מ"ג2/ד"ל2 ולשמור על הפרשת הסידן בשתן בתחום התקין. היפרקלציאוריה (Hypercalciuria) ממושכת יכולה לגרום ל-Nephrocalcinosis, Nephrolithiasis ומחלת כליות כרונית עם ירירה בתפקוד הכלייתי. היפרפוספטמיה עלולה להוביל לשקיעת מלחי סידן זרחן ברקמות הרכות ובגרעינים הבזליים במוח. ההצלחה בהשגת יעדי הטיפול[1] והמינון הטיפולי של תוספי סידן והמטבוליט הפעיל של ויטמין D, שונה מאוד מאדם לאדם. לעתים למרות מתן מינונים גבוהים של תכשירי הטיפול לא מושגים יעדי הטיפול, החולים סובלים מפגיעה באיכות חיים[2],[8] ומאירועי היפוקלצמיה סימפטומטית המחייבים אשפוז, זאת למרות הקפדה על תזונה דלת זרחן, צריכת תכשירים קושרי זרחן ו-Hydrochlorothiazide. עבור חולים אלה נדרש פיתרון יעיל יותר - מתן Natpara [(1-84) rhPTH] , שיעילותו בטיפול בתת פעילות ראשונית של בלוטות יותרת התריס הוכחה.
פרמקודינמיקה
Natpara זהה במבנה למולקולת PTH אנדוגני, המכילה קצה N - טרמינלי (34 חומצות אמינו) וקצה c - טרמינלי המכיל 50 חומצות אמינו[9],[10]. ל-PTH תפקיד מכריע בבקרת משק הסידן. הפרשת PTH מווסתת על ידי ריכוז יוני הסידן בסרום. חיישני הסידן (CaSRs, Calcium Sensing Receptors), הממוקמים בדפנות תאי ארבע בלוטות יותרת התריס, מעבירים לתוך התא מסר בהתאם לריכוז יוני הסידן בסרום[11]. ירידה קלה בריכוז יוני הסידן גורמת להפרשה של PTH ובהמשך להגברה של יצור ההורמון בבלוטות אלו ואילו לעלייה בריכוז יוני הסידן השפעה הפוכה. בכך נשמרת רמת יוני הסידן בסרום באדם הבריא בטווח קבוע ויציב של 5.3-4.4 מ"ג/ד"ל . הסידן היוני מהווה קצת פחות מ-50% מסך הסידן שנמדד בבדיקות שגרה מעבדתיות.
PTH יחד עם שני הורמונים נוספים: 0H)2D)1,25 (מטבוליט פעיל של ויטמין D) ו-23 FGF (23 Fibroblast Growths Factor) מווסת את רמת הסידן והזרחן בסרום, על ידי השפעה ישירה ועקיפה על עצם, כליה ומעי[12].
PTH פועל בשני אופנים שונים. חשיפה רציפה להורמון גורמת להפרשה של הסידן והזרחן מהעצם על ידי הגברת פרוק העצם עקב עידוד התמיינות האוסטיאוקלסטים (Osteoclasts) - תאים מפרקי עצם. חשיפה קצרה להורמון זה מעודדת התמיינות ושרידות של האוסטיאובלסטים (Osteoblasts) - תאים בוני עצם. כך שמצד אחד ההורמון מסייע בגיוס מהיר של יוני הסידן מהמאגר בשלד [בגוף האדם מכיל השלד 1.5-1 קילוגרם (ק"ג) סידן, המהווה מאגר חרום של יוני הסידן] ומאידך מעודד את בניית העצם ואת התחדשותה[13].
בכליה PTH מעודד את הספיגה מחדש (Reabsorption) הטובולרית של יוני הסידן ומגביר את הפרשת יוני הזרחן. כמו כן הוא מעודד את יצירת המטבוליט הפעיל של ויטמין D 0H)2D)1,25 מ-0H)D)25, המשפיע על ספיגת הסידן והזרחן במעי. ל-PTH ול-0H)2D)1,25 תפקיד חשוב בהגברת יצור והפרשה של 23 FGF, הורמון פוספטורי. מכוח פעולה זו נשמרת מכפלת ריכוז הסידן והזרחן בסרום בתחום פיזיולוגי קבוע, שמונע יצירת משקעי מלחי סידן זרחן ברקמות הגוף[4]. לאור מורכבות הפעילות הפיזיולוגית של PTH והקושי לחקותה במדויק, בוצעה שורה של מחקרים להערכת ההשפעה של Natpara על משק הסידן והזרחן בחולי תת פעילות ראשונית של בלוטות יותרת התריס.
במחקר פאזה I, בשבעה חולי תת פעילות ראשונית של בלוטות יותרת התריס, מתן Natpara בהזרקה תת עורית בירך גרם לעלייה בריכוז הסידן בסרום לערך שיא (Peak) 12 שעות לאחר ההזרקה והריכוז נשמר מעל הערך שלפני ההזרקה, לאחר 24 שעות. התגובה הייתה גדולה יותר לאחר מתן 100 מיקרוגרם (מק"ג), בהשוואה למתן 50 מק"ג. כמו כן נצפתה ירידה בהפרשת הסידן בשתן[14],[15]. הזמינות הביולוגית של Natpara לאחר הזרקה תת עורית היא 53%[14]. התרופה מתפנה בעיקר באמצעות הכבד ובמידה פחותה דרך הכליה[14].
יעילות
- מחקרים קליניים פאזה III
הפיתוח הקליני של הטיפול ב-Natpara בתת פעילות ראשונית של בלוטות יותרת התריס, כלל ארבעה מחקרי פאזה III:
- (RACE (NCT01297309
- (REPLACE (NCT00732615
- (RELAY (NCT01268098
- (REPEAT (NCT01455181
התרופה אושרה על ידי ה-FDA (Food and Drug Administration) לטיפול בתת פעילות ראשונית של בלוטות יותרת התריס על סמך ממצאי מחקר REPLACE[9],[16].
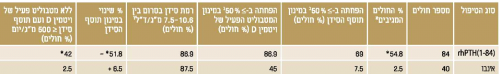
א. הכוונה למטופלים שבהם הושגו כל שלושת היעדים העיקריים של המחקר:
1. הפחתה ביותר מ-50% במינון תוסף הסידן
2. הפחתה ביותר מ-50% במינון המטבוליט הפעיל של ויטמין D
3. רמת הסידן בסרום, המתוקננת לאלבומין בין 7.5 ל-10.6 מ"ג/ד"ל
ב,ג,ד. התייחסות ליעדים 1,2,3 בנפרד
*0.001>p לעומת אינבו
במחקר זה, מחקר כפול סמיות, מבוקר אינבו (Placebo), נבדקה יעילות ובטיחות של טיפול ב-Natpara בחולים עם תת פעילות ראשונית של בלוטות יותרת התריס. במחקר נכללו חולים עם תת פעילות ראשונית של בלוטות יותרת התריס מוכחת במשך 18 חודשים לפחות, בגילאי 18 עד 85 (גיל ממוצע 47), 79% היו נשים. חולים שסבלו ממוטציות ב-CaSR או מ-Pseudohypoparathyroidism לא נכללו במחקר. לפני תחילת המחקר החולים עברו תקופת "הכשרה". בתקופה זו, שנמשכה 16-2 שבועות, תוקנו חסרים במגנזיום וויטמין D והופסק הטיפול ב-Hydrochlorothiazide[9],[16],[17]. רמת הסידן בסרום אוזנה ל-9-8 מ"ג/ד"ל על ידי מתן סדיר של תוסף סידן ומטבוליט פעיל של ויטמין D, 0H)2D)1,25 או Alfacaicidol. חולים ששמרו על איזון יציב של רמת הסידן בתחום היעד עברו רנדומיזציה לקבוצת טיפול או אינבו ביחס 2 ל-1. 84 חולים נכללו בסיום המחקר בקבוצת הטיפול ו-40 בקבוצת האינבו. משתתפי קבוצת הטיפול קבלו 50 מק"ג Natpara, בהזרקה תת עורית בירך פעם ביום, באמצעות מזרק - Multidose. טיפול זה ניתן תוך הורדה הדרגתית במינון תוסף הסידן ו-0H)2D)1,25. בחולים שלא השיגו את יעד הטיפול: הפחתה של מינון תוסף הסידן ל-500 מ"ג ליום והפסקת מתן 0H)2D)1,25, ניתן היה להעלות את המינון הטיפולי של Natpara לפי שיקול דעת החוקר, ל-75 ולאחר מכן ל-100 מק"ג ליום לאחר שבועיים ו-4 שבועות מתחילת הטיפול. לאחר 5 שבועות לא ניתן היה לבצע העלאה של המינון הטיפולי של Natpara, אך ניתן היה לבצע הפחתה, עד למינון של 50 מק"ג ליום[17]. כמו כן ניתן היה לבצע התאמה של מינון תוסף הסידן והמטבוליט הפעיל של ויטמין D במטרה למנוע היפרקלציאוריה ולמנוע עלייה בערכי מכפלת ריכוזי הסידן הזרחן בסרום מעבר לתחום היעד.
תוצאות המחקר סוכמו בטבלה מספר 1. נצפתה ירידה משמעותית במינון תוסף הסידן בקבוצת הטיפול. כמו כן היה הבדל משמעותי באחוז החולים שהפסיקו את השימוש במטבוליט הפעיל של ויטמין D והפחיתו במידה ניכרת את מינון תוסף הסידן, לפחות מ-500 מ"ג ליום (42% בקבוצת הטיפול לעומת 2.5% בקבוצת האינבו) (ראו טבלה 1).
בשתי הקבוצות נצפתה ירידה בהפרשת הסידן בשתן: 79.4- מ"ג/24 שעות בקבוצת Natpara לעומת 91- מ"ג/24 שעות בקבוצת האינבו[16]. בעת הכללה למחקר חולה אחד בכל אחת מקבוצות המחקר התייצג עם מכפלת ריכוזי סידן זרחן בסרום מעל לתקין (יותר מ-55 מ"ג2/ד"ל2), לאחר 24 שבועות טיפול, רק חולה אחד בקבוצת האינבו הציג ערך זה[9],[17]. כמו כן נצפתה ירידה בריכוז הזרחן בסרום ב-0.48 - מ"ג/ד"ל בממוצע בקבוצת הטיפול לעומת 0.04 - מ"ג/ד"ל בקבוצת האינבו. לאחר 24 שבועות טיפול נצפתה עלייה בכל מדדי שחלוף העצם (Bone turnover markers) בקבוצת הטיפול ב-Natpara, ללא עלייה בקבוצת האינבו.
מחקר RELAY בדק את ההשפעה של מתן מינון קבוע של Natpara 25 לעומת 50 מק"ג ליום, במשך 8 שבועות, לחולים שהשתתפו קודם לכן במחקר עם Natpara. 21% מהחולים בקבוצת 25 מק"ג ליום לעומת 26.1% בקבוצת 50 מק"ג ליום הוגדרו כמגיבים לטיפול, כלומר השיגו את כל שלושת יעדי המחקר:
- הפחתת מינון תוסף הסידן לפחות מ-500 מ"ג ליום
- הפחתת מינון המטבוליט הפעיל של ויטמין D לפחות מ-0.25 מק"ג ליום
- שמירה על ריכוז הסידן המתוקנן לאלבומין בסרום בין 7.5 מ"ג/ד"ל לגבול העליון של הנורמה (בהמשך יוגדר כתחום היעד)
במחקר זה לא נצפה הבדל בהשפעה טיפולית של שני המינונים.
מחקר RACE, מחקר המשך פתוח לחולים שהשתתפו קודם לכן במחקר REPLACE או במחקר RELAY (סה"כ 49 חולים), כלל טיפול ב-Natpara במינון של 25, 50, 75 ו-100 מק"ג ליום במשך 52 שבועות עם אפשרות להאריך את הטיפול למשך שנה נוספת. בתום 52 שבועות טיפול השיגו 75.6% מהמטופלים את יעדי הטיפול: הפחתה של מינון תוסף הסידן לפחות מ-500 מ"ג ליום או הפחתה ביותר מ-50% במינון תוסף הסידן; הפחתת מינון המטבוליט הפעיל של ויטמין D לפחות מ-0.25 מק"ג ליום או הפחתה ביותר מ-50% במינון ושמירה על רמת הסידן המתוקנן לאלבומין בסרום בתחום היעד. נכון לספטמבר 2014, 38 חולים השלימו 36 חודשי השתתפות במחקר, 50% מהם השיגו את יעדי הטיפול בתום תקופה זו[18].
מחקר REPEAT, מחקר פתוח, גם הוא מחקר המשך ל-REPLACE, כלל 24 חולים שקבלו טיפול ב-Natpara במינון התחלתי של 50 מק"ג ליום, עם עלייה ל-75 עד 100 מק"ג ליום אם נדרש, 75% מהמטופלים השיגו את יעדי הטיפול בשונה מיעדי הטיפול במחקרים קודמים, רמת הסידן המתוקנן לאלבומין כאן הגיעה לתחום התקין[19].
בטיחות
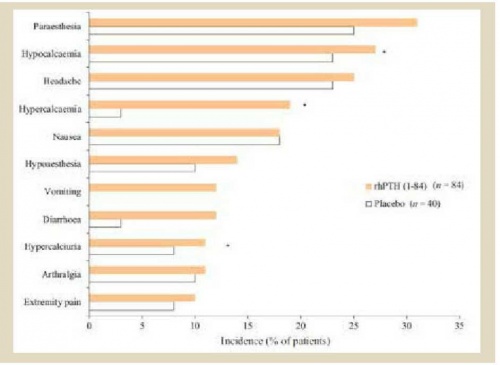
במחקרי פאזה III דווחו כ-10% מהמשתתפים בכל אחת מהקבוצות (טיפול פעיל ואינבו) על תופעת לוואי חמורה אחת לפחות (Serious adverse events). הפסקת טיפול בעקבות ארועים אלה נצפתה בקבוצת הטיפול ב-Natpara בלבד, ב-2.4% מהחולים, אך ארועים אלה סוכמו כאינם קשורים למתן התרופה. ארועי היפוקלצמיה, היפרקלצמיה והיפרקלציאוריה נצפו בשתי הקבוצות, עם שכיחות גבוהה יותר בקבוצת הטיפול בעיקר לגבי היפרקלצמיה, בתקופת העלייה במינון הטיפולי - תקופת הטיטרציה (ב־30% בקבוצת הטיפול לעומת 0% בקבוצת האינבו). ראו תרשים מספר 1.
נוגדנים להורמון PTH אותרו ב-8.6% ממטופלי Natpara וב-5.9% בקבוצת הביקורת[14]. בסיכום של כל מחקרי הטיפול, היארעות הופעת הנוגדנים הגיעה ל-16.1%, ללא עדות לתופעות לוואי עקב נוכחותם[16]. לא נצפו שינויים בעלי משמעות קלינית בסימנים חיוניים, בתרשימי אק"ג או מדדים מעבדתיים נוספים. כמו כן התכשיר כולל Boxed warning לגבי סיכון פוטנציאלי לחלות באוסטיאוסרקומה (Osteosarcoma), לאור העובדה שמכרסמים שנחשפו למינון גבוה (פי 70 מהמנה הטיפולית) של 1-34 rhPTH או Natpara סבלו מאוסטיאוסרקומה. 1-34 rhPTH נמצא בשימוש קליני מתחילת שנות האלפיים בטיפול באוסטיאופורוזיס וניתן, נכון לשנת 2015, ללמעלה ממיליון מטופלים, ללא כל עדות לעלייה בהיארעות באוסטיאוסרקומה במטופלים אלה[20]. גם שימוש ב-Natpara במשך למעלה מ-6 שנים לא חשף עלייה בסיכון זה[21].
מחקר עתידי
Natpara הוא הטיפול התחליפי הראשון הזמין בארצות הברית לאחר אישור FDA לחולים הסובלים מתת פעילות ראשונית של בלוטות יותרת התריס, שאינם מצליחים להגיע לאיזון מספק של ריכוזי הסידן והזרחן בסרום תוך טיפול במטבוליט פעיל של ויטמין D ותוסף סידן. הטיפול הוכח כיעיל ובדרך כלל נסבל היטב. השימוש בו מחייב מיומנות ובקרה תכופה של ריכוזי הסידן והזרחן בסרום, תוך העלאת מינון Natpara במקביל להורדה במינון תוסף הסידן ומטבוליט פעיל של ויטמין D, בעיקר בשלבי טיפול התחלתיים. אומנם אופן המתן, בהזרקה במנה יומית אחת, אינו מחקה את ההפרשה הפיזיולוגית, אך הוא נוח למטופל והשיג תוצאות טיפוליות טובות. ייתכן ובעתיד מתן פולסטילי באמצעות משאבה או באמצעות Transdermal patch, ישיג תוצאות איזון טובות יותר. מחקרים ארוכי טווח, שיעריכו את בטיחות ויעילות הטיפול, כולל השפעות על מטבוליזם העצם, על מדדי איכות חיים ועל סיבוכים רב מערכתיים, יקבעו בעתיד את הקווים המנחים לטיפול בתת פעילות ראשונית של בלוטות יותרת התריס.
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 Powers J, Joy K, Ruscio A, et al. Prevalence and incidence of hypoparathyroidism in the United States using a large claims database. J Bone Miner Res. 2013;28(12):2570-6.
- ↑ 2.0 2.1 2.2 2.3 Bilezikian JP, Khan A, Potts JT Jr, et al. Hypoparathyroidism in the adult: epide¬miology, diagnosis, pathophysiology, target-organ involvement, treatment, and challenges for future research. J Bone Miner Res. 2011;26(10):2317-37.
- ↑ Pajevic PD, Wein MN, Kronenberg HM. Parathyroid hormone actions on bone and kidney. In: Brand[ ML, Brown EM,editors. Hypoparathyroidism. Milan:Springer; 2015. p. 99-109.
- ↑ 4.0 4.1 4.2 4.3 Shoback D. Clinical practice. Hypoparathyroidism. N Engl J Med. 2008;359(4):391-403.
- ↑ 5.0 5.1 Clarke BL. Epidemiology of hypoparathyroidism. In: Brandi ML, Brown EM, editors, hypoparathyroidism. Milan: Springer; 2015. p. 139-54.
- ↑ Wheeler AL, Shoback DM. Clinical presentation of hypoparathyroidism. In: Brandi ML, Brown EM, editors. Hypoparathyroidism. Milan: Springer; 2015. p. 155-65
- ↑ Horwitz MJ, Stewart AF. Hypoparathyroidism: is it time for replacement therapy? J Clin Endocrinol Metab. 2008;93(9): 3307-9.
- ↑ Arlt W, Fremerey C, Callies F, et al. Well-being, mood and calcium homeostasis in patients with hypoparathyroidism receiving standard treatment with calcium and vitamin D. Eur J Endocrinol. 2002;146(2):215-22.
- ↑ 9.0 9.1 9.2 9.3 9.4 US FDA. FDA briefing document for the September 12,2014 meeting of the Endocrine logic and Metabolic Drugs Advisory Committee. 2014. ttp://www.fda.gov/,
- ↑ D'Amour P. Circulating PTH molecular forms: what we know and what we dont. Kidney Int Suppl. 2006;70(Suppl 102s):S29-33.
- ↑ Isaia G, Marchetti M. PTH and PTH-related peptides. In: Brandi ML, Brown EM, editors. Hypoparathyroidism. Milan: Springer;2015. p. 19-24.
- ↑ Goltzman D, Kara pi is AC. The PTH/vitaminD/FGF23 axis. In: Brandi ML, Brown EM, editors. Hypoparathyroidism. Milan: Springer; 2015. p. 69-79.
- ↑ Goltzman D, Kara pi is AC. The PTH/vitaminD/FGF23 axis. In: Brandi ML, Brown EM, editors. Hypoparathyroidism. Milan: Springer; 2015. p. 69-79.
- ↑ 14.0 14.1 14.2 14.3 14.4 US FDA. Natpara_ (parathyroid hormone) for injection: US prescribing informa¬tion. 2015. http://www.fda.gov/. Accessed 22 June 2015.
- ↑ Clarke BL, Kay Berg J, Fox J, et al. Pharmacokinetics and pharmacodynamics of subcutaneous recombinant parathyroid hormone (1-84) in patients with hypopara-thyroidism: an openlabel, single-dose, phase I study. Clin Ther. 2014;36(5):722-36
- ↑ 16.0 16.1 16.2 16.3 16.4 US FDA. Natpara (parathyroid hormone) medical review. 2015.
- ↑ 17.0 17.1 17.2 Mannstadt M, Clarke BL, Vokes T, et al. Efficacy and safety of recombinant human parathyroid hormone (1-84) in hypoparathyroidism (REPLACE): a double-blind, placebo-controlled, randomised, phase 3 study. Lancet Diabetes Endocri-nol.2013;1(4):275-B3.
- ↑ Clarke BL, Mannstadt M, Vokes TJ, et al.Three-year safety and efficacy data for recombinant human parathyroid hormone, rhPTH(l-84), in the treatment of adults with hypoparathyroidism: the RACE study [abstract no. OC3.5]. In: 17th European Congress of Endocrinology; 2015.
- ↑ LakatosP, BajnokL, Lagast H, etal.The REPEAT Study: an open-label clinical trial evaluating the safety and efficacy of recombinant human parathyroid hormone, rhPTH (1-84), for the treatment of hypoparathyroidism in Hungary [abstract no.OC6.4]. In: 16th European Congress of Endocrinology; 2014.
- ↑ Andrews EB, Gilsenan AW, Midkiff K, et al. The US postmarketing surveillance study of adult osteosarcoma and teriparatide: study design and findings from the first 7 years. J Bone Miner Res. 2012;27(12):2429-37.
- ↑ Cipriani C, Irani D, Bilezikian JP. Safety of osteoanabolic therapy: a decade of experience. J Bone Miner Res. 2012;27(12):2419-28 a decade of experience. J Bone Miner Res. 2012:27(12):2419-28
קישורים חיצוניים
המידע שבדף זה נכתב על ידי פרופ׳ צופיה איש-שלום, מומחית לרפואה פנימית, אנדוקרינולוניה וסוכרת, סיו"ר העמותה הישראלית לאוסטיאופורוזיס ומחלות עצם


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק