פפטיד מעי וזואקטיבי - Vasoactive intestinal peptide
| מדריך בדיקות מעבדה | |
| פפטיד מעי ואזואקטיבי | |
|---|---|
| Vasoactive intestinal peptide | |
| שמות אחרים | VIP |
| מעבדה | כימיה בדם או אנדוקרינולוגיה בדם |
| תחום | הורמון פפטידי רב-תכליתי, שמדידתו נעשית בעיקר לאבחון שאת המפרישה פפטיד זה (VIPoma) |
| טווח ערכים תקין | בדם - פחות מ-75 פיקוגרם למ"ל. רמת VIP ב-CSF גבוהה בערך פי 10 מרמתו בפלזמה |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
מדידת רמת VIP חיונית לגילוי שאתות המייצרות VIP בנבדקים עם מחלת שלשולים כרונית. שאתות מסוג VIPoma נדירות יחסית, כאשר 90% מהן ממוקמות בלבלב. צואה שלשולית מיימית, היפוקלמיה ו-achlorydria, הם תסמינים בולטים. השאת הפנקראטית מפרישה כמויות גדולות של VIP, עם ערכים בדם של מעל 75 פיקוגרם למ"ל שיכולים להגיע עד מעל 200 פיקוגרם למ"ל. נפח הצואה המיימית עלול להגיע עד 3 ליטר ביממה במקרים קיצוניים, כאשרה נפח צואה של פחות מ-700 מ"ל ל-24 שעות שולל ברוב המקרים אפשרות של VIPoma. תסמינים אחרים עלולים לכלול כאבי בטן והתכווצויות, בחילות, איבוד משקל וסומק בפנים. שלשולים כרוניים אהל עלולים להביא להתייבשות, מה שמחייב עירויי נוזלים.
אחד השימושים הקליניים הנפוצים ביותר של לקביעה כמותית ב-RIA של רמה גבוהה של VIP בנסיוב, הוא בהערכה של שלשולים מימיים מתמשכים בנפח גבוה כתוצאה מגידולים פנקראטים או ברונכוגנים, כפי שדווחו Said ו-Faloona ב-1975 ב-N Eng J Med. אלה עם שאתות מייצרות VIP מתאפיינים השלשולים בנפח גבוה כפי שהדגימו Masel וחב' בשנת 2000 ב-J Gastroenterol Hepatol ובטביעת המושג "שלשול לבלבי". במטופלים עם נפחי שלשול קטנים ולא תכופים, נשללת האפשרות של VIPoma.
רקע היסטורי של גילוי VIP
בשנת 1968, תוך התבססות על תצפית לפיה מטופלים עם פגיעה ריאתית קשה או תסחיף ריאתי (PE), מפתחים לעיתים קרובות לחץ-דם סיסטמי נמוך עד כדי הלם, ניסה Sami Said לבודד פפטיד הגורם לואזו-דילטציה מתמצית ריאות. בידוד פפטיד זה מרקמת ריאות נתקל בקשיים בגלל מיעוט רקמה ממנה ניתן היה לבודד אותו. בהמשך, Said בשיתוף פעולה עם Viktor Mutt, החליטו לחפש את אותו פפטיד המרפה כלי-דם דווקא בחלק העליון של המעי, שהרי רקמה זו כמו גם הריאות מקורם מאותה רקמת נבט עוברית, החלק העליון של מערכת העיכול (foregut). גישה זו הוכחה כנכונה, ובשנת 1970 פרסמו השניים ב-Science על בידוד מתריסריון של חזיר של פפטיד בעל פעילויות ביולוגיות מגוונות, כולל היותו "hypotensive vasodilator" . באותה שנה פרסמו השניים גם ב-Nature על בידוד VIP שלאחר הזרקתו הסיסטמית, גורם לרלקסציה של שריר חלק במעיים.
המבנה של VIP
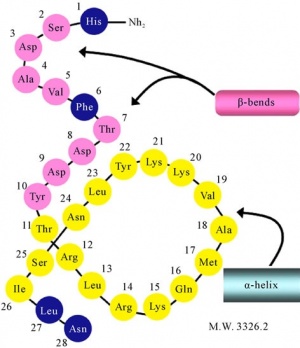
בשנים 4–1973 ריצפו Said וחב' את VIP ממקור חזיר, במאמרים ב-Eur J Biochem וב-Proc Natl Acad Sci, ומצאו שהוא פפטיד בן 28 חומצות אמינו בעל משקל מולקולארי של 3,326 דלטון, שרצף חומצות האמינו שלו הוא כדלהלן:
NH2-His-Ser-Asp-Ala-Val-Phe-Thr-Asp-Asp-Tyr-Thr-Arg-Leu-Arg-Lys-Gln-Met-Ala-Val-Lys-Lys-Tyr-Leu-Asn-Ser-Ile-Leu-Asn-COOH
רצף חומצות האמינו של VIP נלמד בפרוט על ידי Nussdorfer ו-Malendowicz והתפרסם בשנת 1998 ב-Peptides. נמצא ש-VIP השתמר במהלך האבולוציה באופן מרשים ופפטיד זה ממקור אדם, זהה לחלוטין לזה של חזיר, פרה, כבש, עז, כלב, ארנבת וחולדה. אפילו VIP שבודד מחזיר-ים, ומבעלי חיים שאינם יונקים כגון תרנגולת, תנין, צפרדע, דג שמך כמו גם סוגי דגים אחרים, שונה מזה של האדם רק ב-4 עד 5 שיירי חומצות אמינו.
כמו פפטידים רבים של מערכת העיכול, גם VIP מסונתז תחילה כזימוגן, או חלבון מקדים בנוסח "prepro-VIP" המורכב מ-170 חומצות אמינו, עם signal peptide המכיל 22 חומצות מינו בקצה ה-N טרמינאלי (Linder וחב' ב-Proc Natl Acad Sci משנת 1987). ביקוע פרוטאוליטי של prepro-VIP מביא להופעת הקטעים הפפטידיים הבאים: פפטיד 22–79, פפטיד היסטידין-איזולאוצין/היסטידין מתיונין או (PHI/PHM-81-107), פפטיד 111–122, פפטיד VIP (125-152), ועוד פפטיד (156–170). הפפטיד PHI/PHM קשור ל-VIP והוא בעל מספר תכונות ביולוגיות משותפות, אך פוטנטי פחות מ-VIP.
כאשר נעשה אנליזה של VIP בשיטת circular dichroism או על ידי ספקטרוסקופיית NMR, נמצא שלפפטיד יש מבנה הליקאלי כאשר שיירים 11 עד 26 הם בעלי מבנה α-הליקאלי-2 וכן ישנם 2 כיפופים (β-bends) בין השיירים- 2 עד 5 ו-1 עד 10. כן המבנה מכיל 2 קטעים הליקאליים בין השיירים 7 עד 15, ו-19 עד 27. הקצוות ה-N-טרמינאלי וה-C טרמינאלי חיוניות להכרת הקולטן ולפעילות הביולוגית של VIP. בשנות ה-90 הגן VIP המקודד ל-VIP שובט ומוקם לכרומוזום 6 בעמדה q25.26 על פי Gozes וחב' ב-Somat Cell Mol Genet משנת 1987.
המבנה של VIP דומה לזה של מספר פפטידים אחרים, כולל GLP או glucagon-like peptide, וכן GRF או growth hormone-releasing factor, כמו גם PHI או peptide histidine isoleucine ו-PHM או peptide histidine methionine, וכן גם helodermin, אך בעיקר יש ל-VIP הומולוגיה עם PACPA27 או pituitary adenylate cyclase activity peptide, כאשר 24 מתוך 27 חומצות האמינו של הפפטיד האחרון זהות לאלה ב-VIP. ל-VIP יש גם 33% הומולוגיה עם ההורמון secretin.
פעילויות פיזיולוגיות של VIP
מסתבר ש-VIP המופרש מתאים אנדוקריניים במערכת העצבים המרכזית, ההיקפית, מהמעי או מבלוטת הלבלב, הם בעלי מבנה זהה. כאמור, VIP מיוצר בבעלי חוליות על ידי המעי, הלבלב, ובגרעינים סופרה-כיאזמטיים (suprachiasmatic nuclei) בהיפותלמוס. VIP מעודד את יכולת ההתכווצות של הלב, גורם ל-vasodilation, מגביר את הגליקונאוגנזה, מעכב שחרור היסטאמין, פנטגסטרין ופפסין, מקטין את לחץ הדם העורקי, ומרפה את השרירים החלקים של קנה הנשימה, של הקיבה ושל כיס המרה.
הפיזור של VIP ברקמות כה רבות, תואם את מעורבותו בפעילויות פיזיולוגיות מגוונות, כמו וזודילטציה סיסטמית, הגברת תפוקת הלב, ברונכודילטציה, היפרגליקמיה, הרפיית שרירים חלקים, ההתפתחות העוברית, עידוד גדילה, ויסות פעילות של הורמונים שונים, שיכוך כאבים, היפרתרמיה, השפעות נוירוטרופיות, למידה והתנהגות, וויסות השינה, מטבוליזם של העצם, שחרור של הורמוני הלבלב דוגמת אינסולין ועידוד הפרשת מים וביקרבונאט מהלבלב וכן גם מים ואלקטרוליטים מהמעי, השפעות על תהליכי הפרש במערכת העיכול, עידוד הפרשות מרה, עיכוב הפרשת חומצת קיבה והתרוקנות הקיבה.
ההורמון VIP מפוזר באופן ניכר הן במערכת העצבים המרכזית כמו גם ההיקפית, בהן הוא משמש הן כנוירוטרנסמיטור וכן כ-neuromodulator. בפעילותו האחרונה VIP משפיע על ההפרשה, והתנועתיות בקיבה/מעי, כמו גם על שפיעת הדם בבלוטת הלבלב ובמעיים, ופעילויות דומות מיוחסות ל-VIP גם במערכות הקרדיו-וסקולארית, הנשימה, ומערכת דרכי השתן (Dockray משנת 1994 בספרו "VIP and related peptides").
- הפעילות הפיזיולוגית העיקרית של VIP היא הרפיית כלי דם והרחבתם. VIP משרה הרחבת כלי-דם היקפיים, כלי דם במעיים, עורקים כליליים, עורק הריאה, מה שמגביר שפיעת דם, מפחית תנגודת של כלי-דם היקפיים, וגורם ל-hypotension. יתרה מכך, VIP מגביר את זרימת הדם בעורק הכבד ובכלי הדם בלבלב. כיוון של-VIP יש פעילות מרחיבת כלי-דם, נגזרת של VIP הידועה כ-aviptadil נחשבת כבעלת פוטנציאל טיפולי ביתר לחץ-דם ריאתי כפי שתארו Leuchte וחב' ב-2008 ב-Eur Respiratory J.
- כפי שיש ל-VIP השפעה של דיכוי על השריר החלק של המעיים, הוא בעל השפעות מרפות על שריר השוער התחתון של הוושט, על ה-sphincter of Oddi ועל שריר השוער של פי הטבעת. יש ל-VIP גם השפעה מרפה על השריר החלק של הריאות.
- במעי הדק, VIP מעודד הפרשת אלקטרוליטים ונוזלים מיימיים. בקיבה מעכב VIP הפרשת gastrin וכתוצאה מכך מעכב הפרשת חומצות קיבה. VIP מעודד הפרשת פפסינוגן מתאי chief בקיבה. VIP מעודד הפרשת נוזלי מרה וביקרבונאט מתאים כולנגיוציטים במערכת המרה, כפי שהראו Cho ו-Boyer בחולדות במאמר משנת 1999 ב-Gastroenterology.
- בבלוטת הלבלב מעודד VIP הפרשה של חומצה ביקרבונית ונוזלים מימיים מתאי האפיתל הפנקראטיים, ומעודד הפרשת אנזימי לבלב מהתאים האצינריים כפי שהראו Ito וחב' בשנת 2000 ב-Gastrointestinal liver Physiol. מחברים אלה הראו תוך שימוש בתאים אצינריים שבודדו מלבלבים של חולדה וחזיר-ים, ש-90% מהפרשת אנזימי הלבלב נעשו בתיווך הקולטן VPAC1.
5) VIP מעודד את הפרשת אינסולין וגלוקגון במנגנון תלוי-גלוקוזה כפי שהדגימו Winzell ו-Ahren בשנת 2007 ב-Peptides. למרות ש-2 הקולטנים, VPAC1 ו-VPAC2 המבוטאים על תאים אנדוקריניים, הפרשת אינסולין נעשית בעיקר דרך התקשרות VIP לקולטן VPAC2. הפרשת אינסולין נעשית על ידי פעילות ישירה של האנזים protein kinase A, שפעילותו מוחשת על ידי VIP.
6) VIP מפוזר במערכת העצבים המרכזית, בעיקר בהיפותלאמוס ובאונה הקדמית של בלוטת יותרת המוח, והוא קשור עם וויסות הורמוני בלוטה זו. VIP כגורם המביא להפרשת פרולקטין, וכן הוא מעודד את הפרשת הורמון הגדילה GH, על פי Romano וחב' ב-J Biol Chem משנת 2003. ההורמון GH-RH או growth-hormone-releasing hormone הוא חבר במשפחת VIP, ולפיכך מעודד הפרשת growth hormone מהאונה הקדמית של בלוטות יותרת המוח. נמצא שרמות VIP נמוכות בדם של נשים שמנות, וגבוהות בדמן של נשים אנורקסיות, מה שמצביע על כך ש-VIP קשור לשיבושים בהפרשת פרולקטין והורמון דגילה בשני תרחישי הפרעות אכילה אלה (Baranowska וחב' ב-Annal NY acad Sci משנת 2000.
7) על פי מחקר של Pozo משנת 2000 בכתב העת Immunol Today, על ידי שימוש במקרופאגים, נמצא שהקולטן ל-VIP פועל לעיכוב השריית היצירה של האנזים NOS או Nitric oxide synthase, וכן הוא מעכב את יצירת הציטוקין מעודד הדלקת TNF-α, ולעומת זאת מעודד את יצירת הציטוקין נוגד הדלקת IL-10, זאת על פי Delgado וחב' משנת 1999 ב-J Immunol. תפקודים אלה ידועים ככאלה המתווכים על ידי דיכוי השפעול של גורם השעתוק הגרעיני NF-κB.
8) VIP יכול לעכב apoptosis על ידי שהוא מעודד את ביטויו של הגן bcl-2 מעכב האפופטוזיס, או על ידי עיכוב הפעילות של caspase 3, שהוא מרכיב ברצף התהליכים המוליכים לאפופטוזיס (Calafat ב-Atthritis Res Ther משנת 2009). אכן, Pastorina וחב' במחקרם משנת 2008 ב-Brain Res, הראו שהחדרת VIP עוכבה אפופטוזיס בתתאים אצינרים בלוטת תת-מנדיבולארית, כמו גם בתאי neurinoma.
9) VIP פועל גם כגורם גדילה במערכת העצבים (Muller וחב' ב-Molecular Neurobiol משנת 1995) וכן כמעודד שגשוג תאים הן בתאים נורמאליים כמו גם בסרטן הערמונית, בסרטן השד, סרטן הריאות והלבלב, וסוגי סרטן נוספים כפי שדיווחו Rernandes-Martinez ב-Peptide משנת 2009, כמו גם Moody ו-Gozes ב-Curr Pharmaceutical Design משנת 2007, וכן Jiang וחב' ב-Cancer Res משנת 1997. יתרה מכך, נמצא שאנטגוניסטים של הקולטן VPAC1 מעכבים את השגשוג של תאי סרטן השד והריאות בתרבית רקמה.
10) ל-VIP יש השפעה על כלי הדם הריאתיים ורבים מייחסים לו תפקיד במצבי יתר לחץ-דם ריאתי. VIP יכול להביא להרפיה של השרירים החלקים בכלי-דם בריאות, ועל ידי להחליש את פעילות endothelin בכיווץ כלי דם אלה. פעילות זו של VIP הייתה משמעותית יותר מפעילות דומה של אצטילכולין, של isoproterenol ושל PGE1, כפי שדיווחו Said וקבוצתו ב-J Appl Physiol Respir Environ Exerc Physiol בשנת 1983. אכן, כאשר יצרו עכברים טרנסגניים עם פגיעה מכוונת בגן של VIP, התקבל פנוטיפ הדומה באופן מפתיע לתרחיש של יתר לחץ-דם עורקי ריאתי ספונטאני, בוחנים גישות טיפוליות העושות שימוש ב-VIP או בנגזרים שלו לטיפול ביתר לחץ-דם ריאתי, כפי שהראו Dewachter וחב' ב-2010 ב-Expert Opin Investig Drugs.
חסר בנוירונים מפרישי VIP נכרך עם מספר מחלות מעי, ולדוגמה באלה עם מחלת Hirschspung נמצא חסר בגנגליונים מכילי-VIP במעי הגס ( על פי Larson ו-Sundler במאמר משנת 1990 ב-Z Kinderchir). בדומה מטופלים עם אכלזיה הם בעלי ריכוזים מופחתים של של VIP בתאי השריר החלק בוושט הדיסטאלית כפי שהראו Aggestrup וחב' ב-Gastoenterology משנת 1983. אכלזיה ((Achalasia, היא מחלה נדירה של הוושט, המתאפיינת ב-2 פגמים: התכווצות הוושט בקרבת הסוגר התחתון ואי יכולת להרפיה (מצב בשל טונוס מוגבר) עם הפרעה לתנועת המזון במעי; הפרעה בתנועה הפריסטלטית של הוושט, בחלקי הוושט התחתונים המורכבים משריר חלק בדופן.
פפטידים נוספים הנוצרים מהגן המקודד-VIP, כוללים את PHI או peptide histidine isoleucine (על פי Christofides וחב' ב-Lancet n-1982), את PHM או peptide histidine methionine (על פי Bodner וחב' ב-Proc. Natl. Acad, Sci משנת 1985), ואת PHV או peptide histidine valine. למרות שהמשמעות התפקודית של שלושת פפטידים אלה אינה ברורה, PHI ידוע כמעודד הפרשת נוזל במעיים כפי שהראו עוד בשנת 1982 Ghiglione וחב' ב-Neuropeptides. בשנת 1984 פרסמו Lundberg וחב' ב-Neurosci Lett, שהשחרור הסימולטני של VIP ו-PHI פועל בווזודילציה של בלוטות הרוק התת-מנדיבולאריות בחולדה. Holst וחב' הראו ב-1987 ב-Am J Physiol, ש-VIP ו-PHI משתחררים ופועלים יחד בבלוטת הלבלב של חזיר.
VIP מסייע לתגובה ההפרשתית לאצטילכולין באפיתל של בלוטות אנדוקריניות, ומעורב בבקרה של ההפרשה האקסוקרינית כמו גם האנדוקרינית, לא רק במערכת העיכול, אלא גם במערכת הנשימה ובצנרת האורו-גניטלית כפי שהראו Holst וחב' ב-Reg Pept בשנת 1984, ו-Lundberg וחב' ב-Proc Natl Acad Sci בשנת 1980. השחרור האנדוגני של VIP מתרחש על פי גירוי עצבי שתדירות גבוהה, אך יכול גם להתרחש כתגובה ל-neostigmine, כמו גם כתגובה לסרוטונין, לאגוניסטים דופאמינרגיים דוגמת bromocriptine או apomorphine, כמו גם כתגובה לפרוסטגנדינים PGE ו-PGD, וכן בתגובה ל-NGF כמו שהראה Said ב-Peptides ב-1984.
הקולטנים של VIP
הקולטן של VIP הוא חבר במשפחה של חלבוני הממברנה הידועה כ-GPCR או G protein coupled receptor הקושרים Guanine nucleotide או G protein, הכוללת גם את הקולטנים של PACAP, של secretin, של glucgon, של calcitonin, של parathyroid hormone, של GHRF או growth hormone-releasing factor, ושל CRF או corticotropin-releasing favgxctor. משפחת קולטני GPCR מחולקת ל-3 קבוצות (B, A ו-C), כאשר הקולטן ל-VIP שייך לקבוצה B, ומורכב מ-437–459 שיירי חומצות אמינו, כאשר חלק הפפטיד בקצהו ה-N טרמינאלי משתרבב אל מחוץ לממברנת התא, והוא מכיל מעל 120חומצות אמינו.
ב-1989 הדגימו Hershberger וחב' ב-Circ Res את נוכחות קולטנים ל-VIP בלב, ו-Huang וחב' הדגימו ב-1993 ב-Peptides את נוכחות נוגדנים אלה על דופן כלי דם וברקמות רבות אחרות. קולטני VIP נפוצים מאוד בשריר החלק של השוער (sphincter) התחתון של הוושט, באמפולה של Vater ובפי הטבעת, מקומות בהם VIP מווסת של הרלקסציה של ה-sphincter. הקולטנים של VIP בתאים האצינריים ובצינוריות בלבלב, כמו גם בתאי הרירית של המעיים, מתווכים בהפרשת נוזלים באיברים אלה.
המשקל המולקולארי של קולטני VIP נע בין 43,000 ל-80,000 דלטון, ושוֹנוּת זו בגודל הקולטנים, נובעת הן מההטרוגניות בגליקוזילציה שלהם עם שרשרות סוכריות בגודל שונה, אך גם מהטרוגניות בחלק החלבוני שלו. ידועים 2 סוגים של קולטני-VIP: האחד-VPAC1, והאחר- VPAC2, אשר שובטו מרקמת אדם וחולדה ורוצפו, ועל פי Usdin וחב' בדיווח משנת 1994 ב-Endocrinology, קיימת הומולוגיה של 50% בין שני תת-הסוגים של קולטני VIP: באדם, VPAC1 מכיל 457 חומצות אמינו, ו-VPAC2 מכיל 438 חומצות אמינו. בחולדה VPAC1 מכיל 459 חומצות אמינו, ו-VPAC2 מכיל 437 חומצות אמינו.
תוך שימוש בתאים אצינריים של הלבלב שבודדו מחזירי-ים, נמצא שה-VPACs מכילים 2 אתרי-קישור של VIP: אתר קישור אחד הוא בעל זיקה גבוהה ל-VIP, וקבוע דיסוסיאצית (Kd) קישור VIP היא 0.21nM. לאתר הקישור השני, יש זיקה נמוכה ל-VIP עם Kd של nM82.4. שני תת-הסוגים של הקולטנים ל-VIP הם בעלי מספר מאפיינים משותפים, כמו מספר אתרי גליקוזילציה ושיירי ציסטאין בחלק החוץ-תאי של הקולטן, 7 מקטעים (domains) בחלק החוצה את הממברנה, ומספר אתרים בחלק התוך-תאי של הקולטן, בהם מתרחש זרחון על ידי אנזימי קינאזה.
קולטני VPAC1 מפוזרים באופן נרחב במערכת העצבים המרכזית (קליפת המוח, גרעינים באמיגדלה, בהיפוקמפוס), וכן בכבד, בריאות, בכליות, בבלוטות החלב, בטחול, בלימפוציטים, וברירית המעי. וכן מוצאים אותם באבי העורקים, בבלוטת הערמונית, בלב, ברקמת השומן ובכלי הדם של הלבלב (Reubi וחב' ב-Cancer Res משנת 2000). במערכת העצבים המרכזית, קולטני VPAC1 מופיעים בקליפת המוח, ובקורטקס הפיריפורמי (Piriform Cortex) הממוקם סמוך לאנקול, בחלקה המדיאלי-העליון של אונת הרקה. כמו כן מוצאים קולטני VPAC1 בבלוטת האצטרובל, ב-putamen שבסטריאטום, בכורואיד פלקסוס, בגרעין האמיגדלואידי הלטראלי, ב-dentate gyrus שבהיפוקמפוס, ובגרעין הסופרה-אופטי שבהיפותלמוס, כפי שסיכמו Usdin וחב' בשנת 1994 ב-Endocrinology.
קולטני VPAC2 מופיעים בריכוזים גבוהים בשרירים החלקים של איברים שונים כמו גם בדופן כלי הדם. כמו כן מוצאים קולטנים אלה ברירית המעי הגס, בתאים הפוליקולאריים של בלוטת התריס, ברשתית העין, באנדותל של אבי העורקים, באפיתל של פקעיות הריאה, בלב, בלבלב, במדולה הכלייתית, בקליפת האדרנל ובמדולה של בלוטה זו, בשרירי השלד וברקמת השומן.
במערכת העצבים המרכזית קולטני VPAC2 שכיחים בקליפת המוח, בתלמוס, בפקעת הריח (olfactory lobe) שבתוך עצם הכברה, באמיגדלה, בגרעין הסופרה-כיאזמטי שבהיפותלמוס, בקליפה הפארא-ונטריקולארית, וכן מוצאים אותם בריכוזים נמוכים יותר בהיפוקמפוס, בגזע המוח, בעמוד השדרה ובגנגליוני השורש הגבי (dorsal root ganglia).
קולטני VPAC2 מופיעים גם בלימפוציטים ובמקרופאגים לאחר הדבקה חיידקית או נגיפית. על פי Dickson ו-Finlayson בסקירתם משנת 2009 ב-Pharmacology & Therapeutics, קולטנים-ל-VIP מופיעים בתאים סרטניים שונים: VPAC1 מבוטא על פני תאי סרטן ריאה, כבד, לבלב ומערכת העיכול. לעומת זאת, קולטני VPAC2 מבוטאים עיקר ב-leiomyoma, אך גם בסוגי סרטן אחרים.
מתנהל מחקר נמרץ לפיתוח של אגוניסטים ואנטגוניסטים ספציפיים ל-2 סוגי הקולטנים ל-VIP. על פי סקירתו של Harmar וחב' משנת 1998 ב-Pharmacol Rev, קיימים מספר אגוניסטים לקולטן VPAC1, כגון ארגינין במקום serine בעמדה 16 של chicken secretin, או כגון VIP משוחלף בו הוכנסו ליזין לעמדה 15, ארגינין לעמדה 16 ולאוצין לעמדה 27. שני האגוניסטים לקולטן VPAC2 הם Ro 25-1553 ו-Ro 25-1392. אנטגוניסט לקולטן VPAC1 הוא ([Ac-His1, d-Phe2, Lys15, Arg16]VIP(3-7)GRF(8-27)-NH2.
גידולים המייצרים VIP, כגון אדנוקרצינומה של הלבלב או שאת קרצינואידית, מבטאים גם את הקולטנים ל-VIP. לכן ניתן בשיטות הדמיה איזוטופיות למקם ולמפות גידולים כאדנוקרצינומה במעי או גידולים אנדוקריניים לצורך הסרתם כפי שדיווחו Virgolini וחב' ב-N Eng J Med בשנת 1994, וכן Pallela וחב' בשנת 1999 ב-J Nucl Med תוך שימוש באגוניסט לקולטן של VIP מסומן -99mTc.
מנגנון התגובה של קולטני VIP לקישור ההורמון
כאשר VIP נקשר לקולטן שלו, הוא משפעל את האנזים adenlate cyclase, כפי שהודגם בין השאר בכלי דם במוח על ידי Edvinsson וחב' ב-1985 ב-Neur Lett, באבי העורקים על ידי Schoeffter ו-Stoclet בשנת 1985 ב-Eur J Pharmacol, ובכלי דם כליליים של הלב כפי שמצאו Basler וחב' ב-1995 ב-Eur J Pharmacol. אכן, היכולת של VIP לגרות פעילות אדנילאט ציקלאז ולהביא לעלייה ברמת cAMP, תואמת את היכולת של VIP להביא להרפיית עורקים כמו שמצאו Ganz וחב' ב-1986 ב-Am J Physiol. חוקרים אלה הראו גם ש-VIP הוא פי-100 יותר פעיל מאשר isoproterenol או מאשר פרוסטגלנדין E1 בשפעול פעילות אדנליאט ציקלאז בעורק המזנטרי של חולדה.
לאחר ש-VIP נקשר לקולטן שלו, הקומפלקס פפטיד-קולטן עובר במהירות תהליך החדרה אל תוך התא, התהליך של אנדוציטוזה. רוב הקולטנים עוברים מִחזוּר וחוזרים לשטח הפנים של התא ,אך חלקם מתפרקים בליזוזומים. מחזור שלם של החדרת הקולטן אל תוך התא ושחזורו על פני התא, הוא בעל תקופת מחצית חיים של 13 דקות.
ניסויים קליניים עם VIP
טיפול ב-VIP נמצא גורם לשיפור בולט במחלת פרקים במערכת מודל של מחלה כרונית של דלקת מפרקים שגרונית ניסויית שפיתחו Delgado וחב' ופרסמו ב-Nature Med בשנת 2001. המנגנון של שיפור זה הוסבר על ידי עיכוב של Th1 שמשרה VIP, במקביל להגברת Th2. כתוצאה הפעילות האנטי-דלקתית שלו כמו הפעילות האימונו-מודולטורית, הוספה של VIP נבחנה במערכת מודל של הלם סֶפּטי (Delgado וחב' ב-J Immunol, משנת 1999(, מחלת קרוהן (Abad וחב' ב-Gastroenterology משנת 2003, וכן Arranz וחב' ב-Neuroimmunomodulation משנת 2008(, פנקראטיטיס חריפה (Kojima וחב' ב-Pancreas משנת 2005 והפטיטיס (Luo וחב' ב-Eur J Pharmacol משנת 2009). בפנקראטיטיס חריפה שהושרתה בעכברים, היה אפשר לקבל שיפור על ידי מתן VIP ואגוניסט לקולטן VPAC1, כאשר שיפור זה היה מתווך על ידי עיכוב של ציטוקינים המיוצרים על ידי מקרופאגים/מונוציטים.
מספר ניסויים קליניים בוצעו תוך שימוש ב-VIP או באנלוג שלו לטיפול באסתמה או בסרקואידוזיס. Linden וחב' פרסמו ב-Thorax ב-2003, על ניסוי כפול-סמיות, אקראי ומבוקר פלצבו בו השתתפו 24 חולי אסתמה במצב מתון ויציב. שאיפה של Ro25-1553, נתנה תוצאות מבטיחות בהרחבת דרכי הריאה. Prasse וחב' פרסמו ב-2010 ב-Am J respiratory Crit Care Med, על ממצאי ניסוי ב-phase II בו טופלו 20 איש עםsarcoidosis מאובחנת, עם תרסיס VIP למשך 4 שבועות. אינהלציה של VIP הפחיתה משמעותית יצירה של TNF-α על ידי תאים שבודדו מה-lavage הברונכו-אלבאולארי של מטופלים אלה. הטיפול עם VIP הגדיל משמעותית את מספרי תאי T שבודדו מה-lavage, עם המאפיינים של CD4(+)CD127(-)CD25(+), שהם בעלי פעילות רגולטורית על תאי T הקונבנציונאליים. ניסויים in-vitro הדגימו את היכולת של VIP להסב תאי T נאיביים מסוג CD4(+)CD25(-) לתאי T רגולאטוריים עם המאפיינים CD4(+)CD25(+)FoxP3(+), מה שמרמז ליצירה של תאי T היקפיים רגולאטוריים על ידי טיפול ב-VIP. ניסוי זה הראשון המדגים את ההשפעה האימונו-רגולטורית של VIP באדם, ומעלה אפשרות ששאיפת VIP עשויה לדכא תגובה חיסונית מוגזמת במחלות ריאה.
VIP והרפיית והרחבת כלי-דם
בשריר חלק בדופן כלי-דם, הגברה בריכוז cAMP על ידי VIP, יכולה לשפעל את האנזים protein kinase A, המזרחן את החלבון phspholamban שהוא חלבון אינטגראלי בממברנות של תאי אדם המווסת את משאבת ה-Ca+2 בשריר הלב ובתאי שריר השלד. זרחון של חלבון זה מגביר את השאיבה של Ca+2 על ידי הרטיקולום הסרקופלזמי, ובהמשך, חיוני להוצאה של יוני הסידן אל החלל החוץ-תאי. בנוסף, cAMP מקטין את הזיקה של האנזים קינאזה של השרשרות הקלות של מיוזין לקומפלקס calmodulin-Ca+2, מה שמקטין את הזרחון של מיוזין, ואת הזיקה של מיוזין לאקטין. כפי שסיכם Murray בשנת 1990 ב-Pharmac Ther, תהליכים אלה המשופעלים על ידי VIP יכולים להביא להרפיה של שרירים חלקים ולהרחבת כלי-דם.
ההשפעה מרחיבת כלי הדם של VIP בכלי דם במגוון רקמות, אינה נגרמת אך ורק מהגברת הריכוז של cAMP. הודגם שההשפעה מרחיבת כלי הדם של VIP, תלויה גם באנדותל של אבי העורקים בחולדות (Davis ו-Williams, ב-Prostaglandins משנת 1984), באנדותל של עורק הריאה בבקר (Ignarro וחב' ב-Am J Physiol מ-1987), ובאנדותל של עורק הרחם באדם (Jovanovic וחב' משנת 1998 ב-Mol Hum Reprod). בעורק הריאתי בבקר, הרחבת כלי הדם תלוית-אנדותל בתגובה ל-VIP, כורכת הן את השפעול של adenylate cyclase ואת שפעולו של האנזים COX או cyclo-oxygenase דרך 2 מסלולים, הקשורים כנראה גם לפעילות NO ופרוסטציקלין. במערכת זו, cAMP ו-cGMP מגיבים באופן סינרגיסטי לאתחל ולתחזק את התגובה הואזו-דילטורית ל-VIP כמו שמציעים Pelligrino ו-Wang ב-1998 ב-Prog Neurobiol.
לעומת זאת, במספר מערכות אחרות נמצא שהפעילות המרפה כלי הדם של VIP, אינה תלויה באנדותל, לדוגמה, בעורק המרכזי במוחות חתולים (Duckles ו-Said משנת 1982 ב-Eur J Pharmacol), בעורק הקארוטידי בכלבים (D'Orleans-Juste וחב' בשנת 1985 ב-Eur J Pharmacol), בעורק הכבד בכלבים (Varga וחב' ב-Am J Physiol משנת 1986), בעורקים הכליליים בחזיר (Beny וחב' ב-Pharmacology משנת 1986), ווריד השער בחולדה (Amenta וחב' ב-Arch Int Pharmacodyn Ther משנת 1988).
רבים מכלי הדם הסיסטמיים, כמו גם כלי-דם בריאות "מעוצבבים" על ידי סיבי עצב המגיבים ל-VIP, שגורמים להרפיה של שרירים חלקים בדופן כלי דם אלה. בהקשר זה VIP, על בסיס מולרי הוא פוטנטי פי-50 עד פי-100 מאצטילכולין ביכולתו להביא לווזודילציה (כפי שהראה Fahrenkrug ב-Pharmac Ther בשנת 1989).
VIP ומערכת העצבים
בשנת 1976 זוהה VIP על ידי Said ו-Rosenberg במערכת העצבים מרכזית וההיקפית, והוכר מאז כנוירופפטיד, הפועל כנוירוטרנסמיטור וכן כ-neuromodulator ברקמות ואיברים רבים, כולל הלב,הריאות, בלוטת התריס, הכליות, מערכת החיסון, דרכי השתן, בלוטות האדרנל ואיברי הרבייה כפי שסיכמו Henning ו-Sawmiller ב-2001 ב-Cardiovasc Res. במערכת העצבים המרכזית VIP נמצא בקליפת המוח, בהיפותלמוס, באמיגדלה, בהיפוקמפוס, ב-corpus striatum, ובגרעינים הואגאליים של המוח המוארך כפי שסיכמו Gozes וחב' ב-Curr Meed Chem בשנת 1999.
כאמור, אמנם השם VIP נובע מעצם בידודו המקורי מרקמת מעי, וכן כיוון שבגלל הפעילות מרחיבת כלי הדם שלו, הוא משנה את שפיעת הדם במעי, ואת הפרשת אלקטרוליטים במעי. בדיעבד, הסתבר שחשיבות VIP כנוירוטנסמיטור אינה פחותה. VIP יכול אם כן לפעול כנוירו-הורמון אך גם כמתווך פאראקריני המופרש מקצות עצבים ופועל על עצבים סמוכים באופן מקומי. אך פעילותו של VIP משמעותית במערכת העצבים ההיקפית (Fahrenkrug ב-Pharmavol Toxicol משנת 1993), ובגלל הפרשתו המרובה מנוירונים סביר שחלק ניכר מ-VIP שנמדד בדם, מקורו נוירונאלי.
במערכת העצבים המרכזית, VIP תורם לוויסות זרימת הדם בכלי הדם המוחיים, לפעילות אנזימטית ולמטבוליזם הקשור למאזן האנרגטי, והוא פוטנטי פי-20 יותר מאשר נוראפינפרין בגירוי הפירוק האנזימטי של גליקוגן ליצירת גלוקוזה, כמו גם פירוק שומנים. VIP קשור גם להפרשה של corticotropin-releasing hormone, פרולקטין, אוקסיטוצין ו-vasopressin על פי Rostene ב-Prog Neurobiol בשנת 1984.
במחקרים המוקדמים של שנות ה-70 התייחסו אל VIP כאל פפטיד המופרש מתאים "דמויי-תאים אנדוקריניים" במערכת העיכול. בהמשך התגלה VIP בגופי תאי עצב ובאקסונים ובדנדריטים במערכת העצבים המרכזית וההיקפית מקום בו VIP מתפקד כטרנסמיטור נוירופפטידי לא-אדרנרגי ולא-כולינרגי או כנוירו-מודולטור. כן אותר VIP בטרמינל הקדם-סינפטי של קצות העצבים, משם הוא מופרש כנוירו-טרנסמיטור. במערכת העצבים ההיקפית, מופיע VIP בגנגליונים הסימפטתיים, בעצב התועה (vagus), ובמספר עצבים מוטוריים כדוגמת עצב הנָשֶה (sciatic), בעצבים אוטונומיים הקשורים לבלוטות אקסוקריניות, בתאי שריר חלק וסקולאריים ולא-וסקולאריים, ובצברים "דמויי-גנגליונים" של גופי תאי עצב.
במערכת העצבים ההיקפית, נוירונים המכילים VIP, הם בחלקם נוירונים בתר-גנגליוניים שנמצאים בפיקוח של בקרה כולינרגית קדם-גנגליונית. בנוירונים בתר-גנגליוניים,VIP מסונתז בגופי התאים, ומשם הוא מיוצא דרך האקסונים או הדנדריטים לבועיות גדולות (100nm) עם ליבה דחוסה הממוקמים בקצוות הקדם-סינפטיים של הנוירונים. קצב הנדידה של VIP לאורך האקסון הוא 9 מ"מ בשעה.
VIP ומערכת החיסון
ל-VIP תכונות אימונו-מודולטוריות (Pozo וחב' ב-Peptides משנת 2007, ו-Delgado וחב' במאמר ב- Pharmacol Rev משנת 2004), והוא מיוצר בין היתר על ידי לימפוציטי Th2, ותומך בתגובות חיסוניות מסוג Th2. בניסויים in vitro, עם תאי T מסוג CD4 שעברו priming על ידי אנטיגן, נמצא ש-VIP מעכב ציטוקינים המופרשים על ידי תאי Th1 כמו אינטרפרון-גאמא ו-IL-2. במקרופאגים ובתאים דנדריטים, VIP משרה ציטוקינים אופייניים של תאי Th2 כמו IL-4 ו-IL-5. בהזרקת VIP לחיות, גדל את היחס בין התאים Th2 ל-Th1. בכך ש-VIP מדכא יצירת הציטוקין הפרו-דלקתי TNF-alfa, נראה שהוא יכול להיחשב כגורם נוגד דלקת.
השפעת VIP בלב
במיוציטים של חדרי הלב, VIP גורם להגדלת ריכוז cAMP, יכול להגביר פעילות האנזים protein kinase A, מה שגורם לתהליכי זִרחוּן בתעלות הסידן, ולשחרור של סידן מהרטיקולום האנדופלזמי. כתוצאה מכך, רמת הסידן התוך-תאי עולה, מה שמעודד את קצב ועוצמת כיווץ שרירי החדרים הקרדיאלים כפי שהראה Katz ב-Circulation ב- 1990. הגדלת ריכוז cAMP יכולה גם להגביר את הזִרחון של טרופונין I ושל phospholamban, מה שמפחית את הזיקה של טרופונין לסידן, מגביר את ההוצאה של סידן התוך-תאי, ובתוצאה מכך מעודד את הקצב והעוצמה של הרפיית המיוציט. באופן זה, VIP יכול להגביר יכולת הכיווץ וההרפיה של המיוציט הקרדיאלי. השפעות אלה של VIP על cAMP פוחתות משמעותית על ידי אנטגוניסטים של VIP, כולל VIP(7-28)/neurotensin או גם N-acetyl-Tyr-D-Phe2]GRF] כפי שהדגימו Tiaho וחב' ב-1996 ב-Pflugers Arch.
בקשרית הסינוס (sinoatrial node) עלייה בריכוז cAMP המושרה על ידי VIP, יכולה לשפעל את מה שמכונה funny current או If pacemaker current שהוא זרם חשמלי ייחודי בלב שתואר בסוף שנות ה-70 בסיבי Purkinje ובמיוציטים הסינו-אטריאלים. בכך יכול VIP להחיש את קצב הדה-פולריזציה הדיאסטולית, ולהגביר את קצב הלב כפי שתארו Chang וחב' ב-1994 ב-Circ Res. המטבוליזם של VIP מתרחש בעיקר בריאות, בריאות ובכליות, אך לא מתרחש מטבוליזם של VIP בלב, בגלל הניקוז הלימפתי היעיל של VIP או על ידי ניקוז העורקי-ורידי של VIP מן הלב.
תחום רמות פיזיולוגי של VIP
רמת VIP בפלזמה נקבעה לאורך 4 עשורים בשיטות שונות, ואמנם לא התגבש עד היום תחום ערכים נורמאלי מוגדר היטב, וייתכן גם שבגלל האופי הפולסטילי-צירקדיאני של הפרשת VIP בשעות היממה, מדידות במחקרים שונים שנעשו בשעות יום שונות, נתנו תוצאות שונות. לדוגמה, Mitchell ו-Blum קבעו בשנת 1978 במאמרם ב-Gut שרמת VIP באנשים בריאים נעה בין 6.6-14.6 פיקוגרם/מ"ל, ואילו Opstad קבע ב-1987 ב-Peptides,שתחום הנורמה של VIP הוא 1.2-68.3 פיקוגרם/מ"ל. מקובל שרף הנורמה העליון של VIP בפלזמה הוא כ-75.0 פיקוגרם/מ"ל. כל המדידות נעשות בתנאי צום. רמת השיא של VIP בפלזמה של צעירים נמדדה בשעה 2000, ואילו בקרב קשישים רמת השיא נמדדה בשעה 1800. לאחר פעילות גופנית מאומצת רמת VIP יכולה לעלות בפלזמה ב-100%, ולהישאר גבוהה עד 20 דקות לאחר חזרה למנוחה. באנשים עם גידולי מעי המפרישים VIP וסובלים מתסמין של watery diarrhea ניתן למצוא בפלזמה ריכוזי VIP הגבוהים עד פי-200 מרמת VIP התקינה, כפי שהדגימו Bloom וחב' ב-1973 ב-Lancet.
למרות שריכוזי VIP בפלזמה נמוכים יחסית, ואינם משתנים משמעותית במהלך ארוחות, ידוע שהורמון זה יכול להשיג השפעתו ברקמות בהפרשה מקומית פאראקרינית, ולייצר השפעה פיזיולוגית ללא העלאה משמעותית של רמתו בפלזמה. לדוגמה, הריכוז הרקמתי של VIP בקליפת המוח הקדמית ובהיפותלמוס, מגיע עד 65 ננוגרם/גרם רקמה, כפי שהראו Said ו-Rosenberg ב-Science ב-1976. תקופת מחצית החיים של VIP בדם היא קצרה במיוחד, 1-2 דקות, אם כי בשנת 1973 קבעו Domschke וחב' שתקופת מחצית החיים היא של 48 שניות.
רמות מוגברות של VIP נמצא בתרחישים הקליניים הבאים
שאת של הלבלב המפרישה VIP או VIPoma, גידולים של הרכס העצבי (neural ceest) בילדים כגון ganglioneuroma ו-ganglioneuroblastoma, היפרפלזיה של islet cell בלבלב, מחלת כבד, multiple endocrine neoplasia syndrome type I, פיאוכרומוציטומה, medullary thyroid carcinoma. הפרשת-יתר בולטת של VIP מתרחשת גם בתסמונת Verner-Morrison שתוארה בשנת 1974 לראשונה על ידי 2 חוקרים אלה ב-Arch Intern Med, הידועה גם כ-WDHA אוWatery Diarrhea with Hypokalemia and Achlorhydria, בה רמות VIP גבוהות במיוחד כפי שמצאו Masel וחב' בשנת 2000 ב-J Gaastroenterol Hepatol, ו-Bloom בשנת 1978 ב-Am J Dig Dis, וכן Said ו-Faloona במאמרם ב-N Eng J Med משנת 1975. במחלת קרוהן יש עליה של 100% ברמת VIP במעי.
הוראות לביצוע הבדיקה
אין לאכול או לשתות לפחות 4 שעות לפני ביצוע הבדיקה. אין למדוד רמת VIP בדם של אלה שטופלו לאחרונה ברדיו-איזוטופים, למטרות ריפוי או דימות, בשל הפרעה אפשרית לביצוע הבדיקה המתבצעת בשיטה כמותית של RIA או radioimmuoassay. יש ליטול את הדם במבחנת ספירת-דם (EDTA, פקק סגלגל (או במחנת הפארין (פקק ירוק). יש לכלול במבנה מעכב פרוטאזות (מומלץ להשתמש ב-PPACK או Phe-pro-Arg-chloromethyk-ketone שהוא מעכב תרומבין סלקטיבי. אם הבדיקה אינה מתבצעת בזמן אמת ניתן לשמור בקירור את הפלזמה למשך 72 שעות, או להקפיא אותה במינוס 20 מעלות בין 3 עד 12 חודשים. אין לבצע את הבדיקה בדגימה המוליטית באופן בולט.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק