הבדלים בין גרסאות בדף "קווים מנחים לאישור הורמון גדילה בילדים במסגרת סל הבריאות הממלכתי - נייר עמדה - Guidelines for pediatric growth hormone therapy authorization"
| שורה 10: | שורה 10: | ||
}} | }} | ||
{{הרחבה|ערכים=[[קטן לגיל היריון]], [[הורמון גדילה]]}} | {{הרחבה|ערכים=[[קטן לגיל היריון]], [[הורמון גדילה]]}} | ||
| − | {{ראו גם|קווים מנחים לאישור הורמון גדילה בילדים במסגרת סל הבריאות הממלכתי - נייר עמדה | + | {{ראו גם|שינוי קווים מנחים לאישור הורמון גדילה בילדים במסגרת סל הבריאות הממלכתי - נייר עמדה}} |
==מבוא== | ==מבוא== | ||
מטרת המסמך לשמש מקור לכללים מוסמכים לתהליך האבחון והאישור של חוסר [[הורמון גדילה - Growth hormone|הורמון גדילה]] (GH ,{{כ}}Growth hormone) במסגרת סל הבריאות. המסמך ישרת הן את האנדוקרינולוגים הפדיאטריים מגישי הבקשות לטיפול בהורמון גדילה, והן את המאשרים ויצור כללים ברורים לתהליך האבחון והאישור. אני מודה לכל התורמים לשדרוג המסמך וליטושו - והם רבים, אני תקווה שהוא יסייע בתהליך הכנת החומר לאישור, ויהווה מקור לקבלת החלטות מתוך גוף יידע אחיד. | מטרת המסמך לשמש מקור לכללים מוסמכים לתהליך האבחון והאישור של חוסר [[הורמון גדילה - Growth hormone|הורמון גדילה]] (GH ,{{כ}}Growth hormone) במסגרת סל הבריאות. המסמך ישרת הן את האנדוקרינולוגים הפדיאטריים מגישי הבקשות לטיפול בהורמון גדילה, והן את המאשרים ויצור כללים ברורים לתהליך האבחון והאישור. אני מודה לכל התורמים לשדרוג המסמך וליטושו - והם רבים, אני תקווה שהוא יסייע בתהליך הכנת החומר לאישור, ויהווה מקור לקבלת החלטות מתוך גוף יידע אחיד. | ||
גרסה אחרונה מ־11:44, 28 באפריל 2024
|
| |
|---|---|
| קוים מנחים לאישור הורמון גדילה בילדים במסגרת סל הבריאות הממלכתי | |
| תחום | אנדוקרינולוגיה וסוכרת, ילדים |
| |
| האיגוד המפרסם | האיגוד הישראלי לאנדוקרינולוגיה פדיאטרית |
| קישור | באתר ההסתדרות הרפואית בישראל |
| תאריך פרסום | ינואר 2016 |
| יוצר הערך | פרופ' צבי צדיק, ד"ר נחמה לוין- צוקרמן, ד"ר דוד שטריך, ד"ר דוד גיליס |
| ניירות עמדה מתפרסמים ככלי עזר לרופא/ה ואינם באים במקום שיקול דעתו/ה בכל מצב נתון. כל הכתוב בלשון זכר מתייחס לשני המגדרים. | |
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – קטן לגיל היריון, הורמון גדילה
ראו גם – שינוי קווים מנחים לאישור הורמון גדילה בילדים במסגרת סל הבריאות הממלכתי - נייר עמדה
מבוא
מטרת המסמך לשמש מקור לכללים מוסמכים לתהליך האבחון והאישור של חוסר הורמון גדילה (GH ,Growth hormone) במסגרת סל הבריאות. המסמך ישרת הן את האנדוקרינולוגים הפדיאטריים מגישי הבקשות לטיפול בהורמון גדילה, והן את המאשרים ויצור כללים ברורים לתהליך האבחון והאישור. אני מודה לכל התורמים לשדרוג המסמך וליטושו - והם רבים, אני תקווה שהוא יסייע בתהליך הכנת החומר לאישור, ויהווה מקור לקבלת החלטות מתוך גוף יידע אחיד.
ד"ר דוד שטריך,
יושב ראש האיגוד לאנדוקרינולוגיה פדיאטרית.
בשנת 1999 פורסמו קוים מנחים לאבחון חוסר בהורמון גדילה, שנכתבו על ידי פרופ' צבי צדיק, יחד עם נציגים מהאגודה הישראלית לאנדוקרינולוגיה פדיאטרית. ב-2007 פורסמו גם כן בעריכתו של פרופ׳ צדיק, הנחיות קליניות לטיפול בהורמון גדילה בילדים עם SGA (Small for Gestational Age). פרסומים אלו הפכו לאורים ותומים בשני נושאים:
- תהליך האבחון של ילדים החשודים בחוסר בהורמון גדילה
- כללים מעשיים לאישור טיפול בהורמון גדילה
ב-2011 סמכות אישור הטיפול בהורמון הגדילה עברה מהועדה הממלכתית לאישור הורמון גדילה למבטחים. במקביל חלה התקדמות בידע המדעי בכל הקשור לאבחון של קומה נמוכה והטיפול בהורמון גדילה. ביוזמתה של פרופ׳ מ/ק צוקרמן לוין הוסיף ד"ר דוד גיליס את הפרקים הדנים בטיפול בהורמון גדילה בתסמונת טרנר (Turner syndrome), אי ספיקת כליות, Prader-Willi ועדכן את הפרק הדן בחסר הורמון גדילה ואת הפרק על SGA. המסמך המעודכן הופץ לכלל חברי האיגוד, התקבלו הערות מפרופ׳ פיליפ, פרופ׳ רקובר טננבאום, פרופ׳ חנה קלוגלו, פרופ׳ צדיק, ד"ר מודן, ד"ר לוי. הנוסח הסופי גובש לאחר ישיבה משותפת של חלק מהמעירים, המאשרים מטעם המבטחים, מעדכני המסמך וועד האיגוד הישראלי לאנדוקרינולוגיה פדיאטרית (ד"ר נופר-ברהום, ד"ר נאוגולני, ד"ר שטריך). עיקרי הדברים הוצגו בכנס האגודה במאי 2015 בצפת.
התויות בסל הבריאות
הורמון גדילה בישראל נמצא בסל הבריאות לטיפול בקומה נמוכה הנובעת מ:
- כשל בהפרשה או הפרשה לא מתאימה של הורמון גדילה היפופיזרי
- תסמונת טרנר
- אי ספיקה כלייתית
- תסמונת Prader-Willi
- הפרעת גדילה בילדים שנולדו קטנים לשבוע ההיריון (באורך או במשקל), ולא השלימו את פער הגדילה עד גיל 4 שנים (Small for Gestational Age, SGA)
הוראות מפורטות לגבי התייחסות לכל אחת מ-5 ההתויות מסוכמות בהמשך.
התויות נוספות
ISS) Idiopathic Short Stature) - ה-Genotropin מאושר להזרקה בישראל עבור התוויה זו. למתן שני הסוגים המסחריים האחרים בהתוויה זו נדרש אישור מיוחד (טופס 29 ג'). ההתוויה של ISS אינה כלולה בסל הבריאות ולא הייתה בעבר בתחום עבודתה של הוועדה הממלכתית לאישור הורמון גדילה.
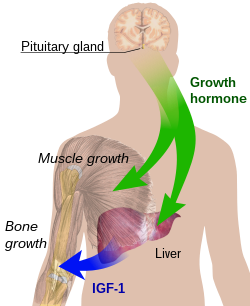
ההורמון הטיפולי
הורמון הגדילה הנמצא בשימוש בישראל לטיפול הוא Recombinant Growth hormone המיוצר מ- DNA) cDNA Complementary) אנושי אשר הועבר בשיטות של הנדסה גנטית לחיידקי E. Coli. כל הצורות המשווקות בארץ נחשבות זהות מבחינת הפעילות הביולוגית והמינון. המינון משתנה בין ההתוויות השונות ויש שיקול דעת לרופא האנדוקרינולוג המטפל לעדכנו בהתאם למשקל המטופל ובהתחשב בתוצאות הטיפול מבחינת שיפור הקומה הנמוכה, רמת גורמי הגדילה IGF-1 (Insulin-like Growth Factor-1, גורם גדילה דמוי אינסולין 1) ו-IGFBP-3 (Insulin-like Growth Factor Binding Protein-3), קידום ההתבגרות המינית וגיל העצמות. האישור הניתן באבחנות המצויות בסל הבריאות אינו ייעודי להורמון המיוצר על ידי חברת מסוימת אלא ניתן להורמון גדילה בכלל.
פירוט ההתויות בסל הבריאות
חוסר הורמון גדילה
חוסר בהורמון גדילה מתאפיין בשילוב של סימנים קליניים, מדדי גדילה וממצאים ביוכימיים. דרגת ההסתמנות הקלינית והמעבדתית תלויה במידת החסר ומשך הזמן שחלף עד שחסר זה הגיע לביטוי ואבחון.
מגוון סיבות יכולות להביא לחוסר בהורמון גדילה החל מגידולים או הקרנות לגולגולת עד לפגמים מולקולרים או הפרעות התפתחותיות שפוגעים בציר הורמון גדילה. במצבים בהם יש פגמים ברצפטורים (קולטנים, Receptors) היכולים לגרום לתנגודת להורמון גדילה או לתנגודת ל-IGF-1 אמנם אין חסר בהורמון גדילה אולם ההסתמנות הקלינית דומה[1].
התמונה הקלינית[2]
חוסר בהורמון גדילה יכול להתבטא בכל גיל ובדרגת חומרה שונה. ייתכן למצוא בילדים הגדלים בצורה תקינה שיא הורמון גדילה נמוך במספר תבחיני גירוי, (השמנה, התבגרות מאוחרת) כך שנחשוד ביוכימית בחסר בהורמון גדילה אף על פי שאין בסיס לטיפול בילדים אלה. כאשר חוסר הורמון גדילה הוא חלק מ-Panhypopituitarism וקצב הגדילה תקין, יש מחלוקת על הצורך בטיפול וכל מקרה ידון לגופו.
מהסימנים היותר שכיחים ניתן לציין:
בילוד: צרוף של אירועי היפוגליקמיה (Hypoglycemia) חוזרים, צהבת ממושכת ו-Micropenis בזכר. פגמים מולדים בקו האמצע (Midline defects) צריכים להחשיד לקיום חוסר בהורמון גדילה. שילוב ממצאים אלה ובמיוחד עדות לחסר הורמונלי נוסף, בדרך כלל מחייבים טיפול בהורמון גדילה בהקדם (לאחר בירור ראשוני קצר שתומך ב-Panhypopituitarism). לטיפול זה חשיבות למניעת אירוע Hypoglycemia ומניעת פיגור שכלי.
בינקות ובילדות: בשנת החיים הראשונה תיתכן תמונה קלינית של חוסר עליה במשקל, המוכר כחוסר שגשוג. אולם, במיוחד בחודשי החיים הראשונים, חוסר בהורמון גדילה אינו מתבטא תמיד כירידה בקצב הגדילה. לאחר תקופה זו הפרעה בגדילה היא הסימן הטוב ביותר לחוסר בהורמון גדילה. סימנים נוספים מקובלים הם: Truncal obesity, Frontal bossing, היפופלזיה (Hypoplasia) של מרכז הפנים, איחור בסגירת מרפסים, איחור בבקיעת שיניים, איחור בגיל עצמות, שיער דליל, קול גבוה צפצפני, כפות ידיים ורגלים קטנות.
בגיל ההתבגרות: Pubertal spurt קטן מהרגיל.
הבירור האבחנתי[2]
- בירור מעבדתי לאישור אבחנה של חסר הורמון גדילה ייעשה בנוכחות התוויה מתאימה ולאחר שקוימו התנאים המקדימים המתאימים. פרט לחריגים מסוימים (כגון: בנוכחות ממצא אורגני ברור של ההיפופיזה בדימות או בנוכחות Panhypopituitarism), נדרש לבצע שני מבחני גירוי שונים להפרשת הורמון גדילה. ראו פירוט בהמשך
- התווית לבירור: קומה נמוכה - 2.5 סטיות תקן (Standard Deviation, SD) מתחת לממוצע לגיל וקצב גדילה היורד ב-0.3 סטיות תקן מקו הגדילה המקורי של הילד
- התוויות יחסיות לבירור
- קצב גדילה היורד ב-0.3 סטיות תקן מקו הגדילה כאשר הגובה בתחום הנורמה
- ילד אשר קומתו (Height SDS, Standard Deviation Score) היא נמוכה בסטיית תקן אחת או יותר מהגובה הממוצע של הוריו מחושב עם תיקון לפי מין (הפרש ממוצע בין גברים ונשים - 13 סנטימטרים)
- ילד עם סיכון גבוה לחסר בהורמון גדילה כגון: לאחר הקרנה לגולגולת, גידולים ו/או ניתוח באזור יותרת המוח (Pituitary gland)/היפותלמוס (Hypothalamus), עדות להפרעה בתפקוד או למחלה של ההיפותלמוס/היפופיזה, תסמונות היכולות להיות מלוות בחסר הורמון גדילה כגון צרוף של היפוגליקמיה ומיקרופניס בילוד
- רמות IGF-1 או IGF-BP3 נמוכות בילד עם קצב גדילה נמוך
- בילד עם תסמונת שאחד ממרכיביה הוא קומה נמוכה (כגון Down syndrome) יש להתייחס בהחלטה על בירור לעקומת הגדילה המתאימה לתסמונת.
- מידע קליני חשוב שיכול להשפיע על בדיקות להורמון גדילה
- השמנה יכולה לגרום לרמות נמוכות של הורמון גדילה בתבחיני גירוי גם כאשר אין חסר בהורמון גדילה. לכן, הפרשת הורמון גדילה נמוכה אצל חולה שמן בתבחינים צריכה להיבדק תוך התחשבות קפדנית במצב הקליני
- "ננסות פסיכו-סוציאלית" (Psychhosocial short stature) יכולה להביא להפרעה בגדילה ולירידה בהפרשת הורמון גדילה. מדובר בהפרעה ממשית להפרשה אשר יכולה להיות מתוקנת על ידי שיפור המצב הפסיכוסוציאלי. חשוב לברר ככל האפשר קיומה של בעיה כזו לפני הבירור המעבדתי
- מצב תזונתי ירוד וכן מחלות מערכתיות וכלליות יכולות להשפיע על הגדילה. לכן יש לשלול מחלות אלה על-ידי תשאול קפדני ובדיקה גופנית הנעשית מתוך מטרה להעריך נוכחותם של גורמים חולניים היכולים להפריע לגדילה
- בירור מעבדתי מקדים
- בצוע בדיקות מעבדה שגרתיות לפני ביצוע בדיקות להורמון גדילה כוללות: תמונת דם שלמה, אחד ממדדי הדלקת שקיעת דם או CRP (C Reactive Protein), הערכת תפקודי כליה וכבד, בדיקת שתן כללית, רמות סידן (Calcium), זרחן (Phosphorus), פוספטזה בסיסית (Alkaline phosphatase), ברור סרולוגי למחלת הכרסת (Celiac), FT4 ,(Thyroid Stimulating Hormone) TSH, IGF-1 (Free T4), (ו-3-IGFBP אם ניתן לבצע). במקרים של אי-ספיקת כליות יש לכלול גם בדיקת גזים בדם (אסטרופ) ורמת PTH (Parathyroid Hormone) בדם
- בדיקת קריוטיפ אצל בנות נמוכות (לשלול תסמונת Turner)
- קביעה ביוכימית של חוסר בהורמון גדילה
- הפרשת הורמון הגדילה היא פעימתית (Pulsatile). כתוצאה מכך, הרמה בצום יכולה להיות אפסית גם באדם המפריש כמויות תקינות של הורמון גדילה. לכן, כדי להעריך הפרשת הורמון גדילה יש צורך בגירוי פרמקולוגי מלאכותי או קביעת ההפרשה הפיזיולוגית הפעימתית. קביעת הורמון גדילה בנסיוב (Serum) בעייתית עקב נוכחות הטרוגנית של מולקולות הורמון גדילה כגון: 20KD (Kilodalton), 22KD, Dimeric GH, Oligomeric GH, היות כ-50 אחוזים מהורמון הגדילה בנסיוב קשור ל"חלבון קושר הורמון גדילה" GHBP (Growth Hormone Binding Protein), שונות (Variability) בשיטות המעבדה, שוני ברמות בהתאם לגיל, מין, מידת ההשמנה, דרגת ההתבגרות ואי-אחידות בתגובה לתבחינים שונים ושונות בתגובה לאותו תבחין (בבדיקה חוזרת יכולה להתקבל תוצאה שונה). חלה התקדמות רבה בהשגת אחידות בבדיקת המעבדה של הורמון הגדילה כאשר החל מאמצע שנת 2010 הופעלו בכל מדינת ישראל מערכות בדיקה אשר מתבססות על סטנדרט רקומביננטי (Recombinant) בינלאומי המכיל הורמון גדילה 22 KD בדרגת טהרה של 95 אחוזים. זהו ה-98/574 IS אשר איפשר סטנדרטיזציה (תקנון) של מדידות הורמון הגדילה בעולם בהתאם להודעת קונצנזוס[3].
- מצבים בהם ניתן לקבוע חסר הורמון גדילה ללא תבחינים דינמיים
- במשפחה בה הוכח חוסר בהורמון גדילה ניתן בילד עם תמונה קלינית של חוסר בהורמון גדילה, לוותר על בצוע תבחינים פרמקולוגיים, אם מוכיחים פגם מולקולרי זהה בגן להורמון הגדילה ואישור למתן טיפול בהורמון גדילה יהיה מותנה בקיומה של קומה נמוכה. זאת, בהתחשב בכך שלעיתים התמונה הקלינית של אותו פגם מולקולרי וריאבילי (Variable) בתוך אותה משפחה[4]
- לאחר פרוצדורה ניתוחית בה הוסרה לחלוטין בלוטת ההיפופיזה אין צורך בתבחין דינמי. אולם, אף על פי שקיים בוודאות חסר הורמון גדילה ההתוויה לטיפול במקרה זה תלויה בנוכחות קומה נמוכה משום שקיימת במצבים אלה לעיתים גדילה ללא הורמון גדילה
- אין צורך בתבחינים דינמיים בתינוקות עד גיל 3 שבועות. ביטוי קליני אופייני לגיל הינקות בנוכחות רמה נמוכה בעת היפוגליקמיה היא אבחנתית
- תבחיני גירוי להפרשת הורמון גדילה[2]
- אין פרוטוקול או תבחין המסוגל לאבחן, באופן חד משמעי, חסר בהורמון גדילה במנותק מהתמונה הקלינית. לכן לאחר שהתקיימה התוויה מתאימה תוך תשומת לב למידע קליני חשוב ומידע מעבדתי מקדים יש לבצע תבחין גירוי. לאחר שהוחלט לבצע תבחין על פי האמור יש לוודא את הפרטים הבאים:
- תפקוד תקין של בלוט התריס לפני ביצוע תבחין גירוי על ידי בדיקה של רמת FT4 ו-TSH
- קיימת מחלוקת לגבי הצורך בהכנה של הורמוני מין לפני ביצוע תבחיני גירוי ואם כן לגבי הגיל הרצוי להכנה זו. נושא זה נדון במסגרת האיגוד הישראלי לאנדוקרינולוגיה פדיאטרית והוסכם כי בילדים בגיל ההתבגרות (מעל 11.5 שנים בבנות, מעל 13 שנים בבנים), בין אם נראים סימני התבגרות ובין אם לאו, יש צורך במתן הורמוני מין לתקופה קצרה לפני ביצוע התבחין. במצב של התבגרות מתקדמת בשני המינים ניתן לוותר על ההכנה (שנועדה לדמות מצב של התבגרות מתקדמת הקיימת בלאו הכי). פרוטוקול הכנה שכיח הוא: בבנים: Testosterone enanthanate 100 מיליגרם 7–10 ימים לפני התבחין. בבנות: Estrofem 2 מיליגרם ליום למשך 3 ימים לפני התבחין. אולם, קיימים פרוטוקולים שונים קבילים.
- שעת תחילת תבחין הגירוי 10:00-8:00
- הנבדק/ת יהיה לאחר צום לילה (בתינוקות, הצום קצר יותר, התחלת התבחין תהיה במועד הצפוי להתחלת ארוחה); זהירות יתר במשך הצום בפרטים הנוטים להיפוגליקמיה. שתית מים צלולים (ללא סוכר) חופשית
- יש לשמור על וריד פתוח בעת ביצוע התבחין על ידי תמיסה שאין בה גלוקוז
- פרוטוקולים מומלצים
-
- ארגינין (Arginine HCI) תוך ורידי:
- יש לתת תמיסת ארגינין (Arginine HCI) 10 אחוזים ב-0.9 NaCI אחוזים בעירוי לוריד במשך 30 דקות במינון 0.5 גרם לקילוגרם משקל ( מינון מקסימלי 30 גרם). זמני דגימות הדם בדקות: '0, '30 (= מיד בתום העירוי), '60, '90, '120. עבודות אחדות הראו שזמן '45 הוא זמן השיא בקרוב למחצית מהנבדקים[5] ולכן רצוי לבדוק זמן זה כזמן נוסף אם כי מאחר שבמרכזים שונים מקובל לא לבדוק זמן זה - תבחין שאינו כולל זמן זה ייחשב מלא. בשל חשש מתגובה אלרגית יש לשקול בזהירות ביצוע תבחין זה אצל אנשים עם נטייה אטופית קשה או אסתמה פעילה.
- כלונידין דרך הפה:
- Clonidine 0.15 מיליגרם/מטר רבוע שטח גוף עד מקסימום של 0.15 מיליגרם.
- זמני דגימות הדם בדקות '0, '30, '60, '90, '120.
- שיא ההורמון הוא בחלק גדול מהמקרים כ-60 דקות לאחר מתן הכדור.
- צפויה עייפות וירידת לחץ דם החל מ-30 דקות לאחר מתן הכדור. יש לעקוב אחר לחץ הדם עד 30 דקות לאחר חזרתו לערכים בסיסיים. לא מומלץ לבצע תבחין זה מתחת לגיל שנתיים. בילדים אסתמיים, כלונידין יכול לעורר התקף. בשל מחקר המדגים שבדיקה של 120 דקות אחרי ההזרקה משנה את תוצאת התבחין ב-0.4 אחוזים מהנבדקים בלבד. לכן אם בוצעה בדיקה ללא זמן זה והיא אמורה לקבוע שילד חסר הורמון גדילה ניתן לקבלה.
- גלוקגון תוך שרירי:
- Glucagon 0.03 מיליגרם/קילוגרם (מינון מקסימלי 1 מיליגרם).
- זמני דגימות הדם בדקות: '0, '30, '60, '90, '120, '150, '180.
- ייתכנו בחילה, הקאה וכאב בטן כתגובה לגלוקגון.
- שיא ההורמון וריאבילי, אם כי לרוב מופיע בין 60–120 דקות מתחילת התבחין. הבדיקה של 180 דקות אחרי ההזרקה משפיעה בערך ב־1 אחוזים מהמקרים על הקביעה אם כן או לא מדובר בחסר הורמון גדילה ולכן אם מבוצעת בדיקה ללא זמן זה יש לקבלה כמליאה.[6] בדיקה זו משמשת גם לבחינת ציר היפותלמוס-היפופיזה-אדרנל.
- אינסולין תוך ורידי:
- 0.05-0.1 יחידות לקילוגרם משקל.
- בדיקה זו היא Gold standard שעל פיה נבחנו התבחינים האחרים. השימוש בה מועט ביותר היום בשל הסכנות שבה. מסיבות אלה יש לבצע את הטסט, אם בכל זאת מחליטים לבצעו, אך ורק במסגרת בית חולים. כדי לגרום לגירוי מספיק להפרשת הורמון גדילה, יש צורך בירידת גלוקוז ב-30 מיליגרם/דציליטר מהערך בצום. ככלל מומלצת ירידה ל-50 אחוזים מהערך בצום. ללא ירידה מספקת בגלוקוז לא ניתן לקבל מבחן זה כקביל. היפוגליקמיה מופיעה ב-15–20 דקות מתחילת התבחין, שיא הורמון הגדילה מופיע לאחר 30–60 דקות. תבחין זה יש לבצע תחת השגחה מרבית, כאשר ליד המשגיח נמצאת תמיסת גלוקוז להזרקה מידית לווריד. כל זמן התבחין ולאחריו, עד אשר חוזרת רמת הגלוקוז לערכים תקינים, יש לשמור על "וריד פתוח" כדי שתהיה יכולת לטפל בהיפוגליקמיה קשה - Hypoglycemic shock. בזמן ביצוע התבחין תיתכן הופעת היפוגליקמיה גם ללא סימני קליניים.
- פירוש תוצאות התבחינים הדינמיים
- הגבול בין הפרשה נורמלית לנמוכה נקבע כ-7.5 מיקרוגרם לליטר על פי הסטנדרט הבינלאומי המקובל היום (98/574 IS). בדיקה תיחשב תקינה (עדות להפרשה מספקת של הורמון גדילה) אם באחת או יותר מבדיקות הורמון הגדילה נמדדת רמה של 7.5 מיקרוגרם לליטר או יותר. אם זמן השיא הוא '0, (כלומר לפני מתן הגורם המגרה), דין הבדיקה כדין רמה כזו בכל זמן אחר. זאת משום שאם התבחין נעשה בדיוק לאחר שיא ספונטני של הורמון גדילה תיתכן תקופה רפרקטורית (Refractory) בה לא תהיה תגובה לחומר הגירוי.
- פרט למקרים חריגים (המפורטים בסעיף 2.7 לעיל) יש צורך בשני תבחינים שונים המראים רמה נמוכה של הורמון גדילה (שיא נמוך מ-10 מיקרוגרם לליטר בבדיקות הישנות או 7.5 מיקרוגרם לליטר בחדשות) כדי לאשר את האבחנה. במקרים חריגים בהם חולה יכול לעבור רק תבחין מסוים יבוצע תבחין זה פעמיים.
- בילדים עם קצב גדילה נמוך, תגובת הורמון גדילה תקינה בתבחינים דינמיים, תמונה קלינית המתאימה לחסר הורמון גדילה ו-IGF-1 נמוך עדיין ייתכן שקיים חסר הורמון גדילה פיזיולוגי. דוגמה טבעית למצב זה היא לאחר קרינה לגולגולת בעקבותיה יורדת ההפרשה הפיזיולוגית תחילה ורק לאחר מכן יורדת התגובה לתבחינים דינמיים[7]. ניתן לבדוק את ההפרשה הפיזיולוגית של הורמון גדילה על ידי בדיקות תכופות במשך 24 שעות, קביעת השטח תחת העקומה, הפרשה ממוצעת או השיא הספונטני המקסימלי. בפועל, בדיקה זו מתבצעת רק לצורכי מחקר.
IGF-BP3, IGF-1
- בדיקות אלה יכולות לשמש במהלך הבירור הראשוני וכבדיקות מסייעות לאבחנת חסר בהורמון גדילה. כמו כן רמתן נמוכה מאוד במחלות בהן קיימת פעילות לא תקינה של הרצפטור (קולטן) להורמון גדילה או מערכות תוך תאיות פוסט-רצפטוריות. אולם, בדיקות אלא אינן יכולות להחליף תבחינים דינמיים. יש לזכור שהתבגרות מאוחרת, תת-תריסיות, מחלה סיסטמית ותזונה לקויה יכולים להביא לרמות נמוכות של IGF-1 ו-IGF-BP3[8].
תסמונת על שם Turner[9]
רקע
בקרוב ל-100 אחוזים מהבנות עם תסמונת Turner קיימת קומה נמוכה. הגובה הסופי של בנות עם תסמונת Turner ללא טיפול תלוי ברקע הגנטי הכללי אך לרוב נמוך מ-145 סנטימטרים. נמצא שחלק משמעותי מאבדן הגובה הסופי מתרחש בשלש שנות החיים הראשונות. הפרעת הגדילה נובעת מפגיעה באזור ה- Pseudoautosomal region של כרומוזום ה-X בגן הקרוי SHOX. היעדר עותק אחד של גן זה גורם להפרעה בגדילה. על כן, אין צורך בחסר של כרומוזום X שלם כדי לפתח מרכיבים של תסמונת זו ובמיוחד מרכיב הקומה הנמוכה. טיפול בהורמון גדילה בבנות עם תסמונת זו יכול להוסיף כ-7–8 סנטימטרים לגובה הסופי ועל כן נחשב מוצדק עד כדי הכנסת הורמון גדילה להתוויה זו לסל התרופות הישראלי.
הנחיות לאישור
לא הוגדרה מידת הקומה הנמוכה המצדיקה טיפול וגם לא הובעה הסתייגות לגבי הגיל הנמוך ביותר בו יש לאשר טיפול. ההגדרה, מבחינת קריוטיפ המצדיקה טיפול בהתוויה זו אף היא לא סויגה. בנות עם אחוז כלשהו של תאים עם קריוטיפ אשר בהם פגיעה בכרומוזום X באזור ה-Pseudoautosomal עם קומה נמוכה נכנסות לקטגוריה זו. זאת משום שאין קורלציה טובה בין מידת המוזאיקה (פסיפס) של תאים "נורמליים" ותאים עם חסר חלקי או שלם של כרומוזום X בדם ההיקפי ובין מידת ההפרעה בגדילה, ייתכן עקב שונות במידת המוזאיקה בין הדם הפריפרי ורקמת העצם.
ככלל, ילדות עם קומה נמוכה אשר להן חסר מלא של כרומוזום X אחד או שאצלן אחד מכרומוזומי X בעל מבנה טבעתי, חסר בחלקו, מוזאיקה הכוללת חסר חלקי/מלא/כרומוזום טבעתי של כרומוזום X עם תאים בעלי קריוטיפ נקבי תקין, זכאיות לטיפול בהורמון גדילה ללא צורך במבחנים דינמיים לבדיקת הורמון גדילה.
מאחר שהגורם העיקרי לקומה נמוכה בתסמונת זו היא חסר או פגם בגן SHOX הרי שחסר או מוטציה הפוגעת בתפקודו של גן זה יאושר לטיפול בהורמון גדילה כמו תסמונת Turner.
משך הטיפול הוא עד אשר קצב הגדילה יורד אל מתחת ל-2 סנטימטרים בשנה על סמך ששה חודשי מעקב.
אי ספיקה כלייתית[10]
הגדרה
אי ספיקת כליות לצורך טיפול בהורמון גדילה מוגדר כמצב בו פינוי הקריאטינין נופל מ-60 מיליליטרים לדקה ל-1.73 מטר מרובע שטח גוף ויש עדות להפרעה בגדילה. נדרש להיטיב מצב של היפרפרתירוידיזם משני (Secondary Hyperparathyroidism) ולמנוע חמצת כדי שהטיפול יהיה יעיל.
רקע
הפרעת גדילה באי ספיקת כליות נובעת בחלקה הגדול מתנגודת משנית להורמון גדילה. תנגודת זו הוכחה וכוללת - עדות לרמות הורמון גדילה גבוהות עם פינוי איטי של ההורמון למרות הפרעה בגדילה, ירידה בביטוי הרצפטור להורמון גדילה, הפרעה ל-Signal transduction של הרצפטור, פעילות יתר של IGF binding proteins בעלי השפעה מעכבת. בנוסף, רבים מהחולים האלה מקבלים טיפול בקורטיקוסטרואידים (Corticosteroids) לאחר השתלה ולתרופות מקבוצה זו השפעה מוכחת משלהם על פעילות הורמון גדילה. ב-Cochrane analysis בנושא סוכם שתוצאות הטיפול מיטביות ככל שחולה היה פחות זמן בדיאליזה, ככל שהטיפול הוחל בגיל צעיר יותר וככל שתפקוד הכליות פחות פגוע.
תופעות הלוואי העיקריות שגרמו לדאגה בתחילה לגבי טיפול זה כללו התקדמות מהירה יותר לאי-ספיקה הדורשת השתלה או דיאליזה וכן עליה בלחץ התוך-גולגולתי. סיכום נתונים ממטופלים מוכיח שהידרדרות התפקוד הכלייתי אינו מזורז על ידי הטיפול בהורמון גדילה והסכנה לעליה בלחץ התוך-גולגולתי אף שקיימת היא מעטה אם מתחשבים בסיכון הקיים מראש לחולים עם אי ספיקת כליות לעליה בלחץ התוך-גולגולתי.
הנחיות לאישור
- ירידה משמעותית בעקומות הגדילה (אין דרישה מדויקת כמו בחסר הורמון גדילה מכיוון שהמטרה כאן היא למנוע ירידה נוספת צפויה)
- נדרשת עדות לאי ספיקת כליות והוכחה של טיפול נאות בחמצת והיפרפרתירוידיזם
תסמונת על שם Prader-Willi[11],[12]
ערך מורחב – תסמונת פראדר-וילי - Prader-Willi syndrome
הגדרה
תסמונת Prader-Willi Syndrome, PWS) Prader-Willi) מאופיינת בממצאים קליניים קלאסיים הכוללים מבנה גוף אופייני, הפרעה קוגניטיבית ואישיותית וכן היפוגונדיזם (Hypogonadism) אשר הוא בעל מאפיינים מרכזיים וגונדליים. כאשר אבחנה גנטית זו מאובחנת מוקנית האפשרות לטפל בהורמון גדילה.
אבחנה גנטית
מבחינה גנטית, התסמונת מתפתחת עקב היעדר התבטאות של גנים ממקור אבהי על כרומוזום 15q11-q13. גנים אלה, מבחינה פיזיולוגית הם מוחתמים (Imprinted) ומושתקים באלל (Allele) האמהי. התסמונת יכולה להתבטא קלינית אם האללים האבהיים חסרים, לא תקינים או מושתקים. אבחנה של PWS דורשת אנליזה של ההחתמה על ידי הוכחה של מתילצית DNA (DNA methylation) באזור הגן.
הנחיות מיוחדות
תופעת הלוואי הייחודית שתוארה עם הורמון גדילה בהקשר לתסמונת זו היא עליה בסיכון לתמותה בשל דום נשימה. לכן מומלץ שחולה אשר אמור לקבל טיפול בהורמון גדילה בהתוויה זו יעבור בדיקות להערכת מצב הנשימה בשינה לפני תחילת הטיפול. לאחוז גבוה של הילדים עם PWS יש הפרעות שונות במערכת הציר הורמון גדילה - 1-IGF. אין דרישה להוכחה של הפרעה כזו מכיוון שהטיפול ניתן עם או בלי הפרעות אלה. זאת, פרט לבדיקת 1-IGF שהיא חשובה גם למעקב במהלך הטיפול.
- לפני תחילת טיפול בהורמון גדילה עקב PWS שיאושר אחרי האבחון הגנטי מומלצים הצעדים הבאים
- להעריך את המצב התזונתי
- הערכה נשימתית כולל רוויון החמצן בשינה ולשקול הערכה מדויקת במעבדת שינה
- בדיקת מומחה אף אוזן גרון מומלצת ויש לשקול כריתת שקדים ואדנואידים לפני תחילת הטיפול מכיוון שמקרים בהם הייתה הגדלה משמעותית של השקדים או האדנואידים נוטים יותר להחמיר את מצבם הנשימתי הלילי על טיפול לעומת אחרים
- יש לבצע צילומי עמוד שדרה בהקשר לסקוליוזיס (עקמת, Scoliosis)
- יש לבדוק תפקודי תריס ולטפל בתת-תריסיות אם מאובחנת
- במקרים של סיפור משפחתי ברור של סוכרת מטיפוס 2 (Type 2 Diabetes mellitus) ובחולים שמנים במיוחד - לערוך העמסת סוכר דרך הפה
- מומלץ להפסיק טיפול במצבים הבאים
- החמרה מתקדמת של סוכרת למרות תרופות, דיאטה ולמרות רמות תקינות של 1-IGF
- החמרה של הפרעות שינה למרות טיפול כולל כריתת שקדים ואדנואידים ורמות תקינות של IGF-1
מומלץ לרדת במינון או לשקול הפסקת טיפול עם הגעה לגובה סופי.
ילדים קטנים לגיל ההיריון (SGA) ללא Catch-up growth
המידע בסעיף זה לקוח, עם הבהרות מעשיות, מהגדרות סל הבריאות ולקוח מההנחיות הקליניות של האיגוד הישראלי לאנדוקרינולוגיה פדיאטרית אשר נכתבו על ידי פרופ' צבי צדיק ופורסמו ב-2007 על ידי ההסתדרות הרפואית בישראל. הטבלאות עם הגדרות מספריות לקוחות אף הן מחוברת זו אשר התבססה על מקורות מידע אחרים[13].
הגדרה
ילד מוגדר כ"קטן לגיל ההיריון" לעניין טיפול בהורמון גדילה כאשר בלידתו הוא במשקל או אורך קטן משתי סטיות תקן מהממוצע למין ולגיל ההיריון.
לעיתים קרובות חסר מידע מהימן לגבי אורך היילוד. לכן ניתן לאשר מקרים בהם עד גיל חודשיים נמדד אורך הנמצא שתי סטיות תקן או יותר נמוך מהממוצע.
כדי להתחיל טיפול נדרש שהילד יהיה 2.5 סטיות תקן או יותר נמוך מהממוצע לגיל ולמין ושלא נצפתה עליה מעל קו ה-2.5 סטיות תקן במהלך הגדילה (אם כי עליה חולפת אינה בהכרח פוסלת טיפול ומקרים כאלה יידונו לגופם).
תנאי מקדים
אין לאשר טיפול בהורמון גדילה לפני שנשללו סיבות אורגניות להפרעה בעליה במשקל או גובה כולל מחלת הדגנת (Celiac) וכן הפרעה הורמונלית כגון תת-פעילות של בלוטת התריס או חוסר בהורמון גדילה.
- תנאי ההתוויה
- משקל לידה או אורך לידה מתחת ל-2 סטיות תקן למשך ההיריון
- גיל תחילת טיפול מעל 4 שנים
- גובה קטן בסטיית תקן אחת מתחת לגובה המשוקלל של ההורים (ממוצע גובה ההורים ב-SDS)
- גובה מתחת ל-2.5 סטיות תקן מותאם לגיל ולמין בכל מהלך הגדילה
- Catch up growth מקסימלי המאפשר טיפול הוא כזה שהביא את הילד עד גובה של פחות מ-2.5 סטיות תקן לגובה מותאם לגיל ולמין. אם כי כאמור עליה חולפת אינה בהכרח פוסלת טיפול ומקרים כאלה יידונו לגופם
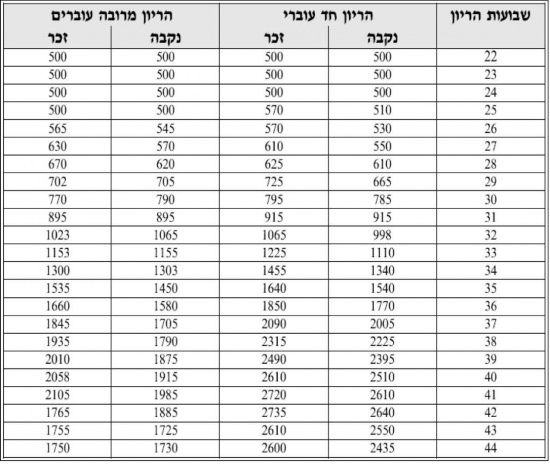
אורך לידה לפי גיל ההיריון נקבעים לפי טבלת Usher (כאמור, לרוב לא קיימים פרטי אורך לידה):
- טבלה 1 - גבול מקורב אחוזון 3 או 2 SD באורך לפי שבוע היריון בלידה
| שבוע | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 |
| אורך | 32 | 33 | 34 | 35 | 36 | 37.5 | 38.5 | 39.5 | 40.5 | 42 | 43 | 44 | 45 | 46 | 46.5 | 47 | 47 |
Usher: J Pediatr 1969; 74: 901-910.
- משקל לידה באחוזון 3 נקבע על פי הטבלה הבאה
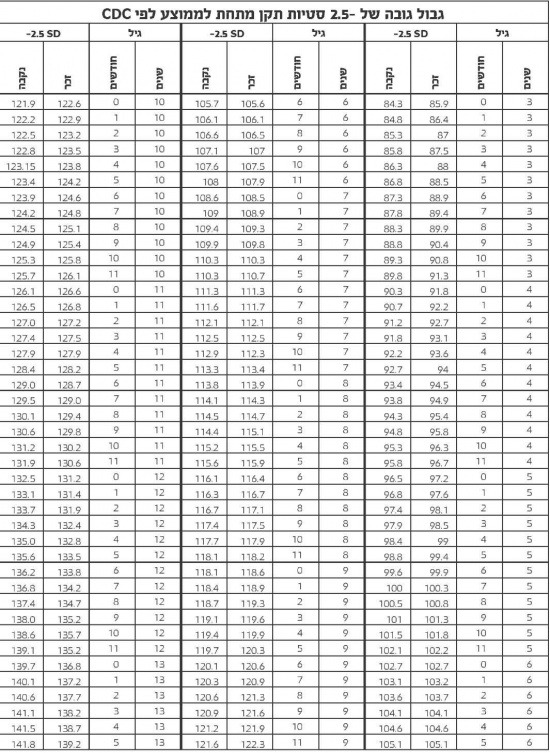
- קביעת הגובה ב-2.5 סטיות תקן על פי הגיל נקבעים על פי הטבלה הבאה (על פי נתוני 2000 CDC)
- תנאים השוללים טיפול
- ילדים שיש להם מחלות כלליות או תסמונות (למעט תסמונת רסל-סילבר, Russel-Silver syndrome) או טיפולים הגורמים להפרעה בגדילה
- ילדים שגדילתם הייתה בתחילה כמצופה וירידה בקצב הגדילה התרחשה בגיל מאוחר יותר אם עברו את קו 2.5 סטיות תקן לגובה מותאם לגיל/מין בשלב כלשהו
- תנאים להפסקת טיפול
- חוסר תגובה לטיפול - קצב גדילה של פחות מ-2 סנטימטרים לשנה
- גיל עצמות בבנות 14 שנה ו-16 שנה בבנים
ביבליוגרפיה
- Strich D et al. Glucagon stimulation test for childhood GH deficiency; timing of the peak is important. J Pediatr 2009;154:415-419
- Morris AH, Harrington MH, Chuchill DL, Oslan JS. Growth hormone stimulation testing with oral clonidine: 90 minutes is the preferred duration for the assessment of growth hormone reserve. J Pediatr Endocrinol Metab
2001;14:1657-60.
- Goldstone AP et al. Recommendations for the diagnosis and management of Prader-Willi syndrome. J Clin Endocrinol Metab 2008;93:4183-4197.
- Stafler P et al. Prader-Willi syndrome: who can have growth hormone? Arch Dis Child 2008;93:341-345.
- ↑ GH research society. Consensus guidelines for the diagnosis and treatment of growth hormone deficiency in childhood and adolescence: Summary statement of the GH research society. J Clin Endocrinol Metab 2000;85:3990-3993.
- ↑ 2.0 2.1 2.2 הסתדרות הרפואית בישראל המועצה המדעית. הנחיות קליניות בנושא: אבחון וטיפול בחוסר הורמון גדילה. הנחיות והמלצות הועדה המקצועית מטעם האיגוד הישראלי.לאנדוקרינולוגיה פדיאטית 1999
- ↑ Trainer P et al. Consensus statement on the standardization of GH assays. Eur J Endocrinol 2006;155:1-2.
- ↑ Zadik et al. The diagnostic value of integrated growth hormone secretion strudies shorter than 24 hours in normal and short growing children. Horm Res 1992;38:250-255.
- ↑ Consensus Statement on the Standardization and Evaluation of Growth Hormone and Insulin-like Growth Factor Assays David R. Clemmons Clinical Chemistry 57:4 555-559 (2011)
- ↑ Muster L et al. Arginine and Clonidine Stimulation Tests for Growth hormone Deficiency Revisited; Do We Really Need So Many Samples? J Ped Endocrinol Metabol 2009;22:215-224.
- ↑ Galluzzi F, Stagi S, Parpagnoli M, Losi S, Pagnini I et al. Oral clonidine provocative test in the diagnosis of growth hormone deficiency in childhood: should we make the timing uniform? Horm Res 2006;66:285-8.
- ↑ Albertsson Wikland K et al. Analysis of 24-hour growth hormone profiles in healthy boys and girls of normal stature, relation to puberty. J Clin Endocrinol Metab 1994;78:1195-1201.
- ↑ Rappaport R et al. Growth and endocrine disorders secondary to cranial irradiation. Horm Res 1989;25:561-7.
- ↑ Savage MO et al. The continuum of growth hormone-IGF-I axis defects causing short stature: diagnostic and therapeutic challenges. Clin Endocrinol (Oxf.) 2010;72:721-728.
- ↑ Hess O et al. Variable phenotypes in familial isolated growth hormone deficiency caused by a G6664A mutation in the GH-1 gene. J Clin Endocrinol Metab. 2007;92:4387-4393.
- ↑ Davenport ML. Approach to the patient with Turner syndrome. J Clin Endocrinol Metab 2010;95:1487-1495.
- ↑ Mehls O et al. Growth hormone treatment in short children with chronic kidney disease. Acta Paediatr 2008;97:1159-1164.
המידע שבדף זה נכתב על ידי פרופ' צבי צדיק, ד"ר נחמה לוין-צוקרמן, ד"ר דוד שטריך, ד"ר דוד גיליס


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק