קנאבידיול - Cannabidiol
| מדריך בדיקות מעבדה | |
| קנאבידיול | |
|---|---|
| Cannabidiol | |
| שמות אחרים | CBD |
| מעבדה | כימיה בדם, כימיה בשתן, אנדוקרינולוגיה בדם, אנדוקרינולוגיה בשתן |
| תחום | חשיפה לרעלים, להרעלות ולהתמכרויות. |
| יוצר הערך | פרופ' בן-עמי סלע |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – קנאביס רפואי
Cannabidiol (להלן CBD) הוא פיטו-קנבינואיד שהתגלה בשנת 1940. הוא אחד מ-113 קנבינואידים שזוהו בצמח הקנאביס, ביחד עם tertrahydrocannabinol (להלן THC), ומהווה בערך 13% מתמצית הצמח (Stella וחב' ב-Nature משנת 1997).
נכון ל-2022 מחקרים הכרוכים בטיפול בדאגנות, בפסיכוזיס, בהתמכרות, בבעיות תנועה, ובכאב, מצאו שאין ראיות באיכות גבוהה ש-CBD יעיל במצבים אלה (Sugiura וחב' ב-Prog Lipid Res משנת 2006, Piomelli ב-Nat Rev Neurosci משנת 2003, De Petrocellis ו-Di Marzo ב-Best Pract Res Clin Endocrinol Metab משנת 2009, ו-Iversen ב-Brain משנת 2003). CBD נמכר גם כתוסף מזון צמחי עם טענות בלתי מוכחות על השפעות תרפויטיות ספציפיות (Devinsky וחב' ב-Epilepsia משנת 2014). CBD יכול להילקח במספר דרכים, כגון שאיפת עשן או אדים של קנאביס, באופן פומי או על ידי תרסיס אירוסולי (Zuardi ב-Braz J Psychiatry משנת 2006), וכן ניתן לקבלו כשמן של CBD המכיל רק CBD ללא THC או terpenes, בקפסולות, כקנאביס מיובש, או כתמיסת מרשם. ל-CBD אין אותה פעילות פסיכוטית כזו של THC (Lutz ב-Biochem Pharmacol משנת 2004), אך הוא יכול לאפנן את ההשפעות הפסיכואקטיביות של THC בגוף (Russo ב-Cannabis Cannabinoid Res משנת 2016). כאשר מחממים את CBD לטמפרטורה של 250–300 מעלות צלזיוס, הוא יכול להיות מותמר בחלקו ל-THC (Potts וחב' ב-J Clin Toxicol משנת 2020). בארצות הברית, תרופת ה-CBD הידועה כ-Epidiolex, אושרה בשנת 2018 לשימוש על ידי ה-FDA לטיפול בשני מפגעים אפילפטיים (Fankhauser ב-Cannbis Cannabinoids משנת 2002). באותה שנה, הוצא CBD מרשימת התרופות המפוקחות, אם כי השיווק של CBD למטרות רפואיות או כתוסף מזון נותר לא חוקי על ידי ה-FDA נכון לשנת 2024 (Abouchedid וחב' ב-J Med Toxicol משנת 2016, ו-Huestis וחב' ב-J Anal Toxicol משנת 1992).
לפחות 100 זנים של קנאביס הם תרכובות הידועים כקנבינואידים, מולקולות עם שלד טרפּנוֹ-פנולי עם 21 פחמנים. קנבינואידים מייצרים למעלה מ-100 כימיקלים טבעיים, שהשכיחים ביותר בהם THC או CBD טרפּנים ופלבונואידים. THC ו-CBD נקשרים לקולטנים קנבינואידים (CB1 ו-CB2) המצויים במוח, ובאיברים רבים. המטבוליזם של קנאביס נקבע על ידי דרך צריכתו. כאשר הוא נשאף, THC והמטבוליטים שלו, נכנסים במהירות לזרם הדם מהריאות, ומגיע לרמות השיא שלו תוך 6-10 דקות ומשם מגיע למוח ולאיברים נוספים. הזמינות של THC הנשאף היא של 10-35%. לאחר ש-THC נספג, הוא נודד לכבד כאשר רובו מורחק או עובר מטבוליזם ל-11-OH-THC או ל-11-COOH-THC. יתר ה-THC והמטבוליטים שלו, נכנסים לצירקולציה. הזמינות הביולוגית של THC הנצרך, היא של 4-12% בלבד. THC מסיס מאוד בליפידים ולפיכך נקלט במהירות ברקמת שומן. תקופת מחצית החיים של THC בפלזמה היא של 1-3 ימים, במשתמשים מזדמנים, ו-5-13 ימים במשתמשים כרוניים. הזמינות הביולוגית של CBD דרך שאיפה, היא של 11-45%, בעוד זו של נטילה פומית של CBD היא של 6%. גם CBD מאוד ליפופילי ולפיכך מגיע למוח, לרקמת השומן ולאיברים נוספים. CBD עובר הידרוקסילציה ל-7-OH-CBD וכן ל-7-COOH-CBD על ידי אנזימי ציטוכרום P450 (CYP3A4 ו-CYP2C9) בכבד, ומופרשים בעיקר בצואה ופחות בשתן. תקופת מחצית החיים של CBD בפלזמה היא 18–32 שעות.
נכון לשנת 2022, היו רק ראיות מעטות של-cannabidiol יש השפעה נוירולוגית באדם (Kirkland וחב' ב-Psychiat Res משנת 2022, Black וחב' ב-Lancet Psychiat משנת 2019, Prud'homme וחב' ב-Substance Abuse משנת 2015, ו-Hoch וחב' ב-Eur Arch Psychiat Clin Neurosci משנת 2019).
היסטוריה
מאמצים לבודד את המרכיבים הפעילים של קנאביס נעשו כבר במאה ה-19. Cannabidiol נלמד כבר ב-1940 תוך שימוש בצמח פרא במינסוטה, כמו גם ב-Egyptian Cannabis indica resin. הנוסחה הכימית של cannabidiol הוצעה בשיטה שבודדה חומר זה מצמח קנאביס פראי. המבנה והסטראוכימיה של cannabidiol נקבעו בשנת 1963 (Conway ב-Statista משנת 2021). קנאביס גודל למטרות רפואיות כבר לפני למעלה מ-4,000 שנה בסין, מה שמיוחס לקיסר האגדי Shen Nung. קנאביס שימש בתרחישים קליניים כמו בעיות מחזור נשי, וירידה בתגובות נפשיות, ובעוד 100 תרחישים. הסינים עשו שימוש בזרעי קנאביס למטרות קליניות (Li ב-Econ Bot משנת 1974, ו-Zuardi ב-Brazil J Psychiatry משנת 2006). קנאביס היה גם בשימוש בהודו, פרס וסוריה, ומשם התפשט למזרח התיכון, לאפריקה לאירופה ולארצות הברית. במאה ה-19 היה זה William O'Shaughnessy ששירת בהודו, והביא את הקנאביס לאנגליה, ופרסם בשנת 1839 את מחקרו על Gunjah (שהוא השם ההודי של קנאביס) ועל יתרונותיו בניסויים קליניים מוצלחים בעיקר במקרי עוויתות שרירים הנגרמות מכלבת ומטטנוס, וכן במקרי ראומטיזם והתכווצויות (Mikuriya ב-Calif Med משנת 1969, ו-Frankhauser ב-History of Cannabis in Western Med משנת 2002). לצמח הקנאביס ישנם סוגים רבים, כאשר העיקריים בהם הם C.sativa ,C.indica ו-C.ruderalis. למעלה מ-500 תרכובות בודדו מקנאביס, כאשר 100 מתוכם הם קנבינואידים, מולקולות עם שלד טרפּנו-פנולי עם 21 אטומי פחמן (Friedman ו-Devinsky ב-N Eng J Med משנת 2015, ו-Maa ו-Figi ב-Epilepsia משנת 2014). הקנבינואידים העיקריים הם: THC ,CBD טרפנים ופלבונואידים. THC הוא הכימיקל הפסיכו-טרופי הגורם לתחושת "high", בעוד ש-CBD אינו פסיכו-טרופי (Joy וחב' ב-Marihuana Med משנת 1999).
הכימיה של cannabidiol
בטמפרטורת החדר, cannabidiol הוא מוצק גבישי חסר-צבע. בתמיסות מאוד בסיסיות בנוכחות אוויר, החומר מתחמצן ל-quinone, ואילו תחת תנאים חומציים הוא עובר ציקליזציה ל-THC (Fox וחב' ב-Lexology משנת 2017), תהליך המתרחש גם במהלך פירוליזה (La Vito ו-Franck ב-CNBC משנת 2019), וכן במהלך עישון סיגריות (Czégény וחב' ב-Sci Rep משנת 2021). הסינתזה של cannabidiol הושלמה על ידי מספר קבוצות מחקר (Donna ב-CTV Business משנת 2019).
פרמקולוגיה
נכון לשנת 2024, ההשפעות התאיות של cannabidiol בתנאי in vivo אינן ידועות, שכן המחקר היה בלתי פסקני ומבוסס על בדיקות מעבדה (Marks וחב' ב-J Exp Botany משנת 2009). נכון לספטמבר 2019, התקשרו 1,085 אנשים למרכזי רעלנות, בקשר למפגעים המושרים על ידי cannabidiol, פי-9 יותר ממספר הפניות בשנת 2017. מהמקרים שפנו למרכזי הטוקסיות, 33% טופלו במקום, ו-46 מהפונים הופנו ליחידות טיפול נמרץ בבתי חולים. In-vitro, יש ל-cannabidiol זיקה נמוכה לקולטנים קנבינואידים CB1 ו-CB2 והוא פועל כאנטגוניסט חלקי של קולטנים אלה. הפוטנציאל של cannabidiol לשנות את התגובה של הקולטן CB1 ל-THC, ולעכב את ההשפעות הפסיכואקטיביות של האחרון, נמצא בשלבי המחקר הראשונים (Bonn-Miller וחב' ב-JAMA משנת 2017, ו-Jacob ו-Todd ב-Nature משנת 1940). בשנת 2022, קבע ה-FDA שיש ראיות ניסוייות לכך שיש ל-cannabidiol השפעה מזיקה למערכת הרבייה הזכרית, כולל אטרופיה של האשכים, נזק לכבד, וכן אינטראקציה עם מספר תרופות (Ghovanloo וחב' ב-J Biol Chem משנת 2018). Cannabidiol יכול להיות אנטגוניסט של GPR55, קולטן הקשור לחלבוני G (Work וחב' ב-Biochem J משנת 1939). Cannabidiol יכול להגיב עם נוירו-טרנמיטורים אחדים כגון סרוטונין, דופאמין ו-GABA (Mechoulam ו-Shvo ב-Tetrahedron משנת 1963). הזמינות הפומית של cannabidiol היא בערך 6% באדם, בעוד שהזמינות שלו על ידי שאיפה היא בממוצע בת 31% (Perucca ו-Bialer ב-CNS Drugs משנת 2020, ו-Scuderi וחב' ב-Phytotherapy Res משנת 2009). תקופת מחצית החיים של פינוי cannabidiol מהדם היא 56–61 שעות לאחר נטילה פומית של התכשיר פעמיים ביום למשך 7 ימים. Cannabidiol עובר מטבוליזם בכבד כמו גם במעיים על ידי אנזימי ציטוכרום P450. ראיות מעבדתיות מצביעות על כך ש-cannabidiol יכול להפחית את פינוי THC ולהגביר את ריכוז האחרון בפלזמה, מה שמגביר את הזמינות שלו לקולטניו, ולהגביר את השפעתו (Lucas וחב' ב-Br J Clin Pharmacol משנת 2018).
Nabiximols (שם מותג Sativex), הוא תרסיס orosomucosal המורכב מקומפלקס של תערובת בוטנית המכילה cannabidiol, Δ-9-tetrahydrocannabinol (THC) ועוד מרכיבים קנבינואידים ולא-קנבינואידים מצמחי cannabis sativa, שאושר לשימוש על ידי Health Canada בשנת 2005, לטיפול בכאב נוירופתי מרכזי בחולי טרשת נפוצה, ואושר שם לטיפול בכאב של חולי סרטן (Romney ב-Los Angeles Times משנת 2012).
מנגנון הפעולה
עד אמצע המאה ה-20, לא היה ידע על מנגנון הפעולה של קנבינואידים. הראייה ש-THC מגיב עם יעד מסוים ביונקים הופיעה בתאי נוירובלסטומה בעכברים, בהם הייתה עלייה בפעילות adenylate cyclase בתגובה לחשיפה לקנבינואידים או לאנלוגים סינתטיים שלהם. ממצא זה סלל את הדרך לבידוד ולשיבוט של הקולטן CB1 הקשור לחלבוני G (Matsuda וחב' ב-Nature משנת 1990). הקולטן הקנבינואידי השני, CB2, בודד לאחר מכן בתאי לויקמיה באדם (Munro וחב' ב-Nature משנת 1993). נמצא ש-CBD מגיב ישירות עם CB2. זיהוי קולטנים אלה הביא להשערה שמערכת קנבינואידית אנדוגנית הידועה כ-endocannabinoids מופיעה בגופם של יונקים. הליגנד האנדוקנבינואידי הראשון בודד ממוח חזיר ונקראN-arachidonoy lethanolamine (להלן AEA) וכן anandamide (Devane וחב' ב-Science משנת 1992). הליגנד האנדוגני השני בודד מרקמת מעי ונקרא 2-arachidonoylglycerol (להלן 2-AG). שני ליגנדים אלה, AEA ו-2-AG, הם נגזרות של חומצה ארכידונית הנוצרים מקודמנים פוספוליפידים. מספר ליגנדים אנדוגניים התגלו, הכוללים N-arachidonoyl dopamine, N-arachidonoyl glycerol ו-O-arachidonoylethanolamine. לאחר קליטתו, AEA עובר הידרוליזה על ידי האנזים fatty acid amide hydrolase ליצירת חומצה ארכידונית ו-אתנולאמין. 2-AG מסונתז בעיקר דרך שפעול של פוספוליפאז C, והיצירה של diacylglycerol המותמר ל-2-AG על ידי diacylglycerol lipase עובר מטבוליזם בעיקר על ידי monoacylglycerol lipase ליצירה של חומצה ארכידונית וגליצרול. ל-AEA ישנה הזיקה הגבוהה ביותר ל-CB1 ול-CB2. גירויים פיזיולוגיים או פתולוגיים משרים את הסינתזה וההפרשה של אנדו-קנבינואידים, שיכולים לשפעל את הקולטנים לקנבינואידים.
THC ו-CBD מהמערכת הפיטו-קנבינואידית יכולים להיקשר לקולטנים CB1 ו-CB2. קולטני CB1 שכיחים בעיקר בקליפת המוח הקדמית, בהיפוקמפוס, בהיפותלמוס, בגנגליונים הבזאליים, במוחון, בעמוד השדרה ובמערכת העצבים ההיקפית. הם נמצאים הן בנוירונים ה-GABA-ergic המעכבים, אך גם בנוירונים הגלוטמאטו-ארגיים הגריינים. לעומתם, קולטני CB2 נמצאים בעיקר בתאי מערכת החיסון, בתאים המטו-פויאטיים (Devinsky וחב' ב-Epilepsia משנת 2014), ובתאי glia. CB2 מבוטא בעיקר במצבים של בריאות נורמלית, אך גם במצבים פתולוגיים ובפציעה, כאשר הרגולציה המתקדמת שלהם מתרחשת במוח, ולפיכך במצבים לא-בריאים. קולטני CB1 ו-CB2 מפוזרים גם במערכת הקרדיו-וסקולרית (Singla וחב' ב-Clin Cardiol משנת 2012). פרט להתקשרותם לקולטנים CB1 ו-CB2, אנדו- ופיטו-קנבינואידים נקשרים גם לקולטנים נוספים הקשורים לחלבוני-G כגון: GPR55 ,GPR18 ,GPR6 ו-GPR12, לקולטנים ברי-חלוף כגון TRPM8, ל-TRP ונילואידיים כגון TRPV1 עד TRPV4, ל־ankyrin TRPA1, וכן הם נקשרים לקולטנים המשופעלים על ידי peroxisome proliferator כגון PPAR2 ו-PPARγ, לקולטנים מונו-אמיניים כגון נוראפינפרין, דופאמין, ולקולטן סרוטונין A1, ל-fatty acid amide hydrolase, לקולטני גליצין α1 ו-α3 ל-monoacylglycerol lipase ולטרנספורטרים של adenosine equilibrative nucleoside.
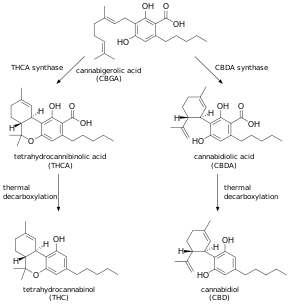
קנאביס מייצר cannabidiol דרך אותו מסלול מטבולי של THC, עד לשלב שלפני האחרון, בו CBDA synthase מבצע קטליזה במקום THCA synthase (Harrison משנת 2019). מחקרים שבוצעו על ידי FDA בין השנים 2014 ו-2019 קבעו שרוב תוצרי cannabidiol אינם מסומנים במדויק על פי כמות ה-cannabidiol שהם מכילים. לדוגמה, אנליזה משנת 2017 של כמות cannabidiol בשמן, בתמצית צבע או בתוצרי תמיסת שאיפה ((vaping, הנרכשים בארצות הברית, הראתה ש-69% של המוצרים הללו אינם מסומנים כהלכה כאשר 43% מתוכם הם בעלי כמות גדולה יותר של cannabidiol ו-26% מתוכם מכילים כמות קטנה יותר של חומר זה. בשנת 2020 ביצע ה-FDA 147 בדיקות של מוצרי cannabidiol ומצא שמחציתם הכילו THC (Hasse ב-Forbes משנת 2021). בין השנים 2015 ו-2022, ה-FDA שלח עשרות מכתבי אזהרה ליצרנים אמריקניים של מוצרי cannabidiol, בגין פרסום שקרי, ושיווק לא חוקי בין מדינות ארצות הברית, כתכשיר לטיפול במחלות כגון סרטן, אוסטאו-ארתריטיס, תסמיני גמילה מאופיואידים, מחלת אלצהיימר.
יש ראיות לכך שהתפקוד של אנדו-קנבינואידים פוחת במספר מצבים רפואיים כמו מיגרנה, פיברומיאלגיה (דאבת), תסמונת המעי הרגיז (IBD), טרשת נפוצה, נוירופתיה סוכרתית, מחלת פרקינסון ואחרים. פיטו-קנבינואידים בעלי פעיליות דומה על קולטנים קנבינואידים יכולים להיות בעלי פוטנציאל תרפויטי במצבים קליניים אלה. לפחות 180 קנבינואידים סינתטיים דווחו בשנת 2019 על ידי המרכז האירופי לניטור תרופות והתמכרות לתרופות. ההשפעות השליליות של קנבינואידים סינתטיים, כוללים דופק לב מהיר, פרנויה, דאגנות מופרזת, בחילה, הקאות, בלבוליות, קואורדינציה ירודה, והתכווצויות. יש דיווחים על כמיהה לקנבינואידים לאחר תקופת שבוע מהפסקת הצריכה שלהם, ויש גם דיווחים על תסמיני גמילה קשים בצורת כאבי ראש, בחילה והקאות.
אפילפסיה
בארצות הברית, ה-FDA אישר בשנת 2018 רק סוג אחד של cannabidiol תחת השם Epidiolex, לטיפול בעוויתות הכרוכות בתסמונת Dravet, תסמונת Lennox-Gastaut או בקומפלקס של tuberous-sclerosis בילדים בגיל שנה ומעלה (Stockings וחב' ב-J Neurol Neurosurg Psychiat משנת 2018 ו-Elliott וחב' ב-Seizure משנת 2020). אף על פי שהטיפול עם Epidiolex נסבל בדרך כלל הוא עלול לגרום לתופעות לוואי מינוריות כגון תחושות מעיים, תיאבון מופחת, לתרגיה (רדמת), ישנוניות ואיכות שינה נמוכה. ברשות הבריאות האירופית, המוצר ששמו Epidyolex, מאושר לטיפול בתסמונות שהוזכרו בשילוב עם clobazam, לבני שנתיים ומעלה. Epidiolex/Epidyolex היא הפורמולציה הראשונה של cannabidiol ממקור צמחי שאושר לשימוש על ידי רשויות הבריאות בארצות הברית ובאירופה.
מספר חוקרים הגיעו למסקנה שאין ראיות מספיקות לקבוע את היעילות של cannabidiol כמפיג כאבים (Villanueva וחב' ב-Cureus משנת 2022). מחקר על שימושים אחרים של cannabidiol כולל מספר מפגעים נוירולוגיים, אך הראיות אינן חזקות דיין על מנת לאשר שימושו בשגרה הקלינית (Devinsky וחב' ב-Epilepsia משנת 2014, Pisanti וחב' ב-Pharmacol Therapeut משנת 2017, Silva וחב' ב-Ann Clin Psychiat משנת 2015, ו-Blessing וחב' ב-Neurotherapeutics משנת 2015). באוקטובר 2019, פרסם ה-FDA אזהרה על כך שהשפעת cannabidiol בהיריון או בתקופת ההנקה אינה ידועה.
פרמקו-קינטיקה
למעלה מ-65% מ-THC מופרשים מהגוף דרך הצואה, ובערך 20% מופרשים דרך השתן. רוב הקנאביס (80-90%) מופרשים תוך 5 ימים כמטבוליטים שעברו הידרוקסילציה וקרבוקסילציה. בין המטבוליטים העיקריים, 11-COOH-THC הוא הקוניוגאט הגלוקורונידי בשתן, ואילו המטבוליט 11-OH-THC של THC, היא הצורה הדומיננטית בצואה (Goulle וחב' ב-Ann Pharm Fr משנת 2008, ו-Vandevenne וחב' ב-Acta Clin Belg משנת 2000). יתר ה-THC ושני המטבוליטים שלו מגיעים ללב ומשם חודרים לצירקולציה. THC ו--OH-THC11, מגיעים למוח סימולטנית. בגלל הליפופיליות שלו, THC מגיע לרקמת השומן שם הוא מצטבר, ומשם הוא מופרש באיטיות לדם (Huestis ב-Handbook Exp Pharmacol משנת 2005). בין כל המשתמשים, קלים וכבדים, שיא הזמינות של THC הנשאף הוא בין 10-35% (Grotenhermen ב-Clin Pharmokinet משנת 2003, ו-Lindgren וחב' ב-Psycopharmacol משנת 1981). כללית שאיפה מייצרת השפעה פסיכואקטיבית חזקה יותר מאשר בליעה, ולאחר שאיפה ריכוזי THC במוח גבוהים יותר מאשר בדם (Wall ו-Perez-Reyes ב-J Clin Pharmacol משנת 1981). תקופת מחצית החיים של THC בפלזמה היא בין 1-3 ימים במשתמשים מזדמנים, ו-5–13 ימים במשתמשים כרוניים (Huestis וחב' ב-J Anal Toxicol משנת 1992).
CBD היא מרכיב אחר של קנאביס, ומגיע לדם בדומה ל-THC. הפרמקוקינטיקה של BD מורכבת, והזמינות הביולוגית של CBD הנלקח פומית נמוכה (Harvey ב-Metabolism Pharmacokinetics of Cannabinoides משנת 1991, Smith-Kielland וחב' ב-J Anal Toxicol משנת 1999, ו-Huestis ב-Chem Biodivers משנת 2007).
באופן כללי, המטבוליטים השכיחים ביותר של CBD הם נגזרות שעברו 7-COOH הידרוקסילציה, המופרשים או ככאלה או כקוניוגאטים גלוקורונידים (Huestis ו-Smith ב-Handbook of Cannabis משנת 2014). CBD יכול לעודד או לעכב את השפעול של התקשרותו לאתרי היעד שלו. CBD מעכב את השפעול של הטרנספורטר של הנוקלאוזיד GPR55, ובין השאר את השפעול של TRP cation channel subfamily הידועה גם כקולטן גליצין TRPM8, ולעודד את הפעילות של הקולטן סרוטונין 1A ואת קולטני הגליצין α1 ו-α3 ו-TRPA1. דרך קליטתו של CBD בגוף, משפיעה על הפרמקו-קינטיקה שלו. הזמינות הביולוגית של CBD היא 11-45% (ובממוצע 31%), ואילו הזמינות הביולוגית שלו בנטילה פומית באדם היא של 6% בלבד. בגלל הליפופיליות הגבוהה שלו, CBD נקלט במהירות במוח, ברקמת השומן, ובאיברים אחרים. CBD מסיס מעט במים, ונהוג לתת אותו בבליעת כמוסות. תקופת מחצית החיים של CBD מוערכת כ-18–32 שעות (Ujváry ו-Hanus ב-Cannabis Cannabinoid Res משנת 2016). CBD מעכב את CYP3A4 ואת CYP2D6, ועלול להפחית את ריכוז התכשיר על ידי מטבוליזם מוגבר, מה שעלול להגביר את השפעותיו, ולגרום לתופעות לוואי משמעותיות (Li וחב' ב-Aust J Acupunct Chin Med משנת 12007, ו-Watanabe וחב' ב-Life Sci משנת 2007). בנוסף, תכשירים המשרים את CYP3A4 דווחו ככאלה המפחיתים את רמות THC ו-CBD, בעוד שתכשירים המעכבים את CYP3A4 ואת CYP2C9, מגבירים את רמות THC ו-CBD (Stout ו-Simino ב-Drug Metab Rev משנת 2014). לבסוף, יש דאגה הולכת וגדלה באשר לסכנה של קליטת קנאביס נשאף לתוך חלב אם מניקה (Garry וחב' ב-J Toxicol משנת 2009, Perez-Reyes ו-Wall ב-N Eng J Med משנת 1982, Baker וחב' ב-Obstet Gynecol משנת 2018). ההשפעות ארוכות הטווח של THC על מוח התינוק היונק אינן ידועות (Fernandez-Ruiz ב-Neurotox Res משנת 2004).
תופעות לוואי
מחקר מראה ש-cannabidiol יכול להפחית את תופעות הלוואי של THC, במיוחד אלו הטוקסיות הגורמות להַרְגָּעָה, שִׁכּוּךְ, או הרדמה קלה רק בריכוזים גבוהים (Fischer וחב' ב-Am J Public Health משנת 2017). מחקרי בטיחות של cannabidiol הראו שהתכשיר נסבל ביותר, אך עלול לגרום לעייפות, להרדמה קלה, להתנמנמות, לשלשולים ולשינויים בתיאבון. נתונים על Epidiolex מונים ישנוניות, נדודי שינה, איכות שינה נמוכה, שלשולים ועייפות. בנובמבר 2019 פרסם ה-FDA דאגה בדבר הבטיחות של cannabidiol תוך ציון העובדה שתכשיר זה עלול לגרום לפגיעה בכבד, לגרום למפגעים של מערכת העיכול, או להשפיע על כושר הזהירות ועל מצבי הרוח. בתקופה שבין 23–2020, עדכן ה-FDA את דאגת הבטיחות של cannabidiol, תוך התייחסות להשפעותיו על המוח המתפתח, על העוברים והתינוקות היונקים, בגין החשש שהוא מגיב עם תוספי מזון, או עם תרופות מרשם, או בגין השפעותיו על פריון הזכרים, ותופעות הלוואי שלו כגון התנמנמות (Hahn ב-US FDA משנת 2020). In vitro cannabidiol עיכב את הפעילות של תעלות נתרן ואשלגן שהן voltage-dependent, מה שעלול להשפיע על פעילות עצבית (Yamaori וחב' ב-Life Sci משנת 2011). מחקר עדכני תוך שימוש בקריסטלוגרפיה של קרני X, הראה ש-cannabidiol נקשר בתוך תעלת נתרן לאזור "חדש" במשטח של פנסטרציות והגומחה ההידרופובית המרכזית של התעלה. הקישור לאתר זה, מספק מנגנון מולקולרי לעיכוב התעלה, שיכול לתרום לגירוי נוירונלי מופחת. ניסוי קליני קטן, דיווח ש-cannabidiol עיכב חלקית את ההידרוקסילציה המקוטלזת על ידי CYP2C של THC ל-11-OH-THC (Wakshlag וחב' ב-Vet Med Res Reports משנת 2020). ידוע גם ש-cannabidiol מתווך בירידה של מטבוליזם של clobazam (McGrath וחב' ב-J Am Therapeut משנת 2019). מחקר עם מיקרוזומים של כבד אדם, הראה ש-cannabidiol מעכב את CYP3A5 ואת CYP3A4 במידה מסוימת (Jung ו-Promelli ב-Neurosci in the 21st Century משנת 2015).
השפעות "לא טוקסיות"
Cannabidiol אינו בעל השפעות טוקסיות (Kicman ו-Toczek ב-Int J Mol Sci משנת 2020), כגון אלו הנגרמות על ידי ∆9-THC אך הוא נמצא בשלבי מחקר מוקדמים באשר להשפעותיו האנטי-דאגניות ואנטי-פסיכוטיות (Iseger ו-Bossong ב־Schizophrenia Res משנת 2015). מספר זנים של "קנביס רפואי" נמצאו בעלי מגוון משמעותי ביחסים של cannabidiol ל-tetrahydrocannabinol (להלן THC) והם אמורים להכיל קנבינואידים לא-פסיכוטרופיים אחרים (Izzo וחב' ב-Trends Pharmacol Sci משנת 2009). כפי שהוגדר על ידי החוק הפדרלי בארצות הברית, קנבוס שאינו פסיכו-אקטיבי ((industrial hemp ללא קשר לתכולת ה-cannabidiol שלו, הוא כל חלק מצמח הקנאביס, המכיל ריכוז של ∆9-tetrahydrocannabinol של לא יותר מ-0.3% על בסיס משקל יבש. החקיקה לגבי גידול קנאביס משתנה במספר מדינות בארצות הברית, ולדוגמה בקולורדו החקיקה לגבי גידול קנאביס מסחרי, מקפידה על כך שהמשק היבש של THC לא יעלה על 0.3%.
מאכלים ומשקאות
מוצרי מזון ומשקאות קלים המכילים cannabidiol שווקו בהרחבה בארצות הברית מאז 2017. זרעי קנאביס שאינם מכילים באופן טבעי THC או cannabidiol, אך עלולים להיות מזוהמים בכמויות קטנות של 2 המרכיבים האחרונים במהלך קצירתם, הוכרזו על ידי ה-FDA כבטיחותיים בדצמבר 2018. עם זאת, cannabidiol לא הוגדר כבטיחותי תחת החוק האמריקני, והוא אינו חוקי למכירה כפריט מזון, תוסף דיאטטי, או מזון לבעלי חיים. בדומה למשקאות אנרגיה וחֲפִיסָת חלבון, המכילים ויטמינים או תוספים צמחיים, מוצרי מזון ומשקאות קלים יכולים להיות מוספים עם cannabidiol כחלופה ללעיסת החומר. בארצות הברית, מוצרי מזון אחדים משווקים כמכילים cannabidiol, אם כי בכמויות זעירות (Milosz ב-CannabizEU משנת 2023). מספר חברות המשווקות פריטי מזון שעברו אינפוזיה עם cannabidiol עם טענה שמוצרים אלה בטיחותיים, קיבלו מכתבי אזהרה מה-FDA על שהן מפרות את עקרונות המזון הבטיחותי (Chu ב-NaturaIngredients.com משנת 2019). בפברואר 2019, המחלקה לבריאות של עיריית ניו-יורק החליטה שהחל מחודש אוקטובר 2019, היא תקנוס מסעדות המוכרות מזון או משקאות המכילים cannabidiol.
ספורט
Cannabidiol היה בשימוש של ספורטאים מקצועניים וחובבים בענפי ספורט שונים ובמדינות אחדות, כאשר World Anti-Doping Agency הסירה את cannabidiol מרשימת החומרים האסורים. סוכנויות ה-Anti-doping בארצות הברית ובבריטניה אינן כוללות הגדרה של doping substance בכל הקשור ל-cannabidiol, ולפיכך חוומר זה מורשה לשימוש בספורט. כל הקנבינואידים האחרים הכוללים קנאביס, חשיש, מריחואנה ו-THC אסורים לצריכה בתחרויות. מטרת הרגולטורים היא למנוע צריכת קנבינואידים העלולים לשפעל את אותם קולטנים במוח המשופעלים על ידי THC. בשנת 2019, יצרן הקנאביס Canopy Growth השיג בעלות על חברת BioSteel Sports Nutrition, המייצרת מוצרי cannabidiol לשימוש של ספורטאים מקצועניים. איגוד שחקני ההוקי קרח החלו פרויקט עם Canopy Growth כדי לקבוע האם cannabidiol או מוצרי קנאביס אחרים עשויים לשפר את התסמינים הנוירולוגיים ואת איכות החיים של ספורטאים פגועי-ראש. מספר ליגות של ענפי ספורט כגון ליגת הבייסבול, הכריזו על שיתוף פעולה עם חברות יצרני cannabidiol, ואחדים מהספורטאים המקצועניים משתמשים ב-cannabidiol לשיכוך כאבים (Leung ב-Hong Kong Free Press משנת 2022).
הוראות לביצוע הבדיקה
הדם נלקח במבחנה כימית (פקק אדום), ולאחר סרכוז הנסיוב מבודד מתאי הדם ומועבר למבחנה פלסטית. אין להשתמש במבחנת ג'ל. אין להוסיף חומר משמר. שליחת הדגמה למעבדה בקירור מועדפת והיא יציבה למשך 30 יום. בטמפרטורת החדר הדגימה יציבה למשך 14 יום. דגימה מוקפאת יציבה למשך 3 חודשיים. שיטת הבדיקה high peformance Liquid Chromatography/ Tandem Mass Spectrometry (LC-MS/MS).
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק