הבדלים בין גרסאות בדף "רזיסטין - Resistin"
| שורה 126: | שורה 126: | ||
===Resistin וציטוקינים=== | ===Resistin וציטוקינים=== | ||
| − | ציטוקינים הם כידוע מולקולות המשגרות איתות לתאים והן משרות בין השאר תהליכי דלקת. ציטוקינים נקשרים לקולטנים ספציפיים שלהם על פני תאים, דרכם הם שולחים את מסריהם לתוך התא באופן שמשנה את תפקודי התא. הודגם ש-resistin מעודד שפעול של תאי אנדותל, על ידי הפרשה של אנדותלין-1, ושדרוג של מולקולות הנספחות לתאים וסקולאריים (כמו VCAM-1). בו זמנית resistin גורם ל-down-regulation של ביטוי TRAF-3 או TNF-receptor factor-3, שהוא מעכב של איתותים דרך TNF-receptor superfamily member 5 או CD40 (עפ"י Verma וחב' ב-Circulation משנת 2003). בנוסף, נמצא ש-resistin משרה בתאי אנדותל יצירה של pentraxin-3, מתווך דלקת הקשור לטרשת עורקים (עפ"י Kawanami וחב' משנת 2004 ב-Biochem Biophys Res Commun). | + | ציטוקינים הם כידוע מולקולות המשגרות איתות לתאים והן משרות בין השאר תהליכי דלקת. ציטוקינים נקשרים לקולטנים ספציפיים שלהם על פני תאים, דרכם הם שולחים את מסריהם לתוך התא באופן שמשנה את תפקודי התא. הודגם ש-resistin מעודד שפעול של תאי אנדותל, על ידי הפרשה של אנדותלין-1, ושדרוג של מולקולות הנספחות לתאים וסקולאריים (כמו VCAM-1). בו זמנית resistin גורם ל-down-regulation של ביטוי TRAF-3 או TNF-receptor factor-3, שהוא מעכב של איתותים דרך TNF-receptor superfamily member 5 או CD40 (עפ"י Verma וחב' ב-Circulation משנת 2003). בנוסף, נמצא ש-resistin משרה בתאי אנדותל יצירה של [[pentraxin-3]], מתווך דלקת הקשור לטרשת עורקים (עפ"י Kawanami וחב' משנת 2004 ב-Biochem Biophys Res Commun). |
בשנת 2010 הראו Zhang וחב' ב-Arthritis Rheum ש-resistin עצמו יכול להשרות יצירת ציטוקינים וכימוקינים בתאי כונדרוציטים ארטיקולאריים באדם. נמצא ש-resistin משרה ביטוי של mRNA של 20 ציטוקינים וכימוקינים שנסרקו, הן בכונדרוציטים נורמאליים של אדם, כמו גם בכונדרוציטים מאזורים של סחוס אוסטיאו-ארטריטי. ציטוקינים אלה כוללים CCL2 ,CCL3 ,CCL4 ,CCL8 ,CXCL1 ,CXCL2 ,CXCL3 ,TNF-α ,IL-1α ו- IL-1β. בירור של המנגנונים הפוטנציאלים דרכם resistin משרה up-regulation של ציטוקינים וכימוקינים בכונדרוציטים, כורך את גורמי השיעתוק הגרעיניים NFκB ו-C/EBPβ. | בשנת 2010 הראו Zhang וחב' ב-Arthritis Rheum ש-resistin עצמו יכול להשרות יצירת ציטוקינים וכימוקינים בתאי כונדרוציטים ארטיקולאריים באדם. נמצא ש-resistin משרה ביטוי של mRNA של 20 ציטוקינים וכימוקינים שנסרקו, הן בכונדרוציטים נורמאליים של אדם, כמו גם בכונדרוציטים מאזורים של סחוס אוסטיאו-ארטריטי. ציטוקינים אלה כוללים CCL2 ,CCL3 ,CCL4 ,CCL8 ,CXCL1 ,CXCL2 ,CXCL3 ,TNF-α ,IL-1α ו- IL-1β. בירור של המנגנונים הפוטנציאלים דרכם resistin משרה up-regulation של ציטוקינים וכימוקינים בכונדרוציטים, כורך את גורמי השיעתוק הגרעיניים NFκB ו-C/EBPβ. | ||
| − | עיכוב של NFκB ושל MAPKs הביא לחסימת הביטוי המושרה על ידי resistin של IL-6 ,TNF-α, ו-IL-1β, הן ברמת mRNA כמו גם ברמת החלבון של שלושת הציטוקינים הללו. לעומת זאת, העיכוב של PI3K הגביר את השפעת resistin המוליכה לביטוי מוגדל של הציטוקינים IL-6 ו-IL-1β, כיוון ש-PI3K פועל כרגולטור שלילי של השפעות דלקתיות שמושרות דרך TLR4 ו-TLR2 (שני החלבונים הציטופלזמיים הקשורים למעבר איתותים תוך תאיים) עפ"י Williams וחב' ב-Shock משנת 2006. ממצאים אלה מצביעים שאיתותים תוך-תאיים קדם-דלקתיים ש-resistin משרה, עוברים דרך מנגנוני איתות בהשתתפות NFκB ו-MAPK כל זאת לאחר קישור resistin לקולטני TLR4. | + | עיכוב של NFκB ושל MAPKs הביא לחסימת הביטוי המושרה על ידי resistin של IL-6 ,TNF-α, ו-IL-1β, הן ברמת mRNA כמו גם ברמת החלבון של שלושת הציטוקינים הללו. לעומת זאת, העיכוב של PI3K הגביר את השפעת resistin המוליכה לביטוי מוגדל של הציטוקינים IL-6 ו-IL-1β, כיוון ש-PI3K פועל כרגולטור שלילי של השפעות דלקתיות שמושרות דרך TLR4 ו-TLR2 (שני החלבונים הציטופלזמיים הקשורים למעבר איתותים תוך תאיים) עפ"י Williams וחב' ב-Shock משנת 2006. ממצאים אלה מצביעים שאיתותים תוך-תאיים קדם-דלקתיים ש-resistin משרה, עוברים דרך מנגנוני איתות בהשתתפות NFκB ו-MAPK כל זאת לאחר קישור resistin לקולטני TLR4. |
===Resistin ופקקת=== | ===Resistin ופקקת=== | ||
גרסה אחרונה מ־08:27, 4 במאי 2019
| מדריך בדיקות מעבדה | |
| רזיסטין | |
|---|---|
| Resistin | |
| שמות אחרים | רזיסטין מכונה גם ADSF או Adipose tissue-specific secretory factor, וכן C/EBP-ε-regulated myeloid-specific secreted cysteine-rich protein (XCP1). |
| מעבדה | אנדוקרינולוגיה בדם וברוק |
| תחום | הערכה של סוכרת type 2, ושל מדדים וסקולאריים |
| טווח ערכים תקין | בנסיוב - 4.7-6.0 ננוגרם/מ"ל; ברוק - 1.2-1.7 ננוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
בסיס פיזיולוגי
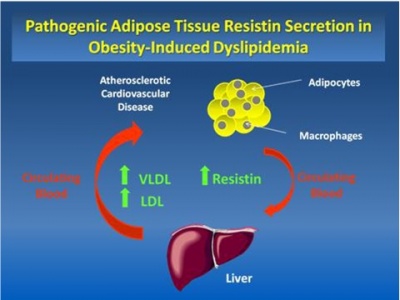
הרקמה השומנית (adipose tissue) ידועה כרקמה המייצרת ומפרישה מגוון רחב של פקטורים, הידועים כאדיפוקינים. בתנאים פיזיולוגיים נורמאליים, אדיפוקינים משחקים תפקיד בוויסות מאזן האנרגיה בגוף, באגירה של טריגליצרידים ובגיוס וניוד של שומן במצבי השמנה בעיקר לחגורת הבטן, או מה שמכונה central adiposity. ניתן אם כן להתייחס לרקמת השומן כאל רקמה אנדוקרינית ופאראקרינית. שנים אחדות חלפו מאז התחוור הקשר בין השמנת-יתר לבין התפתחות סוכרת type 2, מפגע מטבולי בו היווצרות עמידות לאינסולין היא אחד המנגנונים המוצעים להתפתחות המחלה, שפירושה ירידה ביכולת תאים להגיב לפעולת אינסולין בקליטת סוכר לתוכם. קשר מנגנוני זה, התברר כאשר נמצא שתכשירים חדשים לטיפול בסוכרת type 2 ממשפחת ה-thiazolidinediones (להלן TSDs), שפעילותם מפחיתה את העמידות לאינסולין, פועלים דרך הקולטנים ל-PPARγ השכיחים בעיקר על פני תאי שומן.
שני נתונים אחרונים אלה, הולידו את ההשערה שדווקא תאי שומן מגרים ויוזמים את הופעת העמידות לאינסולין שנגרמת בתאים רבים ברחבי הגוף. היה זה Mitchell Lazar מנהל מרכז הסוכרת באוניברסיטת פנסילבניה בפילדלפיה, שזיהה לראשונה חלבון המופרש על ידי אדיפוציטים, במאמר קלאסי משנת 2001 ב-Nature, חלבון שתכונותיו ההורמונאליות מקשרות לכאורה בין השמנת-יתר לסוכרת type 2. למרות שחלבון זה התגלה במקור בעכברים, הוא זוהה עד מהרה באדם ובבעלי חיים נוספים. Lazar יצא מהנחה ש-TSDs פועלים דרך קולטני PPARγ להשפיע על גן ספציפי בתאי השומן הקשור למנגנון האיתות של אינסולין. הוא השתמש בתרבית בשורת תאי עכבר הידועה כ-3T3-L1, ששמשה רבות בתרבית כמודל של תאי אדיפוציטים "לבנים". בקצרה, כאשר תאים אלה טופלו עם rosiglitazone (תכשיר ממשפחת ה-TSDs), זוהה בהם mRNA של חלבון חדש שבא לביטוי רק באדיפוציטים, ואשר יצירתו דוכאה על ידי TSDs. לעומת זאת, כאשר הזינו עכברים במזון עתיר-שומן, היה ייצור משמעותי של חלבון חדש זה בעכברים שמנים.
יתרה מכך, כאשר עכברים שמנים אלה טופלו ב-TSDs פחתה משמעותית כמות החלבון הזה שהופרשה מתאי שומן לדם, ושמו נקבע כ-resistin, כיוון שרמות גבוהות שלו נמצאו בדמם של עכברים סוכרתיים, בהם התפתחה עמידות (resistance) לאינסולין. יתרה מזאת, הוכחה ישירה לקשר בין resistin לבין עמידות לאינסולין ניתנה כאשר עמידות זו התפתחה בעכברים שהוזרקו ישירות עם חלבון זה. בהמשך נמצא שרמות resistin נמצאו מוגברות בנסיוב של עכברים, חולדות ובני-אדם שמנים.
באותו מחקר מכונן שהתפרסם ב-Nature, בחנו Lazar וחב' את השאלה האם אמנם הרמות המוגברות של resistin שהופיעו העכברים שהולעטו בדיאטה משמינה, קשורים להתפתחות סוכרת type 2. לצורך זה, הזריקו נוגדנים מסוג IgG כנגד resistin לעכברים בהם התגלתה עמידות לאינסולין ורמה מוגברת מאוד של גלוקוזה (163 מיליגרם לד"ל, בממוצע), ובדקו את השפעת הנוגדנים הללו שהיו אמורים לנטרל את השפעת reistin.
ראשית הראו אמנם שהזרקה של IgG לא ספציפי, לא השפיעה כלל על רמה גלוקוזה בדמם של העכברים. לעומת זאת, הזרקת העכברים עם IgG-אנטי resistin, הביאה לירידה משמעותית ברמת גלוקוזה עד לרמה של 137 מיליגרם לד"ל, וכאשר הפסיקו את ההזרקות של נוגדן זה, שבו ועלו רמות גלוקוזה בדם לרמתן טרם התחלת הטיפול בנוגדן ל-resitin, כלומר הטיפול לניטרול resistin הפחית באופן הפיך היפר-גליקמיה במודל עכברים זה, בהם הושרתה עמידות לאינסולין. במבחני insulin tolerance שנערכו לעכברים אלה, נמצא שעכברים שהוזרקו עם נוגדן כנגד resistin שופרה משמעותית התגובה לאינסולין, בהשוואה לעכברים מאותה קבוצה שהוזרקו עם IgG ניטרלי. ניסויי חיה אלה הדגימו ש-resistin עשוי להיות קשור בהשראת עמידות לאינסולין כתוצאה מהשמנת יתר.
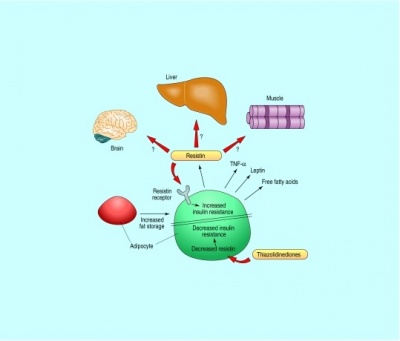
(לקוח מ-Berger, ב-BMJ משנת 2001).
תכונות ביוכימיות של resistin
החלבון resistin (או resistance to insulin) נקרא כך על ידי Steppan וחב' ב-Nature משנת 2001, בשל יכולתו להפריע לפעילות אינסולין, ובאותו זמן הוצע כחוליה המקשרת בין השמנת-יתר וסוכרת, שכן resistin נמצא בצירקולציה בריכוזים מוגברים במודלים של עכבר עם השמנת יתר וסוכרת, ורמות אלה פחתו בטיפול עם thiazolidenedione. בהמשך, מספר מחקרים במכרסמים הציעו שיעד הפעילות העיקרי של resistin הוא הכבד, בו נגרמת עמידות ל-resistin (עפ"י Rajala וחב' ב-J Clin Invest משנת 2003, וכן Muse וחב' ב- J Clin Invest משנת 2004 ו-Banerjee וחב' ב-Science משנת 2004). מחקרים אלה הראו שבעכברים טרנסגניים שאינם מבטאים resistin, רמות גלוקוזה בדם נמוכות, כתוצאה מירידה בגלוקונאוגנזה בכבד. מחקרים אחרים בחולדות מצאו השפעה פחותה של resistin על רקמת שריר או רקמת שומן (עפ"י Pravence וחב' ב-J Biol Chem משנת 2003).
המקור העיקרי של resistin בעכבר היא רקמת השומן "הלבנה", ו-resistin מעכבר הוא פוליפפטיד במשקל מולקולארי של 11 אלף דלטון, כאשר הגן המקודד לו ממוקם בכרומוזום 8. החלבון מסונתז כקודמן עם 114 חומצות אמינו, עם מקטע signal של 20 חומצות אמינו, ו-94 חומצות אמינו במקטע "הבשל", והוא מכיל 5 קשרים די-סולפידיים פנימיים. Resistin עצמו יכול ליצור על ידי קשרים די-סולפידיים או על ידי קשרים אחרים, הומודימרים ורב-דימרים (Banerjee ו-Lazar ב-J Biol Chem משנת 2001 ו-Chen וחב' ב-J Endocrinol משנת 2002). בין עכברים וחולדות קיימת הומולוגיה של 72% ברצף חומצות האמינו של המקטע בן 94 חומצות האמינו (Del Arco וחב' ב-FEBS lett משנת 2003).
מתנהל ויכוח באשר לתפקיד של resistin בעכבר ובאדם. ה-resistin באדם משקלו המולקולארי 12,500 דלטון, כאשר המקטע הבשל שלו מכיל 108 חומצות אמינו. בניגוד לעכבר, הגן המקודד ל-resistin באדם ממוקם בכרומוזום 19, וקיימת רק הומולוגיה של 55% בין המקטעים הבשלים של resistin באדם ובעכבר, מה שמעיד על מנגנוני רגולציה שונים, פיזור רקמתי וכנראה גם תפקוד שונה (עפ"י Ghosh וחב' ב-Gene משנת 2003 ו- Yangוחב' משנת 2003 ב-Biochem Biophys Res Commun). כיוון שיש ל-resistin נטייה ליצור אוליגומרים, ניתן למצוא בנסיוב אדם מספר איזופורמים בעלי משקלים מולקולאריים שונים (Gerber וחב' ב-J Clin Endocrinol Metabol משנת 2005). באופן נורמאלי, רמות resistin בנסיוב אדם נמוכות מ-10 ננוגרם/מ"ל.
באדם, resistin מיוצר בעיקר על ידי אוכלוסיות תאים שונות מאדיפוציטים, הכוללות תאי דם מונונוקלאריים היקפיים (PBMCs), מקרופאגים ותאי מח עצם (Fain וחב' ו-Patel וחב ב-2 מאמרים שהופיעו ב-Biochem Biophys Res Commun משנת 2003). מספר מחקרים הראו שאמנם אדיפוציטים בשלים באדם אינם מבטאים resistin, אך קדם-אדיפוציטים יכולים לבטא resistin (עפ"י Janke וחב' ב-Obes Res משנת 2002). יחד עם זאת Degawa-Yamauchi וחב' ב-J Clin Endocrinol Metabol משנת 2003 כן מדווחים על ייצור resistin על ידי אדיפוציטים בוגרים באדם, וייתכן שהבדלי הגרסאות נובעים מהעיתוי של הפרשת חלבון זה, והפער בזמן בין ביטוי mRNA להפרשת החלבון (McTernan וחב' ב-J Clin Endocrinol Metabol משנת 2003. האפשרות של ייצור resistin על ידי אדיפוציטים באדם, מקבלת סימוכין מכך שבאנשים עם עודף משקל רמות חלבון זה בנסיוב מוגברות משמעותית (Gerber וחב' ב-J Clin Endocrinol Metabol משנת 2005).
בניסויים קליניים נמצא שיש ל-resistin ערך ניבויי למחלת עורקים כליליים ותמותה מאירועים קרדיו-וסקולאריים. יתרה מכך, נמצא שיש ל-resistin השפעה על angiogenesis, פקקת, תנועה ושגשוג של תאי שריר חלק בדופן כלי הדם שעלולים לתרום לתהליכי טרשת עורקים כפי שיפורט בהמשך.
הקשר בין resistin רגישות לאינסולין, סוכרת והתסמונת המטבולית
כאשר דווח לראשונה על גילוי resistin בשנת 2001, נמסר על כך שרמות חלבון זה מוגברות בעכברים שפוטמו על ידי דיאטה או שהיו שייכים לזנים גנטיים עם עודף משקל. ממצא אחר מאותה תקופה היה שהזרקת נוגדנים כנגד resistin הגדילה את הרגישות לאינסולין בחיות שמנות או בכאלו שפיתחו עמידות לאינסולין. כן נמצא שטיפול של עכברים בריאים עם resistin ריקומביננטי, שיבש בהם את התגובה לגלוקוזה, ואת פעילות אינסולין, וכן שהזרקת resistin הפריעה לקליטת גלוקוזה על ידי אדיפוציטים המושרית על ידי אינסולין. כל הממצאים הללו הביאו למסקנה ש-resistin משחק תפקיד חשוב בגרימת עמידות לאינסולין, ומכאן להשמנת-יתר ולסוכרת במודלים של חיות.
יישום מידע זה למחקרים בבני-אדם היה קשה, בגלל הבדלים מובנים בין האדם למכרסמים בהם התבצעו רוב הניסויים בחיות. לדוגמה, בעכברים resistin מופרש בעיקר מרקמה השומן הלבנה, ואילו באדם הוא מופרש בעיקר ממונוציטים בצירקולציה, כאשר רק כמויות קטנות שלו מופרשות מרקמת השומן הלבנה (Savage וחב' ב-Diabetes משנת 2001). כמו כן, הזהות במבנה של resistin מעכבר ואדם היא רק של 55%, מה שמקשה על השוואה של פעילות חלבון זה בחיות מודל ובאדם. לפיכך, עדיין שנויה במחלוקת על התפקיד הפתוגני של resistin בהתפתחות עמידות לאינסולין והשמנת-יתר באדם.
מספר מחקרים תומכים במתאם חיובי בין השמנת-יתר, עמידות לאינסולין ורמות מוגברות של resistin באדם. Sheng וחב' במחקר ב-Endocrine משנת 2008, הדגימו את הביטוי של resistin בהפאטוציטים של אדם ואת העובדה שהוא משרה עמידות לאינסולין. כמו כן, נמצא ש-RNA של resistin ניתן לגילוי בקלות ב-PBMCs באדם, וכן שהוא היה ברמה גבוהה בנשים עם סוכרת type 2 בהשוואה לנשים בריאות (עפ"י Tsiotra וחב' ב-Mediators Inflamm משנת 2008). בדומה, בחקירת ההבדלים ברמות resistin בנסיוב אדם, השמנת-יתר ועמידות לאינסולין בקרב 125 מטופלים עם סוכרת type 2, נקבע שרמות resistin בנסיוב, היו גבוהות יותר במטופלים סוכרתיים עם BMI שלמעלה מ-30 ק"ג/מ' בריבוע, בהשוואה לאלה עם השמנת-יתר ללא סוכרת, אם כי קשר זה לא היה משמעותי סטטיסטית בין חולי סוכרת לבין קבוצת ביקורת עם משקל תקין או עם משקל עודף ( Gharibeh וחב' ב-Diabetes Metab משנת 2010).
ממצאים אלה מעידים על ש-resistin משחק תפקיד בפתוגנזה של השמנת-יתר ועמידות לאינסולין באדם, התורמות להופעת אינסולין type 2. הריכוזים הממוצעים של resistin בנשים עם סוכרת הריון (21.9 ננוגרם/מ"ל), נמצאו גבוהים יחסית לאלה בנשים הרות ללא סוכרת (19.03 ננוגרם/מ"ל) או בנשים לא הרות (14.8 נוגרם/מ"ל) באופן משמעותי (p<0.001). העלייה ברמת resistin הנצפית בנסיוב של נשים עם סוכרת הריון, נכרכה ברמות IL-6, אך לא עם אלה של אינסולין, מה שמרמז שהשינויים ברגישות לאינסולין בסוכרת הריון, עשויים לנבוע מתהליכי דלקת בהם מעורב resistin {עפ"י Kuzmicki וחב' ב-Gynecol Endocrinol משנת 2009).
יתרה מזאת, Tuttolomondo וחב' במאמר ב-Cardivasc Diabetol משנת 2010, הראו שרמות resistin ו-IL-6 באלה עם סוכרת type 2 עם "כף-רגל סוכרתית" וכיבים אופייניים, היו גבוהות יותר מאשר בחולים עם סוג סוכרת זה ללא כיבים בכפות הרגליים, מה שקושר גם כן את resisin, סוכרת type 2 ודלקת. יחד עם זאת, קיימות סתירות בממצאים באשר ליחסי הגומלין בין resistin והשמנת-יתר ו/או סוכרת. במספר מודלים במכרסמים, הודגם שהביטוי של mRNA של resistin ברקמה השומנית של חיות שמנות לא תאם את רמות חלבון זה בנסיוב, ואילו רמות resistin בנסיוב לא תאמו את רמות אינסולין או גלוקוזה (עפ"י Lee וחב' ב-Am J Physiol Endocrinol Metab משנת 2005).
במחקרים אחרים, נמצא למעשה שהביטוי של resistin ברמת השומן נמצא מדוכא בחיות שמנות (Le Lay וחב' ב-Biochem Biophys Res Commun משנת 2001ו-Milan וחב' ב-Obes Res משנת 2002). במחקרים באדם, רמות resistin בצירקולציה נמצאו אמנם מוגברות אך גם בתלות במצבי השמנת יתר או עמידות לאינסולין בדיווחים של Lee וחב' ב- J Clin Endocrinol Metabol משנת 2003, וכן Hasegawa וחב' ב-Acta Diabetol משנת 2005, ו-Iqbal וחב' ב-Eur Rev Med Pharmacol Sci משנת 2005. מחקר של Laudes וחב' משנת 2010 ב-Hormon Metab Res מצא שביטוי resistin עלה באופן משמעותי באנשים שמנים בהשוואה לבעלי משקל תקין, אך ללא כל קשר לסוכרת type 2. נראה מהמסקנות הסותרות במחקרים האמורים שיידרשו מחקרים נוספים להבנת המעורבות או אי המעורבות של resistin בפתוגנזה של עמידות לאינסולין המושרה על ידי השמנת יתר ומכן לפתוגנזה של סוכרת type 2.
למרות שבמקור הוצע ש-resistin הוא גורם התורם להתפתחות עמידות לאינסולין וסוכרת באדם, מתמשך הפולמוס בדבר תפקידו המדויק בהשמנת-יתר, ברגישות לאינסולין ובהתפתחות של סוכרת type 2. במרוצת השנים נכרך resistin גם בהתפתחות טרשת עורקים ומחלות קרדיו-וסקולאריות, בהתפתחות כבד שומני לא-אלכוהולי, מחלות ראומטיות, ממאירות, אסתמה, מחלות מעי דלקתיות ומחלת כליות כרונית (עפ"י Filkova וחב' ב-Clin Immunol משנת 2009 ו-Gnacinska וחב' ב-Adv Med Sci משנת 2009). בתור שכזה, נראה ש-resistin קשור למודולציה של מסלולים מולקולאריים הרלוונטיים למחלות מטבוליות, דלקתיות ואוטו-אימוניות, בנוסף להשפעתו על יעדים קרדיו-וסקולאריים, בעיקר בכך שהוא משבש את תפקוד האנדותל.
Resistin כסמן דלקת של טרשת עורקים באדם
ההתייחסות לטרשת עורקים (atherosclerosis) כאל תרחיש הקשור לתהליכי דלקת, הביאה לבחינה של מדדים המשלבים איתותים מטבוליים ודלקתיים, כמועמדים אטרקטיביים למחלה קרדיו-וסקולארית. רזיסטין כאמור משתייך למשפחה של חלבונים עתירי-ציסטאין הידועה כ-FIZZ או found in inflammatory zones. באדם בניגוד למכרסמים, רזיסטין בא לביטוי בראש ובראשונה במקרופאגים ובתאי דלקת תוך השפעה של משפעלים של PPAR (עפ"י Patel וחב' משנת 2003 ב-Biocem Biophys Res Commun), והביטוי של m-RNA של רזיסטין, מוגבר על ידי ציטוקינים מקדמי-דלקת (עפ"י Patel וחב' באותו כתב עת ובאותה שנה), וביטוי רזיסטין במונוציטים גדל כן על ידי LPS (עפ"י Lu וחב' ב-FEBS lett משנת 2002).
רזיסטין רקומביננטי מגביר את הביטוי של ציטוקינים ושל מולקולות ספיחה בתאי אנדותל באדם (עפ"י Verma וחב' ב-Circulation משנת 2003 ו-Kawanami וחב' ב-Biochem Biophys Res Commun משנת 2004), מה שמרמז לתפקיד אפשרי של רזיסטין בטרשת עורקים. Reilly וחב' במאמרם ב-Ciculation משנת 2005, ניסו לבחון האם רמות רזיסטין בפלזמה היו קשורות לסמני דלקת, או לתהליך של CAC או coronary artery calcification שהוא מדד לתהליכי טרשת עורקית. הניסוי הידוע כ-SIRCA או Study of Inherited Risk of Coronary Atherosclerosis, בו נכללו 879 מטופלים תסמיניים לא סוכרתיים. כמו נעשתה השוואה בין רמות רזיסטין עם סמני דלקת במדגם של 215 חולי סוכרת type 2, וכן בקבוצת ביקרות של פרטים צעירים ובריאים.
ממצאי ניסוי זה הראו שרמות רזיסטין היו במתאם חיובי עם רמות סמני דלקת, כולל soluble TNF-α receptor-2 במובהקות גבוהה (p<0.001), כמו גם IL-6 במובהקות בינונית (p=0.04), ו-lipoprotein-associated A2 עם מובהקות משמעותית (p=0.002). רמות רזיסטין היו קשורות גם כן עם CAC מוגבר לאחר התאמה לגיל, מין, ולגורמי-סיכון מוכרים (OR=1.23, ו-p=0.03).
הקשר בין resistin ומחלות קרדיו-וסקולאריות
מתרבות הראיות לכך שמחלות קרדיו-וסקולאריות מלוות על ידי שינויים ברמת resistin בנסיוב. לדוגמה, Wang וחב' ב-Chin Med Sci J משנת 2009 מתארים ניסוי בו השתתפו 220 מטופלים עם כאבים בחזה, ונמצא שבאלה מתוכם עם תסמונת כלילית חדה (ACS), רמות resistin בנסיוב (1.18±0.48נוגרם/מ"ל) היו גבוהות משמעותית מרמות חלבון זה במטופלים עם תעוקת חזה יציבה (0.49±0.40 ננוגרם/מ"ל) או במטופלים בריאים (0.66±0.40 ננוגרם/מ"ל), (p<0.01). בקבוצת אלה עם תסמונת כלילית חדה, הרמות המוגברות של resistin בנסיוב היו כרוכות באופן משמעותי עם הרמות של C-reactive protein, כמו גם עם ספירת הכדוריות הלבנות. כמו כן הייתה התאמה בין רמת resistin ומספר כלי הדם הכליליים עם היצרות של למעלה מ-50%. כללית על פי Wang וחב', רמות resistin בנסיוב נחשבות כגורם סיכון משמעותי של תסמונת כלילית חדה.
מחקר דומה של Hu וחב' ב-Chin Med J משנת 2007, הראה עלייה משמעותית ברמות resistin בפלזמה במטופלים עם תעוקת חזה בלתי-יציבה, כאשר הן מושוות לאלה במטופלים עם תעוקת חזה יציבה או באנשים בריאים. גם במחקר זה רמת resistin בפלזמה נמצאה במתאם חיובי עם עם מדדים לדלקת כמו CRP, ספירת לויקוציטים ורמת אנדותלין-1 בדם. בהתאם, מחקר שכלל 39 מטופלים עם תסמונת כלילית חדה, מצא שרמות resistin בפלזמה היו מוגברות באופן בולט 24 שעות אחר תחילת התסמינים, בהשוואה עם קבוצת ביקורת. רמות מוגברות אלה נמשכו שבוע ימים, ורמתם הייתה גבוהה יותר באלה עם תסמינים חמורים יותר (עפ"י Chu וחב' משנת 2008 ב-Circ J).
Resistin ומקרופאגים
שלב חיוני ביצירה של טרשת עורקים דלקתית כרונית, הוא שלב הנדידה של מונוציטים מהצירקולציה לתוך אזורים שמתחת לשכבת האנדותליום, שם הם מתמיינים למקרופאגים. בשלב זה המקרופאגים קולטים ליפופרוטאינים (apo-B) אתֶרוֹגניים עתירי-כולסטרול (LDL, וכן IDL ו-VLDL), ליצירת תאי קצף (foam cells) עפ"י Glass ו-Witztum ב-Cell משנת 2001. באדם, resistin בא לביטוי בעיקר במונוציטים/מקרופאגים (Savage וחב' ב-Diabetesמשנת 2001).
כמו שכבר הוזכר, רמות resistin מוגברות בתסמונת כלילית חדה, ועלתה השערה שהאיתות הנגרם מכך הוא כתוצאה מ-resistin המופרש מה-plaques הטרשתיים. הפרשה זו של resistin משפיעה על תפקוד האנדותל ועל נדידת תאי שריר חלק (VSMCs) בדופן כלי הדם להגברת תהליך האתרוגנזה. במקביל, נמצא ש-resistin מגביר את קליטת LDL המחומצן על ידי מקרופאגים, ומסייע בכך ליצירת תאי קצף (Lee וחב' ב-Life Sci משנת 2009 ו-Xu וחב' ב-Biochem Biophys Res Commun משנת 2006). המנגנון האחרון קשור לפעילות resistin המעלה את הביטוי על פני מקרופאגים של SR-A או scavenger receptor A ושל CD36 השייך לקבוצת scavenger receptor B, שהם קולטנים דרכם קולטים מקרופאגים את הכולסטרל המחומצן. לעומת זאת, resistin מביא להפחתה בחלבון האחראי להפרשת כולסטרול ממקרופאגים, הידוע כ-ATP-binding cassette transporter 1.
שינוי פנוטיפי המושרה על ידי resistin של מקרופאגים לתאי קצף הודגם בהקשרים שונים, על ידי שחלבון זה משפיע ישירות על המטבוליזם של חומצות שומן על ידי הגברת האסטריפיקציה של כולסטרול לליפידים, ועל ידי כך להגברת הזמינות בתוך המקרופאגים באדם של חומצות שומן שלא עברו אסטריפיקציה (Rae וחב' ב-FEBS lett משנת 2007). לאור ההבדלים בין מקורות יצירת resistin בעכבר ובאדם (רקמה שומנית לעומת מקרופאגים), Quatanani וחב' תארו ב-J Clin Invest משנת 2009, מודל של עכברים טרנסגניים שיוצרו, כאלה המייצרים resistin ספציפי לאדם שמקורו במקרופאגים, ואינם יודעים לייצר resistin מרקמת שומן. נמצא שכאשר האכילו עכברים אלה בדיאטה עתירת-שומן, הם הפגינו עמידות לאינסולין, מלווה בתהליכי דלקת ברקמת השומן הלבנה, בליפוליזה מוגברת, ובהגברת רמת חומצות שומן חופשיות בנסיוב.
הקשר של resistin לתפקוד האנדותליאלי
תאים אנדותליאלים מפרישים חומרים וָאזוֹ-אקטיביים או חומרים טרופיים כגון prostacyclin, חד תחמוצת החנקן (NO), אנגיוטנסין-II ואנדותלין-1. חומרים אלה חיוניים לשגשוג התאים הוסקולאריים ולפעילות הואזו-מוטורית, תפקוד טסיות הדם, קרישתיות, ותגובות חיסוניות ודלקתיות (עפ"י Libby ב-Circulation משנת 2001). תאי אנדותל קשורים דרך מבנים הידועים כ-endothelial cell junctions המאפשרים תפקוד שכבת האנדותל כשכבה חסימתית המבקרת מעבר פנימה והחוצה של מולקולות במערכת הוסקולארית. פגיעה בתפקוד שכבת האנדותל כתוצאה משבירת הקשר בין תאי האנדותל, מעודדת טרשת עורקים כתוצאה מחדירות מוגברת של מולקולות שונות דרך שכבת האנדותל, ספיחה מוגברת של לויקוציטים, מונוציטים ומקרופאגים, והצטברות בחלל שמתחת לאנדותל של ליפופרוטאיים נושאי-כולסטרול (Widlansky וחב' ב-J Am Coll Cardiol משנת 2003 ו-Endemann ו-Schiffrin ב-J Am Soc Nephrol משנת 2004).
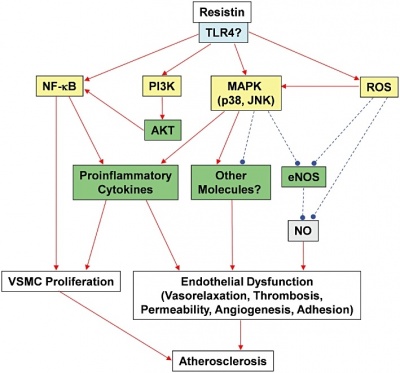
במחקר משנת 2010 של Chen וחב' ב-Am J Physiol Heart Circ Physiol, נבחנה השאלה האם resistin פוגע בפעילות האנדותל על ידי השפעתו על מערכת NOS או nitric oxide oxidase בתאי אנדותל של העורקים הכליליים באדם. אנזים זה נבחר למחקר בשל תפקידיו המרכזיים בפיקוח על ה-tone הוסקולארי ועל תהליך ה-neovascularization (עפ"י Murohara וחב' ב-J Clin Invest משנת 1998). במחקר האמור של Chen וחב', ריכוזים רלוונטיים מבחינה קלינית של resistin, הפחיתו משמעותית את רמת mRNA של האנזים NOS, כמו גם את רמת האנזים ואת דרגת פעילותו, וממילא את רמת NO. כמו כן נמצא שהרמה התאית של מולקולות פעילות מחמצנות (ROS) כולל superoxide anion, עלו משמעותית בתאי האנדותל של העורקים הכליליים המטופלים על ידי resistin, בה בשעה שהפעילות של האנזים SOD או superoxide dismutase האמור לפרק תרכבות ROS, ירדה משמעותית, זאת בהשוואה לתאים לא מטופלים ב-resistin.
יתרה מכך, נמצא במחקר של Chen וחב' שריכוזי resistin עלו באזורים עתירי טרשת של אבי העורקים או של העורקים התרדמניים באדם. במחקר על המנגנון האפשרי של פעילות resistin, נמצא שחלבון זה משפעל את 38 MAPK או mitogen-activated protein kinases P38, שהיא קבוצת קינאזות המשופעלות על ידי מיטוגנים לצורך זרחון של חלבונים תוך-תאיים. קינאזות אלו מגיבות לגירויי עקה, כגון ציטוקינים, קרינת UV, הלם אוסמוטי או heat shock, ומעורבים בהתמיינות תאים, באפופטוזיס, ובעיכול עצמי של התא (autophagy). כמו כן נמצא ש-resistin משפעל את JNK או c-Jun N terminal kinase. החדרת מעכב ספציפי של p38, חסמה באופן יעיל את יצירת ROS המושרית על ידי resistin , ואת הפחתת הייצור של האנזים NOS.
כמו כן נלמדה השפעת resistin על תאי אנדותל מאבי העורקים של חזיר בתרבית, על ידי Kougias וחב' ב- J Vasc Surg משנת 2005. בדומה למה שתואר עם תאי אנדותל מאבי העורקים באדם שטופלו עם resistin, רמות mRNA של NOS פחתו בתלות בכמות resistin שהוספה. תוצאות אלה מצביעות על ש-resistin אמנם מפחית ביטוי NOS, ומשמש כמתווך הנתמך בחמצון של הפרעה לפעילות האנדותליאלית. Chen וחב' קבעו גם ש-resistin יכול להשפיע על תפקוד ואזו-מוטורי של העורקים הכליליים. והרחבת כלי-דם על ידי תאי האנדותל המפרישים NO בתגובה ל-bradykinin, פחתה משמעותית בטבעות עורקיות המטופלות עם resistin. הרחבת כלי דם מפעילות האנדותל בתגובה ל-sodium nitroprusside, גם כן פחתה לאחר טיפול ב-resistin במינון של 40 ננוגרם/מ"ל. נתונים אלה מהווים עדות לכך ש-resistin מפחית אל כושר הרחבת כלי הדם עי ידי שכבת האנדותל, זאת על ידי הגברת הייצור של superoxides.
השפעת resistin על התפקוד הואזו-מוטורי הכלילי, נלמדה in-vivo ו-in-vitro על ידי Dick וחב' (ב-Am J Physiol Heart Circ Physiol משנת 2006). ניסויים בוצעו לבחון את השפעות resistin על יצירת האניון superoxide בעורקים כליליים ועל התפקוד הואזו-מוטורי בתגובה למרפים (relaxants) אנדותליאליים בכלבים מורדמים, או בטבעות כליליות מבודדות. ניסויים אלה הראו שהחדרת resistin לתוך העורק הכלילי, לא שינתה את זרימת הדם בו, לא שינתה את הלחץ העורקי הממוצע, ואף לא שינתה את קצב הלב ואף לא את הרפיית טבעות עורקים כליליים המושרית על ידי אצטילכולין. יחד עם זאת, resistin כן שיבש את הרפיית הטבעות הכליליות המושרית in vitro על ידי bradykinin, כן החלישה את הרפיית עורקים אלה in vivo שמשרה bradykinin.
כדי לקבוע האם פעילות resistin בהחלשת ההשפעה מרחיבת העורקים של bradykinin מקורה ביצירת אניון superoxide או כתוצאה מיצירה מוחלשת של חומרים מרחיבי עורקים כמו NO או פרוסטגלנדין-12, נבחנה השפעת ההוספה של מעכבים ספציפיים. בין השאר נוסו tempol שהוא חומר המדמה את פעילות האנזים SOD, וכן L-NAME אוNG-nitro-L-arginine methyl ester (מעכב של NOS) ו-indomethacin (מעכב של פרוסטגלנדין-12). התברר שההחלשה של פעילותו מרחיבת כלי הדם של bradykinin על ידי resistin, נותרה בעינה בנוכחות כל אחד משלושת המעכבים הלו. לכן, המסקנה היא שהשפעתו המעכבת של resistin מתרחשת דרך הקולטן של bradykinin או דרך מסלולי האיתות של NOS ושל האנזים cyclooxygenase.
יחד עם זאת קיימת סתירה בין תוצאות מחקרי Kougias עם עורקים כליליים של חזירים, לבין תוצאות הניסוי של Dick בכלבים, באשר למעורבות או לאי-מעורבות של יצירת superoxide, כל זאת בהקשר של השפעת resistin במערכת זו. קיימים הבדלים בין מינים שונים (כלבים וחזירים) הן בממדי העורקים הכליליים, וכל אלה רק מדגישים עד כמה לא ברורה עדיין השפעתו של resistin על תפקוד האנדותל באדם.
מחקר של Gentile וחב' ב-Diabetes משנת 2008, על השפעות resistin על התפקוד הוסקולארי ועל השפעת אינסולין על הרפיית כלי-דם, מצא שהחדרת resistin לעכברים צעירים מזן C57BL/6 או הוספת חלבון זה לתאי אנדותל של עכברים בתרבית, מנעה משמעותית את הרחבת כלי הדם המושגת על ידי אינסולין על ידי הפחתת פעילות האנזים NOS. אינסולין נמצא כבר בשנת 1996 על ידי Zeng ו-Quon במאמרם ב- J Clin Invest כמשרה הרחבת כלי-דם, על ידי שחרור של NO, ונראה שהשפעת resistin במחקרם של Gentile וחב' היו ספציפיים לפעילות אינסולין בהרחבת כלי-דם, שכן פעילות אצטילכולין וניטרוגליצרין כמרחיבי כלי-דם לא מושפעת על ידי resistin.
השפעת דיאטה מצומצמת על רמות רזיסטין
מחקרים עדכניים שהדגימו השפעות משמעותיות של אדיפוקינים על מטבוליזם, מאזן האנרגיה, וכן וויסות של משקל הגוף, עודדו מחקרים על התפקיד האפשרי של מאזן אנרגיה שלילי על הפרשת אדיפוקינים. Wolfe וחב' דווחו ב-Clin Endocrinol משנת 2004 על ניסוי בו נבחנה השפעת דיאטה היפּו-קאלורית של 1,000 קילו-קלוריות ליום לתקופה של 4 שבועות על מתנדבים צעירים ובריאים במשקל תקין. המדגם כלל 15 צעירים בגיל 22±3 שנה, שערכי leptin, adiponectin ו-resistin נמדדו בדמם בבסיס הניסוי, ולאחר 4 שבועות של הדיאטה המוגבלת.
במהלך הניסוי משתתפיו הפסידו בממוצע3.4±2.1 ק"ג, כאשר רמות leptin בפלזמה ירדו ירידה משמעותי של 60.3% בממוצע מ-12.1 ננוגרם/מ"ל ל-4.95ננוגרם למ"ל (p<0.001), רמת adiponectin פחתה ב-16.2% בממוצע מ-11.8 מיקרוגרם/מ"ל ל-9.95 מיקרוגרם/מ"ל (p<0.04), אך לא נרשם כל שינוי ברמת resistin שהייתה ונותרה 4.7 ננוגרם/מ"ל בבסיס הניסוי ולאחר השלמתו.
רמות resistin בחולים קריטיים כרוכות ברמת הדלקת, אי-תפקוד איברים וסטיות מטבוליות ועשויים לנבא הישרדות בחולים ללא ספסיס
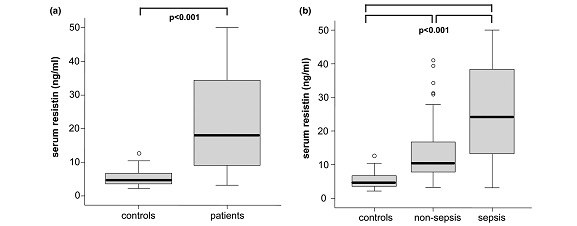
היפרגליקמיה ועמידות לאינסולין הם ממצאים שכיחים בחולים קריטיים עם ספסיס או עם הלם ספטי, והם מהווים גם גורמים המשפיעים על תמותה בתרחישים אלה. כיוון ש-resistin המופרש בעיקר ממקרופאגים בבני-אדם ידוע כמווסת חילוף חומרים של גלוקוזה וכן את הרגישות לאינסולין. חומר זה מוכר גם כמשפיע על עמידות לאינסולין, על תסמונת מטבולית, השמנת יתר וסוכרת type 2. לכן החליטו Koch וחב' לבחון רמות resistin בחולים קריטיים ביחידת טיפול נמרץ, על מנת לבחון את המתאם בין רמות אלה עם מדדים כגון דלקת, תפקוד איברים, וחומרת המחלה וההישרדות בחולים אלה.
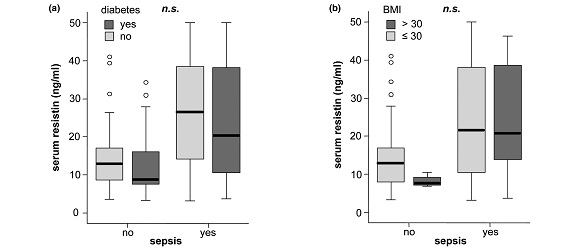
ממצאי מחקר זה הראו שרמות resistin בנסיוב היו מוגברות משמעותית בכל החולים הקריטיים בהשוואה עם ביקורת של פרטים בריאים, והן נמצאו מוגברות משמעותית במטופלים עם ספסיס בהשוואה לאלה ללא ספסיס. לעומת זאת, לא נמצא שרמות resistin היו קשורות לסוכרת או להשמנת-יתר. כמו כן, רמות resistin נמצאו במתאם טוב עם מדדי דלקת כמו C-reactive protein, רמת לויקוציטים, procacitonin, וציטוקינים כגון IL-6 ו-TNF-α, והיו גם במתאם טוב כשל כליות והפוטנציאל הסינתטי של הכבד. רמות מוגברות של resistin שמעל 10 ננוגרם/מ"ל היו כרוכות עם תוצאות לא רצויות במטופלים ללא ספסיס ביחידה לטיפול נמרץ ובהישרדות שלהם ככלל. לכו נראה ש-resistin יכול לשמש מדד פרוגנוסטי בחולים קריטיים ללא ספסיס.
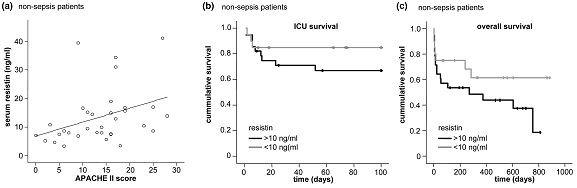
(a) רמת resistin נמצאת במתאם עם מדרג APACHE II (r=0.481, p=0.005) ב-48 מטופלים ללא ספסיס; (b ו-c) רמות resistin בנסיוב משמשות סמן פרוגנוסטי במטופלים בטיפול נמרץ ללא ספסיס: עקומות Kaplan-Mayer של הישרדות כאשר ערכי resistin גבוהים או נמוכים מ-10 ננוגרם/מ"ל.
(שלושת התרשימים האחרונים לקוחים מ-Koch וחב' ב-Critical Care משנת 2009).
Resistin וציטוקינים
ציטוקינים הם כידוע מולקולות המשגרות איתות לתאים והן משרות בין השאר תהליכי דלקת. ציטוקינים נקשרים לקולטנים ספציפיים שלהם על פני תאים, דרכם הם שולחים את מסריהם לתוך התא באופן שמשנה את תפקודי התא. הודגם ש-resistin מעודד שפעול של תאי אנדותל, על ידי הפרשה של אנדותלין-1, ושדרוג של מולקולות הנספחות לתאים וסקולאריים (כמו VCAM-1). בו זמנית resistin גורם ל-down-regulation של ביטוי TRAF-3 או TNF-receptor factor-3, שהוא מעכב של איתותים דרך TNF-receptor superfamily member 5 או CD40 (עפ"י Verma וחב' ב-Circulation משנת 2003). בנוסף, נמצא ש-resistin משרה בתאי אנדותל יצירה של pentraxin-3, מתווך דלקת הקשור לטרשת עורקים (עפ"י Kawanami וחב' משנת 2004 ב-Biochem Biophys Res Commun).
בשנת 2010 הראו Zhang וחב' ב-Arthritis Rheum ש-resistin עצמו יכול להשרות יצירת ציטוקינים וכימוקינים בתאי כונדרוציטים ארטיקולאריים באדם. נמצא ש-resistin משרה ביטוי של mRNA של 20 ציטוקינים וכימוקינים שנסרקו, הן בכונדרוציטים נורמאליים של אדם, כמו גם בכונדרוציטים מאזורים של סחוס אוסטיאו-ארטריטי. ציטוקינים אלה כוללים CCL2 ,CCL3 ,CCL4 ,CCL8 ,CXCL1 ,CXCL2 ,CXCL3 ,TNF-α ,IL-1α ו- IL-1β. בירור של המנגנונים הפוטנציאלים דרכם resistin משרה up-regulation של ציטוקינים וכימוקינים בכונדרוציטים, כורך את גורמי השיעתוק הגרעיניים NFκB ו-C/EBPβ.
עיכוב של NFκB ושל MAPKs הביא לחסימת הביטוי המושרה על ידי resistin של IL-6 ,TNF-α, ו-IL-1β, הן ברמת mRNA כמו גם ברמת החלבון של שלושת הציטוקינים הללו. לעומת זאת, העיכוב של PI3K הגביר את השפעת resistin המוליכה לביטוי מוגדל של הציטוקינים IL-6 ו-IL-1β, כיוון ש-PI3K פועל כרגולטור שלילי של השפעות דלקתיות שמושרות דרך TLR4 ו-TLR2 (שני החלבונים הציטופלזמיים הקשורים למעבר איתותים תוך תאיים) עפ"י Williams וחב' ב-Shock משנת 2006. ממצאים אלה מצביעים שאיתותים תוך-תאיים קדם-דלקתיים ש-resistin משרה, עוברים דרך מנגנוני איתות בהשתתפות NFκB ו-MAPK כל זאת לאחר קישור resistin לקולטני TLR4.
Resistin ופקקת
מספר מחקרים הראו ש-resistin עלול להחיש יצירת קרישי-דם במהלך התהליך של יצירת הרובד הטרשתי. לדוגמה, טיפול של תאי אנדותל של עורקים כליליים באדם ב-resistin נמצא מגביר את הביטוי של ה-tissue factor (TF) המשחק תפקיד מרכזי ביצירת קרישי דם. מוצע ש-resistin משיג את השפעתו זו בעזרת שפעול של גורם השעתוק NF-κB ובכך מסתייע מעבר לשלב קדם-קרישתי (על פי Calabro וחב' ב-J Vasc Res משנת 2011). ניסוי של Fang וחב' משנת 2011 ב-J Endocrinol Invest, נמדדו רמות resistin בנסיוב של 90 מטופלים עם תסמונת מטבולית והושוו לרמותיהם של תווכים (mediators) שונים של פקקת. נקבע שהרמה הממוצעת של resistin במטופלים עם תסמונת מטבולית עם או ללא אוטם חד של הלב או של המוח, הייתה גבוהה משמעותית מזו בקבוצת ביקורת. זאת ועוד, במטופלים עם תסמונת מטבולית ואטם, רמות resistin נמצאו במתאם טוב עם TF ועם plasminogen activaton inhibitor-1.
ההשפעות in vitro של resistin על ביטוי גני נלמדו על ידי אנליזה של microarray, ונמצא שהטיפול של HUVEC או human umbilical vein endothelial cells עם resistin גרם לעלייה דרמטית ברמות הביטוי של apolipoprotein C-I, של ACE, של TNF receptor superfamily member 1A וכן של CD40. ממצאים אלה מרמזים לכך ש-resistin יכול להשרות סיבוכי פקקת על ידי התערבותו במטבוליזם של ליפופרוטאינים ועל ידי עידוד דלקת בסביבה המעודדת קרישיות-יתר.
למרות שאין עדיין הוכחה ישירה לתפקידו של resistin ביצירת הקריש, אם כי הוא יכול להיות מעורב בתהליכים תרומבוטיים דרך היותו מווסת את האנזים NOS ואת יצירת NO. מחקרים של Moore וחב' (Eur J Pharmacol משנת 2011 ו-Thromb Haemost משנת 2010) הראו ש-NO משחק תפקיד מרכזי בוויסות של תפקוד טסיות-דם in vivo. חוקרים אלה מצאו ש-eNOS הוא בעל תפקיד חשוב בצימות של טסיות, שעה ש-iNOS ו-nNOS הם בעלי השפעה מזערית בתהליך זה. כיוון ש-resistin הוא בעל יכולת וויסות של eNOS, השפעתו על תהליכי פקקת נראית סבירה.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק