הבדלים בין גרסאות בדף "שימור פוריות בחולות אונקולוגיות - Fertility preservation in oncologic patients"
| שורה 149: | שורה 149: | ||
|Basal serum estradiol (E2) level Serum inhibin B level | |Basal serum estradiol (E2) level Serum inhibin B level | ||
|- | |- | ||
| − | |Serum antimullerian hormone (AMH) level | + | |Serum antimullerian hormone ([[AMH]]) level |
|- | |- | ||
|Sonography: Total antral follicle count (AFC) | |Sonography: Total antral follicle count (AFC) | ||
גרסה מ־09:39, 18 בינואר 2014
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| שימור פוריות בחולות אונקולוגיות | ||
|---|---|---|
| Fertility preservation in oncologic patients | ||
| יוצר הערך | ד"ר הילה רענני וד"ר דרור מאירוב |
|
עם התפתחות הטיפולים האונקולוגיים ועלייה בשיעור ההחלמה בעקבות טיפולים כימותרפיים ורדיותרפיים, עלה באופן ברור הצורך לתת את הדעת לנושאי איכות החיים של המטופלות ונושא הפריון בנשים צעירות הוא גורם ראשון במעלה. בזכרים, בשנות ה-50 של המאה הקודמת, החלו להקפיא זרע אנושי. על פי מידע הקיים כיום, נולדו יותר מ-250 אלף איש מזרע שהוקפא החל מ-1996.
מיצוי זרע הוא תהליך פשוט יחסית ועם התפתחות טכנולוגיות ההקפאה ושיטות ההפריה החוץ גופית ובעיקר החדרת תא זרע בודד לביצית (ICSI), הפך תהליך הקפאת זרע בגברים לפני טיפולים אונקולוגיים לתהליך מובן ושיעורי ההצלחה גבוהים[1].
כאשר מדובר בילדה, נערה או אישה העומדת בפני מצב רפואי העשוי לפגוע בפוריותה, תהליך השימור מורכב ועל כן יש צורך ״לתפור חליפה אישית״ לכל אחת, בהתאם למספר גורמים משפיעים שאותם ננסה להבהיר בסקירה זו.
השפעת מחלת הסרטן על הפוריות
פוריות האישה תלויה בתפקוד השחלתי, המהווה תנאי ליצירת הפריה, ומתפקוד הרחם, המהווה אינקובטור לגידול העובר. השחלה מתפקדת כל עוד קיים בה מאגר של ביציות השמורות בתוך הזקיקים הראשוניים (primordial follicles) . במשך חיי האישה חלק מהזקיקים מתפתחים לביציות בשלות אך רוב מאגר הזקיקים מתנוון. ככל שחולפות השנים, מאגר הזקיקים מידלדל עד שמספרם מגיע לרמה קריטית קטנה, המחזור מפסיק והאישה נכנסת לגיל המעבר. מקובל להניח כי הביציות אינן יכולות להתחלק ולגדול במספרן, על כן אין תחליף לביציות שנהרסו. אם בגיל צעיר מאגר הביציות בשחלה נפגע עד לרמה קריטית נמוכה והמחזור ההורמונלי נפסק, האישה לא תוכל להרות. אולם, אף במקרים בהם הווסת ממשיכה ומופיעה באופן סדיר לאחר הטיפולים, קיימת שכיחות מוגברת של אי פריון מוקדם והפסקה של המחזור בגיל צעיר מהממוצע[2] עקב הידלדלות מאגר הזקיקים.
השפעת הטיפול האונקולוגי על הפריון
כשל שחלתי מוקדם מוכר כאחת מתופעות הלוואי ארוכות הטווח השכיחות הפוגעות בנשים בגיל הפריון המטופלות בחומרים כימותרפיים או בקרינה ישירה לאגן.
עבודות היסטולוגיות בבעלי חיים ובשחלות הומאניות הדגימו שהתוצאה הסופית של נזקים מכימותרפיה היו אטרופיה שחלתית והרס הזקיקים הפרהמורדיאלים[3] , [4]. ידוע כי מנגון ההרס אינו ״הכל או לא כלום״[5] וכי מספר הזקיקים הנותר חיוני לאחר חשיפה לכימותרפיה ונמצא ביחס הפוך למינון התרופות. מכניזם הפגיעה עדיין אינו מובן כל צורכו אך נמצא נזק מושרה לתאי פרהגרנולוזה והודגמו תהליכי אפופטוזיס במהלך הרס הביציות והזקיקים[6] , [7]. ברמת רקמת השחלה, הודגם נזק לכלי הדם ויצירת מוקדי הצטלקות בקורטקס השחלה. מאזורים אלה, הזקיקים נעלמו. ירידה משמעותית במאגר הזקיקים הודגמה בחיות שבייצו כביכול באופן ״נורמלי״[8].
הגורמים המשפיעים על כושר הפוריות הם הגיל בזמן החשיפה לטיפולים, פרוטוקול הטיפול ובעיקר שימוש בכימותרפיה ממשפחת האלקלואידים, מינון וחשיפה לטיפולים קודמים (תמונה1). כאמור, גם הישנות מחזורי וסת עם סיום הטיפולים אינה מבטיח פוטנציאל פוריות נורמלי. בסקירה שפורסמה[9] הוסק כי הסיכוי להריון ספונטני מוערך בכ-28 אחוז בנשים שחלו לפני גיל 20 ורק בחמישה אחוזים אם חלו אחרי גיל 25! במקרים של השתלת מח עצם, כשל שחלתי מופיע ביותר מ-80 אחוז, גם אם הטיפול בוצע בגיל הילדות. במידה שיש סכנה ממשית לפגיעה בפוריות, חשוב כי האישה תקבל ייעוץ לגבי האפשרויות השונות לשימור פריון לפני התחלת הטיפול.
תכשירים כימותרפיים
הנזקים הקשים ביותר נגרמים לרקמת השחלה על ידי alkylating agents כמו ציקלופוספמיד. חומרים אלה מאיצים את תהליך הרס הביציות, אחראיים לנזק המשמעותי ביותר למאגר הביציות ולפיכך גורמים להפסקת המחזור ולכשלון השחלה. אצל נשים שטופלו בעברן (למעלה משנה) בחומרים אלה, לא נמצאה עלייה בשיעור הפלות או עלייה בסיכון למומים מולדים[10]. גם לתרופות מקבוצת ה-Cisplatin and Analogues יכולת פגיעה משמעותית במאגר הביציות. לעומת זאת, לתרופות ממשפחת ה-anti metabolics יכולת פגיעה נמוכה ביותר. למרות שאין עבודות אפידמיולוגיות נרחבות לגבי קבוצת ה- taxol, עבודות בבעלי חיים ובחולות סרטן השד מעידות כי תכשירים אלה הם טוקסיים למאגר הזקיקים.
סיכום המידע לגבי מידת הפגיעה של תכשירים כימותרפיים בנשים בתלות בפרוטוקול ובגיל האישה, (מופיע במאמרים[11] , [12] , [13] ובטבלה 1).
| טבלה 1. הערכת הסיכון לכשלון שחלה בנשים | |
|---|---|
| High risk | Stem cell transplant, external beam irradiation to fields including the ovaries, breast cancer adjuvant combination chemotherapy regimens containing cyclophosphamide, methotrexate, fluorouracil, doxorubicin, epirubicin in women > 40 years |
| Intermediate risk | Breast cancer adjuvant chemotherapy regimens containing cyclophosphamide in women 30-39 years, or doxorubicin/ cyclophosphamide in women > 40 years |
| Low risk (<20%) | Combination chemotherapy regimens for NHL, ALL, AML, breast cancer adjuvant chemotherapy regimens containing cyclophosphamide in women < 30 years or , or doxorubicin/ cyclophosphamide in women < 40 years |
| Very low risk or no risk | Vincristine, methotrexate, fluorouracil |
| Unknown risk* | Paclitaxel, taxotere, oxaliplatin, irinotecan, trastuzumab, bevacizumab, cetuximab, erlotinib, imatinib |
השפעת רדיותרפיה על פריון האישה
קרינה ישירה לאזור האגן פוגעת בתפקוד השחלות, דבר העלול להביא להפסקת הפרשת הורמוני המין, מצב הדומה לניתוח לכריתת שחלות. מידת הפגיעה תלויה במינון הקרינה הישירה ובמידת החשיפה לקרינה בסמוך לשדה הקרינה (50-4Gy LD). קרינה לבטן total body irradiation במינון של 20-30Gy גורמת ל-97 אחוז כשלון שחלה בנשים ועד 70 אחוז כשלון שחלה בילדות טרם בשלות מינית[13] , [14] , [15]. הרחם עלול להיפגע מקרינה לבטן לאגן או בקרינה, כתלות במינון ובגיל בעת ההקרנה. בילדות שהוקרנו טרם גדילת הרחם, עם ההתבגרות המינית נמצא נפח קטן של הרחם. פגיעה בתפקוד הרחמי עלולה להיגרם בחשיפה למנות קרינה של 14-30Gy כתוצאה מפגיעה הנגרמת לכלי הדם הפוגעת באלסטיות של שריר הרחם. אפילו במינוני קרינה נמוכים יותר, כמו ב- TBI, נראה פגיעה בגדילת הרחם ובזרימות הדם ברקמה. טיפול קרינתי אף לאחר ההתבגרות המינית גורם לפגיעה ברירית הרחם ועל כן קיימת הפרעה ביכולת ההשרשה של העובר. בהריונות שנקלטו מדווח על שיעור הפלות מוגבר, לידות מוקדמות ועל הפרעות בתפקוד השליה.
נסיונות לשפר תפקוד הרחם לאחר TBI על ידי מתן טיפול הורמונלי תחליפי הביאו לשיפור מסוים שהתבטא בהתעבות רירית הרחם ובמדידת זרימת הדם, אולם עבודתו של לרסן הדגימה כי הנזק הקרינתי שנגרם לרחם במינוני קרינה ישירה היה בדרך כלל בלתי הפיך[13] , [14] , [15], [16] , [17].
הריון עתידי
ההחלטה לגבי כניסה להריון לאחר טיפול במחלת הסרטן היא מורכבת. יש להביא בחשבון מספר גורמים על מנת להגיע להחלטה. מבין השיקולים החשובים יש לציין: מהו פרק הזמן הנדרש על מנת להגיע לסבירות גבוהה של החלמה, מתי מתרחשות עיקר החזרות של המחלה, מהו המעקב הרפואי הנדרש אחרי הישנות מחלה ומתי והאם הריון יפריע לבדיקות מעקב אלו. מהו פרק הזמן שבו האישה פורייה ועדיין יכולה להרות וללדת. נתון חשוב זה קשור לגיל ולטיפולים כימותרפיים קודמים. אחד הגורמים החשובים המובאים בחשבון הוא הרצון להרות, ללדת ולקיים משפחה.
אחת השאלות החוזרות הקשורה להריון היא לגבי הסיכוי להצלחת ההריון ותקינות העובר. עבודות רבות הדגישו שאין שכיחות מוגברת של הפלות או מומים מולדים בנשים שטופלו בעבר (למעלה משנה) בתרופות כימותרפיות[10] , [18].
אפשרויות לשימור פריון בחולות סרטן
כיום קיימים ברשותנו מספר כלים לשימור פוריות. היכולת להשתמש בכלי זה או אחר או בשילוב מספר שיטות תלויה, כמובן, במספר גורמים שאותם עלינו להביא בחשבון כמו גיל החולה, המחלה הבסיסית ופרוטוקולי הטיפול המקובלים בה, התקדמות המחלה והאם קיימת אפשרות לדחיית התחלת הטיפול, מצב בריאותי בעת הייעוץ ורצון האישה והמשפחה[13] , [19] , [20] , [21].
הפריית ביציות ושימור עוברים
שימור עוברים בחנקן נוזלי למשך תקופה ארוכה הוכח כיעיל ונמצא בשימוש רוטיני בטיפולי פוריות. במידה שניתן, מומלץ לנשים לעבור טיפולי הפריה חוץ גופית (IVF) והקפאת עוברים לפני מתן טיפול הפוגע בשחלות. לא ניתן ליישם טיפול זה בילדות ובנערות. בנשים לא נשואות, יש להשתמש בזרע תורם למטרות ההפריה. ניתן לשמור עוברים בהקפאה למשך שנים רבות, אף למשך יותר מעשר שנים. על מנת להשיג מספר רב של עוברים, יש צורך במתן טיפולים הורמונליים על מנת לגרות את השחלות. הטיפול גורם לעלייה ברמת האסטרוגן בדם, המהווה מצב היפרקואגולבילי. כמו כן, יש צורך בהתייחסות מיוחדת לנשים החולות בסרטן השד או בגידולים אחרים המושפעים מהורמונים. לשם כך קיימות תכניות טיפול מיוחדות לגירוי השחלות כמו מתן טמוקסיפן החוסם את הרצפטורים לאסטרוגן או פרוטוקול עם מעכבי ארומטז המונע עלייה ברמות אסטרוגן בזמן הגירוי השחלתי ויכול להתאים לנשים עם סרטן שד או גידול רגיש להורמוני מין.
יתרונות השיטה: זוהי השיטה שצברה את הניסיון הרב ביותר עם אחוזי הצלחה ידועים התלויים בגיל האישה ובפרמטרים מוכרים אחרים של פוריות הזוג.
חסרונות השיטה:
- דחייה של הטיפול האונקולוגי למשך מספר שבועות. לעתים, המצב הרפואי אינו מאפשר דחייה בטיפול לתקופה כה ממושכת.
- גירוי הורמונלי של השחלות.
- הצורך בזרע (בן זוג או תורם).
- שאיבת ביציות נעשית בהרדמה מלאה ויש להביא בחשבון סיכויים לסיבוכים (אם כי נמוכים) של דמם תוך בטני והתפתחות זיהום תוך אגני.
- לאחרונה ניתן במקרים מסוימים לבצע שאיבת ביציות ללא גירוי הורמונלי מקדים. במקרה כזה, זמן הטיפול מתקצר במספר ימים ואין סיכון הנגזר ממצב היפראסטרוגני, אך בשיטה זו נשאבות בעיקר ביציות בלתי בשלות ויש לנסות להבשילן מחוץ לגוף. שטה זו נקראת IVM ) in-vitr Maturation). בשיטה זו, אחוז ההפריות נמוך יותר ויעברו עוד מספר שנים עד ששיטה זו תבטיח יעילות דומה לזו הקיימת בהפריה חוץ גופית של ביציות בשלות. כמו כן, עדיין אין מידע מספק לגבי בטיחות השיטה. את הביציות שהבשילו ניתן להקפיא או להפרות ולהקפיא כעוברים[22].
הקפאת ביציות בשלות
ניתן לשאוב ביציות בשלות מתוך השחלה במחזור הפריה חוץ גופית (IVF) ולהקפיאן ללא הפריה עם זרע. אין צורך בבן זוג ואין צורך להשתמש בבנק הזרע על מנת להקפיא ביציות. מבחינת הגירוי השחלתי, שאיבת הביציות, דחייה במתן הטיפול הכימותרפי והסכנות ההורמונליות, הטיפול זהה לטיפול המתואר בהקפאת עוברים. אולם, ההקפאה אינה יעילה באותה מידה, אם כי לאחרונה דווח על עלייה בשיעורי ההצלחה (כרבע לעומת הקפאת עוברים. שיעור ההריונות - ארבעה אחוזים לביצית מוקפאת שהופשרה) .
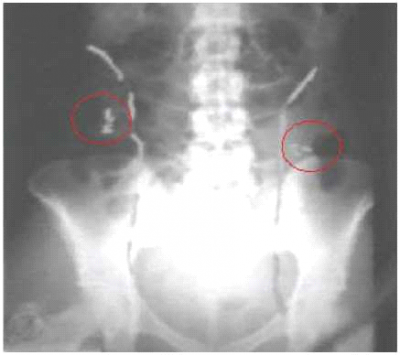
הסטת שחלות
במידה שצפויה קרינה ישירה לאזור האגן, ניתן לבצע הסטת שחלות בניתוח לפרוסקופי. בשיטה זו מקבעים את שתי השחלות גבוה בגבול העליון של עצמות האגן על ידי תפר או מאחורי הרחם. חשוב לדעת לפני הפרוצדורה את שדה הקרינה המיועד על מנת להוציא את השחלות מחוץ לאזור זה. במהלך ההסטה נשמרת אספקת הדם לשחלות. במקרים רבים תיתכן נפילת השחלות חזרה למקומן המקורי. לכן, רצוי לבצע ניתוח בסמוך ככל האפשר למועד ההקרנה.
חסרונות השיטה:
- צורך בניתוח
- כישלון בקיבוע ובחשיפת השחלות לקרינה.
- פגיעה וסקולרית הגורמת לפגיעה בשחלה והפסקת תפקודה.
- היווצרות ציסטות שחלתיות.
- סיכוי נמוך מאוד להריונות ספונטניים ובדרך כלל יש צורך בשימוש בהפריית מבחנה בעתיד לצורך הריון. בשל גורמים אלה מדווח על שיעור גבוה של כשלונות, 30-50 אחוז, ובשל כך אנו ממליצים לשלב את הניתוח עם הקפאת רקמת שחלה (תמונה 2).
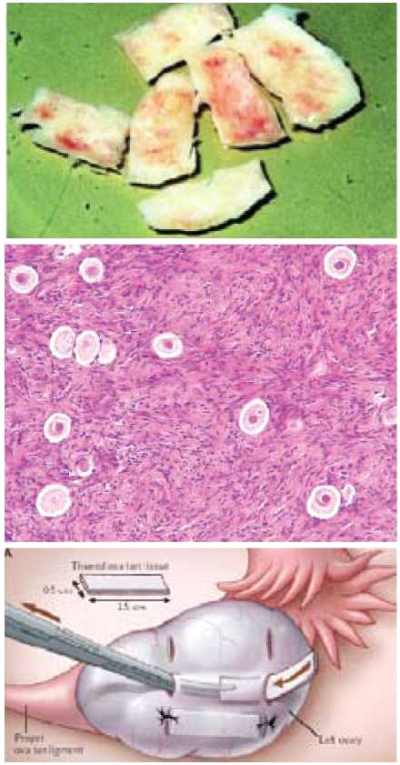
הקפאה והשתלת רקמת שחלה
במידה שצפויה פגיעה בסבירות משמעותית בפוריות האישה עקב הטיפולים הכימותרפיים, ניתן לבצע ניתוח לפרוסקופי שבו מוציאים מקטע ממעטפת שחלה לצורך הקפאה. בשיטה זו מונעים חשיפת הרקמה לגורמים הטוקסים. את מקטע השחלה חותכים לחתיכות קטנות, חלקן נשלח לבדיקה פתולוגית לשלילת הימצאות תאי סרטן. מקטעים אלה מכילים ביציות המוקפות בתאי גרנולוזה וטקה החיוניים לשמירה על איכות הביציות. את תהליך ההקפאה שורדות כ-70 אחוז מהביציות שהוקפאו. מרקמת השחלה ניתן למצות ביציות ולהבשילן במעבדה (IVM) לקראת תהליך הפריה חוץ גופית. את רקמת השחלה ניתן להשתיל חזרה לגוף במיטת השחלה, בסמוך לה בחלל הבטן, או במקום אחר מתחת לעור. הקפאת רקמת שחלה מבוצעת בעולם במרכזים רבים זה כעשר שנים והערכה היא כי מאות נשים עברו עד היום פרוצדורה זו. בארץ בוצעו הקפאות מאז 1996. שיטה זו נחשבת עדיין לנסיונית מאחר שההפשרות וההשתלות חזרה לגוף הנשים בוצעו רק במספר קטן של מקרים. עד היום דווח על חמש לידות (שתי לידות של הריונות ספונטניים ושלוש של הריונות IVF), מספר הריונות שעדיין לא ילדו וכן על מספר הריונות שהסתיימו בהפלות. דווח על מספר הריונות לאחר השתלת שחלה (ללא הקפאה) בין תאומות מונוזיגוטיות. הלידה הראשונה לאחר השתלת רקמת שחלה IVF-I דווחה בבית החולים שיבא. לא ידוע מהו מספר נסיונות ההשתלה שכשלו ולא דווחו[23] , [24] , [25] , [26] , [27].
יתרונות השיטה:
- ניתן לבצע ניתוח זה ללא דיחוי, ללא צורך להתחשב במחזור ההורמונלי של האישה.
- ניתן להתחיל הטיפול האונקולוגי כבר מספר ימים ספורים לאחר הניתוח.
- ניתן לבצע גם בנשים שטופלו בזמן האחרון בכימותרפיה.
- ניתן להציע הקפאת שחלה גם לנערות לא נשואות ולילדות שתרם קיבלו מחזור וסת ראשון.
חסרונות השיטה:
- צורך בהרדמה ובניתוח לפרוסקופי במצב שהאישה אינה בשיא בריאותה (לפני התחלת הטיפולים). יש להתייעץ עם הרופא המטפל ומרדים בכיר להקטנת הסיכונים הכרוכים בניתוח.
- השיטה נסיונית ועד כה דווח על מספר הריונות קטן בעולם.
על מנת להקטין את הסיכון בהחזרת תאים סרטניים לגוף האישה עם השתלת רקמה שלא עברה חשיפה לטיפול האונקולוגי, יש להקפיד על פרוטוקול בדיקות לפני הקפאת הרקמה ולבצע בדיקות מעמיקות טרם ההשתלה. בעבודה שפרסמנו לאחרונה, 58 חולות עם ממאירות המטולוגית שהופנו לביצוע הקפאת רקמת שחלה לפני טיפול אונקולוגי, עברו בדיקות הדמיה לפני הניתוח הלפרוסקופי וכן בדיקה היסטולוגית של קטעי שחלה לאחר הניתוח. לאחר הפשרת קטעי הרקמה, בוצעו בדיקות אימונוהיסטוכימיות לגילוי מרקרים אופייניים לשלילת שארית מחלה מינימלית. מתוך 58 נשים, אצל שתיים נתגלתה מעורבות שחלתית בהדמיה מקדימה. היסטולוגיה לפני ההקפאה לא הראתה סימני מחלה מינימלית אצל אף אחת מהנשים ולאחר ההפשרה נמצאה בדיקת PCR חיובית רק באישה אחת עם היסטוריה של CML. בדיקה זו מנעה השתלת קטעי רקמה חזרה בגוף האישה. מסקנות העבודה היו כי שילוב כל האמצעים הנ״ל ימנע הקפאת רקמת שחלה עם מעורבות אונקולוגית וכן יאפשר השתלת רקמה ללא שארית מחלה[28].
שיטה זו, על יתרונותיה וחסרונותיה, מוצעת כיום לנשים שהסיכון לאובדן פוריותן משמעותי, כמו לפני טיפולי השתלת מח עצם או פרוטוקולים אגרסיביים .
דיכוי שחלתי
דיכוי שחלתי במנגנון היפותלמי היפופיזרי ניתן להשיג במתן זריקות תקופתיות של תכשירי דקהפפטיל. מטרת הטיפול להקטין חשיפת שחלה לא פעילה לטוקסיות של החומרים הכימותרפיים .
יש עבודות בספרות המעידות כי דיכוי פעילות השחלה בזמן טיפולים כימותרפיים עשוי להגן על השחלות מפני הפגיעה השחלתית הנגרמת מטיפולים כימותרפיים. לעומתם, יש עבודות אחרות שלא הוכיחו הגנה על השחלות. טיפולים אלה מיועדים רק לנערות ולנשים לאחר ההתבגרות המינית ולא לילדות שטרם החלו לווסת[29] . הטיפול ניתן בזריקות של GNRH-a depo במרווחים של ארבעה שבועות. רצוי להתחיל את הטיפול לפני התחלת הטיפול הכימותרפי.
יתרונות השיטה:
- בטווח הקצר, בהיות האישה בסיכון לאנמיה או טרומבוציטופניה, יש יתרון ברור למניעת דמם[30].
- אמצעי יעיל למניעת הריון במהלך כימותרפיה.
חסרונות השיטה:
- יעילות הטיפול לא הוכחה עדיין.
- גלי חום, לאחר מספר שבועות תחושת יובש בנרתיק, הפרעות בשינה ושינויים במצבי רוח.
- מתן ממושך מעל שישה חודשים משפיע לרעה על מסת העצם המאפיין מצב היפואסטרוגני ממושך.
לאחר סיום הטיפולים במחלת הסרטן, יש חשיבות רבה למעקב ספציפי אחרי התפקוד השחלתי. ידוע כי גם הישנות מחזורי הווסת אינה בהכרח מבטיחה יכולת פריון רגילה. מעקב זה יכלול בדיקות דם לפרופיל הורמונלי ומעקב סונוגרפי להדמיית נפח השחלות, פעילות הורמונלית ותגובת רירית הרחם. שיטות להערכת רזרבה שחלתית מופיעות בטבלה 2.
| טבלה 2. הערכת רזרבה שחלתית |
|---|
| Basal serum follicle stimulating hormone (FSH) level |
| Basal serum estradiol (E2) level Serum inhibin B level |
| Serum antimullerian hormone (AMH) level |
| Sonography: Total antral follicle count (AFC) |
| Sonography: Ovarian volume Ovarian biopsy |
| Response to ovarian stimulation |
במידה שקיים רצון להרות לאחר סיום הטיפול האונקולוגי, יש צורך בהערכת פוטנציאל הפריון והערכת מצב בריאותה הכללי של האישה עקב חשיפה לחומרים כימותרפיים היכולים להשפיע על פעילות הלב, הכליות ומערכות גוף אחרות[10].
במידה שקיים כשל שחלתי מוקדם (היעלמות הווסת בנוכחות גונדוטרופינים גבוהים), ניתן להציע לאישה הפריה באמצעות תרומת ביצית. בהליך זה נלקחת ביצית מאישה תורמת, מבוצעת הפריה חוץ גופית בזרע בן הזוג והעוברים מוחזרים לרחם האישה המקבלת. במידה שקיים חשש לפגיעה ברירית הרחם (בעיקר עקב הקרנה ישירה לאגן), ניתן לבצע באישה הפריה חוץ גופית ולהחזיר את העוברים לאחר הפריה לרחם של פונדקאית.
לסיכום, השפעת תהליך אונקולוגי על פוטנציאל הפריון העתידי של המטופלת הוא מולטיפקטוריאלי ותלוי בעיקר בגיל האישה בעת הטיפול, סוג הטיפול, פרוטוקול הטיפול ומשכו. יש חשיבות רבה לערב את האישה ומשפחתה בדיון מפורט לגבי סיכונים ואפשרויות לשימור פוריותה ורצוי מאוד לפני תחילת הטיפול האונקולוגי.
בשנים האחרונות עלתה המודעות בעולם לתחום שימור הפוריות הן בקרב הרופאים ההמטולוגים והאונקולוגים המטפלים בחולים והן בקרב רופאי הפריון. סיכום השיטות השונות הזמינות כיום לשימור פוריות מוצג בטבלה 3. על מנת לקדם את התחום ולעזור למטופלות, יש צורך בשיתוף פעולה הדוק בין קבוצות רופאים בעלי התמחויות שונות. על כן הוקמו קבוצות עניין וארגונים העוסקים בתחום שימור הפוריות.
| טבלה 3. טיפולים לשימור והשגת פוריות בנשים החולות במחלת הסרטן | ||
|---|---|---|
| סוג טיפול | הגדרה | הער1ת |
| הקפאת עוברים | שאיבת ביציות, הפריית מבחנה, הקפאת עוברים כדי לאפשר החזרה לרחם בעתיד. | השיסה שבה נצבר הניסיון הרב ביותר. יש צורך בגירוי שחלתי (שבועיים ממחזור), התייחסות מיוחדת לנשים עם גידולים התלויים בהורמונים, יש צורך בזרע בן זוג או בנק זרע |
| הקפאת ביציות | שאיבת ביציות, הקפאת ביציות לא מופרות להפשרה והפריה בעתיד | שיעור הצלחה נמוך משמעותית מהקפאת עוברים. אין צורך בזרע להפריה. ההכנה כמו בהקפאת עוברים |
| ביציות לא בשלות | שאיבת ביציות ללא גירוי שחלתי, הבשלתן בתנאי מעבדה | שיסה נסיונית המיושמת לאחרונה. ניתן להשיג את הביציות משאיבה או מרקמת שחלה. לאחר הבשלת הביציות, להפרות ולהקפיא, או להקפיא את הביציות הבשלות |
| הקפאת רקמת שחלות | ניתוח ללקיחת מקסע משחלה והקפאתו, הפשרה והשתלה חוזרת לגוף לאחר סיפול במחלת הסרסן על מנת לאפשר פריון | ניתוח לפרוסקופי. ניתן להתחיל סיפולים מיד לאחר הפעולה. ניתן לבצע בילדות ונערות. ניתן לבצע לאחר התחלת סיפול כימותרפי. נסיוני, לא לבצע בנשים שיש סכנה של הימצאות סרסן בשחלות |
| הסטת שחלות | ניתוח להזזת שחלות משדה קרינה על מנת שלא תיפגענה | ניתוח לפרוסקופי. ניתן להתחיל סיפולים מיד לאחר הפעולה. בחלק מהנשים השחלות אינן מתפקדות לאחר הניתוח. השגת פוריות על ידי החזרת השחלות לאגן או במחזורי הפריה חוץ גופית |
| תרומת ביציות | נשים ששחלותיהן אינן פעילות לאחר סיפולים יכולות לקבל מאישה תורמת ביציות שנלקחו במחזור הפריה חוץ גופי. הביציות יופרו עם זרע בן הזוג והעוברים יוחזרו לרחם המקבלת | נשים שלא שימרו פריון, השחלות נפגעו אך הרחם לא. האישה נושאת את ההריון ויולדת את בנה, הזרע מבן הזוג, ההרכב הגנטי הוא של תורמת הביצית. יש צורך בהסכם חתום. |
| פונדקאות | ביציות יישאבו מנשים ששחלותיהן לא נפגעו אך הרחם הוצא או נפגע מקרינה. הביציות יופרו במחזור הפריה חוץ גופית עם זרע בן הזוג והעוברים יוחזרו לרחם הפונדקאית על מנת שתישא את ההריון | אישה שאינה יכולה לשאת הריון לאחר סיפולים בסרסן. שאיבת ביציות והפריה חוץ גופית עם זרע בן הזוג, החזרת העוברים לרחם פונדקאית על מנת שתישא את ההריון ותלד. יש צורך בהסכם חתום. |
ביבליוגרפיה
- Bath LE, Critchley HO, Chambers SE, Anderson RA, Kelnar CJ, Wallace WHB. Ovarian and uterine characteristics after total body irradiation in childhood and adolescence: response to sex steroid replacement. Br J Obstet Gynaecol 1999; 106: 1265-1272.
- ↑ D Meirow, I Hardan, J Dor, E Friedman, S Elizur, H Ra'anani, et. al. Searching for evidence of disease and malignant cell contamination in ovarian tissue stored from hematologic cancer patients. Hum. Reprod. May;23(5):1007-13.
- ↑ Sklar C, Mertens AC, Mitby P et al. Premature menopause in survivors of childhood cancer: a report from the childhood cancer survivor study.J Natl Cancer Inst. 2006;98:890-6.
- ↑ Familiari, G, Caggiati A, Nottola SA, Ermini M, Rita Di Benedetto M, Motta PM. Ultrastructure of human ovarian primordial follicles after combination chemotherapy for Hodgkin's disease. Hum Reprod 1993;8:2080-2087.
- ↑ Himelstein-Braw R, Peters H, Faber M. Morphological study of the ovaries of leukaemic children. Br J Cancer 1978;38:82-7.
- ↑ D Meirow, H Lewis, D Nugent, M Epstein. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool. Hum. Reprod.14:pp.1903-1907,1999.
- ↑ Marcello MF, Nuciforo G, Romeo R, Dino GD, Russo I, Russo A. et al. Structural and ultrastructural study of the ovary in childhood leukemia after successful treatment. Cancer 1990;66:2099-2104
- ↑ Perez GI, Knudson CM, Leykin L, Korsmeyer SJ and Tilly JL (1997) Apoptosis-associated signalling pathways are required for chemotherapymediated female germ cell destruction. Nat Med 3,1228-1232.
- ↑ D Meirow, J Dor, B Kaufman, A Shrim, Y Rabinovici, E.Schiff, H. Raanani, J. Levron, E Fridman. Cortical fibrosis and blood-vessels damage in human ovaries exposed to chemotherapy. Potential mechanisms of ovarian injury. Hum. Reprod.22:pp.1626-33,2007.
- ↑ Lobo RA.. Potential options for preservation of fertility in women. N Engl J Med 2005;353:64-73
- ↑ 10.0 10.1 10.2 D Meirow, E Schiff. Impact of maternal exposure to chemotherapy on embryos and offspring. J. National Cancer Institute Monograph.(34):21-5,2005.
- ↑ Lee SJ, Schover LR, Partridge AH, Patrizio P, Wallace WH, Hagerty K, Beck LN, Brennan LV and Oktay K (2006) American Society of Clinical Oncology Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol 24,2917-2931.
- ↑ D Meirow, J Dor. Epidemiology and infertility in cancer patients. In: Preservation of Fertility Editors: Togas Tulandi & Roger Gosden. Taylor and Francis Publishing,pp.21-38,2004.
- ↑ 13.0 13.1 13.2 13.3 H. Wallace D. Meirow. Gonadal function in Children and Young People treated for Cancer. and. International International Society fertility Preservation (ISFP) web site. http://www.isfp-fertility.org. 2008
- ↑ 14.0 14.1 Wallace WHB, Thomson AB, Kelsey TW. The radiosensitivity of the human oocyte. Hum Reprod 2003; 18: 117-121.
- ↑ 15.0 15.1 Wallace WHB, Shalet SM, Crowne EC, et al. Ovarian failure following abdominal irradiation in childhood: natural history and prognosis. Clin Oncol 1989; 1: 75-79.
- ↑ Critchley HO, Wallace WHB, Shalet SM, Mamtora H, Higginson J, Anderson DC.Abdominal irradiation in childhood; the potential for pregnancy. Br J Obstet Gynaecol 1992; 99: 392-394.
- ↑ Larsen EC, Schmiegelow K, Rechnitzer C, Loft A, Muller J, Andersen AN Radiotherapy at a young age reduces uterine volume of childhood cancer survivors. Acta Obstet Gynecol Scand. 2004;83:96-102.
- ↑ J Arnon, D Meirow, H Lewis-Roness, A Ornoy. Genetic and Teratogenic Effects of Cancer Treatments on Gametes and Embryos. Hum. Reprod. Update.7(4):pp.394-403,2001
- ↑ Donnez J, Martinez-Madrid B, Jadoul P, Van Langendonckt A, Demylle D, Dolmans MM. Ovarian tissue cryopreservation and transplantation: a review. Hum Reprod Update. 2006;12:519-35.
- ↑ Roberts JE, Oktay K. Fertility preservation: a comprehensive approach to the young woman with cancer. J Natl Cancer Inst Monogr. 2005;34:57-9.
- ↑ O Kutluk, D Meirow. Planning for fertility preservation before cancer treatment. Sexuality, Reproduction and Menopause (SRM).5:pp.17-22,2007.
- ↑ Elizur SE, Chian RC, Pineau CA, Son WY, Holzer HE, et.al. Fertility preservation treatment for young women with autoimmune diseases facing treatment with gonadotoxic agents. Rheumatology (Oxford). 2008 Jul 26. [Epub ahead of print]
- ↑ Donnez J, Dolmans MM, Demylle D, Jadoul P, Pirard C, Squifflet J, et al. Livebirth after orthotopic transplantation of cryopreserved ovarian tissue. Lancet 2004; 364: 1405-10.
- ↑ Meirow D, Levron J, Eldar-Geva T, Hardan I, Fridman E, Zalel Y, et.al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 2005;353:318-21.
- ↑ Demeestere I, Simon P, Emiliani S, Delbaere A, Englert Y. Fertility preservation: successful transplantation of cryopreserved ovarian tissue in a young patient previously treated for Hodgkin's disease. Oncologist. 2007 Dec;12(12):1437-42.
- ↑ Andersen CY, Rosendahl M, Byskov AG, Loft A, Ottosen C, Dueholm M, et.al. Two successful pregnancies following autotransplantation of frozen/thawed ovarian tissue. Hum Reprod. 2008 Jul 3.
- ↑ Silber SJ, Lenahan KM, Levine DJ, Pineda JA, Gorman KS, Friez MJ, Crawford EC, Gosden RG. Ovarian transplantation between monozygotic twins discordant for premature ovarian failure. N Engl J Med. 2005 Jul 7;353(1):58-63.
- ↑ D Meirow, I Hardan, J Dor, E Friedman, S Elizur, H Ra'anani, et.al. Searching for evidence of disease and malignant cell contamination in ovarian tissue stored from hematologic cancer patients. Hum. Reprod. May;23(5):1007-13. Epub,Mar 27,pp.1-7,2008.
- ↑ Blumenfeld Z, Avivi I, Eckman A, Epelbaum R, Rowe JM, Dann EJ. Gonadotropin-releasing hormone agonist decreases chemotherapy-induced gonadotoxicity and premature ovarian failure in young female patients with Hodgkin lymphoma. Fertil Steril. 2008. ;89:166-73.
- ↑ D Meirow, J Rabinovici, D Katz, R Or, D Ben-Yehuda. Prevention of severe menorrhagia in oncology patients with treatment-induced thrombocytopenia by luteinizing hormone-releasing hormone agonist and depo-medroxyprogesterone acetate. Cancer. 107:pp.1634-41,2006.
קישורים חיצוניים
הוקם ארגון בינלאומי ששם לו למטרה לקדם את התחום, וכן הוקם אתר אינטרנט המכיל את האינפורמציה העדכנית ביותר שנכתבה על ידי מומחים בתחום זה:
- שימור פוריות בחולות אונקולוגיות, TheMEDICAL
המידע שבדף זה נכתב על ידי ד״ר הילה רענני, ד״ר דרור מאירוב, שירות לשימור פוריות, שיבא תל השומר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק