הבדלים בין גרסאות בדף "תלסמיה - טיפול ומניעה - Thalassemia - treatment and prevention"
| שורה 16: | שורה 16: | ||
'''[[תלסמיה]]''' היא מחלת דם תורשתית, אשר מתפתחת כתוצאה מפגם במרכיב החלבוני של ה[[המוגלובין]] (Hemoglobin). עד כה, נאלצו החולים הסובלים מ[[תלסמיה]] ו-[[המוסידרין - Hemosiderin#בסיס פיזיולוגי|Hemosiderosis]] לקבל טיפול בהזלפה תת-עורית בעזרת משאבה, במשך כמחצית משעות היממה. כבר משנות השמונים קיים תכשיר הניתן דרך הפה לטיפול ב-Hemosiderosis ובשנת 2005 אושר תכשיר נוסף. | '''[[תלסמיה]]''' היא מחלת דם תורשתית, אשר מתפתחת כתוצאה מפגם במרכיב החלבוני של ה[[המוגלובין]] (Hemoglobin). עד כה, נאלצו החולים הסובלים מ[[תלסמיה]] ו-[[המוסידרין - Hemosiderin#בסיס פיזיולוגי|Hemosiderosis]] לקבל טיפול בהזלפה תת-עורית בעזרת משאבה, במשך כמחצית משעות היממה. כבר משנות השמונים קיים תכשיר הניתן דרך הפה לטיפול ב-Hemosiderosis ובשנת 2005 אושר תכשיר נוסף. | ||
| − | מחלת התלסמיה שייכת לקבוצת ה[[אנמיה המוליטית|אנמיות ההמוליטיות]] התורשתיות (Hereditary hemolytic anemias), הקשורות לפגם במבנה ה-Globin ([[המוגלובינופתיות]], Hemoglobinopathies), שהוא המרכיב החלבוני של ההמוגלובין. את ההמוגלובינופתיות ניתן לחלק לפגמים הקשורים למבנה ה-Globin, לדוגמה [[אנמיה חרמשית]] (Sickle-cell anemia), ולמחלות הקשורות לכמות הייצור של חלבון זה, אלו הן התלסמיות. מבנה ה-Globin מורכב משני זוגות של שרשראות, כאשר בבוגר בריא רוב ה-Globin מורכב מהמוגלובין מסוג A, שמורכב משתי שרשראות מסוג α {{כ}}(Alpha) ושתי שרשראות מסוג β{{כ}} (Beta), לכן ההרכב הוא α2β2. ההמוגלובין העוברי (F Hgb{{כ}}, Fetal hemoglobin), שהרכבו הוא α2γ2, מהווה חלק קטן מכלל ההמוגלובין. חלק נוסף, המהווה פחות מ-3.5 אחוזים, הוא ההמוגלובין A2 שהרכבו הוא α2δ2. השמות של מחלות התלסמיה ניתנים על פי סוג השרשראות החסרות: [[α תלסמיה]] או [[β תלסמיה]]. התורשה של מחלות אלו מועברת בצורה אוטוזומלית רצסיבית (Autosomal recessive). | + | מחלת התלסמיה שייכת לקבוצת ה[[אנמיה המוליטית|אנמיות ההמוליטיות]] התורשתיות (Hereditary hemolytic anemias), הקשורות לפגם במבנה ה-Globin ([[המוגלובינופתיות]], Hemoglobinopathies), שהוא המרכיב החלבוני של ההמוגלובין. את ההמוגלובינופתיות ניתן לחלק לפגמים הקשורים למבנה ה-Globin, לדוגמה [[אנמיה חרמשית]] (Sickle-cell anemia), ולמחלות הקשורות לכמות הייצור של חלבון זה, אלו הן התלסמיות. מבנה ה-Globin מורכב משני זוגות של שרשראות, כאשר בבוגר בריא רוב ה-Globin מורכב מהמוגלובין מסוג A, שמורכב משתי שרשראות מסוג α {{כ}}(Alpha) ושתי שרשראות מסוג β{{כ}} (Beta), לכן ההרכב הוא α2β2{{כ}} (Alpha 2 beta 2). ההמוגלובין העוברי (F Hgb{{כ}}, Fetal hemoglobin), שהרכבו הוא α2γ2{{כ}} (Alpha 2 gamma 2), מהווה חלק קטן מכלל ההמוגלובין. חלק נוסף, המהווה פחות מ-3.5 אחוזים, הוא ההמוגלובין A2 שהרכבו הוא α2δ2{{כ}} (Alpha 2 delta 2). השמות של מחלות התלסמיה ניתנים על פי סוג השרשראות החסרות: [[α תלסמיה]] או [[β תלסמיה]]. התורשה של מחלות אלו מועברת בצורה אוטוזומלית רצסיבית (Autosomal recessive). |
מחלת התלסמיה נחשבת לפגם הגנטי (Genetic) הנפוץ ביותר בעולם - מעל 100 מליון נשאים וכ-120,000 לידות של חולים חדשים הנוספים מדי שנה. אזורים אנדמים ל[[מלריה]] (Malaria endemic areas) הם האזורים בהם שכיחות ההמוגלובינופתיות גבוהה במיוחד, עקב עמידות הנשאים לזיהום על ידי טפיל זה. האזור המכונה "חגורת התלסמיה" (Thalassemia belt) הוא האזור המשתרע מספרד בקצה המערבי של אגן הים התיכון, ועד לדרום מזרח אסיה. באגן הים התיכון נפוצה בעיקר β תלסמיה ובדרום מזרח אסיה ההמוגלובינופתיות השכיחות הן α תלסמיה ו-HbE thalassemia. בישראל, תלסמיה נפוצה באוכלוסיות שונות מבחינת המוצא האתני, כאשר באוכלוסייה היהודית כ-20 אחוז מיוצאי כורדיסטן נושאים גן זה ובאוכלוסייה הערבית השכיחות נעה בין 5 ל-10 אחוזים באזורים שונים. בישראל ידועים כ-600 חולים הלוקים בהמוגלובינופתיות שונות, רובם חולי β תלסמיה. גם הגן ל-α תלסמיה נפוץ בישראל. גן זה קיים הן באוכלוסייה המזרח תימנית, יהודית וערבית, ואף ביהודים ממוצא אשכנזי. | מחלת התלסמיה נחשבת לפגם הגנטי (Genetic) הנפוץ ביותר בעולם - מעל 100 מליון נשאים וכ-120,000 לידות של חולים חדשים הנוספים מדי שנה. אזורים אנדמים ל[[מלריה]] (Malaria endemic areas) הם האזורים בהם שכיחות ההמוגלובינופתיות גבוהה במיוחד, עקב עמידות הנשאים לזיהום על ידי טפיל זה. האזור המכונה "חגורת התלסמיה" (Thalassemia belt) הוא האזור המשתרע מספרד בקצה המערבי של אגן הים התיכון, ועד לדרום מזרח אסיה. באגן הים התיכון נפוצה בעיקר β תלסמיה ובדרום מזרח אסיה ההמוגלובינופתיות השכיחות הן α תלסמיה ו-HbE thalassemia. בישראל, תלסמיה נפוצה באוכלוסיות שונות מבחינת המוצא האתני, כאשר באוכלוסייה היהודית כ-20 אחוז מיוצאי כורדיסטן נושאים גן זה ובאוכלוסייה הערבית השכיחות נעה בין 5 ל-10 אחוזים באזורים שונים. בישראל ידועים כ-600 חולים הלוקים בהמוגלובינופתיות שונות, רובם חולי β תלסמיה. גם הגן ל-α תלסמיה נפוץ בישראל. גן זה קיים הן באוכלוסייה המזרח תימנית, יהודית וערבית, ואף ביהודים ממוצא אשכנזי. | ||
| שורה 22: | שורה 22: | ||
==α תלסמיה== | ==α תלסמיה== | ||
| − | בכל אחד מן הכרומוזומים בזוג הכרומוזומים מספר 16, קיימים שני גנים המקדדים את יצור שרשראות ה-α גלובין. מצב של חסר או מוטציה באחד או בשני גנים, גורם למצב קליני של נשאות. חסר או מוטציה בשלושה גנים גורם למחלה המוליטית קלה עד בינונית המכונה [[מחלת המוגלובין H]]{{כ}} (Hgb H disease). מצב של חסר או מוטציה בארבעת הגנים גורם למצב המכונה [[הידרופס עוברי]] | + | בכל אחד מן הכרומוזומים (Chromosomes) בזוג הכרומוזומים מספר 16, קיימים שני גנים (Genes) המקדדים (Codes) את יצור שרשראות ה-α גלובין. מצב של חסר או מוטציה (Mutation) באחד או בשני גנים, גורם למצב קליני של נשאות. חסר או מוטציה בשלושה גנים גורם למחלה המוליטית קלה עד בינונית' המכונה [[מחלת המוגלובין H]]{{כ}} (Hgb H disease). מצב של חסר או מוטציה בארבעת הגנים גורם למצב המכונה [[הידרופס עוברי|Hydrops fetalis]], מצב שאינו מאפשר חיים. מצב זה איננו נפוץ באגן הים התיכון ולעומת זאת נפוץ בדרום מזרח אסיה. |
==β תלסמיה== | ==β תלסמיה== | ||
| − | הגן המקדד את יצור החלבון של β גלובין נמצא בכרומוזום 11, בסמוך לגנים המקדדים את יצור שרשראות ה- γ גלובין | + | הגן המקדד את יצור החלבון של β גלובין נמצא בכרומוזום 11, בסמוך לגנים המקדדים את יצור שרשראות ה-γ גלובין וה-δ גלובין. במקרה של β תלסמיה, החסר של שרשראות β גלובין יכול להיות חלקי, מצב המכונה +β תלסמיה, או חסר מלא המכונה β0 תלסמיה. |
ב-β תלסמיה ניתן להגדיר שלושה מצבים קליניים: | ב-β תלסמיה ניתן להגדיר שלושה מצבים קליניים: | ||
| − | #נשאים | + | #נשאים בעלי מוטציה באחד מתוך שני הגנים הם בעלי הסתמנות קלינית קלה המכונה [[Thalassemia minor]] |
| − | + | # חולים הומוזיגוטיים (Homozygous) למוטציה הם בעלי הסתמנות קלינית של [[Thalassemia major]], הם החולים הקשים | |
| − | #חולים בדרגת חומרה משתנה | + | #חולים בדרגת חומרה משתנה, בעלי הסתמנות קלינית של [[Thalassemia intermedia]], הם לרוב הומוזיגוטיים למוטציות אופייניות |
[[קובץ:Pathogenesis of B thalassemia.png|ממוזער|מרכז|520px|תמונה 1. הפטוגנזיס של מחלת β תלסמיה]] | [[קובץ:Pathogenesis of B thalassemia.png|ממוזער|מרכז|520px|תמונה 1. הפטוגנזיס של מחלת β תלסמיה]] | ||
| − | הפתופיזיולוגיה של | + | הפתופיזיולוגיה (Pathophysiology) של β תלסמיה קשורה בעיקר לעודף היחסי של שרשראות α גלובין אשר לא מייצרות את ההמוגלובין הבוגר, עקב מחסור בשרשראות β גלובין. עקב זאת, נוצר עודף יחסי של Hgb F, ושארית שרשראות ה-α גלובין עוברות Denaturation ושקיעה בתוך הכדוריות האדומות (Red blood cells) (תמונה 1). שקיעתן של שרשראות α גלובין העודפות, גורמת לשינויי צורתן של הכדוריות האדומות לצורה האופיינית של תאי מטרה (Target cells). לכדוריות אדומות אלו אורך חיים קצר משמעותית לעומת ה-120 יום של כדורית אדומה רגילה. כתוצאה מכך, יש הגברה של התהליך ההמוליטי, הגדלה של הטחול ו[[אנמיה]]. מצד שני, ההרס המוגבר של הכדוריות האדומות, הלא תקינות, גורם ל-[[Erythropoiesis]] בלתי יעיל בתוך לשד העצמות (Bone marrow), דבר המוביל גם הוא לאנמיה. להמוגלובין העוברי תכונה של יכולת קשירת חמצן מוגברת אבל קושי במסירת חמצן ברקמות. עקב כך נגרמת [[Hypoxia]] ברקמה. כל התהליכים הללו גורמים להגברת ייצור ה-[[Erythropoietin]] ולפעילות יתר של Erythropoiesis גם בלשד העצמות וגם במקומות אשר בדרך כלל אינם משתתפים בתהליך זה, מצב המכונה [[Extramedullary erythropoiesis]]. מצב זה גורם לעיוותים כגון: לסתות בולטות, מצח בולט, עצמות שבירות ועוד. התהליך של Erythropoiesis מוגבר מעלה את ספיגת הברזל (Iron) מהמעיים, תהליך אשר בסופו של דבר יגרום ל[[המוסידרוזיס]] (Hemosiderosis). תהליך זה מווסת על ידי חלבון ה-[[Hepcidin]], אשר מאפשר ספיגה מוגברת של ברזל למרות מצב עודף הברזל הקיים בחולי תלסמיה. |
==תלסמיה והתפתחות המוסידרוזיס== | ==תלסמיה והתפתחות המוסידרוזיס== | ||
| − | חולי | + | חולי β תלסמיה מפתחים אנמיה משמעותית בסביבות גיל חצי שנה והחל מגיל זה זקוקים לקבלת עירויי דם (Blood transfusions). מטרת מתן עירויי הדם היא לאפשר רמת המוגלובין סבירה כדי לגדול ולהתפתח, אך לא רק. מתן עירויי דם בתדירות קבועה, לרוב כל 2 עד 4 שבועות, מונעת את העיוותים בשלד, מפחיתה את הגדלת הטחול ומדכאת את ה-Erythropoiesis הבלתי יעיל. המטרה היא לשמור את החולים ברמת המוגלובין בסיסית שבין 9 ל-10 גרם/ד"ל (דציליטר), כאשר בגילאים הצעירים רצוי לשמור על רמת המוגלובין גבוהה יותר ולאחר גיל ההתבגרות ניתן להוריד את הסף הבסיסי של ההמוגלובין. |
| − | כל מנת דם מכילה בין 200 ל-250 | + | כל מנת דם מכילה בין 200 ל-250 מ"ג (מיליגרם) ברזל. כתוצאה ממתן עירויי הדם וה-Hematopoiesis המוגבר, נוצר מצב של עודף ברזל אשר גוף האדם איננו מסוגל להפריש. עודף הברזל שוקע במערכת הרטיקולואנדוטליאלית (Reticuloendothelial) ובכל רקמות הגוף, כולל בעור, וכתוצאה מכך מקבל העור צבע דמוי נחושת האופייני לחולים אלה. הברזל שוקע גם בכבד, בלב ובכל המערכת האנדוקרינית (Endocrine). כתוצאה מכך, כבר בעשור השני לחייהם, חולי β תלסמיה מפתחים [[Cardiomyopathy]] ו[[הפרעות קצב]], [[היפופאראתירואידיזם|תת פעילות של בלוטת יותרת התריס]] (Hypoparathyroidism), ושל [[תת פעילות בלוטת התריס|בלוטת התריס]] (Hypothyroidism), איחור בגדילה ובהתבגרות. שקיעת ברזל בלבלב גורמת ל[[סוכרת תלויית אינסולין]] [(Insulin Dependent Diabetes Mellitus (Type 1]. האיחור בהתבגרות בולט יותר בבנים מאשר בבנות וקשור למצב עודף הברזל הקיים עוד לפני גיל ההתבגרות. קצב הגדילה השנתי של חולי תלסמיה נמוך משמעותית לעומת נערים/ות בריאים/ות. |
| − | המדד המקובל להערכת | + | המדד המקובל להערכת חומרת ההמוסידרוזיס הוא בדיקת רמת [[Ferritin]]. ה-Ferritin הוא חלבון המשקף את מאגרי הברזל. יחד עם זאת, רמת פריטין מושפעת מגורמים שונים, כגון מחלות חריפות (Acute) וכרוניות (Chronic) ולכן אין להסתמך על בדיקה בודדת, אלא על מגמות השינויים בפרקי זמן ארוכים יחסית. הנזק של עודף ברזל קשור בעיקר בברזל אשר אינו קשור ל[[Transferrin]] {{כ}}(NTBI ,Non-Transferrin-Bound serum Iron), ברזל חופשי זה הוא השוקע ברקמות השונות וגורם לנזקים שתוארו. קיימות אפשרויות נוספות להערכת מידת ההמוסידרוזיס. הדרך המקובלת היום, אם כי מדובר בפעולה פולשנית, היא בדיקת כמות הברזל ברקמת כבד שהתקבלה מביופסית מחט (Needle biopsy). המגבלה של בדיקה זו, בנוסף להיותה פעולה פולשנית, היא שפיזור שקיעת הברזל ברקמת הכבד איננו אחיד ולכן הבדיקה יכלה לדגום אזורים עם כמויות משתנות של ברזל בין אזור לאזור. שיטה נוספת, אשר הוכנסה לשימוש בשנים האחרונות, היא הדמייה בעזרת MRI {{כ}}(Magnetic Resonance Imaging) בשיטה המכונה T2 - שיטה המסוגלת להעריך את כמות הברזל בכבד, ובשיטת ה-*T2 אשר נועדה להעריך את כמות הברזל בשריר הלב. עם הכנסת שתי שיטות אלו, הוכח שאין התאמה מלאה בין עומס הברזל בלב ועומס הברזל בכבד, וזו מגבלה נוספת של בדיקת כמות ברזל ברקמת כבד מביופסיה. שיטת T2-MRI מסוגלת גם להעריך את שקיעת הברזל בלבלב ובבלוטת יותרת המוח (Pituitary gland). בדיקת רמות הברזל שאינו קשר ל-Transferrin יכולה להעריך את כמות הברזל החופשי, אבל זו איננה בדיקה שגרתית. |
| − | חולי תלסמיה בוגרים סובלים מ[[אוסטאופורוזיס]] עקב התהליך של | + | חולי תלסמיה בוגרים סובלים מ[[אוסטאופורוזיס]] (Osteoporosis) עקב התהליך של Erythropoiesis מוגבר וחלקם בשילוב עם תת פעילות בלוטת יותרת התריס. |
==הטיפול בחולי תלסמיה== | ==הטיפול בחולי תלסמיה== | ||
| − | האפשרות היחידה להבראת חולי | + | האפשרות היחידה להבראת חולי התלסמיה היא השתלת תאי אב של לשד העצם (Hematopoietic stem cell transplantation), פעולה אשר אפשרית רק בחלק מהחולים וזאת בשל הצורך במציאת תורם מתאים מבחינת התאמת רקמות. יש לציין, כי חולים השייכים לקבוצת סיכון נמוכה אשר מאופיינים בהיעדר הגדלת הכבד, טיפול סדיר בקושרי ברזל והעדר לייפת (Fibrosis) בכבד, הם בעלי סיכוי של כ-90 אחוז להבריא לאחר השתלת תאי אב מסוג זה. |
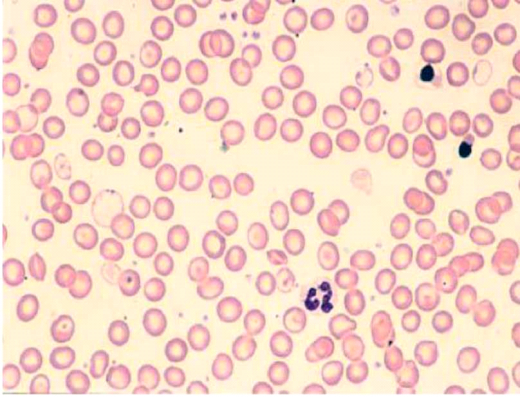
[[קובץ:דם תלסמיה.png|ממוזער|מרכז|520px|תמונה 2. תמונת דם של חולה תלסמיה]] | [[קובץ:דם תלסמיה.png|ממוזער|מרכז|520px|תמונה 2. תמונת דם של חולה תלסמיה]] | ||
| שורה 53: | שורה 53: | ||
===טיפול תרופתי בעודפי הברזל=== | ===טיפול תרופתי בעודפי הברזל=== | ||
| − | את הנזקים של עודף | + | את הנזקים של עודף הברזל בחולי תלסמיה ניתן למנוע על ידי טיפול בקושרי ברזל. הטיפול המקובל מזה יותר מארבעה עשורים הוא על ידי [[Desferal]]{{כ}} (Deferoxamine mesylate), תכשיר אשר ניתן בהזלפה תת-עורית בעזרת משאבה, שישה ימים בשבוע, במשך כעשר שעות ביממה. לתכשיר זה זמן מחצית חיים קצר של כחצי שעה ולכן יש להזליפו במשך 8 עד 10 שעות ביממה. נוסף לכך לא ניתן לתת אותו פומית (Per os). ההזלפה במשך 8 עד 10 שעות משאירה את יתר היממה ללא טיפול, ובזמן זה הברזל החופשי בפלסמה עולה ושוקע ברקמות. טיפול זה של מתן [[Desferal]], בהזלפה מתמשכת, גורם ל[[היענות לטיפול|היענות נמוכה של החולים לטיפול]]. יחד עם זאת, חשוב לציין שטיפול סדיר מונע את כל הסיבוכים של ה[[המוסידרוזיס]] ומאפשר חיים רגילים ותוחלת חיים ההולכת וגדלה. במצב של תופעות לבביות, לDesferal היכולת להוציא ברזל משריר הלב וממערכת ההולכה ועל ידי כך לשפר את התפקוד הלבבי. במצבים של המוסידרוזיס קשה ניתן להזליף מינונים גדולים יותר של Desferal במשך רוב שעות היממה דרך צנתר מרכזי, או דרך הזלפה תת עורית. טיפול זה מסוגל להציל חיים של חולי [[תלסמיה]] עם [[קרדיומיופתיה]] קשה. יחד עם זאת, הנזקים האנדוקריניים הם ככל הנראה בלתי הפיכים. תופעות הלוואי העיקריות של הDesferal הן תגובה מקומית במקום ההזרקה ונזק בשמיעה ובראיה הקשורים ככל הנראה, לטיפול במינון עודף. |
תכשיר נוסף המסוגל לגרום להפרשת הברזל העודף הוא ה[[פריפרוקס - Ferriporox|Ferriprox]]{{כ}} (Deferiprone). היתרון הבולט של תכשיר זה טמון באפשרות לתת אותו דרך הפה ובזמן מחצית החיים שלו (של כ-2 עד 3 שעות), המאפשר מתן של התרופה 3 פעמים ביום. תופעות הלוואי של תכשיר זה הן נזקים לסינוביה של הפרקים ו[[נויטרופילים נמוכים|ירידה במספר הנויטרופילים]], אשר לעיתים היא בלתי הפיכה. עקב זאת, התכשיר לא הצליח לתפוס את מקומו של ה[[Desferal]] כתכשיר קושר הברזל הנבחר בטיפול בחולי [[תלסמיה]]. אלטרנטיבה שכן נכנסה לשימוש נרחב, היא מתן שילוב של Desferal{{כ}} ו-Ferriprox. | תכשיר נוסף המסוגל לגרום להפרשת הברזל העודף הוא ה[[פריפרוקס - Ferriporox|Ferriprox]]{{כ}} (Deferiprone). היתרון הבולט של תכשיר זה טמון באפשרות לתת אותו דרך הפה ובזמן מחצית החיים שלו (של כ-2 עד 3 שעות), המאפשר מתן של התרופה 3 פעמים ביום. תופעות הלוואי של תכשיר זה הן נזקים לסינוביה של הפרקים ו[[נויטרופילים נמוכים|ירידה במספר הנויטרופילים]], אשר לעיתים היא בלתי הפיכה. עקב זאת, התכשיר לא הצליח לתפוס את מקומו של ה[[Desferal]] כתכשיר קושר הברזל הנבחר בטיפול בחולי [[תלסמיה]]. אלטרנטיבה שכן נכנסה לשימוש נרחב, היא מתן שילוב של Desferal{{כ}} ו-Ferriprox. | ||
גרסה מ־14:30, 9 ביולי 2017
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| תלסמיה - מניעה וטיפול | ||
|---|---|---|
| Thalassemia - prevention and treatment | ||
| שמות נוספים | תלסמיה או אנמיה ים תיכונית - אבחנה, טיפול ומניעה | |
| יוצר הערך | פרופ' אריאל קורן | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – המוגלובינופתיות
תלסמיה היא מחלת דם תורשתית, אשר מתפתחת כתוצאה מפגם במרכיב החלבוני של ההמוגלובין (Hemoglobin). עד כה, נאלצו החולים הסובלים מתלסמיה ו-Hemosiderosis לקבל טיפול בהזלפה תת-עורית בעזרת משאבה, במשך כמחצית משעות היממה. כבר משנות השמונים קיים תכשיר הניתן דרך הפה לטיפול ב-Hemosiderosis ובשנת 2005 אושר תכשיר נוסף.
מחלת התלסמיה שייכת לקבוצת האנמיות ההמוליטיות התורשתיות (Hereditary hemolytic anemias), הקשורות לפגם במבנה ה-Globin (המוגלובינופתיות, Hemoglobinopathies), שהוא המרכיב החלבוני של ההמוגלובין. את ההמוגלובינופתיות ניתן לחלק לפגמים הקשורים למבנה ה-Globin, לדוגמה אנמיה חרמשית (Sickle-cell anemia), ולמחלות הקשורות לכמות הייצור של חלבון זה, אלו הן התלסמיות. מבנה ה-Globin מורכב משני זוגות של שרשראות, כאשר בבוגר בריא רוב ה-Globin מורכב מהמוגלובין מסוג A, שמורכב משתי שרשראות מסוג α (Alpha) ושתי שרשראות מסוג β (Beta), לכן ההרכב הוא α2β2 (Alpha 2 beta 2). ההמוגלובין העוברי (F Hgb, Fetal hemoglobin), שהרכבו הוא α2γ2 (Alpha 2 gamma 2), מהווה חלק קטן מכלל ההמוגלובין. חלק נוסף, המהווה פחות מ-3.5 אחוזים, הוא ההמוגלובין A2 שהרכבו הוא α2δ2 (Alpha 2 delta 2). השמות של מחלות התלסמיה ניתנים על פי סוג השרשראות החסרות: α תלסמיה או β תלסמיה. התורשה של מחלות אלו מועברת בצורה אוטוזומלית רצסיבית (Autosomal recessive).
מחלת התלסמיה נחשבת לפגם הגנטי (Genetic) הנפוץ ביותר בעולם - מעל 100 מליון נשאים וכ-120,000 לידות של חולים חדשים הנוספים מדי שנה. אזורים אנדמים למלריה (Malaria endemic areas) הם האזורים בהם שכיחות ההמוגלובינופתיות גבוהה במיוחד, עקב עמידות הנשאים לזיהום על ידי טפיל זה. האזור המכונה "חגורת התלסמיה" (Thalassemia belt) הוא האזור המשתרע מספרד בקצה המערבי של אגן הים התיכון, ועד לדרום מזרח אסיה. באגן הים התיכון נפוצה בעיקר β תלסמיה ובדרום מזרח אסיה ההמוגלובינופתיות השכיחות הן α תלסמיה ו-HbE thalassemia. בישראל, תלסמיה נפוצה באוכלוסיות שונות מבחינת המוצא האתני, כאשר באוכלוסייה היהודית כ-20 אחוז מיוצאי כורדיסטן נושאים גן זה ובאוכלוסייה הערבית השכיחות נעה בין 5 ל-10 אחוזים באזורים שונים. בישראל ידועים כ-600 חולים הלוקים בהמוגלובינופתיות שונות, רובם חולי β תלסמיה. גם הגן ל-α תלסמיה נפוץ בישראל. גן זה קיים הן באוכלוסייה המזרח תימנית, יהודית וערבית, ואף ביהודים ממוצא אשכנזי.
α תלסמיה
בכל אחד מן הכרומוזומים (Chromosomes) בזוג הכרומוזומים מספר 16, קיימים שני גנים (Genes) המקדדים (Codes) את יצור שרשראות ה-α גלובין. מצב של חסר או מוטציה (Mutation) באחד או בשני גנים, גורם למצב קליני של נשאות. חסר או מוטציה בשלושה גנים גורם למחלה המוליטית קלה עד בינונית' המכונה מחלת המוגלובין H (Hgb H disease). מצב של חסר או מוטציה בארבעת הגנים גורם למצב המכונה Hydrops fetalis, מצב שאינו מאפשר חיים. מצב זה איננו נפוץ באגן הים התיכון ולעומת זאת נפוץ בדרום מזרח אסיה.
β תלסמיה
הגן המקדד את יצור החלבון של β גלובין נמצא בכרומוזום 11, בסמוך לגנים המקדדים את יצור שרשראות ה-γ גלובין וה-δ גלובין. במקרה של β תלסמיה, החסר של שרשראות β גלובין יכול להיות חלקי, מצב המכונה +β תלסמיה, או חסר מלא המכונה β0 תלסמיה. ב-β תלסמיה ניתן להגדיר שלושה מצבים קליניים:
- נשאים בעלי מוטציה באחד מתוך שני הגנים הם בעלי הסתמנות קלינית קלה המכונה Thalassemia minor
- חולים הומוזיגוטיים (Homozygous) למוטציה הם בעלי הסתמנות קלינית של Thalassemia major, הם החולים הקשים
- חולים בדרגת חומרה משתנה, בעלי הסתמנות קלינית של Thalassemia intermedia, הם לרוב הומוזיגוטיים למוטציות אופייניות
הפתופיזיולוגיה (Pathophysiology) של β תלסמיה קשורה בעיקר לעודף היחסי של שרשראות α גלובין אשר לא מייצרות את ההמוגלובין הבוגר, עקב מחסור בשרשראות β גלובין. עקב זאת, נוצר עודף יחסי של Hgb F, ושארית שרשראות ה-α גלובין עוברות Denaturation ושקיעה בתוך הכדוריות האדומות (Red blood cells) (תמונה 1). שקיעתן של שרשראות α גלובין העודפות, גורמת לשינויי צורתן של הכדוריות האדומות לצורה האופיינית של תאי מטרה (Target cells). לכדוריות אדומות אלו אורך חיים קצר משמעותית לעומת ה-120 יום של כדורית אדומה רגילה. כתוצאה מכך, יש הגברה של התהליך ההמוליטי, הגדלה של הטחול ואנמיה. מצד שני, ההרס המוגבר של הכדוריות האדומות, הלא תקינות, גורם ל-Erythropoiesis בלתי יעיל בתוך לשד העצמות (Bone marrow), דבר המוביל גם הוא לאנמיה. להמוגלובין העוברי תכונה של יכולת קשירת חמצן מוגברת אבל קושי במסירת חמצן ברקמות. עקב כך נגרמת Hypoxia ברקמה. כל התהליכים הללו גורמים להגברת ייצור ה-Erythropoietin ולפעילות יתר של Erythropoiesis גם בלשד העצמות וגם במקומות אשר בדרך כלל אינם משתתפים בתהליך זה, מצב המכונה Extramedullary erythropoiesis. מצב זה גורם לעיוותים כגון: לסתות בולטות, מצח בולט, עצמות שבירות ועוד. התהליך של Erythropoiesis מוגבר מעלה את ספיגת הברזל (Iron) מהמעיים, תהליך אשר בסופו של דבר יגרום להמוסידרוזיס (Hemosiderosis). תהליך זה מווסת על ידי חלבון ה-Hepcidin, אשר מאפשר ספיגה מוגברת של ברזל למרות מצב עודף הברזל הקיים בחולי תלסמיה.
תלסמיה והתפתחות המוסידרוזיס
חולי β תלסמיה מפתחים אנמיה משמעותית בסביבות גיל חצי שנה והחל מגיל זה זקוקים לקבלת עירויי דם (Blood transfusions). מטרת מתן עירויי הדם היא לאפשר רמת המוגלובין סבירה כדי לגדול ולהתפתח, אך לא רק. מתן עירויי דם בתדירות קבועה, לרוב כל 2 עד 4 שבועות, מונעת את העיוותים בשלד, מפחיתה את הגדלת הטחול ומדכאת את ה-Erythropoiesis הבלתי יעיל. המטרה היא לשמור את החולים ברמת המוגלובין בסיסית שבין 9 ל-10 גרם/ד"ל (דציליטר), כאשר בגילאים הצעירים רצוי לשמור על רמת המוגלובין גבוהה יותר ולאחר גיל ההתבגרות ניתן להוריד את הסף הבסיסי של ההמוגלובין.
כל מנת דם מכילה בין 200 ל-250 מ"ג (מיליגרם) ברזל. כתוצאה ממתן עירויי הדם וה-Hematopoiesis המוגבר, נוצר מצב של עודף ברזל אשר גוף האדם איננו מסוגל להפריש. עודף הברזל שוקע במערכת הרטיקולואנדוטליאלית (Reticuloendothelial) ובכל רקמות הגוף, כולל בעור, וכתוצאה מכך מקבל העור צבע דמוי נחושת האופייני לחולים אלה. הברזל שוקע גם בכבד, בלב ובכל המערכת האנדוקרינית (Endocrine). כתוצאה מכך, כבר בעשור השני לחייהם, חולי β תלסמיה מפתחים Cardiomyopathy והפרעות קצב, תת פעילות של בלוטת יותרת התריס (Hypoparathyroidism), ושל בלוטת התריס (Hypothyroidism), איחור בגדילה ובהתבגרות. שקיעת ברזל בלבלב גורמת לסוכרת תלויית אינסולין [(Insulin Dependent Diabetes Mellitus (Type 1]. האיחור בהתבגרות בולט יותר בבנים מאשר בבנות וקשור למצב עודף הברזל הקיים עוד לפני גיל ההתבגרות. קצב הגדילה השנתי של חולי תלסמיה נמוך משמעותית לעומת נערים/ות בריאים/ות.
המדד המקובל להערכת חומרת ההמוסידרוזיס הוא בדיקת רמת Ferritin. ה-Ferritin הוא חלבון המשקף את מאגרי הברזל. יחד עם זאת, רמת פריטין מושפעת מגורמים שונים, כגון מחלות חריפות (Acute) וכרוניות (Chronic) ולכן אין להסתמך על בדיקה בודדת, אלא על מגמות השינויים בפרקי זמן ארוכים יחסית. הנזק של עודף ברזל קשור בעיקר בברזל אשר אינו קשור לTransferrin (NTBI ,Non-Transferrin-Bound serum Iron), ברזל חופשי זה הוא השוקע ברקמות השונות וגורם לנזקים שתוארו. קיימות אפשרויות נוספות להערכת מידת ההמוסידרוזיס. הדרך המקובלת היום, אם כי מדובר בפעולה פולשנית, היא בדיקת כמות הברזל ברקמת כבד שהתקבלה מביופסית מחט (Needle biopsy). המגבלה של בדיקה זו, בנוסף להיותה פעולה פולשנית, היא שפיזור שקיעת הברזל ברקמת הכבד איננו אחיד ולכן הבדיקה יכלה לדגום אזורים עם כמויות משתנות של ברזל בין אזור לאזור. שיטה נוספת, אשר הוכנסה לשימוש בשנים האחרונות, היא הדמייה בעזרת MRI (Magnetic Resonance Imaging) בשיטה המכונה T2 - שיטה המסוגלת להעריך את כמות הברזל בכבד, ובשיטת ה-*T2 אשר נועדה להעריך את כמות הברזל בשריר הלב. עם הכנסת שתי שיטות אלו, הוכח שאין התאמה מלאה בין עומס הברזל בלב ועומס הברזל בכבד, וזו מגבלה נוספת של בדיקת כמות ברזל ברקמת כבד מביופסיה. שיטת T2-MRI מסוגלת גם להעריך את שקיעת הברזל בלבלב ובבלוטת יותרת המוח (Pituitary gland). בדיקת רמות הברזל שאינו קשר ל-Transferrin יכולה להעריך את כמות הברזל החופשי, אבל זו איננה בדיקה שגרתית.
חולי תלסמיה בוגרים סובלים מאוסטאופורוזיס (Osteoporosis) עקב התהליך של Erythropoiesis מוגבר וחלקם בשילוב עם תת פעילות בלוטת יותרת התריס.
הטיפול בחולי תלסמיה
האפשרות היחידה להבראת חולי התלסמיה היא השתלת תאי אב של לשד העצם (Hematopoietic stem cell transplantation), פעולה אשר אפשרית רק בחלק מהחולים וזאת בשל הצורך במציאת תורם מתאים מבחינת התאמת רקמות. יש לציין, כי חולים השייכים לקבוצת סיכון נמוכה אשר מאופיינים בהיעדר הגדלת הכבד, טיפול סדיר בקושרי ברזל והעדר לייפת (Fibrosis) בכבד, הם בעלי סיכוי של כ-90 אחוז להבריא לאחר השתלת תאי אב מסוג זה.
טיפול תרופתי בעודפי הברזל
את הנזקים של עודף הברזל בחולי תלסמיה ניתן למנוע על ידי טיפול בקושרי ברזל. הטיפול המקובל מזה יותר מארבעה עשורים הוא על ידי Desferal (Deferoxamine mesylate), תכשיר אשר ניתן בהזלפה תת-עורית בעזרת משאבה, שישה ימים בשבוע, במשך כעשר שעות ביממה. לתכשיר זה זמן מחצית חיים קצר של כחצי שעה ולכן יש להזליפו במשך 8 עד 10 שעות ביממה. נוסף לכך לא ניתן לתת אותו פומית (Per os). ההזלפה במשך 8 עד 10 שעות משאירה את יתר היממה ללא טיפול, ובזמן זה הברזל החופשי בפלסמה עולה ושוקע ברקמות. טיפול זה של מתן Desferal, בהזלפה מתמשכת, גורם להיענות נמוכה של החולים לטיפול. יחד עם זאת, חשוב לציין שטיפול סדיר מונע את כל הסיבוכים של ההמוסידרוזיס ומאפשר חיים רגילים ותוחלת חיים ההולכת וגדלה. במצב של תופעות לבביות, לDesferal היכולת להוציא ברזל משריר הלב וממערכת ההולכה ועל ידי כך לשפר את התפקוד הלבבי. במצבים של המוסידרוזיס קשה ניתן להזליף מינונים גדולים יותר של Desferal במשך רוב שעות היממה דרך צנתר מרכזי, או דרך הזלפה תת עורית. טיפול זה מסוגל להציל חיים של חולי תלסמיה עם קרדיומיופתיה קשה. יחד עם זאת, הנזקים האנדוקריניים הם ככל הנראה בלתי הפיכים. תופעות הלוואי העיקריות של הDesferal הן תגובה מקומית במקום ההזרקה ונזק בשמיעה ובראיה הקשורים ככל הנראה, לטיפול במינון עודף.
תכשיר נוסף המסוגל לגרום להפרשת הברזל העודף הוא הFerriprox (Deferiprone). היתרון הבולט של תכשיר זה טמון באפשרות לתת אותו דרך הפה ובזמן מחצית החיים שלו (של כ-2 עד 3 שעות), המאפשר מתן של התרופה 3 פעמים ביום. תופעות הלוואי של תכשיר זה הן נזקים לסינוביה של הפרקים וירידה במספר הנויטרופילים, אשר לעיתים היא בלתי הפיכה. עקב זאת, התכשיר לא הצליח לתפוס את מקומו של הDesferal כתכשיר קושר הברזל הנבחר בטיפול בחולי תלסמיה. אלטרנטיבה שכן נכנסה לשימוש נרחב, היא מתן שילוב של Desferal ו-Ferriprox.
הפרוטוקולים הטיפוליים של השילובים הם שונים ונעים בין מתן Desferal 3-4 ימים בשבוע ו-Ferriprox ביתר ימי השבוע, עד למתן שילוב יום יומי של שני התכשירים. יתרון יחסי לFerriprox הוא יכולתו לסלק בצורה יעילה יותר את הברזל משריר הלב.
בשנת 2005, אישר מנהל המזון והתרופות האמריקאי (FDA-Food and Drug Administration) ומשרד הבריאות בארץ לשימוש תכשיר חדש- Exjade (Deferasirox). לתכשיר זה, הניתן דרך הפה, זמן מחצית חיים של 12 עד 16 שעות, דבר המאפשר לתת אותו פעם ביום. תופעות הלוואי קשורות בעיקר לדרכי העיכול (בחילות ושלשולים) ופריחות בעור והן לרוב חולפות תוך כדי המשך הטיפול בתכשיר ואינן גורמות להפסקת הטיפול. כמו כן נצפתה עלייה קלה של רמת קראטינין, אבל עלייה זו אינה חורגה מהרמה המקסימלית התקינה לגיל החולה. התוצאות שהתקבלו בניסוי במאות חולים מראות שיעילות התכשיר דומה ליעילות של Desferal עם יתרון בדרך מתן התכשיר, דבר אשר מבטיח היענות טובה יותר לטיפול מצד החולים. שלושת התכשירים נמצאים בסל הבריאות בארץ לטיפל במצבי עודף ברזל כתוצאה מעירויי דם על רקע מחלות מולדות/תורשתיות.
שיקולים כללים בטיפול
הטיפול הכוללני בחולי β תלסמיה מצריך שיתוף של צוותים גדולים הכוללים רופאים המטולוגים, אחיות, רופאים קרדיולוגים, אנדוקרינולוגים, אורתופדים, רופאי פה לסת, עובדים סוציאליים, עובדי מעבדה ובנק הדם, יחידות אשפוז יום ועוד. מכאן, שעלות הטיפול בכל חולה בוגר מגיעה ל-40,000 דולר בשנה, כלומר במשך 50 שנות חיים מדובר בהוצאה של לפחות 2,000,000 דולר לטיפול בחולה בודד. תוחלת החיים של חולי תלסמיה המטופלים באופן סדיר עם היענות טובה לטיפול עוברת היום את גיל 50 ויש לצפות שחולים הנמצאים היום בשנות העשרים והשלושים לחייהם, יאריכו ימים עוד יותר. מילת המפתח, ללא ספק, היא היענות טובה וקפדנית בטיפול בקושרי ברזל, בנוסף לעירוי דם.
מניעת המחלה
הואיל ותלסמיה היא מחלה קשה לחולה ויקרה למערכת, יש מקום לפתח תוכניות למניעתה. הפעלת מערכה הסברה אינה מספיקה על מנת להגיע לכלל הזוגות בסיכון ואת תוצאותיה ניתן לראות רק לאחר שנים רבות. הפעלת תוכנית לאיתור זוגות בסיכון להוליד ילדים חולים נותנת לבני הזוג את האפשרות לבצע אבחון טרום לידתי והפסקת היריון, במידה וזהו רצונם.
ביבליוגרפיה
קישורים חיצוניים
- תלסמיה או אנמיה ים תיכונית - אבחנה, טיפול ומניעה, TheMEDICAL
המידע שבדף זה נכתב על ידי פרופ' אריאל קורן, מנהל מח' ילדים ב' והיחידה להמטולוגיה פדיאטרית, מרכז רפואי העמק, עפולה. פרופסור חבר קליני, הפקולטה לרפואה ע"ש רות וברוך רפפזרט, הטכניון, חיפה
הצהרת גילוי נאות:
פרופ׳ קורן הועסק כיועץ רפואי כנושא של הערכה וטיפול בעודף ברזל בחולי אנמיה חרמשית, והשתתף במחקר בטיפול בחולי תלסמיה בתכשיר Exjade Deferasirox מטעם חברת Novartis. כמו כן הוא משמש כיועץ רפואי בנושא המוגלובינופתיות ע"י חב' Apopharma המשווקת את התכשיר Deferiprone בארץ.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק