תסמונת נפרוטית מולדת - Congenital nephrotic syndrome
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| תסמונת נפרוטית מולדת | ||
|---|---|---|
| Congenital nephrotic syndrome | ||
| שמות נוספים | CNS | |
| יוצר הערך | ד"ר גלעד שרמן, פרופ' אבישלום פומרנץ
|
|
תסמונת נפרוטית בשנה הראשונה לחיים (Congenital nephrotic syndrome), היא מחלה ראשונית של הכליה. מספר מחלות אחראיות להופעת התסמונת הנפרוטית בשנה הראשונה לחיים. עם זאת, תסמונת זו אינה שכיחה.
המהלך והפרוגנוזה של התסמונת הנפרוטית המולדת תלוי במחלה הראשונית (האטיולוגיה) הגורמת למחלה. תסמונת נפרוטית מולדת, כמו כלל התסמונות הנפרוטיות בילדים ומתבגרים, מתבטאת בכמויות גדולות של חלבון בשתן, ריכוז אלבומין נמוך בדם (היפואלבומינמיה), רמות גבוהות של כולסטרול ובצקות.
חולים אלו סובלים מכלל הסיבוכים הקשורים לתסמונת נפרוטית של המבוגר ומסיבוכים ייחודיים ליילוד, כמו הפרעה קשה בשגשוג (FTT - Failure to thrive).
אפידמיולוגיה
תסמונת נפרוטית בשנה הראשונה לחיים אינה שכיחה.
אטיולוגיה
פתופיזיולוגיה
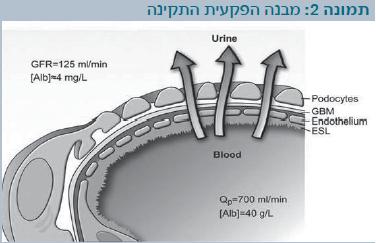
באדם בריא, פחות מ-0.1% מהאלבומין שבפלסמה יחצה את מחסום הסינון הפקעיתי (Glomerular filtration barrier)[7].
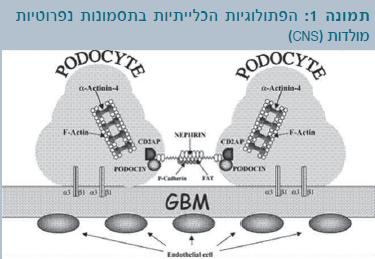
מבנה דופן הנימיות הפקעתיות (הקפילרות הגלומרולריות):
- תאי אנדותל מחוררים יושבים על ממברנת הבסיס של הפקעית.
- ממברנת הבסיס מכוסה באפיתל של הפקעית - תאי-רגל (פודוציטים).
- האפיתל של הפקעית עוטף את הנימיות בעזרת שלוחות תאיות הנקראות רגלונים (Foot processes). בין רגלונים אלו קיימים חריצים לסינון.
שלושת המבנים הללו – האנדותל המחורר, ממברנת הבסיס והאפיתל הפקעיתי – הם מחסום הסינון הפקעיתי (תמונה 2).
סינון המים והמומסים הוא חוץ-תאי, ומתרחש דרך הנקבים באנדותל ובחריצי הסינון. חשיבות תאי-הרגל וחריצי הסינון נראית במחלות הגנטיות:
- בתסמונת נפרוטית מולדת מהסוג הפיני (Finnish type nephrotic syndrome) יש פגם בגן המקודד לנפרין (Nephrin) - חלבון הפועל בחריצי הסינון. פגם זה גורם לתסמונת נפרוטית בילדות.
- בדומה, הגן המקודד לפודוצין (Podocin) - חלבון הפועל במערכת תאי-הרגל - יכול להיות פגום בילדים עם טרשת פקעיתית מוקדית מקטעית (FSGS - Focal segmental glomerulosclerosis) שעמיד לטיפול בסטרואידים.
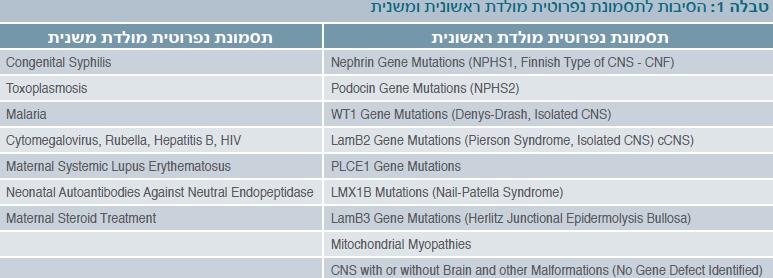
גורמים לתסמונת נפרוטית מולדת ראשונית
תסמונת נפרוטית מולדת ראשונית היא מחלת כליה נדירה הנגרמת מפגמים גנטיים הפוגעים במרכיבי מחסום הסינון הפקעיתי, בעיקר בגנים המקודדים לנפרין ולפודוצין. הגורמים הגנטיים אחראים לרוב רובם של מקרי התסמונת הנפרוטית המולדת בעולם המערבי.
תסמונות נפרוטיות מולדות ראשוניות קשורות בדרך כלל לפגמים בגנים שונים, והן רוב התסמונות שיתוארו לעיל. התסמונת הנפרוטית מהסוג הפיני מייצגת קבוצה זו של מחלות.
מוטציות בגן המקודד לנפרין (Nephrotic syndrome type 1) - תסמונת נפרוטית מולדת מסוג פיני
מוטציות בגן NPHS1 (Nephrotic syndrome type 1 gene) גרמו למחלה שנקראה במקור תסמונת נפרוטית מולדת מסוג פיני[1]. המחלה מועברת בתורשה אוטוזומלית רצסיבית.
ההיארעות של המחלה בפינלד היא כ-1 ל-8,200 לידות, וכחצי מהמקרים שפורסמו הם של תושבי פינלנד. קרוב ל-100 מוטציות בגן זוהו בשלב זה[2]. שתי המוטציות השכיחות ביותר בפינלנד הן Fin-Minor ו-Fin-Major.
הגן NPHS1 מקודד לחלבון נפרין, חלבון טרנס-ממברנלי ממשפחת האימונוגלובולינים. נפרין מיוצר כמעט בבלעדיות על ידי תאי הרגל בפקעיות (תמונה 1).
[תמונה 1 המצורפת, p1.eps, עם הכיתוב: תמונה 1: הפתולוגיות הכלייתיות בתסמונות נפרוטיות מולדות (CNS)]
מוטציות בגן המקודד לפודוצין (Nephrotic syndrome type 2) - תסמונת נפרוטית מולדת מסוג 2
מוטציות בגן NPHS2 (Nephrotic syndrome type 2 gene), המקודד לחלבון הפודוצין, הן סיבה שכיחה לתסמונת נפרוטית שלא מגיבה לסטרואידים בילדים בני למעלה משנה, אך הן חשובות גם בהתפתחות תסמונת נפרוטית מולדת.
יש האומרים שמוטציות בגן NPHS2 אחראיות לעד כמחצית מחולים אלו, בעוד מוטציות בגן NPHS1 אחראיות רק לכשליש מהם[3].
מוטציה בגן זה היא לרוב חמורה וגורמת לייצור חלבון פודוצין לא תפקודי. בעקבות כך הן משפיעות גם על פעילות חלבון הנפרין, כיוון שפודוצין אחראי גם על הפעילות התקינה של חלבון הנפרין בכליה[4].
גורמים לתסמונת נפרוטית מולדת משנית
תסמונת נפרוטית מולדת משנית יכולה להיגרם מזיהומים תוך-רחמיים, זיהומים מסביב ללידה, או בשל מחלה מערכתית אחרת, כמו זאבת אדמנתית מערכתית (SLE - Systemic lupus erythematosus) עם פגיעה כלייתית משנית (טבלה 1). זאבת אדמנתית מערכתית יכולה לגרום לתסמונת נפרוטית משנית בשנה הראשונה לחיים של היילוד; מחלה זו מתוארת לעתים רחוקות מתחת לגיל 5 שנים, אך תסמונת נפרוטית תוארה בילדים עם זאבת אדמנתית מערכתית של הפעוט.
במדינות מתפתחות, במיוחד באפריקה, זיהומים תוך-רחמיים יכולים לגרום לתסמונת נפרוטית מולדת ולתסמונת נפרוטית בפעוטות:
- עגבת מולדת היא סיבה ידועה לתסמונת נפרוטית או נפריטית מולדת ביילוד[5].
- נגיף כשל חיסוני אנושי (HIV - Human immunodeficiency virus) יכול לגרום לפגיעה כלייתית עם או בלי תסמונת נפרוטית.
- נגיף CMV (Cytomegalovirus) מולד יכול לגרום לתסמונת נפרוטית מולדת[6]. זיהום תוך רחמי ב-CMV נפוץ בשבועות הראשונים לחיים, וזיהוי הנגיף ביילוד לא שולל אפשרות של תסמונת גנטית נוסף על כך.
- טוקסופלזמוזיס (Toxoplasmosis) תואר כגורם לתסמונת נפרוטית מולדת. קיימים תיאורים בודדים.
- אדמת מולדת
קליניקה
תסמונת נפרוטית מולדת מסוג פיני
הבעיה העיקרית של חולים הסובלים מתסמונת נפרוטית מולדת מהסוג הפיני היא איבוד קשה של חלבון בשתן, המתחיל עוד בחיים העובריים.
במקרים חמורים ישנה בצקת מפושטת, והילדים סובלים מבצקת מפושטת קיצונית (Anasarca) (תמונה 3). במקרה זה, של עודף מים מפושט בכל הגוף, ניתן לראות בצקת בגפיים, מיימת ותפליטים בקרום הצדר (תפליטים פלאורליים).
הבצקות הן משניות לאיבוד חלבון בשתן, היכול להגיע ליותר מ-20 גרם לליטר, ולרמות אלבומין קטנות מ-10 גרם לליטר. דרגת החלבון בשתן שונה בין התסמונות הנפרוטיות המולדות, והממצאים הקליניים לא בהכרח גלויים בשבועות הראשונים לחיים. לעתים חומרת איבוד החלבון בשתן מתגלה רק לאחר תיקון חלקי של ריכוז נמוך מאד של אלבומין בדם על ידי מתן אלבומין.
ברוב הילדים נמצא במקביל לאיבוד החלבון בשתן איבוד קל של דם בשתן (המטוריה) והימצאות מוגלה בשתן (Pyuria).
בחולי תסמונת נפרוטית מהסוג הפיני תפקוד הכליות נשאר לרוב בגדר הנורמה בחודשים הראשונים לחיים, אך במקרים אחרים אי ספיקת כליות יכולה להתפתח במהירות. לחץ הדם יכול להיות נמוך מתת-חלבון בדם או גבוה אם אי ספיקת הכליות כבר מתקדמת.
Fin-Major ו-Fin-Minor הן שתי המוטציות העיקריות בחולים אלו, והן גורמות לחוסר מוחלט של חלבון הנפרין בפקעית הכליה. בכליות יש חוסר של הסיבים (ה-Filament image) של תא-הרגל וחוסר של מסננת החריצים (Slit diaphragm). בעקבות כך יתקבל איבוד מסיבי ולא בררני של חלבון בשתן.
מרבית הילדים (80%) עם מוטציות בגן לנפרין נולדים טרם המועד (שבועות 35-38 להיריון) עם משקל לידה של 1,500-3,500 גרם. הממוצע הוא 2.6 ק"ג. מיעוטם יהיו גם קטנים לגיל ההריון (SGA - Small for gestational age). משקל השליה הוא גבוה מ-25% ממשקל היילוד בכלל המקרים. בתסמונת נפרוטית מולדת מהסוג הפיני קיים יחס שליה לעובר של 0.38. זאת בהשוואה לתינוק בריא, שלו יחס של 0.18 משקל שליה לעובר. הסיבה לכך לא ברורה.
רוב הילדים נולדים עם מקוניום (Meconium) במי השפיר. מרביתם לא סובלים מבעיות נשימתיות משמעותיות. למרבית היילודים אין מומים חוץ-כלייתיים, אך כן ניתן לאבחן בשכיחות גבוהה הפרעות נוירולוגיות קלות, כמו רפיסות שרירים (היפוטוניה) והגדלה של הלב. תפרי הגולגולת (Cranial sutures) בדרך כלל רחבים בשל התגרמות מעוכבת. ליילודים יש אף קטן ואוזניים נמוכות ולעתים עיוותים בירכיים, בברכיים ובמרפקים בשל השליה הגדולה. בצקות מופיעות כבר בלידה או בשבוע הראשון לחיים במחצית מהמקרים.
תסמונת נפרוטית מולדת מסוג 2
חומרת הפרוטאינוריה, ובהתאם לכך הממצאים הקליניים, היא מגוונת יותר בחולי NPHS2 מאשר בחולי NPHS1, אך אנליזות רב מערכתיות של ממצאים אלו לא פורסמו. הממצאים ההיסטולוגים הכלייתיים הם לרוב מסוג Focal Segmental Glomerulosclerosis. החולים מפתחים אי ספיקת כליות סופנית (ESRD) בגיל הילדות. פודוצין הוא חלבון המבוטא רק בכליה, לכן אין לו ביטויים חוץ-כלייתיים משמעותיים, אך כמו ב-NPHS1, ייתכנו בעיות לבביות קלות.
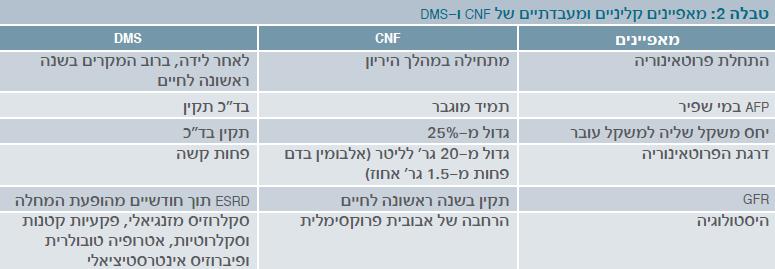
IDMS (Isolated Diffuse Mesangial Sclerosis)
תסמונת נפרוטית המתאפיינת בסקלרוזה של הפקעית. DMS יכול להיות מבודד (IDMS) או מלווה בעוד אנומליות, במיוחד ב-DDS (Denys-Drash syndrome).IDMS לרוב מופיע בבנות, אך תסמונת זו תוארה גם בבנים. המחלה מועברת בתורשה אוטוזומלית רצסיבית. מוטציה ב-WT1 (Wilm's Tumor Gene) תוארה בילדים עם IDMS.
השינויים הפתולוגיים ב-DMS הם אופייניים בשלבים הראשונים, ומאופיינים בהרחבת המשתית המזנגיאלית ובהיפרטרופיה של הפודוציטים, עם התעבות והתרחבות של ה-GBM בהמשך. התרחבות המזנגיום והשינויים הסקלרוטיים חוסמים את הקפילרות.
ההיריון והלידה בילדים אלו הוא תקין, ויחס השליה לעובר נמצא תקין. הפרוטאינוריה היא בדרגה בינונית, ומופיעה בחודש השלישי לחיים בדרך כלל. בניגוד ל-CNF, הילדים יפתחו ESRD תוך מספר חודשים (טבלה 2), וחלק גדול מהם יסבלו מיתר לחץ דם.
DDS (Denys-Drash Syndrome)
תסמונת המורכבת מ- Wilm's Tumor Male Pseudohermaphroditism (XY) ונפרופתיה פרוגרסיבית, מוגדרת כ-DDS. תסמונת זו מאופיינת בתסמונת נפרוטית מולדת, אך יכולה להופיע גם בגילאים מאוחרים יותר. DDS היא תסמונת משנית למוטציה בגן WT1. הגן ממוקם על כרומוזום 11p13. לגן WT1 יש חשיבות רבה בחיים העובריים ליצירת הכליה ודרכי השתן.
DDS נחלק לשלוש קטגוריות קליניות: 1. גנוטיפ זכרי עם שלושת האנומליות שתוארו; 2. גנוטיפ זכרי עם נפרופתיה ו-Ambiguous External and/or Internal Genitalia; 3. גנוטיפ נקבי עם נפרופתיה ו-Wilm's Tumor.
תסמונת נפרוטית מולדת משנית
- עגבת מולדת: פרוטאינוריה והמטוריה שכיחות, אך תסמונת נפרוטית קשה שכיחה פחות. תסמונת נפרוטית יכולה להופיע בלידה, אך שכיחה יותר מגיל חודש עד 4 חודשים.
- HIV יכול לגרום לפגיעה כלייתית עם או בלי תסמונת נפרוטית. התסמונת הנפרוטית המולדת מופיעה בד"כ בילדים מעל גיל שנה, אך תוארו מקרים שבהם הופיעה בגילאים צעירים יותר.
- אדמת מולדת מתוארת כגורמת לפגיעה ב-CNS עם פגיעה כלייתית מסוג של MGN עם או בלי פגיעה עינית ומוחית.
אבחנה
תסמונת נפרוטית מולדת מתחלקת באופן מלאכותי לשתי תקופות: תסמונת נפרוטית של היילוד (Congenital NS), המאובחנת מהלידה ועד גיל 3 חודשים ותסמונת נפרוטית של גיל הילדות (Infantile NS), המאובחנת בגילאי 12-4 חודשים. האטיולוגיה השכיחה ביותר בילדים הסובלים מ-CNS היא (CNF) שמתחילה להתבטא לרוב לפני גיל חודש. מחקרים מהשנים האחרונות מראים שפגם ספציפי בגן יכול להתבטא בגילאים שונים, ומכך נובע ההיגיון שמאחורי החלוקה שבין תסמונת מולדת (עד גיל 3 חודשים) לתסמונת של גיל הילדות (גילאי 12-4 חודשים).
זמן ההופעה של ה-CNS בשאר המחלות הוא רחב יותר, ויכול להתחיל מהיום הראשון לחיים ועד מספר חודשים. האבחנה של ילד הסובל מתסמונת נפרוטית חייבת להתבסס על מספר קריטריונים שכוללים מהלך קליני, סיפור משפחתי, ממצאים מעבדתיים ותוצאות של ניקור כליה (ממצאים היסטולוגיים). האבחון הסופי מתבסס על בדיקות גנטיות.
האבחנה לפי גיל בלבד אינה מספקת. חלוקה נוספת של היא לפי הגורם האטיולוגי - תסמונת נפרוטית מולדת ראשונית או משנית (טבלה 1).
יילודים עם תסמונת נפרוטית ללא אי ספיקה כלייתית או ממצאים חוץ-כליתיים יכוונו אותנו ל-NPHS1. אם הגן לא נמצא או במקרה של אי ספיקה כלייתית מוקדמת המלווה את התסמונת הנפרוטית, מומלץ להשלים בירור בחשד לפגם ב-WT1 או ב-NPHS2, במיוחד אם הממצאים ההיסטופתולוגיים מכוונים לכיוון DMS או FSGS.
מאפייני תסמונת נפרוטית מולדת מהסוג הפיני
בתסמונת נפרוטית מולדת מהסוג הפיני קיימת תסמונת נפרוטית קשה עם מיימת עוד לפני גיל 3 חודשים. איבוד החלבון בשתן מתחיל עוד בתוך הרחם, וניתן לגילוי בבדיקת השתן הראשונה לאחר הלידה. רמה מיקרוסקופית של דם בשתן (המטוריה מיקרוסקופית) וערכי קריאטנין נורמליים הם אופייניים בחודשים הראשונים לחיים. איבוד חלבון רב (עד 100 גר' לליטר) גורם למיעוט שתן (אוליגוריה) ולבצקת קשה אם היילוד לא מקבל טיפול תומך. אי ספיקת כליות סופנית מתרחשת בגילאי 3-8 שנים.
הכליות בתסמונת נפרוטית מולדת מהסוג הפיני גדולות והיפראקוגניות עם טשטוש הגבול הקורטיקו-מדולרי (כמו במקרים אחרים של תסמונת נפרוטית מולדת). אין ממצאים היסטולוגיים פתוגנומוניים לתסמונת נפרוטית מולדת מהסוג הפיני, אך ניתן לראות הרחבה של המזנגיום, הרחבה של הצינוריות המקורבות והמרוחקות, ובהמשך הסננת תאי דלקת ולייפת (פיברוזיס). במיקרוסקופ אלקטרוני ניתן לראות הרס הרגליות של תאי-הרגל (תמונה 1).
השוואה בין תסמונת נפרוטית מולדת מהסוג הפיני לבין תסמונת DSM מפורטת בטבלה לעיל:
מומים חוץ-כלייתיים
חיפוש אחר מומים חוץ-כלייתיים הוא חשוב מכיוון שהוא יכול לרמז על האטיולוגיה. מומים אלו כוללים אבנורמליות גניטליות (WT1), פגמים עיניים (LAMB2) והפרעות נוירולוגיות (Mowat-Galloway). הערכה לבבית מדגימה לעתים קרובות היפרטרופיה של החדרים, ללא שינויים מבניים.
ביופסיית כליה
ביופסיה כלייתית לא תמיד מאבחנת את המחלה הראשונית. הפגמים הגנטיים השונים יכולים לגרום לסוגים שונים של פגיעות גלומרולריות, כגון: הרחבה של המזנגיום, FSGS, MCNS ו-Diffuse Mesangial Proliferation, אך ממצאים אלו יכולים לחפוף במחלות השונות. הממצאים החוץ-פקעיתיים, כגון: הרחבת הצינוריות, תסנין של תאים לבנים, תאי פלזמה ופיברוזיס אינטרסטיציאלי יכולים להיראות בכל סוגי המחלות שגורמות ל-CNS. לפיכך, האינדיקציות לביצוע ביופסיית כליה הן לא ברורות. הערכת חומרת הסקלרוזיס והפיברוזיס יכולה לעזור בהחלטות טיפוליות. מצד שני, הפגיעות הן פוקאליות, ותוצאות הביופסיה יכולות להיות מטעות. צביעות אימונוהיסטוכימיות לנפרין ולפודוצין יכולות לעזור, וחסר מלא של אחד החלבונים האלו מצביע על מחלה קשה שלא תגיב לטיפולים נוגדי הפרוטאינוריה (כמפורט בהמשך).
אבחון גנטי
אבחון גנטי הוא בדיקת הבחירה לאבחנה מדויקת של תסמונת נפרוטית מולדת. ידיעת האטיולוגיה עוזרת בהערכת הטיפול והפרוגנוזה, בגילוי סימנים חוץ-כלייתיים ובייעוץ גנטי למשפחה. אנליזה של מוטציות ב-NPHS1 וב-NPHS2 היא נחוצה בכל המקרים הללו. אם מוטציות בגנים אלו לא מתגלה, או אם הממצאים הקליניים מצביעים על מוטציות ב-WT1 או LAMB2, ניתן לבצע אנליזות לגנים אלו במעבדות מחקר.
אבחנה טרום-לידתית
הביטויים הקליניים מופיעים כבר בשבועות 16-15 להיריון. הסימן הראשון הוא בד"כ פרוטאינוריה עוברית שמובילה לעלייה של פי 10 בריכוז אלפה פטופרוטאין (AFP) במי השפיר. עלייה מקבילה, אך פחות מרשימה, נראית ברמות ה-AFP בפלזמה האימהית. שינויים אלו הם לא ספציפיים, אך מאפשרים אבחנה טרום-לידתית במשפחות עם סיכון גבוה שבהן הפסקת היריון יכולה להישקל. בדיקת רמות AFP היא בשלב זה בדיקת הסקר הזמינה היחידה. תוצאות חיוביות מוטעות קורות, וגורמות להפלות של תינוקות בריאים. במקרה של NPHS1 שהוא הטרוזיגוט, ניתן עדיין לקבל רמות גבוהות מאוד של AFP, עד פי 50 מהרמה התקינה, ובעוברים אלו ימליצו על הפסקת היריון בעוד העובר הוא נשא בלבד ולא חולה. רמות AFP מוגברות בעוברים ללא אנאנצפליה או מומים אחרים מרמזות לאבחנת NHPS1. אנליזה של הגן ל-NPHS1 היא בדיקת הבחירה הטרום-לידתית במשפחות לילדים עם מוטציה מזוהה. במשפחות שבהן אין היסטוריה משפחתית או כאשר המוטציות לא זוהו, בדיקות גנטיות טרום-לידתיות הן מאתגרות בשל הזמן הרב שלוקח לבצע אותן ומסגרת הזמן הקצרה.
תסמונת נפרוטית מולדת משנית
- עגבת מולדת: עגבת גורמת לשילוב של מחלה גלומרולרית עם מחלה טובולואינטרסטיציאלית. ביופסיית כליה מדגימה Membranous Nephropathy, והיא דוגמה נדירה למחלה של מכלולים אימוניים ביילוד. ניתן לראות תסנין של לימפוציטים ותאי פלזמה באינטרסטיציום.
- CMV מולד יכול לגרום לתסמונת נפרוטית מולדת: מעורבות של מערכת העצבים המרכזית עוזרת להגיע לאבחנה הנכונה במקביל לזיהוי הנגיף בשתן של היילוד. במקרים שבהם טיפול בגנציבקלוביר לא עוזר, מומלץ לחפש סיבות גנטיות.
- זאבת אדמנתית: ילדים אלו חיוביים ל-ANA עם ירידה ברמות חלבוני המשלים שלוש וארבע (C3 ,C4) בגילאים שבין 6 שבועות לחצי שנה. בביופסיה כלייתית נמצא Proliferative GN Diffuse
טיפול
הגישה הטיפולית והאטיולוגיה של תסמונת נפרוטית בילדים המבוגרים מגיל שנה שונה מזו של תסמונת נפרוטית מולדת.
בתסמונת נפרוטית מולדת תרופות אימונוסופרסיביות אינן עוזרות, והטיפול היעיל היחיד שקיים היום הוא השתלת כליה. טרם השתלת כליה, הטיפול בילדים אלו תלוי במידת הפרוטאינוריה, ובמקרים קשים, עירויים יומיים של אלבומין הם הכרחיים למניעת בצקות מסכנות חיים. טיפולים נוספים כוללים דיאטות מעושרות בקלוריות, תירוקסין, תוספים של מינרליים, מניעת אירועי קרישות יתר וטיפול מהיר בזיהומים.
בניגוד לתסמונת נפרוטית בילדים (מעבר לגיל שנה), בתסמונת הנפרוטית המולדת הטיפול בסטרואידים או בתרופות אימונוסופרסיביות לא עוזר. השתלת כליה היא הטיפול המרפא היחידי ברוב המקרים. מטרת הטיפול בחודשים הראשונים היא שליטה בבצקות, באורמיה ומניעת סיבוכים, כגון זיהומים ותסחיפים, תוך כדי מתן תזונה עשירת קלוריות. מטרת הטיפול התומך היא לאפשר לתינוק לגדול ולהתפתח באופן תקין ככל שניתן:
- ילדים אלו צריכים לקבל כלכלה תמיכתית עם תוספת של קלוריות וחלבונים במקביל לדיאטה דלת מלח
- מתן אלבומין תוך-ורידי הוא חשוב לשימור קצב גדילה תקין.
- טיפול אנטי-פרוטאינורי באינדומד ובמעכבי ACE בחולי CNF תלוי בביטוי הנפרין על גבי הפודוציט
- השתלת כליה היא הטיפול המרפא היחיד ל-CNS.
טיפול נוגד פרוטאינוריה
- מעקבי האנזים המהפך (ACE-I) בשילוב אינדומטצין
טיפול זה מעכב ו/או מקטין את מידת הפרשת החלבון בשתן (8). טיפול זה אינו יעיל בחולים עם מוטציה חמורה ב-NPHS1/2. עבודות שפורסמו הראו שבמקרי Fin Major/Minor אין תגובה לטיפול בקפטופריל ואינדומד. במקרים שבהם אין ביטוי של הנפרין בפני השטח של הפודוציט, לא תהיה תגובה לטיפול. מצד שני, אם מוטציה ב-NPHS1 גורמת לשינוי בחומצת אמינו אחת, ניתן לראות ירידה בהפרשה של החלבון בטיפול זה. לכן, בתסמונת נפרוטית מולדת מקובל לנסות את הטיפול המשולב באינדומד ובקפטופריל, ובהתאם לתגובה הטיפולית ניתן להחליט על המשך הטיפול. הערכה של מבנה הפודוציט בביופסיה כלייתית תאפשר ביצוע בדיקות היסטוכימיות לנוכחות נפרין והערכת הסיכוי להצלחת הטיפול התרופתי.
עירוי אלבומין
פרוטאינוריה כבדה ללא החזר של חלבונים תגרום לתת-תזונה שתעכב את הגדילה של הילדים החולים. Mahan וחב' הראו תגובה טובה לטיפול בילדים שסבלו מ-CNS וטופלו בדיאטה עשירת קלוריות שכללה כלכלה שהכילה יותר מ-120 קלוריות לק"ג משקל גוף ליום, שבה כמות החלבונים הייתה 4-3 גר' חלבון ליום. כל הילדים קיבלו דיאטה דלת מלח. תרופות דיורטיות בשילוב אלבומין לווריד ניתנו לפי הצורך. למרות טיפול זה נצפו הפרעות נוירולוגיות והפרעה בשגשוג של הילדים. משנות ה-80 הוחל טיפול אגרסיבי שכלל מתן אלבומין לווריד מלידה במינון 4-3 גר' ליום בריכוז המגיע ל-20% בשילוב עם דיורטיקה לווריד (פוסיד ו/או דיזותיאזיד), בתחילה כל שעתיים ובהמשך 3-2 פעמים ביום.
תזונה
דיאטה עשירת קלוריות (מעל 130 קלוריות לק"ג משקל גוף) עם תכולת חלבון גבוהה (כ-4 גר' חלבון ליום) מומלצת לילדים עם תסמונת נפרוטית מולדת. בילדים יונקים ובילדים הניזונים מתחליפי חלב נהוג להעשיר את האוכל במוצרי חלבון מבוססי קזאין. פולימרים של גלוקוז ניתנים כתוספי אנרגייה ותערובת של לפתית (Rapeseed) ושמן חמניות כתוספת שומנים. במקביל מומלץ להוסיף שמן דגים כדי לשמור על היחס בין שומנים רווים ללא רווים. מומלץ שהרכב הדיאטה יהיה עד 20% חלבונים, כ-40% שומנים וכ-40% סוכרים. רוב החולים, במיוחד בגיל הצעיר, יזדקקו ל-Gastric Tube. כמו כן, רצוי להוסיף לכלכלה ויטמין D2, מולטי-ויטמינים, מגנזיום וסידן וכן להקפיד על דיאטה דלת מלח כדי למנוע את החמרת הבצקות.
תירוקסין
בשל הפרשת החלבון בשתן, לחולים רבים יש רמות נמוכות של Thyroid Binding Globulin ותירוקסין. רמת TSH יכולה להיות תקינה בתחילה, אך היא עולה במהלך החודשים הראשונים. לכן, מתן תירוקסין חליפי מומלץ בחולים אלו.
נוגדי קרישה
חולי CNS מפרישים פלזמינוגן ואנטי-טרומבין III בשתן. הירידה ברמות שלהם תגרום לעלייה במקרוגלובולין ופיברינוגן וכן בתרומבופלסטין, פקטור II, V, VII, X ו-XII שיגרמו לעלייה בקרישות בילדים הסובלים מתסמונת נפרוטית מולדת. הפרעות בקרישה ותופעות תרומבואמבוליות תוארו בחולים עם תסמונת נפרוטית מולדת (9). השימוש באספרין במינונים קטנים ובדיפירידמול מומלצים בחולים אלו. מרכזים מסוימים אף מטפלים בקומדין מלידה למניעת סיבוכים אלו.
אנטיביוטיקה פרופילקטית
בשל איבוד גמא-גלובולינים ומרכיבי המשלים B ו-D, חולים בתסמונת נפרוטית מולדת רגישים לזיהומים חיידקיים, במיוחד פנאומוקוקים. כמו כן, השימוש הרב בקתטרים מגביר את הסיכון לחלות במחלה זיהומית. הדעות חלוקות בנוגע לטיפול המונע (פרופילקטי), מאחר שקיים סיכון להתפתחות זנים עמידים. גם שימוש ב-IVIG לא מוריד את שכיחות הזיהומים. חשד קליני גבוה לזיהומים חיידקיים הוא חשוב מאוד, והתחלת טיפול אנטיביוטי רחב טווח צריך להינתן בהקדם האפשרי, ולכלול את המזהמים השכיחים בבית החולים. חיסונים לילדים שסובלים מתסמונת נפרוטית מולדת, כולל פנאומווקס, אינם יעילים מאחר שקיים איבוד קבוע של אימונוגלובולינים כולל IgG בשתן.
כריתת כליה
מרכזים מסוימים כורתים כליה אחת כדי להפחית את איבוד החלבון בילדים הנמצאים בתת-תזונה למרות כלכלה עשירת קלוריות (10). גישה טיפולית זו מפחיתה את תדירות עירויי האלבומין, משפרת את הגדילה ויכולה לדחות את השתלת הכליה. גישה אחרת היא כריתת שתי הכליות, והתחלת דיאליזה צפקית למניעת סיבוכים מוקדמים הכוללים פגיעה בכלי דם עקב ההפרעות המטבוליות המתפתחות במחלה זו.
דיאליזה
ניתן להשיג קצב גדילה סביר בטיפול שמרני אופטימלי. אולם, ברוב המקרים יסבלו הילדים מתת-תזונה והיפואלבומינמיה קשה והפרעה בשגשוג. לאחר נפרקטומיה דו-צדדית, ניתן להתחיל בדיאליזה צפקית. המטרה של הטיפול בדיאליזה הוא לשפר את מצבם התזונתי של הילדים כהכנה להשתלה.
השתלת כליה
השתלת כליה ראשונה בילד שסבל מ-CNS בוצעה בשנת 1973. מאוחר יותר תיארו Mahan וחב' סידרה של 17 מושתלים עם תוצאות טובות. לרוב ההשתלה מתבצעת לאחר השנה השנייה לחיים. חזרה של תסמונת נפרוטית בשתל היא נדירה, אך יכולה לקרות בילדים עם NPHS1 שפיתחו נוגדנים נגד חלבון הנפרין. טיפול בציקלופוספמיד ופלזמהפרזיס מוביל לרמיסיה (11). שרידות החולים ל-5 שנים היא יותר מ-90% בדומה להשתלות כליה מסיבות אחרות (12), והישרדות השתל לתקופה זו מגיעה ל-80%.
תסמונת נפרוטית מולדת משנית
- עגבת מולדת: טיפול אנטיביוטי בפנצילין מרפא, בתנאי שנזק כלייתי בלתי הפיך לא התפתח.
- CMV מולד: במקרים שבהם טיפול בגנציבקלוביר לא עוזר, מומלץ לחפש סיבות גנטיות.
IDMS
טיפול בסטרואידים או כל טיפול אימונוסופרסיבי אחר אינו יעיל בחולים הסובלים מ-IDMS. יש להתחיל בטיפול תומך בחולים אלו, כפי שניתן לחולי CNF. מאחר שהפרוטאינוריה פחות מסיבית, החזר החלבונים קטן יותר. השתלת כליה הוא הטיפול המרפא היחיד לקבוצת חולים זו.
פרוגנוזה
תסמונת נפרוטית מולדת ראשונית
תסמונת נפרוטית מולדת ראשונית היא קבוצה של מחלות עם פרוגנוזה גרועה. בעבר התבסס האבחון על ממצאים היסטופתולוגיים. אבחון גנים שונים, כגון WT1 ,NPHS1 ,NPHS2 ונוסף על כך גנים נוספים הקשורים למחלה של הפודוציטים, יאפשרו חלוקה עתידית חדשה של CNS. הפרוגנוזה של ילדים מושתלים שסבלו מתסמונת נפרוטית מולדת ראשונית דומה לפרוגנוזה של שאר מושתלי הכליה.
תסמונת נפרוטית מולדת משנית
- עגבת מולדת: טיפול אנטיביוטי בפנצילין מרפא, בתנאי שנזק כלייתי בלתי הפיך לא התפתח.
- זאבת אדמנתית: התגובה לטיפול האימונוסופרסיבי היא מאכזבת.
דגלים אדומים
ביבליוגרפיה
- Kestilä M, Lenkkeri U, Männikkö M, et al. Positionally cloned gene for a novel glomerular protein—nephrin—is mutated in congenital nephrotic syndrome. Mol Cell 1998;1:575–582
- Beltcheva OJ, Martin P, Lenkkeri U, et al. Mutation spectrum in the nephrin gene (NPHS1) in congenital nephrotic syndrome. Hum Mutat 2001;17:368–337
- Hinkes B, Mucha B, Vlangos C, et al. Arbeitsgemeinschaft fur Paediatrische Nephrologie Study Group. Nephrotic syndrome in the first year of life: two thirds of cases are caused by mutations in 4 genes (NPHS1, NPHS2, WT1, LAMB2). Pediatrics 2007;119:907–919
- Nishibori Y, Liu L, Hosoyamada M, et al. Diseasecausing missense mutations in NPHS2 gene alter normal nephrin trafficking to the plasma membrane. Kidney Int 2004;66:1755–1765
- Vachvanishsanong P, Mitarnum W, Tungsinmunkong K, et al. Congenital and infantile nephrotic syndrome in Thai infants. Clin Pediatr 2005;44:169–174
- Besbas N, Bayrakci U, Kale G, et al. Cytomegalovirus-related congenital nephrotic syndrome with diffuse mesangial sclerosis. Pediatr Nephrol 2006;21:740–742
- Haraldsson B, Nyström J, Deen WM. Properties of the glomerular barrier and mechanisms of proteinuria. Physiol Rev 2008;88:451-487
- Licht C, Eifinger F, Gharib M, et al. A stepwise approach to treatment of early onset nephritic syndrome. Pediatr Nephrol 2000;14:1077–1082
- Mahmoodi BK, ten Kate MK, Waanders F, et al. High absolute risks and predictors of venous and arterial thromboembolic events in patients with nephrotic syndrome: results from a large retrospective cohort study. Circulation 2008;117(2):224-230
- Kovacevic L, Reid C, Ridgen S. Management of congenital nephrotic syndrome. Pediatr Nephrol 2003;18:426–430
- Kuusniemi A-M, Qvist E, Sun Y, et al. Plasma exchange and retransplantation in recurrent nephrosis of patients with congenital nephritic syndrome of the Finnish type. Transplantation 2007;83:1316–1323
- Qvist E, Laine J, Rönnholm K, et al. Graft function 5–7 years after renal transplantation in early childhood. Transplantation 1999;67:1043–1049
המידע שבדף זה נכתב על ידי ד"ר גלעד שרמן, פרופ' אבישלום פומרנץ; היחידה למחלות כליה ויתר לחץ דם בילדים, מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק