הבדלים בין גרסאות בדף "Gastric inhibitory polypeptide"
בן עמי סלע (שיחה | תרומות) |
|||
| (5 גרסאות ביניים של 2 משתמשים אינן מוצגות) | |||
| שורה 1: | שורה 1: | ||
| − | ==polypeptide Gastric inhibitory | + | {{בדיקת מעבדה |
| + | |שם עברי={{רווח קשיח}} | ||
| + | |שם לועזי=polypeptide Gastric inhibitory | ||
| + | |קיצור=GIP, glucose-dependent insulinotropic peptide | ||
| + | |תמונה= | ||
| + | |כיתוב תמונה= | ||
| + | |מעבדה= | ||
| + | |תחום=הערכת מצבי [[סוכרת]], [[השמנת יתר]] והערכה תפקודית של פעילות בלוטת ה[[לבלב]] | ||
| + | |יחידות מדידה= | ||
| + | |טווח ערכים תקין=בדם בצום-50-100 פיקוגרם/מ"ל; בדם לאחר ארוחה-110-720 פיקוגרם/מ"ל | ||
| + | |יוצר הערך=[[משתמש:בן עמי סלע|פרופ' בן-עמי סלע]] | ||
| + | |אחראי הערך= | ||
| + | }} | ||
| − | + | ==בסיס פיזיולוגי== | |
| − | |||
| − | |||
| − | |||
| − | + | חלפו למעלה מ-100 שנה מאז התגלית של מושג האינקרטינים (incretins), שפתח לאחר מכן אפשרות של טיפול חדש בחולי [[סוכרת]]. בשנת 1902 פרסמו Bayliss ו-Starling ב-J Physiol, על גילוי secretin, מה שהביא את Moore וחב' להשערה שפורסמה ב-Biochem J בשנת 1906, שתמצית מעי מכילה הורמון המווסת את פעילותו האנדוקרינית של בלוטת הלבלב, ואף הראו שהזרקת תמצית זו הפחיתה את כמות הסוכרים המופרשים בשתן של חולי סוכרת, כנראה על ידי גירוי הפעילות האנדוקרינית של הלבלב. אך רק בשנת 1929 חלה התעוררות בנושא, כאשר La Barre ו-Zunz פרסמו ב-Arch Int Physiol Biochim, שהם ניקו מתמצית מעי את הגורם המפחית גלוקוזה וכינו אותו incretin או INtestine seCRETion Insulin. חלפה תקופה דומה של כמעט שלושים שנה, עד אשר פותחה שיטת RIA לכימות רמת אינסולין בשנות ה-60, ובשנת 1964 הופיעו 2 מאמרים שהראו שהעמסת סוכר באופן פומי, הביאה ליצירה מוגברת יותר של אינסולין מאשר היו מזריקים גלוקוזה ישירות לווריד (Elrick וחב' ב-J Clin Endocrinol Metab משנת 1964, ו-McIntyre וחב' ב-Lancet באותה שנה). כיום מייחסים ממצא זה ל-incretins המופרשים מהמעי לאחר בליעת גלוקוזה אך גם ארוחות עשירות בשומן, מה שמגרה את תאי β בלבלב להפריש יותר אינסולין. | |
| − | + | רק 2 הורמוני מעי כאלה נתגלו עד כה שפועלים כ-incretins, והם GIP או gastric inhibitory polypeptide, ו-GLP-1 או glucagon-like peptide-1. ה-GIP הוא הורמון בן 42 חומצות אמינו שמשקלו המולקולארי 4,944 דלטון, המופרש מתאי K בחלק העליון של המעי הדק באזור התריסריון וה-jejunum הקריבני (פרוקסימאלי), אך ניתן למצוא את GIP לאורך כל המעי (Inagaki וחב' ב-Mol Endocrinol משנת 1989). במקור בודדו GIP בשנת 1970 ממעי של חזיר על ידי Brown וחב' על בסיס יכולתו לעכב הפרשת חומצת קיבה ו-gastrin בכלבים כפי שתואר ב-J Physiol. מאוחר יותר פרסמו Dupre וחב' ב-J Clin Endocrinol Metab משנת 1973 שהזרקת GIP מעודדת הפרשת אינסולין במתנדבים בריאים על ידי פעולה ישירה של הורמון זה על תאי הלבלב להפרשת אינסולין (Adrian וחב' ב-Diabetologia משנת 1978, ו-Taminato וחב' ב-Diabetes משנת 1977). נתונים אלה הצביעו על GIPכעל ה-incretin המקורי, ולאחר מכן יש שכינו אותו glucose-dependent insulinotropic polypeptide. | |
| − | + | הגן ל-GIP אנושי מורכב מ-6 אֶקסונים כאשר רוב המידע המקודד ל-GIP נמצא ב-3 exon, וגן זה ממוקם בזרוע הארוכה של כרומוזום 17 בעמדה 17 q21.3-q22. ביטוי הגן ל-GIP התגלה בקיבה ובתאי K במעי במכרסמים כמו גם באדם, כאשר בחולדות ביטוי גן זה מופיע גם בבלוטת הרוק התת-מנדיבולארית. נמצא שבחולדות, רמת mRNA של GIP, עולה בתריסיון ובבלוטת הרוק לאחר ארוחות המכילות גלוקוזה או עשירות בשומן, אך רמת mRNA זה פוחתת בתגובה לצום ממושך. | |
| − | + | ===ביוסינתזה של GIP=== | |
| − | + | הרצף של חומצות האמינו של GIP בחולדה ובאדם, מצביע על כך שהורמון זה מיוצר מקדם-הורמון (preproGIP) גדול יותר המכיל signal peptide , פפטיד N-טרמינאלי, GIP ופפטיד C-טרמינאלי, על ידי פעילות PC או prohormone convertase 1/3. מחקרים עם עכברי knockout בהם פגום הגן של האנזים PC, וכן ניסויים בתרבית תאים עם פעילות-יתר של PC, הדגימו שהצורה הבשלה והפעילה של GIP, המכילה 42 חומצות אמינו מקורה בקודמן preproGIP המכיל 153 חומצות אמינו, כאשר הביקוע מתבצע ליד שייר ארגינין (Ugleholdt וחב' ב-J Biol Chem משנת 2003). הפפטידים המקוּדדים בתוך המקטעים ה-N-טרמינאלי וה-C-טרמינאלי הם חסרי פעילות ידועה. הרצף של GIP השתמר בצורה בולטת בין מיני בעלי חיים שונים, ורצפי חומצות האמינו של GIP של האדם לבין זה של עכבר, חולדה, חזיר ופרה מראים זהות של למעלה מ-90%. יש עדות מסוימת שגם תאי α בלבלב מסוגלים לייצר כמויות קטנות של preproGIP, שעובר ביקוע על ידי prohormone convertase 2 לייצור הורמון קטום בקצה ה-C טרמינאלי של ה-preproGIP , המוגדר כ-(GIP (1-30, אך אין מידע לגבי פעילות פיזיולוגית של פפטיד זה. | |
| − | |||
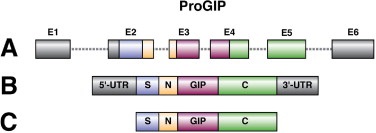
| − | + | [[קובץ:GIP1.jpg|600px|ממוזער|מרכז|A) הגן ל-proGIP; {{כ}} B){{כ}} mRNA של GIP;{{כ}} C) החלבון הפעיל GIP שנוצר מביקוע של הקודמן proGIP, ליד שייר ארגינין.]] | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | [[קובץ:GIP2.jpg|600px|ממוזער|מרכז|הביוסינתזה של GIP]] | |
| − | |||
| − | + | [[קובץ:GIP3.jpg|500px|ממוזער|מרכז|רצף 42 חומצות האמינו של GIP]] | |
| − | |||
| − | + | ===התפקוד של GIP=== | |
| + | במקור נקרא הורמון פפטידי זה gastric inhibitory peptide בגלל יכולתו להפחית את הפרשת חומצת הקיבה בחיות (אם כי לא באדם) (Kim ו-Egan ב-Pharmacol Rev משנת 2008) על מנת להגן על המעי הדק מנזק החומצה, להפחית את קצב העברת המזון דרך הקיבה, ולעכב את התנועתיות (motility) של המעיים. אך לאחרונה מייחסים פעולות אלה ביתר שאת להורמון דומה, secretin. היום מאמינים שתפקידו העיקרי של GIP הוא להשרות הפרשת אינסולין, המושפעת העיקר על ידי היפר-אוסמולריות של גלוקוזה בתריסריון (Thorens ב-Diabète & Métabolisme משנת 1995). לכן יש מעדיפים כיום את כינוי ההורמון כ-glucose-dependent insulinotropic peptide. | ||
| − | + | משערים שיש ל-GIP השפעות משמעותיות על המטבוליזם של חומצות שומן, דרך הגירוי של פעילות האנזים [[lipoprotein lipase]] באדיפוציטים. כמו כן, נמצא ש-GIP מופרש בתגובה להנקה הראשונה של חלב אם (colostrum) בגורי עזים. משיקולים אתיים, הפרשת GIP הודגמה בתינוקות אדם רק בגיל 10 ימים בערך. לאחרונה נמצא שיש ל-GIP תפקיד מרכזי בתהליכי עיצוב (remodeling) של רקמת העצם. Gaudin-Audrain וחב' דיווחו בשנת 2013 ב-Bone שעכברים טרנסגניים עם חסר בקולטן ל-GIP, סבלו משינויים ניכרים במיקרו-ארכיטקטורה, בנפח ובאיכות של העצם הטרבקולארית. ממצאים דומים פורסמו באותו כתב-עת בשנת 2013 על ידי Mieczkowska וחב', כאשר נמצא שאיכות העצם נפגמה והייתה נטייה לשברי עצם בעכברים עם חסר מושרה בקולטן ל-GIP. | |
| − | + | הרלוונטיות של GIP ל[[סוכרת type 2]] הודגמה, כאשר נמצא שחולים בסוג סוכרת זו מגיבים משמעותית פחות ל-GIP, וכן בחולים אלה יש הפרשה פחותה של GIP לאחר ארוחה, בהשוואה לאנשים ללא סוכרת (Skrha וחב' ב-Physiol Res משנת 2010). במחקר עם עכברי knockout, נמצא שחסר בקולטנים ל-GIPכרוך בעמידות להשמנת-יתר (Yamada ו-Seino ב-Hormone & Metabol Res משנת 2004). | |
| − | ( | ||
| − | |||
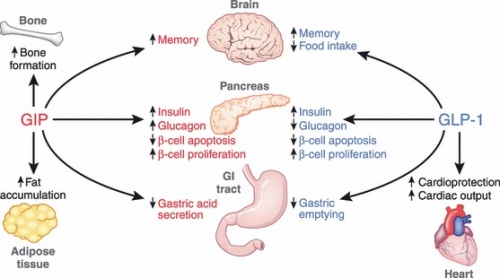
| − | + | [[קובץ:GIP4.jpg|500px|ממוזער|מרכז|'''התפקוד הפנקראטי והחוץ-פנקראטי של GIP בהשוואה ל-GLP-1''':{{ש}}בעוד ש-GIP פועל ישירות על המנגנון האנדוקריני של הלבלב, רקמת עצם, רקמת שומן, מערכת העיכול והמוח, פועל GLP-1 על המנגנון האנדוקריני של הלבלב, מערכת העיכול, הלב, והמוח.]] | |
| − | |||
| − | |||
| − | + | ===הפרשה, מטבוליזם ופינוי של GIP=== | |
| + | GIP מיוצר ומופרש מתאי K בתריסריון וב-jejunum הקריבני, עם פעילות סינתטית והפרשתית נמוכה יותר לאורך המעי הדק כולו (Mortensen וחב' ב-Regu Pept משנת 2003, ו-Butchan וחב' ב-Histochemistry משנת 1978). GIP מופרש בתגובה לקליטת מזון, בעיקר גלוקוזה או שומן. באופן ספציפי יותר, הפרשת GIP מושפעת יותר מקצב ספיגת המזון מאשר מנוכחות מזון במעי. לכן, הפרשת GIP פוחתת באנשים עם בעיות ספיגה, או לאחר נטילת תכשירים האמורים להפחית את הספיגה (Besterman וחב' ב-BMJ משנת 1979, ו-Fushiki וחב' ב-J Nutr משנת 1992). בעוד שמזון שומני הוא גריין יעיל יותר של הפרשת GIP באדם, פחמימות יותר יעילות בגירוי הפרשה זו במכרסמים ובחזירים. באדם, הרמה הבסיסית של GIP בפלזמה היא מתחת ל-50 פיקוגרם/מ"ל, והיא עולה לאחר ארוחה לרמה של עד 720 פיקוגרם/מ"ל בתלות בסוג וכמות המזון בארוחה (Orskov וחב' ב-Scand J Gastroenterol משנת 1996, ו-Vilsbøll וחב' ב-Diabetes משנת 2001). רמות GIP בפלזמה דומות או מוגברות אך במקצת בחולים עם סוכרת type 2 בהשוואה לזו באנשים בריאים (Ross וחב' ב-Diabetes משנת 1977). | ||
| − | GIP פועל על ידי התקשרות לקולטן ספציפי GIPR ששובט במקור מספריית cDNA מקליפת המוח של חולדה, ולאחר מכן שובט ממקור אוגר ואדם. הגן של הקולטן האנושי ל-GIP מכיל 14 exons ש"אורכם" | + | |
| + | [[קובץ:GIP5.jpg|500px|ממוזער|מרכז|'''הפרשה ומטבוליזם של GIP בהשוואה ל-GLP-1''':{{ש}}הפפטיד GIP מופרש מתאי K בחלק העליון של המעי הדק. בעוד ש-GLP-1 מופרש מתאי L בחלק התחתון של המעי הדק. מיד לאחר הפרשתם שני הפפטידים עוברים הידרוליזה על ידי האנזים DPP-4, מאבדים את פעילותם ומופרשים דרך הכליות. הפפטידים שנותרו שלמים ופעילים, משפיעים על תאי β בלבלב, ואלה מייצרים ומפרישים אינסולין.]] | ||
| + | |||
| + | |||
| + | [[קובץ:GIP6.jpg|500px|ממוזער|מרכז|'''שני incretins פעילים ביולוגית''':{{ש}}GLP-1 (7-36)amide ו- (1-42) GIP, מופרשים מהמעי הדק לאחר ארוחה, ומעודדים הפרשת אינסולין תלויית-גלוקוזה. האנזים DPP-4 פועל במהירות להסב את 2 ה-incretins לפפטידים בלתי פעילים (9-36) GLP-1 ו-(3-42) GIP. מעכב האנזים DPP-4 דוגמת sitagliptin מונע את האינאקטיבציה של פעילות 2 ה-incretins.]] | ||
| + | |||
| + | |||
| + | תקופת מחצית החיים של GIP היא פחות מ-2 דקות במכרסמים (Kieffer וחב' ב-Endocrinology משנת 1995), ואילו בבני-אדם בריאים תקופת מחצית החיים היא של 7 דקות, כאשר בחולי סוכרת type 2 היא בת 5 דקות (Deacon וחב' ב-J Clin Endocrinol Metabol משנת 2000). תקופת מחצית החיים של GIP בצורתו הקטומה (לאחר הסרת 2 חומצות האמינו פרולין ואלנין בקצה ה-N טרמינאלי על ידי DPP-4) מתארכת עד כדי 17 דקות (Vilsbøll וחב' ב-Regul Pept משנת 2006). | ||
| + | |||
| + | שייר אלנין בעמדה 2 של רצף חומצות האמינו של GIP, מהווה יעד פעולה של DPP-4 או Dipeptidyl peptidase-4, שהוא האנזים הגורם לאינאקטיבציה של (1-42) GIP על ידי הפיכתו למטבוליט הבלתי-פעיל (GIP(3-42, המאבד את תכונותיו האינסולינוטרופיות (Deacon וחב' ב-J Clin Endocrinol Metabמשנת 2000). אנזים זה ממוקם בממברנות brush-border של המעי והכליות, אך ניתן למצוא אותו גם על פני קפילארות, ובצורה מסיסה בפלזמה (Mentlain ב-Regul Pept משנת 1999). | ||
| + | |||
| + | פעילות זו של DPP-4 כאנזים העיקרי הפוגע בפעילות GIP הודגמה היטב במכרסמים ובבני-אדם בריאים או סוכרתיים. התצפיות לפיהן רמות GIP בפלזמה מוגברות באנשים הסובלים מ-uremia או באלה עם מחלת כליות כרונית, כמו גם הממצאים על פינוי משובש של GIP בחולדות שעברו nephrectomy, מצביעים על הכליות כאיבר דרכו מתבצע רוב הפינוי (clearance) של GIP (על פי Meier וחב' ב-Diabetes משנת 2004). מחקרים של Deacon וחב' ב-Diabetes משנת 2001 מראים שגם לכבד יש תפקיד בספיגת GIP מהדם, ואילו Vilsbøll וחב' דיווחו ב-Regul Pept משנת 2006, שקצב הפינוי של GIPשלם ושל המטבוליטים שלו דומים בין אנשים בריאים לבין אנשים שמנים עם סוכרת type 2. | ||
| + | |||
| + | ===הקולטן ל-GIP=== | ||
| + | |||
| + | GIP פועל על ידי התקשרות לקולטן ספציפי GIPR ששובט במקור מספריית cDNA מקליפת המוח של חולדה, ולאחר מכן שובט ממקור אוגר ואדם. הגן של הקולטן האנושי ל-GIP מכיל 14 exons ש"אורכם" 14kb (ע"פ Yamada וחב' ב-Genomics משנת 1995), והוא ממוקם בכרומוזום 19 בעמדה q13.3. הקולטן ל-GIP באדם מכיל 466 חומצות אמינו, אך יש גם איזופורם של קולטן ל-GIP עם 493 חומצות אמינו. הגן ל-GIPR בא לביטוי בבלוטת הלבלב, בקיבה, במעי הדק, ברקמת השומן, בקורטקס של האדרנל, בבלוטת יותרת המוח (היפופיזה), בלב, באשכים, בתאים אנדותליאליים, ברקמת העצם, בטרכיאה, בטחול, בבלוטת ההרת (תימוס), בריאות, בכליות בבלוטת התריס (תירואיד), ובאזורים אחדים של מערכת העצבים המרכזית (Asmar ב-Dan Med Bull משנת 2011). יחד עם זאת, לא ברורה עדיין המשמעות של תוצאות השפעול של קולטנים חוץ-פנקראטיים אלה. | ||
הקולטן של GIP הוא חבר במשפחת העל של קולטנים החוצים את הממברנה באופן מפותל 7 פעמים, שהם בעלי מבנה הֶטֶרוֹ-טרימרי והם קשורים לחלבוני G בציטופלזמה (Usdin וחב' ב-Endocrinology משנת 1993). מעט יחסית ידוע על הגורמים האחראיים לוויסות ביטויו של הקולטן ל-GIP, אך ידוע רמות ה-mRNA של GIPR ושל חלבון הקולטן עצמו, נמוכות יותר באיי הלבלב של חולדות סוכרתיות, מה שנכון גם לבני אדם (Lynn וחב' ב-Diabetes משנת 2001). | הקולטן של GIP הוא חבר במשפחת העל של קולטנים החוצים את הממברנה באופן מפותל 7 פעמים, שהם בעלי מבנה הֶטֶרוֹ-טרימרי והם קשורים לחלבוני G בציטופלזמה (Usdin וחב' ב-Endocrinology משנת 1993). מעט יחסית ידוע על הגורמים האחראיים לוויסות ביטויו של הקולטן ל-GIP, אך ידוע רמות ה-mRNA של GIPR ושל חלבון הקולטן עצמו, נמוכות יותר באיי הלבלב של חולדות סוכרתיות, מה שנכון גם לבני אדם (Lynn וחב' ב-Diabetes משנת 2001). | ||
| − | שפעול של איתות המועבר דרך GIPR קשור לשדרוג פעילות האנזים adenylyl cyclase ולעליות ברמת cAMP ויוני סידן תוך תאי, כמו גם לשפעול של החלבונים p38 MAPK, PKB, PKA, PI-3K ו-פוספוליפאז A2 (על פי McIntosh וחב' ב-Vitam Horm משנת 2009). ניסויים in-vitro העלו שהקצה ה-N-טרמינאלי של GIPR והלולאה החוץ תאית הראשונה של GIPR חיוניים לזיקה הגבוהה של קישור של GIP לקולטן שלו, בעוד שחלקים מהקצה ה-N טרמינאלי בנוסף למקטע (domain) הטרנס-ממברנאלי חיוניים לשפעול הקולטן ולצימוד של cAMP. למרות שרוב רצף חומצות האמינו בקצה ה-C טרמינאלי של GIPR נראה מיותר לאיתות התוך-תאי, רצף מינימאלי של הקולטן הכולל 405 חומצות אמינו נדרש להעברה יעילה של האיתות לאחר קישור | + | שפעול של איתות המועבר דרך GIPR קשור לשדרוג פעילות האנזים adenylyl cyclase ולעליות ברמת cAMP ויוני סידן תוך תאי, כמו גם לשפעול של החלבונים p38 MAPK, PKB, PKA, PI-3K ו-פוספוליפאז A2 (על פי McIntosh וחב' ב-Vitam Horm משנת 2009). ניסויים in-vitro העלו שהקצה ה-N-טרמינאלי של GIPR והלולאה החוץ תאית הראשונה של GIPR חיוניים לזיקה הגבוהה של קישור של GIP לקולטן שלו, בעוד שחלקים מהקצה ה-N טרמינאלי בנוסף למקטע (domain) הטרנס-ממברנאלי חיוניים לשפעול הקולטן ולצימוד של cAMP. למרות שרוב רצף חומצות האמינו בקצה ה-C טרמינאלי של GIPR נראה מיותר לאיתות התוך-תאי, רצף מינימאלי של הקולטן הכולל 405 חומצות אמינו נדרש להעברה יעילה של האיתות לאחר קישור GIP לקולטן שלו. Wheeler וחב' דיווחו ב-J Biol Chem משנת 1999, ששיירי serine 406 ו-411 בקצה ה-C טרמינאלי חיוניים לנטרול (desensitization) פעולת הקולטן, בעוד ששיירי serine 426 ו-427 חיוניים לתהליך החדרת הקולטן לאחר קישורו של GIP. |
| + | |||
| + | ===הפעילויות הביולוגיות של GIP=== | ||
| − | + | הפעילות של GIP על תאי β בלבלב אנלוגית לזו של GLP-1, ל-GIP יש גם פעילות פיזיולוגית ייחודית ברקמות חוץ-פנקראטיות. | |
| − | |||
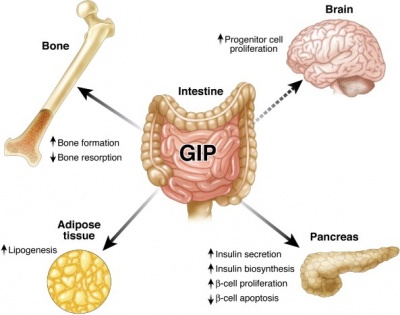
| − | + | [[קובץ:GIP7.jpg|400px|ממוזער|מרכז|פעילות GIP ברקמות היקפיות.]] | |
| − | |||
| − | התפקיד הפיזיולוגי העיקרי של GIP היא פעילותו כ-incretin, דהיינו בהתקשרות לקולטניו על פני תאי β בלבלב, ובעידוד הפרשת אינסולין. המנגנונים המולקולאריים האחראיים להפרשת אינסולין בהשפעת GIP, חופפים באופן משמעותי את אלה המושפעים על ידי GLP-1, וכוללים הגדלת ריכוז cAMP, עיכוב תעלות KATP, עלייה ברמות התוך-תאיות של יוני סידן וגירויי של exocytosis (על פי Ding וחב' ב-Diabetes משנת 1997). הגירוי על ידי GIP להפרשת אינסולין, מסתייע על ידי שפעול של 2 הצמדים, AMP/Protein kinase A ו- cAMP/Epac2, בנוסף לשפעול של phospholipase A2 ומסלולי איתות ספציפיים של פרוטאין קינאז (Kashima וחב' ב- J Biol Chem משנת 2001, ו-Ehses וחב' ב-J Biol Chem משנת 2002). כמו כן, GIP מגביר את השעתוק של הגן לאינסולין ואת הביוסינתזה של הורמון זה בתאי β וכן את הביטוי של החיישנים לגלוקוזה על פני תאים אלה (Wang וחב' ב-Mol Cell Endocrinol משנת 1996). | + | ===בלוטת הלבלב=== |
| + | |||
| + | התפקיד הפיזיולוגי העיקרי של GIP היא פעילותו כ-incretin, דהיינו בהתקשרות לקולטניו על פני תאי β בלבלב, ובעידוד הפרשת אינסולין. המנגנונים המולקולאריים האחראיים להפרשת אינסולין בהשפעת GIP, חופפים באופן משמעותי את אלה המושפעים על ידי GLP-1, וכוללים הגדלת ריכוז cAMP, עיכוב תעלות KATP, עלייה ברמות התוך-תאיות של יוני סידן וגירויי של exocytosis (על פי Ding וחב' ב-Diabetes משנת 1997). הגירוי על ידי GIP להפרשת אינסולין, מסתייע על ידי שפעול של 2 הצמדים, AMP/Protein kinase A ו-cAMP/Epac2, בנוסף לשפעול של phospholipase A2 ומסלולי איתות ספציפיים של פרוטאין קינאז (Kashima וחב' ב- J Biol Chem משנת 2001, ו-Ehses וחב' ב-J Biol Chem משנת 2002). כמו כן, GIP מגביר את השעתוק של הגן לאינסולין ואת הביוסינתזה של הורמון זה בתאי β וכן את הביטוי של החיישנים לגלוקוזה על פני תאים אלה (Wang וחב' ב-Mol Cell Endocrinol משנת 1996). | ||
החשיבות הפיזיולוגית של GIP כ-incretin, מודגמת על ידי פגיעה בפעילות הורמון זה in vivo. ביטול האיתות העובר דרך הקולטן GIPR על ידי שימוש באנטגוניסטים או בנוגדנים המכוונים כנגד GIPR, או על ידי אינאקטיבציה ממוקדת של הגן ל-GIPR בעכברים טרנסגניים (-/-GIPR), גורמים לעמידות פגומה למתן פומי של גלוקוזה, כמו גם להפרשה משובשת של אינסולין הצפויה בעקבות מתן גלוקוזה (Tseng וחב' ב-J Clin Invest משנת 1996, וכן Lewis וחב' ב-Endocrinology משנת 2000 ו-Miyawaki וחב' ב-Proc Natl Acad Sci USA משנת 1999). | החשיבות הפיזיולוגית של GIP כ-incretin, מודגמת על ידי פגיעה בפעילות הורמון זה in vivo. ביטול האיתות העובר דרך הקולטן GIPR על ידי שימוש באנטגוניסטים או בנוגדנים המכוונים כנגד GIPR, או על ידי אינאקטיבציה ממוקדת של הגן ל-GIPR בעכברים טרנסגניים (-/-GIPR), גורמים לעמידות פגומה למתן פומי של גלוקוזה, כמו גם להפרשה משובשת של אינסולין הצפויה בעקבות מתן גלוקוזה (Tseng וחב' ב-J Clin Invest משנת 1996, וכן Lewis וחב' ב-Endocrinology משנת 2000 ו-Miyawaki וחב' ב-Proc Natl Acad Sci USA משנת 1999). | ||
| − | כמו כן | + | כמו כן GIP פועל בסינרגיזם עם גלוקוזה לעודד שגשוג תאים ולשפר את הישרדותם של תאי β פנקריאטיים, והשפעה הגנתית זו על תאי β ניתנת להדגמה באיי לנגרהנס של עכברי בר תקינים, אך לא בעכברים הומוזיגוטיים טרנסגניים מסוג -/-GIPR (ע"פ Kim וחב' ב-J Biol Chem משנת 2005). מנגנוני האיתות המולקולאריים המתווכים בהשפעה של GIP על שגשוג תאים דרך פעילות אנטי-אפופטוטית פוענחו על ידי שימוש בתאים הטרולוגיים שעברו טרנספקציה עם GIPR, בשורת תאי β של מכרסמים, באיי פנקריאס של עכברים, וכללו שפעול של מסלולי cAMP/PKA, וכן של ו-PKA/CREB ו-p38MAPK (על פי Trumper וחב' ב-Mol Endocrinol משנת 2001, ו-Ehses וחב' ב- Endocrinology משנת 2003). |
| − | ניסויים עם חולדות סוכרתיות מזן ZDF הראו שעירוי של GIP למשך שבועיים, הפחית משמעותית את האפופטוזיס בתאי β בלבלב על ידי שפעול של Akt-PKB בתלות ב-PI-3K, וכן שפעול הפוספורילציה והרחקה מגרעין התא של FoxO1, מה שגורם להפחתת ביטויו של הגן מקדם האפופטוזיס Bax, הפחתה בפעילות caspase 3 (אנזים המפתח בתהליך האפופטוזיס), כמו גם דיכוי השעתוק של הגן ל-bax (חלבון מקדם אפופטוזיס נוסף), ולעומת זאת שדרוג בפעולת הגן של החלבון האנטי-אפופטוטי bcl-2 (על פי Kim וחב' ב-J Biol Chem משנת 2005). כמו כן, נמצא ש-GIP מפחית את רמת סמנים ביוכימיים הקשורים לעקה של הרטיקולום האנדופלזמי (ER) בשורת תאים של איי הלבלב לאחר השריית עקה זו של ה-ER בתנאי תרבית תאים (Yusta וחב' ב-Cell Metab משנת 2006). ניתן לומר שהפעילות האינסולינו-טרופית של GIP פחותה בחולדות היפר-גליקמיות, לפחות באופן חלקי בגלל הביטוי המופחת של הקולטן ל-GIP בחולדות אלה (Lynn וחב' ב-Diabetes משנת 2001). | + | ניסויים עם חולדות סוכרתיות מזן ZDF הראו שעירוי של GIP למשך שבועיים, הפחית משמעותית את האפופטוזיס בתאי β בלבלב על ידי שפעול של Akt-PKB בתלות ב-PI-3K, וכן שפעול הפוספורילציה והרחקה מגרעין התא של FoxO1, מה שגורם להפחתת ביטויו של הגן מקדם האפופטוזיס Bax, הפחתה בפעילות caspase 3 (אנזים המפתח בתהליך האפופטוזיס), כמו גם דיכוי השעתוק של הגן ל-bax (חלבון מקדם אפופטוזיס נוסף), ולעומת זאת שדרוג בפעולת הגן של החלבון האנטי-אפופטוטי bcl-2 (על פי Kim וחב' ב-J Biol Chem משנת 2005). כמו כן, נמצא ש-GIP מפחית את רמת סמנים ביוכימיים הקשורים לעקה של הרטיקולום האנדופלזמי (ER) בשורת תאים של איי הלבלב לאחר השריית עקה זו של ה-ER בתנאי תרבית תאים (Yusta וחב' ב-Cell Metab משנת 2006). ניתן לומר שהפעילות האינסולינו-טרופית של GIP פחותה בחולדות היפר-גליקמיות, לפחות באופן חלקי בגלל הביטוי המופחת של הקולטן ל-GIP בחולדות אלה (Lynn וחב' ב-Diabetes משנת 2001). |
| − | פעילות GIP במערכת העצבים המרכזית | + | ===פעילות GIP במערכת העצבים המרכזית=== |
| − | ב-CNS, ניתן למצוא ביטוי של | + | ב-CNS, ניתן למצוא ביטוי של GIP בהיפוקמפוס, בתאי Purkinje במוחון וב-olfactory bulb (על פי Nyberg וחב' ב-J Neurosci Res משנת 2007). קולטנים ל-GIP אותרו באזורי מוח אחדים כולל בקליפת המוח, בהיפוקמפוס, ב-olfactory bulb (על פי Kaplan ו-Vigna ב-Peptides משנת 1994, ו-Usdin וחב' ב-Endocrinology משנת 1993). עירוי של GIP אקסוגני למוח חולדות, השרתה שגשוג של תאים פרוגניטורים בהיפוקמפוס in vivo כמו גם בתאים פרוגניטרים מההיפוקמפוס בתנאי תרבית תאים (Nyberg וחב' ב-J Neurosci משנת 2005). לעומת זאת, עכברים טרנסגניים בוגרים (-/-GIPR), עם פגיעה מושרית בקולטן ל-GIP, הכילו מספר קטן משמעותית של תאים פרוגניטורים חדשים ב-dentate gyrus של ההיפוקמפוס. כמו כן, עכברים טרנסגניים המבטאים ביתר את הקולטן GIPR, מפגינים קואורדינציה תחושתית-מוטורית משופרת, כמו גם שיפור בממדי זיכרון בהשוואה לעכברים wild-type. |
| − | נראה אם כן שהביטוי של GIPR בתאי עצב פרוגניטורים ב-dentate gyrous של ההיפוקמפוס, מצביעים על מעורבות אפשרית של GIP הוויסות של נוירוגנזה ובתפקוד הזיכרון. באופן הצפוי על יסוד ההשפעה השגשוגית של GIP על תאי פרוגניטור עצביים, השפעול של GIPR על ידי אנאלוגים של GIP, מעודד יצירת LTP (או long-term potentiation) בהיפוקמפוס, ואילו עיכוב ביטוי GIPR על ידי אנטגוניסט של GIP דוגמת Pro3)GIP), מפחית את ה-LTP (על פי Gault וחב' ב-J Neurophysiol | + | נראה אם כן שהביטוי של GIPR בתאי עצב פרוגניטורים ב-dentate gyrous של ההיפוקמפוס, מצביעים על מעורבות אפשרית של GIP הוויסות של נוירוגנזה ובתפקוד הזיכרון. באופן הצפוי על יסוד ההשפעה השגשוגית של GIP על תאי פרוגניטור עצביים, השפעול של GIPR על ידי אנאלוגים של GIP, מעודד יצירת LTP (או long-term potentiation) בהיפוקמפוס, ואילו עיכוב ביטוי GIPR על ידי אנטגוניסט של GIP דוגמת Pro3) GIP), מפחית את ה-LTP (על פי Gault וחב' ב-J Neurophysiol משנת 2008). לעומת זאת, עכברים טרנסגניים עם ביטוי-יתר של GIP, מראים שיפור בביצוע משימות הכרוכות בזיכרון (Ding וחב' ב-Peptides משנת 2006). פעילות נוספת של GIP במוח קשורה לוויסות תחושות התיאבון והשובע. |
| − | GIP ורקמת שומן | + | ===GIP ורקמת שומן=== |
| − | קולטני GIPR פונקציונאליים מבוטאים על פני אדיפוציטים מבודדים מחולדות ועל פני תאי 3T3-L1 (על פי Yip וחב' ב-Endocrinology | + | קולטני GIPR פונקציונאליים מבוטאים על פני אדיפוציטים מבודדים מחולדות ועל פני תאי 3T3-L1 (על פי Yip וחב' ב-Endocrinology משנת 1998). כיוון שכך, יש הקושרים את GIP לפיקוח על המטבוליזם של שומן, ולהתפתחות של השמנת-יתר. קליטת שומן מהמזון היא גריין משמעותי של הפרשת GIP באדם, ורמות GIP בפלזמה עולות בחלק מחולי סוכרת type 2 כבדי המשקל (על פי Creutzfeldt וחב' ב-Diabetologia משנת 1978, ו-Salera וחב' ב-J Clin Endocrinol Metab משנת 1982). ההשפעה האנאבולית של GIP על רקמת השומן, כוללת גירוי של סינתזה של חומצות שומן ו-רה-אסטריפיקציה שלהן עידוד של החדרת חומצות שומן לתוך טריגליצרידים המושרית על ידי אינסולין, שדרוג הסינתזה של האנזים lipoprotein lipase, הגברת הזיקה של אינסולין לקולטנים שלו, והפחתה בתהליכים ליפוליטיים המושרים על ידי glucagon. יחד עם זאת, יש ל-GIP כנראה גם השפעות ליפוליטיות, אם כי אלה שנויות במחלוקת (Yip ו-Wolfe ב-Life Sci משנת 2000). עכברים טרנסגניים (-/-GIPR), מראים עמידות להשמנת-יתר הנובעת מקליטת מזון, תוך שהם מראים מסת שומן מופחתת, למרות מספר חודשים של האכלתם בדיאטה עתירת-שומן (Miyawaki וחב' ב-Nat Med משנת 2002). |
הוספת GIP נמצאה מגבירה את פינוי כילומיקרונים בכלבים (Wasada וחב' ב-J Clin Invest משנת 1981), מפחיתה את רמת טריגליצרידים לאחר ארוחה בחולדות (Ebert וחב' ב-Horm Metab Res משנת 1991) ומגבירה טרנספורט של גלוקוזה וסינתזת חומצות שומן ב-explants של רקמת שומן מחולדות (Knapper וחב' ב-J Nutr משנת 1995, ו-Oben וחב' ב-J Endocrinol משנת 1991). בנוסף, נראה ש-GIP מגביר את רגישות אדיפוציטים לאינסולין, ובכך מעודד קליטת גלוקוזה וחומצות שומן לאגירה בתאים אלה. | הוספת GIP נמצאה מגבירה את פינוי כילומיקרונים בכלבים (Wasada וחב' ב-J Clin Invest משנת 1981), מפחיתה את רמת טריגליצרידים לאחר ארוחה בחולדות (Ebert וחב' ב-Horm Metab Res משנת 1991) ומגבירה טרנספורט של גלוקוזה וסינתזת חומצות שומן ב-explants של רקמת שומן מחולדות (Knapper וחב' ב-J Nutr משנת 1995, ו-Oben וחב' ב-J Endocrinol משנת 1991). בנוסף, נראה ש-GIP מגביר את רגישות אדיפוציטים לאינסולין, ובכך מעודד קליטת גלוקוזה וחומצות שומן לאגירה בתאים אלה. | ||
| שורה 86: | שורה 103: | ||
זאת ועוד, עכברי -/-ob/ob:GIPR עולים פחות במשקלם, הם בעלי רקמת שומן מצומצמת יותר, ומגיבים טוב יותר לעודף גלוקוזה, על ידי רגישות רבה יותר לאינסולין, בהשוואה לעכברי ob/ob. למרות שצריכת המזון דומה בין עכברי -/-GIPR לבין עכברי wild-type, כאשר מאכילים אותם במזון עתיר-שומן, עכברי -/-GIPR מוציאים יותר אנרגיה, ולכן הם משתמשים בשומן כמצע אנרגיה מועדף, ולפיכך נמנעת אגירת שומן באדיפוציטים שלהם. בעכברי ob/ob עירוי כרוני של אנטגוניסט לקולטן GIPR דוגמת Pro3)GIP) משפר את הסבילות לגלוקוזה, מגביר את הרגישות לאינסולין, ומתקן את ההיפרטרופיה של תאי הלבלב המושרית על ידי השמנת-יתר, כמו גם את ההיפרפלזיה של תאי β (על פי Gault וחב' ב-Diabetes משנת 2005). | זאת ועוד, עכברי -/-ob/ob:GIPR עולים פחות במשקלם, הם בעלי רקמת שומן מצומצמת יותר, ומגיבים טוב יותר לעודף גלוקוזה, על ידי רגישות רבה יותר לאינסולין, בהשוואה לעכברי ob/ob. למרות שצריכת המזון דומה בין עכברי -/-GIPR לבין עכברי wild-type, כאשר מאכילים אותם במזון עתיר-שומן, עכברי -/-GIPR מוציאים יותר אנרגיה, ולכן הם משתמשים בשומן כמצע אנרגיה מועדף, ולפיכך נמנעת אגירת שומן באדיפוציטים שלהם. בעכברי ob/ob עירוי כרוני של אנטגוניסט לקולטן GIPR דוגמת Pro3)GIP) משפר את הסבילות לגלוקוזה, מגביר את הרגישות לאינסולין, ומתקן את ההיפרטרופיה של תאי הלבלב המושרית על ידי השמנת-יתר, כמו גם את ההיפרפלזיה של תאי β (על פי Gault וחב' ב-Diabetes משנת 2005). | ||
| − | יחד עם זאת, עכברי -/-GIPR שניזונו על דיאטת chow נורמאלית, מראים חוסר סבילות לגלוקוזה, והחדרה של Pro3)GIP) פוגעת בסבילות לגלוקוזה בעכברי wild-type (על פי Irwin וחב' ב-Biol Chem משנת 2004). בנוסף, שפעול של GIPR כרוך עם שיפור בסבילות לגלוקוזה, ומגביר הפרשת אינסולין במודלים של סוכרת בחיות. לכן, למרות שחולים בסוכרת type 2 עמידים באופן יחסי להשפעות האינסולינוֹ-טרופיות של החדרה אקסוגנית של GIP, ואין קשר ישיר בין השמנת-יתר ו-GIP בבני-אדם, יש לשקול את היתרונות היחסיים של שפעול לעומת עיכוב של GIPR, בכל ניסיון בעתיד לשימוש תרפויטי של GIP או של האנלוגים שלו. | + | יחד עם זאת, עכברי -/-GIPR שניזונו על דיאטת chow נורמאלית, מראים חוסר סבילות לגלוקוזה, והחדרה של Pro3) GIP) פוגעת בסבילות לגלוקוזה בעכברי wild-type (על פי Irwin וחב' ב-Biol Chem משנת 2004). בנוסף, שפעול של GIPR כרוך עם שיפור בסבילות לגלוקוזה, ומגביר הפרשת אינסולין במודלים של סוכרת בחיות. לכן, למרות שחולים בסוכרת type 2 עמידים באופן יחסי להשפעות האינסולינוֹ-טרופיות של החדרה אקסוגנית של GIP, ואין קשר ישיר בין השמנת-יתר ו-GIP בבני-אדם, יש לשקול את היתרונות היחסיים של שפעול לעומת עיכוב של GIPR, בכל ניסיון בעתיד לשימוש תרפויטי של GIP או של האנלוגים שלו. |
| − | התפקיד הפיזיולוגי של GIP בהצטברות שומן | + | ===התפקיד הפיזיולוגי של GIP בהצטברות שומן=== |
| − | שומן מגביר באופן ניכר הפרשת GIP (על פי Carr וחב' ב-Am J Physiol Endocrinol Metab , ו-Thomsen וחב' ב-Am J Clin Nutr משנת 1999) וכמו כן רמות GIP מוגברות בחולי סוכרת type 2 כבדי משקל. קיים מתאם טוב בין רמות GIP בפלזמה לבין ריכוזי טריגליצרידים (Elliotte וחב' ב-J Endocrinol משנת 1993). הייתה השערה ש-GIP הוא בעל תפקיד פיזיולוגי בהצטברות שומן באדיפוציטים, ובתחילת שנות ה-80 נעשה ניסוי שהראה ש-GIP בנוכחות אינסולין משרה החדרה של חומצות שומן תוך בלוטות השמן בעקבי חולדות (Beck ו-Max ב-Regul Pept משנת 1983). כמו כן, כאשר בעכברים כבדי-משקל (ob/ob) כתוצאה מפגם בגן של leptin, מניפולציה גנטית של פגיעה ב-GIPR הביאה לא רק לשיפור של בעיית עודף המשקל על ידי הגברת "שריפת" אנרגיה, אלא גם הגבירה את הרגישות לאינסולין ואת הסבילות לגלוקוזה, ללא פגיעה קשה בהפרשת אינסולין (Zhang וחב' ב-Nature משנת 1994, וכן Vilsbøll וחב' ב-Diabetologia משנת 2002 ו-Yamada וחב' ב-Diabetes משנת 2006). | + | שומן מגביר באופן ניכר הפרשת GIP (על פי Carr וחב' ב-Am J Physiol Endocrinol Metab , ו-Thomsen וחב' ב-Am J Clin Nutr משנת 1999) וכמו כן רמות GIP מוגברות בחולי סוכרת type 2 כבדי משקל. קיים מתאם טוב בין רמות GIP בפלזמה לבין ריכוזי טריגליצרידים (Elliotte וחב' ב-J Endocrinol משנת 1993). הייתה השערה ש-GIP הוא בעל תפקיד פיזיולוגי בהצטברות שומן באדיפוציטים, ובתחילת שנות ה-80 נעשה ניסוי שהראה ש-GIP בנוכחות אינסולין משרה החדרה של חומצות שומן תוך בלוטות השמן בעקבי חולדות (Beck ו-Max ב-Regul Pept משנת 1983). כמו כן, כאשר בעכברים כבדי-משקל (ob/ob) כתוצאה מפגם בגן של leptin, מניפולציה גנטית של פגיעה ב-GIPR הביאה לא רק לשיפור של בעיית עודף המשקל על ידי הגברת "שריפת" אנרגיה, אלא גם הגבירה את הרגישות לאינסולין ואת הסבילות לגלוקוזה, ללא פגיעה קשה בהפרשת אינסולין (Zhang וחב' ב-Nature משנת 1994, וכן Vilsbøll וחב' ב-Diabetologia משנת 2002 ו-Yamada וחב' ב-Diabetes משנת 2006). |
תצפיות אלו אושרו בעכברים שהוזנו בדיאטה עתירת-שומן וכן בעכברים שמנים ob/ob, שטופלו באנטגוניסט Pro3)GIP) של הקולטן ל-GIP (ע"פ Gault וחב' ב-Diabetologia משנת 2008, וכן Irwin וחב' באותו כתב עת משנת 2007), כמו גם בעכברים טרנסגניים החסרים תאי K מפרישי GIP (ע"פ Althage וחב' ב-J Biol Chem משנת 2008). | תצפיות אלו אושרו בעכברים שהוזנו בדיאטה עתירת-שומן וכן בעכברים שמנים ob/ob, שטופלו באנטגוניסט Pro3)GIP) של הקולטן ל-GIP (ע"פ Gault וחב' ב-Diabetologia משנת 2008, וכן Irwin וחב' באותו כתב עת משנת 2007), כמו גם בעכברים טרנסגניים החסרים תאי K מפרישי GIP (ע"פ Althage וחב' ב-J Biol Chem משנת 2008). | ||
| שורה 96: | שורה 113: | ||
למרות ש-GIP נמצא מגביר את פעילות lipoprotein lipase, אנזים הקשור לממברנת תאים אדיפוציטים, ואשר תפקידו לבצע הידרוליזה של טריגליצרידים הקשורים לליפופרוטאין על מנת לייצר חומצות שומן, המנגנון המולקולארי דרכו GIP פועל על אדיפוציטים אינו ברור דיו. Kim וחב' דיווחו בשנת 2007 ב-J Biol Chem, שקישור GIP לקולטניו על פני תאי 3T3-L1 גורם להפרשה מוגברת של resistin במסלול הקשור ל-p38 MAPK ו-SAPK/JNK. אותם חוקרים הראו גם ש-GIP משפעל את PI3K ואת Akt/PKB על ידי הפרשת resistin, ועל ידי כך הוא מדכא את AMPK ומגביר את פעילות lipoprotein lipase וליפוגנזה באדיפוציטים. | למרות ש-GIP נמצא מגביר את פעילות lipoprotein lipase, אנזים הקשור לממברנת תאים אדיפוציטים, ואשר תפקידו לבצע הידרוליזה של טריגליצרידים הקשורים לליפופרוטאין על מנת לייצר חומצות שומן, המנגנון המולקולארי דרכו GIP פועל על אדיפוציטים אינו ברור דיו. Kim וחב' דיווחו בשנת 2007 ב-J Biol Chem, שקישור GIP לקולטניו על פני תאי 3T3-L1 גורם להפרשה מוגברת של resistin במסלול הקשור ל-p38 MAPK ו-SAPK/JNK. אותם חוקרים הראו גם ש-GIP משפעל את PI3K ואת Akt/PKB על ידי הפרשת resistin, ועל ידי כך הוא מדכא את AMPK ומגביר את פעילות lipoprotein lipase וליפוגנזה באדיפוציטים. | ||
| − | + | אגוניסט אחר של GIPR, הידוע כ-(D-Ala2GIP (1-30 מראה פעילות דומה לזו של (1-42) GIP על התפקוד וההישרדות של תאי בתא, אך יש לו השפעה פחותה בהרבה על פעילות lipoprotein lipase בתאי 3T3-L1 (ע"פ Widenmaiser וחב' ב-PLoS ONE משנת 2010). | |
| − | |||
| − | |||
| + | ===GIP ורקמת עצם=== | ||
האפשרות ש-GIP במטבוליזם של רקמת עצם הועלתה על ידי Tsukiyama וחב' ב-Mol Endocrinol משנת 2006, שהראו שלעכברים החסרים GIPR טרבקולות העצם (כפיסונים) דקות יותר מה שאופייני לאוסטיאופורוזיס. חוקרים אלה הדגימו על ידי אנליזה היסטו-פוטומטרית, שיצירת רקמת עצם בעכברים אלה ירודה יותר, ומספר האוסטיאוקלסטים גדול יותר כאופייני לתהליכי אוסטיאופורוזיס. כן הודגם in vitro במחקר זה ש-GIP מדכא תהליכי אפופטוזיס של אוסטיאובלסטים, מה שמרמז לאפשרות שגם in vivo יש ל-GIP תפקיד במניעת אפופטוזיס של אוסטיאובלסטים. | האפשרות ש-GIP במטבוליזם של רקמת עצם הועלתה על ידי Tsukiyama וחב' ב-Mol Endocrinol משנת 2006, שהראו שלעכברים החסרים GIPR טרבקולות העצם (כפיסונים) דקות יותר מה שאופייני לאוסטיאופורוזיס. חוקרים אלה הדגימו על ידי אנליזה היסטו-פוטומטרית, שיצירת רקמת עצם בעכברים אלה ירודה יותר, ומספר האוסטיאוקלסטים גדול יותר כאופייני לתהליכי אוסטיאופורוזיס. כן הודגם in vitro במחקר זה ש-GIP מדכא תהליכי אפופטוזיס של אוסטיאובלסטים, מה שמרמז לאפשרות שגם in vivo יש ל-GIP תפקיד במניעת אפופטוזיס של אוסטיאובלסטים. | ||
| שורה 106: | שורה 122: | ||
ה-mRNA של GIP וההורמון עצמו מבוטאים בעצם הנורמאלית וכן בשורות תאים של אוסטיאובלסטים (Bollag וחב' ב-Endocrinology משנת 2000). נמצא ש-GIP מעודד הגברה ברמות של cAMP ושל יוני סידן תוך-תאי של אוסטיאובלסטים בתרבית, ושהשפעות אלה של GIP כרוכות בסמנים של יצירת רקמת עצם חדשה, כולל הגברת הפעילות של פוספטאזה בסיסית, ועלייה ברמת mRNA של קולאגן type 1. כן נמצא ש-GIP מגדיל את צפיפות העצם (BMD) בחולדות שעברו כריתת שחלות, המהוות מודל של אוסטיאופורוזיס בנשים בגיל חידלון הווסת (Bollag וחב' ב-Endocrinology משנת 2001). יתרה מכך, GIP עשוי לסייע לשקיעת סידן בעצם בתגובה לארוחה, שכן רמות סידן בפלזמה הוגברו בעכברים החסרים GIPR. | ה-mRNA של GIP וההורמון עצמו מבוטאים בעצם הנורמאלית וכן בשורות תאים של אוסטיאובלסטים (Bollag וחב' ב-Endocrinology משנת 2000). נמצא ש-GIP מעודד הגברה ברמות של cAMP ושל יוני סידן תוך-תאי של אוסטיאובלסטים בתרבית, ושהשפעות אלה של GIP כרוכות בסמנים של יצירת רקמת עצם חדשה, כולל הגברת הפעילות של פוספטאזה בסיסית, ועלייה ברמת mRNA של קולאגן type 1. כן נמצא ש-GIP מגדיל את צפיפות העצם (BMD) בחולדות שעברו כריתת שחלות, המהוות מודל של אוסטיאופורוזיס בנשים בגיל חידלון הווסת (Bollag וחב' ב-Endocrinology משנת 2001). יתרה מכך, GIP עשוי לסייע לשקיעת סידן בעצם בתגובה לארוחה, שכן רמות סידן בפלזמה הוגברו בעכברים החסרים GIPR. | ||
| − | בהשוואה לעכברי ביקורת | + | בהשוואה לעכברי ביקורת wild-type בני אותו גיל, מוצאים בעכברים טרנסגניים צעירים -/-GIPR מסת וגודל עצם נמוכים יותר, מיקרו-ארכיטקטורה בלתי-נורמאלית של העצם, תכונות ביו-מכאניות פגומות של העצם וכן שינוים במדדי ספיגה ובנייה מחדש של רקמת עצם (Xie וחב' ב-Bone משנת 2005). יחד עם זאת ככל שהעכברים מתבגרים ההבדלים המוזכרים בביולוגיה של העצם נעשים פחות מובהקים. היפוכו של דבר כאשר מסת העצם גדלה בעכברים טרנסגניים המייצרים GIP ביתר, בהשוואה לעכברי wild-type. בשנת 2007 דיווחו Zhong וחב' ב-Am J Physiol, על גילוי mRNA של GIPR ואת הקולטן עצמו בתאים אוסטיאוקלסטים של מכרסמים, כאשר החדרת GIP נמצאה מעכבת תהליכים של ספיגת עצם. |
| − | יתרה מכך, עכברי -/-GIPR מבוגרים הראו ירידות בפרמטרים של יצירת עצם כמו גם עליות ברמת סידן בפלזמה לאחר צריכת מזון, מה שמרמז לכך ש-GIPעשוי לספק קשר ישיר בין סידן במזון לבין שקיעת סידן בעצמות. יחד עם זאת, הוספה של GIP במינון גבוה, אין כדי לשנות את התחלופה בתהליכי ספיגה ובניה של רקמת עצם בניסויים ארוכי-טווח של GIP באדם (Henriksen וחב' ב-J Bone Miner Res משנת 2003). כללית, לא ברור אם מתן ארוך טווח של GIP יביא למודולציה של תהליכי ספיגה ובנייה מחדש של רקמת עצם באדם. למרות שממצאים אלה יכולים לרמז על כך שנשים בגיל חידלון הווסת עלולות להיות מועמדות לאוסטיאפורוזיס באופן חלקי בגלל תגובה מופחתת של GIP (על פי Ahren וחב' ב-Eur J Endocrinol | + | יתרה מכך, עכברי -/-GIPR מבוגרים הראו ירידות בפרמטרים של יצירת עצם כמו גם עליות ברמת סידן בפלזמה לאחר צריכת מזון, מה שמרמז לכך ש-GIPעשוי לספק קשר ישיר בין סידן במזון לבין שקיעת סידן בעצמות. יחד עם זאת, הוספה של GIP במינון גבוה, אין כדי לשנות את התחלופה בתהליכי ספיגה ובניה של רקמת עצם בניסויים ארוכי-טווח של GIP באדם (Henriksen וחב' ב-J Bone Miner Res משנת 2003). כללית, לא ברור אם מתן ארוך טווח של GIP יביא למודולציה של תהליכי ספיגה ובנייה מחדש של רקמת עצם באדם. למרות שממצאים אלה יכולים לרמז על כך שנשים בגיל חידלון הווסת עלולות להיות מועמדות לאוסטיאפורוזיס באופן חלקי בגלל תגובה מופחתת של GIP (על פי Ahren וחב' ב-Eur J Endocrinol משנת 1997) יהיה צורך לקבוע האם GIP הוא אמנם בעל תפקיד אוסטיאוגני באדם. |
| − | GIP ורקמות אחרות | + | ===GIP ורקמות אחרות=== |
| − | למרות ש-GIP מעכב בקיבה הפרשת חומצת קיבה, פעילות זו מושגת רק בריכוזים הגבוהים משמעותית מריכוזיו הפיזיולוגיים של הורמון זה (Nauck וחב' ב-Digestion משנת 1992). כמן כן נמצא ש-GIP מגביר את הטרנספורט של סוכרים במעי. בכבד, GIP מחליש יצירה של גלוקוזה המושרית על ידי glucagon, כנראה במנגנון בלתי-ישיר, שכן לא נמצאו עד כה קולטנים ל-GIP בכבד. GIP יכול לעודד פינוי של גלוקוזה התלויה באינסולין בבעלי חיים, אם כי השפעה זו לא נמצאה באדם. GIP יכול גם לעודד הפרשה של גלוקו-קורטיקואיד בחולדות דרך מסלול איתות התלוי ב-cAMP/PKA (על פי Mazzocchi וחב' ב-Peptides משנת 1999). | + | למרות ש-GIP מעכב בקיבה הפרשת חומצת קיבה, פעילות זו מושגת רק בריכוזים הגבוהים משמעותית מריכוזיו הפיזיולוגיים של הורמון זה (Nauck וחב' ב-Digestion משנת 1992). כמן כן נמצא ש-GIP מגביר את הטרנספורט של סוכרים במעי. בכבד, GIP מחליש יצירה של גלוקוזה המושרית על ידי glucagon, כנראה במנגנון בלתי-ישיר, שכן לא נמצאו עד כה קולטנים ל-GIP בכבד. GIP יכול לעודד פינוי של גלוקוזה התלויה באינסולין בבעלי חיים, אם כי השפעה זו לא נמצאה באדם. GIP יכול גם לעודד הפרשה של גלוקו-קורטיקואיד בחולדות דרך מסלול איתות התלוי ב-cAMP/PKA (על פי Mazzocchi וחב' ב-Peptides משנת 1999). |
למרות שלא נראה ש-GIP מווסת הפרשה של קורטיזול בבני-אדם בריאים, ביטוי בלתי נורמאלי של GIPR באדנומות ממקור הקורטקס של האדרנל, כרוך בהתפתחות תסמונת Cushing תלויית-מזון (Lacroix וחב' ב-N Eng J Med משנת 1992). נצפה שקולטנים ל-GIP נמצאים גם באנדותליום הווסקולארי, ואמנם GIP מעודד הגברה של רמות סידן תוך-תאי בתרבית של תאי אנדותל (Zhong וחב' ב-Peptides משנת 2000). עירוי של GIP לכלבים משרה בהם הפרשה של endothelin-1 וכיווץ כלי-דם, או הפרשה של NO והרחבת כלי-דם, בתלות במערכת כלי הדם הרלוונטית. ההשפעות המנוגדות של GIP על כלי-דם שונים, מיוחסות לשונות בדרגת השפעול של מסלולי העברת האיתותים בסוגי תאי אנדותל שונים. למרות שמוצאים mRNA של GIPR גם ברקמת הלב, באשכים, בריאות ובמספר רקמות נוספות, הפעילות הפיזיולוגית של GIP ברקמות אלה אינה ברורה, אם בכלל. | למרות שלא נראה ש-GIP מווסת הפרשה של קורטיזול בבני-אדם בריאים, ביטוי בלתי נורמאלי של GIPR באדנומות ממקור הקורטקס של האדרנל, כרוך בהתפתחות תסמונת Cushing תלויית-מזון (Lacroix וחב' ב-N Eng J Med משנת 1992). נצפה שקולטנים ל-GIP נמצאים גם באנדותליום הווסקולארי, ואמנם GIP מעודד הגברה של רמות סידן תוך-תאי בתרבית של תאי אנדותל (Zhong וחב' ב-Peptides משנת 2000). עירוי של GIP לכלבים משרה בהם הפרשה של endothelin-1 וכיווץ כלי-דם, או הפרשה של NO והרחבת כלי-דם, בתלות במערכת כלי הדם הרלוונטית. ההשפעות המנוגדות של GIP על כלי-דם שונים, מיוחסות לשונות בדרגת השפעול של מסלולי העברת האיתותים בסוגי תאי אנדותל שונים. למרות שמוצאים mRNA של GIPR גם ברקמת הלב, באשכים, בריאות ובמספר רקמות נוספות, הפעילות הפיזיולוגית של GIP ברקמות אלה אינה ברורה, אם בכלל. | ||
| − | שינויים ברמת GIP בתרחישים קליניים | + | ===שינויים ברמת GIP בתרחישים קליניים=== |
רמות מוגברות משמעותית של GIP בולטות לאחר עירוי גלוקוזה בחולים עם פנקראטיטיס. רמות מוגברות אלה ניתן למצוא גם בחולי סוכרת. רמה מוגברת של GIP מוצאים בחולים עם VIPoma הידועה גם כתסמונת Verner-Morrison המאוד נדירה, בה תאי איי-לבלב שאינם תאי-β מייצרים VIP. לעומת זאת רמות GIP נמוכות יותר בטיפול בקלציטונין. | רמות מוגברות משמעותית של GIP בולטות לאחר עירוי גלוקוזה בחולים עם פנקראטיטיס. רמות מוגברות אלה ניתן למצוא גם בחולי סוכרת. רמה מוגברת של GIP מוצאים בחולים עם VIPoma הידועה גם כתסמונת Verner-Morrison המאוד נדירה, בה תאי איי-לבלב שאינם תאי-β מייצרים VIP. לעומת זאת רמות GIP נמוכות יותר בטיפול בקלציטונין. | ||
| − | + | ||
| − | == הוראות לביצוע הבדיקה == | + | ==הוראות לביצוע הבדיקה== |
יש להיות בצום של 10-12 שעות לפני נטילת הדם. תכשירים נוגדי חומציות קיבה (Antacids) או תרופות המשפיעות על תנועתיות המעי, או על הפרשת אינסולין יכולים להשפיע על תוצאות מדידת GIP, ולכן יש להפסיק נטילתם במידת האפשר לפחות לפרק זמן של 48 שעות לפני דגימת הדם. יש לדגום את הדם במבחנת הפארין (פקק ירוק) ולאחר סרכוז יש לאחסן את הפלזמה המופרדת בהקפאה במהירות האפשרית. דגימת הפלזמה יציבה בתנאי הקפאה למשל 6 חודשים. הבדיקה נעשית בשיטת RIA. יש לפסול דגימות שאינן פלזמה, או דגימות מופשרות ששהו זמן ממושך בטמפרטורת החדר. המדידה נעשית בשיטת RIA. | יש להיות בצום של 10-12 שעות לפני נטילת הדם. תכשירים נוגדי חומציות קיבה (Antacids) או תרופות המשפיעות על תנועתיות המעי, או על הפרשת אינסולין יכולים להשפיע על תוצאות מדידת GIP, ולכן יש להפסיק נטילתם במידת האפשר לפחות לפרק זמן של 48 שעות לפני דגימת הדם. יש לדגום את הדם במבחנת הפארין (פקק ירוק) ולאחר סרכוז יש לאחסן את הפלזמה המופרדת בהקפאה במהירות האפשרית. דגימת הפלזמה יציבה בתנאי הקפאה למשל 6 חודשים. הבדיקה נעשית בשיטת RIA. יש לפסול דגימות שאינן פלזמה, או דגימות מופשרות ששהו זמן ממושך בטמפרטורת החדר. המדידה נעשית בשיטת RIA. | ||
| + | |||
| + | ==ראו גם== | ||
| + | |||
| + | * [[מדריך בדיקות מעבדה|חזרה לדף מדריך בדיקות מעבדה]] | ||
| + | * [[מפגעי בלוטת הלבלב|בדיקות מעבדה - מפגעי בלוטת הלבלב]] | ||
| + | * [[בדיקות סוכרת|בדיקות מעבדה - סוכרת]] | ||
| + | |||
| + | |||
| + | {{ייחוס|[[משתמש:בן עמי סלע|פרופ' בן-עמי סלע]]}} | ||
| + | |||
| + | [[קטגוריה:בדיקות מעבדה: אנדוקרינולוגיה]] | ||
| + | [[קטגוריה:בדיקות מעבדה - מפגעי בלוטת הלבלב]] | ||
| + | [[קטגוריה:בדיקות מעבדה: כימיה בדם]] | ||
| + | [[קטגוריה:בדיקות מעבדה - סוכרת]] | ||
גרסה אחרונה מ־13:41, 19 במאי 2021
| מדריך בדיקות מעבדה | |
| polypeptide Gastric inhibitory | |
|---|---|
| שמות אחרים | GIP, glucose-dependent insulinotropic peptide |
| תחום | הערכת מצבי סוכרת, השמנת יתר והערכה תפקודית של פעילות בלוטת הלבלב |
| טווח ערכים תקין | בדם בצום-50-100 פיקוגרם/מ"ל; בדם לאחר ארוחה-110-720 פיקוגרם/מ"ל |
| יוצר הערך | פרופ' בן-עמי סלע |
בסיס פיזיולוגי
חלפו למעלה מ-100 שנה מאז התגלית של מושג האינקרטינים (incretins), שפתח לאחר מכן אפשרות של טיפול חדש בחולי סוכרת. בשנת 1902 פרסמו Bayliss ו-Starling ב-J Physiol, על גילוי secretin, מה שהביא את Moore וחב' להשערה שפורסמה ב-Biochem J בשנת 1906, שתמצית מעי מכילה הורמון המווסת את פעילותו האנדוקרינית של בלוטת הלבלב, ואף הראו שהזרקת תמצית זו הפחיתה את כמות הסוכרים המופרשים בשתן של חולי סוכרת, כנראה על ידי גירוי הפעילות האנדוקרינית של הלבלב. אך רק בשנת 1929 חלה התעוררות בנושא, כאשר La Barre ו-Zunz פרסמו ב-Arch Int Physiol Biochim, שהם ניקו מתמצית מעי את הגורם המפחית גלוקוזה וכינו אותו incretin או INtestine seCRETion Insulin. חלפה תקופה דומה של כמעט שלושים שנה, עד אשר פותחה שיטת RIA לכימות רמת אינסולין בשנות ה-60, ובשנת 1964 הופיעו 2 מאמרים שהראו שהעמסת סוכר באופן פומי, הביאה ליצירה מוגברת יותר של אינסולין מאשר היו מזריקים גלוקוזה ישירות לווריד (Elrick וחב' ב-J Clin Endocrinol Metab משנת 1964, ו-McIntyre וחב' ב-Lancet באותה שנה). כיום מייחסים ממצא זה ל-incretins המופרשים מהמעי לאחר בליעת גלוקוזה אך גם ארוחות עשירות בשומן, מה שמגרה את תאי β בלבלב להפריש יותר אינסולין.
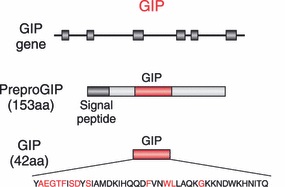
רק 2 הורמוני מעי כאלה נתגלו עד כה שפועלים כ-incretins, והם GIP או gastric inhibitory polypeptide, ו-GLP-1 או glucagon-like peptide-1. ה-GIP הוא הורמון בן 42 חומצות אמינו שמשקלו המולקולארי 4,944 דלטון, המופרש מתאי K בחלק העליון של המעי הדק באזור התריסריון וה-jejunum הקריבני (פרוקסימאלי), אך ניתן למצוא את GIP לאורך כל המעי (Inagaki וחב' ב-Mol Endocrinol משנת 1989). במקור בודדו GIP בשנת 1970 ממעי של חזיר על ידי Brown וחב' על בסיס יכולתו לעכב הפרשת חומצת קיבה ו-gastrin בכלבים כפי שתואר ב-J Physiol. מאוחר יותר פרסמו Dupre וחב' ב-J Clin Endocrinol Metab משנת 1973 שהזרקת GIP מעודדת הפרשת אינסולין במתנדבים בריאים על ידי פעולה ישירה של הורמון זה על תאי הלבלב להפרשת אינסולין (Adrian וחב' ב-Diabetologia משנת 1978, ו-Taminato וחב' ב-Diabetes משנת 1977). נתונים אלה הצביעו על GIPכעל ה-incretin המקורי, ולאחר מכן יש שכינו אותו glucose-dependent insulinotropic polypeptide.
הגן ל-GIP אנושי מורכב מ-6 אֶקסונים כאשר רוב המידע המקודד ל-GIP נמצא ב-3 exon, וגן זה ממוקם בזרוע הארוכה של כרומוזום 17 בעמדה 17 q21.3-q22. ביטוי הגן ל-GIP התגלה בקיבה ובתאי K במעי במכרסמים כמו גם באדם, כאשר בחולדות ביטוי גן זה מופיע גם בבלוטת הרוק התת-מנדיבולארית. נמצא שבחולדות, רמת mRNA של GIP, עולה בתריסיון ובבלוטת הרוק לאחר ארוחות המכילות גלוקוזה או עשירות בשומן, אך רמת mRNA זה פוחתת בתגובה לצום ממושך.
ביוסינתזה של GIP
הרצף של חומצות האמינו של GIP בחולדה ובאדם, מצביע על כך שהורמון זה מיוצר מקדם-הורמון (preproGIP) גדול יותר המכיל signal peptide , פפטיד N-טרמינאלי, GIP ופפטיד C-טרמינאלי, על ידי פעילות PC או prohormone convertase 1/3. מחקרים עם עכברי knockout בהם פגום הגן של האנזים PC, וכן ניסויים בתרבית תאים עם פעילות-יתר של PC, הדגימו שהצורה הבשלה והפעילה של GIP, המכילה 42 חומצות אמינו מקורה בקודמן preproGIP המכיל 153 חומצות אמינו, כאשר הביקוע מתבצע ליד שייר ארגינין (Ugleholdt וחב' ב-J Biol Chem משנת 2003). הפפטידים המקוּדדים בתוך המקטעים ה-N-טרמינאלי וה-C-טרמינאלי הם חסרי פעילות ידועה. הרצף של GIP השתמר בצורה בולטת בין מיני בעלי חיים שונים, ורצפי חומצות האמינו של GIP של האדם לבין זה של עכבר, חולדה, חזיר ופרה מראים זהות של למעלה מ-90%. יש עדות מסוימת שגם תאי α בלבלב מסוגלים לייצר כמויות קטנות של preproGIP, שעובר ביקוע על ידי prohormone convertase 2 לייצור הורמון קטום בקצה ה-C טרמינאלי של ה-preproGIP , המוגדר כ-(GIP (1-30, אך אין מידע לגבי פעילות פיזיולוגית של פפטיד זה.
התפקוד של GIP
במקור נקרא הורמון פפטידי זה gastric inhibitory peptide בגלל יכולתו להפחית את הפרשת חומצת הקיבה בחיות (אם כי לא באדם) (Kim ו-Egan ב-Pharmacol Rev משנת 2008) על מנת להגן על המעי הדק מנזק החומצה, להפחית את קצב העברת המזון דרך הקיבה, ולעכב את התנועתיות (motility) של המעיים. אך לאחרונה מייחסים פעולות אלה ביתר שאת להורמון דומה, secretin. היום מאמינים שתפקידו העיקרי של GIP הוא להשרות הפרשת אינסולין, המושפעת העיקר על ידי היפר-אוסמולריות של גלוקוזה בתריסריון (Thorens ב-Diabète & Métabolisme משנת 1995). לכן יש מעדיפים כיום את כינוי ההורמון כ-glucose-dependent insulinotropic peptide.
משערים שיש ל-GIP השפעות משמעותיות על המטבוליזם של חומצות שומן, דרך הגירוי של פעילות האנזים lipoprotein lipase באדיפוציטים. כמו כן, נמצא ש-GIP מופרש בתגובה להנקה הראשונה של חלב אם (colostrum) בגורי עזים. משיקולים אתיים, הפרשת GIP הודגמה בתינוקות אדם רק בגיל 10 ימים בערך. לאחרונה נמצא שיש ל-GIP תפקיד מרכזי בתהליכי עיצוב (remodeling) של רקמת העצם. Gaudin-Audrain וחב' דיווחו בשנת 2013 ב-Bone שעכברים טרנסגניים עם חסר בקולטן ל-GIP, סבלו משינויים ניכרים במיקרו-ארכיטקטורה, בנפח ובאיכות של העצם הטרבקולארית. ממצאים דומים פורסמו באותו כתב-עת בשנת 2013 על ידי Mieczkowska וחב', כאשר נמצא שאיכות העצם נפגמה והייתה נטייה לשברי עצם בעכברים עם חסר מושרה בקולטן ל-GIP.
הרלוונטיות של GIP לסוכרת type 2 הודגמה, כאשר נמצא שחולים בסוג סוכרת זו מגיבים משמעותית פחות ל-GIP, וכן בחולים אלה יש הפרשה פחותה של GIP לאחר ארוחה, בהשוואה לאנשים ללא סוכרת (Skrha וחב' ב-Physiol Res משנת 2010). במחקר עם עכברי knockout, נמצא שחסר בקולטנים ל-GIPכרוך בעמידות להשמנת-יתר (Yamada ו-Seino ב-Hormone & Metabol Res משנת 2004).
הפרשה, מטבוליזם ופינוי של GIP
GIP מיוצר ומופרש מתאי K בתריסריון וב-jejunum הקריבני, עם פעילות סינתטית והפרשתית נמוכה יותר לאורך המעי הדק כולו (Mortensen וחב' ב-Regu Pept משנת 2003, ו-Butchan וחב' ב-Histochemistry משנת 1978). GIP מופרש בתגובה לקליטת מזון, בעיקר גלוקוזה או שומן. באופן ספציפי יותר, הפרשת GIP מושפעת יותר מקצב ספיגת המזון מאשר מנוכחות מזון במעי. לכן, הפרשת GIP פוחתת באנשים עם בעיות ספיגה, או לאחר נטילת תכשירים האמורים להפחית את הספיגה (Besterman וחב' ב-BMJ משנת 1979, ו-Fushiki וחב' ב-J Nutr משנת 1992). בעוד שמזון שומני הוא גריין יעיל יותר של הפרשת GIP באדם, פחמימות יותר יעילות בגירוי הפרשה זו במכרסמים ובחזירים. באדם, הרמה הבסיסית של GIP בפלזמה היא מתחת ל-50 פיקוגרם/מ"ל, והיא עולה לאחר ארוחה לרמה של עד 720 פיקוגרם/מ"ל בתלות בסוג וכמות המזון בארוחה (Orskov וחב' ב-Scand J Gastroenterol משנת 1996, ו-Vilsbøll וחב' ב-Diabetes משנת 2001). רמות GIP בפלזמה דומות או מוגברות אך במקצת בחולים עם סוכרת type 2 בהשוואה לזו באנשים בריאים (Ross וחב' ב-Diabetes משנת 1977).
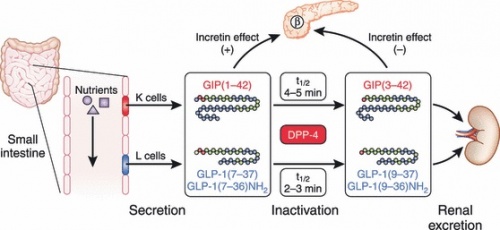
הפפטיד GIP מופרש מתאי K בחלק העליון של המעי הדק. בעוד ש-GLP-1 מופרש מתאי L בחלק התחתון של המעי הדק. מיד לאחר הפרשתם שני הפפטידים עוברים הידרוליזה על ידי האנזים DPP-4, מאבדים את פעילותם ומופרשים דרך הכליות. הפפטידים שנותרו שלמים ופעילים, משפיעים על תאי β בלבלב, ואלה מייצרים ומפרישים אינסולין.
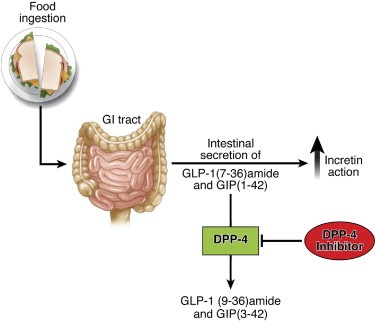
GLP-1 (7-36)amide ו- (1-42) GIP, מופרשים מהמעי הדק לאחר ארוחה, ומעודדים הפרשת אינסולין תלויית-גלוקוזה. האנזים DPP-4 פועל במהירות להסב את 2 ה-incretins לפפטידים בלתי פעילים (9-36) GLP-1 ו-(3-42) GIP. מעכב האנזים DPP-4 דוגמת sitagliptin מונע את האינאקטיבציה של פעילות 2 ה-incretins.
תקופת מחצית החיים של GIP היא פחות מ-2 דקות במכרסמים (Kieffer וחב' ב-Endocrinology משנת 1995), ואילו בבני-אדם בריאים תקופת מחצית החיים היא של 7 דקות, כאשר בחולי סוכרת type 2 היא בת 5 דקות (Deacon וחב' ב-J Clin Endocrinol Metabol משנת 2000). תקופת מחצית החיים של GIP בצורתו הקטומה (לאחר הסרת 2 חומצות האמינו פרולין ואלנין בקצה ה-N טרמינאלי על ידי DPP-4) מתארכת עד כדי 17 דקות (Vilsbøll וחב' ב-Regul Pept משנת 2006).
שייר אלנין בעמדה 2 של רצף חומצות האמינו של GIP, מהווה יעד פעולה של DPP-4 או Dipeptidyl peptidase-4, שהוא האנזים הגורם לאינאקטיבציה של (1-42) GIP על ידי הפיכתו למטבוליט הבלתי-פעיל (GIP(3-42, המאבד את תכונותיו האינסולינוטרופיות (Deacon וחב' ב-J Clin Endocrinol Metabמשנת 2000). אנזים זה ממוקם בממברנות brush-border של המעי והכליות, אך ניתן למצוא אותו גם על פני קפילארות, ובצורה מסיסה בפלזמה (Mentlain ב-Regul Pept משנת 1999).
פעילות זו של DPP-4 כאנזים העיקרי הפוגע בפעילות GIP הודגמה היטב במכרסמים ובבני-אדם בריאים או סוכרתיים. התצפיות לפיהן רמות GIP בפלזמה מוגברות באנשים הסובלים מ-uremia או באלה עם מחלת כליות כרונית, כמו גם הממצאים על פינוי משובש של GIP בחולדות שעברו nephrectomy, מצביעים על הכליות כאיבר דרכו מתבצע רוב הפינוי (clearance) של GIP (על פי Meier וחב' ב-Diabetes משנת 2004). מחקרים של Deacon וחב' ב-Diabetes משנת 2001 מראים שגם לכבד יש תפקיד בספיגת GIP מהדם, ואילו Vilsbøll וחב' דיווחו ב-Regul Pept משנת 2006, שקצב הפינוי של GIPשלם ושל המטבוליטים שלו דומים בין אנשים בריאים לבין אנשים שמנים עם סוכרת type 2.
הקולטן ל-GIP
GIP פועל על ידי התקשרות לקולטן ספציפי GIPR ששובט במקור מספריית cDNA מקליפת המוח של חולדה, ולאחר מכן שובט ממקור אוגר ואדם. הגן של הקולטן האנושי ל-GIP מכיל 14 exons ש"אורכם" 14kb (ע"פ Yamada וחב' ב-Genomics משנת 1995), והוא ממוקם בכרומוזום 19 בעמדה q13.3. הקולטן ל-GIP באדם מכיל 466 חומצות אמינו, אך יש גם איזופורם של קולטן ל-GIP עם 493 חומצות אמינו. הגן ל-GIPR בא לביטוי בבלוטת הלבלב, בקיבה, במעי הדק, ברקמת השומן, בקורטקס של האדרנל, בבלוטת יותרת המוח (היפופיזה), בלב, באשכים, בתאים אנדותליאליים, ברקמת העצם, בטרכיאה, בטחול, בבלוטת ההרת (תימוס), בריאות, בכליות בבלוטת התריס (תירואיד), ובאזורים אחדים של מערכת העצבים המרכזית (Asmar ב-Dan Med Bull משנת 2011). יחד עם זאת, לא ברורה עדיין המשמעות של תוצאות השפעול של קולטנים חוץ-פנקראטיים אלה.
הקולטן של GIP הוא חבר במשפחת העל של קולטנים החוצים את הממברנה באופן מפותל 7 פעמים, שהם בעלי מבנה הֶטֶרוֹ-טרימרי והם קשורים לחלבוני G בציטופלזמה (Usdin וחב' ב-Endocrinology משנת 1993). מעט יחסית ידוע על הגורמים האחראיים לוויסות ביטויו של הקולטן ל-GIP, אך ידוע רמות ה-mRNA של GIPR ושל חלבון הקולטן עצמו, נמוכות יותר באיי הלבלב של חולדות סוכרתיות, מה שנכון גם לבני אדם (Lynn וחב' ב-Diabetes משנת 2001).
שפעול של איתות המועבר דרך GIPR קשור לשדרוג פעילות האנזים adenylyl cyclase ולעליות ברמת cAMP ויוני סידן תוך תאי, כמו גם לשפעול של החלבונים p38 MAPK, PKB, PKA, PI-3K ו-פוספוליפאז A2 (על פי McIntosh וחב' ב-Vitam Horm משנת 2009). ניסויים in-vitro העלו שהקצה ה-N-טרמינאלי של GIPR והלולאה החוץ תאית הראשונה של GIPR חיוניים לזיקה הגבוהה של קישור של GIP לקולטן שלו, בעוד שחלקים מהקצה ה-N טרמינאלי בנוסף למקטע (domain) הטרנס-ממברנאלי חיוניים לשפעול הקולטן ולצימוד של cAMP. למרות שרוב רצף חומצות האמינו בקצה ה-C טרמינאלי של GIPR נראה מיותר לאיתות התוך-תאי, רצף מינימאלי של הקולטן הכולל 405 חומצות אמינו נדרש להעברה יעילה של האיתות לאחר קישור GIP לקולטן שלו. Wheeler וחב' דיווחו ב-J Biol Chem משנת 1999, ששיירי serine 406 ו-411 בקצה ה-C טרמינאלי חיוניים לנטרול (desensitization) פעולת הקולטן, בעוד ששיירי serine 426 ו-427 חיוניים לתהליך החדרת הקולטן לאחר קישורו של GIP.
הפעילויות הביולוגיות של GIP
הפעילות של GIP על תאי β בלבלב אנלוגית לזו של GLP-1, ל-GIP יש גם פעילות פיזיולוגית ייחודית ברקמות חוץ-פנקראטיות.
בלוטת הלבלב
התפקיד הפיזיולוגי העיקרי של GIP היא פעילותו כ-incretin, דהיינו בהתקשרות לקולטניו על פני תאי β בלבלב, ובעידוד הפרשת אינסולין. המנגנונים המולקולאריים האחראיים להפרשת אינסולין בהשפעת GIP, חופפים באופן משמעותי את אלה המושפעים על ידי GLP-1, וכוללים הגדלת ריכוז cAMP, עיכוב תעלות KATP, עלייה ברמות התוך-תאיות של יוני סידן וגירויי של exocytosis (על פי Ding וחב' ב-Diabetes משנת 1997). הגירוי על ידי GIP להפרשת אינסולין, מסתייע על ידי שפעול של 2 הצמדים, AMP/Protein kinase A ו-cAMP/Epac2, בנוסף לשפעול של phospholipase A2 ומסלולי איתות ספציפיים של פרוטאין קינאז (Kashima וחב' ב- J Biol Chem משנת 2001, ו-Ehses וחב' ב-J Biol Chem משנת 2002). כמו כן, GIP מגביר את השעתוק של הגן לאינסולין ואת הביוסינתזה של הורמון זה בתאי β וכן את הביטוי של החיישנים לגלוקוזה על פני תאים אלה (Wang וחב' ב-Mol Cell Endocrinol משנת 1996).
החשיבות הפיזיולוגית של GIP כ-incretin, מודגמת על ידי פגיעה בפעילות הורמון זה in vivo. ביטול האיתות העובר דרך הקולטן GIPR על ידי שימוש באנטגוניסטים או בנוגדנים המכוונים כנגד GIPR, או על ידי אינאקטיבציה ממוקדת של הגן ל-GIPR בעכברים טרנסגניים (-/-GIPR), גורמים לעמידות פגומה למתן פומי של גלוקוזה, כמו גם להפרשה משובשת של אינסולין הצפויה בעקבות מתן גלוקוזה (Tseng וחב' ב-J Clin Invest משנת 1996, וכן Lewis וחב' ב-Endocrinology משנת 2000 ו-Miyawaki וחב' ב-Proc Natl Acad Sci USA משנת 1999).
כמו כן GIP פועל בסינרגיזם עם גלוקוזה לעודד שגשוג תאים ולשפר את הישרדותם של תאי β פנקריאטיים, והשפעה הגנתית זו על תאי β ניתנת להדגמה באיי לנגרהנס של עכברי בר תקינים, אך לא בעכברים הומוזיגוטיים טרנסגניים מסוג -/-GIPR (ע"פ Kim וחב' ב-J Biol Chem משנת 2005). מנגנוני האיתות המולקולאריים המתווכים בהשפעה של GIP על שגשוג תאים דרך פעילות אנטי-אפופטוטית פוענחו על ידי שימוש בתאים הטרולוגיים שעברו טרנספקציה עם GIPR, בשורת תאי β של מכרסמים, באיי פנקריאס של עכברים, וכללו שפעול של מסלולי cAMP/PKA, וכן של ו-PKA/CREB ו-p38MAPK (על פי Trumper וחב' ב-Mol Endocrinol משנת 2001, ו-Ehses וחב' ב- Endocrinology משנת 2003).
ניסויים עם חולדות סוכרתיות מזן ZDF הראו שעירוי של GIP למשך שבועיים, הפחית משמעותית את האפופטוזיס בתאי β בלבלב על ידי שפעול של Akt-PKB בתלות ב-PI-3K, וכן שפעול הפוספורילציה והרחקה מגרעין התא של FoxO1, מה שגורם להפחתת ביטויו של הגן מקדם האפופטוזיס Bax, הפחתה בפעילות caspase 3 (אנזים המפתח בתהליך האפופטוזיס), כמו גם דיכוי השעתוק של הגן ל-bax (חלבון מקדם אפופטוזיס נוסף), ולעומת זאת שדרוג בפעולת הגן של החלבון האנטי-אפופטוטי bcl-2 (על פי Kim וחב' ב-J Biol Chem משנת 2005). כמו כן, נמצא ש-GIP מפחית את רמת סמנים ביוכימיים הקשורים לעקה של הרטיקולום האנדופלזמי (ER) בשורת תאים של איי הלבלב לאחר השריית עקה זו של ה-ER בתנאי תרבית תאים (Yusta וחב' ב-Cell Metab משנת 2006). ניתן לומר שהפעילות האינסולינו-טרופית של GIP פחותה בחולדות היפר-גליקמיות, לפחות באופן חלקי בגלל הביטוי המופחת של הקולטן ל-GIP בחולדות אלה (Lynn וחב' ב-Diabetes משנת 2001).
פעילות GIP במערכת העצבים המרכזית
ב-CNS, ניתן למצוא ביטוי של GIP בהיפוקמפוס, בתאי Purkinje במוחון וב-olfactory bulb (על פי Nyberg וחב' ב-J Neurosci Res משנת 2007). קולטנים ל-GIP אותרו באזורי מוח אחדים כולל בקליפת המוח, בהיפוקמפוס, ב-olfactory bulb (על פי Kaplan ו-Vigna ב-Peptides משנת 1994, ו-Usdin וחב' ב-Endocrinology משנת 1993). עירוי של GIP אקסוגני למוח חולדות, השרתה שגשוג של תאים פרוגניטורים בהיפוקמפוס in vivo כמו גם בתאים פרוגניטרים מההיפוקמפוס בתנאי תרבית תאים (Nyberg וחב' ב-J Neurosci משנת 2005). לעומת זאת, עכברים טרנסגניים בוגרים (-/-GIPR), עם פגיעה מושרית בקולטן ל-GIP, הכילו מספר קטן משמעותית של תאים פרוגניטורים חדשים ב-dentate gyrus של ההיפוקמפוס. כמו כן, עכברים טרנסגניים המבטאים ביתר את הקולטן GIPR, מפגינים קואורדינציה תחושתית-מוטורית משופרת, כמו גם שיפור בממדי זיכרון בהשוואה לעכברים wild-type.
נראה אם כן שהביטוי של GIPR בתאי עצב פרוגניטורים ב-dentate gyrous של ההיפוקמפוס, מצביעים על מעורבות אפשרית של GIP הוויסות של נוירוגנזה ובתפקוד הזיכרון. באופן הצפוי על יסוד ההשפעה השגשוגית של GIP על תאי פרוגניטור עצביים, השפעול של GIPR על ידי אנאלוגים של GIP, מעודד יצירת LTP (או long-term potentiation) בהיפוקמפוס, ואילו עיכוב ביטוי GIPR על ידי אנטגוניסט של GIP דוגמת Pro3) GIP), מפחית את ה-LTP (על פי Gault וחב' ב-J Neurophysiol משנת 2008). לעומת זאת, עכברים טרנסגניים עם ביטוי-יתר של GIP, מראים שיפור בביצוע משימות הכרוכות בזיכרון (Ding וחב' ב-Peptides משנת 2006). פעילות נוספת של GIP במוח קשורה לוויסות תחושות התיאבון והשובע.
GIP ורקמת שומן
קולטני GIPR פונקציונאליים מבוטאים על פני אדיפוציטים מבודדים מחולדות ועל פני תאי 3T3-L1 (על פי Yip וחב' ב-Endocrinology משנת 1998). כיוון שכך, יש הקושרים את GIP לפיקוח על המטבוליזם של שומן, ולהתפתחות של השמנת-יתר. קליטת שומן מהמזון היא גריין משמעותי של הפרשת GIP באדם, ורמות GIP בפלזמה עולות בחלק מחולי סוכרת type 2 כבדי המשקל (על פי Creutzfeldt וחב' ב-Diabetologia משנת 1978, ו-Salera וחב' ב-J Clin Endocrinol Metab משנת 1982). ההשפעה האנאבולית של GIP על רקמת השומן, כוללת גירוי של סינתזה של חומצות שומן ו-רה-אסטריפיקציה שלהן עידוד של החדרת חומצות שומן לתוך טריגליצרידים המושרית על ידי אינסולין, שדרוג הסינתזה של האנזים lipoprotein lipase, הגברת הזיקה של אינסולין לקולטנים שלו, והפחתה בתהליכים ליפוליטיים המושרים על ידי glucagon. יחד עם זאת, יש ל-GIP כנראה גם השפעות ליפוליטיות, אם כי אלה שנויות במחלוקת (Yip ו-Wolfe ב-Life Sci משנת 2000). עכברים טרנסגניים (-/-GIPR), מראים עמידות להשמנת-יתר הנובעת מקליטת מזון, תוך שהם מראים מסת שומן מופחתת, למרות מספר חודשים של האכלתם בדיאטה עתירת-שומן (Miyawaki וחב' ב-Nat Med משנת 2002).
הוספת GIP נמצאה מגבירה את פינוי כילומיקרונים בכלבים (Wasada וחב' ב-J Clin Invest משנת 1981), מפחיתה את רמת טריגליצרידים לאחר ארוחה בחולדות (Ebert וחב' ב-Horm Metab Res משנת 1991) ומגבירה טרנספורט של גלוקוזה וסינתזת חומצות שומן ב-explants של רקמת שומן מחולדות (Knapper וחב' ב-J Nutr משנת 1995, ו-Oben וחב' ב-J Endocrinol משנת 1991). בנוסף, נראה ש-GIP מגביר את רגישות אדיפוציטים לאינסולין, ובכך מעודד קליטת גלוקוזה וחומצות שומן לאגירה בתאים אלה.
יתרה מכך, ניסוי של Isken וחב' שפורסם ב-Am J Physiol Endocrinol Metab משנת 2008, הראה שהשמנת יתר המושרית בדרך כלל על ידי ניתוח להרחקת השחלות נמנעה בעכברים עם חסר בקולטן ל-GIP, מה שניתן להסביר חלקית על ידי הפחתה בצריכת מזון בגלל החסר ב-GIPR. התברר שעירוי לתוך המוח של NPY או הנוירופפטיד האורקסיגני Y, מעודד הפרשת GIP מתאי העצב, מה שרומז לכך ש-GIP פועל כמווסת שלילי של NPY, ועשוי לווסת צריכת מזון על ידי הכלבים המטופלים (Yavropoulou וחב' ב-Peptides משנת 2008). יחד עם זאת, יש לשקול בזהירות יתרה את ההערכה של תפקוד נוגד-השמנה של GIP במוח, כיוון שיש להורמון האחרון השפעה ישירה על רקמת השומן. יש גם להתחשב בהשפעה של ההורמון האינקרטיני האחר GLP-1 בהקשר של השפעתו על צריכת מזון ושובע באדם. בניגוד ל-GLP-1 המעכב התרוקנות הקיבה, נמצא של-GIP יש השפעה מועטה בלבד על התרוקנות הקיבה באדם ובעכברים (Meier וחב' ב-Am J Physiol Endocrinol Metab משנת 2004).
זאת ועוד, עכברי -/-ob/ob:GIPR עולים פחות במשקלם, הם בעלי רקמת שומן מצומצמת יותר, ומגיבים טוב יותר לעודף גלוקוזה, על ידי רגישות רבה יותר לאינסולין, בהשוואה לעכברי ob/ob. למרות שצריכת המזון דומה בין עכברי -/-GIPR לבין עכברי wild-type, כאשר מאכילים אותם במזון עתיר-שומן, עכברי -/-GIPR מוציאים יותר אנרגיה, ולכן הם משתמשים בשומן כמצע אנרגיה מועדף, ולפיכך נמנעת אגירת שומן באדיפוציטים שלהם. בעכברי ob/ob עירוי כרוני של אנטגוניסט לקולטן GIPR דוגמת Pro3)GIP) משפר את הסבילות לגלוקוזה, מגביר את הרגישות לאינסולין, ומתקן את ההיפרטרופיה של תאי הלבלב המושרית על ידי השמנת-יתר, כמו גם את ההיפרפלזיה של תאי β (על פי Gault וחב' ב-Diabetes משנת 2005).
יחד עם זאת, עכברי -/-GIPR שניזונו על דיאטת chow נורמאלית, מראים חוסר סבילות לגלוקוזה, והחדרה של Pro3) GIP) פוגעת בסבילות לגלוקוזה בעכברי wild-type (על פי Irwin וחב' ב-Biol Chem משנת 2004). בנוסף, שפעול של GIPR כרוך עם שיפור בסבילות לגלוקוזה, ומגביר הפרשת אינסולין במודלים של סוכרת בחיות. לכן, למרות שחולים בסוכרת type 2 עמידים באופן יחסי להשפעות האינסולינוֹ-טרופיות של החדרה אקסוגנית של GIP, ואין קשר ישיר בין השמנת-יתר ו-GIP בבני-אדם, יש לשקול את היתרונות היחסיים של שפעול לעומת עיכוב של GIPR, בכל ניסיון בעתיד לשימוש תרפויטי של GIP או של האנלוגים שלו.
התפקיד הפיזיולוגי של GIP בהצטברות שומן
שומן מגביר באופן ניכר הפרשת GIP (על פי Carr וחב' ב-Am J Physiol Endocrinol Metab , ו-Thomsen וחב' ב-Am J Clin Nutr משנת 1999) וכמו כן רמות GIP מוגברות בחולי סוכרת type 2 כבדי משקל. קיים מתאם טוב בין רמות GIP בפלזמה לבין ריכוזי טריגליצרידים (Elliotte וחב' ב-J Endocrinol משנת 1993). הייתה השערה ש-GIP הוא בעל תפקיד פיזיולוגי בהצטברות שומן באדיפוציטים, ובתחילת שנות ה-80 נעשה ניסוי שהראה ש-GIP בנוכחות אינסולין משרה החדרה של חומצות שומן תוך בלוטות השמן בעקבי חולדות (Beck ו-Max ב-Regul Pept משנת 1983). כמו כן, כאשר בעכברים כבדי-משקל (ob/ob) כתוצאה מפגם בגן של leptin, מניפולציה גנטית של פגיעה ב-GIPR הביאה לא רק לשיפור של בעיית עודף המשקל על ידי הגברת "שריפת" אנרגיה, אלא גם הגבירה את הרגישות לאינסולין ואת הסבילות לגלוקוזה, ללא פגיעה קשה בהפרשת אינסולין (Zhang וחב' ב-Nature משנת 1994, וכן Vilsbøll וחב' ב-Diabetologia משנת 2002 ו-Yamada וחב' ב-Diabetes משנת 2006).
תצפיות אלו אושרו בעכברים שהוזנו בדיאטה עתירת-שומן וכן בעכברים שמנים ob/ob, שטופלו באנטגוניסט Pro3)GIP) של הקולטן ל-GIP (ע"פ Gault וחב' ב-Diabetologia משנת 2008, וכן Irwin וחב' באותו כתב עת משנת 2007), כמו גם בעכברים טרנסגניים החסרים תאי K מפרישי GIP (ע"פ Althage וחב' ב-J Biol Chem משנת 2008).
למרות ש-GIP נמצא מגביר את פעילות lipoprotein lipase, אנזים הקשור לממברנת תאים אדיפוציטים, ואשר תפקידו לבצע הידרוליזה של טריגליצרידים הקשורים לליפופרוטאין על מנת לייצר חומצות שומן, המנגנון המולקולארי דרכו GIP פועל על אדיפוציטים אינו ברור דיו. Kim וחב' דיווחו בשנת 2007 ב-J Biol Chem, שקישור GIP לקולטניו על פני תאי 3T3-L1 גורם להפרשה מוגברת של resistin במסלול הקשור ל-p38 MAPK ו-SAPK/JNK. אותם חוקרים הראו גם ש-GIP משפעל את PI3K ואת Akt/PKB על ידי הפרשת resistin, ועל ידי כך הוא מדכא את AMPK ומגביר את פעילות lipoprotein lipase וליפוגנזה באדיפוציטים.
אגוניסט אחר של GIPR, הידוע כ-(D-Ala2GIP (1-30 מראה פעילות דומה לזו של (1-42) GIP על התפקוד וההישרדות של תאי בתא, אך יש לו השפעה פחותה בהרבה על פעילות lipoprotein lipase בתאי 3T3-L1 (ע"פ Widenmaiser וחב' ב-PLoS ONE משנת 2010).
GIP ורקמת עצם
האפשרות ש-GIP במטבוליזם של רקמת עצם הועלתה על ידי Tsukiyama וחב' ב-Mol Endocrinol משנת 2006, שהראו שלעכברים החסרים GIPR טרבקולות העצם (כפיסונים) דקות יותר מה שאופייני לאוסטיאופורוזיס. חוקרים אלה הדגימו על ידי אנליזה היסטו-פוטומטרית, שיצירת רקמת עצם בעכברים אלה ירודה יותר, ומספר האוסטיאוקלסטים גדול יותר כאופייני לתהליכי אוסטיאופורוזיס. כן הודגם in vitro במחקר זה ש-GIP מדכא תהליכי אפופטוזיס של אוסטיאובלסטים, מה שמרמז לאפשרות שגם in vivo יש ל-GIP תפקיד במניעת אפופטוזיס של אוסטיאובלסטים.
זאת ועוד, ההגברה של יצירת עצם על ידי GIP, כמנגנון של דיכויים של אוסטיאוקלסטים ומניעת אפופטוזיס של תאים אלה, הודגמה בעכברים טרנסגניים עם פגם בייצור GIP (ע"פ Ding וחב' ב-J Bone Miner Res משנת 2008, וכן Xie וחב' ב-Bone משנת 2007 ו-Zhong וחב' ב-Am J Physiol Endocrinol Metab משנת 2007).
ה-mRNA של GIP וההורמון עצמו מבוטאים בעצם הנורמאלית וכן בשורות תאים של אוסטיאובלסטים (Bollag וחב' ב-Endocrinology משנת 2000). נמצא ש-GIP מעודד הגברה ברמות של cAMP ושל יוני סידן תוך-תאי של אוסטיאובלסטים בתרבית, ושהשפעות אלה של GIP כרוכות בסמנים של יצירת רקמת עצם חדשה, כולל הגברת הפעילות של פוספטאזה בסיסית, ועלייה ברמת mRNA של קולאגן type 1. כן נמצא ש-GIP מגדיל את צפיפות העצם (BMD) בחולדות שעברו כריתת שחלות, המהוות מודל של אוסטיאופורוזיס בנשים בגיל חידלון הווסת (Bollag וחב' ב-Endocrinology משנת 2001). יתרה מכך, GIP עשוי לסייע לשקיעת סידן בעצם בתגובה לארוחה, שכן רמות סידן בפלזמה הוגברו בעכברים החסרים GIPR.
בהשוואה לעכברי ביקורת wild-type בני אותו גיל, מוצאים בעכברים טרנסגניים צעירים -/-GIPR מסת וגודל עצם נמוכים יותר, מיקרו-ארכיטקטורה בלתי-נורמאלית של העצם, תכונות ביו-מכאניות פגומות של העצם וכן שינוים במדדי ספיגה ובנייה מחדש של רקמת עצם (Xie וחב' ב-Bone משנת 2005). יחד עם זאת ככל שהעכברים מתבגרים ההבדלים המוזכרים בביולוגיה של העצם נעשים פחות מובהקים. היפוכו של דבר כאשר מסת העצם גדלה בעכברים טרנסגניים המייצרים GIP ביתר, בהשוואה לעכברי wild-type. בשנת 2007 דיווחו Zhong וחב' ב-Am J Physiol, על גילוי mRNA של GIPR ואת הקולטן עצמו בתאים אוסטיאוקלסטים של מכרסמים, כאשר החדרת GIP נמצאה מעכבת תהליכים של ספיגת עצם.
יתרה מכך, עכברי -/-GIPR מבוגרים הראו ירידות בפרמטרים של יצירת עצם כמו גם עליות ברמת סידן בפלזמה לאחר צריכת מזון, מה שמרמז לכך ש-GIPעשוי לספק קשר ישיר בין סידן במזון לבין שקיעת סידן בעצמות. יחד עם זאת, הוספה של GIP במינון גבוה, אין כדי לשנות את התחלופה בתהליכי ספיגה ובניה של רקמת עצם בניסויים ארוכי-טווח של GIP באדם (Henriksen וחב' ב-J Bone Miner Res משנת 2003). כללית, לא ברור אם מתן ארוך טווח של GIP יביא למודולציה של תהליכי ספיגה ובנייה מחדש של רקמת עצם באדם. למרות שממצאים אלה יכולים לרמז על כך שנשים בגיל חידלון הווסת עלולות להיות מועמדות לאוסטיאפורוזיס באופן חלקי בגלל תגובה מופחתת של GIP (על פי Ahren וחב' ב-Eur J Endocrinol משנת 1997) יהיה צורך לקבוע האם GIP הוא אמנם בעל תפקיד אוסטיאוגני באדם.
GIP ורקמות אחרות
למרות ש-GIP מעכב בקיבה הפרשת חומצת קיבה, פעילות זו מושגת רק בריכוזים הגבוהים משמעותית מריכוזיו הפיזיולוגיים של הורמון זה (Nauck וחב' ב-Digestion משנת 1992). כמן כן נמצא ש-GIP מגביר את הטרנספורט של סוכרים במעי. בכבד, GIP מחליש יצירה של גלוקוזה המושרית על ידי glucagon, כנראה במנגנון בלתי-ישיר, שכן לא נמצאו עד כה קולטנים ל-GIP בכבד. GIP יכול לעודד פינוי של גלוקוזה התלויה באינסולין בבעלי חיים, אם כי השפעה זו לא נמצאה באדם. GIP יכול גם לעודד הפרשה של גלוקו-קורטיקואיד בחולדות דרך מסלול איתות התלוי ב-cAMP/PKA (על פי Mazzocchi וחב' ב-Peptides משנת 1999).
למרות שלא נראה ש-GIP מווסת הפרשה של קורטיזול בבני-אדם בריאים, ביטוי בלתי נורמאלי של GIPR באדנומות ממקור הקורטקס של האדרנל, כרוך בהתפתחות תסמונת Cushing תלויית-מזון (Lacroix וחב' ב-N Eng J Med משנת 1992). נצפה שקולטנים ל-GIP נמצאים גם באנדותליום הווסקולארי, ואמנם GIP מעודד הגברה של רמות סידן תוך-תאי בתרבית של תאי אנדותל (Zhong וחב' ב-Peptides משנת 2000). עירוי של GIP לכלבים משרה בהם הפרשה של endothelin-1 וכיווץ כלי-דם, או הפרשה של NO והרחבת כלי-דם, בתלות במערכת כלי הדם הרלוונטית. ההשפעות המנוגדות של GIP על כלי-דם שונים, מיוחסות לשונות בדרגת השפעול של מסלולי העברת האיתותים בסוגי תאי אנדותל שונים. למרות שמוצאים mRNA של GIPR גם ברקמת הלב, באשכים, בריאות ובמספר רקמות נוספות, הפעילות הפיזיולוגית של GIP ברקמות אלה אינה ברורה, אם בכלל.
שינויים ברמת GIP בתרחישים קליניים
רמות מוגברות משמעותית של GIP בולטות לאחר עירוי גלוקוזה בחולים עם פנקראטיטיס. רמות מוגברות אלה ניתן למצוא גם בחולי סוכרת. רמה מוגברת של GIP מוצאים בחולים עם VIPoma הידועה גם כתסמונת Verner-Morrison המאוד נדירה, בה תאי איי-לבלב שאינם תאי-β מייצרים VIP. לעומת זאת רמות GIP נמוכות יותר בטיפול בקלציטונין.
הוראות לביצוע הבדיקה
יש להיות בצום של 10-12 שעות לפני נטילת הדם. תכשירים נוגדי חומציות קיבה (Antacids) או תרופות המשפיעות על תנועתיות המעי, או על הפרשת אינסולין יכולים להשפיע על תוצאות מדידת GIP, ולכן יש להפסיק נטילתם במידת האפשר לפחות לפרק זמן של 48 שעות לפני דגימת הדם. יש לדגום את הדם במבחנת הפארין (פקק ירוק) ולאחר סרכוז יש לאחסן את הפלזמה המופרדת בהקפאה במהירות האפשרית. דגימת הפלזמה יציבה בתנאי הקפאה למשל 6 חודשים. הבדיקה נעשית בשיטת RIA. יש לפסול דגימות שאינן פלזמה, או דגימות מופשרות ששהו זמן ממושך בטמפרטורת החדר. המדידה נעשית בשיטת RIA.
ראו גם


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק