HIF1A
| מדריך בדיקות מעבדה | |
| HIF-1-α | |
|---|---|
| שמות אחרים | MOP1, PASD8, bHLHe78, hypoxia inducible factor-1α. Hypoxia-inducible factor 1-alpha, HIF-1-alpha, HIF-1-α, HIF-1α |
| מעבדה | כימיה בדם, אימונולוגיה בדם |
| תחום | חלבון רב-תחומי ומשפעל שיעתוק של גנים רבים בהיבט של היפוקסיה |
| יוצר הערך | פרופ' בן-עמי סלע |
הגן וביטויו
הגן האנושי HIF1A המקודד לתת היחידה α של hypoxia-inducible factor (HIF1) ממוקם על כרומוזום 14 בעמדה 14q23.2. רמת HIF-1α תלויה בשפעול של הפרומוטר שלו העשיר ב-GC (Minet וחב' ב-Biochem Biophys Res Commun משנת 1999). ברוב התאים הגן של HIF-1α מבוטא באופן קונסטיטוטיבי ברמות נמוכות בתנאי חמצן נורמליים, אך במצבי היפוקסיה, השיעתוק של הגן HIF1A בדרך כלל משודרג באופן משמעותי (Palmer וחב' ב-Am J Physiol משנת 1998, Wiener וחב' ב-Biochem Biophys Res Commun משנת 1996 ו-Ladoux ו-Frelin ב-Biochem Biophys Res Commun משנת 1997). באופן מקובל, המסלול שאינו תלוי בחמצן מווסת את ביטוי החלבון, בעוד שהמסלול התלוי בחמצן מווסת את הרס החלבון.
המבנה של HIF-1
HIF-1 הוא הטרודימר בעל מבנה בסיסי של helix-loop-helix, המורכב מתת-יחידה אלפא, הלא הוא HIF-1α, ומתת-יחידה β שידועה כ-Arnt או aryl hydrocarbon receptor nuclear translocator (על פי Wang וחב' ב-J Biol Chem משנת 2004).
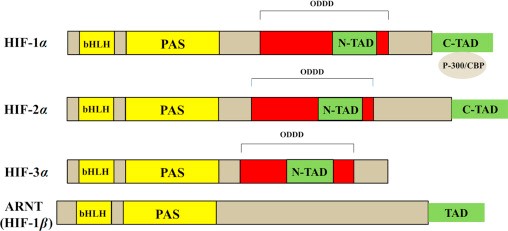
מקטעים תפקודיים (bHLH, PAS ו-TAD) באיזופורמים של HIF: HIF-1α ו- HIF-2α הם בעלי דרגה גבוהה של הומולוגיה ברצף חומצות האמינו, ושניהם כוללים שני מקטעי TAD (C-TAD ו-N-TAD). בניגוד לכך, HIF-3α מכיל רק N-TAD. שני מקטעי TAD אחראיים לפעילות השיעתוקית של HIF-1α (Li וחב' ב-J Biol Chem משנת 1996). C-TAD מגיב עם משפעלים כמו CBP/p300 כדי לגרום למודולציה של שיעתוק הגן של HIF-1α בתנאי היפוקסיה, ואילו N-TAD אחראי לייצב את HIF-1α כדי למנוע את פירוקו (Yamashita וחב' ב-J Biol Chem משנת 2001). יתרה מכך, כל תת-היחידות של HIF-α שונות מאלו ב-HIF-1β, בכך שהן מכילות מקטע ODDD החופף את מקטע N-TAD במבנים שלהם. מקטע ODDD חשוב באשר ליציבות של HIF-1α, HIF-2α ו-HIF-3α בנוכחות חמצן (Bruick ו-McKnight ב-Science משנת 2001).
ישנם שלושה איזופורמים, HIF-1α, HIF-2α ו- HIF-3α (Ema וחב' ב-Proc Natl Acad Sci USA משנת 1997). בניגוד ל-HIF-3α, ל- HIF-2α יש דרגה גבוהה של דמיון עם HIF-1α (48% זהות ברצף חומצות האמינו). אך בעוד ש-HIF-1α מתבטא ברקמות רבות בגוף, HIF-2α מוגבל רק למספר רקמות.
הפונקציה של HIF
חלבון זה התגלה על ידי Semenza וחב' בשנת 1991 במהלך מחקר על הגן של אריתרופויאטין (EPO) האחראי לקידוד של EPO (על פי Semenza וחב' ב-Proc Natl Acad Sci USA משנת 1991). גורם השיעתוק HIF-1 הוא בעל תפקיד חשוב בתגובה התאית לרמות חמצן סיסטמיות ביונקים (Semenza ב-Ann Rev Cell Develop Biol משנת 1999, וב-J Appl Physiol משנת 2000). פעילות הגן HIF1A מווסתת על ידי מודיפיקציות בתר-תרגומיות של המאחסן כגון הידרוקסילציה, אצטילציה ופוספורילציה (Lee וחב' ב-Exp Mol Med משנת 2004). HIF-1 ידוע ביכולתו להשרות שיעתוק של יותר מ-50 גנים, כולל VEGF וerythropoietin, הקשורים בתהליכים ביולוגיים כגון אנגיוגניוּת ו-erythropoiesis, המסיעים בהגברת העברת חמצן לאזורים היפוקסיים (Semenza ב-Trends Mol Med משנת 2002). HIF-1 משרה כמו כן שיעתוק של גנים הקשורים להתרבות תאים והישרדותם, כמו גם גנים הקשורים למטבוליזם של גלוקוזה ושל ברזל. בהתאמה לתפקידו הביולוגי הדינמי, מגיב HIF-1 לרמות סיסטמיות של חמצן, על ידי שינויי מבנה, והתקשרות עם אזורי HRE בפרומוטרים של גנים המגיבים להיפוקסיה על מנת להשרות שיעתוק (Bruick ו-McKnight ב-Science משנת 2001,Epstein וחב' ב-Cell משנת 2001, Ivan וחב' ב-Science משנת 2001, Jaakkola וחב' ב-Science משנת 2001, ו-Masson וחב' ב-EMBO J משנת 2001).
היציבות של HIF-1α מיקומו התוך-תאי כמו גם פעילותו השיעתוקית מושפעים בעיקר על ידי רמת החמצן. בתנאי חמצן נורמליים פעילות פרוטאוליטית בסיוע ubiquitin המושרה על ידי VHL מפרקת במהירות את HIF-1α, אלא שבמצב של היפוקסיה פירוק החלבון האחרון נמנע וכך רמות HIF-1α מצטברות ומגיבות עם HIF-1β על מנת להשפיע שיעתוקית על גנים שונים (Huang וחב' ב-J Biol Chem משנת 1996, ו-Kallio וחב' ב-Proc Natl Acad Sci USA משנת 1997).
בתנאים נורמליים לאחר פציעה, HIF-1α מתפרק על ידי פרוליל-הידרוקסילזות, וביוני 2015 נתגלה שעליה ברמת HIF-1α ידי מעכבים של פרוליל-הידרוקסילזות, יכולים לשכך או להגביר תהליכי רגנרציה ביונקים (Zhang וחב' ב-Sci Transl Med משנת 2015). אחד מתהליכי הרגנרציה בהם מעורב HIF-1α מתרחש בעצבים ההיקפיים בהם לאחר נזק לאקסונים, HIF-1α משפעל את VEGFA תוך סיוע לרגנרציה ולהתאוששות תפקודית (Cho וחב' ב-Neuron משנת 2015, ו-Mahar ו-Cavalli ב-Nature Rev Neurosc משנת 2015). הנוכחות של HIF-1α מווסתת באופן שיעתוקי באופן התלוי ב-NF-κB (על פי van Uden וחב' ב-Biochem J משנת 2008), וכן על ידי פרוליל-הידרוקסליזות בשלב הבתר-תרגומי (Semenza ב-Physiology משנת 2004). כיוון שהאנזימים האחרונים תלויים במולקולות ברזל לצורך ההידרוקסילציה של HIF-1α, מתברר ש-chelators של ברזל כגון desferrioxamine מצליחים לייצב את פעילות HIF-1α, בה במידה שתרפיה בשיטת hyperbaric oxygen ו-cobalt chloride סייעו גם כן לאותה מטרה (Xiao וחב' ב-Int J Med Sci משנת 2013).
התפקיד של HIF-1 במחלות סרטניות
החלבון HIF-1 מבוטא ביתר במחלות סרטן אנושיות (Zhong וחב' ב-Cancer Res משנת 1999, ו-Talks וחב' ב-Am J Pathol משנת 2000). ביטוי-יתר זה של HIF-1 מזוהה באופן בולט בעידוד שגשוגם של תאי סרטן ובתהליך הגרורתי דרך תפקידו באתחול של אנגיוגניות ובוויסות של המטבוליזם התאי להתגבר על היפוקסיה (Bos וחב' ב-Cancer משנת 2003). עם זאת, תנאים היפוקסיים במיקרו-סביבה של הגידול תורמים לביטוי היתר של HIF-1 (Semenza ב-Cancer משנת 2003). ביטוי משמעותי של HIF-1 נמצא ברוב הגידולים הסולידיים שנחקרו, כולל סרטני המעי הגס, שד, פנקריאס, כליות, ערמונית, שחלות, מוח ושלפוחית השתן. מבחינה קלינית, רמה מוגברת של HIF-1α במספר סוגי סרטן כולל סרטן האגן, NSCLC, סרטן השד, אוליגו-דנדרוגליומה, סרטן אורו-פרינגיאלי, סרטן השחלה, סרטן האנדומטריום, סרטן הוושט, סרטן הראש והצוואר וסרטן הקיבה, מזוהה עם התפתחות אגרסיבית יותר של הגידול, עם עמידות להקרנות ולכימותרפיה, ובהגברת התמותה (Aebesold וחב' ב-Cancer Res ב-2001, Höckel ו-Vaupel ב-J National Cancer Inst משנת 2001, ו-Virner וחב' ב-Clin Cancer Res משנת 2001).
הביטוי של HIF-1α יכול גם לווסת את התקדמות סרטן השד, והוא אמנם התגלה בשלבים מוקדמים של in situ ductal carcinoma שהוא שלב קדם-גרורתי של התפתחות סרטן השד (Bos וחב' ב-J Natl Cancer Inst משנת 2001). יתרה מכך, אף על פי שבחינה היסטולוגית שדירגה את סרטן השד קבעה שהוא בשלב נמוך, ואף קשרי הלימפה נמצאו נקיים בתת-קבוצה של חולות, ביטוי מוגבר של HIF-1α, ניבא תגובה מעטה לתרופות. ממצאים דומים התגלו גם בסרטן המוח והשחלות, המעידים על השפעה של HIF-1α באתחול האנגיוגניות על ידי שהוא מגיב עם גורמים קדם-אנגוגניים דוגמת VEGF (Zagzag וחב' ב-Cancer משנת 2000). מחקרים על glioblastoma multiforme הראו דמיון ניכר בין הביטוי של HIF-1α לבין הביטוי של הגן המקודד ל-VEGF (Neufeld וחב' ב-Surg Oncol Clin North Amer משנת 2001, ו-Powis ו-Kirkpatrick ב-Mol Cancer Ther משנת 2004). בנוסף, גידולי glioblstoma multiforme בדרגה גבוהה, עם ביטוי מוגבר של VEGF, בדומה לסרטן שד עם ביטוי-יתר של HIF-1α, מבטאים סימנים משמעותיים של נאו-וסקולריזציה של הגידול (Pietsch וחב' ב-Acta Neuropathol משנת 1997), מה שמצביע גם כן על תפקידו הרגולטורי של HIF-1α בסיוע להתפתחות הגידול, במסלול של היפוקסיה-מושרית על ידי ביטוי של VEGF. ביטוי היתר של HIF-1α בגידולים סרטניים יכול להתרחש גם במסלול שאינו קשור להיפוקסיה. ב-hemagioblstoma מוצאים ביטוי של HIF-1α ברוב התאים של גידול עתיר בכלי-דם (Krieg וחב' ב-Oncogene משנת 2000). אף על פי שבשני סוגי הסרטן, קרצינומה של הכליות ו-hemagioblatoma יש אינאקטיבציה של הגן von Hippel-Lindau, עדיין מוצאים ביטוי ניכר של HIF-1α.
בנוסף לביטוי-יתר של VEGF בתגובה לרמות מוגברות של HIF-1α, גם המסלול של P13K/AKT משתתף בהתפתחות הגידול. בגידול סרטני של בלוטת הערמונית, המוטציה השכיחה ב-PTEN מסייעת לפעילות יתר של HIF-1α וקשורה בהתפתחות גידול זה לקראת השלב האגרסיבי שלו, כתוצאה מתהליך אנגיוגני (Zundel וחב' ב-Genes & Development משנת 2000).
HIF-1 מבוטא ביתר בסוגי סרטן אנושיים רבים (Zhong וחב' ב-Cancer Res משנת 1999, ו-Talks וחב' ב-Am J Pathol משנת 2000). ההשערה הרווחת היא שביטוי-יתר זה מסייע לשגשוג תאים סרטניים על ידי אתחול של אנגיוגניות וכן וויסות מטבוליזם תאי להתגבר על היפוקסיה (Bos וחב' ב-Cancer משנת 2003). היפוקסיה מעודדת אפופטוזיס בתאים בריאים וסרטניים (Vaupel ו-Mayer ב-Cancer Metast Rev משנת 2007). ביטוי משמעותי של HIF-1 זוהה ברוב הגידולים הסולידיים במעי הגס, שד, לבלב, כליות, ערמונית, שחלות, מוח ושלפוחית השתן. מבחינה קלינית, רמות מוגברות של HIF-1α במספר סוגי סרטן, כולל סרטן פי הרחם, השד, השחלות, רירית הרחם, oligodendroglioma, הוושט, הקיבה, הראש והצוואר, הפה והלוע וכן קרצינומה של הריאות מסוג non-small cell, התבטאו במחלה אגרסיבית, וניתן היה להשתמש בהן כמדד ניבויי ופרוגנוסטי של העמידות המחלה לטיפולי הקרנות, לכימותרפיה ולתמותה מוגברת (Semenza ב-Nature Rev Cancer משנת 2003, Aebersold וחב' ב-Cancer Res משנת 2001, Hockel ו-Vaupel ב-J Natl Cancer Inst משנת 2001, Dvorak ב-Vnitrni Lekarstvi משנת 1990, ו-Birner וחב' ב-Clin Cancer Res משנת 2001).
במהלך היפוקסיה, הגן p53 מדכא הסרטן, עשוי להיות כרוך עם מסלול התלוי ב-HIF-1α באתחול של אפופטוזיס. מחקר אחד על סרטן שחלות אפיתליאלי, הראה ש-HIF-1α ו-p53 לא-פונקציונלי, התאימו לדרגת אפופטוזיס נמוכה ופרוגנוזה גרועה (Birner וחב' ב-Clin Cancer Res משנת 2001). זאת ועוד, במטופלים עם שלבים מוקדמים של סרטן הוושט, עם ביטוי מוגבר של HIF-1α אך עם חסר מוחלט של ביטוי Bcl-2, נכשל טיפול פוטו-דינמי (Koukourakis וחב' ב-Cancer Res משנת 2001). עם זאת, אף על פי שהמאמצים המחקריים לפתח תרופות המכוונות כנגד תאי סרטן במצבי היפוקסיה, אין עדיין פריצת דרך ספציפית ויעילה הממוקדת במסלולי HIF-1α, להחלשת אנגיוגניות והתפתחות הגידול (Liu וחב' ב-Autophagy משנת 2014).
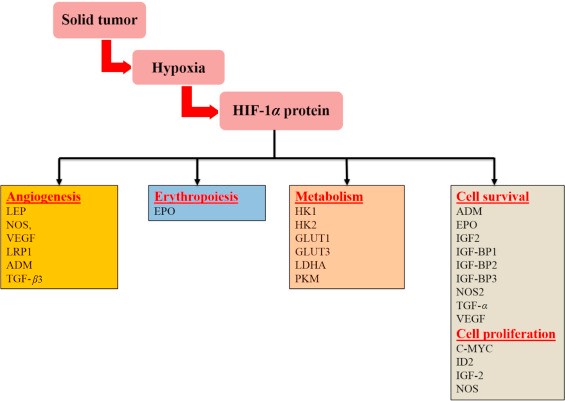
HIF-1 משופעל משחק תפקיד קריטי בתגובות אדפטיביות של תאי סרטן לשינויים ברמת החמצן, על ידי שפעול שיעתוקי של למעלה מ-100 גנים המווסתים תהליכים ביולוגיים חיוניים להישרדות הגידול הסרטני ולהתפתחותו. דוגמאות כוללות גנים הקשורים למטבוליזם של גלוקוזה, לשגשוג תאים, לנדידת תאים אלה ולאנגיוגניות (Semenza ב-Curr Opin Cell Biol משנת 2001). חלק מהגנים המשופעלים על ידי HIF-1 מופיעים בתרשים:
השפעת גנים המשופעים על ידי HIF-1 על התפתחות הגידול הסרטני: LEP-leptin; NOS-nitric oxide synthase; VEGF-vascular endothelial growth factor; LRP1-LDL-receptor-related protein 1; ADM-adrenomedulllin; TGF-β3-transforming growth factor-β 3; EPO-erythropoietim; HK1-hexokinase 1; HK2-hexokinase 2;GLUT1 -glucose transporter 1 ; glucose transporter 3-GLUT3; PKM-pyruvate kinase M; IGF2-insulin-like growth factor 2; IGF-factor-binding protein 2-IGF-BP2 ; IGF-factor-binding protein 3-IGF-BP3; TGF-α - transforming growth factor α; myelocytomatosis virus oncogene cellular homolog-C-MYC; ID2-DNA-binding protein inhibitor.
HIF-1α היא תת-יחידה של גורם השיעתוק ההטרו-דימרי HIF-1, המקודד על ידי הגן HIF-1α (על פי Semenza וחב' ב-Genomics משנת 1996, ו-Hogenwsch וחב' ב-J Biol Chem משנת 1997). חלבון זה נחשב למווסת התאי הבכיר בתנאים של היפוקסיה (Wang וחב' ב-Proc Natl Acad Sci USA משנת 1995, ו-Iyer וחב' ב-Genes Develop משנת 1998). הדיס-רגולציה וביטוי היתר של HIF-1α הנגרמת על היפוקסיה ושינויים גנטיים, משחקים תפקיד בביולוגיה של התהליך הסרטני, כמו גם במספר תרחישים פתו-פיזיולוגיים נוספים, כגון אנגיוגניות ווסקולריזציה, מטבוליזם של האנרגיה התאית, ותהליכים גרורתיים (Semenza ב-Nature Rev Cancer משנת 2003).
בתאי סרטן הגדלים מהר, HIF-1 מסייע לתאים היפוקסיים להסב מטבוליזם של גלוקוזה מפוספורילציה חמצונית היותר יעילה למסלול הגליקוליזה במטרה לשמֵר ליצירת האנרגיה שלהם (מה שידוע כאפקט Warburg) (Weinhouse וחב' ב-Science משנת 1956). מסיבה זו, תאים היפוקסיים נוטים לצרוך יותר גלוקוזה על מנת לספק את הצרכים האנרגטיים שלהם. HIF-1 מאפשר את ההמרה המטבולית הזו על ידי השריית אנזימים הכרוכים במסלול הגליקוליזה ועל ידי ביטוי-יתר של טרנספורטרים של גלוקוזה (GLUTs) המגבירים את חדירת גלוקוזה לתאים הסרטניים (Denko ב-Nature Rev Cancer משנת 2008). דוגמה נוספת היא ש- HIF-1 משרה באופן שיעתוקי מספר גורמים קדם-אנגיוגניים כגון VEGF, המעודד את ההתפתחות של כלי-דם חדשים על מנת להעשיר את תאי הסרטן בחמצן החיוני לשגשוגם (Conway וחב' ב-Cardiovasc Res משנת 2001). בנוסף, HIF-1 מעודד יצירת גרורות לאזורים מרוחקים ולרקמות מחומצנות יותר, על ידי שפעול שיעתוקי של גורמי גדילה אונקוגניים כגון TGF-β3,EGF ואחרים (Laderuote וחב' ב-Mol Cell Biol משנת 2002).
המסלול התלוי ב-pVHL
בתנאי ריכוז תקין של חמצן הביטוי של HIF-1α מווסת באופן שלילי על ידי הרס חלבון זה ב-proteasome, ו-ubiquitination במסלול הכורך גם von Hippel−Lindau protein (להלן pVHL), שהוא חלבון מדכא סרטן, ואחד מהמרכיבים המוכרים של E3 ubiquitin protein ligase (Iwai וחב' ב-Proc Natl Acad Sci USA משנת 1999). שני שיירי פרולין בעמדות P402 ו-P564, ממוקמים על motif LXXLAP במקטע ODDD של HIF-1α התבררו כמצעים טובים לפעילות של קבוצת האנזימים prolyl-4-hydroxylases (Epstein וחב' ב-Cell משנת 2001). אלה אנזימי dioxygenase הדורשים חמצן לפעילות ההידרוקסילציה שלהם, בנוסף לחומרים אחרים כברזל וחומצה אסקורבית, לכן ההידרוקסילציה של שיירי proline מתרחשת רק כאשר ישנה כמות מספקת של חמצן. יתרה מכך, שייר נוסף ב-ODDD שהוא ליזין בעמדה 532, יכול לעבור אצטילציה על ידי אנזים אצטיל-טרנספרזה המוכר כ-Arrest-defective-1 (או ARD-1) (על פי Jeong וחב' ב-Cell משנת 2002). אף על פי שהפעילות של ARD-1 אינה תלויה בזמינות של חמצן, הביטוי שלו פוחת במצבי היפוקסיה (Maxwell וחב' ב-Nature משנת 1999). כתוצאה מכך, תת-יחידות של HIF-1α עם שיירי p402 ו-p564 שעברו הידרוקסילציה וכן אצטילציה בשייר k532, מזוהות ביתר קלות על ידי pVHL ובכך הם "מסומנים" על ידי ubiquinin ומפורקים ב-proteasome. אך בתנאי היפוקסיה, לא מתרחשות ריאקציות ההידרוקסילציה והאצטילציה של שיירי פרולין וליזין, מה שמייצב את המבנה של HIF-1α.
מסלול שאינו תלוי ב-pVHL
מנגנון מרכזי נוסף התלוי בחמצן והגורם לוויסות שלילי של מסלול HIF-1α בתנאים של ריכוז חמצן נורמלי מתבצע על ידי שליטה על הטרנס-אקטיבציה של HIF-1α. במסלול זה לא נכרך החלבון pVHL. במצב של רמת חמצן נורמלית, הידרוקסילציה התלויה בחמצן של שייר אספרגין בעמדה N803, הידועה גם כ-asparginyl hydroxylase, ופוגעת בשעתוק של הגן המקודד ל- HIF-1α (על פי Block וחב' ב-J Am Chem Soc משנת 2009, Dann וחב' ב-Proc Natl Acad Sci USA משנת 2002, Lando וחב' ב-Genes Dev משנת 2002, ו-McNeill וחב' ב-Biochem J משנת 2002).
מעכבים של ביטוי HIF-1α mRNA
EZN-2698 הוא anti-sense oligonucleotide הפועל כאנטגוניסט של RNA ומעכב את הביטוי של HIF-1α mRNA. דווח שהעיכוב של HIF-1α על ידי EZN-2698, מחליש את התקדמות הגידול גם בניסויים in vivo וכן in vitro בשוּרות תאים הלקוחים מסרטן הערמונית ומגליובלסטומה באדם (Greenberger וחב' ב-Mol Cancer Ther משנת 2008). ניסויים קליניים ב-phase 1 גילו ש- EZN-2698 הוא בעל פוטנציאל טיפולי באלה עם קרצינומה של תאי כליה בשלב מתקדם. Aminoflavone הוא תכשיר נוסף המעכב ביטוי של HIF-1α mRNA, אך מנגנון הפעולה המדויק שלו אינו ברור עדיין (Onnis וחב' ב-J Cell Mol Med משנת 2009).
מעכב דימריזציה של HIF-1
Acriflavin הוא תערובת של trypaflavin ושל proflavine שזוהה כמעכב שלHIF-1α . Acriflavin מעכב את הדימריזציה של HIF-1 על ידי קישורו לתת המקטע PAS-B של HIF-1α ושל HIF-2α. כיוון ש-acriflavin הוא בעל רמת בטיחות גבוהה, הוא הופך למועמד סביר להערכה קלינית בסוגי סרטן שונים, בהם רמות מוגברות של HIF-1α ושל HIF-2α מהוות סיבה עיקרית להתפתחות הגידול (Lee וחב' ב-Proc Natl Acad Sci USA משנת 2009).
מעכבים של HIF-1α ברמות שונות
YC-1 הוא תכשיר המונע צימות של טסיות-דם (תרומבוציטים). הוא התגלה במקור כמשפעל של האנזים guanylate cyclase בטסיות הדם במאמר שהופיע ב-Blood בשנת 1994, ולאחר מכן נמצא שתכשיר זה מעכב פעילות HIF-1. YC-1 עשוי להגביר את הקישור של FIH ל-HIF-α CAD, באופן שקומפלקס הזה מפרק את הקשר ל-p300 ולדיכוי HIF-1. במנגנון זה לא משתתף האתר הפעיל של FIH בשייר Asn803 (Li וחב' ב-Mol Cancer Ther משנת 2008). YC-1 יכול להפריע להצטברות של HIF-1α ו- HIF-2α (Chun וחב' ב-Biochemical Pharmacol משנת 2001).
PX-478 הוא נגזר של melphalan והוא בעל פעילות אנטי-סרטנית נמרצת. הוצע ש-PX-478 מפחית את רמות HIF-1α במספר מנגנונים:
- עיכוב של ה-deubiquitination של HIF-1α במנגנון שאינו תלוי ב-p53 וב-pVHL מה שמגביר את הרמות של polyubiquitinated HIF-1α
- הפחתה של רמת הביטוי שלHIF-1α mRNA ; (ג) עיכוב התרגום של HIF-1α
המעכבים של הפעילות השעתוקית של HIF-1
הפרעה לקישור של HIF-1α ושל HIF-1β לקו-פקטור p300 ליצירת קומפלקס שעתוק פעיל, שהוא השלב הסופי לקראת טרנס-אקטיבציה של HIF-1, מייצגת מנגנון פוטנציאלי דרכו מולקולות קטנות עשויות לעכב את פעילות HIF-1. האנטי-מטבוליט האנטי-מיקרוביאלי ממקור פטריות הידוע כ-chetomin, זוהה כבר בשנת 2004 כמולקולה קטנה החוסמת את מסלול השפעול השעתוקי של HIF-1. על ידי קישורו למקטע CH1 של הקוֹ-משפעל p300, גורם chetomin לפגיעה במבנה השלישוני של CH1, וכך משתבשת האינטראקציה של מקטע זה עם HIF-1 ופוחתת הטרנס-אקטיבציה של HIF-1 (על פי Kung וחב' ב-Cancer Cell משנת 2004). אמנם ההשפעה הטוקסית של chetomin מנעה את המשך פיתוחו למטרות קליניות, אך מחקר מצא שעיכוב פעילות HIF-1 על ידי chetomin מעודד את היעילות של רדיו-תרפיה על תאי HT 1080 (על פי Staab וחב' ב-BMC Cancer משנת 2007).
מעכב אחר של proteasome הידוע כ-botezomib, מעכב קישור HIF-1α ל-p300 בריכוזי ננומול. באופן פרדוקסלי, בריכוזים גבוהים יותר, bortezomib מגביר את רמות HIF-1α, על ידי חסימת הפירוק של חלבון זה בפרוטאזום. ברמה המולקולרית, bortezomib מעודד את האינטראקציה בין C-TAD ו-HIF-1 עם אתר היעד FIH (או factor inhibiting HIF-1) שהוא שייר asn803, וכך מדוכא הגיוס של p300. ה-FDA אישר טיפול עם bortezomib במיאלומה נפוצה (Richardson וחב' ב-Cancer Control משנת 2003). הודגמה היכולת של bortezomib לדכא את מסלול PI3K/AKT/mTOR דרכו פועל HIF-1 בתאי סרטן הערמונית (Befani וחב' ב-J Mol Med משנת 2012). ממצא אחרון זה האיץ מחקרים שנועדו לאשש את הספקטרום האנטי-סרטני של bortezomib, בסוגי סרטן שונים (Goda וחב' ב-Mol Oncol משנת 2015, Zhang ו-Gu ב-Gene משנת 2015, ו-Huang וחב' ב-Pathol Biol משנת 2015).
מעכבי התרגום של HIF-1α
אף על פי שאופי הרגולציה של תרגום החלבון HIF-1α אינו מובן במלואו, מספר תכשירים פותחו המכוונים כנגד שיעור הסינתזה של HIF-1α כולל תכשירים המעכבים את האנזימים topoisomerase I ו-topoisomerase II, וכן receptor tyrosine kinase, ו-cyclin-dependent kinase, וכן תכשירים ההורסים את מארג ה-microtubuli. נזכיר מתכשירי קבוצה זו את האנלוגים של Camptothecins (להלן CPTs) המעכבים את topoisomerase I, ויכולים לעכב גם את ההצטברות של HIF-1α בתאי גליומה היפוקסיים אנושיים מסוג U251 (Hsiang וחב' ב-J Biol Chem משנת 1985, ו-Sapra וחב' ב-Clin Cancer Res משנת 2008).
מעכבי mTOR
מעכבי mTOR יכולים גם כן לעכב את התרגום של HIF1α. המסלול המאותת לגורמי גדילה הכורך את הקינאזות של PI3K/Akt/mTOR מייצג גם מסלול עיקרי של תרגום HIF1α בלמעלה מ-70% משורות התאים של סרטן אנושי (Xia וחב' ב-Eur J Med Chem משנת 2012). תכשירים כ-tersirolimus ,everolimus ו-sirolimus הם מעכבי mTOR המצויים בפיתוח קליני של טיפול בגידולים סולידיים (Del Bufalo וחב' ב-Cancer Res משנת 2006). Temsirolimus ו-everolimus עברו את שלבי הניסויים ב-phase III, וקיבלו את אישור ה-FDA לטיפול בקרצינומה של תאי כליה (Ravaud וחב' ב-Bull Cancer משנת 2010). מעכבים של PI3K, כגון LY294002 ו-wortmannin הוכרו כבעלי פעילות anti-HIF, ורמות גבוהות של PI3K מוכרות כמאפיין שכיח בגידולים סולידיים, ואמנם LY294002 ו-wortmannin מגבילים את הסינתזה של HIF-1α בשורות התאים PC-3 ו-DU145 שמקורם בסרטן הערמונית (Jiang וחב' ב-Cell Growth Differ משנת 2001). גליקוזידים לבביים דוגמת digoxin כמו גם aubain ו-proscillaridin משמשים כבר עשרות שנים לטיפול באי-ספיקת לב גדושה. תרופות אלו זוהו כמעכבים של תרגום של החלבון HIF-1α, וכמעכבים של ביטוי HIF-2α mRNA, מה שמצביע על המעורבות של HIF-1 בפעילות האנטי-סרטנית של digoxin.
מעכבי הייצוב של HIF-1α
- מעכבי HSP90: דווח שמעכבים של heat-shock protein 90, כגון geldanamycin יכולים לבטל את תוקפו של HIF-1α ללא קשר לנוכחות חמצן (Isaacs וחב' ב-J Biol Chem משנת 2002). ידוע ש-Hsp90 נקשר ישירות ל-HIF-1α ובכך הוא משרה מספר שינויים מבניים במבנה של האחרון, באופן שמאפשר לו להתאים ולהיקשר ל-HIF-1β ולאתחל את הטרנס-אקטיבציה שלו (Gradin וחב' ב-Mol Cell Biol משנת 1996). נראה אם כן שאנטגוניסטים של Hsp90 צפויים להשרות את הפירוק של HIF-1α (Hur וחב' ב-Mol Pharmacol משנת 2002). ה-geldanamycin הוא מעכב Hsp90 הראשון שהתגלה. יש טוענים שהאופן בו מונע תכשיר זה את הקישור של Hsp90 לחלבוני המטופל, היא על ידי תחרות עם Hsp90 על אתרי הקישור שלו ל-ATP, מה שגורם לחלבונים אלה לעבור סימון על ידי ubiquitin ולהריסתם ב-proteasome. אך הסתבר שתכשיר זה וחלק מנגזריו אינם ראויים לטיפול, שכן רבים מחלבוני המטופל, ולא רק HIF-1α עלולים להיות מושפעים מעיכוב Hsp90.
- Apigenin הוא flavon טבעי בעל פעילות אנטי-אנגיוגנית, החוסם את שדרוגם של HIF-1α, כמו גם VEGF ו-glucose transporter-1 בתנאי היפוקסיה במנגנון של הפרעה לתפקוד של Hsp90 (על פי Osada וחב' ב-FEBS lett משנת 2004, ו-Melstrom וחב' ב-J Surg Res משנת 2011).
- Radicicols היא קבוצה נוספת של מעכבי Hsp90 בעלי מנגנונים שונים לעיכוב HIF-1α. לדוגמה, radicicol מונע את האינטראקציה בין ההטרודימרים HIF-1α/HIF-1β לבין DNA ובכך מחלישים את תהליך השפעול של HIF-1 ללא שינוי משמעותי ביציבות של HIF-1alfa. אחד מנגזרי radicicol, הידוע כ-KF58333, מפחית את הביטוי הבתר-שיעתוקי של HIF-1α ושל VEGF בסוגי סרטן שונים באדם ( Kurebayashi וחב' ב-Jpn J Cancer Res משנת 2001).
- SCH66336 הוא נגזר של farensyltransferase, בעל פעילות אנטי-סרטנית כנגד non-small cell lung cancer, והוא מונע את האינטראקציה בין HIF-1α לבין Hsp90, ובכך מאפשר פירוקו של HIF-1α ב-proteasome (על פי Han וחב' ב-J Natl cancer Inst משנת 2005).
מעכבי האנזים histone deacetylase
- ראיות עדכניות מראות שאצטילציה של HIF-1α על ידי p300/CBP associated factor בשייר k674, בסביבה שהיא ברמה נמוכה של +NAD, קריטית בסיוע לגיוס p300 והביטוי שלאחריו של גנים המשמשים מטרה ל-HIF-1α. ה-deacetylase הידוע כ-sirtuin 1, נחשב כ-histone deacetylase class III (להלן HDAC), מפריע לריאקציה זו על ידי קיטלוז תהליך הדה-אצטילציה של HIF-1α, בריכוזים גבוהים של +NAD. המנגנון המדויק דרכו מעכבי HDAC מעכבים את HIF-1α אינו ברור, אך ידוע שהם אנטגוניסטים של טרנסאקטיבציה על ידי HIF-1α תוך שהם משדרגים מסלולי דגרדציה על ידי ubiquitin.
- גם התכשיר LW6 מפחית את הביטוי של HIF-1α על ידי הגברת הביטוי של חלבון von Hippel-Lindau (להלן VHL), המגיב עם prolyl-hydroxylated HIF-1α, וגורם לפירוקו בפרוטאזום. מנגנון זה ניתן להדגמה על ידי פעילות אנטי-סרטנית בקסנוגרפטים של עכברים בהם הושתלו תאי סרטן המעי הגס האנושיים מסוג HCT116. ההשערה היא ש-LW6 מסוגל לשדרג את הביטוי של VHL על ידי דה-מתילציה של הפרומוטר של VHL, עיכוב של HDAC, או דיכוי של הדגרדציה של VHL בפרוטאזום (Lee וחב' ב-Biochem Pharmacol משנת 2010).
מעכבי קישור של HIF-1 ל-DNA
Echinomycin הוא פפטיד ציקלי השייך למשפחת האנטיביוטיקה quinoxalin, והוא נקשר ספציפית לליבה של הרצף המזוהה על ידי HIF-1 שהוא 5'-CGTG-3', ובכך מונע קישור HIF-1 ל-DNA. עם זאת, הטוקסיות של תכשיר זה שהופגנה בניסויים קליניים ב-phase I וב-phase II, הביאו להפסקת הניסויים עם תכשיר זה (Hong וחב' ב-Cancer Res משנת 2005).
מסלולים המאותתים לגורמי-גדילה
השפעול של phosphatidyl inositol-4,5 biphosphate-3-kinase (או PI3K), עשוי לשדרג את התרגום של HIF-1α (על פי Semenza ב-Pharmacol משנת 2002, ו-Conrad וחב' ב-J Biol Chem משנת 1999). החלבון PI3K מווסת סינתזות של חלבונים דרך חלבון היעד שלו protein kinase B (או Akt) וכן דרך החלשת ביטוי היעד של mTOR. הרכיב האחרון, mTOR, מתווך את פעולתו דרך פוספורילציה של eukaryotic translation initiation factor 4e binding protein (או 4E-BP1) החיוני לעיכוב התרגום של mRNA, מה שגורם להגברת התרגום של HIF-1α (על פי Gingras וחב' ב-Genes Dev משנת 2001). בנוסף, פוספורילציה של p70 S6 kinase (או S6K) על ידי mTOR, מסייע לפוספורילציה של המצע שלו, החלבון הריבוזומלי S6, ומשרה תרגום של חלבון. מסלול זה מנוגד ל-tumor suppressor protein (הידוע כ-PTEN) המונע את הפוספורילציה של נגזרי PI3K.
התפקיד של HIF בוויסות של סינתזת erythropoietin (להלן EPO)
סינתזת EPO נמצאת תחת בקרה של זמינות חמצן, ול-HIF המצוי בתאים מייצרי EPO יש תפקיד בבקרה זו. דרך פעולתו של HIF-1α היא, שכאשר הוא מיוצב הוא מגיע לגרעין התא שם הוא פועל כגורם שיעתוק. נמצא ש-EPO פועל לייצוב של HIF-1α, על ידי חסימת ריאקציות ביוכימיות הגורמות לדה-סטביליזציה של HIF-1α. לא מדובר ב-EPO הניתן ישירות, שכן ידוע שגם גנים אחרים המעורבים בסינתזה של המוגלובין ויצירת תאי-דם אדומים, משופעלים על ידי HIF-1α. הסתבר ש-hepcidin, שהוא ווסת שלילי של ספיגת ברזל והפרשתו, מדוכא על ידי תכשירים מייצבי HIF-1α. נמצא שהשיעתוק ושפעול הגן המקודד ל-EPO בתגובה להיפוקסיה מושפע מפעילות HIF-1 (על פי Goldberg וחב' ב-Science משנת 1988).
הוראות לביצוע הבדיקה
רמת HIF-1α יכולה להימדד בנסיוב או בפלזמה, או בדם מלא בשיטה משולבת של Polymerase Chain Reaction Amplification/Sanger Sequence Analysis. יציבות הדגימה בקירור עד 30 יום.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק